Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. v.42 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2010
MICROBIOLOGÍA BÁSICA
Coloración de azul de metileno como alternativa para determinar la viabilidad de larvas libres de Trichinella spiralis
V.R. Randazzo*, S.R. Costamagna
Cátedra de Parasitología Clínica. Universidad Nacional del Sur San Juan 670 (8000) Bahía Blanca (Argentina)
*Correspondencia. E-mail: viviana.randazzo@uns.edu.ar
RESUMEN
El objetivo de la presente investigación fue determinar si la coloración con azul de metileno, de probada utilidad para demostrar la viabilidad de protoescólices de Echinococcus granulosus, puede evidenciar también la viabilidad de larvas libres de Trichinella spiralis. Para ello se utilizaron tres suspensiones de larvas de T. spiralis (M1, M2 y M3), las que fueron expuestas a diferentes condiciones y observadas a distintos tiempos: M1 se expuso a -30 °C y se observó a los 70 días; M2 a 80 °C durante 5 minutos y se observó inmediatamente, y M3 se mantuvo a 4 °C durante todo el experimento, como testigo del 100% de vitalidad. Cada suspensión contenía 500 estadios larvarios libres. Se emplearon 100 μl de solución de azul de metileno 1:10 000 en agua destilada, agregados a igual volumen de suspensión de larvas, y las muestras fueron observadas al microscopio óptico para evaluar la motilidad. Los resultados evidenciaron que cuando las larvas de T. spiralis estaban muertas (M1 y M2), el 100% se coloreaban totalmente de azul en su interior, y las estructuras internas, en relación con la capa quitinosa, aparecían retraídas y algunas fragmentadas. En la suspensión testigo M3 las larvas no se coloreaban, y como prueba adicional de viabilidad se pudo observar su típico movimiento en espiral en el 100% de ellas.
Palabras clave: Viabilidad; Trichinella spiralis; Azul de metileno
ABSTRACT
Methylene blue test for the determination of viability of free larvae of Trichinella spiralis. The present research was carried out with the purpose of determining whether or not the methylene blue test could also evidence viability of free larvae of Trichinella spiralis, taking into account its usefulness in the determination of viability of protoscolices in Echinococcus granulosus. To this end, three T. spiralis larval suspensions (M1, M2 and M3) were used, each containing 500 free larval stages. A hundred μl of methylene blue solution 1:10000 in distilled water were added to 100 μl of the larval suspension. Larvae were observed under optical microscopy to evaluate motility. M1 was exposed to -30 °C and could be observed on day 70, M2 was exposed to 80 °C during 5 minutes and it was immediately observed under optical microscopy, and M3 was maintained at 4 °C during the experiment as a 100% viability testing. Our results indicated that when T. spiralis larvae took up 100% of the methylene blue stain (M1 and M2), their inner structures appeared not only retracted but also stained blue, whereas in the M3 suspension test, larvae remained unstained and 100% of them showed their typical spiral-like movement.
Key-words: Viability; Trichinella spiralis; Methylene blue
La trichinellosis es una zoonosis parasitaria originada por el nematodo Trichinella spiralis, el que puede infestar un gran número de mamíferos, entre ellos el hombre. En nuestro país, la provincia de Buenos Aires es el área de mayor endemicidad (1, 2, 3, 4, 5, 6). La infección se produce por el consumo de carne de cerdo cruda o mal cocida que contiene larvas viables de T. spiralis. La coloración del azul de metileno es utilizada como test de exclusión para demostrar viabilidad de protoescólices de Echinococcus granulosus (2, 11). En el presente estudio se evaluó la utilidad de esta coloración para poner en evidencia la viabilidad de larvas libres de T. spiralis. Esto permitiría disponer de un método sencillo y económico al momento de tener que comprobar la ausencia de larvas viables.
La cepa de T. spiralis que se utilizó en este estudio fue tipificada por PCR en el Centro Internacional de Referencia, en Roma (Italia), por el Dr. Edoardo Pozzio.
Se utilizaron tres suspensiones de larvas de T. spiralis recientemente obtenidas por digestión enzimática de músculo de ratón infectado, de acuerdo con metodología ya descrita (9). Fueron rotuladas como M1, M2 y M3, y cada una contenía 500 estadios larvarios libres por ml de agua destilada.
En trabajos previos hemos demostrado que las larvas de T. spiralis mueren a -30 °C en un lapso de 65 días, e inmediatamente a 80 °C (6). Teniendo en cuenta estas características, M1 fue sometida a -30 °C durante 70 días y M2 a 80 °C durante 5 minutos, para asegurar que el 100% de las larvas muriesen. M3 fue conservada a 4 °C como testigo de 100% de viabilidad, ya que es sabido que a esta temperatura las larvas viven más de 250 días (6).
Para los experimentos se utilizaron 100 μl de solución de azul de metileno (AM) 1:10 000 en agua destilada, agregados a igual volumen de suspensión de larvas, y se observó al microscopio óptico.
Los resultados evidenciaron que cuando las larvas estaban muertas (M1 y M2), el 100% se coloreaba totalmente de azul en su interior (Figura 1), mientras que en la suspensión testigo M3 las larvas no se coloreaban (Figura 2). La pérdida de viabilidad de las larvas se evidenció, además, por la ausencia de movimientos, por la típica postura de "coma", producto de la retracción de las estructuras internas en relación con la capa quitinosa, y por la fragmentación de esta última, lo que habría facilitado la penetración del colorante y así, determinar el estado de vitalidad de las larvas.
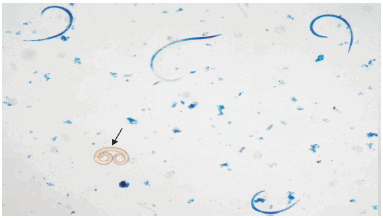
Figura 1. Larvas de T. spiralis teñidas con azul de metileno. Se observan cuatro larvas muertas, que aparecen teñidas de color azul, con forma de coma e inmóviles, y una larva viva de aspecto espiralado y sin colorear (flecha).

Figura 2. Larva de T. spiralis viable. Puede visualizarse su forma espiralada y su estructura interna conservada.
La viabilidad de las larvas utilizadas como testigo se confirmó, además, por el típico movimiento en espiral en el 100% de ellas.
Todos los experimentos fueron realizados por cuadruplicado, y en cada observación se contaron 500 larvas, lo que permitió estimar en todos los grupos la pérdida de viabilidad.
Para el análisis estadístico se utilizó el test "t", con lo que pudo establecerse que no hubo diferencias significativas (p < 0,05).
La cantidad de larvas viables de T. spiralis consumidas determina, junto con otros factores, la variabilidad e intensidad de los signos y síntomas clínicos que presentará el hospedador.
Si se quisiera aplicar esta técnica sobre carne de cerdo, a los fines de determinar si esta es apta o no para el consumo humano, se deberá cumplir inicialmente con la técnica de digestión enzimática artificial legislada para cada región de Argentina (10). A partir de la liberación de las larvas en el digesto, se deberá emplear la coloración de azul de metileno para determinar el verdadero potencial infectante de la carne procesada.
La Ley Sanitaria de Carnes N° 11123 de la provincia de Buenos Aires (Argentina), en su sección numeral 9.5.50, dice: "Comprobada la presencia del parásito de Trichinella spiralis en cualquier estado en que se halle se decomisará la res" (10). Para la legislación vigente en Argentina (Ley Federal Sanitaria de Carnes 22375, complementada por el Decreto N° 4238/68 y por la Resolución 555/2006), tanto a nivel provincial como nacional, la detección de larvas de este nematode en carnes o subproductos cárnicos sería causa suficiente para prohibir su comercialización y consumo, independientemente de si las larvas están vivas o muertas.
Considerando que hasta el momento, la evaluación de la viabilidad de las larvas se determinaba observando sus movimientos característicos y el constante enrollamiento y desenrollamiento, y que los signos de mortalidad estaban dados por la ausencia de movimiento y la típica postura de coma (7, 8), la metodología propuesta posibilitaría determinar mediante una técnica rápida, sencilla y económica, con mayor certeza, la viabilidad del estadio larvario de T. spiralis. Un elevado porcentaje de larvas viables (sin colorear) indicaría infección reciente, lo que nos permitiría señalar la verdadera peligrosidad de cada animal en particular y predecir su impacto epidemiológico. Además, esta coloración constituye una herramienta simple y económica para determinar la verdadera cantidad de larvas vivas que se utilizan en experiencias de laboratorio, lo cual permitiría estandarizar las dosis necesarias de cada cepa o especie de Trichinella para generar determinado efecto, a los fines de lograr resultados internacionalmente válidos y reproducibles.
De esta manera, queda demostrada la utilidad del colorante azul de metileno -después de haber realizado la correspondiente digestión enzimática artificial- para diferenciar infecciones recientes de T. spiralis (larvas vivas) de otras de larga data (larvas muertas), tanto para fines epidemiológicos o estudios de brotes como para investigaciones de laboratorio. La muerte de los estadios larvarios produciría alteraciones en la cubierta del parásito, lo que facilitaría la penetración del colorante al interior de las larvas.
Agradecimientos: a la Secretaria de Ciencia y Tecnología de la Universidad Nacional del Sur por financiar el presente estudio (PGI 24/B133).
1. Bolpe J, Caminoa R. Triquinosis humana, incremento de la casuística registrada en el período 1975-1997 en la provincia de Buenos Aires, Argentina. Segundo Congreso Argentino de Zoonosis, 1998, Resumen J1, p. 184, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
2. Casado N, Criado A, Jiménez A, De Armas C, Brasa C, Perez Serrano J, et al. Viability of Echinococcus granulosus cysts in mice following cultivation in vitro. Int J Parasitol 1992, 22: 335-9. [ Links ]
3. Constantino S, Caminoa R, Ledesma M, Venturiello S. Outbreaks of domestic trichinellosis in Buenos Aires, Argentina during 1992. En: Campbell WC, Pozio E, Bruschi F, editors. Trichinellosis. Rome: Istituto Superiore di Sanità Press, 1994, p. 511-4. [ Links ]
4. Costamagna S, García S, Visciarelli E, Casas N. Epidemiología de las parasitosis en la ciudad de Bahía Blanca, provincia de Buenos Aires, Argentina. 1994-1999. Parasitol Latinoam 2002, 57: 103-10. [ Links ]
5. Costamagna S. Trichinellosis: a propósito de un peritaje judicial. VI Congreso Argentino de Protozoología y Enfermedades Parasitarias, 2000, Resumen DG122, p. 84, Huerta Grande, Córdoba, Argentina. [ Links ]
6. Costamagna S, Randazzo V. Viabilidad de larvas libres y enquistadas de Trichinella spiralis. III Congreso Latinoamericano de Zoonosis y VI Congreso Argentino de Zoonosis, 2008, Resumen J32, p. 33, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
7. Costamagna S. Trichinellosis. En: Costamagna S, Visciarelli E, compiladores. Parasitosis regionales. 2da Edición. Bahía Blanca, Argentina, Ediuns, 2008, p. 215-27. [ Links ]
8. Chávez Guajardo E, Muñoz Escobedo J, Reveles Hernández G, Rivas Gutiérrez J, Moreno García MA. Efecto de la temperatura en la viabilidad e infectividad de Trichinella spiralis. AVFT 2007, 26: 105-9. [ Links ]
9. Giménez R, Caminoa R, Ledesma M, Maurizzi D, Barberio P. Aspectos epidemiológicos de la presentación de casos de trichinellosis humana de origen comercial, en la ciudad de Bahía Blanca (mayo-junio de 1997). Segundo Congreso Argentino de Zoonosis, 1998, Resumen I1, p. 188, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
10. Montali G, Cabral M, Plaza H. Diagnóstico de Trichinella spiralis por el método de digestión artificial. Publicación del Ministerio de Asuntos Agrarios, Buenos Aires, Argentina, 1997, p. 1-14. [ Links ]
11. Ohniski K, Nakao M, Inaoka T. Viability and infectivity of protoscolices of Echinococcus multilocularis stored at different temperatures. Int J Parasitol 1984, 14: 577-80. [ Links ]
Recibido: 22/09/09
Aceptado: 25/02/10














