Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541versão On-line ISSN 1851-7617
Rev. argent. microbiol. v.42 n.2 Ciudad Autónoma de Buenos Aires abr./jun. 2010
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
La anaerobiosis más allá de las bacterias anaerobias. Su importancia en la recuperación de microorganismos aerobios a partir de materiales purulentos
M.R. Litterio Bürki*, H. Lopardo
Servicio de Microbiología, Hospital de Pediatría SAMIC "Prof. Dr. Juan P. Garrahan". Combate de los Pozos 1881, (1245) CABA, Argentina.
*Correspondencia. E-mail: mirtalitterio@yahoo.com.ar
RESUMEN
El objetivo fundamental de la incubación en anaerobiosis es la recuperación de bacterias anaerobias obligadas, aunque ésta no excluye la recuperación de otros microorganismos. En el año 2003 iniciamos un estudio prospectivo y comparativo de los microorganismos aerobios recuperados a partir de la siembra primaria de muestras clínicas consecutivas en anaerobiosis y de aquellos recuperados a partir de la siembra primaria de las mismas muestras en aerobiosis. Los objetivos fueron evaluar el rendimiento de la metodología empleada en anaerobiosis en la recuperación de microorganismos aerobios no diagnosticados a partir de la siembra primaria en aerobiosis y establecer la relación entre éstos y el origen de la muestra. En el período 2003-2004 se procesaron 2776 muestras. Se recuperaron 1884 microorganismos aerobios; el 69,4% desarrolló tanto en condiciones aerobias como anaerobias, mientras que el 30,6% restante sólo lo hizo en una de las dos atmósferas: el 49,2% sólo en aerobiosis y el 50,8% sólo en anaerobiosis. La metodología empleada para los cultivos primarios en anaerobiosis (incubación anaerobia, medios de cultivo, lupa o microscopio estereoscópico para examinar las placas primarias, etc.) permitió la recuperación de microorganismos aerobios, en particular de cocos gram positivos (microaerófilos y facultativos) no diagnosticados a partir del cultivo primario en aerobiosis. Este rendimiento extra fue más evidente en materiales con flora polimicrobiana, especialmente gram negativa, e independiente del tipo de muestra estudiada.
Palabras clave: Anaerobiosis; Microorganismos aerobios; Materiales purulentos; Siembra primaria en anaerobiosis
ABSTRACT
Anaerobiosis beyond anaerobic bacteria. Its role in the recovery of aerobic microorganisms from purulent samples. The main objective of incubation in anaerobiosis is the recovery of obligate anaerobic bacteria, not excluding other microorganisms. In 2003, we conducted a comparative and prospective study from consecutive clinical samples on the recovery of aerobic microorganisms from primary cultures both in anaerobiosis and aerobiosis of the same sample. The aims were to evaluate the methodology used in anaerobiosis in the recovery of aerobic microorganisms not diagnosed in primary aerobic cultures, and to establish a relationship between them and the origin of the sample. From 2003 to 2004, 2776 bacteriological samples were analyzed and 1884 aerobic microorganisms were cultured altogether. The result was that 69.4% of the samples showed growth both in aerobic and anaerobic incubation from primary cultures of the sample, whereas 30.6% only in one of the mentioned incubation atmosphere: 49.2% in aerobiosis and 50.8% in anaerobiosis. According to these results, the methodology used in anaerobiosis (anaerobic incubation, culture media, stereoscopic microscope or hand lens to examine the primary plates), allowed an extra yield of aerobic organisms, especially gram positive facultative and microaerophilic cocci, which was particularly evident in polimicrobial cultures, and especially when gram negative accompanying flora was present, independently of the type of sample.
Key words: Anaerobiosis; Aerobic microorganisms; Purulent samples; Primary cultures in anaerobiosis
Las infecciones en humanos involucran un amplio espectro de microorganismos en relación con la atmósfera más favorable para su desarrollo (2). Por razones de orden práctico, en el presente trabajo se establecieron sólo dos grupos de microorganismos: anaerobios obligados y aerobios; este último término reunió a los aerobios obligados, los microaerófilos y los anaerobios facultativos. El objetivo fundamental de la incubación en anaerobiosis es brindar la atmósfera adecuada para la recuperación de bacterias anaerobias obligadas (2). Aunque este concepto es elemental y ampliamente difundido, no lo es tanto el hecho de que la atmósfera anaerobia no excluye la recuperación de otros microorganismos que pueden estar presentes en una muestra clínica (2, 5). En nuestro laboratorio hemos pautado la búsqueda sistemática de anaerobios en toda muestra tomada por punción aspiración o biopsia que guarde condiciones anaerobias de transporte y conservación y que provenga de procesos infecciosos que reúnan condiciones predisponentes: evolución crónica, localización cercana a mucosas, traumatismos, etc.
En el año 2003 se inició un estudio prospectivo y comparativo cuyos objetivos fueron: 1. evaluar el rendimiento de la metodología usada para la siembra primaria en anaerobiosis en el aislamiento de microorganismos aerobios no diagnosticados a partir de la siembra primaria en aerobiosis; 2. establecer la relación entre estos microorganismos y el origen de la muestra.
En el período 2003-2004, en el Servicio de Microbiología del Hospital de Pediatría SAMIC "Prof. Dr. Juan P. Garrahan" se procesaron en forma consecutiva 2776 muestras que cumplían las condiciones antes estipuladas para el cultivo de aerobios y anaerobios simultáneamente. Las muestras se agruparon según el sitio de infección en: abdominales (A), cabeza y cuello (CC), ganglio (G), osteoarticular (OA), pericardio (PE), piel y partes blandas (PP), tracto respiratorio inferior (RI), tracto respiratorio superior (RS), sistema nervioso (SN), otras (OS).
Los medios de cultivo empleados en la siembra primaria fueron: agar chocolate (ACH) (incubación en 5-10% CO2), agar sangre (AS) y caldo tioglicolato (CT) (Oxoid Ltd., Hampshire, Inglaterra), incubados de 48 horas a 7 días a 35 °C. El AS y el CT se incubaron en aerobiosis. El ACH se preparó usando agar cerebro-corazón (Laboratorios Britania S.A., CABA, Argentina), 0,5% de extracto de levadura (Oxoid Ltd.), 0,1% de hemina (Sigma-Aldrich Corporation, St. Louis, EE.UU.) y 5-7% de sangre. El AS se preparó usando agar base Columbia (Laboratorios Britania S.A.) y sangre (5-7%). La identificación de los microorganismos (MO) aerobios recuperados exclusivamente a partir de la siembra primaria en aerobiosis se llevó a cabo empleando los métodos bioquímicos convencionales (7).
Paralelamente, para incubar en anaerobiosis se sembró en agar sangre anaerobio (ASA) y caldo anaerobio (CA) preparados a partir de agar tripticasa de soja (Biokar Diagnostic, Beauvais, Francia) y caldo cerebro corazón (Laboratorios Britania S.A.), respectivamente, suplementados con 5 μg/ml de hemina (Sigma-Aldrich Corporation), 1 μg/ml de vitamina K1 (Biol, Argentina), 0,5% de extracto de levadura (Oxoid Ltd.), 0,1% de bicarbonato de sodio (Anedra, San Fernando, Argentina), 0,5% de Tween 80 (Sigma-Aldrich Corporation), 1% de piruvato de sodio (Invitrogen Gibco, Auckland, Nueva Zelanda) y 5% de sangre lacada (sólo en medios sólidos). El ASA se incubó en bolsas Anaerocult® P (Merck, KGaA, Alemania) las primeras 48 h. El CA, una vez sembrado, se selló con un tapón de vaselina-parafina (3:2) y se incubó hasta 7 días. La primera observación de las placas de ASA se llevó a cabo a las 48 h. A partir de allí, su incubación se continuó en jarras con generadores AnaeroPack® Anaero (Mitsubishi Gas Chemical CO., INC, Japón) o en cámara anaerobia BactronTM Anaerobic Chambers and Incubators (Anaerobe Systems, EE.UU.) durante 5 días. La temperatura de incubación en todos los casos fue de 35 ºC. El CA se subcultivó en agar fenil-etil-alcohol (FEA) (Becton, Dickinson and Co., Sparks, EE.UU.), suplementado con sangre lacada al 5% en atmósfera anaerobia cuando la siembra primaria en ASA presentó características culturales típicas de Proteus spp. (swarming).
Para la observación de las placas incubadas en atmósfera anaerobia se empleó una Lupa Tusculum® 10X (Fab Cadio S.R.L.) o un microscopio estereoscópico adosado a la cámara anaerobia. Cada uno de los morfotipos de colonia detectados fue sometido a una prueba de tolerancia al oxígeno (5) para distinguir los MO aerobios de los anaerobios. La identificación de los dos grupos se llevó a cabo empleando los métodos bioquímicos convencionales (4, 7). En cuanto a los MO aerobios, sólo se completó la identificación de aquellos que no habían sido recuperados a partir de la siembra primaria en aerobiosis.
El análisis estadístico se realizó aplicando el test de chi cuadrado. Un valor de p ≤ 0,05 fue considerado significativo.
Se analizaron 2776 muestras y se recuperaron 1884 MO aerobios, de los cuales 1307 (69,4%) desarrollaron a partir de la siembra primaria, tanto en atmósfera de incubación aerobia como anaerobia (designados AE/AN) y 577 (30,6%) crecieron sólo en una de las dos atmósferas de incubación. De estos últimos, 284 se recuperaron exclusivamente a partir de la siembra primaria en aerobiosis (designados AE) y 293 se recuperaron exclusivamente a partir de la siembra primaria en anaerobiosis (designados AN). En la Tabla 1 se presentan los resultados de los cultivos, con el detalle del número de muestras procesadas para cada sitio de infección, la proporción de éstas que resultaron positivas y su distribución en cultivos monomicrobianos (M) o polimicrobianos (P). Además, se muestra el número (y la proporción respecto del total de MO aerobios) que se recuperaron como AE, AN o AE/AN en los cultivos M y P. En la Tabla 2 se detalla la distribución de los MO aerobios recuperados de los distintos sitios de infección en función de su aislamiento a partir de cultivos M o P. Asimismo, se muestra cómo se distribuyeron en función del método de cultivo para su recuperación (AE o AN), agrupados sobre la base de su tinción de Gram y su ubicación taxonómica.
Tabla 1. Muestras cultivadas en aerobiosis y en anaerobiosis simultáneamente y microorganismos (MO) aerobios recuperados. Período 2003-2004
Tabla 2. Distribución de microorganismos (MO) aerobios recuperados exclusivamente en aerobiosis o en anaerobiosis de cultivos mono o polimicrobianos, según el sitio de infección (n=577)
Si bien la recuperación de AN fue mayor que la de AE en cabeza y cuello, piel y partes blandas y tracto respiratorio superior (14 frente a 9, 60 frente a 52 y 164 frente a 141, respectivamente), la diferencia no fue significativa con respecto al total de AN en el resto de las muestras (p = 0,42; p = 0,51 y p = 0,13, respectivamente) (Tabla 1).
En coincidencia con estudios efectuados con los sistemas automatizados para hemocultivos sobre la recuperación de aerobios a partir de botellas anaerobias, el aislamiento de dichos MO, en especial el de cocos gram positivos, fue significativamente mayor en aquellas que en las aerobias (1, 3, 8). En nuestro estudio, el número de MO aerobios gram positivos recuperados como AN y como AE fue 223 y 123 (p < 0,001). Sobresalieron Streptococcus pneumoniae (17 y 7; p = 0,045), estreptococos grupo viridans (57 y 18; p = 0,001), Enterococcus spp. (77 y 31; p = 0,001), Staphylococcus aureus (12 y 1; p = 0,0025) y estafilococos coagulasa negativos (42 y 25; p = 0,038), sobre todo en cultivos P (Tabla 2). En cambio, el aislamiento de AN gram negativos fue menor que el de AE gram negativos (70 contra 161). Únicamente los miembros de la familia Enterobacteriaceae (con la excepción de Proteus spp.) tuvieron un aislamiento estadísticamente superior como AN que como AE (33 contra 9, p = 0,001) y puntualmente, Haemophilus influenzae a partir de cultivos polimicrobianos (22 contra 18) (Tabla 2).
En 198 de las 464 muestras con cultivo polimicrobiano (42,7%) se aislaron AN. Al resto de los MO aerobios presentes simultáneamente, ya sean éstos AE o AE/AN, se los agrupó bajo la denominación de "flora acompañante" (FA). A partir de las 198 muestras se recuperó un total de 621 MO aerobios: 235 (38%) fueron los AN, 173 (73,6%) de ellos fueron gram positivos y 62 (26,4%) gram negativos (Tabla 2). Los restantes 386 (62%) formaron parte de la FA aerobia, 131 (34%) fueron gram positivos y 255 (66%) gram negativos (Tabla 3).
Tabla 3. Distribución de microorganismos (MO) aerobios presentes en la "flora acompañante" (FA) de los AN en cultivos polimicrobianos, según el sitio de infección (n=386)
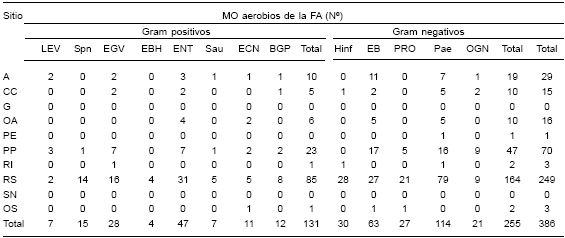
A: abdominal, CC: cabeza y cuello, G: ganglio, OA: osteoarticulares, PE: pericardio, PP: piel y partes blandas, RI: tracto respiratorio inferior, RS: tracto respiratorio superior, SN: sistema nervioso, OS: otros.
LEV: levaduras, Spn: Streptococcus pneumoniae, EGV: estreptococos grupo viridans, EBH: estreptococos β-hemolíticos, ENT: Enterococcus spp., Sau: Staphylococcus aureus, ECN: estafilococos coagulasa negativos, BGP: bacilos gram positivos, Hinf: Haemophilus influenzae, EB: Enterobateriaceae no Proteus spp., PRO: Proteus spp., Pae: Pseudomonas aeruginosa, OGN: otros gram negativos.
FA: MO aerobios, AE y AE/AN presentes simultáneamente en cultivos polimicrobianos con AN.
Según nuestros resultados, los cultivos polimicrobianos mostraron un mayor aislamiento de AN, en particular de cocos gram positivos. Esto coincidió con el desplazamiento de la FA aerobia en favor de los gram negativos, especialmente de Pseudomonas aeruginosa (p < 0,001) y de la familia Enterobacteriaceae (p = 0,00124) (Tabla 3). En presencia de oxígeno, los MO aerobios obligados y los anaerobios facultativos usan el oxígeno molecular como último aceptor de electrones en la cadena respiratoria (2). Pero en su ausencia, también son capaces de usar una variedad de componentes (por ejemplo, NO3 -) como fuente de energía (6). En el caso de P. aeruginosa, este camino metabólico alternativo puesto en marcha en anaerobiosis se traduce en un desarrollo muy inferior (diámetro de las colonias < 1 mm) al obtenido en condiciones aerobias. Este "freno" que la incubación en anaerobiosis ocasiona en el desarrollo de P. aeruginosa permite poner en evidencia a otros MO presentes circunstancialmente, y podría ser una de las causas que explique la mayor recuperación de AN en nuestros cultivos polimicrobianos.
El uso de lupas es una práctica que nos permitió distinguir con mayor precisión la presencia de morfotipos diferentes y su posterior aislamiento e identificación. También el empleo de un medio selectivo como el FEA en cultivos con Proteus spp. propició indirectamente, en cultivos polimicrobianos, la recuperación de AN.
En conclusión, la metodología empleada en el cultivo en anaerobiosis (incubación anaerobia, medios de cultivo, lupa o microscopio estereoscópico para examinar las placas primarias, etc.) permitió la recuperación de MO aerobios, en particular de cocos gram positivos, no diagnosticados a partir del cultivo primario en aerobiosis. Este rendimiento extra fue más notable a partir de cultivos polimicrobianos con predominio de gram negativos, y fue independiente del tipo de muestra estudiada.
Este trabajo se presentó como Trabajo Final Integrador de la Carrera de Especialización en Bioquímica Clínica, Área Bacteriología Clínica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Director: Prof. Dra. Ángela Famiglietti. Coordinador: Prof. Dr. Carlos Vay. Cohorte 2003-2004.
Agradecimientos: a los Sres. Bioq. Claudia Hernández y Técnico de Laboratorio J. L. Pinheiro, responsables del diagnóstico microbiológico de los microorganismos aerobios recuperados a partir de la siembra primaria en aerobiosis de las muestras incluidas en este estudio; a la Técnica de Laboratorio Laura Lovadina por su colaboración en la trascripción de los datos; a la Dra. Graciela Demirdjian, a cargo del Área de Coordinación de Investigación Tecnológica del Hospital, por su asesoramiento en el tratamiento estadístico de los datos; a la Dra. Hebe Bianchini por su colaboración en la revisión del manuscrito. A los rotantes y residentes pasantes del Sector Anaerobios y Técnicos y Auxiliares del Servicio de Microbiología del Hospital.
1. Borbeau P, Riley J, Heiter B, Master R, Young C, Pierson C. Use of the BacT/Alert blood culture system for culture of sterile body fluids other than blood. J Clin Microbiol 1998; 36: 3273-7. [ Links ]
2. Engelkirk PG, Duben-Engelkirk J, Dowell VR Jr., editors. Principles and Practice of Clinical Anaerobic Bacteriology. Belmont, California 94002, Star Publishing Company,1992, p. 1-14. [ Links ]
3. Grohs P, Mainardi JL, Podglajen I, Hanras X, Eckert C, Buu-Hoi A, et al. Relevance of routine use of the anaerobic blood culture bottle. J Clin Microbiol 2007; 45: 2711-5. [ Links ]
4. Jousimies-Somer HR, Summanen P, Citron DM, Baron EJ, Wexler HM, Finegold SM, editors. Wadsworth Anaerobic Bacteriology Manual, 6th ed., Belmont, California, Star Publishing Company, 2002. [ Links ]
5. Jousimies-Somer HR, Summanen P, Citron DM, Baron EJ, Wexler HM, Finegold SM, editors. Wadsworth Anaerobic Bacteriology Manual, 6th ed., Belmont, California, Star Publishing Company, 2002, p. 43-54. [ Links ]
6. Koneman EW, Allen SD, Dowell VR Jr, Janda WM, Sommers HM, Winn WC, editors. Diagnóstico Microbiológico, 3ra ed., Buenos Aires, Argentina, Editorial Médica Panamericana, 1992, p. 488-563. [ Links ]
7. Murray PR, Baron EJ, Jorgensen JH, Pfaller MA, Yolken RH, editors. Manual of Clinical Microbiology. Washington D.C., ASM Press, 2003. [ Links ]
8. Riley JA, Heiter BJ, Borbeau PF. Comparison of recovery of blood culture isolates from two BacT/ALERT FAN aerobic blood culture bottles with recovery from one FAN aerobic bottle and one FAN anaerobic bottle. J Clin Microbiol 2003; 41: 213-7. [ Links ]
Recibido: 18/08/09
Aceptado: 20/04/10














