Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.42 no.2 Ciudad Autónoma de Buenos Aires Apr./June 2010
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Queratitis por Acanthamoeba sp.: primer caso confirmado por aislamiento y tipificación molecular en Bahía Blanca, provincia de Buenos Aires, Argentina
M. L. Gertiser1, E. Giagante2, E. Sgattoni2, N. Basabe1, F. Rivero3, H. Luján3, M. Occhionero4, L. Paniccia4, E. Visciarelli1, S. R. Costamagna1 *
1Cátedra de Parasitología Clínica, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur. San Juan 670, (8000) Bahía Blanca;
2MEGAVISIÓN, Centro Privado de Oftalmología. Casanova 248, (8000) Bahía Blanca;
3Laboratorio de Investigación en Bioquímica y Biología Molecular, Facultad de Medicina, Universidad Católica de Córdoba. Jacinto Ríos 571, (5000) Córdoba;
4Cátedra de Microbiología Especial, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur. San Juan 670, (8000) Bahía Blanca, Argentina.
*Correspondencia. E-mail: rcosta@uns.edu.ar
RESUMEN
Algunas especies del género Acanthamoeba provocan queratitis amebiana (QA), una infección de la córnea muy dolorosa, generalmente unilateral, con compromiso importante de la visión. Se presenta el caso de una mujer de 31 años usuaria de lentes de contacto con hábitos inadecuados de higiene y conservación de las lentes. La paciente consultó por enrojecimiento y dolor intenso en el ojo derecho, de dos meses de evolución. Luego del examen oftalmológico y ante la sospecha de una etiología parasitaria se realizó una biopsia de la zona lesionada, que se destinó al análisis bacteriológico y parasitológico en el laboratorio. También se remitieron los líquidos de lavado y el estuche de las lentes. No se detectó crecimiento bacteriano en las muestras. Los cultivos para la búsqueda de Acanthamoeba resultaron positivos en todos los especímenes analizados. Las amebas aisladas fueron clasificadas morfológica y molecularmente como pertenecientes al género Acanthamoeba. El presente trabajo muestra el primer caso de queratitis por Acanthamoeba de la ciudad de Bahía Blanca identificado por el laboratorio mediante procedimientos de alto valor diagnóstico.
Palabras claves: Queratitis; Acanthamoeba; Córnea; Protozoos
ABSTRACT
Acanthamoeba sp. keratitis: first case confirmed by isolation and molecular typification in Bahía Blanca, Buenos Aires Province, Argentina. Some species of the Acanthamoeba genus cause keratitis, a very painful, most likely unilateral corneal infection , associated with eye and vision impairment. We here present a case of a 31-year-old female patient, a regular user of soft contact lenses without good practices of lens hygiene and handling. The patient attended medical consultation after two months of inflammation and pain in her right eye. After ophthalmological studies, and due to suspicion of a parasitic infection, a biopsy was performed and the sample submitted for bacteriological and parasitological analyses. Moreover, contact lens holders and lens cleaning solutions were studied. The samples yielded negative results for bacterial infection. However, cultivation of all samples showed the presence of amoeboid parasites. Isolated amoebae were morphologically and molecularly classified as members of the Acanthamoeba genus. This is the first case of keratitis caused by Acanthamoeba in Bahía Blanca, Buenos Aires Province, where the parasite was identified by specific and sensitive molecular techniques.
Key words: Keratitis; Acanthamoeba; Cornea; Protozoan
Los protozoarios del género Acanthamoeba son extremadamente ubicuos y con capacidad para vivir en una gran diversidad de ambientes, incluyendo suelo, aire, aguas, sedimento oceánico y hospedadores animales y humanos. Algunas especies provocan queratitis amebiana (QA), una infección de la córnea muy dolorosa, generalmente unilateral, con compromiso importante de la visión (8).
El primer caso de QA fue comunicado por Nagington et al. (10) y durante más de una década fue considerada una patología de baja incidencia, hasta que el número de casos comenzó a aumentar conforme se incrementaba el uso de lentes de contacto. Más del 80% de los casos de QA se han presentado en pacientes que utilizaban lentes de contacto blandas o semiblandas (11). El principal factor de riesgo es el manejo inadecuado de éstas: su uso durante períodos prolongados, una mala higiene de las lentes y de sus estuches, o bien su lavado con agua de red, con desinfectantes a base de cloro, con soluciones caseras preparadas con agua corriente o con soluciones comerciales almacenadas de manera inadecuada (11). Otros factores que aumentan el riesgo de infección son la práctica de deportes acuáticos con las lentes puestas, el lavado de los ojos con agua de red o lesiones corneales leves producidas por cuerpos extraños, comunes en soldadores y jardineros (1, 7, 11, 15).
El parásito presenta una forma vegetativa metabólicamente activa o trofozoíto y una forma de resistencia o quiste. El daño corneal es un requisito fundamental para que se produzca la infección, ya que el epitelio lesionado expone glucoproteínas y glucolípidos ricos en manosa, que sirven de anclaje para los trofozoítos de Acanthamoeba (5, 11). Los quistes son menos sensibles a la acción de las drogas, pueden permanecer durante mucho tiempo en el estroma corneal y serían los responsables de las recurrencias de la QA (9).
El proceso infeccioso se inicia cuando los trofozoítos entran en contacto con el epitelio de la córnea. Esto puede ocurrir por el uso de lentes de contacto contaminadas, que actúan como vectores al transportar las amebas hasta el ojo, o bien por contacto directo de la lesión con agua, aire o elementos contaminados con trofozoítos y quistes (11). Después de la unión del trofozoíto se inicia un proceso de descamación celular, producto de la citólisis, la fagocitosis y la apoptosis inducidas sobre las células epiteliales (6, 11). Si el proceso avanza, hay invasión del estroma, con inflamación intensa. Los trofozoítos secretan serina y cisteína proteasas, elastasa, metaloproteinasas, colagenasas y un activador del plasminógeno, compuestos encargados de destruir la matriz extracelular y permitir su acceso al estroma (6). Los trofozoítos afectan al nervio óptico y provocan una neuritis radial, responsable del dolor extremo que caracteriza a esta patología (11).
Los síntomas de QA incluyen fotofobia, visión borrosa, lagrimeo y dolor intenso. Los pacientes no responden a la terapia antimicrobiana y el cuadro clínico muchas veces se confunde con una queratitis de origen herpético, lo que retarda la instauración de un tratamiento adecuado. Cuando el cuadro está avanzado se presenta un característico anillo de infiltrado corneal rodeando la lesión. La córnea puede llegar a ulcerarse y requerir un trasplante o, en casos extremos, la enucleación del ojo (6, 8, 11).
La QA se trata con la administración tópica de biguanidas (polihexametilen biguanida 0,02% o clorhexidina dicluconato 0,02%) combinadas con alguna diamidina, un antibiótico para las infecciones bacterianas asociadas, un analgésico y antiinflamatorios esteroideos. El tratamiento es muy prolongado, lo que provoca molestias y perjuicios económicos a los pacientes, pero es necesario para minimizar las posibilidades de recrudecimientos de la enfermedad (6).
En este trabajo se presenta el caso de una paciente de 31 años, usuaria de lentes de contacto blandas, cuyos hábitos de higiene y conservación de las lentes no eran los adecuados (lentes de 3 años de antigüedad, cambio de la solución conservadora cada 2-3 días y enjuague con agua corriente). Consultó por enrojecimiento y dolor intenso en el ojo derecho, de dos meses de evolución. La paciente había concurrido un mes antes a otro centro donde le habían realizado un raspado de la lesión corneal. Los análisis bacteriológicos de la muestra, de las lentes de contacto y de su estuche arrojaron resultados negativos en ese momento. Fue tratada con antibióticos, corticoides, antivirales y lágrimas artificiales.
Dieciséis días después del primer análisis y ante la falta de respuesta al tratamiento instaurado, la paciente se presentó a la consulta en nuestro centro. De acuerdo con estos antecedentes y luego de exámenes oftalmológicos donde se observó el tipo de lesión que presentaba (Figura 1, a y b), se sospechó una etiología parasitaria. Se le realizó en el quirófano una biopsia incisional corneal con cuchillete, y el material obtenido se dividió en dos partes, una se colocó en un tubo ependorff con solución de Page (12) estéril para el análisis parasitológico y la otra en un tubo seco estéril para el análisis bacteriológico. Ambos tubos, el líquido de lavado y el estuche de las lentes se remitieron a la Cátedra de Parasitología Clínica de la Universidad Nacional del Sur para su procesamiento. Frente a la presunción clínica y los datos epidemiológicos se inició inmediatamente el tratamiento contra infección por Acanthamoeba spp.
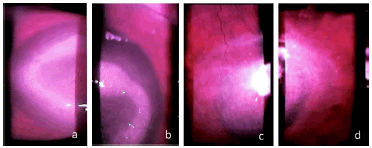
Figura 1. (a) y (b), anillo de infiltración corneal característico de la infección por Acanthamoeba; (c) y (d) leucoma corneal cicatrizal postratamiento.
En el laboratorio, la muestra para análisis parasitológico se centrifugó un minuto en microcentrífuga a 2000 rpm, se descartó parte del sobrenadante, y el sedimento se recogió con pipeta automática y la porción de tejido con ansa bacteriológica. Ambas muestras se sembraron en el centro de una placa de Petri con agar no nutritivo (ANN) 1,5% en Page, cubierto con una suspensión de Escherichia coli (12). Los líquidos de lavado de las lentes y del estuche se centrifugaron a 2000 rpm a volumen cero durante 10 min en tubos plásticos con tapa, estériles, y se sembraron siguiendo el mismo procedimiento.
Las placas se incubaron en estufa a 37 °C, todas mostraron crecimiento a las 48 h de incubación. Se observó el material en fresco entre porta y cubreobjetos al microscopio óptico; luego se realizaron extendidos que se fijaron con metanol a 4 °C para ser coloreados con May Grunwald-Giemsa y Giemsa. A las 96 horas de incubación se realizó el análisis morfológico y morfométrico de los quistes. Con ocular micrométrico se midieron los diámetros de los trofozoítos (n = 30) y de los quistes (n = 30).
Para la identificación molecular a nivel de género se utilizó la técnica de reacción en cadena de la polimerasa (PCR) siguiendo el protocolo publicado por Schroeder (14). Se usaron los cebadores JDP1 (5´-GGCCCAGATCGTTTACCGTGAA) y JDP2 (5´-TCTCACAAGCTGCTAGGGGAGTCA), que amplifican una región del ADN ribosomal (18S rDNA) específica para este género (14). El producto de la PCR, ASA.S1 ("Acanthamoeba-specific amplimer" S1), presenta un tamaño que oscila entre 423 a 551 pb dependiendo del genotipo.
Los estudios ultraestructurales de las amebas aisladas se realizaron por microscopía electrónica de transmisión (MET), siguiendo las técnicas clásicas adecuadas para el estudio de protozoos (4). A partir de los cultivos en ANN se realizaron repiques en medio líquido MYAS (extracto de maltosa 0,01% y extracto de levadura 0,01% en solución de Page). Para la observación de trofozoítos y quistes se tomaron alícuotas del cultivo de 50 ml a las 48 h y a los 7 días respectivamente, las que se centrifugaron a 2000 rpm durante 15 minutos, a volumen cero. El pellet fue fijado en glutaraldehído 4%, posfijado con OsO4, deshidratado con etanol e incluido en resina Spurr. Los cortes ultrafinos (100 micrones) recogidos sobre grillas de cobre de 200 Mesh fueron contrastados con acetato de uranilo 3% (40 min) y citrato de plomo (10 min). Las observaciones de trofozoítos y quistes fueron realizadas utilizando un microscopio electrónico de transmisión marca JEOL modelo 100 CXII a 80 KV. Las fotomicrografías fueron tomadas con un equipo SO-163 Kodak electron Image-film.
La muestra remitida para el análisis bacteriológico se sembró en caldo tioglicolato, agar sangre y agar chocolate. Los medios sólidos se incubaron en microaerofilia durante 48 h a 37 °C y el caldo de enriquecimiento durante 7 días en las mismas condiciones. Los caldos se examinaron diariamente para investigar el crecimiento bacteriano, realizando repiques en agar sangre y agar chocolate. Todos estos cultivos fueron negativos.
Por microscopía óptica se observaron trofozoítos de 21,7 μm a 23 μm de diámetro, con acantópodos, núcleo único refringente, vacuolas de exclusión de agua que se contraían y dilataban constantemente, y un movimiento tipo babosa por la emisión de seudópodos hialinos (Figura 2, a-c). Los quistes (diámetro de 11,3 μm a 12,8 μm) presentaron una pared doble compuesta por un exoquiste ondulado y un endoquiste estrellado (Figura 2, d y e). De acuerdo con su morfología, todos los aislamientos fueron clasificados como pertenecientes al género Acanthamoeba (12). Según la clasificación de Pussard y Pons (13), basada en la morfología y el tamaño de los quistes, todos ellos se ubicaron dentro de las especies pertenecientes al Grupo II.
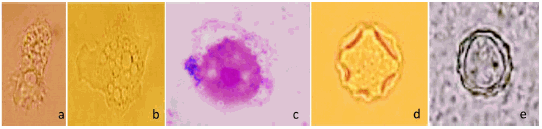
Figura 2. Trofozoítos de Acanthamoeba en fresco, aislados de la biopsia (a) y del líquido de lavado (b). Trofozoítos aislados de la biopsia, teñidos con Giemsa (c). Quistes de Acanthamoeba en fresco (d y e), con las características correspondientes al Grupo II de Pussard y Pons (13)
El producto obtenido de la PCR corresponde al segmento ASA. S1, específico del género Acanthamoeba.
Por MET fue posible observar en el citoplasma de quistes y trofozoítos numerosas mitocondrias, vacuolas de exclusión de agua, vacuolas digestivas de contenido amorfo, gotas de lípidos, un núcleo único con nucléolo central esférico, complejo de Golgi y retículo endoplásmico bien visible (2, 3). En los trofozoítos aislados de la biopsia se visualizó el contorno celular irregular, resultado de la formación de numerosos acantópodos y seudópodos; por debajo de la membrana plasmática se observó una zona de citoplasma hialino: el ectoplasma. Se apreciaron pequeñas vacuolas de exclusión de agua distribuidas por todo el citoplasma, circundadas en la mayoría de los casos por mitocondrias alargadas o esféricas (Figura 3 a). Los quistes maduros se visualizaron rodeados por un exoquiste, separado del endoquiste por un espacio, excepto en los ostiolos, donde las membranas se fusionaban. El citoplasma se observó denso, deshidratado (Figura 3 b).
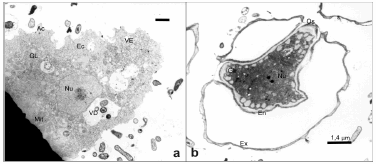
Figura 3. Fotomicrografías de Acanthamoeba obtenidas por MET. (a) trofozoíto aislado de la biopsia; (b) quiste. Ac: acantópodos, Ec: ectoplasma, VE: vacuolas de exclusión de agua, GL: gotas de lípidos, Mit.: mitocondrias, Vd: vacuolas digestivas, Nu: núcleo, Ex: exoquiste, En: endoquiste, Os: ostiolo.
De acuerdo con las características de la lesión que presentaba la paciente al momento de la consulta (Figura 1 a), se realizó un diagnóstico presuntivo de QA y se inició el tratamiento con polihexametilen biguanidina al 0,02% y neomicina al 0,5%. Los tres primeros días se aplicó la terapia cada hora, tanto durante el día como durante la noche; en los 3-4 días subsiguientes se aplicó cada hora sólo durante el día. Seguidamente se redujo a una aplicación cada 2 horas (primer mes), con 6 aplicaciones al día hasta completar el año. Se observó buena respuesta al procedimiento terapéutico; en forma lenta la lesión se vascularizó en la periferia (Figuras 1 c y d).
El agente etiológico de la queratitis que presentaba la paciente fue identificado como perteneciente al género Acanthamoeba sobre la base de estudios morfológicos y moleculares. Según la clasificación de Pussard y Pons (13), la cepa aislada pertenecería al Grupo II (A. castellanii, A. polyphaga, A. rhysodes, A. mauritaniensis, A. divionensis, A. griffini, A. lugdunensis, A. quina, A. hatchetti, y A. triangularis), donde se encuentran especies de demostrada patogenicidad.
Si bien la QA presenta baja prevalencia, es importante tener presente este tipo de etiología al momento del análisis oftalmológico. El aislamiento de Acanthamoeba es de baja complejidad y de bajo costo; su implementación en los laboratorios bioquímicos incrementaría la posibilidad de confirmar nuevos casos. No obstante, la tipificación molecular requiere de laboratorios especializados.
Un diagnóstico rápido y certero permite un tratamiento efectivo y previene acciones drásticas como la enucleación o el trasplante de córnea. El comienzo oportuno del tratamiento, además de preservar la integridad del ojo parasitado, evita la formación de quistes, lo que minimiza las posibilidades de recidivas.
Es muy importante, como medida preventiva, informar a los usuarios de lentes de contacto sobre su uso y cuidados adecuados, de manera que disminuyan las posibilidades de contraer queratitis por Acanthamoeba.
Agradecimientos: a la Secretaría de Ciencia y Tecnología de la Universidad Nacional del Sur y a la Fundación Alberto J. Roemmers, por subvencionar el presente estudio.
1. Auran JD, Starr MB, Jokobiec FA. Acanthamoeba keratitis: a review of the literature.Cornea 1987; 6: 2-26. [ Links ]
2. Bowers B, Korn ED. The fine structure of Acanthamoeba castellanii. I. The trophozoite. J Cell Biol 1968; 39: 95-111. [ Links ]
3. Bowers B, Korn E. The fine structure of Acanthamoeba castellanii (Neff strain). II Encystment. J Cell Biol 1969; 41: 786-805. [ Links ]
4. Costamagna SR, Sorrivas V, Prado Figueroa M. Processing Trichomonas vaginalis for scanning electron microscopy. Microscopy Res Techn 1996; 35: 357-8. [ Links ]
5. Jaison PL, Cao Z, Panjwani N. Binding of Acanthamoeba to (corrected) mannose-glycoproteins of corneal epithelium: effect to injury. Curr Eye Res 1998; 17: 770-6 [ Links ]
6. Khan NA. Acanthamoeba: biology and increasing importance in human health. FEMS Microbiol Rev 2006; 30: 564-95. [ Links ]
7. Latapie LB, Cremona G, Carrasco MA, Molina VE, Bozzini JP, Mariano ML. Queratitis inflamatoria por Acanthamoeba spp. Análisis estructural por microscopía electrónica de transmisión. Parasitol Latinoam 2003; 58: 159-65. [ Links ]
8. Marciano-Cabral F, Cabral G. Acanthamoeba spp. as agents of disease in humans. Clin Microbiol Rev 2003; 16: 273-307. [ Links ]
9. Martínez A, Visvesvara GS. Free living amphizoic and opportunistic amebas. Brain Pathol 1997; 7: 583-98. [ Links ]
10. Nagington J, Watson PG, Playfair TJ, Mc Gill J, Jones BR, Steele ADM. Amoebic infection of the eye. Lancet 1974; 2: 1537-40. [ Links ]
11. Niederkorn JY, Alizadeh A, Leher H, McCulley JP. The pathogenesis of Acanthamoeba keratitis. Microb Infect 1999; 437-43. [ Links ]
12. Page FC. An illustrated key to freshwater and soil amoebae: with notes on cultivation and ecology. Freshwater Biological Association, Publisher, 1976, p. 155. [ Links ]
13. Pussard M, Pons R. Morphologies de la paroi kystique et taxonomie du genre Acanthamoeba (Protozoa, Amoebida). Protistologica 1977; 13: 557-610. [ Links ]
14. Schroeder JM, Booton GC, Hay J, Niszl IA, Seal DV, Markus MB, et al. Use of subgenic 18S ribosomal DNA PCR and sequencing for genus and genotype identification of Acanthamoebae from humans with keratitis and from sewage sludge. J Clin Microbiol 2001; 39: 1903-11. [ Links ]
15. Sharma S, Srinivassan M, George C. Acanthamoeba keratitis in non-contact lens wearers. Arch Ophthalmol 1990; 108: 676-8. [ Links ]
Recibido: 16/02/10
Aceptado: 29/03/10














