Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.42 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2010
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Brote de histoplasmosis en la Escuela de Cadetes de la Base Aérea de Morón, Provincia de Buenos Aires, República Argentina
R. Negroni1, 3*, R. Duré2, Á. Ortiz Nareto2, A. I. Arechavala1, E. I. Maiolo1, G. M. Santiso1, C. Iovannitti3, B. Ibarra-Camou4, C. E. Canteros4
1Unidad Micología y
2Unidad Endoscopía del Hospital de Infecciosas Francisco J. Muñiz, Uspallata 2272 (1282), Ciudad Autónoma de Buenos Aires;
3Centro de Micología del Departamento de Microbiología y Parasitología de la Facultad de Medicina UBA, Paraguay 2155 (1114) Ciudad Autónoma de Buenos Aires;
4Departamento de Micología del INEI-ANLIS "Dr. Carlos Malbrán", Av. Vélez Sarsfield 563 (1281), Ciudad Autónoma de Buenos Aires, Argentina.
*Correspondencia. E-mail: ricnegroni@hotmail.com
RESUMEN
Se describe un brote de histoplasmosis que afectó a 6 cadetes de la Fuerza Aérea Argentina, sin antecedentes patológicos previos. Todos consultaron por problemas respiratorios después de haber limpiado un hangar. En ese recinto se encontraron abundantes deyecciones de animales, presuntamente de palomas y murciélagos. Los pacientes sufrieron fiebre, mialgias, taquipnea y tos no productiva. Las radiografías y tomografías de tórax mostraron imágenes pulmonares micronodulares, engrosamiento de los tabiques interalveolares y adenopatías hiliares. Todos tuvieron una evolución favorable y no requirieron tratamiento antifúngico. Las pruebas de inmunodifusión y contrainmunoelectroforesis con antígenos de Histoplasma capsulatum fueron positivas, al igual que las intradermorreacciones con histoplasmina. Se recogieron 5 muestras de tierra del lugar, las que fueron inoculadas por vía intraperitoneal a 20 hámsteres. De los cultivos de hígado y bazo de dichos animales se consiguió aislar la fase micelial de H. capsulatum. La cepa aislada se comparó con las obtenidas de 12 pacientes argentinos utilizando perfiles genéticos y se observó un clado único con más de 96% de similitud, lo que confirma la homogeneidad de las cepas argentinas. Si bien la histoplasmosis es endémica en la Pampa húmeda, este es el primer brote totalmente documentado al sur del paralelo 34°.
Palabras clave: Histoplasmosis; Histoplasma capsulatum; Infección primaria; Brote
ABSTRACT
Histoplasmosis outbreak in Morón, Buenos Aires Province, Argentina. An histoplasmosis outbreak affecting 6 previously healthy Air Force cadets is herein presented. The patients suffered from fever and respiratory symptoms after having cleaned an abandoned hangar soiled with pigeons and bat droppings. They all presented fever, myalgia, tachypnea, and nonproductive cough. Chest X-ray and CT scan studies showed disseminated reticulonodular images affecting both lungs. Hiliar adenomegalies were also observed. All patients achieved a favourable outcome without antifungal treatment. Both serologic tests searching for specificic antibodies (immunodiffusion and counterimmunoelectrophoresis) and histoplasmin skin tests were positive in all cases. Five soil samples mixed with pigeons and bat droppings were collected from the hangar. Suspensions of these samples were inoculated into 20 hamsters by intraperitoneal injection; mycelial phase of H. capsulatum was isolated from liver and spleen cultures. The genetic profile of this strain was compared with 12 isolates obtained from Argentinean patients, and a great degree of homogeneity was observed (> 96% similarity). Although histoplasmosis is endemic in the wet Pampas, this is the first epidemic outbreak reported south of the 34th parallel.
Key words: Acute pulmonary histoplasmosis; Histoplasma capsulatum primary infection; Histoplasmosis outbreak
INTRODUCCIÓN
La histoplasmosis clásica es una micosis sistémica endémica producida por el hongo dimorfo Histoplasma capsulatum var. capsulatum. Esta afección es más común en el continente americano; en el Cono Sur de Sudamérica se han reconocido varias zonas endémicas, como la Serra do Mar en el sur de Brasil, la Pampa húmeda y las cuencas de los ríos Paraná y Uruguay en Brasil, Uruguay y la República Argentina (18, 20). En este último país, entre el 30% y el 40% de los habitantes adultos aparentemente sanos de las áreas endémicas han sufrido la infección por este hongo (20). La fuente de infección es el suelo, especialmente las tierras ricas en sustancias orgánicas cuando contienen heces de aves o de murciélagos. En la tierra vive la forma micelial de H. capsulatum, cuyas microconidias son los elementos infectantes (14, 28). La infección se produce por vía inhalatoria, es asintomática en la gran mayoría de los casos y cuando presenta manifestaciones clínicas, éstas son respiratorias, leves y con tendencia a la involución espontánea. Esta infección fúngica no se transmite frecuentemente de persona a persona ni de los animales al ser humano.
En los primeros días posteriores a la infección, el organismo humano se defiende mediante las barreras anatómicas de la mucosa respiratoria y la inmunidad innata. Entre la segunda y la tercera semana de la infección, la inmunidad adaptativa mediada por células consigue habitualmente controlar la infección mediante la estimulación de los macrófagos por parte de las citoquinas de tipo Th1 producidas por los linfocitos T CD4 positivos, en especial la IL12 y el γ interferón (14, 18, 28). Las manifestaciones clínicas de la primoinfección son tanto más graves cuanto mayor es la carga infectante. Sin embargo, una vez superadas las dos o tres primeras semanas se produce la mejoría clínica, independientemente de la gravedad inicial.
En lugares densamente infectados, la primoinfección es masiva y suele ser sintomática y afectar a varias personas a la vez; se originan de esta forma brotes.
El propósito de esta comunicación es dar a conocer un brote de histoplasmosis que afectó a 6 cadetes de la Base Aérea de Morón, dependiente de la Fuerza Aérea Argentina.
MATERIALES Y MÉTODOS
La Unidad Micología del Hospital Francisco J. Muñiz fue consultada para estudiar a 6 pacientes, todos ellos cadetes asignados a la Base Aérea de Morón, que en setiembre de 2008 (primavera del hemisferio sur) presentaron manifestaciones respiratorias y fiebre, dos semanas después de haber efectuado tareas de limpieza en un hangar abandonado.
El hangar había sido abandonado durante varios años y cuando los cadetes efectuaron las tareas de limpieza encontraron deyecciones de animales, que no pudieron identificar, junto con plumas y otros restos orgánicos. Sólo pudimos estudiar a los cadetes que presentaron sintomatología, dado que las autoridades de esta base aérea no permitieron el estudio del resto del personal. Por otra parte, cabe señalar que sólo estas 6 personas estuvieron afectadas a dicha tarea.
Se confeccionaron fichas con los datos demográficos, las manifestaciones clínicas, los estudios por imágenes y los hallazgos de laboratorio de los pacientes.
Los estudios serológicos se llevaron a cabo con pruebas de inmunodifusión en gel de agar y de contrainmunoelectroforesis con inmunodifusión secundaria, de acuerdo con procedimientos ya publicados (17, 31). El antígeno empleado fue un extracto acuoso de la fase levaduriforme de H. capsulatum obtenido conforme con una técnica previamente comunicada (16).
Las pruebas cutáneas se realizaron con histoplasmina diluida 1/100, este antígeno fue obtenido por filtración del desarrollo de H. capsulatum en medio líquido de asparagina-sales descrito por Smith (2). El reactivo utilizado, correspondiente al lote L63, fue provisto por el Centro de Micología de la Facultad de Medicina de la Universidad de Buenos Aires. También se usó con el mismo propósito el antígeno de fase levaduriforme empleado en las pruebas serológicas, diluido 1/50. La lectura de las pruebas cutáneas se realizó a las 48 horas y sus resultados se expresaron en milímetros de infiltrado.
Los lavados broncoalveolares fueron centrifugados a 2000 rpm. durante 10 minutos y el sedimento se examinó al microscopio en preparaciones al estado fresco y teñidas por los métodos de Gram, Kinyoun y Giemsa. Los cultivos se efectuaron en agar-miel de Sabouraud (17) y agar-infusión de cerebro y corazón, ambos adicionados con cloranfenicol y estreptomicina; la incubación se llevó a cabo a 28 °C y 37 °C durante 3 semanas.
Se recibieron 5 muestras de tierra con deyecciones de animales, tomadas de los lugares del hangar en donde se encontraron excrementos de animales y plumas de aves similares a los descritos por los cadetes destinados a las tareas de limpieza. Los cadetes nos informaron que la parte del hangar que estaba menos alterada por la limpieza era la correspondiente a la puerta del recinto y de ese lugar se recogieron 2 muestras.
Las muestras de tierra fueron colocadas en recipientes estériles utilizando cucharas previamente flameadas en alcohol. Veinte gramos de cada muestra fueron vertidos en Erlenmeyers que contenían 100 ml de solución salina isotónica con 600 U/ml de penicilina, 100 μg/ml de cloranfenicol, 100 μg/ml de estreptomicina y 500 μg/ml de cicloheximida. La suspensión obtenida fue agitada en un agitador Vórtex durante 1 minuto; seguidamente se le agregaron 20 ml de aceite mineral estéril y se dejó el frasco en reposo durante 20 minutos. A continuación se obtuvo material de la interfase aceite-agua para efectuar las siembras y la inoculación a los animales. Se sembraron 150 μl de cada muestra en 4 placas de Petri con agar-glucosado de Sabouraud, estos cultivos fueron incubados durante 4 semanas a 28 °C. Además, 4 hámsteres adultos de aproximadamente 80 g de peso (machos y hembras) se inocularon con 1 ml del material obtenido de la interfase aceite-agua. Se dejó a estos animales en jaulas separadas, con comida y bebida ad libitum. Al cabo de 4 semanas se los sacrificó y se efectuaron siembras de hígado y bazo en tubos de ensayo con agar-miel de Sabouraud. Estos cultivos se incubaron a 28 °C durante 3 semanas.
La identificación de las cepas aisladas de H. capsulatum en su fase micelial se realizó mediante la demostración de su capacidad patógena en 2 hámsteres adultos (de igual peso que los antes citados) inoculados por vía intratesticular con 0,1 ml de una suspensión del cultivo en solución salina isotónica estéril, con una opacidad equivalente al N° 3 de la escala de Mac Farland.
La cepa aislada del hangar fue comparada con 12 cepas provenientes de casos clínicos autóctonos de la República Argentina diagnosticados entre 2006 y 2009 y con la cepa Downs (ATTC 38904) mediante métodos moleculares. Se utilizó la técnica RAPD-PCR con los cebadores 1281-1283 y el microsatélite M13. La extracción del ADN fúngico y las condiciones de las técnicas de PCR fueron realizadas de acuerdo con una metodología previamente descrita (6, 32). Los perfiles electroforéticos de los ADN genómicos fueron documentados fotográficamente, digitalizados y comparados utilizando el método de UPGMA y el coeficiente de Dice, con 2% de tolerancia, en el programa BioNumerics ver 5.1 (Applied Maths, Sint-Martens-Latem, Bélgica). Los datos obtenidos fueron reunidos en un árbol de consenso estricto originado en el mismo programa; se dio igual categoría a los resultados de PCR obtenidos con ambos cebadores.
RESULTADOS
Los pacientes estudiados eran jóvenes de 19 a 25 años de edad, de sexo masculino, sin antecedentes patológicos.
Todos presentaron manifestaciones generales y respiratorias, 5/6 tuvieron fiebre mayor de 38 °C y ninguno tuvo hemoptisis. Los síntomas que se presentaron en 3 o más pacientes están consignados en la Tabla 1. Las radiografías de tórax fueron patológicas en todos los enfermos, mostrando imágenes micronodulillares simétricas y diseminadas en ambos pulmones (Figura 1). Las tomografías de tórax de alta resolución mostraron hallazgos patológicos que se consignan en la Tabla 1; se muestra un ejemplo de ellos en la Figura 2. Ninguno de los pacientes tuvo derrame pleural ni pericárdico. Las ecografías abdominales no aportaron datos patológicos. Los estudios funcionales de aparato respiratorio obtenidos por espirometría dieron resultados dentro de los límites normales en 5/6 casos.
Tabla 1. Manifestaciones clínicas y radiológicas de los pacientes

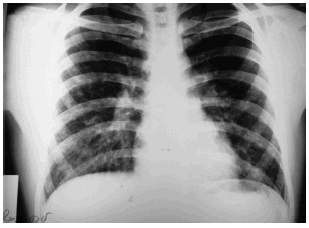
Figura 1. Radiografía de tórax de frente. Se observan lesiones micronodulares diseminadas en ambos pulmones.
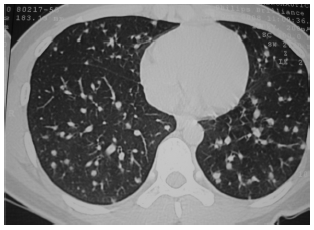
Figura 2. Tomografia axial computarizada de tórax. Se observan micronódulos y aumento de espesor de los tabiques interalveolares.
Respecto de los estudios de laboratorio, los resultados estuvieron comprendidos dentro de los siguientes valores: eritrosedimentación en la primera hora, 5 a 32 mm; hemoglobina, 15,1 a 16,9 g/dl; hematocrito, 43,1% a 48,5%; leucocitos, 5800 a 7810/μl, con fórmula leucocitaria normal. Las concentraciones de láctico-deshidrogenasa oscilaron entre 426 U/ml y 565 U/ml (valor normal: 230 a 460 U/ml) y las de proteína C reactiva entre 80 y 287,2 μg/ml (valor normal: 0 a 5 μg/ml).
Ninguno de los pacientes recibió tratamiento antifúngico y todos mejoraron en la evaluación clínica y radiológica después de 2 meses de control. Al año de producido el brote, todos gozaban de buena salud y estaban realizando sus tareas habituales.
Los estudios micológicos de los lavados broncoalveolares no acusaron la presencia de hongos en los exámenes microscópicos y los cultivos no presentaron el desarrollo de estos microorganismos.
Los resultados de las pruebas cutáneas con histoplasmina y con el antígeno de la fase levaduriforme de H. capsulatum se presentan en la Tabla 2; se ilustra lo observado en una de estas pruebas en la Figura 3.
Tabla 2. Resultados de las pruebas cutáneas y serológicas con antígenos de Histoplasma capsulatum.
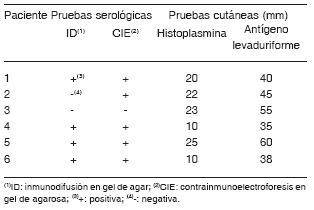
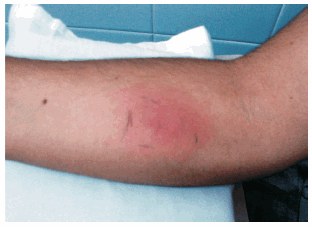
Figura 3. Intradermorreacción con histoplasmina en uno de los pacientes. Se aprecia eritema e infiltrado de más de 25 mm de diámetro.
Las pruebas de contrainmunoelectroforesis con antígeno levaduriforme de H. capsulatum fueron positivas en 5/6 pacientes, con la formación de 2 a 4 bandas de precipitación. La inmunodifusión en gel de agar con el mismo preparado antigénico fue positiva en 4/6 casos, con sueros sin diluir o diluidos al medio. Los resultados obtenidos en cada paciente se consignan en la Tabla 2. Estas pruebas serológicas repetidas un año después arrojaron resultados negativos en todos los casos.
Los cultivos en agar glucosado de Sabouraud de las muestras de tierra procesadas según se describió, e incubadas a 28 °C durante 4 semanas, presentaron el desarrollo de numerosos hongos ambientales, con predominio de Scopulariopsis spp. Asimismo, los hámsteres inoculados con dicho material estaban todos vivos 4 semanas después. Estos animales fueron sacrificados bajo anestesia con éter etílico y se les practicó la necropsia. El examen macroscópico de las vísceras no acusó alteraciones. Se sembraron trozos de hígado y de bazo de todos los animales en agar-miel de Sabouraud y en Lactrimel de Borelli (17). Estos cultivos fueron incubados a 28 ºC durante 4 semanas. Los órganos de los hámsteres inoculados con las dos muestras extraídas del portón del hangar presentaron el desarrollo de colonias vellosas, inicialmente blancas y luego de color canela (Figura 4), que examinadas al microscopio presentaron macroconidias y microconidias compatibles con H. capsulatum (Figura 5). Para confirmar el diagnóstico se inocularon 2 hámsteres por vía intratesticular. A las 3 semanas de inoculados, los 2 hámsteres presentaron orquitis granulomatosa. Estos animales fueron sacrificados, se extrajo el testículo y se hicieron improntas de la superficie de corte de estos órganos. Dichas improntas fueron teñidas con el método de Giemsa y con el resto de estos órganos fijados en formol al 10% e incluidos en parafina se realizaron cortes histológicos, que fueron teñidos con el método de PAS. Ambos tipos de preparaciones mostraron numerosos macrófagos con elementos levaduriformes intracelulares de H. capsulatum (Figura 6).

Figura 4. Cultivos de la fase micelial de H. capsulatum obtenidos de los órganos de animales inoculados con las muestras de tierra provenientes del hangar de la Base Aérea de Morón.

Figura 5. Examen microscópico de los cultivos de la Figura 4. Preparación por disociación montada en azul lactofenol observada con 400 X; debe notarse la presencia de macro y microconidias típicas.
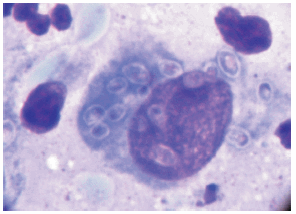
Figura 6. Extendido de la superficie de corte del testículo de un hámster inoculado con el cultivo aislado de las muestras de tierra provenientes del hangar de la Base Aérea de Morón. Se ve un macrófago con elementos levaduriformes intracitoplasmáticos, típicos de H. capsulatum. Tinción de Giemsa, 1000 X.
La cepa de H. capsulatum aislada del hangar de la Base Aérea de Morón presentó un perfil genético con más del 96% de similitud con las cepas obtenidas de pacientes argentinos, con las que formó un grupo muy homogéneo y diferente de la cepa de referencia Downs (ATCC 38904), originaria de los EE.UU. (Figura 7).
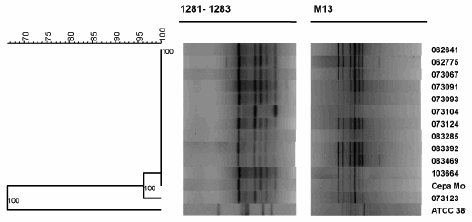
Figura 7. Dendrograma de consenso y perfiles electroforéticos del ADN genómico de diferentes cepas de H. capsulatum, entre las que se incluyó la cepa aislada de las muestras de tierra provenientes del hangar de la Base Aérea de Morón.
DISCUSIÓN Y CONCLUSIONES
Las infecciones primarias producidas por H. capsulatum después de una exposición moderada a los esporos de este microorganismo suelen ser asintomáticas o presentar un cuadro seudogripal leve, acompañado de tos seca, fiebre y astenia. En estos casos, las alteraciones radiológicas son variables y pueden consistir en el aumento del tamaño de los ganglios del hilio pulmonar y del mediastino, así como en la aparición de infiltrados difusos en el parénquima pulmonar. Por lo general estos procesos son leves, curan espontáneamente en 2 o 3 semanas y suelen pasar sin diagnóstico etiológico. Como esta infección no se trasmite de persona a persona, cuando la exposición a la fuente infectante es leve o moderada, los casos sintomáticos son aislados (11, 14, 18, 28).
En los casos de exposición a una fuente masiva de infección suele producirse un ataque difuso a ambos pulmones. Los síntomas, tanto generales como respiratorios, son graves y consisten en fiebre alta, escalofríos, astenia intensa, disnea, tos seca y dolor torácico. Las radiografías y los estudios tomográficos del pulmón muestran imágenes difusas reticulonodulillares que abarcan ambos pulmones, y a veces adenopatías hiliares y mediastinales (11, 14). En los casos más graves, esta infección primaria puede conducir a la falla respiratoria y a la muerte, aunque esta última circunstancia es rara (14). Cuando varias personas se exponen simultáneamente a una fuente de infección masiva se originan pequeños brotes epidémicos, de los cuales pueden participar tanto personas como animales mascota, especialmente perros (25). Los pacientes afectados de estas infecciones respiratorias agudas de cierta gravedad pueden recuperarse totalmente sin necesidad de tratamiento antifúngico. Sin embargo, esta recuperación suele ser lenta y los pacientes permanecen con astenia durante varias semanas (11).
Se han registrado brotes en diversas regiones, incluyendo EE.UU., México, Centroamérica, islas del Mar Caribe y Perú (1, 3-5, 8, 21, 26). Cabe desatacar la gravedad de los brotes registrados en minas de México, con casos clínicos muy graves y con frecuencia fatales (4, 10). Además, en varias regiones se comprobaron brotes de histoplasmosis aguda entre agricultores que empleaban guano de diversas aves como abono (1, 3).
En los EE.UU. se han registrado también epidemias que afectaron a un gran número de personas, en especial brotes urbanos en áreas endémicas, frecuentemente vinculados con construcciones que removieron tierra con heces de murciélagos o que afectaron a nidos de estorninos (pájaros negros que fueron llevados a EE.UU. desde Inglaterra). Inclusive se evaluó el riesgo de los obreros que trabajaron en estas construcciones y se propusieron medidas protectoras para evitar o disminuir el número de infectados (7, 12, 26, 28).
Tanto en los EE.UU. como en Europa se han registrado brotes entre turistas que visitaron áreas endémicas de histoplasmosis. En uno de los brotes observados en los EE. UU., los participantes habían efectuado obras de remodelación en una iglesia en El Salvador; en el otro brote habían estado en un hotel de Acapulco, México, que estaba en remodelación, y un grupo de turistas españoles habían visitado Honduras; estos últimos no pudieron precisar la fuente de infección (15, 19, 27).
La mayor parte de los brotes comunicados en la región austral de América del Sur han sido estudiados en Brasil, en especial en el litoral del estado de Río de Janeiro, en el litoral norte de Sao Paulo, en las sierras de Santa Catarina, en una zona de la altiplanicie central vecina a Brasilia y en Río Grande do Sul (9, 22-25, 30). Todos estos estudios fueron bien documentados e incluyeron aspectos clínicos, radiológicos e inmunológicos de los pacientes y el aislamiento del agente causal de la fuente de infección. De ellos cabe destacar la alta frecuencia de brotes estudiados en el litoral fluminense, que comprometieron a niños y perros que entraban en minas de arcilla abandonadas e invadidas por murciélagos, situadas en las sierras vecinas al litoral marítimo (25).
A diferencia de lo ocurrido en Brasil, los brotes epidémicos de histoplasmosis en la República Argentina han sido raros e incompletamente documentados, y no hay publicaciones acerca de ellos.
Este brote detectado en la Base Aérea de Morón presentó las características habituales de las histoplasmosis agudas ocasionadas por una fuente masiva de infección en un espacio circunscripto. Los pacientes presentaron las manifestaciones clínicas más comunes en este tipo de brotes, los hallazgos radiológicos coincidieron con los descritos en otros brotes epidémicos y la involución espontánea de su enfermedad hizo sospechar la posibilidad de histoplasmosis. Esto último se confirmó mediante el aislamiento de H. capsulatum de la fuente de infección, así como por la positividad de las pruebas cutáneas y serológicas con antígenos de H. capsulatum.
Los resultados de los perfiles genéticos demostraron que el aislamiento obtenido de las muestras de tierra tomadas del hangar de la Base Aérea de Morón es idéntico a los otros aislamientos de la República Argentina. Esto coincide con estudios previos que sugirieron una alta homogeneidad de la población de H. capsulatum en nuestro país (32), población de la que inclusive se postula que tendría un origen clonal (13). Aunque no podemos asegurar que la fuente de infección del brote fue la tierra acumulada en el citado hangar contaminada con guano de murciélagos, estudios previos realizados en quirópteros de la ciudad de Buenos Aires demostraron que estos animales están infectados con H. capsulatum, con un genotipo idéntico al de los aislados de pacientes, hecho que sugiere que estos animales estarían dispersando este hongo patógeno (6).
Hasta la fecha, los brotes epidémicos de histoplasmosis más australes se informaron en el estado de Río Grande do Sul, Brasil, al norte del paralelo 32° de latitud sur (24). Si bien la histoplasmosis es endémica en toda la región de la Pampa húmeda, este es el primer brote totalmente documentado al sur del paralelo 34° 30´, en un sitio distante a tan solo 15 km del centro geográfico de la Ciudad Autónoma de Buenos Aires.
El interés de esta presentación es dar a conocer este brote producido en las inmediaciones de la ciudad de Buenos Aires, dado que es el primero en ser totalmente documentado en la República Argentina. También deseamos advertir sobre la necesidad de informar a la población acerca de los riesgos de contraer infecciones primarias masivas por H. capsulatum vinculadas con la exposición a lugares muy contaminados con excretas de aves y de murciélagos o a maderas enmohecidas.
1. Ajello L. Relationship of Histoplasma capsulatum to avian habitats. Public Health Rep 1964; 79: 266-70. [ Links ]
2. Ajello L, George L, Kaplan W, Kaufman L. Laboratory Manual for Medical Mycology. U.S. Department of Health, Education and Welfare. Public Health Service. Communicable Disease Center. Atlanta, Georgia, USA, 1962. [ Links ]
3. Ajello L, Lazarus AS, Cornejo A, Moore JC. Studies on the occurrence of Histoplasma capsulatum in Peru. Sabouraudia 1961; 1: 83-6. [ Links ]
4. Alarcón DG. Histoplasmosis pulmonar epidémica. Gac Med Mex 1957; 87: 745-50. [ Links ]
5. Campins H, Zubillaga C, Gómez López L, Dorante M. Estudio de una epidemia de histoplasmosis en el Estado de Lara, Venezuela. Gac Med Caracas 1955; 62: 85-109. [ Links ]
6. Canteros CE, Iachini RH, Vaccaro O, Madariaga J, Galarza R, Snaiderman L, et al. Primer aislamiento de Histoplasma capsulatum de murciélago urbano Eumops bonaerenses. Rev Argent Microbiol 2005; 37: 46-56. [ Links ]
7. D´alessio DJ, Heeren RH, Hendricks SL, Ogilvie P, Furcolow ML. A starling root as the source of urban epidemic histoplasmosis in an area of low incidence. Am Rev Resp Dis 1965; 92: 725-31. [ Links ]
8. Emmons C. Histoplasma capsulatum and house bats in Trinidad. Sabouraudia 1962; 2: 18-22. [ Links ]
9. Fava Netto C, Silva VA, Chammas F, Lacaz CS. Histoplasmose epidémica. Estudo clínico, radiológico e imunologico de surto ocorrido no Estado de Sao Paulo. Rev Inst Med trop Sao Paulo 1967; 9: 222-32. [ Links ]
10. González Ochoa A. Histoplasmosis pulmonar aguda primaria. Mycopathologia 1961; 15: 299-305. [ Links ]
11. Goodwin JE, Lloyd R, Des Prez R. Histoplasmosis in the normal host. Medicine 1981; 60: 231-66. [ Links ]
12. Huhn GD, Austin C, Carr M, Heyer D, Boudreau P, Gilbert G, et al. Two outbreaks of occupational acquired histoplasmosis: more than workers at risk. Environ Health Perspect 2005; 113: 585-9. [ Links ]
13. Kasuga T, White J, Koenig J, Mc Ewen J, Restrepo A, Castañeda E, et al. Phylogeography of the fungal pathogen Histoplasma capsulatum. Mol Ecol 2003; 12: 3383-401. [ Links ]
14. Kauffman C.A. Histoplasmosis. Clin Chest Med 2009; 30: 217-25. [ Links ]
15. Morgan J, Cano MV, Feikin DR, Phelan M, Velázquez Monroe O, Kuri Morales P, et al. A large outbreak of histoplasmosis among american travelers associated with a hotel in Acapulco, Mexico, spring 2001. Am J Trop Med Hyg 2003; 69: 663-9. [ Links ]
16. Negroni R, Iovannitti C, Arechavala A, Carnovale S, Eiguchi K. Preparación y estudio de un exo-antígeno de la fase levaduriforme de H. capsulatum para reacciones serológicas. Rev Iberoam Micol 1998; 15: 282-5. [ Links ]
17. Negroni R, Guelfand L. Manual de Procedimentos para La boratorios de Micología Médica. Acta Bioquim Clin Latinoam 1999; Supl 1: S5-57. [ Links ]
18. Negroni R. Histoplasmose. En: Cimerman S, Cimerman B, editores. Condutas em infectologia. Atheneu. Sao Paulo, Rio de Janeiro, Belo Horizonte, 2004, p. 376-83. [ Links ]
19. Norman FF, Martín Davila P, Fortúm J, Dronda F, Quereda C, Sanchez Souza A, et al. Imported histoplasmosis: two distinct profiles in travelers and immigrants. J Travel Med 2009; 16: 258-62. [ Links ]
20. Rubinstein P, Negroni R. Histoplasmosis. En: Rubinstein P, Negroni R, editores. Micosis Broncopulmonares del Adulto y del Niño. 2° Edición. Buenos Aires, Editorial Beta. 1981, p. 248-90. [ Links ]
21. Sack JJ, Ajello L, Crockett LK. An outbreak and review of cave associated histoplasmosis capsulati. J Med Mycol 1986; 24: 313-27. [ Links ]
22. Schmidt S, Machado OP, Galvão AB. Microepidemia de histoplasmose na zona rural de Brasilia DF 2. Rev Soc Bras Med Trop 1973; 7: 107-15. [ Links ]
23. Severo LC, Petrillo VF, Camargo JJ, Geyer GR, Porto N. Acute pulmonary histoplasmosis and first isolation of Histoplasma capsulatum from soil of Rio Grande do Sul. Rev Inst Med trop Sao Paulo 1986; 28: 51-5. [ Links ]
24. Severo LC, Oliveira FM, Irion K, Porto NS, Londero AT. Histoplasmosis in Rio Grande do Sul, Brazil: a 21-year experience. Rev Inst Med trop Sao Paulo 2001; 43: 183-7. [ Links ]
25. Wanke B. Histoplasmose estudo epidemiológico, clinico e experimental. Rio de Janeiro, 1985. Tese de Doutoramento. Facultade de Medicina Universidade Federal do Rio de Janeiro, Brasil. [ Links ]
26. Ward JI, Weeks M, Allen D, Hutcheson RH, Anderson R, Fraser DW, et al. Acute histoplasmosis: clinical, epidemiologic and serologic findings of an outbreak associated with exposure to a fallen tree. Am Med J 1979; 66: 587-95. [ Links ]
27. Warren KA, Wellman A, Hanks C, LaFountain T, Lowery E, Woolard D, et al. Outbreak of histoplasmosis among travelers returning from El Salvador-Pennsylvania and Virginia, 2008. JAMA 2009; 301: 478-80. [ Links ]
28. Wheat LJ, Slama TG, Eitzen HE, Kohler RB, French MLV, Beisecker JL. A large urban outbreak of histoplasmosis: clinical features. Ann Intern Med 1981; 94: 331-7. [ Links ]
29. Wheat LJ, Kauffman CA. Histoplasmosis. Infect Dis Clin N Am 2003; 17: 1-19. [ Links ]
30. Zancopé-Oliveira RM, Wanke B. Distribuicao das fontes de infeccao do Histoplasma capsulatum em Rio da Prata. �Rev Inst Med trop Sao Paulo 1987; 29: 243-50. [ Links ]
31. Zaror L, Robles AM, Negroni R. Pruebas de inmunodifusión en medios gelosados con el agregado de polietilenglicol 6000 para el serodiagnóstico de las micosis. Rev Argent Microbiol 1978; 10: 61-4. [ Links ]
32. Zuiani MF, Rivas MC, Lee W, Guelfand L, Davel G, Canteros CE. Histoplasma capsulatum con morfología aberrante aislado en la Argentina. Rev Argent Microbiol 2006; 38: 79-83. [ Links ]
Recibido: 11/05/2010
Aceptado: 28/07/2010














