Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541
Rev. argent. microbiol. vol.43 no.2 Ciudad Autónoma de Buenos Aires jun. 2011
ARTÍCULOS ESPECIALES
Criterios de ensayo, interpretación e informe de las pruebas de sensibilidad a los antibióticos en los bacilos gram negativos no fermentadores de importancia clínica: recomendaciones de la Subcomisión de Antimicrobianos de la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas, Asociación Argentina de Microbiología
Marcela Radice1, Marcelo Marín1, Marta Giovanakis1, Carlos Vay2, Marisa Almuzara2, Adriana Limansky2, José M. Casellas1, Angela Famiglietti1, Mirta Quinteros1, Carlos Bantar1, Marcelo Galas2, Jaime Kovensky Pupko1, Federico Nicola1, Fernando Pasterán1, Rolando Soloaga1, Gabriel Gutkind1, 3*
1Subcomisión de Antimicrobianos, Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas, Asociación Argentina de Microbiología;
2Expertos invitados;
3Coordinador de la Subcomisión de Antimicrobianos, Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas, Asociación Argentina de Microbiología. Deán Funes 472 (1214) Ciudad Autónoma de Buenos Aires, Argentina.
*Correspondencia. E-mail: ggutkind@ffyb.uba.ar
RESUMEN
En este documento se dan a conocer una serie de recomendaciones para el ensayo, la lectura, la interpretación y el informe de las pruebas de sensibilidad a los antimicrobianos para los bacilos gram negativos no fermentadores (BGNNF) que se aíslan en humanos. Se adoptaron como base las recomendaciones internacionales, las de la Subcomisión de Antimicrobianos de la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas y las de un grupo de expertos invitados. Se incluye, además, la nomenclatura actualizada de los BGNNF y la descripción de algunas de sus características individuales, de sus resistencias naturales o habituales a los antimicrobianos de uso clínico y de los mecanismos responsables de tales resistencias. También se indican los agentes antimicrobianos que se deberían ensayar frente a las distintas especies, con la especificación de cuáles deberían ser informados, y su ubicación estratégica en las placas de cultivo para poder detectar los mecanismos de resistencia más frecuentes y relevantes. Por último, se detallan los métodos de detección y de confirmación fenotípica de la presencia de b-lactamasas emergentes en Argentina, como las carbapenemasas clases A y B.
Palabras clave: Bacilos gram negativos no fermentadores; Pruebas de sensibilidad; Antimicrobianos; Recomendaciones
ABSTRACT
Antimicrobial susceptibility testing in clinically relevant non-fermenting gram-negative bacilli: recommendations from the Antimicrobial Agents Subcommittee of the Sociedad Argentina de Bacteriología, Micología y Parasitología Clínicas, Asociación Argentina de Microbiología. This document contains the recommendations for antimicrobial susceptibility testing of the clinically relevant non-fermenting gram-negative bacilli (NFGNB), adopted after conforming those from international committees to the experience of the Antimicrobial Agents Subcommittee members and invited experts. This document includes an update on NFGNB classification and description, as well as some specific descriptions regarding natural or frequent antimicrobial resistance and a brief account of associated resistance mechanisms. These recommendations not only suggest the antimicrobial drugs to be evaluated in each case, but also provide an optimization of the disk diffusion layout and a selection of results to be reported. Finally, this document also includes a summary of the different methodological approaches that may be used for detection and confirmation of emerging b-lactamases, such as class A and B carbapenemases.
Key words: Non-fermenting gram-negative bacilli; Antimicrobial susceptibility testing; Recommendations
INTRODUCCIÓN
Los bacilos gram negativos no fermentadores (BGNNF) constituyen un grupo heterogéneo de microorganismos que no fermentan los hidratos de carbono. Están ampliamente distribuidos en la naturaleza, ya que se los encuentra en el suelo, el agua y las plantas. Aunque más de 120 especies de BGNNF han sido reconocidas como patógenos oportunistas, y Burkholderia pseudomallei, Burkholderia mallei, Brucella spp. y Francisella spp. son siempre considerados patógenos para el hombre, las infecciones más frecuentes son ocasionadas por un número limitado de especies: Pseudomonas aeruginosa, el complejo Acinetobacter baumannii-calcoaceticus y Stenotrophomonas maltophilia. Estas infecciones son habitualmente adquiridas en el ambiente hospitalario.
Los métodos por difusión son adecuados para determinar la sensibilidad a los antimicrobianos de P. aeruginosa, Acinetobacter spp., S. maltophilia y B. cepacia. Sin embargo, otros BGNNF requieren pruebas de sensibilidad por dilución (19). Los métodos epsilométricos resultan una alternativa útil para la determinación de la sensibilidad, especialmente por su sencillez. Si bien es posible recurrir a los métodos automatizados, frente a pacientes críticos es recomendable la determinación de la concentración inhibitoria mínima (CIM) por dilución.
El objetivo central de estas recomendaciones para el ensayo, la lectura, la interpretación y el informe de las pruebas de sensibilidad a los antimicrobianos de los BGNNF, elaboradas de manera acorde con las necesidades de nuestro país, es generar un instrumento útil en la práctica microbiológica diaria que oriente hacia el mejor esquema terapéutico. Se adoptaron como base las recomendaciones del Clinical Laboratory Standards Institute (CLSI) y del European Committee on Antimicrobial Susceptibility Testing (EUCAST), y la experiencia de los miembros de la Subcomisión de Antimicrobianos de la Sociedad Argentina de Bacteriología, Micología y Parasitología Clínica (SADEBAC), división de la Asociación Argentina de Microbiología (AAM), y de un grupo de expertos invitados.
Se incluye una actualización de la nomenclatura de BGNNF frecuentes en humanos y la descripción individual de sus resistencias naturales o habituales, así como de los mecanismos responsables de ellas. Se recomiendan los agentes antimicrobianos que se deberían ensayar en las distintas especies (con la expresa indicación de cuáles deberían ser informados) y se señala cuál debe ser su ubicación estratégica en las placas de cultivo para poder detectar los mecanismos de resistencia más frecuentes y relevantes.
Por último, se detallan los métodos de detección y de confirmación fenotípica de la presencia de b-lactamasas emergentes o potencialmente emergentes, como las carbapenemasas de clases A y B.
ACTUALIZACIÓN TAXONÓMICA Y SINONIMIAS
Desde el punto de vista taxonómico, la clasificación de los BGNNF es extremadamente compleja. Estos microorganismos pertenecen al dominio Bacteria (Eubacteria) y dentro de este a dos phylum: Proteobacteria y Flavobacteria. Tres son las clases (secciones) de Proteobacteria en donde se encuentran los BGNNF de importancia clínica: a-Proteobacteria, b-Proteobacteria y g-Proteobacteria. Asimismo, en el phylum Flavobacteria son dos las Clases donde se encuentran géneros de BGNNF relevantes: Flavobacteria y Sphingobacteria.
Las especies que con más frecuencia infectan al hombre se hallan ubicadas entre las a-proteobacterias (familia Pseudomonadaceae: P. aeruginosa, familia Moraxellaceae: Acinetobacter spp., familia Xanthomonadaceae: S. maltophilia).
Si bien el desarrollo de métodos moleculares de caracterización ha resuelto muchísimos problemas taxonómicos, aún existen algunos miembros de este grupo cuya ubicación no ha sido totalmente esclarecida.
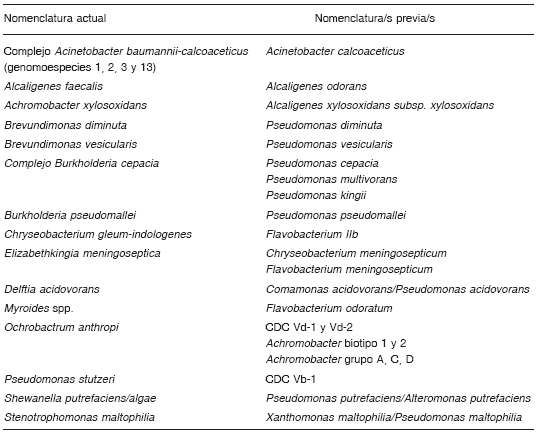
En la Tabla 1 se mencionan algunas actualizaciones en la nomenclatura de los BGNNF.
Tabla 1. Nomenclatura actualizada de los BGNNF
La taxonomía del género Acinetobacter ha sufrido continuos cambios. Actualmente este género contiene 33 genomoespecies, de las cuales 21 han sido denominadas y de ellas, solo 12 han sido recuperadas de especímenes clínicos: Acinetobacter baumannii, Acinetobacter calcoaceticus, Acinetobacter haemolyticus, Acinetobacter johnsonii, Acinetobacter junii, Acinetobacter lwoffii, Acinetobacter radioresistens, Acinetobacter ursingii, Acinetobacter schindleri, Acinetobacter parvus, Acinetobacter beijerinckii y Acinetobacter gyllenbergii (www.bacterio.cict.fr). Las genomoespecies 3, 13UT, 10 y 11 también han sido recuperadas de muestras clínicas.
RESISTENCIAS NATURALES
Si bien se considera a todos los BGNNF resistentes a la vancomicina, existen aislamientos de Chryseobacterium gleum-indologenes, Elizabethkingia meningoseptica, Weeksella virosa, Bergeyella zoohelcum, Sphingobacterium spp., Sphingomonas paucimobilis, Acinetobacter lwoffii y Brevundimonas vesicularis que pueden ser inhibidos por este antimicrobiano.
En la Tabla 2 se mencionan las resistencias naturales o habituales a los antimicrobianos en los BGNNF de importancia clínica.
Tabla 2. Resistencias habituales a los antimicrobianos en los BGNNF de importancia clínica

Pseudomonas aeruginosa
P. aeruginosa constituye un importante patógeno nosocomial ya que ocupa el tercer lugar (11 %) en frecuencia de aislamientos recuperados de pacientes hospitalizados [Sistema Informático de Resistencia (SIR) 2006-2007, www.aam.org.ar]. La elección del tratamiento antimicrobiano empírico adecuado resulta dificultosa dado que, por un lado, P. aeruginosa es naturalmente resistente a muchos antimicrobianos de uso clínico (Tabla 2), y por otro, presenta una elevada capacidad de adquirir nuevos mecanismos de resistencia que reducen aún más las posibilidades terapéuticas. La resistencia natural se debe, en parte, a la baja permeabilidad de su membrana externa y a la expresión natural de sistemas de eflujo que extruyen antibióticos fuera de la célula. La expresión natural de MexAB-OprM y MexXY-OprM contribuye a la resistencia intrínseca observada en P. aeruginosa, mientras que los niveles de expresión de MexCD-OprJ y MexEF-OprN no resultan suficientes. Además, este microorganismo posee una b-lactamasa cromosómica inducible de tipo AmpC que, combinada con los sistemas anteriores, contribuye a la resistencia a los antibióticos b- lactámicos (47).
Dentro de los mecanismos de resistencia adquirida pueden mencionarse la hiperproducción de la enzima de tipo AmpC; la reducción de la permeabilidad de la membrana externa por alteración en la expresión de porinas; la sobreexpresión de sistemas de eflujo; la adquisición de genes codificantes de b-lactamasas de clase A, de metaloenzimas de clase B, y de enzimas de tipo OXA de clase D y la producción de enzimas modificadoras de los aminoglucósidos (88).
La presencia de b-lactamasas adquiridas es menos frecuente que en enterobacterias. Dentro de las enzimas de espectro ampliado (BLEA) son habituales las de tipo PSE, y en menor medida, enzimas de tipo TEM y OXA. Entre las b-lactamasas de espectro extendido (BLEE) descritas en P. aeruginosa se encuentran las enzimas de tipo TEM, OXA, SHV, VEB, PER, GES y CTX-M (78, 88). En nuestro país, se ha comunicado la presencia de las enzimas GES-1 y CTX-M-2 (5, 74, 79).
La sensibilidad a los carbapenemes se ve afectada tanto por la inactivación enzimática como por alteraciones en la accesibilidad (o extrusión) de la droga al espacio periplásmico, desde donde acceden a sus proteínas blanco. La inactivación enzimática está mediada por la producción de carbapenemasas, las que pueden ser tanto serino-enzimas como metalo-b- lactamasas (MBL). La alteración de la concentración en el periplasma puede deberse al déficit en la expresión de OprD o a la sobreexpresión de los sistemas de eflujo de tipo MexAB-OprM, MexCD-OprJ, MexEF-OprN, MexXY-OprM (47).
La detección de aislamientos de bacilos gram negativos productores de carbapenemasas ha aumentado a lo largo de los últimos años en todo el mundo (73). Las enzimas más frecuentemente detectadas son las de tipo IMP y VIM, tanto en P. aeruginosa como en otros BGNNF, y comúnmente se asocian a brotes intrahospitalarios (96). En nuestro país se ha comunicado el hallazgo de aislamientos de P. aeruginosa productores de serino-enzimas tipo KPC (64) y MBL tipo IMP, VIM y SPM-1 (17, 20, 61-63, 83).
Cabe destacar que es muy común la presencia conjunta de varios de los mecanismos de resistencia mencionados, por lo que resulta difícil poder dilucidar los mecanismos presentes sobre la base del fenotipo observado en el antibiograma.
Antibióticos que se deben ensayar e informar
Para la realización del antibiograma por difusión sugerimos tomar en cuenta los lineamientos del CLSI (19), incluyendo las pruebas de control de calidad que evalúan la concentración de cationes en el medio de cultivo (ya que estos pueden afectar especialmente las lecturas de los halos de inhibición que producen los aminoglucósidos).
En la Tabla 3 se detallan los antimicrobianos que se recomienda ensayar por el método de difusión en agar e informar en esta especie.
Tabla 3. Antimicrobianos que se deben ensayar por el método de difusión en agar e informar en P. aeruginosa y Acinetobacter spp.
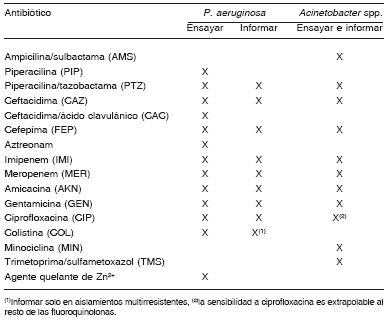
Si bien el CLSI recomienda incubar las placas hasta 24 h en los aislamientos de P. aeruginosa recuperados de pacientes con fibrosis quística o con enfermedad pulmonar obstructiva crónica, este grupo de expertos recomienda prolongar la incubación hasta las 48 h para la lectura de los halos de inhibición.
Aunque el CLSI aún no ha establecido puntos de corte para el doripenem, algunos expertos de nuestro país sugieren emplear aquellos propuestos por Brown et al. (16), dado que se ha demostrado que esta droga resulta más activa in vitro que otros carbapenemes frente a aislamientos deficitarios en OprD o sobreproductores de sistemas de eflujo.
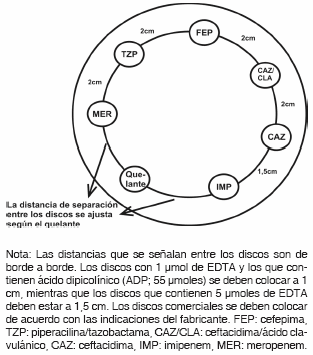
Para maximizar la información obtenida a partir del antibiograma inicial, se recomienda distribuir los discos que contienen los antibióticos según se indica en la Figura 1.
Placa 1: imipenem (IMI), quelante de Zn, meropenem (MER), ceftacidima (CAZ), ceftacidima/ácido clavulánico (CAC), cefepima (FEP) y piperacilina/tazobactama (PTZ) (Figura 1). Pueden utilizarse discos que contienen agentes quelantes preparados en el laboratorio, como EDTA (1 μmol o 5 μmoles, equivalentes a 375 μg o 187 μg respectivamente), o ADP (ácido dipicolínico) (55 μmoles, equivalente a 920 μg), o bien discos comerciales.
Placa 2: amicacina (AMK), gentamicina (GEN), ciprofloxacina (CIP), piperacilina (PIP), colistina (COL) y aztreonam (AZT).
Las MBL catalizan la ruptura del anillo b-lactámico mediada por cationes divalentes (Zn2+), por lo que su actividad se inhibe en presencia de agentes quelantes de iones, como el EDTA (81). Es por ello que la aproximación de un disco impregnado con un agente quelante a un disco que contiene un carbapeneme resulta una herramienta útil para la detección de MBL. El efecto sinérgico entre IMI o MER y el agente quelante será indicativo de la presencia de MBL, aunque es aconsejable confirmar su presencia con otras metodologías, tal como se indica en el anexo metodológico.
Dado que las MBL son capaces de hidrolizar todos los antibióticos b-lactámicos excepto monobactamas (AZT), la sensibilidad a este antimicrobiano podría ser un buen predictor de la presencia de estas enzimas en microorganismos resistentes a todos los b-lactámicos, incluyendo IMI y MER. Por el contrario, la resistencia a AZT en microorganismos resistentes a carbapenemes no descarta la presencia de MBL, ya que pueden sumarse enzimas de espectro extendido que superponen su actividad a la de las MBL.
En la Tabla 4 se describen distintos perfiles de resistencia a las cefalosporinas de espectro extendido y a los carbapenemes, los probables mecanismos responsables de estas resistencias, los métodos que permiten confirmar la presencia de dichos mecanismos y los criterios aconsejados en este consenso para el informe de la sensibilidad a antibióticos.
Tabla 4. Mecanismos probables de resistencia en P. aeruginosa, métodos confirmatorios y criterios de informe.
4a. Resistencia a cefalosporinas de espectro extendido
4b. Resistencia a los carbapenemes
En los aislamientos de P. aeruginosa que presenten halos de inhibición por IMI o MER de 16 a 21 mm (83), cuando se detecte la posible presencia de carbapenemasas, los editores de este consenso sugieren que se determine y se informe el valor de la CIM y se advierta de la presencia de la enzima.
Acinetobacter spp.
Como ya fue expuesto, el género Acinetobacter ha sufrido cambios taxonómicos significativos a lo largo de las últimas décadas. La mayoría de los aislamientos recuperados de especímenes clínicos corresponden al complejo Acinetobacter calcoaceticus-baumannii (Ac-b), constituido por A. calcoaceticus, A. baumannii y Acinetobacter genomoespecies 3 y 13TU. De todas ellas, la genomoespecie A. baumannii es la que se aísla con mayor frecuencia (67).
Tanto los esquemas de identificación convencionales como las galerías comerciales poseen limitada capacidad para diferenciar las genomoespecies que incluyen el complejo Ac-b. De ser esto necesario, debe recurrirse al empleo de métodos moleculares. Entre ellos, el reconocimiento de la presencia del gen codificante de la ß-lactamasa OXA-51, presente en todos los aislamientos de A. baumannii independientemente de la sensibilidad a los carbapenemes, podría ser utilizado como indicador de dicha genomoespecie (90).
Los miembros del complejo Ac-b se aíslan con frecuencia en pacientes hospitalizados, inmuncomprometidos, sometidos a procedimientos invasivos y en aquellos que están bajo tratamiento con varios antibióticos o antibióticos de amplio espectro (32, 68). Son frecuentes colonizantes de fómites y sobreviven largos períodos en superficies metálicas, lo que favorece su diseminación en el ambiente hospitalario.
Las infecciones causadas por los microorganismos pertenecientes a este complejo representan un verdadero desafío para el equipo hospitalario de salud debido a su multirresistencia a los antibióticos. Estos microorganismos presentan una capa mucoide constituida por un derivado de la N-acetil-galactosamina, que favorece su adherencia a varios tejidos. Asimismo, se ha comprobado la producción de biopelículas que lo protegen de los antibacterianos (22). El complejo Ac-b es con frecuencia resistente a muchos antibióticos, incluyendo los b-lactámicos (14, 31, 67, 68, 72, 95), los aminoglucósidos y las fluoroquinolonas (12, 72, 80, 95). Además, posee una excelente capacidad para adquirir y expresar en forma conjunta nuevos mecanismos de resistencia, ya que es fácilmente transformable (31, 67, 68, 95). La emergencia de la resistencia a carbapenemes es absolutamente relevante, ya que en muchas situaciones este grupo de antibióticos constituye la única opción de tratamiento frente a aislamientos multirresistentes (15, 67, 68).
La resistencia a los antibióticos b-lactámicos en el complejo Ac-b puede deberse alternativamente a la inactivación enzimática, a alteraciones en la afinidad de las proteínas ligadoras de penicilina (PLP), a alteraciones en la expresión de las porinas, a la presencia de bombas de eflujo, o bien a la combinación de algunos de estos mecanismos de resistencia (68).
A. baumannii produce una cefalosporinasa cromosómica de tipo AmpC que no es inducible en su expresión (31). Sin embargo, la inserción de la secuencia de inserción ISAba1 incrementa el nivel de expresión de la enzima, lo que confiere la resistencia a penicilinas, cefalosporinas de primera, segunda y tercera generación y a cefamicinas (36). Aun así, debe recordarse que esta enzima no afecta eficientemente a la cefepima ni a los carbapenemes, por lo que no es infrecuente encontrar su asociación a otros mecanismos de resistencia.
En este género se ha descrito, además, la adquisición de otras b-lactamasas de espectro ampliado, como TEM-1, y de espectro extendido, como VEB, PER-2 y CTX-M-2 (65).
La resistencia a carbapenemes parece estar esencialmente asociada a la producción de enzimas de tipo OXA (b-lactamasas de clase D de Ambler), y con menor frecuencia a la producción de MBL (15, 69, 73, 96). Debido a la facilidad de la especie para captar y expresar nuevos mecanismos de resistencia, no es sorprendente que también se haya descrito en este género la presencia de enzimas de tipo KPC (carbapenemasas de clase A de Ambler) (77).
Los mecanismos no enzimáticos de resistencia a carbapenemes incluyen la reducción en la expresión de PLP-2 (31), la pérdida de una proteína de membrana externa, CarO, que afecta principalmente al imipenem, (45, 55, 77, 87), y la sobreexpresión de la bomba de eflujo AdeABC, caracterizada en A. baumannii. Esta bomba extruye aminoglucósidos, cefotaxima, tetraciclinas, eritromicina, cloranfenicol, trimetoprima-sulfametoxazol y fluoroquinolonas, y contribuye significativamente (junto con las enzimas de clase D) en la resistencia a los carbapenemes (49).
Además de esta bomba, la resistencia a los aminoglucósidos también es influenciada por la expresión de enzimas modificadoras, como fosfo-, acetil- y nucleotidil-transferasas (56).
La resistencia franca a las quinolonas modernas parece deberse a la sumatoria de diversos mecanismos, incluyendo las alteraciones en la estructura de la ADN girasa o de la topoisomerasa IV (mediadas por mutaciones en los genes gyrA y parC, respectivamente) (35, 38) y a las bombas de eflujo AdeABC y AdeM. Recientemente se ha descrito que los mecanismos de resistencia enzimática a quinolonas mediada por los genes qnr ya han arribado a este género (89).
La resistencia a las tetraciclinas (y sus derivados) se debe a la expresión de bombas de eflujo [tet(A) y tet(B) y AdeABC] o a modificaciones ribosomales [tet(M) y tet(O)]. La tigeciclina puede ser expulsada por la bomba de eflujo AdeABC (66, 80), aunque quizás esta extrusión, mediada por niveles basales de la bomba, no llegue a ser suficiente para la categorización como resistente.
La multirresistencia creciente en este género hace que algunas alternativas terapéuticas previamente dejadas de lado (polimixinas, rifampicina, minociclina, sulbactama) o bien algunas relativamente nuevas (tigeciclina) sean hoy consideradas como opciones de tratamiento válidas.
Si bien los aislamientos iniciales de Ac-b rara vez son categorizados como resistentes a colistina (< 3 %), puede ocurrir la selección de microorganismos resistentes a partir de aislamientos heterorresistentes. En este caso, la heterorresistencia es definida por la preexistencia de una subpoblación minoritaria de microorganismos resistentes (CIM ≥ 32 μg/ml) dentro de una población mayoritaria sensible (CIM ≤ 2 μg/ml) (43).
La sensibilidad a colistina solo puede ser determinada por métodos por dilución o epsilométricos, ya que ni el CLSI ni el EUCAST han establecido puntos de corte por difusión. La heterorresistencia suele detectarse al realizar las pruebas epsilométricas solo luego de 48 h de incubación, como desarrollo de colonias dentro de la elipse.
Por otro lado, pese a que la sulbactama es casi siempre considerada un inhibidor de las b-lactamasas de clase A, también tiene actividad intrínseca sobre algunas especies de bacterias gram negativas, en las que bloquea específicamente alguna PLP esencial (91). La sensibilidad a esta droga suele ser inferida empleando sus combinaciones con aminopenicilinas, ya que estas son inactivas sobre a Ac-b.
En la Argentina, la resistencia a sulbactama en Ac-b se observa en el 60 % de los aislamientos, según datos relativamente recientes (www.aam.org, SIR 2007). La sensibilidad a sulbactama en nuestro medio era aproximadamente del 50 % en 1991 y este agente restituía la actividad de la ampicilina en un 80 % de los casos (72). En otros países latinoamericanos, la sensibilidad parece ser mayor (J. M. Casellas, comunicación personal).
La tigeciclina resulta activa in vitro frente a muchas cepas de Ac-b; no obstante, se han descrito aislamientos con valores de CIM elevados debido a la sobreexpresión de la bomba de eflujo AdeABC, mediada por la asociación a una secuencia de inserción (ISABA) (67, 68). Se ha demostrado el riesgo de selección de este mecanismo de resistencia por la presión selectiva de concentraciones subóptimas de antibiótico (como la alcanzada en el suero, que es inferior a 1 μg/ml) (66). Sin embargo, debe recordarse que la tigeciclina llega a concentraciones muy superiores a las séricas tanto en el fluido pulmonar como en las células alveolares.
En la actualidad, no existen puntos de corte definidos de tigeciclina para Ac-b. La FDA propone puntos de corte de tigeciclina para Enterobacteriaceae (S ≤ 2 μg/ml y R ≥ 8 μg/ml por dilución; S ≥ 19 mm y R ≤ 14 mm por difusión). Por su parte, el EUCAST solo considera puntos de corte para Enterobacteriaceae por dilución (S ≤ 1 μg/ml). Si bien las apreciaciones preliminares de algunos autores parecían indicar que un punto de corte de 2 μg/ml podría ser un valor aceptable desde el punto de vista farmacocinético, posteriores casos de fallas de tratamiento en algunos pacientes graves sugieren que un punto de corte de 1 μg/ml podría ser más adecuado. Por su parte, en un estudio multicéntrico realizado en nuestro país se ha informado que 1 μg/ml de dicha droga es capaz de inhibir el 90 % de los aislamientos de esta especie (18). Los integrantes de este consenso sugieren que se determine la sensibilidad por métodos de dilución y se informe el valor de CIM obtenido.
Antibióticos que se deben ensayar e informar
Para la realización del antibiograma por difusión se tendrán en cuenta los lineamientos del CLSI (19); nuevamente, cabe destacar la importancia de realizar el control de calidad que evalúa la concentración de cationes en el medio de cultivo, variable que puede afectar especialmente las lecturas de los halos frente a aminoglucósidos.
En la Tabla 3 se detallan los antimicrobianos que se recomienda ensayar por el método de difusión en agar frente a aislamientos de Acinetobacter spp.; todos los resultados deben ser informados. El tiempo de incubación según el CLSI es de 20-24 h.
Se recomienda la misma ubicación de discos y la incorporación de discos con quelantes de Zn2+, tal como se indicó para P. aeruginosa (Figura 1)
Placa 1: imipenem (IMI), quelante de Zn2+, meropenem (MER), ceftacidima (CAZ), ceftacidima/clavulánico (CAC), cefepime (FEP) y piperacilina/tazobactama (TAZ).
Placa 2: amicacina (AMK), gentamicina (GEN), ciprofloxacina (CIP), ampicilina/sulbactama (AMS), cotrimoxazol (TMS), piperacilina (PIP) y minociclina (MIN).
Se propone igual metodología de screening para detectar BLEE y carbapenemasas que en P. aeruginosa.
La alta prevalencia de multirresistencia hace necesario ensayar antibióticos polipeptídicos (colistina-polimixina B), para lo cual debe determinarse la CIM. Los puntos de corte recomendados por el CLSI para métodos de dilución son los siguientes: sensible ≤ 2 μg/ml y resistente ≥ 4 μg/ml.
Perfil de resistencia más probable en el antibiograma por difusión en los BGNNF (excluidos P. aeruginosa y el complejo A. baumannii)
La determinación del perfil de sensibilidad ayuda enormememente a la identificación de muchos BGNNF; de hecho, la resistencia a ciertos antimicrobianos es una herramienta diagnóstica de incalculable valor en la confirmación de la identidad bacteriana. El antibiotipo puede determinarse por difusión en agar empleando los puntos de corte de P. aeruginosa y Acinetobacter spp. Esto no implica que se apruebe la utilización de estos puntos de corte para establecer la sensibilidad/resistencia a los antibacterianos; solo se sugiere su utilización como una herramienta en la identificación, ya que el conocimiento de la especie nos permite guiar el tratamiento más adecuado.
En la Tabla 5 se observa el perfil de sensibilidad hallado con mayor frecuencia en relación con la especie aislada.
Tabla 5. Perfil de sensibilidad a antibióticos en las distintas especies de BGNNF excluidos P. aeruginosa y Acinetobacter spp.

Stenotrophomonas maltophilia
S. maltophilia es un BGNNF de importancia clínica, ya que es un patógeno oportunista asociado a infecciones nosocomiales y a infecciones en pacientes inmunocomprometidos (24, 44, 53).
Este BGNNF es intrínsecamente resistente a una amplia variedad de antimicrobianos debido a la presencia de enzimas inactivantes de antibióticos, a la impermeabilidad de su membrana externa y también a la presencia de bombas de eflujo para una multiplicidad de drogas (98). Asimismo, se ha descrito la selección de mutantes resistentes intratramiento frente al uso de drogas a las que no presenta resistencia natural (33). Por ello, el manejo de las infecciones producidas por este microorganismo con frecuencia resulta problemático (Tabla 3).
Típicamente, S. maltophilia posee dos b-lactamasas cromosómicas que le confieren resistencia a los antibióticos b-lactámicos. Estas b-lactamasas, denominadas L1 y L2, tienen diferentes características: L1 es una MBL con capacidad de hidrolizar penicilinas, cefalosporinas y carbapenemes, pero no puede hidrolizar al aztreonam (82). L2 exhibe fundamentalmente actividad de cefalosporinasa y, a diferencia de L1, inactiva al aztreonam y a la ticarcilina. Esta enzima es inhibida por inhibidores de b-lactamasas; el ácido clavulánico es más eficiente a tal fin que la tazobactama o la sulbactama.
S. maltophilia puede presentar una acetiltransferasa AAC (6') Iz que inactiva a la amicacina, la netilmicina y la tobramicina, pero no a la gentamicina (44), o una fosfotransferasa Aph (3´) IIc que inactiva a la kanamicina y la neomicina (59).
Las drogas más activas in vitro son la combinación trimetoprima-sulfametoxazol, la minociclina y las fluoroquinolonas (94); de estas últimas, la moxifloxacina presenta valores de CIM90 menores que la ofloxacina y la ciprofloxacina (92). Muchos aislamientos poseen bombas de eflujo que confieren resistencia a todas las quinolonas (99). Cabe destacar que con las fluoroquinolonas, a pesar de ser drogas activas in vitro, pueden emerger mutantes resistentes intratratamiento por alteración de las proteínas de membrana externa, lo que hace conveniente la asociación con otros antimicrobianos, como ticarcilina/ácido clavulánico o minociclina, para mejorar su eficacia clínica (71).
A pesar que la combinación trimetoprima-sulfametoxazol resulta efectiva en más del 90 % de los aislamientos de esta especie, se ha comunicado la existencia de cepas resistentes a esta terapéutica. En estos casos, la ciprofloxacina, la levofloxacina, la ceftacidima o la ceftriaxona y la ticarcilina con clavulanato, solas o en combinación con otros antibióticos, pueden considerarse alternativas terapéuticas (30).
Si bien ni el CLSI ni el EUCAST establecen puntos de corte para la tigeciclina, distintos trabajos en los que se han empleado los puntos de corte de la FDA han demostrado que esta droga presenta buena actividad in vitro en esta especie (11, 34, 54).
Antibióticos que se deben ensayar e informar
Para la realización del antibiograma por difusión se tendrán en cuenta los lineamientos del CLSI (19). En la Tabla 6 se detallan los antimicrobianos que se recomienda ensayar por el método de difusión en agar frente a aislamientos de esta especie; todos los resultados deben informarse. El tiempo de incubación según el CLSI es de 20-24 h.
La sensibilidad a ceftacidima y ticarcilina/ácido clavulánico debe determinarse mediante ensayos por dilución.
Tabla 6. Antimicrobianos que se deben ensayar por el método de difusión en agar e informar en Stenotrophomonas maltophilia y en el complejo Burkholderia cepacia

Complejo Burkholderia cepacia
El complejo Burkholderia cepacia comprende al menos 17 especies diferentes: Burkholderia cepacia, Burkholderia multivorans, Burkholderia cenocepacia, Burkholderia stabilis, Burkholderia vietnamiensis, Burkholderia dolosa, Burkholderia ambifaria, Burkholderia anthina, Burkholderia pyrrocinia, Burkholderia ubonensis, Burkholderia latens, Burkholderia diffusa, Burkholderia arboris, Burkholderia seminalis, Burkholderia metallica, Burkholderia contaminans y Burkholderia lata. B. cepacia se reconoce en la actualidad como un patógeno oportunista de importancia, particularmente en infecciones nosocomiales en pacientes inmunocomprometidos o con fibrosis quística (70).
El tratamiento de las infecciones producidas por B. cepacia es dificultoso, ya que las especies que forman este complejo presentan usualmente altos niveles de resistencia intrínseca a una amplia variedad de antimicrobianos, entre los que se incluye la ticarcilina, las cefalosporinas, los aminoglucósidos y las polimixinas (100). Los patrones de resistencia intrínseca de las distintas especies son heterogéneos (58).
La resistencia a los aminoglucósidos se debe a la presencia de enzimas modificadoras de aminoglucósidos, conjuntamente con alteraciones en la permeabilidad de la membrana externa. La resistencia a antibióticos b-lactámicos es usualmente mediada por la presencia de b-lactamasas inducibles de clase A, cuyos genes están localizados en el cromosoma bacteriano. Estas b-lactamasas tipo Pen son específicas de cada especie del complejo B. cepacia, lo que puede constituir una herramienta útil para la identificación de la especie. Las enzimas tipo Pen hidrolizan penicilinas, cefalosporinas y aztreonam (este último, en menor medida) (70).
Las alteraciones en la permeabilidad de la membrana externa pueden contribuir a la resistencia a los b-lactámicos, mientras que la adquisición de b-lactamasas plasmídicas derivadas de TEM, o las alteraciones en las PLP, que confieren resistencia a piperacilina, resultan más infrecuentes. Fue descrita una b-lactamasa PCM-1 (enzima clase D de tipo OXA) que hidroliza con mayor eficiencia al imipenem que al meropenem (57).
Los tratamientos se basan en los resultados in vitro sumados a la apreciación de una buena respuesta clínica; en las infecciones graves la monoterapia trae aparejada la emergencia de resistencia, por lo que se sugiere la utilización de dos antimicrobianos.
A pesar de la sensibilidad in vitro observada frente a algunos antimicrobianos, la erradicación de la colonización pulmonar en pacientes con enfermedad fibroquística resulta dificultosa debido a varios factores, entre ellos la formación de biopelículas (23), la disponibilidad de oxígeno, la alteración de la farmacocinética del antimicrobiano, la falta de droga libre en el pulmón bronquiectásico, la penetración insuficiente en la mucosa bronquial anormal y viscosa, el alto inóculo, el pH bajo y la alta concentración de cationes divalentes que impiden la fagocitosis en el pulmón (28).
Antibióticos que se deben ensayar e informar
Para la realización del antibiograma por difusión se tendrán en cuenta los lineamientos del CLSI (19). En la Tabla 6 se detallan los antimicrobianos que se recomienda ensayar en esta especie por el método de difusión en agar y cuáles resultados deben ser informados.
Alcaligenes / Achromobacter
Los géneros Achromobacter y Alcaligenes pertenecen a la familia Alcaligenaceae. Las especies de mayor importancia clínica son Achromobacter xylosoxidans, Achromobacter piechaudii, Achromobacter denitrificans y Alcaligenes faecalis. A. xylosoxidans constituye un patógeno emergente y representa el 6,6 % de los BGNNF (excluidos P. aeruginosa y Acinetobacter spp.), según un estudio realizado en la Ciudad Autónoma de Buenos Aires (93). El incremento en la frecuencia de aislamiento podría estar relacionado con el uso extensivo de cefalosporinas de tercera generación y de fluoroquinolonas, que resultan inactivas frente a Achromobacter sp. (29).
Achromobacter sp. es resistente a las aminopenicilinas, con inhibidores de b-lactamasas o sin ellos, y a cefalosporinas de primera y de segunda generación, debido a la presencia de una b-lactamasa cromosómica no inducible de espectro reducido de clase D, conocida como OXA-114 (27). Esta b-lactamasa no presenta actividad hidrolítica sobre cefalosporinas de amplio espectro como ceftacidima, cefotaxima, cefoxitina, cefepima, ni sobre aztreonam. La resistencia a dichos antimicrobianos observada en esta especie podría deberse a la presencia de otras b-lactamasas, ya que la contribución de OXA-114 a este perfil de resistencia resulta secundaria. La b-lactamasa OXA-114 no presenta actividad hidrolítica sobre la oxacilina, pero presenta una débil actividad hidrolítica sobre el imipenem. Además, no es inhibida por el ácido clavulánico, la sulbactama ni la tazobactama, ni su expresión es inducida por el imipenem o la cefoxitina (27).
Por otra parte, A. xylosoxidans presenta resistencia a aminoglucósidos y fluoroquinolonas (94) (Tablas 2 y 5). La actividad de la colistina sobre este BGNNF resulta variable. En la Ciudad Autónoma de Buenos Aires, más del 90 % de los aislamientos, especialmente aquellos provenientes de materiales respiratorios, presentan resistencia a los antibióticos polipeptídicos, lo que explica que puedan desarrollar en los medios selectivos para el aislamiento del complejo Burkholderia cepacia (94).
Si bien los carbapenemes pueden resultar activos frente a esta especie (94), en los últimos años han emergido aisamientos con alto nivel de resistencia a carbapenemes debido a la presencia de carbapenemasas de tipo IMP, como IMP-1 (85) e IMP-10 (39), y VIM, como VIM-1 (76) y VIM-2 (86). En Argentina se han aislado A. xylosoxidans procedentes de materiales respiratorios de pacientes con fibrosis quística, con alto nivel de resistencia a carbapenemes y no productores de MBL.
El CLSI no ha establecido puntos de corte para el estudio de la sensibilidad antimicrobiana de Achromobacter spp. por el método de difusión. Recientemente, en Argentina se han sugerido puntos de corte para carbapenemes, trimetoprima-sulfametoxazol, tetraciclina, doxiciclina y gentamicina (1) (Tabla 7).
Tabla 7. Puntos de corte por difusión propuestos por Almuzara et al. (1) para Achromobacter spp.

Elizabethkingia meningoseptica
Los miembros de los géneros Chryseobacterium, Elizabethkingia y Myroides pertenecen a la familia Flavobacteriaceae. E. meningoseptica y C. gleum-indologenes son las especies que se asocian con mayor frecuencia a infecciones humanas (13).
Tanto la presencia de diferentes tipos de b-lactamasas como la impermeabilidad de la membrana externa determinan la resistencia a múltiples antimicrobianos, como b-lactámicos (incluidos los carbapenemes), aminoglucósidos y antibióticos polipeptídicos (75). La resistencia a las cefalosporinas de tercera generación se relaciona con la producción de una BLEE denominada CME (10), mientras que la resistencia a los carbapenemes se relaciona con dos MBL: GOB-1 y BLAB-1 (6) (Tablas 2 y 5).
Se ha propuesto utilizar vancomicina en las infecciones graves (48, 60), ya que existen algunas evidencias clínicas que apoyan el uso de vancomicina asociada a rifampicina en el tratamiento empírico de la meningitis neonatal por E. meningoseptica (25). Sin embargo, se han informado valores de CIM de vancomicina entre 8 y 128 μg/ml en 12 aislamientos de E. meningoseptica recuperados en la Argentina (C. Vay, comunicación personal). Algunos estudios in vitro mostraron una actividad superior de la minociclina asociada con rifampicina (3) para el tratamiento de infecciones graves.
En aquellos pacientes en los que la minociclina está contraindicada, la combinación trimetoprima-sulfametoxazol asociada a rifampicina podría ser una opción terapéutica aceptable, ya que también existe evidencia clínica que avala la efectividad de esta elección (46).
Con referencia a las quinolonas, la levofloxacina y la gatifloxacina resultan más activas que la ciprofloxacina y la ofloxacina (40).
Si bien el CLSI no ha establecido normas respecto del método por difusión para este microorganismo, en 1997 Chang et al. establecieron puntos de corte tentativos para la prueba de sensibilidad por difusión para piperacilina, ceftacidima y ciprofloxacina (21). Sin embargo, es nuestra opinión que el tratamiento debería estar basado en resultados de sensibilidad obtenidos por el método de dilución para cada aislamiento en particular.
Chryseobacterium gleum-indologenes
Los microorganismos pertenecientes al género Chryseobacterium resultan resistentes a las cefalosporinas, los carbapenemes y los antibióticos polipeptídicos y aminoglucósidos (Tablas 2 y 5). La resistencia a las cefalosporinas se debe a la producción de una cefalosporinasa de clase A inhibible por el ácido clavulánico, denominada CGA-1, que inactiva más eficientemente a la cefotaxima y la ceftacidima que a la cefepima (8). La resistencia a los carbapenemes se debe a la producción de MBL del tipo CGB en C. gleum (7) y del tipo IND en C. indologenes (9). La piperacilina no se ve significativamente afectada por ninguna de las enzimas mencionadas.
Estos microorganismos son frecuentemente sensibles a rifampicina, minociclina, trimetoprima-sulfametoxazol y fluoroquinolonas (Tabla 5).
También en este caso, en 1997 Chang et al. establecieron puntos de corte tentativos para la prueba de sensibilidad por difusión para piperacilina, ceftacidima y ofloxacina (21). Sin embargo, también en este caso es nuestra opinión que el tratamiento debería estar basado en resultados de sensibilidad obtenidos por el método de dilución para cada aislamiento en particular.
Myroides spp.
Presentan resistencia a todos los b-lactámicos (incluidos los carbapenemes), a los antibióticos polipeptídicos, a los aminoglucósidos y a las fluoroquinolonas. La resistencia a carbapenemes se debe a la presencia de una MBL denominada TUS-1 en Myroides odoratum y MUS-1 en Myroides odoratimimus (50) (Tablas 2 y 5).
Los antimicrobianos más activos in vitro son la minociclina, la rifampicina y la trimetoprima-sulfametoxazol, aunque puede observarse resistencia a esta última combinación.
Presentan sensibilidad variable a la eritromicina.
Shewanella algae-putrefaciens
Shewanella spp. suelen presentar sensibilidad a múltiples antimicrobianos como ampicilina, piperacilina, cefalosporinas de tercera y cuarta generación, carbapenemes, eritromicina, aminoglucósidos y fluoroquinolonas, pero resultan resistentes a otras penicilinas y cefalosporinas de primera y segunda generación. La actividad de los antibióticos polipeptídicos es variable (94).
Algunas investigaciones recientes mostraron que las CIM de ampicilina y tetraciclina en S. algae son mayores que las de S. putrefaciens. La primera especie, además, tiene una b-lactamasa cromosómica de clase D de Ambler (OXA-55) que hidroliza débilmente al imipenem (37).
Pseudomonas putida
Los aislamientos de P. putida son generalmente sensibles a los carbapenemes, las fluoroquinolonas y los aminoglucósidos; sin embargo, se ha informado la emergencia de resistencia a carbapenemes debida a la producción de MBL de tipo IMP y VIM (2, 26, 42, 52, 97). También se ha comunicado la existencia de aislamientos resistentes a fluoroquinolonas debido a mutaciones en la ADN girasa y en la topoisomerasa IV; la sobreexpresión de sistemas de eflujo puede contribuir, además, a la resistencia a fluroquinolonas y a algunos b-lactámicos (41).
ANEXO METODOLÓGICO PARA LA DETECCIÓN Y CARACTERIZACIÓN DE CARBAPENEMASAS
En la actualidad no existe estandarización sobre las técnicas más eficaces de detección y caracterización preliminar de carbapenemasas potencialmente presentes en las diferentes especies; la detección de la presencia de los genes codificantes es el método confirmatorio. Los participantes de este consenso tienen experiencia en la utilización de distintos métodos, por ello, en lugar de indicar un único método se incluye la descripción de varios, de manera de poder eventualmente ser comparados en virtud de su sensibilidad.
Para la elección de dichos métodos se ha tenido en cuenta su posible aplicación en la rutina diaria de un laboratorio clínico. Cabe mencionar que este anexo constituye un material de consulta que excede a la práctica de rutina, para ser utilizado solo en casos en que se desee caracterizar las enzimas responsables de las resistencias observadas.
1. Ensayo de detección fenotípica de MBL por difusión empleando agentes quelantes
Los ensayos de sinergia por aproximación de discos constituyen los métodos más empleados debido al bajo costo, su fácil realización, la rapidez y la elevada sensibilidad. Sin embargo, algunos autores han comunicado que no resultan absolutamente sensibles (51).
Este ensayo, modificado a partir del método inicialmente descrito por Arakawa et al. (4), consiste en ubicar sobre placas de agar Mueller Hinton previamente inoculadas (a partir de cultivos ajustados a 108 bacterias/ml) discos que contienen IMI, MER y CAZ y discos que contienen EDTA, 1 μmol o 5 μmoles, distanciados de los primeros a 1 cm o a 1,5 cm (de borde a borde), respectivamente (61). Un aumento en la zona de inhibición entre el disco que contiene el antibiótico (CAZ, MER o IMI) y el disco que contiene el agente quelante se considera un resultado positivo y, por lo tanto, se sospecha la presencia de la MBL (Figuras 2a, 2b). Pueden emplearse discos de agentes quelantes comerciales o éstos pueden ser preparados en el laboratorio (51, 62). La metodología que emplea los tres antimicrobianos (IMI, MER y CAZ) y ambas concentraciones de EDTA (ensayo de sinergia extendido, ver Figura 2c) tiene buena sensibilidad (S: 0,92) y baja especificidad (E: 0,41), por lo que es necesaria la confirmación por otro método (51), mientras que la metodología que emplea discos de EDTA de 1 μmol presenta elevada sensibilidad y especificidad en la detección de enzimas de tipo VIM e IMP en P. aeruginosa (61, 83).

Figura 2. Ensayos de detección de MBL
a) Detección de MBL usando EDTA 1 μmol en P. aeruginosa productora de VIM-2.
b) Detección de MBL usando EDTA 1 μmol en P. aeruginosa productora de IMP-13. CAZ: ceftacidima, IMI: imipenem, MER: meropenem.
c) Ensayo de sinergia extendido en P. aeruginosa portadora de IMP-7. A la izquierda, disco de EDTA con 5 μmoles; a la derecha, disco de EDTA con 1 μmol. CAZ: ceftacidima, IMP: imipenem, MER: meropenem, E: EDTA.
d) Detección de carbapenemasas por el método "Hodsuda"
e) Detección de MBL mediante EMIB (ensayo microbiológico con inhibidores de carbapenemasas y diferentes b-lactámicos). P. aeruginosa 5182, productora de MBL VIM-11a. Panel A: se observa desarrollo de la bacteria indicadora alrededor de los discos S y S/Zn, lo que altera los halos de inhibición de IMI (arriba), MER (medio) y CAZ (abajo), señalado por flechas. La ausencia de deformación del halo para los 3 sustratos alrededor de los discos S/E confirma la inhibición enzimática con EDTA. Panel B: se observa deformación de los halos de los tres b-lactámicos alrededor de los discos S, aun en presencia de AC (S/C), señalado con flechas. Este perfil de inhibición y de sustratos indica una cepa productora de MBL. Disco B (buffer), control negativo.
2. Ensayo fenotípico de detección de MBL por dilución empleando EDTA
Se determina la CIM de carbapenemes en presencia y ausencia de EDTA 0,4 mM, de acuerdo con las recomendaciones del CLSI (19). Si bien esta prueba presenta elevada sensibilidad, resulta manualmente demandante. Además, en ocasiones se obtienen resultados borderline y/o se requiere el ensayo de los dos carbapenemes.
3. Ensayo epsilométrico (ETest) para la detección de MBL
Se realiza el ensayo empleando tiras de IMI/IMI+EDTA, según indicaciones del fabricante. La complejidad de este método es baja o nula, pero resulta costoso. Aunque su sensibilidad es elevada, se ve afectada cuando los valores de CIM del IMI para ese aislamiento son bajos (CIMIMI < 4 μg/ml). No puede ser usado en cepas productoras de carbapenemasas tipo oxacilinasas, ya que se observan resultados falsos positivos (84). Esta clase de carbapenemasas se presenta con elevada frecuencia en cepas de A. baumannii.
4. Detección de carbapenemasas por el método de Hodge modificado: "Hodsuda"
Este método permite la detección de la presencia de enzimas con actividad de carbapenemasas, pero no discrimina entre serino-carbapenemasas y MBL. Su realización es de baja complejidad y presenta moderada sensibilidad.
En el centro de una placa de agar Mueller Hinton inoculada a partir de un cultivo ajustado a 108 bacterias/ ml de un microorganismo indicador (E. coli ATCC 25922), se coloca un disco con el antibiótico (su elección se realiza de acuerdo con el perfil de hidrólisis de la enzima que se quiera evaluar). Luego se siembra una ansada densa del microorganismo en estudio dentro de la zona de inhibición esperada para la droga ensayada. Se deja reposar a temperatura ambiente durante 15 minutos y se incuba toda la noche a 35 ˚C. Una deformación del halo de inhibición (efecto D o achatamiento o crecimiento del microorganismo indicador por dentro del halo de inhibición) se interpreta como un ensayo positivo (Figura 2d).
5. Detección de carbapenemasas mediante el ensayo microbiológico con inhibidores de carbapenemasas y diferentes b-lactámicos (EMIB)
Este ensayo emplea diferentes antibióticos b-lactámicos (IMI, MER y CAZ) e inhibidores de serino-carbapenemasas y de MBL (ácido clavulánico y EDTA, respectivamente). Este método tiene elevada sensibilidad, pero su realización presenta moderada complejidad dado que requiere la obtención de extractos enzimáticos.
En el centro de una placa de agar Mueller Hinton (previamente inoculada con E. coli ATCC 25922) se coloca el disco que contiene el antibiótico. Luego de 10 minutos (para permitir la difusión del antibiótico), se colocan a 0,8 cm de distancia (de centro a centro) discos de papel de filtro estériles impregnados con: i) 20 μl de extracto enzimático (S); ii) 20 μl de extracto enzimático más sulfato de zinc (concentración final 0,1 mM) (S/Zn); iii) 20 μl de extracto enzimático más EDTA (concentración final 20 mM) (S/E); iv) 20 μl de extracto enzimático más ácido clavulánico (concentración final 300 μM) (S/C); y v) 20 μl de buffer (B), como control negativo. En el trabajo de Marchiaro et al. se detalla la preparación de los extractos enzimáticos y de los discos respectivos (58). La interpretación que deriva del análisis de este ensayo se resume a continuación y se ilustra en la Figura 2e.
Cepas no productoras de carbapenemasa ni ceftacidimasas: no se observa deformación del halo de inhibición de los carbapenemes ni de CAZ.
Cepas productoras de carbapenemasa: se observa desarrollo de E. coli alrededor de los discos S y S/Zn, con alteración del halo de inhibición de los carbapenemes. Con estas cepas pueden presentarse los siguientes casos: a) si se observa inhibición del desarrollo alrededor del disco S/E, dicha actividad enzimática corresponde a una MBL; b) si se observa inhibición del desarrollo alrededor del disco S/C, dicha actividad corresponde a una serino-carbapenemasa clase A; c) si no se observa inhibición del desarrollo alrededor del disco S/E ni del disco S/C, se sospecha que existe una serino-carbapenemasa clase D (tipo OXA) o alta expresión de AmpC.
1. Almuzara M, Limansky A, Ballerini V, Galanternik L, Famiglietti A, Vay C. In vitro susceptibility of Achromobacter spp. isolates: comparison of disk diffusion, Etest and agar dilution methods. Int J Antimicrob Agents 2009; 35: 68-71. [ Links ]
2. Almuzara M, Radice M, de Garate N, Kossman A, Cuirolo A, Santella G, Famiglietti A, Gutkind G, Vay C. VIM-2-producing Pseudomonas putida, Buenos Aires. Emerg Infect Dis 2007; 13: 668-9. [ Links ]
3. Appelbaum PC, Tamim J, Stavitz J, Aber R, Pankuch G. Sensitivity of 341 non-fermentative gram- negative bacteria to seven ß-lactam antibiotics. Eur J Clin Microbiol 1982; 1: 159-65. [ Links ]
4. Arakawa Y, Shibata N, Shibayama K, Kurokawa H, Yagi T, Fujiwara H, Goto M. Convenient test for screening metallo-ß-lactamase-producing gram-negative bacteria by using thiol compounds. J Clin Microbiol 2000; 38: 40-3. [ Links ]
5. Arduino S, Catalano M, Orman B, Roy P, Centron D. Molecular epidemiology of orf513-bearing class 1 integrons in multiresistant clinical isolates from Argentinean hospitals. Antimicrob Agents Chemother 2003; 47: 3945-9. [ Links ]
6. Bellais S, Aubert D, Naas T, Nordmann P. Molecular and biochemical heterogeneity of class B carbapenem-hydrolyzing ß-lactamases in Chryseobacterium meningosepticum. Antimicrob Agents Chemother 2000; 44: 1878-86. [ Links ]
7. Bellais S, Naas T, Nordmann P. Genetic and biochemical characterization of CGB-1, an Ambler class B carbapenem-hydrolyzing ß-lactamase from Chryseobacterium gleum. Antimicrob Agents Chemother 2002; 46: 2791-6. [ Links ]
8. Bellais S, Naas T, Nordmann P. Molecular and biochemical characterization of Ambler class A extended-spectrum ß-lactamase CGA-1 from Chryseobacterium gleum. Antimicrob Agents Chemother 2002; 46: 966-70. [ Links ]
9. Bellais S, Poirel L, Leotard S, Naas T, Nordmann P. Genetic diversity of carbapenem-hydrolyzing metallo-ß-lactamases from Chryseobacterium (Flavobacterium) indologenes. Antimicrob Agents Chemother 2000; 44: 3028-34. [ Links ]
10. Bellais S, Poirel L, Naas T, Girlich D, Nordmann P. Genetic-biochemical analysis and distribution of the Ambler class Aß-lactamase CME-2, responsible for extended-spectrum cephalosporin resistance in Chryseobacterium (Flavobacterium) meningosepticum. Antimicrob Agents Chemother 2000; 44: 1-9. [ Links ]
11. Betriu C, Rodriguez-Avial I, Sanchez B, Gómez M, Picazo J. Comparative in vitro activities of tigecycline (GAR-936) and other antimicrobial agents against Stenotrophomonas maltophilia. J Antimicrob Chemother 2002; 50: 758-9. [ Links ]
12. Biendo M, Laurans G, Lefebvre J, Daoudi F, Eb F. Epidemiological study of an Acinetobacter baumannii outbreak by using a combination of antibiotyping and ribotyping. J Clin Microbiol 1999; 37: 2170-5. [ Links ]
13. Bloch KC, Nadarajah R, Jacobs R. Chryseobacterium meningosepticum: an emerging pathogen among immunocompromised adults. Report of 6 cases and literature review. Medicine (Baltimore) 1997; 76: 30-41. [ Links ]
14. Bou G, Martinez-Beltran J. Cloning, nucleotide sequencing, and analysis of the gene encoding an AmpC ß-lactamase in Acinetobacter baumannii. Antimicrob Agents Chemother 2000; 44: 428-32. [ Links ]
15. Brown S, Amyes S. OXA (ß)-lactamases in Acinetobacter: the story so far. J Antimicrob Chemother 2006; 57: 1-3. [ Links ]
16. Brown SD, Traczewski M. Comparative in vitro antimicrobial activity of a new carbapenem, doripenem: tentative disk diffusion criteria and quality control. J Antimicrob Chemother 2005; 55: 944-9. [ Links ]
17. Bucca R, Menéndez V, Mastroberti M, Centron D, Jorda Vargas L, Kovensky J. Emergencia de metalo-ß-lactamasas en Pseudomonas spp. provenientes de infecciones en pacientes quemados. Congreso SADEBAC 2006, Resumen 16560, Ciudad Autómona de Buenos Aires, Argentina. [ Links ]
18. Casellas JM, Bantar C, Duret F. Comparative in vitro activity of tigecycline against aerobic and facultative isolates recovered from hospitalized patients: an Argentinean multicenter study. J Chemother 2007; 19: 482-7. [ Links ]
19. Clinical and Laboratory Standard Institute. Performance Standards for Antimicrobial Susceptibility Testing; 20th Informational Supplement, 2010; M100-S20. Wayne, PA, EE.UU. [ Links ]
20. Cuirolo A, Almuzara M, Radice M, Gutkind G. Molecular characterization of IMP-13 producing Pseudomonas aeruginosa. 46th Interscience Conference on Antimicrobial Agents and Chemotherapy, 2006, Resumen C2-415, San Francisco, EE. UU. [ Links ]
21. Chang JC, Hsueh P, Wu J, Ho S, Hsieh W, Luh K. Antimicrobial susceptibility of flavobacteria as determined by agar dilution and disk diffusion methods. Antimicrob Agents Chemother 1997; 41: 1301-6. [ Links ]
22. Choi A, Slamti L, Avci F, Pier G, Maira-Litran T. The pgaABCD locus of Acinetobacter baumannii encodes the production of poly-beta-1-6-N-acetylglucosamine, which is critical for biofilm formation. J Bacteriol 2009; 191: 5953-63. [ Links ]
23. Dales L, Ferris W, Vandemheen K, Aaron S. Combination antibiotic susceptibility of biofilm-grown Burkholderia cepacia and Pseudomonas aeruginosa isolated from patients with pulmonary exacerbations of cystic fibrosis. Eur J Clin Microbiol Infect Dis 2009; 28: 1275-9. [ Links ]
24. Denton M, Kerr K. Microbiological and clinical aspects of infection associated with Stenotrophomonas maltophilia. Clin Microbiol Rev 1998; 11: 57-80. [ Links ]
25. Di Pentima MC, Mason E, Kaplan S. In vitro antibiotic synergy against Flavobacterium meningosepticum: implications for therapeutic options. Clin Infect Dis 1998; 26: 1169-76. [ Links ]
26. Docquier J, Riccio M, Mugnaioli C, Luzzaro F, Endimiani A, Toniolo A, Amicosante G, Rossolini GM. IMP-12, a new plasmid-encoded metallo-ß-lactamase from a Pseudomonas putida clinical isolate. Antimicrob Agents Chemother 2003; 47: 1522-8. [ Links ]
27. Doi Y, Poirel L, Paterson D, Nordmann P. Characterization of a naturally occurring class D ß-lactamase from Achromobacter xylosoxidans. Antimicrob Agents Chemother 2008; 52: 1952-6. [ Links ]
28. Donaldson S, Boucher R. Update on pathogenesis of cystic fibrosis lung disease. Curr Opin Pulm Med 2003; 9: 486-91. [ Links ]
29. Dunne W, Maisch S. Epidemiological investigation of infections due to Alcaligenes species in children and patients with cystic fibrosis: use of repetitive-element-sequence polymerase chain reaction. Clin Infect Dis 1995; 20: 836-41. [ Links ]
30. Falagas M, Valkimadi P, Huang Y, Matthaiou D, Hsueh P. Therapeutic options for Stenotrophomonas maltophilia infections beyond co-trimoxazole: a systematic review. J Antimicrob Chemother 2008; 62: 889-94. [ Links ]
31. Fernández-Cuenca F, Martínez-Martínez L, Conejo M, Ayala J, Perea E, Pascual A. Relationship between ß-lactamase production, outer membrane protein and penicillin-binding protein profiles on the activity of carbapenems against clinical isolates of Acinetobacter baumannii. J Antimicrob Chemother 2003; 51: 565-74. [ Links ]
32. García-Garmendia JL, Ortiz-Leyba C, Garnacho-Montero J, Jiménez-Jiménez F, Pérez-Paredes C, Barrero-Almodovar A, Gili-Miner M. Risk factors for Acinetobacter baumannii nosocomial bacteremia in critically ill patients: a cohort study. Clin Infect Dis 2001; 33: 939-46. [ Links ]
33. Garrison M, Anderson D, Campbell D, Carroll K, Malone C, Anderson J, Hollis R, Pfaller M. Stenotrophomonas maltophilia: emergence of multidrug-resistant strains during therapy and in an in vitro pharmacodynamic chamber model. Antimicrob Agents Chemother 1996; 40: 2859-64. [ Links ]
34. Gómez-Garces J, Aracil B, Gil Y, Burillo A. Susceptibility of 228 non-fermenting gram-negative rods to tigecycline and six other antimicrobial drugs. J Chemother 2009; 21: 267-71. [ Links ]
35. Hamouda A, Amyes S. Novel gyrA and parC point mutations in two strains of Acinetobacter baumannii resistant to ciprofloxacin. J Antimicrob Chemother 2004; 54: 695-6. [ Links ]
36. Heritier C, Poirel L, Nordmann P. Cephalosporinase over-expression resulting from insertion of ISAba1 in Acinetobacter baumannii. Clin Microbiol Infect 2006; 12: 123-30. [ Links ]
37. Heritier C, Poirel L, Nordmann P. Genetic and biochemical characterization of a chromosome-encoded carbapenem-hydrolyzing ambler class D ß-lactamase from Shewanella algae. Antimicrob Agents Chemother 2004; 48: 1670-5. [ Links ]
38. Higgins P, Wisplinghoff H, Stefanik D, Seifert H. Selection of topoisomerase mutations and overexpression of adeB mRNA transcripts during an outbreak of Acinetobacter baumannii. J Antimicrob Chemother 2004; 54: 821-3. [ Links ]
39. Iyobe S, Kusadokoro H, Takahashi A, Yomoda S, Okubo T, Nakamura A, O'Hara K. Detection of a variant metallo-ß-lactamase, IMP-10, from two unrelated strains of Pseudomonas aeruginosa and an Alcaligenes xylosoxidans strain. Antimicrob Agents Chemother 2002; 46: 2014-6. [ Links ]
40. Kirby J, Sader H, Walsh T, Jones R. Antimicrobial susceptibility and epidemiology of a worldwide collection of Chryseobacterium spp.: report from the SENTRY Antimicrobial Surveillance Program (1997-2001). J Clin Microbiol 2004; 42: 445-8. [ Links ]
41. Kumita W, Saito R, Sato K, Ode T, Moriya K, Koike K, Chida T, Okamura N. Molecular characterizations of carbapenem and ciprofloxacin resistance in clinical isolates of Pseudomonas putida. J Infect Chemother 2009; 15: 6-12. [ Links ]
42. Lee K, Lim J, Yum J, Yong D, Chong Y, Kim J, Livermore D. Bla(VIM-2) cassette-containing novel integrons in metallo-ß-lactamase-producing Pseudomonas aeruginosa and Pseudomonas putida isolates disseminated in a Korean hospital. Antimicrob Agents Chemother 2002; 46: 1053-8. [ Links ]
43. Li J, Rayner C, Nation R, Owen R, Spelman D, Tan K, Liolios L. Heteroresistance to colistin in multidrug-resistant Acinetobacter baumannii. Antimicrob Agents Chemother 2006; 50: 2946-50. [ Links ]
44. Li X, Zhang L, McKay G, Poole K. Role of the acetyltransferase AAC(6')-Iz modifying enzyme in aminoglycoside resistance in Stenotrophomonas maltophilia. J Antimicrob Chemother 2003; 51: 803-11. [ Links ]
45. Limansky A, Mussi M, Viale A. Loss of a 29-kilodalton outer membrane protein in Acinetobacter baumannii is associated with imipenem resistance. J Clin Microbiol 2002; 40: 4776-8. [ Links ]
46. Linder N, Korman S, Eyal F, Michel J. Trimethoprim sulphamethoxazole in neonatal Flavobacterium meningosepticum infection. Arch Dis Child 1984; 59: 582-4. [ Links ]
47. Lister P, Wolter D, Hanson N. Antibacterial-resistant Pseudomonas aeruginosa: clinical impact and complex regulation of chromosomally encoded resistance mechanisms. Clin Microbiol Rev 2009; 22: 582-610. [ Links ]
48. Lu C, Huang C, Tsai N, Chang C, Chuang C, Lee P, Lei C, Wang H, Wang K, Chang W. An adult case of Chryseobacterium meningosepticum meningitis. Jpn J Infect Dis 2004; 57: 214-5. [ Links ]
49. Magnet S, Courvalin P, Lambert T. Resistance-nodulation-cell division-type efflux pump involved in aminoglycoside resistance in Acinetobacter baumannii strain BM4454. Antimicrob Agents Chemother 2001; 45: 3375-80. [ Links ]
50. Mammeri H, Bellais S, Nordmann P. Chromosome-encoded b-lactamases TUS-1 and MUS-1 from Myroides odoratus and Myroides odoratimimus (formerly Flavobacterium odoratum), new members of the lineage of molecular subclass B1 metalloenzymes. Antimicrob Agents Chemother 2002; 46: 3561-7. [ Links ]
51. Marchiaro P, Mussi M, Ballerini V, Pasterán F, Viale A, Vila A, Limansky A. Sensitive EDTA-based microbiological assays for detection of metallo-ß-lactamases in nonfermentative gram-negative bacteria. J Clin Microbiol 2005; 43: 5648-52. [ Links ]
52. Marchiaro P, Viale A, Ballerini V, Rossignol G, Vila A, Limansky A. First report of a Tn402-like class 1 integron carrying blaVIM-2 in Pseudomonas putida from Argentina. J Infect Dev Ctries 2010; 4: 412-6. [ Links ]
53. Micozzi A, Venditti M, Monaco M, Friedrich A, Taglietti F, Santilli S, Martino P. Bacteremia due to Stenotrophomonas maltophilia in patients with hematologic malignancies. Clin Infect Dis 2000; 31: 705-11. [ Links ]
54. Milatovic D, Schmitz F, Verhoef J, Fluit A. Activities of the glycylcycine tigecycline (GAR-936) against 1,924 recent European clinical bacterial isolates. Antimicrob Agents Chemother 2003; 47: 400-4. [ Links ]
55. Mussi M, Limansky A, Viale A. Acquisition of resistance to carbapenems in multidrug-resistant clinical strains of Acinetobacter baumannii: natural insertional inactivation of a gene encoding a member of a novel family of ß-barrel outer membrane proteins. Antimicrob Agents Chemother 2005; 49: 1432-40. [ Links ]
56. Nemec A, Dolzani L, Brisse S, van den Broek P, Dijkshoorn L. Diversity of aminoglycoside-resistance genes and their association with class 1 integrons among strains of pan-European Acinetobacter baumannii clones. J Med Microbiol 2004; 53: 1233-40. [ Links ]
57. Niumsup P, Wuthiekanun V. Cloning of the class D ß-lactamase gene from Burkholderia pseudomallei and studies on its expression in ceftazidime-susceptible and -resistant strains. J Antimicrob Chemother 2002; 50: 445-55. [ Links ]
58. Nzula S, Vandamme P, Govan J. Influence of taxonomic status on the in vitro antimicrobial susceptibility of the Burkholderia cepacia complex. J Antimicrob Chemother 2002; 50: 265-9. [ Links ]
59. Okazaki A, Avison M. Aph(3')-IIc, an aminoglycoside resistance determinant from Stenotrophomonas maltophilia. Antimicrob Agents Chemother 2007; 51: 359-60. [ Links ]
60. Ozkalay N, Anil M, Agus N, Helvaci M, Sirti S. Community-acquired meningitis and sepsis caused by Chryseobacterium meningosepticum in a patient diagnosed with thalassemia major. J Clin Microbiol 2006; 44: 3037-9. [ Links ]
61. Pagniez G, Radice M, Cuirolo A, Rodríguez O, Rodríguez H, Vay C, Famiglietti A, Gutkind G. Prevalence of metallo-ß-lactamase in carbapenem resistant Pseudomonas aeruginosa at a University Hospital of Buenos Aires City. Rev Argent Microbiol 2006; 38: 33-7. [ Links ]
62. Pagniez G, Radice M, Amoroso A, Famiglietti A, Gutkind G. Class I integron containing a new variant of VIM-2 metallo-ß-lactamase in Pseudomonas aeruginosa. 44th Interscience Conference on Antimicrobial Agents and Chemotherapy, 2004, Resumen C1-293, p. 65, Washington, EE.UU. [ Links ]
63. Pasterán F, Faccone D, Petroni A, Rapoport M, Galas M, Vázquez M, Procopio A. Novel variant [bla(VIM-11)] of the metallo-ß-lactamase bla (VIM) family in a GES-1 extended-spectrum-ß-lactamase-producing Pseudomonas aeruginosa clinical isolate in Argentina. Antimicrob Agents Chemother 2005; 49: 474-5. [ Links ]
64. Pasterán F, Rapoport M, Faccone D, Gómez S, Galas M, Whonet-Argentina, Corso A. Spread of KPC-producing gram-negative bacilli in multiples hospitals: changing the epidemiology of Argentina. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy, 2009, Resumen C1-1772, p. 82, San Francisco, EE.UU. [ Links ]
65. Pasterán F, Rapoport M, Petroni A, Faccone D, Corso A, Galas M, Vázquez M, Procopio A, Tokumoto M, Cagnoni M. Emergence of PER-2 and VEB-1a in Acinetobacter baumannii strains in the Americas. Antimicrob Agents Chemother 2006; 50: 3222-4. [ Links ]
66. Peleg A, Adams J, Paterson D. Tigecycline efflux as a mechanism for nonsusceptibility in Acinetobacter baumannii. Antimicrob Agents Chemother 2007; 51: 2065-9. [ Links ]
67. Peleg A, Seifert H, Paterson D. Acinetobacter baumannii: emergence of a successful pathogen. Clin Microbiol Rev 2008; 21: 538-82. [ Links ]
68. Pérez F, Hujer A, Hujer M, Decker B, Rather P, Bonomo R. Global challenge of multidrug-resistant Acinetobacter baumannii. Antimicrob Agents Chemother 2007; 51: 3471-84. [ Links ]
69. Poirel L, Nordmann P. Carbapenem resistance in Acinetobacter baumannii: mechanisms and epidemiology. Clin Microbiol Infect 2006; 12: 826-36. [ Links ]
70. Poirel L, Rodríguez-Martínez J, Plesiat P, Nordmann P. Naturally occurring Class A ß-lactamases from the Burkholderia cepacia complex. Antimicrob Agents Chemother 2009; 53: 876-82. [ Links ]
71. Poole, K. Outer membranes and efflux: the path to multidrug resistance in gram-negative bacteria. Curr Pharm Biotechnol 2002; 3: 77-98. [ Links ]
72. Predari S, Kaufman S, Gutiérrez M, De Paulis A, Guelfand L, Centron D. In-vitro activity of 16 antibiotics and sulbactam against Acinetobacter calcoaceticus phenotype A1. J Chemother 1991; 4: 29-31. [ Links ]
73. Queenan A, Bush K. Carbapenemases: the versatile ß-lactamases. Clin Microbiol Rev 2007; 20: 440-58. [ Links ]
74. Radice M, Stortz M, Rodriguez C, Vay C, Famiglietti A, Gutkind G. Caracterización de BLEE en Pseudomonas aeruginosa aisladas en un hospital de Buenos Aires. VII Congreso Argentino de la Sociedad Argentina de Infectología, 2007, Resumen 17601, p. 20, Mar del Plata, Argentina. [ Links ]
75. Raimondi A, Moosdeen F, Williams J. Antibiotic resistance pattern of Flavobacterium meningosepticum. Eur J Clin Microbiol 1986; 5: 461-3. [ Links ]
76. Riccio M, Pallecchi L, Fontana R, Rossolini GM. In70 of plasmid pAX22, a bla(VIM-1)-containing integron carrying a new aminoglycoside phosphotransferase gene cassette. Antimicrob Agents Chemother 2001; 45: 1249-53. [ Links ]
77. Robledo I, Aquino E, Sante I, Santana J, Otero D, Leon C, Vázquez. Detection of KPC in Acinetobacter spp. in Puerto Rico. Antimicrob Agents Chemother 2009; 54: 1354-7. [ Links ]
78. Rodríguez-Martínez J, Poirel L, Nordmann P. Extended-spectrum cephalosporinases in Pseudomonas aeruginosa. Antimicrob Agents Chemother 2009; 53: 1766-71. [ Links ]
79. Ruggiero M, Di Conza J, Famiglietti A, Vay C, Radice M, Gutkind G. Genetic environment characterization of blaCTX-M-2 in Pseudomonas aeruginosa in Argentina. 49th Interscience Conference on Antimicrobial Agents and Chemotherapy, 2009, Resumen C2-634, p. 100, San Francisco, EE. UU. [ Links ]
80. Ruzin A, Keeney D, Bradford P. AdeABC multidrug efflux pump is associated with decreased susceptibility to tigecycline in Acinetobacter calcoaceticus-Acinetobacter baumannii complex. J Antimicrob Chemother 2007; 59: 1001-4. [ Links ]
81. Sacha P, Wieczorek P, Hauschild T, Zorawski M, Olszanska D, Tryniszewska E. Metallo-ß-lactamases of Pseudomonas aeruginosa - a novel mechanism resistance to ß-lactam antibiotics. Folia Histochem Cytobiol 2008; 46: 137-42. [ Links ]
82. Saino Y, Kobayashi F, Inoue M, Mitsuhashi S. Purification and properties of inducible penicillin ß-lactamase isolated from Pseudomonas maltophilia. Antimicrob Agents Chemother 1982; 22: 564-70. [ Links ]
83. Santella G, Cuirolo A, Almuzara M, Palombarani S, Sly G, Radice M, Gutkind G. Full resistance and decreased susceptibility to carbapenems in IMP-13-producing Pseudomonas aeruginosa isolates from an outbreak. Antimicrob Agents Chemother 2010; 54: 1381-2. [ Links ]
84. Segal H, Elisha B. Use of Etest MBL strips for the detection of carbapenemases in Acinetobacter baumannii. J Antimicrob Chemother 2005; 56: 598. [ Links ]
85. Shibata N, Doi Y, Yamane K, Yagi T, Kurokawa H, Shibayama K, Kato H, Kai K, Arakawa Y. PCR typing of genetic determinants for metallo-ß-lactamases and integrases carried by gram-negative bacteria isolated in Japan, with focus on the class 3 integron. J Clin Microbiol 2003; 41: 5407-13. [ Links ]
86. Shin K, Han K, Lee J, Hong S, Son B, Youn S, Kim J, Shin H. Imipenem-resistant Achromobacter xylosoxidans carrying blaVIM-2-containing class 1 integron. Diagn Microbiol Infect Dis 2005; 53: 215-20. [ Links ]
87. Siroy A, Molle V, Lemaitre-Guillier C, Vallenet D, Pestel-Caron M, Cozzone A, Jouenne T, De E. Channel formation by CarO, the carbapenem resistance-associated outer membrane protein of Acinetobacter baumannii. Antimicrob Agents Chemother 2005; 49: 4876-83. [ Links ]
88. Strateva T, Yordanov D. Pseudomonas aeruginosa - a phenomenon of bacterial resistance. J Med Microbiol 2009; 58: 1133-48. [ Links ]
89. Touati A, Brasme L, Benallaoua S, Gharout A, Madoux J, De Champs C. First report of qnrB-producing Enterobacter cloacae and qnrA-producing Acinetobacter baumannii recovered from Algerian hospitals. Diagn Microbiol Infect Dis 2008; 60: 287-90. [ Links ]
90. Turton J, Woodford N, Glover J, Yarde S, Kaufmann M, Pitt T. Identification of Acinetobacter baumannii by detection of the blaOXA-51-like carbapenemase gene intrinsic to this species. J Clin Microbiol 2006; 44: 2974-6. [ Links ]
91. Urban C, Go E, Mariano N, Rahal J. Interaction of sulbactam, clavulanic acid and tazobactam with penicillin-binding proteins of imipenem-resistant and susceptible Acinetobacter baumannii. FEMS Microb Lett 1995; 125: 193-8. [ Links ]
92. Valdezate S, Vindel A, Baquero F, Canton R. Comparative in vitro activity of quinolones against Stenotrophomonas maltophilia. Eur J Clin Microbiol Infect Dis 1999; 18: 908-11. [ Links ]
93. Vay C. Ecología y emergencia de bacilos gram negativos no fermentadores en patología clínica en el área metropolitana de Buenos Aires. Tesis de Doctorado de la Universidad de Buenos Aires 2004. Universidad de Buenos Aires. [ Links ]
94. Vay C, Almuzara M, Rodríguez C, Pugliese M, Lorenzo Barba F, Mattera J, Famiglietti A. In vitro activity of different antimicrobial agents on gram-negative nonfermentative bacilli, excluding Pseudomonas aeruginosa and Acinetobacter spp. Rev Argent Microbiol 2005; 37: 34-45. [ Links ]
95. Vila J, Marti S, Sánchez-Céspedes J. Porins, efflux pumps and multidrug resistance in Acinetobacter baumannii. J Antimicrob Chemother 2007; 59: 1210-5. [ Links ]
96. Walsh T, Toleman M, Poirel L, Nordmann P. Metallo-ß-lactamases: the quiet before the storm? Clin Microbiol Rev 2005; 18: 306-25. [ Links ]
97. Yomoda S, Okubo T, Takahashi A, Murakami M, Iyobe S. Presence of Pseudomonas putida strains harboring plasmids bearing the metallo-ß-lactamase gene bla(IMP) in a hospital in Japan. J Clin Microbiol 2003; 41: 4246-51. [ Links ]
98. Zhang L, Li X, Poole K. Multiple antibiotic resistance in Stenotrophomonas maltophilia: involvement of a multidrug efflux system. Antimicrob Agents Chemother 2000; 44: 287-93. [ Links ]
99. Zhang L, Li X, Poole K. SmeDEF multidrug efflux pump contributes to intrinsic multidrug resistance in Stenotrophomonas maltophilia. Antimicrob Agents Chemother 2001; 45: 3497-503. [ Links ]
100. Zhou J, Chen Y, Tabibi S, Alba L, Garber E, Saiman L. Antimicrobial susceptibility and synergy studies of Burkholderia cepacia complex isolated from patients with cystic fibrosis. Antimicrob Agents Chemother 2007; 51: 1085-8. [ Links ]
Recibido: 04/01/11
Aceptado: 03/05/11