Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.43 no.4 Ciudad Autónoma de Buenos Aires oct./dic. 2011
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Efecto de la temperatura sobre la viabilidad de larvas de Trichinella spiralis
Viviana R. Randazzo1, Luciano F. la Sala2, Sixto R. Costamagna1*
1 Cátedra de Parasitología Clínica, Universidad Nacional del Sur. San Juan 670, (8000) Bahía Blanca, Argentina;
2 Centro de Estudios Parasitológicos y de Vectores (CONICET-UNLP), Calle 2 Nro. 584, (1900) La Plata, Buenos Aires, Argentina.
*Correspondencia. E-mail: rcosta@uns.edu.ar
RESUMEN
El objetivo de este estudio fue determinar el efecto de diferentes temperaturas sobre la viabilidad de larvas libres y enquistadas de Trichinella spiralis aisladas en el sudoeste de la provincia de Buenos Aires, Argentina. Se trataron larvas libres y enquistadas a diferentes temperaturas (-30 °C, -20 °C, 4 °C, 20 °C, calentamiento gradual entre 0-100 °C). Se determinó el tiempo necesario para matar el 100 % de las larvas. Durante los primeros días, la mortalidad larvaria en todos los tratamientos con frío aumentó signifcativamente en función del tiempo. En todos los casos, las larvas libres sobrevivieron menor cantidad de días que las enquistadas. A -30 °C, -20 °C y 20 °C no se observaron diferencias signifcativas entre las curvas de mortalidad de cada estadio larvario, pero a 4 °C la mortalidad fue menos intensa entre las larvas enquistadas. El calentamiento disminuyó la viabilidad, sin observarse diferencias entre estadios larvarios. La totalidad de las larvas libres y enquistadas había muerto a los 61 y 95 días (-30 °C), a los 160 y 180 días (-20 °C), a los 280 y 330 días (4° C), y a los 460 y 590 días (20 °C), respectivamente. Fue necesaria una cocción durante 15 minutos a 90 °C para matar al 100 % de las larvas libres y a 100 °C para lograr igual mortalidad de las enquistadas. Nuestros resultados indican que la temperatura y los tiempos tradicionalmente utilizados para tratar productos cárnicos con potencial de transmisión de T. spiralis no serían los más efectivos para lograr la inactivación de la totalidad de larvas vivas de este parásito.
Palabras clave: Viabilidad; Trichinella spiralis; Temperatura
ABSTRACT
Effect of temperature on the viability of Trichinella spiralis larvae. The aim of this work was to study the effect of temperature on the viability of free and encysted larvae of Trichinella spiralis from southwest Buenos Aires province, Argentina. Larvae were treated at variable temperatures (-30 °C, -20 °C, 4 °C, 20 °C, gradual heating between 0-100 °C). The time necessary to kill 100 % of larvae was calculated. During the frst days of freezing, larval mortality signifcantly increased as a function of time. Regardless of temperature, encysted larvae survived longer than the free ones. At -30 °C, -20 °C, and 20 °C there were no signifcant differences between the survival curves for each larval stage. At 4 °C, mortality was less severe for encysted larvae. All free and encysted larvae died at 61 days and 95 days (-30 °C), 160 days and 180 days (-20 °C), 280 days and 330 days (4 °C) and 460 days and 590 days (20 °C), respectively. Cooking at 90 °C and 100 °C during 15 minutes killed 100 % of free and encysted larvae, respectively. Our results suggest that temperatures and exposure times traditionally used to treat meat products with a potential to transmit T. spiralis are not entirely effcient.
Key words: Viability; Trichinella spiralis; Temperature
INTRODUCCIÓN
La trichinellosis es una zoonosis parasitaria producida por larvas de nematodes del género Trichinella (20). La infección se produce por el consumo de carne de cerdo y de especies silvestres cruda o mal cocida, que contiene larvas viables del parásito (22).
En la Argentina, la enfermedad es producida por T. spiralis (14). El género Trichinella resiste condiciones ambientales rigurosas (23), lo que actualmente plantea controversias al momento de sugerir la temperatura y el tiempo necesarios para producir la muerte del estadio larvario de este parásito en los alimentos (12).
A pesar del establecimiento de programas de control, los brotes de trichinellosis humana son constantes en diferentes regiones del mundo (3, 4, 21, 23) y, particularmente, en la Argentina (5, 6, 10, 26).
En nuestro país, se informaron más de 5000 casos clínicos de trichinellosis en el período 1990-1999, de los cuales más del 90 % ocurrieron en las provincias de Buenos Aires, Córdoba y Santa Fe (5). Por otro lado, hasta el año 2006 no se habían registrado casos en las provincias de Mendoza, San Juan, Chaco, Tierra del Fuego, Formosa y Salta (9). Cabe destacar que para abril de 2011 fueron notifcados casos sospechosos en las provincias de Tierra del Fuego, Buenos Aires, Santa Fe y Entre Ríos, y hubo casos confrmados en las provincias de Mendoza, Córdoba y Chaco y en la Ciudad Autónoma de Buenos Aires (17). Estos datos muestran que la distribución geográfca de esta enfermedad se ha expandido a provincias en las que antes se consideraba ausente, con un aumento importante del número total de casos en el período 2009-2011 en provincias donde la enfermedad es endémica (17).
En la Argentina existen unos 47 000 criaderos de cerdos; el 94 % de ellos son emprendimientos familiares o de subsistencia, con control sanitario escaso o nulo (9). En estos establecimientos los animales son generalmente alimentados con desperdicios, lo que favorece la presencia de roedores y otros animales silvestres con un papel fundamental en la transmisión de esta zoonosis (23). En estos sistemas de crianza, la faena casera es habitual y los productos son frecuentemente comercializados y consumidos sin control sanitario previo, lo que aumenta signifcativamente el riesgo de infección (6).
Los productos cárnicos que no son analizados por un método aceptable de diagnóstico para T. spiralis requieren, antes de su distribución para el consumo humano, de un tratamiento preventivo para inactivar de forma efcaz aquellas larvas que pudieran estar presentes en el producto (19, 27). Entre los procedimientos propuestos por la Comisión Internacional de Trichinellosis se encuentran la cocción, el congelamiento y la irradiación, de modo que resulta fundamental establecer la temperatura y el tiempo de tratamiento requeridos para la destrucción de las larvas (12, 19). A pesar de dichas recomendaciones, en la Argentina se ha observado en los últimos años un aumento del número de casos de trichinellosis humana y de su distribución geográfca (17).
Con estos antecedentes, el objetivo del presente trabajo fue determinar las temperaturas y los tiempos de tratamiento necesarios para lograr la pérdida de viabilidad de larvas libres y enquistadas de T. spiralis, aisladas del sudoeste de la provincia de Buenos Aires en Argentina.
MATERIALES Y MÉTODOS
Condiciones experimentales
Se utilizó la cepa BBSC 01 de T. spiralis tipifcada por PCR en el Centro Internacional de Referencia en Roma, Italia, y en la Cátedra de Parasitología Clínica de la Universidad Nacional del Sur (UNS).
Como modelo animal se utilizaron ratones BALBc infectados con el parásito, obtenidos del Bioterio del Departamento de Biología, Bioquímica y Farmacia (UNS) y controlados sanitariamente.
Cada ratón (n = 20) fue infectado con 2500 larvas vivas de T. spiralis cuantifcadas utilizando un microscopio óptico. En un ensayo previo, los autores determinaron que dicha carga parasitaria produce infecciones con intensidades de 250 ± 50 larvas enquistadas por gramo de tejido muscular, sin provocar la muerte del hospedero. Los ratones fueron sacrifcados a los 45 días posinfección. Los animales fueron ambientados y tratados de acuerdo con estándares humanitarios (13).
Las larvas libres (L) y enquistadas (E) fueron obtenidas a partir del sacrifcio y evisceración de 10 ratones para conformar cada grupo. Las larvas libres fueron recuperadas a partir de la digestión enzimática artifcial de los ratones muertos (18). Se prepararon 600 tubos con 500 larvas en 1 ml de H2 O destilada por tubo. Cada tubo fue asignado aleatoriamente a uno de los cinco grupos que representaron a las larvas libres (L1, L2, L3, L4 y L5). Las larvas enquistadas fueron obtenidas a partir de 600 muestras de músculo (2 g; 2,5 ± 0,2 cm de espesor) con 500 ± 50 larvas enquistadas cada una, las cuales fueron cuantifcadas utilizando un microscopioóptico. Cada muestra fue asignada aleatoriamente a uno de los cinco grupos que representaron a las larvas enquistadas (E1, E2, E3, E4 y E5). Al momento de su estudio, las muestras con larvas enquistadas fueron sometidas a digestión enzimática artifcial para el posterior recuento de larvas vivas (18).
En el presente trabajo se defnió a las diferentes temperaturas como "tratamientos".
Los tratamientos de las larvas fueron realizados como se describe a continuación: (1) L1/E1: -30 °C en freezer, (2) L2/ E2: -20 °C en freezer, (3) L3/E3: 4 °C en heladera, (4) L4/E4: 20 ± 0,5 °C en mesada de laboratorio, (5) L5/E5: calentamiento gradual (incremento de 10 °C cada 15 minutos, entre 0 y 100 °C) en baño termostatizado. Las temperaturas y los tiempos de tratamiento fueron monitoreados diariamente mediante reloj y termómetro de precisión calibrado (Hanna, rango de medición: entre -50 °C y 150 °C).
Las larvas de los tratamientos L1/E1 y L2/E2 fueron observadas diariamente durante los primeros 20 días, y luego cada 10 días. Las de los tratamientos L3/E3 y L4/E4 fueron observadas cada 10 días.
Todos los recuentos fueron realizados utilizando un microscopio óptico. Las larvas fueron clasifcadas como "muertas" cuando se observaron al mismo tiempo las siguientes condiciones: 1) ausencia de movimientos; 2) retracción de las estructuras internas; 3) ruptura de la capa quitinosa del parásito. La ausencia de estas tres características permitió clasifcar a las larvas como "vivas".
Finalmente, la viabilidad fue confrmada mediante la técnica de azul de metileno (25). Los recuentos de larvas fueron realizados hasta el día en que se logró el 100 % de mortalidad, momento defnido como T100 . Los recuentos fueron realizados por triplicado y los resultados fueron promediados.
Análisis estadístico
Inicialmente se ajustaron modelos aditivos generalizados (MAG) no paramétricos para explorar la forma de la relación entre cada variable independiente y la respuesta (15). Luego se construyeron modelos de regresión lineal polinómica (MLP) para evaluar la bondad de ajuste del mejor modelo e interpretar los resultados.
En principio, se analizó la asociación entre la variable independiente "días" (ordinal) y la variable dependiente "mortalidad" (conteo), de forma separada para cada tratamiento térmico. La variable "estado larvario" (libre/enquistada) fue incorporada en cada modelo como variable indicadora ("dummy"). Cada modelo incluyó términos paramétricos (lineales, cuadráticos y cúbicos, cuando fue necesario) y funciones de enlace adecuados para reproducir las relaciones identifcadas en los MAG y producir el mejor ajuste. Se partió de un modelo saturado, el cual incluyó todas las variables independientes y las posibles interacciones entre ellas. Cada modelo fue seleccionado y reducido a su estructura más simple utilizando el criterio de información de Akaike (AIC) como medida de contraste entre modelos alternativos (2). Las variables fueron excluidas del modelo, a menos que redujeran el AIC en más de 2 unidades (8). La bondad de ajuste de cada modelo fnal fue determinada por el valor de R2 ajustado, el cual indica la proporción en la variabilidad de la variable dependiente explicada por el modelo. La falta de mejora de ajuste por parte de la interacción "días × grupo" indicó que la relación entre "días" y "mortalidad" no dependió del estadio larvario.
En todos los tratamientos, la mortalidad larvaria tuvo una relación no lineal con los días transcurridos. Por lo tanto, los modelos requirieron de términos polinómicos de segundo o tercer orden para describir adecuadamente las funciones de mortalidad.
Para la construcción de los MAG, se utilizó la función "gam" del paquete "mgcv" del programa R (24). Los MLG y MLP fueron construidos con las funciones "glm" y "lm" de los paquetes "mgcv" (28) y "stats" de R, respectivamente.
La cantidad de larvas por gramo de alimento necesarias para producir trichinellosis humana varía entre 1 y 150 (6). En nuestro estudio, cada tubo tratado contenía 500 larvas libres/ml o 500 larvas enquistadas/2 g de tejido (250 larvas/g). Ambas concentraciones se encuentran por encima del rango antes mencionado. A partir de cada modelo, se realizaron predicciones de la curva de mortalidad larval para nuevos valores de las variables "días" y "temperatura", utilizando la función "predict" de R. Así, se estimó para cada tratamiento la cantidad de días necesarios para matar un mínimo de 430 larvas dejando de este modo no más de 70 larvas vivas, lo cual fue defnido como T70 y representaría una cifra conservadora con potencial de producir enfermedad.
Debido a la presencia de un punto de cambio abrupto en la pendiente de la curva de mortalidad de larvas enquistadas tratadas a -30 °C, además de ajustar el modelo de regresión global correspondiente, se utilizó un modelo de regresión segmentada (11) para estudiar la mortalidad larvaria en cada uno de los segmentos de la curva.
La presencia de problemas de colinearidad fue evaluada mediante la matriz de correlación y el factor de infación de la varianza.
RESULTADOS
El T100 y T70 dependieron del tratamiento (Tablas 1 y 2) y las larvas libres sobrevivieron menor cantidad de días que las larvas enquistadas en todos los tratamientos (Figura 1). Los modelos de regresión que mejor ajustaron los datos se describen en la Tabla 3 (calentamiento), Tabla 4 (20 °C), Tabla 5 (4 °C), Tabla 6 (-20 °C) y Tabla 7 (-30 °C).
Tabla 1. Tiempo (días) requerido para matar el 100 % de larvas (T100) de T. spiralis (datos obtenidos experimentalmente).

Tabla 2. Tiempo (días) requerido para matar un mínimo de 430 larvas (T70 ). Se informa el promedio e intervalo de confanza del 95 % (IC95 %) para la cantidad de larvas vivas (LVIVAS) a T70. Datos estimados a partir de los modelos de regresión ajustados.
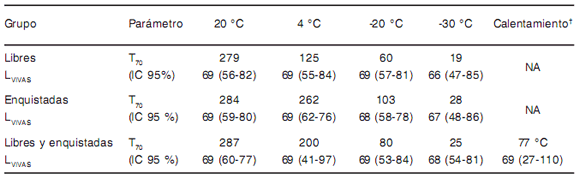
NA = no aplicable por no haberse ajustado modelos para cada tipo de larva por separado.
† Temperatura necesaria para llegar al T70.

Figura 1. Promedio (--) ± 1 desvío estándar ( ) e intervalo de confanza del 95 % (- - -) para la mortalidad media de larvas
(libres y enquistadas) de T. spiralis en función del tiempo y bajo cuatro tratamientos térmicos: -30 °C (A), -20 °C (B), 4 °C (C),
20 °C (D) y calentamiento gradual hasta 100 °C (E).
Tabla 3. Modelo de asociación entre las variables estudiadas y la mortalidad de larvas de T. spiralis bajo calentamiento
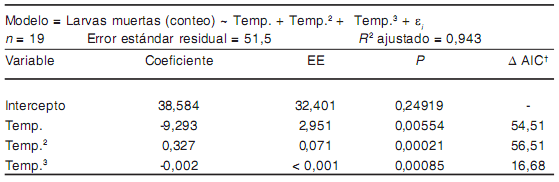
† Aumento en el valor de AIC cuando el término es eliminado del modelo.
Tabla 4. Modelo de asociación entre las variables estudiadas y la mortalidad de larvas de T. spiralis a 20 °C
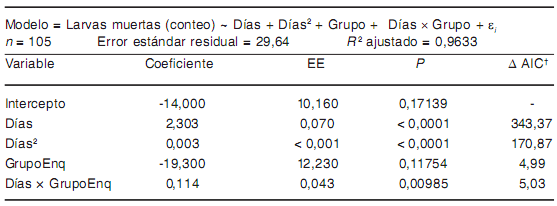
† Aumento en el valor de AIC cuando el término es eliminado del modelo.
GrupoEnq = larvas enquistadas
Tabla 5. Modelo de asociación entre las variables estudiadas y la mortalidad de larvas de T. spiralis a 4 °C
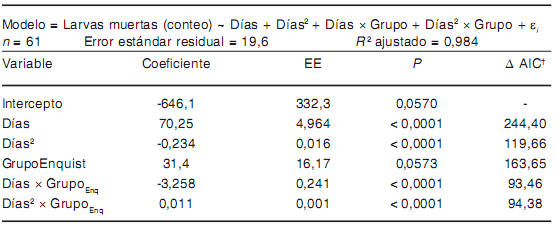
† Aumento en el valor de AIC cuando el término es eliminado del modelo.
GrupoEnq = larvas enquistadas
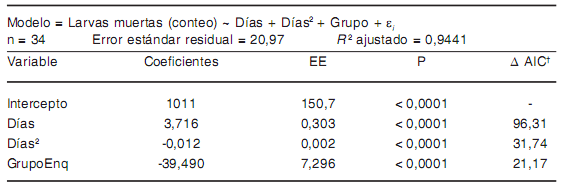
Tabla 6. Modelo de asociación entre las variables estudiadas y la mortalidad de larvas de T. spiralis a -20 °C
† Aumento en el valor de AIC cuando el término es eliminado del modelo.
GrupoEnq = larvas enquistadas
Tabla 7. Modelo de asociación entre las variables estudiadas y la mortalidad de larvas de T. spiralis a -30 °C
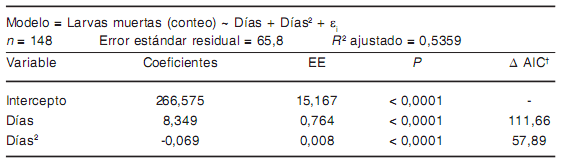
† Aumento en el valor de AIC cuando el término es eliminado del modelo.
De acuerdo con los modelos, la mortalidad larvaria aumentó signifcativamente en función del tiempo en todos los tratamientos (Figura 1A a 1E).
En el calentamiento gradual, las curvas de mortalidad no mostraron diferencias signifcativas para los distintos estadios larvarios entre los 0 y los 90 °C. Sin embargo, el T100 fue alcanzado a 90 °C para las larvas libres y a los 100 °C para las larvas enquistadas (Figura 1E). De forma similar, durante el congelamiento a -30 °C no se observaron diferencias signifcativas entre las curvas de mortalidad para cada tipo de larva (i.e. pendiente similar y ausencia de interacción grupo × días) (Tablas 3 y 7). A -30 °C, la mayor parte de las larvas libres (80 %) y enquistadas (83,6 %) murieron durante los primeros ocho días de tratamiento. La curva de mortalidad de las larvas enquistadas mostró pendientes diferentes (p < 0,001) antes y después del 8.o día (Figura 1A). En el primer período, la mortalidad promedio fue de 71 larvas/día (p < 0,001), mientras que durante el segundo período la mortalidad descendió a 0,7 larvas/día (p < 0,001).
A 20 °C y 4 °C se observaron fenómenos de interacción "grupo × días" (i.e. el efecto del tiempo sobre la mortalidad en cada tratamiento estuvo fuertemente infuenciado por el estadio larvario) (Tablas 4 y 5). A -20 °C, el efecto de grupo en ausencia de interacción signifcativa "grupo × días" (Tabla 6) muestra que, en promedio, murieron 39,5 larvas menos de las enquistadas en comparación con las larvas libres, por cada día de tratamiento.
La detección de colinearidad fuerte entre tratamientos impidió el ajuste de un modelo general que incluyera todos los tratamientos.
DISCUSIÓN
El presente trabajo aporta información novedosa sobre la viabilidad de larvas de T. spiralis de una cepa aislada en el sudoeste de la provincia de Buenos Aires, al ser sometidas a diferentes tratamientos térmicos.
Si los alimentos potencialmente infectados no pudieran ser analizados por los métodos diagnósticos obligatorios, los organismos regentes en sanidad animal recomiendan la cocción de la carne de cerdo y de caballo hasta que su temperatura interna alcance los 71 °C, o bien su congelación a -15 °C durante 3 semanas, en caso de cortes con un espesor mayor de 15 cm. En cortes de mayor espesor, se recomienda el congelamiento durante por lo menos 4 semanas (12). Sin embargo, ya en la década de los 70 se sugería la posible existencia de cepas con mayor resistencia a la congelación (29) y adaptadas a diversas regiones geográfcas (14). Más recientemente, organismos internacionales mencionan que estos tratamientos podrían ser inefectivos para carnes procedentes de animales silvestres que alberguen cepas de Trichinella spp. con mayor resistencia a bajas temperaturas (1, 12).
Nuestros resultados demuestran que las larvas de la cepa utilizada en este estudio, se encuentren libres o enquistadas, permanecen vivas cuando son sometidas a temperaturas aún más adversas (tanto de congelamiento como de calentamiento) que las recomendadas (12). Así por ejemplo, el 40,3 % de las larvas libres y el 45,8 % de las larvas enquistadas permanecieron vivas a la tercera y cuarta semana de tratamiento a -20 °C, respectivamente.
Las diferencias observadas entre nuestros resultados y las recomendaciones antes mencionadas podrían atribuirse al hecho de que las temperaturas de congelamiento tradicionalmente utilizadas no tienen en cuenta posibles diferencias entre cepas de T. spiralis procedentes de distintas regiones geográfcas y diferentes hospederos, como fue sugerido por Gould (14). De esta manera, las variaciones espaciales y entre especies podrían actuar como factores de confusión que, al ser ignorados, llevarían a la utilización de tratamientos térmicos efcientes para determinadas cepas de T. spiralis, pero inefcientes para otras.
En este estudio, la mortalidad observada para todos los tratamientos con frío mostró un marcado aumento inicial en función del tiempo, el cual fue independiente del estado larvario. Este hallazgo indica que el efecto negativo de la baja temperatura sobre la viabilidad es más intenso durante los primeros días de tratamiento, y sugiere que el enquistamiento no actúa como factor protectivo de muerte.
Cabe resaltar que en brotes de trichinellosis humana en la provincia de Buenos Aires, la cantidad de larvas por gramo obtenidas de los alimentos involucrados varió entre 1 y 150 (6). Sobre la base de estos antecedentes y considerando cuál fue el tiempo necesario para la supervivencia de un máximo de 70 larvas en nuestro estudio, y que dicha cantidad de larvas sería sufciente para producir enfermedad, sugerimos que la temperatura y los tiempos tradicionalmente recomendados (12) no serían los más efectivos para lograr un producto libre de larvas vivas de la cepa de T. spiralis aquí utilizada.
En cuanto al tratamiento de cocción, Kotula et al. (16) sugirieron que con el método tradicional, y aun por encima de los 82 °C, no se eliminaría la totalidad de las larvas de "triquina". Nuestros resultados apoyan lo sugerido por estos autores, ya que el tratamiento de las muestras a la temperatura recomendada de 71 °C (12) mató solamente el 74,9 % de las larvas (libres y enquistadas). Por consiguiente, sugerimos el calentamiento uniforme del producto a una temperatura mínima de 87 °C durante al menos 15 minutos para matar a la totalidad de las larvas presentes en el producto.
A temperatura ambiente, la supervivencia de las larvas enquistadas fue de 16,4 meses. Este tiempo supera al informado por Borchert (7), lo cual reviste importancia desde el punto de vista de la epidemiología de este parásito en la naturaleza.
En conclusión, nuestro trabajo proporciona información valiosa acerca de los requerimientos térmicos para obtener un producto "libre" de T. spiralis sobre la base de un estudio realizado con una cepa previamente aislada en el sudoeste de la provincia de Buenos Aires, y resalta la necesidad de rever de forma crítica las condiciones de tratamiento de alimentos con potencial de transmisión de este parásito, cuando ellos no puedan ser analizados por los métodos diagnósticos obligatorios.
Agradecimientos: Agradecemos a la Secretaria de Ciencia y Tecnología de la Universidad Nacional del Sur por fnanciar el presente estudio (PGI 24/B133).
1. Airas N, Seppo S, Mikkonen T, Virtala A, Pellikka J, Oksanen A, Isomursu M, Kilpelä SS, Lim CW, Sukura A. Sylvatic Trichinella spp in Finland. J Parasitol 2010; 96: 67-76. [ Links ]
2. Akaike H. A new look at the statistical model identifcation. IEEE T Automat Contr 1974; 19: 716-23. [ Links ]
3. Ancelle T, Dupouy-Camet J, Desenclos C J, Maillot E, Savage-Houze S, Charlet F, Drucker J, Moren A. A multifo- A multifo- cal outbreak of trichinellosis linked to horse meat imported from North America to France in 1993. Am J Trop Med Hyg 1998; 59: 615-19. [ Links ]
4. Bailey T, Schantz P. Trends in the incidence and transmission patterns of trichinosis in humans in the United States: comparisons of the periods 1975-1981 and 1982-1986. Rev Inf Dis 1990; 12: 5-11. [ Links ]
5. Bolpe J, Boff R. Human Trichinellosis in Argentina. Review of the casuistry registered from 1990 to 1999. Parasite 2001; 8: 78-80. [ Links ]
6. Bolpe J. Triquinosis: Aspectos epidemiológicos, de diagnóstico y control de una zoonosis endémica en la República Argentina. In: Basualdo J, Cacchione R, Durlach R, Martino P, Seijo A, editores. Temas de Zoonosis V, 1ra edición. Buenos Aires, Asociación Argentina de Zoonosis, 2011, p. 347-54. [ Links ]
7. Borchert A. Parasitología Veterinaria. Editorial Acribia, Zaragoza, España, 1975, 745 p. [ Links ]
8. Burnham KP, Anderson DR. Information and likelihood theory: a basis for model selection and inference. En: Burnham KP, Anderson DR, editors. Model selection and multimodel inference: a practical information-theoretic approach. Springer-Verlag New York, Inc., 2002, p. 49-97. [ Links ]
9. Caracostantogolo J, Steffan P, Dillon J, De la Sota M, Belgrano D, Veneroni R, Ruiz M, Schapiro J, Castaño R, Martínez M, Morici G, Balbiani G, Castro M, Eddi C. Mejoramiento del control de la Trichinellosis en Argentina: proyecto TCP ARG 3003 entre la FAO y el gobierno argentino. En: FAO, editor. Mejoramiento del control de la Trichinellosis. Roma, Italia, 2007, p. 5-13. [ Links ]
10. Costamagna S, García S, Visciarelli E, Casas N. Epidemiología de las parasitosis en la ciudad de Bahía Blanca, Provincia de Buenos Aires, Argentina. 1994-1999. Parasitol Latinoam 2002; 57: 103-10. [ Links ]
11. Faraway JJ. Extending the linear model with R, 1st edition. Chapman & Hall/CRC, Boca Raton, 2006, 331 p. [ Links ]
12. Gamble H, Cuperlovic K, Gajadhar A, Van Knapen F, Nockler K, Schenone H, Zhu X. International Commission on Trichinellosis. Recommendations on methods for the control of Trichinella on domestic and wild animals intended for human consumption. Vet Parasitol 2000; 93: 393-408. [ Links ]
13. Garber J, Barbee RW, Bielitzki JT, Clayton LA, Donovan JC, Kohn DF, Lipman NS, Locke P, Melcher J, Quimby FW, Turner PV, Wood GA, Würbel H. Guide for the Care and Use of Laboratory Animals, 8th edition. Washington DC, The National Academy Press, 2010, 326 p. [ Links ]
14. Gould SE. Trichinosis in man and animals, 2nd edition. Gould SE, editor. CC Thomas, Springfeld, 1970, 540 p. [ Links ]
15. Hastie TJ, Tibshirani RT. Generalized Additive Models, 2nd edition. Chapman & Hall, London, 1990, 335 p. [ Links ]
16. Kotula AW, Murrell KD, Acosta-Stein L, Lamb L, Douglass L. Destruction of Trichinella spiralis during cooking. J Food Sci 1983; 48: 765-8. [ Links ]
17. Ministerio de Salud. Boletín Semanal de Vigilancia. Boletín de Vigilancia N° 84. [Online] http://www.msal.gov.ar/htm/site/epidemiologia.asp. Fecha de acceso: 28/06/2011. [ Links ]
18. Montali G, Cabral M, Plaza H. Diagnóstico de Trichinella spiralis por el Método de digestión artifcial. Ministerio de Asuntos Agrarios, Buenos Aires, Argentina, 1997; p. 1-14. [ Links ]
19. Nöckler K, Pozio E, Voigt W, Heidrich J. Detection of Trichinella infection in food animals. Vet Parasitol 2000; 93: 335-50. [ Links ]
20. Owen R. Description of a microscopic entozoon infesting the muscles of the human body. Trans Zool Soc Lond 1835; 1: 315-24. [ Links ]
21. Pozio E, La Rosa G, Rossi P, Murrell KD. Biological characterization of Trichinella isolates from various host species and geographical regions. J Parasitol 1992; 78: 647-53. [ Links ]
22. Pozio E. Factors affecting the fow among domestic, synanthropic and sylvatic cycles of Trichinella. Vet Parasitol 2000; 93: 241-62. [ Links ]
23. Pozio E. Taxonomy, Biology and Epidemiology of Trichinella parasites. In: Dupouy-Camet J, Murrell KD, editores. FAO/WHO/OIE. Guidelines for the surveillance, management, prevention and control of Trichinellosis, 2007, p. 1-35. [ Links ]
24. R Development Core Team (2010). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. [Online]: http://www.R-project.org [ Links ]
25. Randazzo V, Costamagna S. Coloración de azul de metileno como alternativa para determinar viabilidad de larvas de Trichinella spiralis. Rev Argent Microbiol. 2010; 42: 95-7. [ Links ]
26. Ribicich M, Gamble H, Rosa A, Bolpe J, Franco A. Trichinellosis in Argentina: An historical review. Vet Parasitol 2005; 132: 137-42. [ Links ]
27. Van Knapen F. Control of trichinellosis by inspection and farm management practices. Vet Parasitol 2000; 93: 385-92. [ Links ]
28. Wood SN. Generalized Additive Models: An Introduction with R. Chapman and Hall/CRC, New York, 2006, 391 p. [ Links ]
29. Zimmermann WJ. Trichinosis in bear of western and north central United States. Amer J Epidemiol 1977; 2: 161-71. [ Links ]
Recibido: 05/07/11
Aceptado: 06/09/11














