Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Revista argentina de microbiología
versão impressa ISSN 0325-7541
Rev. argent. microbiol. vol.43 no.4 Ciudad Autónoma de Buenos Aires out./dez. 2011
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Infección diseminada por Penicillium marneffei en un paciente HIV-positivo
Primera observación en la República Argentina
Gabriela Santiso1, Viviana Chediak2, Elena Maiolo1, María T. Mujica3, Jorge San Juan2, Alicia Arechavala1, Ricardo Negroni1*.
1 Unidad Micología,
2 Unidad de Cuidados Intensivos, Hospital de Infecciosas "F. J. Muñiz". Uspallata 2272 (1282) CABA;
3 Centro de Micología del Departamento de Microbiología y Parasitología, Facultad de Medicina, UBA. Paraguay 2155 (1114) CABA, Argentina.
*Correspondencia. E-mail: hmmicologia@intramed.net
RESUMEN
Se presenta el primer caso humano de peniciliosis por Penicillium marneffei observado en la República Argentina. El paciente era un joven de 16 años, HIV-positivo, procedente de un área rural del sur de China. El paciente fue internado en el Hospital "F. J. Muñiz" por padecer una neumonía grave con insufciencia respiratoria aguda. El agente causal fue aislado de un lavado broncoalveolar y se lo observó en un citodiagnóstico de piel. La identifcación de P. marneffei fue confrmada por las características fenotípicas del aislamiento y la amplifcación del ADNr. El enfermo padecía una infección muy avanzada por HIV que condujo a la aparición simultánea de infecciones por citomegalovirus, Pneumocystis jirovecii y procesos bacterianos nosocomiales. Este complejo cuadro derivó en una evolución fatal.
Palabras clave: Peniciliosis; Penicillium marneffei; Infecciones relacionadas al HIV
ABSTRACT
Disseminated infection due to Penicillium marneffei related to HIV infection. First observation in Argentina. The frst case observed in Argentina of AIDS-related human penicillosis is herein presented. The patient was a six- teen year-old young man coming from a rural area of southern China. He was admitted at the F. J. Muñiz Hospital of Buenos Aires city with severe pneumonia and adult respiratory distress. Penicillium marneffei was isolated from bronchoalveolar lavage fuid and was microscopically observed in a skin cytodiagnosis. P. marneffei identifcation was confrmed by rRNA amplifcation and its phenotypic characteristics. The patient suffered an advanced HIV infection and also presented several AIDS-related diseases due to CMV, nosocomial bacterial infections and Pneumocystis jirovecii which led to a fatal outcome.
Key words: Penicillosis; Penicillium marneffei; AIDS-related infections
La peniciliosis es una micosis sistémica, endémica, producida por el hongo dimorfo Penicillium marneffei, que infecta a seres humanos y roedores del sudeste asiático. Ha habido un notable incremento de la incidencia de esta micosis desde la aparición de la pandemia del sida en la región. La mayor parte de los casos son pacientes con recuentos de linfocitos CD4 + inferiores a 100/µl y presentan la forma diseminada de esta infección fúngica (6).
Las áreas endémicas de esta micosis abarcan el norte de Tailandia, el sur de China (incluyendo Hong Kong), Taiwán, Laos, Vietnam, Malasia, Myanmar (Birmania), Filipinas y el nordeste de India (Manipur) (8, 14).
P. marneffei fue aislado del suelo y de infecciones espontáneas de diversas especies de ratas de los géneros Rhizomys y Cannomys, que habitan en los bambusales (1, 2).
El agente infeccioso penetra posiblemente por vía inhalatoria, es mucho más frecuente la infección durante la estación lluviosa y hay indicios de que existen infecciones asintomáticas, así como largos períodos de latencia que preceden a las formas clínicas progresivas (8, 13). El principal mecanismo defensivo frente a esta micosis es la producción de una respuesta de citoquinas con predominio Th1, que conduce a la formación de un granuloma epiteioide compacto, semejante al de la tuberculosis. En las personas con défcit de la inmunidad mediada por células, como los pacientes con sida, esta respuesta es inadecuada, se produce una hiperplasia de macrófagos, con gran cantidad de microorganismos, algunos extracelulares (2, 6).
Las manifestaciones clínicas son muy semejantes a as observadas en la histoplasmosis clásica y se pueden parecer a las de la criptococosis.
El objeto de este informe es dar a conocer el primer caso de peniciliosis diseminada asociada a la infección por HIV observado en la República Argentina.
Se trata de un paciente de 16 años, sexo masculino, nacido en la Argentina. Hijo de padres oriundos de Fujian, China, emigró a un área rural del sur de ese país cuando tenía un año.
La enfermedad que motivó su internación había comenzado durante su regreso de China a la Argentina, luego de pasar por Hong Kong y San Pablo. Ingresó a nuestro país el 17 de marzo de 2010. Tres días más tarde fue llevado al Hospital de Infecciosas "F. J. Muñiz" por presentar febre (38-39 °C), escalofríos, tos no productiva, diarrea, vómitos y disnea. de tres semanas de evolución. El paciente impresionó como gravemente enfermo, adelgazado, febril, taquipneico, asténico, con signos de deshidratación, con palidez de piel y mucosas, aunque consciente y cooperador. La presión arterial era de 108/65 mm Hg; la frecuencia cardíaca de 128 latidos/ min; la respiratoria de 32 por minuto, la temperatura axilar fue de 38,5 °C y la presión venosa central fue de 0 cm de agua. En el examen semiológico mostró palidez de piel y mucosas, signo del pliegue cutáneo (deshidratación), roncus y estertores crepitantes en ambos pulmones, hepatomegalia de 1 cm por debajo del reborde costal; en la piel del cuello y los miembros superiores se observaron pápulas de aspecto moluscoide. La radiografía de tórax mostró infltrados pulmonares nodulares y difusos bilaterales. La tomografía axial computarizada de tórax reveló la presencia de lesiones micronodulillares y áreas de condensación con broncograma aéreo, rodeadas de infltrados de aspecto semejante a vidrio esmerilado, diseminadas en ambos pulmones (Figura 1).

Figura 1. Tomografía computarizada de tórax; se observan lesiones intersticiales nodulares e infltrados difusos en ambos pulmones.
Los estudios de gases en sangre demostraron hipoxia y acidosis metabólica compensada respiratoriamente (pH 7,4; PaCO2 28,6; PaO2 42 mm de Hg, HCO3 19 mEq/l). Los exámenes de laboratorio informaron los siguientes datos: hematocrito, 30,5 %, hemoglobina, 10 g/dl; leucocitos, 6800/µl; plaquetas, 225 000/µl; glucemia 126 mg/ dl; creatininemia 1,06 mg/dl; suero anictérico, GOT 263 U/l; GPT 158 U/l; tiempo de protrombina 69 %; KPTT 48 segundos; sodio 141 mEq/l y potasio 3,3 mEq/l.
Fue admitido en la Unidad de Cuidados Intensivos debido al agravamiento de la insufciencia respiratoria, que obligó a mantenerlo con asistencia respiratoria mecánica. Presentó dos veces neumotórax espontáneo, en ambos casos hubo que drenar quirúrgicamente. Sufrió una infección urinaria intrahospitalaria, episodios de excitación psicomotriz y sepsis con falla multiorgánica. Se comprobó la existencia de varias infecciones concomitantes, lo que llevó a complicaciones graves.
La serología de HIV 1 y 2 fue reactiva, la carga viral fue de 750 000 copias de ARN/ml y el recuento de linfocitos CD4 + fue de 6/µl. Presentó PCR positiva para citomegalovirus en el LCR.
El examen de lavado broncoalveolar (LBA) mostró escasos leucocitos y abundantes hematíes y macrófagos; en el examen en fresco y mediante coloraciones de Giemsa y de Grocott se comprobó la presencia de elementos compatibles con Pneumocystis jirovecii. Los cultivos en medios con antibióticos presentaron el desarrollo de numerosas colonias de Penicillium con pigmento rojo difusible al medio de cultivo (Figura 2).
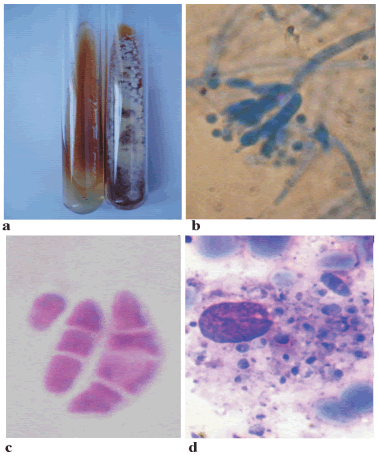
Figura 2. a. Medios BHI-agar y agar-miel de Sabouraud; se observan las formas micelial y levaduriforme de P. marneffei. b. Examen microscópico de la forma micelial, se observa el esporóforo típico. Preparación montada en líquido de Gueguen, 1000X. c. Preparación en líquido de Gueguen; se observan elementos de la forma levaduriforme de P. marneffei, 1000X. d. Citodiagnóstico de Tzanck de las lesiones cutáneas, se observa un macrófago con elementos de la forma parasitaria de P. marneffei. Tinción con Giemsa, 1000X.
Se realizaron extendidos teñidos con Giemsa de material obtenido por escarifcación de las lesiones cutáneas, en los que se observaron macrófagos que contenían elementos ovalados de 3 a 5 µm de diámetro, con una pared celular que no tomaba el colorante y un tabique transversal con morfología compatible con P. marneffei. Figura 2.
Presentó desarrollo de Acinetobacter baumannii en el urocultivo y de Pseudomonas aeruginosa en los hemocultivos.
Para controlar la neumocistosis se le indicó cotrimoxazol y corticosteroides, de acuerdo con las normas de la OMS (9). La infección por CMV fue tratada con foscarnet por vía intravenosa; por su micosis diseminada recibió anfotericina B desoxicolato en dosis creciente, de 0,3 a 0,7 mg/kg/día. Las infecciones bacterianas fueron tratadas con ceftriaxona, claritromicina, vancomicina y colistina, y a la segunda semana de internación se le instituyó tratamiento antirretroviral con lopinavir-ritonavir y 3 Tc.
Como efectos colaterales se produjo una acentuación de la anemia, leucopenia de menos de 1000 células/µl (que no respondió a los factores estimulantes de colonias de granulocitos y macrófagos), hiperglucemia de 300 mg/ dl, desequilibrio hidroelectrolítico e hipoproteinemia con hipoalbuminemia y edemas.
Finalmente, presentó un absceso corneano con endoftalmitis, el líquido del neumotórax se tornó purulento y el paciente falleció por empeoramiento de su cuadro séptico.
Estudio del aislamiento de Penicillium recuperado. Colonia gigante a los 15 días de incubación a 28 °C en agar-glucosado de Sabouraud: presentó una colonia circular de 4 cm de diámetro, plana, con micelio aéreo corto, agamuzado, de color amarillo verdoso y pigmento rojo vinoso, que difundía al medio de cultivo. Microcultivos en medios de Czapek con extracto de levadura y agar-papa-glucosado: se observó un micelio vegetativo hialino, ramifcado y tabicado, de paredes lisas, de 3-4µm de diámetro; los conidióforos tenían 80-100 µm de largo por 3-4 µm de ancho, eran ramifcados en forma de pincel, presentaron ramas, con 3 a 5 métulas de 7-10µm de largo por 2-3 µm de ancho y 8 a 10 esterigmas en forma de fálides de 5-6 µm de largo por 2-3 µm de ancho. En el vértice de los esterigmas se originaban cadenas de conidios elípticos, lisos, de 2 a 3 µm de diámetro (Figura 2). Después de varios subcultivos en agar infusión cerebro-corazón (BHI) a 37 °C, las colonias se trasformaron en pastosas, pequeñas y de color rosado; microscópicamente se observaron elementos ovales o en forma de salchicha, de 2 a 6 µm de diámetro, con tabiques transversales. Las características morfológicas encontradas corresponden a P. marneffei (5, 7).
Con la cepa aislada se preparó una suspensión de esporas de la forma micelial en solución salina isotónica estéril, con opacidad equivalente al N.° 1 de la escala de Mc Farland. Con 0,1 ml de esta suspensión se inocularon dos hámsteres de 100 g de peso, por vía intratesticular. Un mes después los animales fueron sacrifcados mediante sangría y se comprobó que presentaban una orquitis granulomatosa, con necrosis caseosa en el centro y adherencias fbrosas hacia los tejidos vecinos. En el examen microscópico de impresiones de los testículos teñidas con Giemsa se observaron elementos ovales, de 3-5 µm de diámetro, con un tabique transversal, compatibles con la fase tisular de P. marneffei. Los cultivos de macerados de los testículos presentaron el desarrollo de P. marneffei. Se separaron los sueros de estos animales para estudios serológicos.
Se preparó un antígeno metabólico de P. marneffei con la cepa aislada. Se sembró una suspensión densa de esporas de la forma micelial en un medio líquido (glucosa al 2 % y extracto de levadura al 1 % en agua destilada). Los frascos se incubaron a 28 °C en un agitador mecánico rotatorio, a razón de 90 ciclos/minuto, durante 4 semanas. Se le adicionó etilmercurio-tiosalicilato de sodio y borato de sodio a la concentración fnal de 1/5000, para matar al hongo. Después de 48 h a temperatura ambiente, se separó el micelio por fltración y el líquido remanente fue concentrado 10 veces. La capacidad antigénica de este reactivo se probó frente a los sueros de los hámsteres inoculados. La contrainmunoelectroforesis en agarosa presentó dos bandas de precipitación con ambas muestras de suero. La misma reacción efectuada con el suero del paciente no presentó bandas de precipitado.
Estudios moleculares para la identifcación del aislamiento fúngico proveniente del LBA. A partir de un cultivo en BHI incubado a 37 °C durante 5 días, se preparó una suspensión del hongo (forma levaduriforme) con opacidad equivalente al N.° 3 de la escala de Mc Farland. Un volumen de 10 µl de esta suspensión se usó como molde en las reacciones de PCR.
La reacción de PCR se realizó según el siguiente protocolo: tampón PCR 1 x 5 µl, 200 µM de cada dexosirribonucleósido trifosfato (dATP, dGTP, dCTP, dTTP), 0,3 mM de MgCl2 , 0,4 µM de cada iniciador (ITS1: 5'-TCCGTAGGTGAACCTGCGG-3' y ITS4: 5'-TCCTC-CGCTTATTGATATG-3') (15), 10 µl de molde, 1,25 U/µl Taq ADN polimerasa (Invitrogen, Argentina) y sufciente agua destilada para que el volumen de reacción fuera de 50 µl. La amplifcación de la región ADNr se realizó en un termociclador (MiniCycler TM MJ Research Inc, NY, EE. UU.) con los siguientes ciclos: 3 min a 94 °C, 30 ciclos de 45 seg a 94 °C, 45 seg a 55 °C y 45 seg a 72 °C, seguido de una extensión fnal de 10 min a 72 °C. En la reacción de PCR se incluyó un control negativo y como control positivo se amplifcó un aislamiento en fase levaduriforme de P. marneffei de la colección de cultivos de McGinnis (University of Texas, Galverston, EE. UU.).
Detección del producto de PCR. Los fragmentos amplifcados se separaron por electroforesis en gel de agarosa al 1,5 % en tampón TBE (0,09 M Tris, 0,09 Mácido bórico y 2 mM de EDTA, pH 8,3) durante 90 minutos a 90 voltios, y se visualizaron con bromuro de etidio bajo irradiación con luz UV.
El producto de amplifcación obtenido se purifcó con el equipo QIAquick PCR (Qiagen AG, Basel, Suiza) y se secuenció en ambas direcciones usando el equipo ABI Prism 3100/ 3100-Avant Genetic Analyser (Applied Biosystems, Foster City, CA, EE. UU.). El producto resultante, de 494 pb, se comparó con las secuencias disponibles en GenBank con el programa BLASTn. La secuencia de nucleótidos para la región ADNr del aislamiento procedente del LBA presentó un 100 % de identidad con P. marneffei números de accesos FJ009566.1, FJ009565.1 y FJ009555.1. Esto nos permitió confrmar la identifcación microbiológica del aislamiento del LBA del paciente como P. marneffei.
P. marneffei es la única especie de género Penicillium que es dimorfa y patógena primaria para el hombre y otras especies de animales. Sobre la base de sus caracteres fenotípicos, fue ubicada por Segretain entre las especies de la sección Asymetrica Divaricada de la clasifcación de Raper y Thom (11). Actualmente, sobre la base de los estudios de su ADN, ha sido incluida dentro del subgénero Biverticillum. Si bien el estado teleomorfo de esta especie es desconocido, los integrantes de este subgénero poseen un estado teleomorfo del género Talaromyces, subdivisión Ascomycotina (5, 7).
Más del 70 % de los casos de peniciliosis diseminada se asocian al sida y presentan una evolución subaguda. Las manifestaciones clínicas más frecuentes son febre prolongada, adelgazamiento, astenia, anorexia, anemia, diarrea, tos seca, disnea, dolor torácico, lesiones cutáneas papulosas de aspecto moluscoide, adenomegalias y hepatosplenomegalia (2, 6, 8, 14).
El paciente de este caso presentó varios de estos síntomas, pero debe señalarse que ellos son compartidos por un gran número de enfermedades infecciosas que se observan en pacientes con sida (13).
La evolución espontánea de la peniciliosis asociada al sida es siempre fatal, pero su respuesta a los tratamientos antifúngicos es buena. La anfotericina B-desoxicolato, así como sus formulaciones lipídicas y el itraconazol, han demostrado ser efcaces en el tratamiento de esta infección (3, 12, 13). Los estudios in vitro han demostrado que P. marneffei es sensible a anfotericina B, ketoconazol, itraconazol, fuconazol, 5-fuorocitosina, voriconazol y posaconazol (10). El ketoconazol ha sido desechado por su mayor toxicidad y el fuconazol presentó mayor frecuencia de fracasos terapéuticos que el itraconazol. En cuanto a los triazoles de segunda generación, la experiencia clínica es aún escasa. Por lo general, en los casos graves de peniciliosis se inicia el tratamiento con anfotericina B-desoxicolato, a razón de 0,3 a 0,7 mg/kg/día, y cuando el paciente mejora se cambia por itraconazol por vía oral, a razón de 400 mg/día, hasta alcanzar la remisión clínica completa (3, 11, 13). Para evitar las recidivas, los pacientes HIV-positivos continúan recibiendo 200 mg/ día de itraconazol hasta que presenten dos recuentos de células CD4+ superiores a 150/ml, como consecuencia del tratamiento antirretroviral (4, 12).
En el enfermo que motiva esta comunicación de peniciliosis se comprobó la coexistencia de una infección por HIV muy avanzada y con gran velocidad de progresión, como lo demuestran el recuento de linfocitos CD4+ muy bajo y la elevada carga viral. Esta situación facilitó el desarrollo, en corto tiempo, de otras enfermedades virales, bacterianas y fúngicas que complicaron el reconocimiento de la peniciliosis y su tratamiento, lo que empeoró su pronóstico, hasta ocasionarle la muerte.
La presentación de este caso clínico tiene por propósito alertar a los médicos de Sudamérica sobre la necesidad de tener en cuenta a la peniciliosis como una de las infecciones fúngicas graves asociadas a la infección avanzada por el HIV, ya que el incremento de las relaciones comerciales y turísticas con el sudeste asiático, así como las corrientes migratorias, hacen posible la observación de esta enfermedad fuera del área endémica, tal como ya ha sucedido en otras regiones (14). Su diagnóstico no es fácil debido a la similitud de manifestaciones clínicas y hallazgos microscópicos con la histoplasmosis (9, 14).
1. Chariyalertsak S, Sirisanthana TA, Supparatpinyo K, Nelson KE. Seasonal variation of disseminated Penicillium marneffei infections in northern Thailand: a clue to the reservoir?. J Infect Dis 1996; 173: 1490-3. [ Links ]
2. Chariyalertsak S, Sirisanthana TA, Supparatpinyo K, Praparattanapan J, Nelson EK. Controlled study of risk factors for Penicillium marneffei infection in human immunodefciency virus-infected patients in Northern Thailand. Clin Infect Dis 1997; 24: 1080-6. [ Links ]
3. Chariyalertsak S, Supparatpinyo K, Sirisanthana T, Nelson KE. A controlled trial of itraconazole as primary prophylaxis for systemic fungal infections in patients with advanced human immunodefciency virus infection in Thailand. Clin Infect Dis 2002; 34: 277-84. [ Links ]
4. Chaiwarith R, Charoenyos N, Sirisanthana T, Supparatpinyo K. Discontinuation of secondary prophylaxis against Penicilliosis marneffei in AIDS patients after HAART. AIDS 2007; 21: 365-7. [ Links ]
5. de Hoog G, Guarro J, Gené J, Figueras MG. Atlas of Clinical Fungi. 3rd Edition. CBS & Universitat Rovira i Virgili, 2009. [ Links ]
6. Doung TA. Infection due to Penicillium marneffei, an emerging pathogen: review of 155 reported cases. Clin Infect Dis 1996; 23: 125-30. [ Links ]
7. Lacaz C da S, Porto E, Heins-Vaccari EM, Takhashui de Melo N. Guia de Identifcação. Fungus, Actinomicetos, Algas de interesse médico. São Paulo, Brasil. Editorial Sarvier 1998, p. 283-4. [ Links ]
8. Nelson KE, Sarisanthana T. Penicillosis. En: Dismukes WE, Pappas PG, Sobel JD, editors. Clinical Mycology, Oxford University Press, 2003, p. 355-64. [ Links ]
9. Organización Mundial de la Salud. Organización Panamericana de la Salud, Washington, DC. Tratamiento de las Enfermedades Infecciosas. Cuarta Edición.2009-2010; p. 259. [ Links ]
10. Pfaller MA, Messer SA, Hollis RN. Antifungal activities of posaconazole, ravuconazole and voriconazole compared to those of itraconazole and amphotericin B against 239 clinical isolates of Aspergillus spp. and other flamentous fungi: report from SENTRY Antimicrobial 1032-7.Surveillance Program 2000. Antimicrob Agents Chemother 2002; 46: 13. [ Links ]
11. Segretain G. Description d´une nouvelle espèce de Penicillium: Penicillium marneffei n.sp. Bull Soc Mycol Fr 1959; 75: 412-6. [ Links ]
12. Sirasanthana T, Supparatpinyo K, Perriens J, Nelson KE. Amphotericin B and itraconazole for treatment of disseminated Penicillium marneffei infection in human immunodeffciency virus-infected patients. Clin Infect Dis 1998; 26: 1107-10. [ Links ]
13. Supparatpinyo K, Perriens J, Nelson KE, Sirisanthana TA. A controlled trial of itraconazole to prevent relapse of Penicillium marneffei infection in patients infected with the human immunodefciency virus. N Engl J Med 1998; 339: 1739-43. [ Links ]
14. Viviani MA, Tortorano AM. Penicillium marneffei. En: Ajello L, Hay RJ, editors. Medical Mycology. Topley and Wilson Microbiology and Microbial Infections. Arnold, London, Sydney, Auckland, 1998, p. 409-19. [ Links ]
15. White TJ, Bruns T, Lee S, Taylor J. Amplifcation and direct sequencing of fungal ribosomal RNA genes for phylogenetics. En: Innis MA, Gelfand DH, Sninsky JJ, White TJ, editors. PCR protocols: a guide to methods and applications, San Diego, California; Academic Press Inc 1990, p. 315-22. [ Links ]
Recibido: 30/05/2011
Aceptado: 29/08/2011














