Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.44 no.2 Ciudad Autónoma de Buenos Aires abr./jun. 2012
ARTÍCULO ORIGINAL
Obtención y evaluación preliminar de un virus canarypox recombinante como candidato a vacuna antirrábica
Flavia zanetti12*, Liliana Rudak3, Matías Micucci3, Daniela Conte Grand12, Andrea Luque4, Susana Russo4, Oscar Taboga12, Oscar Pérez3, Gabriela Calamante2
1Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET);
2instituto de Biotecnología, Instituto Nacional de Tecnología Agropecuaria (CICVyA-INTA). Casilla de Correo 25 (1712) Castelar, Buenos Aires;
3Servicio de Vacuna Antirrábica, Instituto Nacional de Producción de Biológicos (ANLIS), "Dr. Carlos G. Malbrán". Av. Vélez Sarsfield 563 (1282), Ciudad Autónoma de Buenos Aires; 'Departamento de Rabia y Pequeños Animales de la Dirección General de Laboratorios y Control Técnico (DILAB), Servicio Nacional de Sanidad y Calidad Agroalimentaria (SENASA). Av. Fleming 1653 (1640) Martínez, Buenos Aires, Argentina.
*Correspondencia. E-mail: fzanetti@cnia.inta.gov.ar
RESUMEN
En la Argentina, la rabia está circunscripta a algunas provincias del norte. La disponibilidad de nuevas vacunas que eliminen la manipulación del virus rábico y que permitan el control de la enfermedad es de importancia estratégica nacional y regional. Las vacunas basadas en poxvirus recombinantes se han utilizado con éxito como vacunas antirrábicas a nivel mundial. SI bien estos sistemas no están disponibles comercialmente, la plataforma de obtención de virus canarypox (CNPV) recombinantes ya ha sido implementada en nuestro laboratorio. El objetivo de este trabajo fue obtener y evaluar un candidato a vacuna antirrábica basado en CNPV recombinantes que expresan la glicoproteína G (RG) del virus rábico (RV). Se construyó un virus recombinante que expresa la secuencia codificante de RG (CNPV-RG). La inoculación de ratones con este virus indujo altos títulos de anticuerpos seroneutralizantes de RV (3,58 y 9,76 Ul/ml después de una o dos inmunizaciones, respectivamente) y protegió al 78 % de los animales desafiados intracerebralmente con RV. Además, se determinó que el CNPV-RG posee una potencia relativa de 3,5 Ul/ml. Los resultados obtenidos constituyen la primera etapa en la evaluación del CNPV-RG como candidato a vacuna antirrábica. Se requerirán nuevos ensayos para confirmar su utilidad en especies de interés veterinario.
Palabras clave: Virus canarypox recombinante; Vacuna antirrábica; Glicoproteína G
ABSTRACT
Development and preliminary assessment of a recombinant canarypox virus as an antirabic vaccine candidate. In Argentina, rabies is limited to some northern provinces. Availability of new vaccines abolishing the handling of the rabies virus and allowing disease control has regional and national strategic importance. Vaccines based on recombinant poxviruses have been successfully used as antirabic vaccines worldwide. Although these systems are not commercially available, the platform to obtain recombinant canarypox viruses (CNPV) has been previously set up in our laboratory. The aim of this work was the development and evaluation of an antirabic vaccine candidate based on recombinant CNPV expressing the rabies virus (RV) glycoprotein G (RG). A recombinant virus (CNPV-RG) expressing the RG coding sequence was designed. Inoculation of mice with this virus induced high RV seroneutralizing antibodies (3.58 and 9.76 lU/ml after 1 or 2 immunizations, respectively) and protected 78% of intracerebrally RV-challenged animals. In addition, it was determined that CNPV-RG has a relative potency of 3.5 lU/ml. The obtained results constituted the first stage of CNPV-RG evaluation as antirabic vaccine candidate. Further assays will be necessary to confirm its utility in species of veterinary Interest.
Key words: Recombinant canarypox virus; Rabies vaccine; Glycoprotein G
INTRODUCCION
La rabia es una enfermedad infecto-contagiosa de evolución aguda, habitualmente mortal. Es causada por el virus rábico (RV), el cual se transmite entre algunas especies de animales de sangre caliente y el hombre. De este modo, la rabia constituye una de las principales zoonosis con distribución mundial, responsable de aproximadamente 60 000 muertes humanas por año (32, 41). En la década del sesenta, la República Argentina presentaba una delicada situación sanitaria con al menos 12 provincias con focos activos de transmisión de rabia canina. Frente al aumento del número de casos, en 1976 se fortaleció el Programa de Control de Rabia tomando medidas de intervención basadas en la vacunación masiva de los perros (principal reservori y vector de rabia urbana), la eliminación de los reservónos sin dueño y sin control, la vigilancia epidemiológica y la educación sanitaria de la población (21). La citada campaña de vacunación permitió, hacia mediados de los años 90, controlar la transmisión de la rabia, al limitar su presencia a algunas provincias del norte argentino. Aunque desde entonces se registra un número reducido de casos de rabia canina, la enfermedad aún permanece presente en esa región del país debido a la existencia de especies silvestres (principalmente zorros y murciélagos hematófagos e insectívoros) que funcionan como reservorios del virus y que esporádicamente infectan al hombre, a animales domésticos y a otros de interés económico (bovinos, equinos, porcinos, ovinos y caprinos).
La vacunación es el método preventivo más económico y efectivo para la profilaxis y el control de las enfermedades infecciosas. Con la vacunación se estimulan específicamente los mecanismos de defensa del organismo antes de la interacción con el patógeno, de manera que el hospedador inicie una rápida respuesta frente a la infección. En la Argentina, las vacunas antirrábicas de primera y segunda generación para uso veterinario emplean como agente inmunizante al virus inactivado luego de su amplificación en tejido nervioso de animales o en cultivos celulares, respectivamente (21). Si bien estas vacunas son efectivas, presentan ciertas desventajas relacionadas con su obtención y administración. Esto se debe a que la producción requiere la utilización y el sacrificio de un gran número de animales, o la manipulación de grandes cantidades del patógeno en plantas productoras, con estrictas condiciones de bioseguridad. Esto implica que el personal debe estar específicamente entrenado y poseer inmunidad, con un título de anticuerpos protectores validado. Entre las desventajas inherentes a su aplicación podemos mencionar la aparición de reacciones adversas locales asociadas a los adyuvantes presentes en la formulación y la posibilidad de transmisión de patógenos no detectados (virus, bacterias, priones).
La necesidad de disponer a nivel mundial de vacunas antirrábicas seguras, efectivas y de bajo costo ha llevado al desarrollo y evaluación de nuevos inmunógenos desde hace aproximadamente tres décadas. En este sentido, existen numerosos informes en la bibliografía que describen la utilización de vectores virales (replicativos o no) para el clonado y la expresión de la glicoproteína G del virus rábico, principal antígeno responsable de inducir inmunidad celular y humoral protectora en el hospedador (6,17,20, 36,39, 42). De este modo, se obtuvieron virus recombinantes basados en adenovirus canino (2, 15, 16, 19) y humano (24, 38), en herpesvirus canino (43), en virus rábico no replicativo (4), en virus de la pseudorrabia (44) y en los siguientes poxvirus: vaccinia (8, 18, 37); virus vaccinia modificado, cepa Ankara (Modified vaccinia virus: MVA) (35); racoonpox (viruela de mapache) (9), fowlpox (viruela de ave de corral) (30) y canarypox (viruela de canario) (29). La inmunización de ratones y otras especies con estos vectores confirió protección frente al desafío letal con virus rábico.
Una ventaja destacable de los avipoxvirus, como el virus fowlpox (FWPV) o el canarypox (CNPV), es su capacidad de infectar productivamente solo a sus hospedadores naturales. Estos virus pueden iniciar una infección abortiva por inoculación en especies no aviares o por infección de líneas celulares derivadas de mamíferos. Sin embargo, los antígenos foráneos insertados en estos vectores pueden ser sintetizados, procesados y presentados en la superficie de células no permisivas y desencadenar repuestas inmunes de tipo celular y humoral (26, 30). De este modo, la inmunización se consigue en ausencia de replicación viral, con lo que se elimina la posibilidad de una diseminación del vector desde los animales vacunados hacia animales susceptibles o hacia el medio ambiente. Además, el adecuado perfil de seguridad de las vacunas basadas en CNPV recombinantes está demostrado en estudios del National Institute of Health (NIH) para su utilización como vacuna contra el sida y como terapia antitumoral en humanos (http://elinicaltrials.gov; http://www.iavi.org/Pages/home.aspx). En particular, recientemente se publicaron los resultados de un ensayo clínico (RV144, fase III) realizado en Tailandia, que evalúa una vacuna contra HIV basada en CNPV recombinantes. Por primera vez, se mostró cierta eficacia (31,2 %) en la prevención de la infección por HIV (34).
En este trabajo describimos el desarrollo local de un candidato a vacuna antirrábica basado en un virus canarypox recombinante que expresa la glicoproteína G del virus rábico. La capacidad inmunogénica y protectora del virus recombinante se evaluó en el modelo murino. La potencia del candidato vacunal se comparó con la potencia de una vacuna antirrábica de uso veterinario en la Argentina.
MATERIALES Y MÉTODOS
Virus y células
Las líneas celulares Vero {American Type Culture Collection, ATCC CCL-81) y BHK-21 (ATCC CCL-10) se propagaron en medio mínimo esencial de Eagle (MEM-E, Life Technologies Inc., NY, EE.UU.) suplementado con 10 % de suero fetal bovino (Internegocios, Argentina).
Los cultivos primarios de fibroblastos de embrión de pollo (FEP) se prepararon a partir de embriones de 11 días, libres de patógenos específicos (SPF), adquiridos en el Instituto Rosenbusch de la Argentina. Estos se crecieron en medio 199 (Life Technologies Inc.) suplementado con 10 % de suero fetal bovino.
La cepa vacunal Abbatista 95 del CNPV, gentilmente cedida por el Dr. Samus, se utilizó para la obtención de virus canarypox recombinantes. La cepa Abbatista 95 se comercializa en la Argentina como vacuna viva atenuada -liofilizada- contra la difteroviruela del canario (Diftervac®, Laboratorios LaDiPreVet, La Plata) y, en nuestro laboratorio, fue adaptada al crecimiento en FEP.
La cepa Challenge Virus Standardáe\ virus rábico, amplificada en cerebro de ratón, fue provista por la Organización Panamericana de la Salud (OPS). En el INPB ANLIS "Dr. Carlos G. Malbrán", este virus se propagó en cerebro de rata lactante (CVS) y luego se adaptó al crecimiento en cultivos de células Vero (CVS-Vero). Esta cepa es uno de los componentes de las vacunas antirrábicas de primera generación que se utilizan hasta la fecha en la Argentina.
La vacuna antirrábica de referencia nacional elaborada por SENASA, cepa Virus Pasteur propagada en monocapas de células BHK-21 clon 13 e inactivada por tratamiento con bromoetilenimina (BEI, Merck, Alemania) 0,1 mM (PV-BHK3), se estandarizó con la vacuna de referencia internacional 5" patrón de la Organización Mundial de la Salud (OMS) y se usó como control en los ensayos de potencia.
Construcción del vector de transferencia VT-C-GUS-RG
El ARN viral de la cepa CVS-Vero se extrajo con el reactivo comercial de TrizolOLS (Invitrogen, CA, EE.UU.) a partir del sobrenadante del cultivo de células Vero infectadas. Una alícuota del ARN extraño se utilizó como templado para la obtención del ADN copia en una reacción de transcripción reversa junto con hexámeros al azar como oligonucleótidos iniciadores. Posteriormente, la región genómica codificante de la glicoproteína G (RG) se amplificó por PCR en dos fragmentos de 922 y 673 pares de bases, utilizando los pares de oligonucleótidos iniciadores RG1 (1-17)-RG4 (903-922) y RG3 (903-922)-RG2 (1559-1575), respectivamente. Estos cebadores fueron diseñados sobre la base de las secuencias de otras cepas CVS del virus rábico, depositadas en el GenBank (CVS: AJ506997, CVS-B2c: AF042824, CNV-N2c: AF325714). Las secuencias y características de los oligonucleótidos utilizados en este trabajo se indican en la Tabla 1.
Tabla 1. Secuencia de los oligonucleótidos utilizados
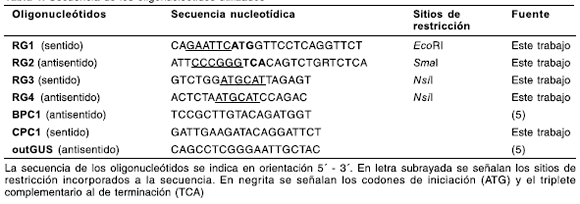
Los productos de amplificación de PCR se clonaron en el vector comercial pGem-»-T Easy (Promega, Madison, EE.UU.) y se liberaron nuevamente por digestión con las enzimas EcoRI y Nsi\ o Nsi\ y Sma\ (New England BioLabs, Inc., MA, EE.UU.). Los fragmentos obtenidos se subclonaron en el vector pE/L -disponible en nuestro laboratorio (5)- digerido con las enzimas EcoRI y Sma\. Esto se realizó mediante una reacción de ligación triple, de manera de obtener la secuencia completa del gen RG bajo regulación del promotor sintético temprano-tardío E/L de poxvirus (Figura 1A). El cassette de expresión E/L-RG-t se liberó por digestión con la enzima Not\ y se subclonó en el mismo sitio del vector VT-C-GUS (5) digerido parcialmente, con lo que se obtuvo el vector de transferencia denominado VT-C-GUS-RG (Figura 1B). Este vector porta, además, un cassette para la expresión del gen marcador uidA, cuyo producto es la enzima D-glucuronidasa bacteriana (GUS), bajo regulación del promotor H6 de poxvirus. Ambas construcciones se encuentran flanqueadas por secuencias correspondientes al gen no esencial CNPV 048, para permitir la recombinación homologa in vivo (5). La identidad del gen codificante de RG se corroboró por secuenciación, utilizando el equipo ABI PRIS® 3130 Genetic Analyzer (Applied Biosystems, Japón).
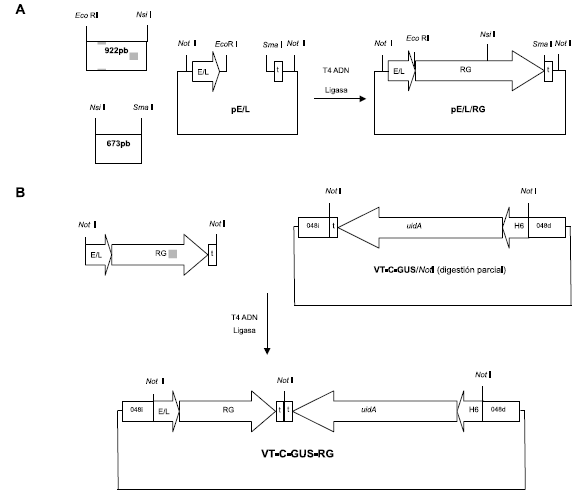
Figura 1. Esquema de la construcción de VT-C-GUS-RG Se esquematizan las estrategias de clonado para la obtención del plásmido intermediario pE/L/RG (A) y el vector de transferenci a VT-C-GUS-RG (B). 922pb/673pb: amplicones de la secuencia codificante de la glicoproteina G (RG) del virus rábico obtenidos con los pares de cebadores RG1-RG4 y RG3-RG2, respectivamente. E/L: promotor sintético temprano-tardío E/L de poxvirus, H6: promotor del gen H6 del virus vaccinia, GUS: gen u/'dA, t: secuencias terminadoras de la transcripción de poxvirus. Las secuencias de interés se encuentran flanqueadas por secuencias del gen CNPV048 para permitir la recombinación homologa con el genoma del virus canarypox. Sobre la base de la secuencia genómica del CNPV (33), se definió que 048¡ corresponde a un fragmento de aprox. 600 pb, con inicio en la posición 59.528, y que 048d corresponde a un fragmento de aprox. 1700 pb, con inicio en la posición 57.247
Obtención y selección de virus canarypox recombinantes
Un cultivo de FEP (80-90 % de confluencia) se infectó con CNPV en una relación de una partícula viral por cada 10 células. A las 2 h posinfección, el cultivo infectado se transfectó con una mezcla de 10 Dg del ADN purificado de VT-C-GUS-RG y 31 Di de lipofectina (Invitrogen), y se incubó a 37 °C en atmósfera de 5 % de C02 hasta la visualización de efecto citopático. El virus recombinante producido, denominado CNPV-RG, se seleccionó por su capacidad de generar placas de lisis azules cuando el sustrato de la enzima marcadora GUS, X-Gluc (5-bromo-4-cloro-3-indolil-l-D-glucurón¡do, Inalco, Italia) se agregó en el cultivo agarizado (5, 11). Posteriormente, el virus fue purificado por seis pasajes sucesivos bajo agar hasta obtener un stock homogéneo (100 % de placas de lisis azules).
Caracterización molecular del virus CNPV-RG por PCR
Con los virus CNPV y CNPV-RG se infectaron monocapas de FEP en una relación de una partícula viral por cada 10 células. Cuando el efecto citopático fue de aproximadamente 100 %, las monocapas se lavaron y se resuspendieron en PBS (NaCI 0,14 M; KCI 0,003 M; Na2HP04 0,008 M; KH2P04 0,0015 M; pH 7,2). A partir de una alícuota de estas suspensiones celulares se realizó la extracción de ADN total por el método descrito por Dellaporta era/. (7). Para comprobar la pureza del stock viral recombinante, el material genético obtenido se utilizó como templado en una reacción de PCR diseñada para obtener dos productos de amplificación de distinto tamaño, según se esquematiza en la Figura 2A. La reacción se realizó en presencia de los oligonucleótidos BPC1, outGUS y CPC1 (Tabla 1), este último al doble de concentración, y el tiempo de elongación se ajustó de manera tal que la amplificación sobre el genoma recombinante estuviera favorecida para la obtención del producto más corto (combinación de cebadores CPC1 -outGUS) y no fuera suficiente para la amplificación del producto de mayor tamaño (combinación de cebadores CPC1 -BPC1).

*Figura 2. Análisis por PCR de los virus canarypox recombinantes CNPV-RG
A) Representación esquemática de los genomas del virus canarypox recombinante (esquema superior) y no recombinante (esquema inferior). Se indica la ubicación de los oligonucleótidos utilizados en la reacción de amplificación por PCR. Las líne as indican el tamaño esperado de los amplicones. B) Electroforesis en gel de agarosa 1 %, teñido con bromuro de etidio, de los productos de amplificación por PCR utilizando como templado ADN de cultivos de FEP no infectados (FEP NI), clones virales N.a 37 y 38 de CNPV-RG, vector de transferencia VT-C-GUS-RG (VT), y virus no recombinante (CNPV). En la reacción se incluyó un control sin ADN (C-). Como marcador de peso molecular (MPM) se utilizó 1 Kb DNA Plus (Invitrogen)
Análisis de la expresión de la proteína RG por Western blot
Se infectaron monocapas confluyentes de BHK-21 con los virus CNPV o CNPV-RG utilizando una relación de 4 partículas virales por cada 10 células. A las 24 h posinfección, las células se cosecharon, se lavaron con PBS y se resuspendieron en bufferde extracción (Tris-HCI 50 mM pH 8, NaCI 150 mM, NP-40 1 %). Los extractos proteicos se incubaron en hielo durante 45 min y se centrifugaron a 10 000 g durante 2 min. Las muestras proteicas se resuspendieron en buffer Laemmli (Tris-HCI 62,5 mM pH 6,8; dodecilsulfato de sodio, SDS 2 %; azul de bromofenol 0,25 %; glicerol 5 %, B-mercapto-etanol 3 %) y se sembraron sobre un gel de poliacrilamida (PAGE 12 % -SDS). Luego de la electroforesls, las proteínas se transfirieron a una membrana de nitrocelulosa (Bio-Rad Laboratories, CA, EE.UU.). La expresión de la proteína RG se determinó mediante la técnica de Western blot utilizando un suero policlonal equino anti-virus rábico (dilución 1/100) obtenido en SENASA, y un suero anti-lgG equina conjugado a peroxidasa de rábano (dilución 1/1000, Kirkegaard & Perry Laboratories, Inc., EE.UU.). La presencia de la proteína RG recombinante se reveló mediante precipitación de sustrato 4-cloro-1-naftol (Tris-HCI 42 mM pH 7,5; 4-CI-1-naftol 0,05 %; H202 0,02 %).
Ensayos de potencia del virus CNPV-RG
Durante el trabajo con animales se cumplió la disposición N.° 6344/96 de ANMAT, que reglamenta los bioterios de laboratorios elaboradores de especialidades medicinales y/o de análisis para terceros. Los ensayos de potencia relativa del virus CNPV-RG se realizaron en el modelo murino. Para ello, grupos de 10-11 ratones de la cepa BALB/c de 5-6 semanas se vacunaron por vía intraperitoneal aplicando un esquema dosis-refuerzo. En el primer ensayo se determinó la capacidad de la vacuna de inducir inmunidad protectora. Los ratones se inmunizaron a los 0 y 21 días utilizando una dosis fija de 2x107 unidades formadoras de placas (UFP) de los virus CNPV o CNPV-RG, purificados sobre colchón de sacarosa (5). En el segundo experimento se evaluó la potencia relativa de la vacuna CNPV-RG. Se realizó una modificación del protocolo del National Institute of Health (NIH) para una vacuna en estudio (40). Los animales se vacunaron los días 0 y 21 con 0,5 mi de las diluciones 1:5,1:25 y 1:125 de un cultivo de FEP infectado con el virus CNPV-RG (título inicial de 4,2 x 106 UFP/ml).
En ambos experimentos se incluyeron grupos controles de animales no vacunados o inmunizados a los 21 y 28 días con diluciones 1:5,1:25 y 1:125 de la vacuna antirrábica PV-BHK3. En el día 35, todos los animales se desafiaron por inoculación intracerebral con una dosis comprendida entre 12 y 50 DL50/ 0,03 mi del virus CVS (40). Los ratones se observaron durante un período de 14 días; se llevó el registro del número de animales muertos o con signos clínicos compatibles con rabia respecto del total. Las muertes ocurridas durante los primeros 4 días posdesafío se registraron como inespecíficas.
Determinación de anticuerpos neutralizantes del virus rábico
Se utilizó el protocolo de determinación de anticuerpos in vivo según Fitzgerald (12). Brevemente, los sueros del primer ensayo obtenidos a los días 20 o 34 se agruparon en pools, se realizaron diluciones seriadas en base 5 y se incubaron 1 h a 37 °C con una dosis fija (comprendida entre 12 y 50 DL50) de la cepa CVS de virus rábico. Como control se analizó en paralelo una inmunoglobulina equina estandarizada con la inmunoglobulina antirrábica de referencia de la OMS. Esta inmunoglobulina equina (IgG) se obtuvo por precipitación con sulfato de amonio a partir de un suero equino hiperinmune, según el protocolo descrito por el Instituto Panamericano de Protección de Alimentos y Zoonosis (INPPAZ, Nota Técnica N.° 8 2-IX-75). Las mezclas se inocularon intracerebralmente en ratones adultos (11 a 14 g) naive de la cepa CF-1, los cuales se observaron durante un período de 14 días para llevar un registro del número de animales muertos y sobrevivientes.
Análisis de datos
El test estadístico de Reed y Muench (25) se utilizó para calcular la dilución efectiva 50 (DE50) y la dilución protectora 50 (DP50) en los ensayos de potencia y seroneutralización, respectivamente.
La potencia del candidato vacunal CNPV-RG se calculó como la relación entre los valores de las inversas de las DE50 obtenidas para dicho virus respecto de las obtenidas para la vacuna de referencia. Análogamente, pero relacionando las DP50, se determinaron los títulos de anticuerpos neutralizantes de RV inducidos por la inmunización con el virus recombinante. Todos los resultados se expresaron en unidades internacionales por mi (Ul/ml); a las vacunas y gammaglobulinas de referencia se les asignó el valor de 1.
RESULTADOS
Construcción y caracterización in vitro del virus canarypox recombinante CNPV-RG
Se desarrollaron virus CNPV recombinantes que portan la secuencia codificante de la glicoproteina G del virus rábico interrumpiendo el gen viral no esencial CNPV048. Como se muestra en la Figura 2B, mediante amplificación por PCR se confirmó que los virus recombinantes CNPV-RG (clones N.° 37 y 38) portan la secuencia del gen heterólogo y se encuentran puros (ausencia de genoma viral no recombinante), ya que solo se amplificó un fragmento de 2,4 kpb correspondiente al genoma viral recombinante.
La expresión de la proteína RG se confirmó mediante Western blot utilizando un suero anti-virus rábico. La presencia de una banda reactiva de aproximadamente 60 kDa se detectó en las muestras provenientes de células infectadas con CNPV-RG, mientras que no se detectó señal en las muestras provenientes de células no infectadas o infectadas con CNPV (Figura 3). Finalmente, la estabilidad genética del virus recombinante se confirmó mediante PCR luego de 10 pasajes ciegos en FEP (resultado no mostrado). En conjunto, estos resultados demuestran que el virus recombinante CNPV-RG porta y expresa la secuencia codificante de la glicoproteína G del virus rábico.

Figura 3. Expresión de la proteína RG a partir de CNPV-RG Los extractos proteicos se analizaron mediante la técnica de Western blot. La flecha indica la banda reactiva del tamaño esperado. Los extractos proteicos se obtuvieron a partir de cultivos de BHK-21 no infectados (NI) o infectados con el clon viral N.° 37 del virus canarypox recombinante (CNPV-RG) y no recombinante (CNPV). MPM: marcador de peso molecular preteñido Page Ruler (Fermentas, EE.UU.)
Respuesta inmune y protección en ratones vacunados con CNPV-RG
La capacidad del virus recombinante CNPV-RG de inducir una respuesta inmune humoral y de conferir protección frente al desafío con virus rábico se evaluó en un primer ensayo utilizando el modelo murino, según se describe en Materiales y Métodos.
Los títulos de anticuerpos neutralizantes de RV determinados en los sueros de los ratones vacunados se muestran en la Tabla 2. La vacuna antirrábica de referencia (PV-BHK 3) indujo la síntesis de anticuerpos neutralizantes; el título observado fue mayor cuanto mayor fue la cantidad de masa antigénica administrada. Como era esperado, los sueros de los ratones no vacunados o inmunizados con el virus no recombinante CNPV no presentaron actividad neutralizante de RV, mientras que en los sueros de ratones vacunados con el virus CNPV-RG se determinaron títulos seroneutralizantes de 3,58 y 9,76 Ul/ml luego de una y dos inmunizaciones, respectivamente.
Tabla 2. Títulos de anticuerpos neutralizantes (Ul/ml) y supervivencia frente al desafío con virus rábico en ratones

En la Tabla 2 se muestran los valores de supervivencia obtenidos para cada grupo experimental luego del desafío. Todos los ratones no vacunados o vacunados con el virus CNPV murieron dentro del período de observación. En este ensayo, la vacuna antirrábica PV-BHK 3 protegió al 100 % (dilución 1:5), al 87,5 % (dilución 1:25) y al 50 % (dilución 1:125) de los animales vacunados, mientras que en el grupo de ratones inmunizados con CNPV-RG, 7 de 9 animales sobrevivieron, lo que resulta en una protección del 78 %.
A un año del desafío, se determinó que los sueros de los ratones sobrevivientes del grupo CNPV-RG presentaron actividad neutralizante del virus rábico, con un título de 7,39 Ul/ml.
Determinación de la potencia relativa del candidato vacunal CNPV-RG
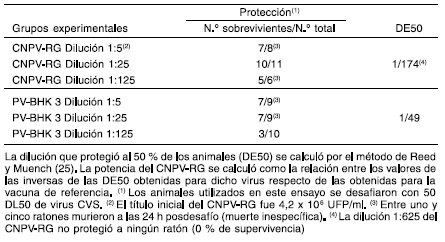
Con el objetivo de determinar la potencia relativa del virus CNPV-RG, se realizó un segundo experimento de inmunización y desafío de ratones, siguiendo el protocolo descrito en Materiales y Métodos. Este ensayo permite comparar los niveles de protección conferidos por una vacuna en estudio y una vacuna antirrábica de referencia. Luego del desafío se calculó la dilución que protegió al 50 % de los animales (DE50). En este experimento, se obtuvo un valor de 1:49 y de 1:174 para PV-BHK 3 y CNPV-RG, respectivamente. La relación entre ambos valores de DE50 permitió calcular una potencia relativa de 3,5 Ul/ml para el candidato vacunal CNPV-RG (Tabla 3).
Tabla 3. Potencia relativa del candidato vacunal CNPV-RG
DISCUSIÓN
En la actualidad, en el área de la medicina veterinaria se requieren vacunas antirrábicas que sean seguras y efectivas. Los vectores virales de expresión no replicativos constituyen la herramienta de elección para el desarrollo de nuevos inmunógenos que cumplan con este propósito. En particular, el virus canarypox cepa ALVAC, se utilizó para la expresión de la glicoproteína G del virus rábico (1, 3). Los ensayos de potencia demostraron que la eficacia protectora del virus canarypox recombinante (ALVAC-RG) fue 100 veces mayor que la de un vector basado en fowlpox (FPV-RG), pero similar a aquella del virus replicativo vaccinia, V-RG (29). Estos datos, sumados al excelente perfil de seguridad de ALVAC-RG para animales y humanos (3, 13, 28), permitieron obtener la licencia para su uso como vacuna antirrábica en gatos, en Estados Unidos y Canadá (23).
Basándonos en los buenos resultados obtenidos con ALVAC-RG, se decidió desarrollar en nuestro laboratorio un candidato vacunal utilizando la cepa Abbatista 95 del virus canarypox como vector no replicativo para la expresión de la proteína G del virus rábico. El vector viral utilizado en este trabajo fue obtenido en nuestro laboratorio y está protegido a través de la patente argentina N° AR052743B1.
La inmunidad protectora inducida por el virus CNPV-RG obtenido se evaluó en el modelo murino. La presencia de anticuerpos neutralizantes del virus rábico en los sueros de los ratones vacunados con CNPV-RG purificado indicó la correcta síntesis de novo de la glicoproteína G y su capacidad para inducir una respuesta inmune humoral, que pudo ser detectada hasta un año después de la última vacunación. Los títulos de anticuerpos neutralizantes inducidos por CNPV-RG superaron ampliamente el valor de 0,5 Ul/ mi, asociado con la protección en animales (22), y fueron altos comparados con aquellos inducidos por la vacuna antirrábica nacional de referencia. Sin embargo, la protección fue menor en los ratones vacunados con CNPV-RG que en los animales inmunizados con las diluciones 1:5 y 1:25 de la vacuna PV-BHK 3. Esto puede deberse a que no siempre existe una estricta correlación entre los niveles de anticuerpos neutralizantes y el grado de protección conferido, tal como fue descrito por Hu et al. (16).
Los resultados obtenidos en el ensayo de potencia sugieren que el candidato vacunal, producido como extracto de células infectadas con CNPV-RG, sería capaz de brindar una buena protección in vivo frente al virus rábico debido a que dicho vector presentó un valor de potencia relativa superior al de la vacuna de referencia.
Los experimentos presentados aportan datos preliminares y promisorios sobre la evaluación del virus CNPV-RG como candidato a vacuna antirrábica para uso veterinario. De todos modos, los valores de potencia relativa como así también el nivel de anticuerpos neutralizantes inducidos por este vector deberán corroborarse con un número mayor de experimentos en el modelo murino. Para ello será necesario aumentar la escala de producción de cultivos de FEP infectados con el virus CNPV-RG y establecer un protocolo de elaboración validado. Esto permitirá contar con la suficiente cantidad de inoculo para continuar con su caracterización. Se prevé analizar el perfil de seguridad del virus recombinante, la efectividad de la inmunización utilizando diferentes vías de administración, las dosis mínimas inmunizantes y protectoras, la duración de la inmunidad luego de la aplicación de una sola dosis, la utilidad del virus CNPV-RG en presencia de anticuerpos maternos antirrábicos, etc. Otro factor importante que se tendrá en cuenta será la optimización de la presentación antigénica, lo que podría conllevar un mejor reconocimiento por parte del sistema inmune y un aumento de los niveles de protección en el hospedador. En la bibliografía se ha descrito que la potencia de una vacuna antirrábica basada en vectores virales no replicativos está determinada, principalmente, por su capacidad para expresar la glicoproteína G (19). En este sentido, se demostró que la sobreexpresión de esta proteína incrementa significativamente la velocidad de aparición de la respuesta inmune humoral al virus rábico en el hospedador, así como su magnitud (4, 10). Además, existen trabajos que indican que la nucleoproteína (N) activa linfocitos T colaboradores y citotóxicos, con lo que se facilita la producción de anticuerpos neutralizantes y se potencia la respuesta inmune (14, 27, 31). Sobre la base de estos resultados, podrían obtenerse CNPV recombinantes que expresen dos copias del gen codificante de RG o que expresen simultáneamente las proteínas RG y N del virus rábico.
La rabia paralítica o paresiante es la rabia del ganado transmitida por mordedura de murciélagos hematófagos. En la República Argentina, el área endémica abarca las provincias del norte, donde la mortalidad del ganado infectado afecta la economía regional. La vacunación de los animales es voluntaria y, en general, solo se realiza cuando se detectan brotes en el campo o en las inmediaciones, y cesa una vez que el brote fue controlado, por lo cual la enfermedad reaparece una vez que transcurrió el período interepidémico. Si bien en el ganado infectado no existe transmisión horizontal de la enfermedad, este representa un riesgo para la salud pública, ya que constituye un reservorio del virus por ser la principal fuente de alimentación del vampiro. En este contexto sería interesante evaluar, a futuro, la utilidad del virus recombinante CNPV-RG para la prevención de la rabia paresiante en zonas del país actualmente endémicas, y en aquellas áreas potencialmente afectadas debido a las modificaciones en los patrones de migración de los murciélagos, que se registran a causa del cambio climático. En consecuencia, la disponibilidad de nuevas vacunas que eliminen la manipulación del agente infeccioso y que permitan el control de la enfermedad en animales de interés económico es de importancia estratégica nacional y regional.
Finalmente, podemos mencionar que el conjunto de los resultados preliminares presentados en este trabajo muestran un futuro promisorio del virus CNPV-RG como candidato a vacuna antirrábica de nueva generación para uso en el área de la medicina veterinaria.
Agradecimientos: los autores agradecen al INTA, por la financiación recibida (Proyectos Específicos AEGR 2414 y AERG 232141), al Dr. O. Zabal y su equipo, por la realización de los cultivos primarios de embrión de pollo, y a M. J. Monaco, S. Díaz, J. De Filippo y G. Fernández, por su asistencia técnica.
1. Aguilar-Setien A, CamposY, Cruz E, Kretschmer R, Brochier B, Pastoret P Vaccination of vampiro bats using recombinant vaccinia-rabies virus. J Wild Dis 2002; 38: 539-44.
2. Bout-Cararo C, Contreras V, Fournier A, Jallet C, Guibert J, Dubois E, Thiery R, Breard E, Tordo N, Richardson J, Schwartz-Cornil I, Zientara S, Klonjkowski B. Canine adenoviruses elicit both humoral and cell-mediated immune responses against rabies following immunization of sheep. Vaccine 2011; 29: 1304-10. [ Links ]
3. Cadoz M, Meignier B, Plotkin S, Strady A, Taylor J, Tartaglia J, Paoletti E, Plotkin S. Immunization with canarypox virus expressing rabies glycoprotein. Lancet 1992; 339:1429-32. [ Links ]
4. Cenna J, Tan G, Papaneri A, Dietzschold B, Schnelly M, McGettigan J. Immune modulating effect by a phosphoprotein-deleted rabies virus vaccine vector expressing two copies of the rabies virus glycoprotein gene. Vaccine 2008; 26:6405-14. [ Links ]
5. Conte Grand D. Vectores virales de expresión basados en virus canarypox recombinantes: su desarrollo y evaluación como inmunógenos derivados de patógenos de interés pecuario. Tesis doctoral. 2006; Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires.
6. Cox J, Dietzschold B, Schneider L. Rabies virus glycoprotein II. Biological and serological characterization. Infect Immun 1977;16:754-9. [ Links ]
7. Deilaporta S, Word J, Hicks J. A plant molecular DNA minipreparation, versión II. Plant Mol Biol Rep 1983; 1:12-21. [ Links ]
8. Esposito J, Brechling K, Baer G, Moss B. Vaccinia virus recombinants expressing rabies glycoprotein protect against rabies. Virus Gene 1987; 1: 7-21. [ Links ]
9. Esposito J, Knight J, Shaddock J, Novembre F, Baer G. Successful oral rabies vaccination of racoons with raccons poxvirus recombinants expressing rabies virus glycoproteins. Virology 1988; 165: 313-6. [ Links ]
10. Faber M, Pulmanausahakul R, Hodawadekar S, Spitsin S, McGetiggan J, Schnell M, Dietzchold B. Overexpression of the rabies virus glycoprotein results in enhancement of apoptosis and antiviral immune response. J Virol 2002; 76: 3374-81. [ Links ]
11. Ferrer F, Zanetti F, Calamante G. Diseño y construcción de vectores de transferencia para la obtención de virus vaccinia Ankara modificado (MVA) recombinantes. Rev Argent Microbiol 2007; 39:138-42. [ Links ]
12. Fitzgerald E. Potency test for antirabies serum and immunoglobulin.In: Meslin F, Kaplan M, Koprowski H, editors. Laboratory Techniques in Rabies, 4th edition. Geneva, World Health Organization, 1996, p. 417-22.
13. Fries L, Tartaglia J, Taylor J, Kauffman E, Meignier B, Paoletti E, Plotkin S. Human safety and immunogenicity of canarypox-rabies glycoprotein recombinant vaccine: an alternative poxvirus vector system. Vaccine 1996; 14: 428-34. [ Links ]
14. Fu Z, Dietzschold B, Schumacher C, Wunner W, Ertl, H, Koprowski H. Rabies virus nucleoprotein expressed in and purified from insect cells is efficacious as a vaccine. Proc Natl Acad Sei USA1991; 88: 2001-5. [ Links ]
15. Henderson H, Jackson F, Bean K, Panasuk B, Niezgoda M, Slate D, Li J, Dietzschold B, Mattis J, Rupprecht C. Oral immunization of raccons and skunks with a canine adenovirus recombinant rabies vaccine. Vaccine 2009; 27: 7194-7. [ Links ]
16. Hu R, Zhang S, Fooks A, Yuan H, Liu Y, Li H, Tu C, Xia X, Xiao Y. Prevention of rabies virus infection in dogs by a recombinant canine adenovirus type-2 encoding the rabies virus glycoprotein. Microb Infect 2006; 8:1090-7. [ Links ]
17. Kawano H, Mifune K, Ohuchi M, Mannen K, Cho S, Hiramatsu K, Schichijo A. Protection against rabies in mice by cytotoxic T cell clone recognizing the glycoprotein of rabies virus. J Gen Virol 1990; 71: 281 -7. [ Links ]
18. Kieny M, Lathe R, Drillien R, Spehner D, Skory S, Schmitt D, Wiktor T, Koprowski H, Lecocq J. Expression of rabies virus glycoprotein from a recombinant vaccinia virus. Nature 1984;312:163-6. [ Links ]
19. Li J, Faber M, Papaneri A, Faber M-L, McGettigan J, Schnell M, Dietzschold B. A single immunization with a recombinant canine adenovirus expressing the rabies virus G protein confers protective immunity against rabies in mice. Virology 2006; 356:147-54. [ Links ]
20. Macfarlan R, Dietzschold B, Koprowski H. Stimulation of cytotoxic T-lymphocyte responses by rabies virus glycoprotein and identification of an immunodominant domain. J Mol Immunol 1986;23:733-41. [ Links ]
21. Manual de Normas y Procedimientos para la Vigilancia, Prevención y Control de Rabia del Ministerio de Salud de la Nación, 2007; República Argentina.
22. Monaco F, Franchi P, Lelli R. Studies on an inactivated vaccine against rabies virus in domestic animals. Dev Biol (Basel) 2006;125:233-9.
23. Poulet H, Minke J, Pardo M, JuillardV, Nordgren B, Audonnet J-C. Development and registration of recombinant veterinary vaccine, the example of the canarypox vector plataform. Vaccine 2007; 25: 5606-12. [ Links ]
24. Preveo L, Campbell J, Christie B, Bibek L, Graham F. A recombinant human adenovirus vaccine against rabies. J Infect Dis 1990; 161:27-30. [ Links ]
25. Reed L, Muench H. A simple method of estimating fifty percent endpoints. Am J Hyg 1938; 27: 493-7. [ Links ]
26. Somogyi P, Frasier J, Skinner M. Fowlpox virus host range restriction: gene expression, DNA replication and morphogenesis in nonpermissive mammalian cells. Virology 1993; 197: 439-44. [ Links ]
27. Takida-SonodaY, Fujii H, Mifune K, ItoY, Hiraga M, Nishizono A, Mannen K, Minamoto N. Resistance of mice vaccinated with rabies virus internal structural proteins to lethal infection. Arch Virol 1993; 132:51-65. [ Links ]
28. Taylor J, Meignier B, Tartaglia J, Languet B, VanderHoeven J, Franchini G, Trimarchi C, Paoletti E. Biological and immunogenic properties of a canarypox-rabies recombinant, ALVAC-RG (vCP65) in non-avian species. Vaccine 1995; 13:539-49. [ Links ]
29. Taylor J, Trimarchi C, Weinberg R, Languet B, Guillemin F, Desmettre P, Paoletti E. Efficacy study on a canarypox-rabies recombinant virus. Vaccine 1991; 9:190-3. [ Links ]
30. Taylor J, Weinberg R, Languet B, Desmettre P, Paoletti E. A recombinant fowlpox virus inducing protective immunity in non-avain species. Vaccine 1988; 6: 497-503. [ Links ]
31. Tollis M, Dietzschold B, Viola C, Koprowski H. Immunization of monkeys with rabies ribonucleoprotein (RNP) confers protective immunity against rabies. Vaccine 1991; 9:134-6. [ Links ]
32. Tordo N, Bahloul C, Jacob Y, Ballet C, Perrin P, Badrane H. Rabies: epidemiological tendencies and control tools. Dev Biol (Basel) 2006; 125: 3-13. [ Links ]
33. Tulman E, Afonso C, Lu Z, Zsak L, Kutish G, Rock D.The genome of canarypox virus. J Virol 2004; 78: 353-66. [ Links ]
34. Vaccari M, Poonam P, Franchini G. Phase III HIV vaccine trial in Thailand: a step toward a protective vaccine for HIV. Expert Rev Vaccine 2010; 9: 997-1005. [ Links ]
35. Weyer J, Rupprecht C, Mans J, Viljoen G, Nel L. Generation and evaluation of a recombiant modified vaccinia virus Ankara vaccine for rabies. Vaccine 2007; 25: 4213-22.
36. Wiktor T, Gyorgy E, Schlumberger H, Sokol F, Koprowski H. Antigenic properties of rabies virus components. J Immunol 1973; 110: 269-76.
37. Wiktor T, Macfarlan R, Reagan K, Dietzschold B, Curtis P, Wunner W, Kieny M, Lathe R, Lecocq J, Mackett M, Moss B, Koprowski H. Protection from rabies by a vaccinia virus recombinant containing the rabies virus glycoprotein gene. Proc Natl Acad Sci USA 1984; 81: 7194-8. [ Links ]
38. Wiktor T, Plotkin S, Koprowski H. Rabies vaccine. En: Plotkin SA, Mortimer EA, editors. Vaccines. Saunders WB, Philadelphia, 1988, p. 474-91.
39. Wiktor T. Cell-mediated immunity and post-exposure protection from rabies by inactivated vaccine of tissue culture origin. Dev Biol Stand 1977; 40:225-30. [ Links ]
40. Wilbur L, Aubert M. The NIH test for potency. En: Meslin F, Kaplan M, Koprowski H, editors. Laboratory Techniques in Rabies, 4th edition. Geneva, World Health Organization, 1996, p. 360-8.
41. World Health Organization. WHO expert consultation on rabies. First report. (WHO technical report series, N.° 931). 2005; World Health Organization, Geneva, Switzerland.
42. WunnerW, Dletzschold B, Curtis P, Wiktor T. Rabies subunit vaccines. J Gen Virol 1983, 64: 1649-56.
43. Xuan X, Tuchiya K, Sato I, Nishikawa Y, Onoderaz Y, Takashima Y, Yamamoto A. Biological and immunogenic properties of rabies virus glycoprotein expressed by canine herpesvirus vector. Vaccine 1998; 16: 969-76. [ Links ]
44. Yuan Z, Zhang S, Liu Y, Zhang F, Fooks A, Li Q, Hu R. A recombinant Pseudorabies virus expressing rabies virus glycoprotein: Safety and immunogenicity. Vaccine 2008; 26: 1314-21. [ Links ]
Recibido: 22/3/2011 - Aceptado: 15/2/2012














