Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.44 no.2 Ciudad Autónoma de Buenos Aires abr./jun. 2012
INFORME BREVE
Aporte de la técnica de PCR en el diagnóstico de Mansonella ozzardi en zonas endémicas de la Argentina
María F. Degese*, Marta G. Cabrera, Silvio J. Krivokapich, Lucia E. Irazu, Marcelo A. Rodríguez, Eduardo A. Guarnera
Administración Nacional de Laboratorios e Institutos de Salud "Dr. Carlos G Malbrán", Instituto Nacional de Enfennedades Infecciosas, Departamento de Parasitología. Av. Vélez Sarsfield 563(1281) Ciudad Autónoma de Buenos Aires, Argentina.
*Correspondencia. E-mail: mfdegese@anlis.gov.ar
RESUMEN
Mansonella ozzardi es un nematode parásito tisular, agente etiológico de mansonellosis en casi la totalidad de los países latinoamericanos. En Argentina la mansonellosis ha sido descrita a lo largo de la región de las yungas. Su diagnóstico microscópico puede dar resultados falsos negativos en microfilaremias bajas. El objetivo del presente estudio fue optimizar su diagnóstico molecular y comparar los resultados con los obtenidos mediante las pruebas microscópicas de Knott, de gota gruesa y de extendido hemático fino, en 92 muestras de sangre de pacientes de zona endémica. La técnica de PCR seguida de la secuenciación del producto amplificado presentó una sensibilidad del 100 % frente al método de Knott, considerado como referencia, e incluso permitió identificar 7 casos más de la parasitosis.
Palabras clave: Mansonella ozzardi; Diagnóstic;, PCR; Argentina
ABSTRACT
Contribution of the PCR assay to the diagnosis of Mansonella ozzardi in endemic areas of Argentina.
Mansonella ozzardi is a tissue-dwelling parasitic nematode, the causative agent of mansonelliasis in almost all Latin American countries. It has been described along the Argentine Yungas region. The microscopic diagnosis can yield false-negative test results at low microfilaremia levels. The aim of this study was to optimize the molecular diagnostic technique and compare it with the Knott's method and standard blood smear procedures (thin blood films and thick smears) in 92 blood samples of individuals from an endemic area. The PCR technique followed by the sequencing of the amplified product yielded 100 % sensitivity compared to the Knott's test, which is considered a reference method. Seven more cases of this parasitosis could only be identified with the molecular technique.
Key words: Mansonella ozzardi; Diagnosis; PCR; Argentina
Mansonella ozzardi es un nematode filárico, agente etiológico de mansonellosis en casi la totalidad de los países latinoamericanos. Esta afección es transmitida por insectos dípteros hematófagos de los géneros Culicoides y Simulium. Los parásitos adultos, de sexo separado, miden de 3 a 7 cm y se localizan en los plexos mesentéricos; desde allí las hembras fecundadas depositan las microfilarias, de aproximadamente 200 micrones de longitud, en la sangre y, en menor número, en el tejido celular subcutáneo (3).
Las microfilarias humanas fueron descritas en la Argentina por primera vez en 1913 por Biglieri y Aráoz, en la provincia de Tucumán (2), tras un relevamiento del índice malárico en la región. Estos investigadores consideraron que se trataba de una nueva especie a la que denominaron Microfilaria tucumana. Estudios posteriores revelaron la existencia de M. ozzardi a lo largo de toda la nuboselva tucumano-oranense o región de las yungas (10). El vector identificado en esta zona es el Culicoides lahillei (5).
No se conoce una enfermedad definida atribuible a esta parasitosis. Se han descrito casos aislados con adenopatías, linfoedemas, artralgias y mialgias (3) y, en estudios recientes, ha sido asociada a la presencia de lesiones oculares (4).
Tradicionalmente, el diagnóstico se realiza a través de la observación de las microfilarias al microscopio óptico, en sangre capilar o venosa, por medio de diversos métodos, entre ellos el examen directo de la sangre o gota fresca, el examen de extendidos hemáticos en capa fina y gota gruesa teñidos con Giemsa (EF y GG, respectivamente), el método de Knott (KNOTT) y la filtración por membrana de la sangre (FM). Los tres últimos son utilizados como métodos de concentración.
Eventualmente, el diagnóstico de la mansonellosis constituye un hallazgo incidental cuando se realizan exámenes hematológicos de rutina o durante la búsqueda de otras parasitosis en extendidos sanguíneos, debido a la falta de entidad clínica.
Aun cuando el método microscópico es práctico, económico y permite identificar la especie, requiere de un observador experimentado y puede dar resultados falsos negativos en pacientes con microfilaremia baja. En un estudio reciente realizado en Brasil (11), la técnica de PCR demostró mayor sensibilidad que la FM cuando ambos métodos fueron comparados con la técnica de GG.
El objetivo del trabajo fue optimizar el diagnóstico de infección por M. ozzardi a través de una técnica de PCR y comparar los resultados con los alcanzados mediante técnicas de microscopía óptica de uso habitual en la rutina en nuestro laboratorio.
Se seleccionaron al azar 92 pacientes residentes de Sargento Moya (latitud: 27°13'59.88"S, longitud 65°32'60.00"O), departamento de Monteros, provincia de Tucumán. Este lugar forma parte de la ecorregión de las yungas, donde existe alta prevalencia de mansonellosis.
Se obtuvo sangre entera con EDTA, sangre en formol al 2 % (1 mi de sangre venosa/10 mi de formol al 2 %, para realizar KNOTT) y extendidos hemáticos de capa fina. Solo en 10 de los 92 pacientes estudiados se realizaron, además, extendidos hemáticos de gota gruesa.
Se emplearon las técnicas de EF, GG y KNOTT, esta última, con observación directa del sedimento (KNOTTD) y poscoloración de Giemsa (KNOTTG) (6).
Las muestras de sangre entera se dividieron en alícuotas, estas se colocaron en criotubos de 300 ul y se conservaron a -20 °C. Se extrajo el ADN de dichas muestras con el método de extracción de proteinasa K y fenol-cloroformo (1). El ADN obtenido se resuspendió en 30 ul de agua bidestilada estéril; la calidad y cantidad del ADN se evaluaron por electroforesis en gel de agarosa al 1 % y fluorescencia al UV con bromuro de etidio y marcadores de peso molecular. Las muestras se conservaron a 4 °C hasta su uso. Para determinar la especificidad analítica del ensayo, se extrajo ADN de larvas de Toxocara cati y Toxocara canis, de Strongyloides stercoralis y de Dirofílaria immitis.
Para la identificación de las microfilarias se utilizaron los cebadores MolTS, situado a 227 pb del extremo 3' del ITS2, y NC2, situado en el extremo 5' del ADNr 28 S, para amplificar una región del ADN ribosomal de 295 pb, específica de Mansonella ozzardi (7).
La mezcla de reacción de PCR se realizó en un volumen final de 25 ul, que contenía 2 ul de ADN templado; 0,5 U de Taq polimerasa (Invitrogen); 10 mM de Tris-HCI pH 9,6; 50 mM de KCI; 1,5 mM de MgCL, 60 uM de cada dNTP, 5 pmol de NC2 y 10 pmol de MolTS2.
Las condiciones de ciclado (termociclador Eppendorf Mastercycler Gradient) incluyeron una primera desnaturalización a 94 °C durante 120 seg, seguida por 35 ciclos de 15 seg a 94 °C (desnaturalización), 30 seg a 52 °C (hibridación) y 30 seg a 72 °C (extensión), con una extensión final de 10 min a 72 °C (7). Como control negativo se utilizó agua bidestilada estéril.
Los fragmentos de ADN amplificados por PCR fueron determinados por electroforesis en geles de agarosa al 2 % y comparados con un marcador de tamaño molecular de 100 pb (Fermentas), tras teñir con bromuro de etidio (Figura 1).
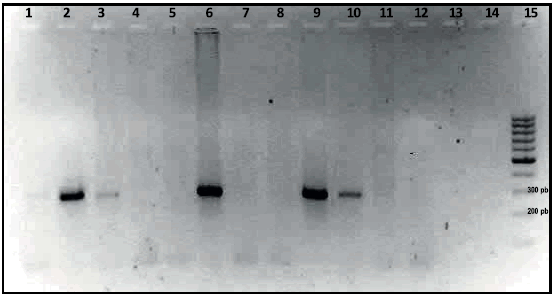
Figura 1. Electroforesis en gel de agarosa (2 %) de los productos de la PCR. Las calles 1 a 12 muestran los resultados obtenidos con las muestras N.° 3, 5, 6, 7, 9,10,11,13,15,18,19 y 20, respectivamente. Calles 13 y 14: controles negativos. Calle 15: marcador de PM (100 pb). Se observa la banda de 295 pb en las calles 1, 2, 3, 6, 9, 10 y 11
Las muestras que dieron la señal esperada fueron purificadas con columnas de purificación de productos de amplificación de PCR a partir de geles de agarosa (Nucleospin Extract II). La secuencia de nucleótidos de los productos de amplificación fue determinada por la secuenciación automática del ADN utilizando el ABI PRISM Big DyeTTerminator Cycle Sequencing Ready Reaction Kit (Perkin Elmer Applied Biosystems). La electroforesis en gel se llevó a cabo en el secuenciador automático de ADN ABI 377 (Perkin Elmer).
Los datos de secuenciación fueron analizados por el programa Chromas LITE 2.01 y las secuencias fueron alineadas y comparadas con la base de datos genética a través del programa Mega 4.O.1., para comprobar que los fragmentos de ADN amplificados de las muestras en estudio correspondían a M. ozzardi.
La secuencia nucleotídica obtenida se encuentra disponible en la base de datos GenBankcon el número de acceso JN871884.
La PCR dio la señal esperada en el 57,6 % de las muestras (53/92). El método KNOTTG arrojó resultados positivos en el 50 % de las muestras (46/ 92); el KNOTTD en el 45,6 % (42/92) y el examen de EF en el 27,2 % (25/92). Las muestras positivas por EF también lo fueron por los otros métodos, así como las muestras positivas por KNOTTD fueron positivas también por KNOTTG y PCR, y 7 muestras fueron solo positivas por PCR.
No se obtuvo señal cuando se utilizó como templado para la PCR el ADN de larvas de T. cati y T. canis, de S. stercoralis y de D. immitis.
Para la estimación del rendimiento diagnóstico de la PCR, se compararon los resultados de las muestras analizadas por PCR y por KNOTTG, este último considerado como método de referencia en nuestro laboratorio. Los resultados fueron los siguientes: sensibilidad diagnóstica del 100,0 % (IC95%: 90,4100,0), especificidad diagnóstica del 84,8 % (IC95%: 70,5-93,2); valor predictivo negativo (VPN) del 100 % (IC95%: 88,8-100,0) y valor predictivo positivo (VPP) del 86,8 % (IC95%: 74,0-94,1). Para estimar si existen diferencias en la capacidad de discriminación diagnóstica de ambos métodos se aplicó el test de Me Nemar, el que reveló diferencias significativas (p: 0,016) (Tabla 1).
Tabla 1. Rendimiento de las técnicas de PCR(1) y de KNOTTG(2) en el diagnóstico de la mansonellosis

La secuenciación de los fragmentos de ADN amplificados permitió identificarlos como pertenecientes a M. ozzardi. Los métodos microscópicos permitieron su identificación sobre la base de las características morfológicas.
Las técnicas de microscopía que concentran la muestra seguidas de la coloración de Giemsa aumentan la posibilidad de encontrar microfilarias. En este sentido, el método KNOTT dio mejores resultados que el de GG porque concentra mayor volumen de muestra, en concordancia con lo que informan otros autores (6).
El rendimiento diagnóstico de la PCR nos permite concluir que el método molecular presentó una excelente sensibilidad diagnóstica en comparación con el método de KNOTTG.
Del análisis estadístico se desprende que las diferencias significativas encontradas (Me Nemar: p < 0,05) se deben a las discrepancias observadas en 7 muestras, que fueron negativas por KNOTTG y positivas por PCR.
Para intentar comprender la causa de estas diferencias, se tuvo en cuenta el análisis de secuenciación de los fragmentos de ADN amplificados por PCR. Los resultados mostraron que, efectivamente, las 7 muestras eran de M. ozzardi, es decir, que estas muestras no arrojaron resultados falsos positivos de la PCR, sino que dieron resultados falsos negativos de KNOTTG. Además, no se observaron señales positivas de la PCR con otros nematodes ensayados, lo que indicaría una buena especificidad analítica del método.
Este hallazgo representa un aporte de las técnicas de biología molecular en la optimización del diagnóstico de infección por M. ozzardi. Este método pudo identificar 7 casos positivos que no habían sido detectados por los métodos tradicionales ensayados. Otros autores han demostrado la mayor sensibilidad de esta técnica comparada con la de FM (11).
La mayor sensibilidad de la PCR hace posible la búsqueda del parásito en una pequeña fracción de muestra y permite llegar a un diagnóstico específico a través del análisis de secuenciación del producto obtenido. Los métodos microscópicos suelen requerir pasos previos de concentración de un volumen considerable de muestra.
En pacientes con sospecha de la enfermedad por residir en sitios endémicos, la PCR permitió diagnosticar la infección en casos donde la microscopía fue negativa, probablemente debido a una microfilaremia baja.
Se sugiere considerar esta prueba en el diagnóstico de infección por M. ozzardi, principalmente en estudios epidemiológicos tendientes a conocer la prevalencia de la infección, para avanzar en el conocimiento de esta parasitosis.
1. Angel SO, Matrajt M, Margarit J, Nigro M, lllescas E, Pszenny V, Amendoeira R, Guarnera E, Garberi JC. Screening for active toxoplasmosis in human patients by DNA hybridizations with ABGTg7 probe in blood samples. J Clin Microbiol 1997; 35: 591-5. [ Links ]
2. Araoz R, Biglieri JM. Casos de microfilaria observados por primera vez en Tucumán. An Dept Nac Higiene 1915; 22:151-9. [ Links ]
3. Botero O, Restrepo M. Mansonellosis. En: Botero O, Restrepo M, editores. Parasitosis humanas, 3a edición. Medellín, Colombia, 1998, p. 304-5.
4. Cohen JM, Ribeiro JA, Martins M. Ocular manifestations in mansonelliasis. Arq Bras Oftalmol 2008; 71:167-71. [ Links ]
5. Dantur Juri M J. Entomological aspects of f ilariasis in Argentina. I Congreso Internacional de Zoonosis y Enfermedades Emergentes, 2011, Resumen 29058, p. 98, Ciudad Autónoma de Buenos Aires, Argentina.
6. Medios auxiliares para el diagnóstico de las infecciones filáricas. Organización Mundial de la Salud, 1997.
7. Morales-Hojas R, Post RJ, Shelley AJ, Maia-Herzog M, Coscaron S, Cheke RA. Characterisation of nuclear ribosomal DNA sequences from Onchocerca volvulus and Mansonella ozzardi (Nematoda: Filarioidea) and development of a PCR-based method for their detection in skin biopsies. Int J Parasitol 2001;31:169-77. [ Links ]
8 Newton LA, Chilton NB, Beveridge I, Gasser RB. Systematic relationships of some members of the genera Oesophagos-tomum and Chabertia (Nematoda: Chabertiidae) based on ribosomal DNA sequence data. Int J Parasitol 1998; 28: 1781-9.
9. Taranto N. Microfilaria tucumana (Mansonella ozzardi}. En: El niño enfermo. Segunda Cátedra de Pediatría. Facultad de Ciencias Médicas. Universidad Nacional de Rosario. Tomo 1, editorial de la UNR, 2005,221.
10. Taranto N, Castelli E. Detección de un foco de microfilarias en el noroeste argentino. Rev Argent Microbiol 1988; 20:49-51. [ Links ]
11. Vera U, Basano Sde A, Camargo Jde S, Franga AK, Ferreira Rde G, Casseb AA, Medeiros JF, Fontes G, Camargo LM. Improvement of a PCR test to diagnose infection by Mansonella ozzardi. Rev Soc Bras Med Trap 2011; 44: 380-2. [ Links ]
Recibido:25/10/2011 - Aceptado: 18/4/2012














