Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541
Rev. argent. microbiol. vol.44 no.4 Ciudad Autónoma de Buenos Aires Dec. 2012
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Campylobacter spp.: prevalencia y caracterización feno-genotípica de aislamientos de pacientes con diarrea y de sus mascotas en la provincia de La Pampa, Argentina
Ana L. Tamborini1*, Luis M. Casabona1, María R. Viñas2, Valeria Asato2, Alicia Hoffer2, María I. Farace2, María C. Lucero2, Alejandra Corso2, Mariana Pichel2
1Servicio de Bacteriología, Establecimiento Asistencial "Dr. Lucio Molas", Raúl B. Díaz y Pilcomayo, Santa Rosa, La Pampa (L6300);
2Departamento de Bacteriología, Instituto Nacional de Enfermedades Infecciosas ANLIS "Dr. Carlos G. Malbrán", Av. Vélez Sarsfeld 563 (1281) CABA, Argentina.
*Correspondencia. E-mail: anatamborini@hotmail.com
RESUMEN
Se investigó la prevalencia de Campylobacter spp. en 327 pacientes con diarrea y en 36 animales (perros, gatos y pollos) que convivían con pacientes en los que se detectó este patógeno; el estudio se llevó a cabo en Santa Rosa, La Pampa, Argentina. Se aisló Campylobacter spp. en 50/327 pacientes y en 12/36 animales, Campylobacter jejuni fue la especie más frecuente. Se detectó resistencia a ciprofoxacina (65 %) y a tetraciclina (32 %) en una selección de 35 aislamientos de origen humano. En el análisis por electroforesis de campo pulsado de 13 aislamientos de C. jejuni se identificaron siete subtipos genéticos. Dos subtipos agruparon aislamientos de pacientes y de sus respectivos perros, y un tercer subtipo agrupó 1 aislamiento humano y 2 de pollos de ese paciente. Si bien las aves son reconocidas como el principal reservorio, es importante fortalecer la vigilancia de Campylobacter spp. en mascotas, las cuales pueden ser portadores asintomáticos del patógeno.
Palabras clave: Campylobacter spp.; Diarrea; Mascotas; Subtipos genéticos.
ABSTRACT
Campylobacter spp.: prevalence and pheno-genotypic characterization of isolates recovered from patients suffering from diarrhea and their pets in La Pampa Province, Argentina. The prevalence of Campylobacter spp. was investigated in 327 patients suffering from diarrhea and in 36 animals (dogs, cats and chickens) owned by the patients that presented infection by Campylobacter in Santa Rosa, La Pampa, Argentina. Campylobacter spp. was isolated in 50/327 patients and in 12/36 animals, being Campylobacter jejuni the most common species. Resistance to ciprofoxacin (65 %) and tetracycline (32 %) was found among 35 isolates of human origin studied. Seven genetic subtypes were observed among 13 C. jejuni isolates by pulsed feld gel electrophoresis. Two subtypes grouped isolates belonging to patients and their respective dogs whereas another subtype grouped one isolate of human origin and two isolates from the patient´s chickens. The results of this investigation highlight the need to strengthen surveillance of Campylobacter spp. not only in poultry, which is recognized as the main reservoir, but also in pets, which were shown to be asymptomatic carriers of the pathogen.
Key words: Campylobacter spp.; Diarrhea; Pets; Genetic subtypes.
La campilobacteriosis es una zoonosis de distribución mundial. Campylobacter spp. se halla habitualmente como comensal del tracto gastrointestinal de animales domésticos y salvajes, entre los cuales las aves de corral constituyen el principal reservorio y vehículo de transmisión del patógeno (1, 6). Muchos casos de enteritis humana por Campylobacter spp. han sido asociados al contacto con animales o al consumo de agua contaminada, de leche cruda o de alimentos de origen animal parcialmente cocidos. Las especies termotolerantes, Campylobacter jejuni y Campylobacter coli, son
Campylobacter spp. en humanos y mascotas las más frecuentemente aisladas en casos de diarrea aguda en el hombre (6). En nuestro medio, la distribución de este microorganismo en el ambiente y en otros huéspedes animales (mascotas) no ha sido ampliamente estudiada (6, 8).
Entre los anos 2009 y 2010, Campylobacter spp. fue reconocido como el principal agente etiológico en pacientes con diarrea en el Establecimiento Asistencial "Dr. Lucio Molas" (datos no publicados). A partir de estos antecedentes, se plantearon como objetivos del presente trabajo conocer la prevalencia de Campylobacter spp. como causal de diarrea aguda en humanos y caracterizar feno-genotípicamente los aislamientos recuperados de muestras clínicas de origen humano y de aves (pollos) y animales domésticos (perros y gatos) que convivían con los pacientes infectados, considerados estos últimos como posibles vías de transmisión del microorganismo. Este estudio comprendió la población de distintos barrios de la ciudad de Santa Rosa (La Pampa, Argentina) y fue de tipo descriptivo, de corte transversal. Desde el 1 de octubre de 2010 hasta el 1 de octubre de 2011 se realizaron 327 coprocultivos de muestras correspondientes a pacientes con diarrea aguda, que concurrieron al Servicio de Bacteriología del Hospital "Dr. Lucio Molas", previa consulta médica y consignación de datos filiatorios. El rango etario de los pacientes estuvo comprendido entre 2 meses y 59 anos, el 61,7 % de ellos eran menores de 4 anos.
Las muestras de materia fecal fueron procesadas para la búsqueda de enteropatógenos bacterianos. En aquellos pacientes con aislamiento positivo para Campylobacter spp., se realizó una visita a las viviendas, una encuesta y posteriormente hisopados rectales de mascotas y aves que compartían el espacio físico con los pacientes.
Las muestras de los pacientes y los hisopados de origen animal se cultivaron en medio selectivo para Campylobacter spp. (Campylosel Agar-bioMerieux, Marcy/Etoile, Francia) y se incubaron en atmósfera de microaerofilia (GENbox microaer bioMerieux) durante 48 h a 42 oC. La identificación presuntiva se realizó mediante un examen en fresco de las colonias aisladas y coloración de Gram. Los aislamientos se caracterizaron por pruebas bioquímicas convencionales: catalasa, citocromo oxidasa, hidrólisis del indoxil acetato e hidrólisis del hipurato (5). Las especies identificadas fenotípicamente fueron confirmadas por PCR múltiple como C. jejuni y C. coli, según el protocolo de PCR de la Red WHO Global Foodborne Infections Network América del Sur (14). La extracción de ADN se realizó por hervido a partir de aislamientos caracterizados fenotípicamente como C. jejuni y C. coli.
Se determinó la sensibilidad a los antimicrobianos por el método de dilución en agar según el documento M45-A2 del CLSI; las drogas evaluadas fueron eritromicina, tetraciclina, ciprofoxacina, gentamicina y nitrofurantoína (3). Para la interpretación de los resultados con las primeras tres drogas se utilizaron los puntos de corte sugeridos en la Tabla 4 del citado documento, mientras que para la nitrofurantoína y la gentamicina, no incluidas en dicha tabla, se utilizaron los puntos de corte para Enterobacteriaceae de la Tabla 2A, M100-S22 (4), como lo sugiere la literatura internacional. Por consenso y en el marco del Programa Nacional de Vigilancia de la Resistencia a los Antimicrobianos WHONET - Grupo Campylobacter, se enviaron al INEI-ANLIS "Dr. Carlos G. Malbrán" los cinco primeros aislamientos de cada mes de origen humano; además, se remitió una selección de aislamientos de origen animal vinculados con los casos.
A fin de determinar la posible relación genética entre los aislamientos, se analizó una selección de 13 aislamientos de C. jejuni y 2 de C. coli de origen humano y/o provenientes de animales con evidencia de contacto (Tabla 1). Se aplicó el protocolo estandarizado de electroforesis en campo pulsado (PFGE) de la red PulseNet Internacional con la enzima de restricción SmaI, considerada como una técnica de poder discriminatorio para la subtipificación molecular de Campylobacter spp. (11, 13). Los resultados obtenidos fueron analizados usando el software BioNumerics v. 4.6 (Applied Maths) y los dendrogramas se construyeron aplicando el coeficiente de Dice, método UPGMA. La interpretación de los perfiles genéticos fue realizada teniendo en cuenta la robustez de la técnica de subtipificación, la diversidad genética del microorganismo en estudio, la prevalencia de cada patrón en el país y el contexto epidemiológico del estudio (2).
Tabla 1. Selección de aislamientos de C. jejuni y C. coli de origen humano y animal analizados por PFGE
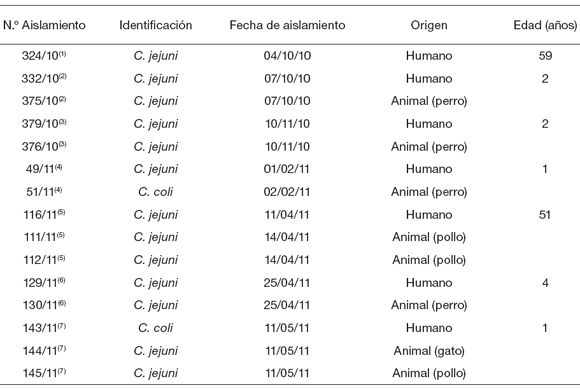
(1) Este paciente tenía contacto con una mascota (perro), pero el aislamiento de origen animal no fue recuperable para el análisis por PFGE; (2), (3), (4), (5), (6), (7) cada número agrupa aislamientos de origen humano y de sus respectivas mascotas y/o pollos.
Con fines comparativos y de interpretación de resultados, los perfiles genéticos obtenidos se compararon con aquellos ingresados en la Base de Datos Nacional (BDN) de subtipos de C. jejuni y C. coli. Esta base contiene información recopilada desde el año 2005 hasta 2011 de casos esporádicos y asociados a brote, y de aislamientos de origen animal (aves) procedentes de diferentes provincias argentinas, en el marco de la Red Nacional de Diarreas y Patógenos Bacterianos de Transmisión Alimentaria.
Se aisló Campylobacter spp. en 50 de 327 muestras de origen humano (15,2 %). Otros enteropatógenos identificados fueron Shigella spp. (12,5 %), Salmonella spp. (8 %), Escherichia coli enteropatógeno (EPEC) (2,4 %) y Escherichia coli enterohemorrágico (EHEC) (0,9 %). Las especies de Campylobacter encontradas fueron C. jejuni (n = 48) y C. coli (n = 2). Los resultados de la prueba de hidrólisis del hipurato de dos aislamientos de C. jejuni fueron de difícil interpretación, pero su identificación fue confirmada por PCR. De los 50 pacientes cuyos aislamientos fueron positivos para Campylobacter spp., 39 (78 %) eran menores de 4 anos; 40 (80 %) tenían animales (perros, gatos, pollos), 6 (12 %) no tenían animales y 4 (8 %) no pudieron ser encuestados. De 36 animales hisopados se aisló Campylobacter spp. en 12 muestras (33,3 %); 11 de estas contenían C. jejuni y la otra C. coli.
Se observó un 65 % de resistencia a ciprofoxacina y un 32 % de resistencia a tetraciclina en los 35 aislamientos de origen humano analizados. No se detectó resistencia a eritromicina, nitrofurantoína y gentamicina (Tabla 2). Los aislamientos de origen animal presentaron el mismo perfil de sensibilidad que aquellos genéticamente relacionados de origen humano (Figura 1).
Tabla 2. Perfil de sensibilidad a los antimicrobianos de aislamientos de C. jejuni y C. coli de origen humano (n = 35)

ATB: antimicrobiano; ERI: eritromicina, CIP: ciprofoxacina, TET: tetraciclina, NIT: nitrofurantoína, GEN: gentamicina; R: resistente según, (1) los puntos de corte para Campylobacter spp. establecidos por el CLSI (3); (2) los puntos de corte para Enterobacteriaceae establecidos por el CLSI (4). No se detectaron aislamientos con sensibilidad intermedia.
Dendograma 1

Dendograma 2

Figura 1. Análisis de los patrones genéticos de aislamientos de C. jejuni (dendograma 1) y de C. coli (dendograma 2) de origen humano y animal obtenidos por PFGE-SmaI y perfiles de resistencia a antimicrobianos. Se indican con recuadros los aislamientos de C. jejuni de origen humano y animal que fueron agrupados en clusters o grupos con idéntico perfil de PFGE. CIP: ciprofoxacina, TET: tetraciclina, R: resistente, S: sensible.
En el análisis por PFGE-SmaI de 13 aislamientos de C. jejuni se identificaron siete subtipos genéticos. Dos de los subtipos, denominados ARDBRS16.00128 y ARDBRS16.0022, agruparon aislamientos de un paciente y de su correspondiente mascota (perro), el patrón ARDBRS16.022 agrupó, además, un aislamiento recuperado de un ave no relacionada. El subtipo ARDBRS16.0080 agrupó un aislamiento de origen humano, dos de aves de dicho paciente y uno de una mascota (gato) correspondiente a otro paciente. Los restantes aislamientos presentaron cuatro perfiles genéticos diferentes, dos de ellos con mayor similitud al patrón ARDBR16.0022 (Figura 1). Al comparar con la BDN, se observó que 2 de los 7 subtipos genéticos de C. jejuni, ARDBRS16.0022 y ARDBRS.0080, habían sido determinados en otras provincias de Argentina en aislamientos de origen humano, en particular en Buenos Aires, Córdoba, Neuquén, Río Negro y Santa Fe; estas tres últimas provincias eran las de mayor representación dentro de la BDN. Los dos aislamientos de C. coli mostraron patrones de PFGE diferentes entre sí, los que fueron identificados anteriormente en aislamientos humanos y de aves de otras provincias.
En el período analizado, Campylobacter spp. fue el enteropatógeno más frecuentemente aislado en los casos de diarrea del Hospital "Dr. Lucio Molas". La especie predominante fue C. jejuni, y los menores de 4 anos fue el grupo etario más afectado. Estos datos son comparables con los comunicados en otros países (1). La PCR múltiple permitió confirmar las especies de Campylobacter spp. caracterizadas fenotípicamente y resultó útil para la identificación de aislamientos con resultados de difícil interpretación en la prueba de hidrólisis del hipurato (7).
Los altos porcentajes de resistencia a ciprofoxacina y a tetraciclinas detectados coinciden con los observados a nivel nacional (9). Otros autores sugieren que los niveles de resistencia a fuoroquinolonas podrían estar relacionados con el uso de estos antimicrobianos en veterinaria (12). No se detectaron aislamientos resistentes a eritromicina ni a nitrofurantoína, mientras que en el resto del país se han informado muy bajos porcentajes de resistencia a macrólidos (3 %) y no se ha registrado resistencia a nitrofuranos (9). Sobre la base de estos resultados preliminares, la eritromicina podría utilizarse en nuestra población como droga de primera elección para el tratamiento de aquellas diarreas graves por Campylobacter spp. que lo requieran, en concordancia con informes de otras partes del mundo (10, 12).
La relación genética observada entre los aislamientos de pacientes y de sus mascotas sugiere la posible exposición a una misma fuente de infección a través de la alimentación, o bien, la transmisión de C. jejuni entre los pacientes y sus mascotas, como lo demostraron Wolfs et al. al informar el primer caso comprobado genéticamente de transmisión de C. jejuni entre animales y seres humanos (15). La identificación de subtipos genéticos de C. jejuni compartidos por distintos huéspedes y encontrados en diferentes provincias y anos sugiere la circulación en el país de aislamientos con potencial de diseminación y transmisibilidad entre distintos huéspedes.
Estos resultados plantean la necesidad de fortalecer la vigilancia y el control de Campylobacter spp., considerando no solo el estudio de las aves reconocidas como principal reservorio a nivel mundial, sino también el de otros animales que podrían estar en contacto con las personas, como las mascotas (perros y gatos), ya que estas fueron evidenciadas como portadores asintomáticos del patógeno. El contacto con estos animales podría constituir un factor de riesgo para la infección, agravado en zonas con hábitos higiénicos deficientes.
A partir de los hallazgos presentados, es importante promover la integración de las áreas de trabajo de laboratorio, clínica humana y veterinaria, con el objetivo de contar con estudios epidemiológicos completos de vigilancia e investigación de brotes en el país, que permitan determinar fuentes de infección y vías de transmisión del microorganismo, para la toma de medidas oportunas de prevención y control.
Agradecimientos: al personal del Servicio de Bacteriología del Hospital "Dr. Lucio Molas" por su colaboración. Al Dr. Marcos Mayer y a la Dra. Claudia Elorza, por la revisión del manuscrito.
1. Acke E, Carroll C, O'Leary A, McGill K, Kelly L, Lawlor A, Madden R, Moran L, Scates P, Mc Namara E, Moore J, Jones B, Seamus F, Whyte P. Genotypic characterization and cluster analysis of Campylobacter jejuni isolates from domestic pets, human clinical cases and retail food. Ir Vet J 2011; 64: 6. [ Links ]
2. Barrett TJ, Gerner-Smidt P, Swaminathan B. Interpretation of pulsed-feld gel electrophoresis patterns in foodborne disease investigations and surveillance. Foodborne Pathog Dis 2006; 3: 20-31. [ Links ]
3. Clinical and Laboratory Standards Institute. Methods for antimicrobial dilution and disk susceptibility testing of infrequently isolated or fastidious bacteria; approved guideline. Second edition, 2010; M45-A2.Wayne, PA, EEUU. [ Links ]
4. Clinical and Laborator y Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; 22th Informational Supplement, 2012; M100-S22.Wayne, PA, EEUU. [ Links ]
5. Farace M, Vinas M. Manual de procedimientos para el aislamiento y caracterización de Campylobacter spp. Departamento de Bacteriología. Instituto Nacional de Enfermedades Infecciosas. ANLIS "Dr. Carlos G. Malbrán" Centro Regional de Referencia WHO-Global Salm Surv para América del Sur, 2007, p. 5-33. [ Links ]
6. Fernández H, Kahler K, Salazar R, Ríos M. Prevalence of thermotolerant species of Campylobacter and their biotypes in children and domestic birds and dogs in southern Chile. Rev Inst Med Trop Sao Paulo 1994; 36: 433-6. [ Links ]
7. Giacoboni G, Echeverria MG, Perfumo C. Aplicación de PCR-RFLP para subtipificar Campylobacter jejuni. Rev Argent Microbiol 2005; 37: 81-3. [ Links ]
8. López C, Agostini A, Giacoboni G, Cornero F, Tellechea D. Campilobacteriosis en una comunidad de bajos recursos de Buenos Aires, Argentina. Rev Sci Tech Off Int Epiz 2003; 22: 1013-20. [ Links ]
9. Lucero MC, Hoffer A, Veliz O, Albornoz E, Guerreiro L, Galas M, Farace MI, Grupo Campylobacter, Corso A. Perfil de sensibilidad a los antimicrobianos en aislamientos de origen humano de Campylobacter jejuni y Campylobacter coli en Argentina: Vigilancia nacional 2007-2010. VII Congreso de la Sociedad Argentina de Bacteriología, Micología, Parasitología Clínicas (SADEBAC). Rev Argent Microbiol 2012; 44 Supl 1: 58. [ Links ]
10. Nachamkin I, Engberg J, Aarestrup FM. Diagnosis and antimicrobial susceptibility of Campylobacter species. En: Nachamkin I, Blaser M, editors. Campylobacter. 2nd Edition. Washington DC, ASM Press, 2000, p. 45-66. [ Links ]
11. Newell DG, Frost JA, Duim B, Wagenaar JA, Madden RH, Van der Plas J, On SLW. New developments in the subtyping of Campylobacter species. En: Nachamkin I, Blaser M, editors. Campylobacter. 2nd Edition. Whashington DC, ASM Press, 2000, p. 27-44. [ Links ]
12. Payot S, Bolla J, Corcoran D, Fanning S, Mgraud F, Zhang Q. Mechanism of fuoroquinolone and macrolide resistance in Campylobacter spp. Microbes Infect 2006; 8: 19 67-72. [ Links ]
13. Ribot EM, Fitzgerald C, Kubota K, Swaminathan B, Barrett TJ. Rapid pulsed-feld gel electrophoresis protocol for subtyping of Campylobacter jejuni. J Clin Microbiol 2001; 39: 1889-94. [ Links ]
14. Wagenar J, Van Bergen M. Multiplex PCR for differentiation of C. coli and C. jejuni. Global Salm-Surv. A global Salmonella surveillance and laboratory support project of the World Health Organization. Laboratory Protocols. Level 4 Training Course 1 Ed. February 2003. [On-line] http://www.antimicrobialresistance.dk/data/images/training%20course%20-%20level%203+4pdf.pdf. [ Links ]
15. Wolfs T, Duim B, Geelen S, Rigter A, Thomson-Carter F, Fleer A, Wagenaar J. Neonatal sepsis by Campylobacter jejuni: genetically proven transmission from a household puppy. Clin Infect Dis 2001; 32: 97-9. [ Links ]
Recibido: 17/1/2012
Aceptado: 31/10/ 2012














