Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.45 no.1 Ciudad Autónoma de Buenos Aires mar. 2013
MICROBIOLOGÍA CLÍNICA Y ENFERMEDADES INFECCIOSAS
Aislamientos bacterianos de muestras respiratorias de pacientes pediátricos con fibrosis quística y su distribución por edades
Natalia P. Busquets1*, María R. Baroni1, María C. Ochoteco1, María L. Zurbriggen1, Stella Virgolini1, Fernando G. Meneghetti2
1Sección Bacteriología y
2Unidad de Fibrosis Quística del Hospital de Niños "Dr. Orlando Alassia". Mendoza 4151 (3000) Santa Fe, Argentina.
*Correspondencia. E-mail: npbusquets@yahoo.com.ar
RESUMEN
Se investigaron los microorganismos aislados de muestras respiratorias de 50 pacientes pediátricos con fibrosis quística. Se analizó la distribución por edades y se examinó la resistencia a los antimicrobianos, la intermitencia de los aislamientos y la presencia de coinfecciones. Se aisló Staphylococcus aureus en el 72 % de los pacientes, seguido de Pseudomonas aeruginosa (58 %), Haemophilus influenzae (56 %) y complejo Burkholderia cepacia (12 %). Encontramos baja frecuencia de aislamientos de P. aeruginosa resistentes a los antibióticos p-lactámicos (13,8 %). El 50,0 % de S. aureus fue resistente a la meticilina. El 57,1 % de H. influenzae fue resistente a la ampicilina por producción de ß-lactamasa. En niños menores de 4 años predominó S. aureus, seguido de P. aeruginosa y H. influenzae. Este orden se observó en todos los grupos etarios analizados, excepto en el de los niños de 10 a 14 años. Los aislamientos de Stenotrophomonas maltophilia y Achromobacter xylosoxidans fueron intermitentes y estuvieron acompañados por otros microorganismos. En suma, en este estudio observamos una gran variedad de especies bacterianas, lo que impone la necesidad de realizar rigurosos estudios microbiológicos en los materiales respiratorios de estos pacientes.
Palabras clave: Fibrosis quística; Patógenos respiratorios.
ABSTRACT
Bacterial isolates from respiratory samples of pediatric patients with cystic fibrosis and their distribution by ages. The bacterial isolates from respiratory samples of 50 pediatric patients with cystic fibrosis, their distribution by ages and antimicrobial resistance pattern as well as the intermittence of isolations and coinfections, were investigated. Staphylococcus aureus was isolated in 72 % of patients, followed by Pseudomonas aeruginosa (58 %), Haemophilus. influenzae (56 %), and the Burkholderia cepacia complex (12 %). The frequency of resistance of P. aeruginosa isolates to ß-lactam antibiotics was low (13.8 %). Fifty percent of S. aureus isolates was methicillin-resistant, and 57.1 % of H. influenza was ampicillin-resistant due to ß-lactamase production. In children under 4 years-old, S. aureus was predominant, followed by P. aeruginosa and H. influenzae. This order of predominance was observed in all the groups studied, except in that of children between 10 and 14 years-old. Stenotrophomonas maltophilia and Achromobacter xylosoxidans isolates were intermittent and accompanied by other microorganisms. Finally, we observed a great variety of bacterial species, which imposes stringent performance requirements for microbiological studies in all respiratory samples of these patients.
Key words: Cystic fibrosis; Respiratory pathogens.
La fibrosis quística (FQ) es la enfermedad autosómica recesiva más frecuente en la población blanca (13). El defecto genético se debe a mutaciones en un gen del brazo largo del cromosoma 7; dicho gen codifica al regulador de la conductancia transmembrana de la FQ (CFTR). Este regulador interviene en el balance de fluidos a través de las células epiteliales, actúa como un canal para el pase del cloro e inhibe la absorción de sodio (13, 14). La deficiencia de CFTR se asocia al transporte disminuido de cloro, sodio y agua a través de las células, lo que da lugar a manifestaciones en muchos
Aislamientos bacterianos en pacientes fibroquísticos órganos y sistemas (13). En el aparato respiratorio se producen secreciones mucosas deshidratadas, extremadamente viscosas, que obstruyen las vías aéreas y secundariamente se infectan.
La infección pulmonar es una de las causas más importantes de morbilidad y mortalidad en el paciente con FQ. A edades tempranas los pacientes con FQ pueden ser infectados por virus, los que favorecerían la destrucción del epitelio respiratorio y estimularían la atracción de los neutrófilos con la producción de factores proinflamatorios (4). Se ha sugerido que las infecciones virales pueden predisponer a la colonización y sobreinfección bacteriana y están directamente implicadas en las exacerbaciones pulmonares.
La enfermedad broncopulmonar es la causa de muerte en el 95 % de los pacientes con FQ. Los organismos bacterianos más frecuentemente aislados son Pseudomonas aeruginosa, Staphylococcus aureus y Haemophilus influenzae (3). A diferencia de otras enfermedades, la FQ exhibe una clara distribución de gérmenes adquiridos en función de la edad. S. aureus es usualmente el primer patógeno aislado de la vía aérea de los pacientes con FQ, con una tasa de infección que disminuye con la edad, mientras que por su parte, la tasa de P. aeruginosa se incrementa. La presencia de S. aureus en el tracto respiratorio en forma intermitente obliga a su erradicación completa por ser quien mayor destrucción produce en la vía aérea. A través de la presencia primaria de S. aureus en el tracto respiratorio en forma intermitente, P. aeruginosa ve facilitada su entrada y posterior colonización. Si bien ambas bacterias pueden coexistir, el desarrollo abundante de P. aeruginosa puede inhibir el crecimiento de S. aureus (10).
En los últimos años se ha incrementado el aislamiento de otros patógenos, como Stenotrophomonas maltophilia, complejo Burkholderia cepacia y Achromobacter xylosoxidans. Más recientemente y debido a la aplicación de las técnicas de biología molecular en el diagnóstico, se ha comunicando la identificación de nuevos microorganismos en las secreciones respiratorias de estos pacientes, aunque su rol patogénico es incierto. Entre ellos se destacan Inquilinus limosus y diversas especies de los géneros Pandoraea, Ralstonia y Burkholderia. Además, es relativamente frecuente el aislamiento de otros microorganismos como las micobacterias ambientales. Otros patógenos que pueden encontrarse de forma ocasional en las secreciones del paciente con FQ son las enterobacterias, aunque muy rara vez colonizan crónicamente el árbol bronquial (9).
Es habitual que inicialmente el aislamiento de las bacterias sea intermitente, pero con el tiempo se puede producir una infección crónica que es importante evitar o retrasar mediante el tratamiento adecuado (10). Cabe aclarar que utilizando un criterio microbiológico, nos referimos a cultivos intermitentes cuando estos son alternadamente positivos y negativos para un mismo microorganismo en muestras consecutivas, con al menos un mes de diferencia entre la toma de ellas (12).
El propósito de este estudio fue identificar en los materiales respiratorios de niños con FQ a los microorganismos más frecuentemente aislados, estudiar su distribución por edades y la resistencia a los antimicrobianos. También se examinó la presencia de bacilos gram negativos no fermentadores (BGNNF) distintos de P. aeruginosa en relación con la edad de los pacientes, la intermitencia de los aislamientos y las coinfecciones con microorganismos considerados patógenos por excelencia.
Se realizó un estudio retrospectivo sobre muestras de esputo, aspirados nasofaríngeos (ANF) e hisopados faríngeos, en el período comprendido entre enero de 2006 y diciembre de 2011. Las muestras pertenecían a 50 pacientes (26 varones y 24 mujeres) con diagnóstico de FQ, con edades comprendidas entre 2 meses y 18 años, atendidos en el Hospital de Niños "Dr. O. Alassia" de la ciudad de Santa Fe.
Las muestras respiratorias fueron sembradas en agar base Columbia con 5 % de sangre de carnero, agar chocolate y agar CLDE (bioMérieux, Brasil S.A.), con el agregado de gentamicina (25 |jg/ml) y colistina (70 |jg/ml), e incubadas a 37 °C de 5 a 7 días. Los dos primeros medios de cultivo se incubaron en atmósfera de CO2 al 5 % y el agar CLDE en aerobiosis. También se realizaron las coloraciones de Gram y Ziehl-Neelsen en los esputos y ANF. La identificación de los microorganismos se realizó con los métodos automatizados Vitek-1 o Vitek-2 Compact (bioMérieux, Marcy l'Etoile, Francia), con pruebas bioquímicas convencionales o con los métodos comerciales API 20 NE y API NH (sistemas de identificación multipruebas- bioMérieux); en algunos casos se usó una combinación de técnicas. El aislamiento de I. limosus se derivó al Servicio Bacteriología Especial del INEI- ANLIS "Dr. Carlos G. Malbrán" para la identificación molecular. La identificación de BGNNF distintos de P. aeruginosa se realizó por dos métodos diferentes. Las pruebas de sensibilidad a los distintos antibacterianos se realizaron por métodos automatizados y por el método de difusión con discos (BD -Becton Dickinson and Company- BBL, Sparks, EE.UU.), según las normas del Clinical and Laboratory Standards Institute (CLSI). Para evaluar la resistencia a la meticilina en S. aureus se utilizó el disco de cefoxitina de 30 ug (BD, BBL). En H. influenzae, la detección de ß-lactamasa se realizó por el método de la cefalosporina cromógena (Cefinase-BD, BBL). Cabe aclarar que para la detección de la resistencia a la ampicilina no se realizó el método de difusión con disco debido a que no disponemos del medio recomendado por el CLSI.
De los 50 pacientes estudiados, solo en 3 casos nunca se aislaron microorganismos implicados en la colonización-infección broncopulmonar crónica.
El porcentaje de pacientes colonizados-infectados por diferentes microorganismos se aprecia en la Figura 1. El 41,4 % de los pacientes colonizados-infectados por P. aeruginosa presentó el fenotipo mucoso. En la Figura 2 se observa la prevalencia puntual de los distintos agentes de colonización-infección bacteriana -no siempre monomicrobiana-en los diferentes grupos etarios evaluados. Los porcentajes de resistencia a los antibacterianos presentados por S. aureus y P. aeruginosa se muestran en las Tabla 1.
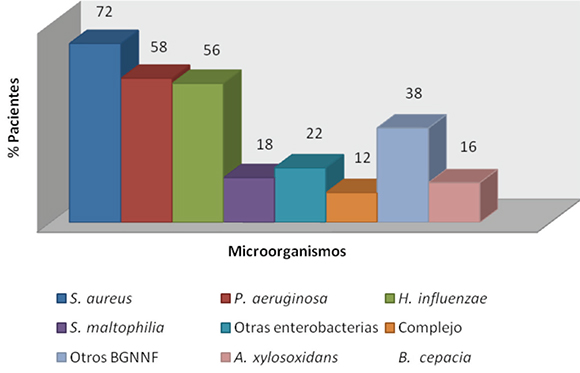
Figura 1. Porcentaje de pacientes colonizados-infectados (n = 50) por diferentes microorganismos
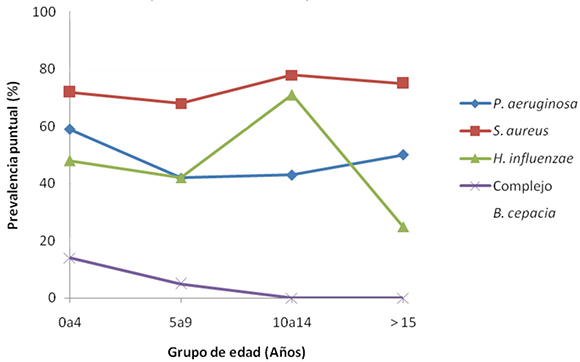
Figura 2. Cronología de la colonización/ infección bacteriana en pacientes con fibrosis quística
Tabla 1. Pacientes colonizados-infectados con P aeruginosa (n = 29) y S. aureus (n = 36); perfil de resistencia a los antimicrobianos

En 28 pacientes colonizados-infectados por H. influenzae, se observó un 57,1 % (16/28) de resistencia a la ampicilina debido a la presencia de ß-lactamasa. En 8 pacientes se aisló A. xylosoxidans, 6 de ellos eran mayores de 5 años, yen4se recuperó también S. aureus. S. maltophilia se aisló de 9 pacientes, 6 de ellos fueron menores de 2 años; en 4 de estos pacientes también se aisló S. aureus. Ambos microorganismos fueron aislados en forma intermitente.
Serratia marcescens fue la enterobacteria más frecuentemente detectada en estos pacientes (6/11), y en 19 enfermos se encontraron BGNNF distintos de P. aeruginosa: Elizabethkingia meningoseptica (n = 3), Chryseobacterium indologenes (n = 2),
Pseudomonas stutzeri (n = 1), Sphingomonas paucimobilis (n = 5), Ralstonia picketti (n = 1), Acinetobacter spp. (n = 6) e I. limosus (n = 1). Este último microorganismo se aisló en prácticamente todas las muestras remitidas de un mismo paciente desde los 5 años de edad (desde 2006 a la fecha), acompañado en la mayoría de las ocasiones por S. aureus.
La colonización del tracto respiratorio de estos pacientes por microorganismos de patogenicidad reconocida ocurre a edades tempranas y representa un serio problema de salud.
En este trabajo no se pretendió definir los episodios de infección crónica o de exacerbaciones agudas de cada paciente, ya que para ello se deben tener en cuenta, entre otros, criterios clínicos, espirométricos, analíticos y radiológicos. En un estudio realizado en la Unidad de FQ del Hospital de Sabadell (1995-2009), los microorganismos prevalentes fueron S. aureus (40,8 %), P. aeruginosa (19,4 %), complejo B. cepacia (16,7 %), H. influenzae (3,3 %), S. maltophilia (1,9 %) y A. xylosoxidans (0,5 %) (2). Similares resultados fueron obtenidos en este estudio con S. aureus (72 %) y P. aeruginosa (58 %). En este trabajo se detectó P. aeruginosa en aproximadamente la mitad de los niños menores de 2 años (13/24).
Según la literatura internacional, aproximadamente el 30 % de los niños con FQ padecen colonización-infección con P. aeruginosa antes de los dos años. Los datos de este trabajo revelan un mayor porcentaje de pacientes colonizados tempranamente con P. aeruginosa en este grupo etario, lo cual nos permite inferir que el pronóstico será peor si lo comparamos con lo comunicado (4). Del total de pacientes con P. aeruginosa, en el 41,4 % se aisló el fenotipo mucoso, lo que indicaría que el tratamiento de los pacientes con este fenotipo característico podría ser dificultoso.
Los pacientes con FQ realizan distintos tratamientos para aliviar la obstrucción bronquial, ayudar a la depuración mucociliar y prevenir infecciones. Se ha demostrado que las estrategias terapéuticas destinadas a la erradicación de la primoinfección por P. aeruginosa tienen como resultado la disminución de la prevalencia de la infección crónica por este microorganismo. Esto puede ser atribuido a la administración en forma precoz del esquema de tratamiento antibiótico (nebulizaciones) junto con antibióticos sistémicos por vía oral (VO) o endovenosa (EV) (11). Estos esquemas son indicados en las exacerbaciones agudas y para disminuir la carga microbiana. En pacientes seleccionados, se podría administrar el tratamiento EV en forma domiciliaria. Los antibióticos han mejorado la sobrevida de estos pacientes, aunque su efecto es limitado. Deben asociarse a una vigorosa kinesioterapia respiratoria que asegure la depuración de las vías aéreas, siempre en el contexto de un adecuado estatus nutricional.
En nuestra institución se utiliza tobramicina y colistina en la prevención de las exacerbaciones respiratorias agudas. Para el tratamiento de las exacerbaciones ocasionadas por P. aeruginosa se administran ciprofloxacina (VO) o ceftacidima y amicacina (en los casos más graves, en forma EV). Se observa una alta frecuencia de cepas sensibles a estos antimicrobianos en la población analizada.
En nuestro estudio encontramos una baja frecuencia de pacientes con aislamientos de P. aeruginosa resistentes a los antibióticos p-lactámicos (13,8 %). En coincidencia con lo publicado por Anzaudo et al. en el año 2005, la resistencia a gentamicina se mantuvo constante (1).
En este estudio S. aureus ocupa el primer lugar en frecuencia (72 %) como causa de colonización-infección crónica en todos los grupos etarios, superando a P. aeruginosa. La Cystic Fibrosis Foundation de los Estados Unidos y la Federación Española contra la FQ refieren un 48 % y 35,5 %, respectivamente.
En dos estudios recientes, Dasenbrook et al. analizan las infecciones pulmonares por S. aureus resistente a meticilina (SARM) en pacientes con FQ y concluyen que la permanencia de SARM en los pulmones por más de 2 años podría afectar la supervivencia. Comunican también que en la última década la prevalencia de SARM se ha incrementado, esta fue del 23,7 % en 2009. SARM se asocia con una disminución más rápida de la función pulmonar y con una mayor mortalidad (7, 8). En nuestro estudio, la mitad de los pacientes se hallaban colonizados-infectados por SARM. De los 36 pacientes colonizados-infectados por S. aureus, 14 presentaron algún mecanismo de resistencia a los macrólidos (38,9 %): fenotipos MLSc, MLSi y M o probable eflujo. La resistencia observada a macrólidos podría deberse a que algunos niños fibroquísticos reciben azitromicina como antiinflamatorio por sus propiedades inmunomoduladoras y, eventualmente, para la prevención de las exacerbaciones. Es importante destacar que estos pacientes se colonizan con cepas de S. aureus provenientes de la comunidad y generalmente no son tratados con antibióticos, salvo que estén sintomáticos, con la función pulmonar deteriorada o que concomitantemente se aíslen otros patógenos, como P. aeruginosa.
Durante los últimos años, ha existido un aumento de patógenos potenciales emergentes en la FQ, como el complejo B. cepacia, S. maltophilia, A. xylosoxidans y otros organismos multirresistentes. La infección pulmonar por el complejo B. cepacia se asocia con disminución de la función pulmonar y un peor pronóstico en la mayoría de los pacientes (15). Oliver et al. informaron una menor supervivencia a los 5 años de los pacientes con S. maltophilia (12); sin embargo, en otros pacientes no se evidencia un deterioro clínico relacionado con esta bacteria. Se observa que los pacientes con S. maltophilia son de mayor edad y presentan un índice elevado de coinfección previa con P. aeruginosa y con el complejo B. cepacia. La prevalencia de este patógeno en los pacientes con FQ ha aumentado en los últimos años (5). Sin embargo, en este trabajo S. maltophilia se aisló en 9 pacientes menores de 7 años; 4 de ellos -menores de 2 años- fallecieron.
Achromobacter xylosoxidans es un patógeno con una incidencia creciente en estos pacientes y tiene un alto índice de coinfección con P. aeruginosa (12). Son pocos los estudios que examinan el efecto de A. xylosoxidans en la función pulmonar y en la mortalidad. Se lo ha relacionado con exacerbaciones pulmonares en FQ, pero además, los pacientes estaban colonizados también con P. aeruginosa. No parece que la colonización a largo plazo produzca un claro deterioro del estado clínico (15). En nuestro estudio, A. xylosoxidans se aisló en forma intermitente en 8 pacientes (5 de ellos mayores de 7 años) y acompañado por S. aureus y P. aeruginosa, a diferencia de lo hallado en el caso de S. maltophilia. La sintomatología clínica de pacientes colonizados con S. maltophilia o el complejo B. cepacia es difícil de controlar, ya que las opciones terapéuticas son muy limitadas.
Otro microorganismo para tener en cuenta es I. limosus por su resistencia a la colistina y a todos los p-lactámicos, excepto imipenem. No hay datos suficientes que permitan conocer el significado clínico de esta bacteria en estos pacientes (12).
En la actualidad se están estudiando varias estrategias en el campo de la investigación clínica para mejorar la calidad de vida del paciente con FQ y aumentar su supervivencia. Los estudios microbiológicos de las secreciones respiratorias se deben realizar en todos los niños con diagnóstico de FQ, aun cuando no existen manifestaciones clínicas en el aparato respiratorio, ya que resulta imprescindible evitar la colonización con microorganismos patógenos que alteren la estructura y funcionalidad pulmonar. Los avances en el diagnóstico microbiológico de la colonización-infección mediante el empleo de una metodología adaptada a las necesidades de esta enfermedad y las nuevas posibilidades en antibioterapia han contribuido decisivamente a mejorar la calidad y la expectativa de vida de estos pacientes.
Agradecimientos: a la Dra. Blanca Gatti por su colaboración en el análisis de los datos. Fundación Hospital de Niños "Dr. O. Alassia" y F.I.P.A.M. por su colaboración económica para la publicación.
1. Anzaudo M, Busquets N, Ronchi S, Mayoral C. Microorganismos patógenos aislados en muestras respiratorias de niños con fibrosis quística. Rev Argent Microbiol 2005; 37: 129-34. [ Links ]
2. Asensio de la Cruz O, Bosque García M, Pérez A, Montón Soler C, Espasa Soley M. Fibrosis quística y sus manifestaciones respiratorias. Pediatr Integral 2012; XVI: 156-69. [ Links ]
3. Campos M, Navarro R, Amuy E, Vargas A, Herrera Marco L. Aislamientos bacterianos del tracto respiratorio de niños con fibrosis quística del páncreas. Rev méd Hosp Nac Niños (Costa Rica) [online] 2000, vol 35, n.1-2. Disponible en: http://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S1017-85462000000100002&lng=es. [ Links ]
4. Cantón R, Cobos N, De Gracia J, Baquero F, Honorato J, Gartner S, Álvarez A, Salcedo A, Oliver A, Gracia-Quetglas E, en representación del Grupo Español de Consenso del Tratamiento Antimicrobiano en el Paciente con Fibrosis Quística. Tratamiento antimicrobiano frente a la colonización pulmonar por Pseudomonas aeruginosa en el paciente con fibrosis quística. Arch Bronconeumol 2005; 41 Supl 1: 1-25. [ Links ]
5. Coutinho HDM, Falcáo-Silva V, Fernandes Gongalves G. Agentes bacterianos pulmonares y terapia antibiótica en pacientes con fibrosis quística: guía para el personal sanitario. Arch Medicina 2009; Vol. 5. N. 2: 4. Doi: 10.3823/028. [ Links ]
6. Cystic Fibrosis Foundation. Patient registry 2001 annual report. Bethesda, Maryland, USA, 2002. [ Links ]
7. Dasenbrook E, Checkley W, Merlo C. Association between respiratory tract methicillin-resistant Sthapylococcus aureus and survival in cystic fibrosis. JAMA 2010; 303: 2386-92. [ Links ]
8. Dasenbrook E, Merlo C, Diener-West M. Persistent methicillin-resistant Sthapylococcus aureus and rate of FEV1 decline in cystic fibrosis. Am J Respir Crit Care Med 2008; 178: 814-21. [ Links ]
9. Davies JC, Rubin BK. Emerging and unusual gram-negative infections in cystic fibrosis. Semin Respir Crit Care Med 2007; 28: 312-21. [ Links ]
10. Doring G, Conway S, Heijerman H. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus group. Eur Respir J 2000; 16: 749-67. [ Links ]
11. Frederiksen B, Koch C, Hoiby N. Changing epidemiology of Pseudomonas aeruginosa infection in Danish cystic fibrosis patients (1974-1995). Pediatr Pulmonol 1999; 28: 159-66. [ Links ]
12. Oliver A, Alarcón T, Caballero E, Cantón R. Diagnóstico microbiológico de la colonización-infección broncopulmonar en el paciente con fibrosis quística. Enferm Infecc Microbiol Clin 2009; 27: 89-104. [ Links ]
13. Ramsey BW. Management of pulmonary disease in patients with cystic fibrosis. New Engl J Med 1996; 335: 179-87. [ Links ]
14. Rosenstein BJ, Zeitlin PL. Cystic fibrosis. Lancet 1998; 351: 277-82. [ Links ]
15. Soto Martínez M. Fibrosis quística: abordaje clínico. Enfermedades crónicas. Acta Pediatr Costarric 2009; 21: 2. [ Links ]
Recibido: 9/10/2012
Aceptado: 8/1/2013













