Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541
Rev. argent. microbiol. vol.46 no.4 Ciudad Autónoma de Buenos Aires Dec. 2014
ARTÍCULO ORIGINAL
Caracterización de rizobacterias promotoras de crecimiento en plántulas de Eucalyptus nitens
Characterization of growth-promoting rhizobacteria in Eucalyptus nitens seedlings
Violeta C. Anguloa, Eugenio A. Sanfuentesab, Francisco Rodríguezc, Katherine E. Sossaab*
aCentro de Biotecnología, Universidad de Concepción, Concepción, Chile
bFacultad de Ciencias Forestales, Universidad de Concepción, Concepción, Chile
cForestal Mininco, Los Ángeles, Región del Bío-Bío, Chile
* Autor para correspondencia.
Correo electrónico: ksossa@udec.cl (K.E. Sossa).
Recibido el 1 de agosto de 2013
Aceptado el 10 de septiembre de 2014
Resumen
Se aislaron bacterias rizosféricas y endófitas a partir de rizósfera y tejidos de raíz de árboles de Eucalyptus nitens con el objetivo de evaluar su capacidad de promover el crecimiento en plántulas de la misma especie en condiciones de invernadero. Los aislamientos que incrementaron el crecimiento de las plántulas fueron identificados y caracterizados por su capacidad de producir ácido indolacético (AIA), solubilizar fosfato y expresar la 1-aminociclopropano-1-carboxilato (ACC) desaminasa. Los 105 aislamientos obtenidos fueron morfológicamente diferentes y solo 15 promovieron significativamente el crecimiento de plántulas de E. nitens. Los máximos incrementos observados fueron en el peso seco aéreo (142 %) y de la raíz (135 %); también aumentaron la altura de las plantas (50 %) y el largo de raíces (45 %) de las mismas. Las rizobacterias pertenecieron a los géneros Arthrobacter, Lysinibacillus, Rahnella y Bacillus. Los aislados identificados como A. phenanthrenivorans 21 y B. cereus 113 incrementaron la emergencia de E. nitens a los 12 días en un valor promedio de 3,15 veces con relación al control. R. aquatilis aislado 78 presentó la mayor producción de AIA (97,5 ± 2,87 µg/ml) en presencia de triptófano y el mayor índice de solubilización de fósforo (2,4). B. amyloliquefaciens aislado 60 fue positivo para la actividad ACC desaminasa. Los resultados obtenidos indican el potencial de las rizobacterias estudiadas como promotoras de emergencia y crecimiento de plántulas de E. nitens y su posible uso como inoculantes, ya que presentan más de un mecanismo de acción asociado a la promoción del crecimiento.
Palabras clave
Eucalyptus nitens; PGPR; Ácido indolacético; Bacterias solubilizadoras de fósforo; ACC desaminasa.
© 2013 Asociación Argentina de Microbiología. Publicado por Elsevier España, S.L. Todos los derechos reservados.
Abstract
Rhizospheric and endophytic bacteria were isolated from the rizosphere and root tissue of Eucalyptus nitens. The objective of this work was to evaluate their capacity to promote growth in seedlings of the same species under greenhouse conditions. The isolates that improved seedling growth were identified and characterized by their capacity to produce indoleacetic acid (IAA), solubilize phosphates and increase 1-aminocyclopropane-1-carboxylate (ACC) deaminase activity. One hundred and five morphologically different strains were isolated, 15 of which promoted E. nitens seedling growth, significantly increasing the height (50%), root length (45%) as well as the aerial and root dry weight (142% and 135% respectively) of the plants. Bacteria belonged to the genus Arthrobacter, Lysinibacillus, Rahnella and Bacillus. Isolates A. phenanthrenivorans 21 and B. cereus 113 improved 3.15 times the emergence of E. nitens after 12 days, compared to control samples. Among isolated R. aquatilis, 78 showed the highest production of IAA (97.5±2.87 µg/ml) in the presence of tryptophan and the highest solubilizer index (2.4) for phosphorus, while B. amyloliquefaciens 60 isolate was positive for ACC deaminase activity. Our results reveal the potential of the studied rhizobacteria as promoters of emergence and seedling growth of E. nitens, and their possible use as PGPR inoculants, since they have more than one mechanism associated with plant growth promotion.
Keywords
Eucalyptus nitens; PGPR; Indoleacetic acid; Phosphate solubilizing bacteria; ACC deaminase.
© 2013 Asociación Argentina de Microbiología. Published by Elsevier España, S.L. All rights reserved.
Introducción
La industria forestal en Chile se posiciona como un pilar fundamental en la economía, con más de dos millones de hectáreas de cobertura forestal compuestas principalmente por Pinus radiata D. Don y Eucalyptus spp.19. Eucalyptus nitens (Deane et Maiden) es una especie con una amplia extensión plantada en el sur de Chile31, de unas 133 411 hectáreas8, debido a que posee una madera con importantes ventajas para ser utilizada como materia prima pulpable55, sumadas a su rápido crecimiento y resistencia a bajas temperaturas11.
El éxito de las plantaciones depende en gran parte de la capacidad de las plantas provenientes de los viveros para tolerar el estrés producto del trasplante, ya que ese nuevo ambiente podría ser percibido como adverso y afectar tanto el crecimiento inicial como la supervivencia de las plantas16,17. La calidad de las plántulas producidas en vivero es considerada clave para determinar el éxito de la futura plantación74, y en términos generales, se considera que estas deben tener su parte aérea y raíces lo suficientemente desarrolladas como para aumentar la probabilidad de establecerse66.
Numerosas especies de bacterias, en su mayor parte asociadas con la rizósfera, han demostrado capacidad para incrementar el crecimiento de las plantas; a estas se las denomina rizobacterias promotoras de crecimiento vegetal [en inglés, plant growth promoting rhizobacteria46 (PGPR)]. En diversos cultivos, la aplicación de PGPR en estadios tempranos de desarrollo ha incrementado la producción de la biomasa por un mayor crecimiento de raíces y tallos15,33,47. En viveros de especies forestales, las PGPR han permitido incrementar la supervivencia de las plantas después del trasplante, lo que se ha asociado a un mejor desarrollo de raíces y, en consecuencia, a un aumento de la captación de nutrientes75.
Las PGPR pueden inducir el crecimiento vegetal directamente o indirectamente. La influencia directa incluye la producción de fitohormonas, como por ejemplo, de ácido indolacético70 (AIA), del grupo de las auxinas; también de ácido giberélico (GA3), citoquininas24 y ácido abscísico21,26 (ABA); o bien la capacidad de producir la enzima 1-aminociclopropano 1-carboxilato (ACC) desaminasa, que reduce el nivel de etileno en las raíces34,54,71. Además, los mecanismos directos incluyen la liberación de fosfatos y micronutrientes y la fijación biológica de nitrógeno26. Los efectos indirectos se deben a la modificación del ambiente rizosférico y su ecología51, actuando como agentes de biocontrol de fitopatógenos mediante la liberación de sustancias como sideróforos, ß-1, 3-glucanasas, quitinasas, antibióticos, pigmentos fluorescentes y cianidas10,35,67.
Géneros bacterianos como Bacillus y Pseudomonas han demostrado su acción promotora del crecimiento en especies forestales13,14,62. Puente et al.74 demostraron el efecto de la inoculación con Azospirillum brasilense sobre el crecimiento y la germinación de E. globulus. También se ha demostrado una estimulación en el enraizamiento de estacas de E. grandis, E. globulus y E. calmaldulensis25,42,56,87 y un efecto de biocontrol de la marchitez bacteriana en E. urophylla76,77. Sin embargo, a la fecha no existen investigaciones sobre la promoción del crecimiento en E. nitens.
Debido a la creciente expansión de las plantaciones de E. nitens en Chile, las rizobacterias representan una alternativa para optimizar el establecimiento y el crecimiento de esta especie. Por lo tanto, el objetivo de este trabajo fue caracterizar bacterias rizosféricas y endófitas promotoras del crecimiento de E. nitens y determinar los potenciales mecanismos de acción asociados, como la producción de AIA, la solubilización de fosfato y la expresión de la actividad 1-aminociclopropano-1- carboxilato (ACC) desaminasa in vitro.
Materiales y métodos
Se colectaron plantas de E. nitens de un año de establecimiento en los predios forestales Choroito y Santa Adriana, ubicados en los 37° 32' 07, 08" de latitud sur y 72° 44' 46, 38"de longitud oeste, y también del predio Lo Álvarez, situado en los 37° 25' 57, 93" latitud sur y 71° 54' 52,78" longitud oeste; los tres predios se encuentran en la región del Bío Bío, República de Chile, y son propiedad de Forestal Mininco S.A. Las plantas fueron extraídas completas y transportadas en frío al laboratorio de Biopelículas y Microbiología Ambiental del Centro de Biotecnología de la Universidad de Concepción.
Para el aislamiento de bacterias rizosféricas se seleccionaron las raíces laterales jóvenes18, las cuales fueron seccionadas y lavadas con agua destilada esterilizada (ADE), posteriormente fueron suspendidas en solución salina tamponada [phosphate buffered saline (PBS)] y sonicadas durante 15 min (40 kHz) (Branson 2510 MT, Branson Ultrasonic Corporation, México), y la suspensión rizosférica así obtenida fue filtrada mediante gasa estéril. Una fracción (1 ml) del filtrado fue diluida sucesivamente al décimo hasta lograr una dilución 10−5 de la original, y se utilizó una alícuota del filtrado (100 µl) para sembrar cada placa87. Se emplearon diferentes medios de cultivo para tratar de aislar a algunos géneros de PGPR frecuentemente comunicados7. Para el aislamiento de Pseudomonas se utilizó King B45 (KB) al 10 %, para el de Streptomyces el medio elegido fue agar almidón caseína49 (AC) suplementado con extracto de suelo38 y cicloheximida (50 µg/ml) (Sigma Aldrich, St. Louis, EE.UU.). Para el aislamiento de Bacillus, alícuotas (1 ml) de las muestras se sometieron a un choque térmico a 80 °C durante 20 min y luego se sembraron en el medio de esporulación CCY85. Para el aislamiento de las bacterias endófitas se procedió según el protocolo de Magallan y Dion57, empleando los mismos medios de cultivo utilizados para el aislamiento de bacterias rizosféricas. En todos los casos, la incubación fue a 28 °C durante 3 a 5 días. Adicionalmente, se realizaron recuentos de las bacterias endófitas y rizosféricas -unidades formadoras de colonia (UFC)- obtenidas a partir de los tejidos de las raíces y de suelo rizosférico, respectivamente. Luego se procedió a aislar las colonias con morfotipos diferentes (forma, borde, tamaño, color y apariencia), las cuales fueron traspasadas al mismo medio en el que fueron obtenidas. Las colonias puras fueron almacenadas a −80 °C en glicerol (Riedel-de Haën, Alemania) al 20 %.
Para la producción del inóculo bacteriano utilizado en los ensayos, los aislados fueron crecidos en caldo tripticasa de soja [en inglés, tryptic soy broth (TSB)] (Becton, Dickinson and Company, Le Pont de Claix, Francia) al 50 % e incubados a 28 °C y 120 r.p.m. durante 48 h, la concentración se ajustó a 1 × 107 UFC/ml.
Para el ensayo de promoción de crecimiento fueron utilizadas semillas de E. nitens, proporcionadas por Forestal Mininco S.A. Las semillas se trataron inicialmente de acuerdo con el procedimiento usual seguido en condiciones productivas, este consistió en un primer remojo en una solución de ácido giberélico (AG3) (200 mg/ml) (Sigma Aldrich, St Louis, EE.UU.) durante una noche y una posterior desinfección superficial en etanol (70 % v/v) por 10 s e hipoclorito de sodio (5 % v/v) durante 10 min, seguida de lavados sucesivos en ADE. Por último, las semillas fueron tratadas mediante inmersión en el inóculo bacteriano, con la adición de carboximetilcelulosa (CMC) (Protex, China) al 0,6 % p/v en agitación (120 r.p.m.) durante 30 min, luego se dejaron secar a temperatura ambiente.
Se utilizó un sustrato natural (corteza de pino compostada, no esterilizada) dispuesto en tubetes plásticos de 70 ml de capacidad, que también fue tratado con cada suspensión bacteriana (relación 1: 10 v/v), y 48 h después se procedió a la siembra. El sustrato presentó las siguientes características fisicoquímicas: materia orgánica 46 %; nitratos (N-NO3), 13,10 mg/kg; amonio (N-NH4), 9,10 mg/kg; N disponible, 923,10 mg/kg; N total, 0,54 %; fósforo disponible, 0,05 %; potasio, 0,14 %; calcio, 0,53 %; magnesio, 0,14 %; sodio, 0,04 %; conductividad eléctrica, 0,2 dS/m; relación C/N, 49,5; y pH en agua (1: 2), 5,65. El ensayo fue realizado en el invernadero de la Facultad de Ciencias Forestales de la Universidad de Concepción durante un periodo de tres meses. A las cuatro semanas después de la siembra se realizó una segunda inoculación con 5 ml de suspensión bacteriana ajustada a 1 × 107 UFC/ml, direccionada a la base de las plántulas emergidas.
El diseño utilizado para el ensayo fue completamente al azar, con 21 plantas por cada tratamiento. Fueron incluidos 116 tratamientos, con 105 aislados bacterianos obtenidos de ejemplares de E. nitens, 10 aislados con antecedentes de haber promovido el enraizamiento de estacas de E. globulus obtenidos previamente por Díaz et al.25 y un tratamiento control, que consistió en la aplicación de caldo de cultivo TSB al 50 % sin bacterias. Se evaluó la emergencia de las plántulas a los 12, 14, 16, 18, 20, 24 y 28 días después de la siembra, y al cabo del tercer mes se colectaron las plantas, para evaluar altura de la parte aérea, largo de raíces, peso seco de la planta y de raíces totales (secadas a 70 °C durante 48 h). El análisis de la emergencia consistió en la estimación y comparación de las probabilidades de emergencia de las plántulas entre tratamientos. Se consideró que el número de plantas emergidas siguió una distribución binomial con probabilidad de emergencia P. El análisis inferencial se efectuó mediante regresión logística y las comparaciones de probabilidades de emergencia versus el testigo se ajustaron según el método de Agresti1,2. Para el análisis de las variables de promoción del crecimiento se realizó un análisis no paramétrico de Kruskal Walllis (p < 0,05), utilizándose el software R.
Los aislados con actividad PGPR fueron identificados con métodos genómicos, el ADN bacteriano fue aislado mediante el kit ZR fungal/bacterial DNA MicroPrep™ (Zymo Research, Irvine CA, EE.UU.) y utilizado como templado para la amplificación por PCR del 16S ADNr. Para la amplificación por PCR se emplearon los cebadores 27-F [5'- GAGTTTGATCCTGGCTCAG-3´]50 y 1542-R [5'- AGAAAGGAGGTGATCCAGCC-3']68, que amplifican para un producto de PCR de 1520 pb. La mezcla de reacción consistió en 1X buffer Flexi DNA polymerase (Promega, Madison, EE.UU.), 1,5 mM MgCl2, 0,5 mM de cada dNTP, 0,5 mM de cada partidor y 0,025 mM de Go Taq polymerase (Promega, Madison, EE.UU.). Las condiciones de amplificación fueron las siguientes: un ciclo de preincubación a 95 °C por 2 min, 30 ciclos de amplificación en tres segmentos, con desnaturalización a 95 °C por 30 s, hibridación a 54 °C por 30 s y extensión a 72 °C por 1,5 min, y la extensión final a 72 °C durante 2 min. Los productos de PCR fueron secuenciados en Macrogen Inc. (Corea del Sur). Las secuencias del gen 16S ADNr fueron analizadas con el programa de búsqueda Basic Local Alignment Search Tool (BLAST), para encontrar identidad entre las secuencias (≥ 99 %), y posteriormente fueron depositadas en la base de datos de secuencias nucleotídicas GenBank (tabla 1).
Tabla 1 Identificación de los aislados promotores de crecimiento en Eucalyptus nitens basada en la secuenciación del gen 16S del ADNr
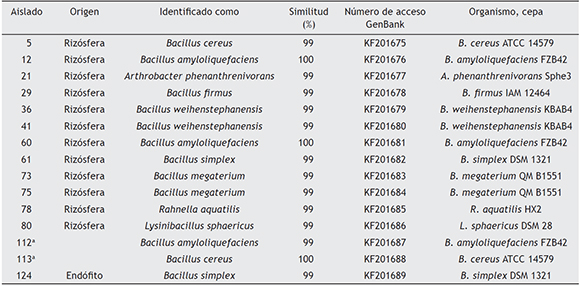
a - Aislado por Díaz et al.25.
La relación filogenética se infirió usando el método Neighbor-Joining80, validado utilizando el árbol consenso boostrap inferido de 500 réplicas29. Los análisis filogenéticos fueron llevados a cabo mediante el paquete de software MEGA 486.
Con aquellos aislados que presentaron actividad PGPR se realizaron ensayos in vitro para determinar la ocurrencia de los mecanismos asociados a la promoción del crecimiento vegetal. Para la detección de AIA, las bacterias fueron multiplicadas en caldo TSB (50 %) e incubadas a 28 °C y 120 r.p.m. durante 24 h, posteriormente se ajustó la concentración a 1 en la escala Mc Farland (3 × 108 cel/ml) y una alícuota de 2 % v/v de cada cultivo fue inoculado en caldo nutriente con L-triptófano (5 mg/ml) (MP Biomedicals LLC, Illkirch, Francia) y sin este, e incubados en las mismas condiciones durante el lapso de cinco días. Luego las muestras fueron centrifugadas a 20 000 r.p.m. a 4 °C durante 20 min y se reveló el sobrenadante con la solución de Salkowski [4,5 g de FeCl3 (AppliChem, Darmstadt, Alemania) en H2SO4 10,8 M] en una relación 1: 2 muestra-reactivo36 durante 30 min en la oscuridad. Para la cuantificación se realizó una curva estándar con las concentraciones: 1, 5, 10, 15, 20, 25, 30, 35 y 40 µg/ml de AIA (Sigma Aldrich, St Louis, EE.UU.). Las lecturas se efectuaron en un lector de placas (Infinite® 200 PRO, Tecan, Männedorf, Suiza) a 530 nm de longitud de onda y el control se calibró con el caldo de cultivo suplementado con triptófano en ausencia de inóculo. Los ensayos fueron realizados por triplicado bajo un diseño completamente al azar, se empleó el análisis estadístico de varianza (ANOVA) y las medias fueron comparadas mediante el test LSD (p < 0,05). Los datos fueron analizados con el paquete estadístico Statistical Analysis Software (SAS), versión 8.
En presencia de triptófano la producción de AIA de los aislados fue confirmada mediante el análisis cuantitativo por cromatografía líquida de alta eficacia [en inglés, high-performance liquid chromatography (HPLC)] (SPD-M10Avp, Shimadzu, EE.UU.). Para la separación cromatográfica, las muestras fueron filtradas en discos de 0,22 µm de porosidad e inyectadas en forma isocrática en una columna de fase reversa C18. Como fase móvil se utilizó una mezcla de metanol-ácido acético 0,5 % en una proporción 60: 40 (v/v), a una velocidad de flujo de 0,7 ml/min y a temperatura ambiente. La detección se realizó por fluorescencia utilizando 280 nm de excitación y 340 nm de emisión9.
Para detectar la capacidad de las bacterias PGPR de solubilizar fósforo (P), estas fueron cultivadas en el medio NBRIP63, con Ca3(PO4)2 (Sigma Aldrich, St Louis, EE.UU.) como fuente de P insoluble, la incubación se efectuó a 28 °C durante 5 días. Aquellas con crecimiento en el medio y con la formación de un halo alrededor de las colonias fueron consideradas solubilizadoras y evaluadas mediante el índice de solubilización (IS) = diámetro del halo (mm)/diámetro de la colonia (mm). La capacidad de solubilización se categorizó en tres niveles: bajo (IS < 2), intermedio (IS entre 2 y 4) o alto60 (IS > 4). Las evaluaciones fueron realizadas a los 3 y 5 días, los aislados fueron "solubilizadores tempranos" cuando el halo se formó hasta el tercer día y "solubilizadores tardíos" cuando ocurrió después del tercer día60. Los ensayos fueron realizados por triplicado.
La actividad ACC desaminasa fue determinada cualitativamente de acuerdo con el método de Penrose y Glick72. Los aislados crecieron en el medio peptona proteasa, caseína hidrolizada, anhidro y glicerol (PAF)72 a 28 °C y 120 r.p.m. durante 24 h, luego se transfirió una alícuota del cultivo (2 % v/v) al mínimo de sales Dworkin y Foster (DF)27 suplementado con 1-aminociclopropano-1-ácido carboxílico (ACC) (MP Biomedicals LLC, Illkirch, Francia) como única fuente de N, y se continuó incubando en las condiciones mencionadas antes. Una alícuota de este cultivo fue transferida a un nuevo caldo DF que se incubó durante 48 h, la presencia de turbidez se tomó como un resultado positivo.
Resultados y discusión
A partir de las muestras de raíces de E. nitens se determinaron las poblaciones bacterianas cultivables, que fueron de 5,2 × 105 UFC/g para rizósfera y 3,1 × 104 UFC/g para endófitos. Se obtuvieron un total de 105 aislados con diferentes morfotipos, de los cuales 76 fueron de rizósfera y 29 endófitos. Entre estos aislados bacterianos, 15 incrementaron el crecimiento de las plántulas de E. nitens para las variables altura y biomasa de la parte aérea y largo y biomasa de raíces con relación al control (p < 0,05), aunque estos aislados no presentaron diferencias entre sí.
Los aislados promotores de crecimiento correspondieron a 12 rizosféricos, uno endófito y dos aislados por Díaz et al.25, los que generaron un incremento de 25 % a 50 % de la parte aérea de las plantas y de 55 % a 142 % en el peso seco de la mismas (fig. 1A). El largo de las raíces se incrementó en un 19 % a 45 %, y la biomasa en un 58 % a 135 % (fig. 1B). Las PGPR se identificaron como pertenecientes a los géneros Bacillus, Lysinibacillus, Arthrobacter y Rahnella (tabla 1), por tanto, vinculadas con tres familias bacterianas: Bacillaceae, Micrococcaceae y Enterobacteriaceae, con un predominio de la primera, que comprendió el 87 % de los aislamientos. La figura 2 exhibe las relaciones filogenéticas entre las especies aisladas. Numerosos estudios realizados con el género Bacillus han demostrado su potencial en la promoción de crecimiento y se han comunicado efectos promotores por acción del biocontrol40, por la solubilización de fosfatos y por la producción de fitohormonas, como AIA39,83. Las especies de Bacillus conforman un grupo predominante en diferentes tipos de suelos30 y se han encontrado estrechamente relacionadas con la promoción del crecimiento en una amplia variedad de plantas22,48 y con el control de fitopatógenos40, a lo que se suma de manera destacada la capacidad de producir endosporas, que les permite sobrevivir por largos períodos en suelo y en almacenamiento64. Las respuestas a la inoculación con PGPR de especies forestales ha sido variable74. Los incrementos de biomasa encontrados en este trabajo fueron en promedio de 89 % y 98 % para la parte aérea y las raíces, respectivamente. Puente et al.74 registraron incrementos de 86 % y 54 % en las variables mencionadas, respectivamente, al tratar plántulas de E. globulus con A. brasilense, mientras que Mohamad et al.61 obtuvieron un incremento de la biomasa del 44 % en plántulas de E. calmadulensis inoculadas con Azotobacter chroococcum y Bacillus megaterium. Entre los mayores incrementos de biomasa documentados, cabe mencionar los resultados de Teixeira et al.87, quienes hallaron incrementos de hasta 223 % en la biomasa de raíces al tratar estacas de Eucalyptus spp. con una cepa de Bacillus subtilis, y los de Díaz et al.25, que observaron un incremento de 168 % en la biomasa de raíces de estacas de E. globulus al ser tratadas con Bacillus mycoides (C2T18).
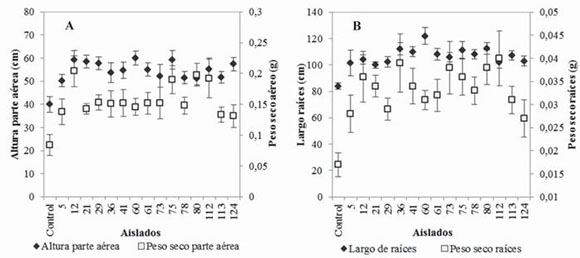
Figura 1 Crecimiento de plántulas de Eucalyptus nitens inoculadas con 15 diferentes aislados promotores de crecimiento. (A): longitud y peso seco de la parte aérea; (B): longitud y peso seco de las raíces, después de tres meses de crecimiento en invernadero. Las barras indican el error estándar.
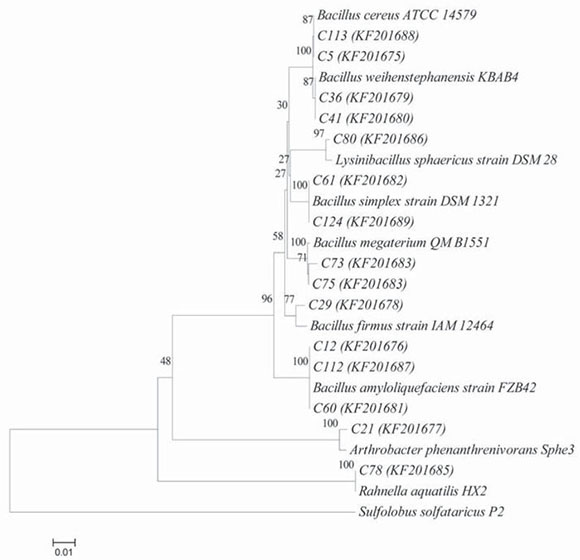
Figura 2 Árbol filogenético basado en la secuenciación del gen 16S del ADNr, que muestra la relación evolutiva entre los 15 aislados promotores de crecimiento inferida mediante el método Neighbor-Joining. Las distancias evolutivas se computaron con el empleo del método de máxima verosimilitud. Los números en las ramas indican el porcentaje de réplicas de árboles en los cuales los taxones asociados se agrupan para el test de bootstrap (500 réplicas). Los números de acceso del GenBank se hallan entre paréntesis.
Con relación a la emergencia, A. phenanthrenivorans aislado 21 y B. cereus aislado 113 promovieron la mayor emergencia temprana en E. nitens (p < 0,05), con probabilidades de emergencia de 0,8 y 0,78 a los 12 días después de la siembra comparado con 0,25 del testigo, lo que implica un incremento promedio de la emergencia para este tiempo de 3,15 veces. Sin embargo, a partir del día 14 no se observaron diferencias entre los tratamientos y el control. El incremento de la emergencia por acción de las PGPR ha sido comunicado con anterioridad23,89. Se ha descrito la promoción del crecimiento y el incremento en el porcentaje de germinación por cepas de Arthrobacter sp. y B. cereus41,79,92. Algunas PGPR han estimulado la emergencia de las semillas hasta el doble del testigo no tratado32, esto se ha asociado a un incremento en la síntesis de hormonas, como giberelinas y auxinas32,41.
En el ensayo de selección de PGPR, el sustrato utilizado fue natural (no esterilizado), condición que implica que las bacterias aplicadas debieron competir con la microbiota natural habitante del compost5. Se ha comunicado que la esterilización del sustrato puede tener resultados variables en la promoción del crecimiento en las plantas13,32. En la condición de sustrato de este ensayo, las bacterias inoculadas pudieron ejercer diferentes efectos, ya sea el biocontrol sobre bacterias patógenas7 o sobre aquellas bacterias que producen compuestos inhibidores del crecimiento de las plantas91.
Todos los aislados con acción PGPR en E. nitens produjeron AIA, independientemente del suministro de triptófano, sin embargo, la producción de AIA bacteriano en presencia de triptófano fue mayor (tabla 2). El triptófano es considerado un precursor del AIA, consecuentemente, su adición al cultivo bacteriano incrementó la biosíntesis del AIA4,20,88. Las PGPR R. aquatilis aislado 78 y B. megaterium aislado 75 presentaron las mayores concentraciones de AIA. El aislado 78 exhibió la mayor producción de AIA a las 24 h, mientras que la producción de B. megaterium aislado 75 alcanzó su valor máximo a las 120 h. Otros autores han comunicado la capacidad de producción de AIA de especies de Rahnella y Bacillus, tanto en presencia como en ausencia de triptófano28,43,52.
Tabla 2 Producción de AIA bacteriano en presencia y en ausencia de triptófano, solubilización de fósforo y actividad ACC desaminasa por las bacterias promotoras de crecimiento en Eucalyptus nitens
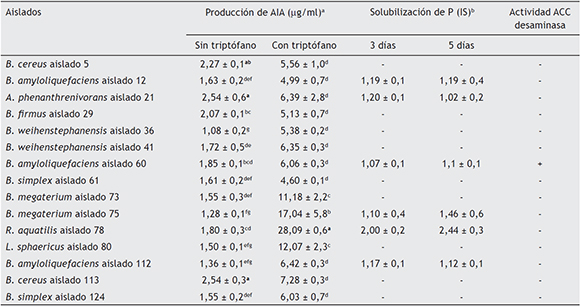
a - Medias aritméticas ± desviación estándar de experimentos por triplicado. Los valores seguidos con letras superíndices distintas indican diferencias significativas (p < 0,05) entre aislados.
b - IS= Diámetro del halo (mm) / diámetro de la colonia (mm).
La cantidad de AIA bacteriano puede ser un factor importante en la promoción del crecimiento. En presencia de triptófano, la producción de la fitohormona en las cepas más activas se encuentra entre 80 a 100 µg/ml88, rango dentro del cual se ubicó la producción en R. aquatilis aislado 78. Sin embargo, existe controversia respecto del impacto de las auxinas exógenas sobre el desarrollo de la planta, y se han documentado efectos positivos y también negativos3,73,84. Las consecuencias para la planta son usualmente una función de dos factores: (1) la cantidad de AIA producida que se vuelve disponible para la planta; (2) la sensibilidad de los tejidos de la planta a cambios en la concentración de AIA53.
Con relación a la capacidad de las bacterias de solubilizar el P, el 40 % de los aislamientos con capacidad promotora de crecimiento fueron capaces de manifestar in vitro dicha propiedad (tabla 2). Los IS de los aislamientos considerados "solubilizadores tempranos" fueron bajos a los tres días de incubación, en cambio, R. aquatilis aislado 78 dio un IS máximo a los cinco días del ensayo (tabla 2). Si bien existe una diversidad de especies bacterianas que poseen capacidad de solubilizar componentes fosfatados inorgánicos insolubles, como fosfato tricálcico, fosfato dicálcico, hidroxiapatitas y roca fosfórica37, los principales solubilizadores del P citados se hallan entre las especies de Pseudomonas, Bacillus, Rhizobium, Burkholderia, Achromobacter, Agrobacterium, Micrococcus, Aerobacter, Flavobacterium y Erwinia69. Se han descrito bacterias promotoras del crecimiento vegetal del género Eucalyptus por su capacidad de solubilizar P61. Entre ellas, el género Rahnella ha sido asociado a la solubilización de fosfatos en diversas investigaciones44,65,90. Becerra et al.6 aislaron bacterias solubilizadoras de P de suelos cultivados con uchuva (Physalis peruviana) y entre los mejores aislados identificaron a R. aquatilis, con IS intermedio de 3 a las 48 h de incubación. Otros autores han reportado IS altos en especies de los géneros Klebsiella y Enterobacter12,59. Sin embargo, el impacto de la solubilización y nutrición con P en el crecimiento de plantas in vivo e in vitro ha dado resultados variables22. Maliha et al.58 atribuyen a la capacidad buffer del medio el éxito de la solubilización de fosfatos por parte de los microorganismos, ya que se ha demostrado que la solubilización de los complejos Ca-P está mediada principalmente por la disminución del pH.
Únicamente B. amyloliquefaciens aislado 60 (tabla 2) fue capaz de crecer con el sustrato que contenía ACC como única fuente de N, lo que puede atribuirse a la actividad de la ACC desaminasa. La ACC desaminasa regula la producción de etileno a través de la degradación del ACC, precursor intermediario de la biosíntesis de etileno, en a-cetobutirato y amonio34,35,82. La presencia de ACC desaminasa ha sido mencionada para numerosas especies microbianas de bacterias gram negativas, gram positivas y hongos81, y, si bien los estudios para el género Bacillus son escasos, Read et al.78 la reportaron para este género bacteriano. En el caso de. B. amyloliquefaciens aislado 60, además fue productor de AIA, de modo que habría un efecto adicional, ya que el AIA activa a la ACC sintasa, esto favorecería la producción de ACC, y por ende, de etileno, el cual es un inhibidor del crecimiento de raíces. Sin embargo, las bacterias que producen la ACC desaminasa reducen el etileno y consecuentemente la inhibición del crecimiento de las raíces, tomando ventaja de esto y utilizando el ACC como una fuente de N84. De esta forma, en presencia de ambos mecanismos, las bacterias tendrán un mayor potencial como PGPR.
Los resultados de este estudio demostraron que bacterias rizosféricas y endófitas de E. nitens estimulan la emergencia y el crecimiento de plántulas de esta especie en condiciones de invernadero. Algunas bacterias PGPR presentaron más de un mecanismo de acción asociado a la promoción del crecimiento en plantas.
Estos resultados permiten predecir el potencial de estas bacterias para ser utilizadas como estimuladores de crecimiento de E. nitens en vivero y, de esta manera, favorecer la posterior supervivencia tras su establecimiento en terreno.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflictos de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
A Forestal Mininco S.A. por el financiamiento y las facilidades para realizar los muestreos y proporcionar las semillas para los ensayos, a la Lic. Evelyn Bustos del Laboratorio de Química de Productos Naturales de la Facultad de Ciencias Naturales de la Universidad de Concepción, por la colaboración con los análisis de HPLC, al Dr. Gonzalo Durán de la Universidad de Basel (Suiza), por la ayuda con el análisis estadístico y, finalmente, a la Dra. Marta Fernández del Centro de Biotecnología de la Universidad de Concepción por la ayuda con el estudio filogenético.
1. Agresti A. Categorical data analysis, 2nd edition. New York, John Wiley & Sons Inc., 2002, p. 710. [ Links ]
2. Agresti A, Caffo B. Simple and effective confidence intervals for proportions and difference of proportions result from adding two successes and two failures. Am Stat. 2000;54: 280-8. [ Links ]
3. Ahmad F, Ahmad I, Khan MS. Indole acetic acid production by the indigenous isolates of Azotobacter and fluorescent Pseudomonas in the presence and absence of tryptophan. Turk J Biol. 2005;29: 29-34. [ Links ]
4. Anjum MA, Zahir ZA, Arshad M, Ashraf M. Isolation and screening of rhizobia for auxin biosynthesis and growth promotion of mung bean (Vigna radiate L.) seedlings under axenic conditions. Soil Environ. 2011;30: 18-26. [ Links ]
5. Bashan Y. Inoculants of plant growth-promoting bacteria for use in agriculture. Biotechnol Adv. 1998;16: 729-70. [ Links ]
6. Becerra JM, Quintero D, Martínez M, Matiz A. Caracterización de microorganismos solubilizadores de fosfato aislados de suelos destinados al cultivo de uchuva (Physalis peruviana L.). Rev Colomb Cienc Hortic. 2011;5: 195-208. [ Links ]
7. Bouizgarne. Bacteria for plant growth promotion and disease management. En: Maheshwari DK, editor. Bacteria in agrobiology: disease management. London, Springer, 2013, p.15-47. [ Links ]
8. Cabrera J, Vega M. Datos tecnológicos del Eucalyptus nitens. 2008 [On-line; consultado 23 Ene 2012]. Disponible en: http: //www.nitens.cl/datos%20tecnologicos.pdf. [ Links ]
9. Castillo G, Altuna B, Michelena G, Sánchez-Bravo J, Acosta M. Cuantificación del contenido de ácido indolacético (AIA) en un caldo de fermentación microbiana. An Biol. 2005;27: 137-42. [ Links ]
10. Cattelan AJ, Hartel PG, Fuhrmann JJ. Screening for plant growth rhizobacteria to promote early soybean growth. Soil Sci Soc Am J. 1999;63: 1670-80. [ Links ]
11. Celhay JA, Bonnefoy PP, Riquelme FJ. Efecto de la intensidad de poda sobre el crecimiento de E. nitens. Actas de Silvotecnia XII Simposio IUFRO: Realidad y potencial del Eucalipto en Chile. Cultivo silvícola y su uso industrial. Concepción, Chile, 1999, p. 119-38. [ Links ]
12. Chakkaravarthy VM, Arunalachaman R, Paulkumar VS, Annadurai G. Biodegradation of tricalcium phosphate by phosphate solubilizing bacteria. J Biol Sci. 2010;10: 532-5. [ Links ]
13. Chanway CP, Holl FB. Growth of outplanted lodgepole pine seedlings one year after inoculation with plant growth promoting rhizobacteria. Forest Sci. 1994;40: 238-46. [ Links ]
14. Chanway CP, Radley RA, Holl FB Inoculation of conifer seed with growth promoting Bacillus strains causes increased seedling emergence and biomass. Soil Biol Biochem. 1991;23: 575-80. [ Links ]
15. Cleyet-Marel JC, Larcher M, Bertrand H, Rapior S, Pinochet X. Plant growth enhancement by rhizobacteria. En: Morot-Gaudry JF, editor. Nitrogen assimilation by plants: physiological, biochemical and molecular aspects. Plymouth, U.K, Science Publishers Inc., 2001, p. 185-97. [ Links ]
16. Close D, Beadle CL, Brown PH. The physiological basis of containerized tree seedling 'transplant shock': a review. Aus For. 2004;68: 112-20. [ Links ]
17. Close D. A review of ecophysiologically-based seedling specifications for temperate Australian eucalypt plantations. New Forests. 2012;43: 739-53. [ Links ]
18. Compant S, Reiter B, Sessitsch A, Nowak J, Clément C, Ait Barka E. Endophytic colonization of Vitis vinifera L. by a plant growth-promoting bacterium Burkholderia sp. strain PsJN. Appl Environ Microbiol. 2005;71: 1685-93. [ Links ]
19. Corma (Corporación chilena de la madera). Superficie de plantaciones, forestación y reforestación. 2008 [On-line; consultado 22 Dic 2012]. Disponible en: http: //www.corma.cl/corma_info.asp?idq=426. [ Links ]
20. Costacurta A, Vanderleyden J. Synthesis of phytohormones by plant-associated bacteria. Crit Rev Microbiol. 1995;21: 1-18. [ Links ]
21. Dangar TK, Basu PS. Studies on plant growth substances, IAA metabolism and nitrogenase activity in root nodules of Phaseolus aureus Roxb. var. mungo. Biol Plant. 1987;29: 350-4. [ Links ]
22. De Freitas JR, Banerjee MR, Germida JJ. Phosphate-solubilising rhizobacteria enhance the growth and yield but not phosphorous uptake of canola (Brassica rapus L.). Biol Fert Soil. 1997;24: 358-64. [ Links ]
23. De Freitas G, Germida J. Plant growth promoting rhizobacteria for winter wheat. Appl Environ Microb. 1989;64: 362-8. [ Links ]
24. Dey R, Pal KK, Bhatt DM, Chauhan SM. Growth promotion and yield enhancement of peanut (Arachis hypogaea L) by application of plant growth promoting rhizobacteria. Microbiol Res. 2004;159: 371-94. [ Links ]
25. Díaz K, Valiente C, Martínez M, Castillo M, Sanfuentes E. Rootpromoting rhizobacteria in Eucalyptus globulus cuttings. World J Microbiol Biotechnol. 2009;25: 867-73. [ Links ]
26. Dobbelaere S, Vanderleyden J, Okon Y. Plant growth promoting effects of diazotrophs in the rhizosphere. Crit Rev Plant Sci. 2003;22: 107-49. [ Links ]
27. Dworkin M, Foster J. Experiments with some microorganisms which utilize ethane and hydrogen. J Bacteriol. 1958;75: 592-601. [ Links ]
28. Erturk Y, Ercisli S, Haznedar A, Cakmakci R. Effects of plant growth promoting rhizobacteria (PGPR) on rooting and root growth of kiwifruit (Actinidia deliciosa) stem cuttings. Biol Res. 2010;43: 91-8. [ Links ]
29. Felsenstein J. Confidence limits on phylogenies: an approach using the bootstrap. Evolution. 1985;39: 783-91. [ Links ]
30. Garbeva P, van Veen JA, van Elsas JD. Predominant Bacillus spp. in agricultural soil under different management regimes detected via PCR-DGGE. Microb Ecol. 2003;45: 302-16. [ Links ]
31. Gerding V, Schatter J, Aparicio JL, Grez R. Rendimiento de Eucalyptus nitens con distintos manejos nutritivos en un suelo rojo arcilloso del sur de Chile. Simposio IUFRO. Desarrollando el eucalipto del futuro. Valdivia, Chile, 2001, p.16. [ Links ]
32. Gholami A, Shahsavani S, Nezarat S. The effect of plant growth promoting rhizobacteria (PGPR) on germination,seedling growth and yield of maize. WASET. 2009;25: 19-24. [ Links ]
33. Glick BR. The enhancement of plant growth by free-living bacteria. Can Microbiol. 1995;41: 109-17. [ Links ]
34. Glick BR. Modulation of plant ethylene levels by the bacterial enzyme ACC deaminase. FEMS Microbiol Lett. 2005;251: 1-7. [ Links ]
35. Glick BR, Pasternak JJ. Plant growth promoting bacteria. En: Glick BR, Pasternak JJ, editores. Molecular biotechnology principles and applications of recombinant DNA. 3.ª ed. Washington DC, ASM Press, 2003, p. 436-54. [ Links ]
36. Glickmann E. Dessaux YA. Critical examination of the specificity of the Salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Appl Environ Microb. 1995;61: 793-6. [ Links ]
37. Goldstein AH. Bacterial solubilization of mineral phosphates: historical perspective and future prospects. Am J Altern Agric. 1986;1: 51-7. [ Links ]
38. Hamaki T, Suzuki M, Fudou R, Jojima Y, Kajiura T, Tabuchi A, Sen K , Shibai H. Isolation of novel bacteria and actinomycetes using soil-extract agar medium. J Biosci Bioeng. 2005;99: 485-92. [ Links ]
39. Idris EE, Iglesias DJ, Talon M, Borriss M. Tryptophan-dependent production of indole-3-acetic acid (IAA) affects level of plant growth promotion by Bacillus amyloliquefaciens FZB42. Mol Plant Microbe Interact. 2007;20: 619-26. [ Links ]
40. Jacobsen BJ, Zidack NK & Larson BJ. The role of bacillus-based biological control agents in integrated pest management systems: plant diseases. Phytophatology. 2004;94: 1272-5. [ Links ]
41. Jetiyanon K, Wittaya-Areekul S, Plianbangchang P. Film coating of seeds with Bacillus cereus RS87 spores for early plant growth enhancement. Can J Microbiol. 2008;54: 861-7. [ Links ]
42. Karthikeyan A, Sakthivel KM. Efficacy of Azotobacter chroococcum in rooting and growth of Eucalyptus camaldulensis stem cuttings. Res J Microbiol. 2011;6: 618-24. [ Links ]
43. Khan AA, Jilani G, Akhtar M S, Naqvi SS, Rasheed M. Phosphorus solubilizing bacteria: occurrence, mechanisms and thei r role in crop production. J Agric Biol Sci. 2009;1: 48-58. [ Links ]
44. Kim KY, Jordan D, Kridhnan HB. Rahnella aquatilis, a bacterium isolated from soybean rhizosphere can solubilize hydroxyapatite. FEMS Microbiol Lett. 1997;153: 273-7. [ Links ]
45. King EO, Ward WK, Raney DE. Two simple media for the demostration of pyocyanin and fluorescein. J Lab Clin Med. 1954;44: 301-7. [ Links ]
46. Kloepper JW, Schroth MN. Plant growth promoting rhizobacteria on radishes. Proceedings of the 4th international conference on plant pathogenic bacteria. Angers, France, INRA, 1978, p. 879. [ Links ]
47. Kloepper JW, Reddy MS, Rodríguez-Kabana R, Kenney DS, Kokalis-Burelle N, Martinez-Ochoa N. Application for rhizobacteria in transplant production and yield enhancement. Acta Hort (ISHS). 2004;631: 219-29. [ Links ]
48. Kokalis- Burelle N, Vavrina CS, Rosspok EN, Shelby RA. Field evaluation of plant growth-promoting rhizobacterias transplant mixes and soil solarization for tomato and pepper production. Plant Soil. 2002;238: 257-66. [ Links ]
49. Kuster E, William T. Production of hydrogen sulfite by streptomycetes and methods for its detection. Appl Microbiol. 1964;12: 46-52. [ Links ]
50. Lane DJ.16S/23S rRNA sequencing. En: Stackebrandt E, Goodfellow M, editores. Nucleic acid techniques in bacterial systematics. New York, Wiley, 1991, p. 115-47. [ Links ]
51. Lazarovits G, Nowak J. Rhizobacteria for improvement of plants growth an establishment. HortSience. 1997;32: 188-92. [ Links ]
52. Lenin G, Jayanthi M. Indoleacetic acid, gibberellic acid and siderophore production by PGPR isolates from rhizospheric Soils of Catharanthus roseus. Int J Pharmacy Biol Arch. 2012;3: 933-8. [ Links ]
53. Leveau JHJ, Lindow SE. Utilization of the plant hormone indole-3-acetic acid for growth by Pseudomonas putida strain 1290. Appl Environ Microbiol. 2005;71: 2365-71. [ Links ]
54. Li J, Ovakin DH, Charles TC, Glick BR. An ACC deaminase minus mutant of Enterobacter cloacae UW4 no longer promotes root elongation. Curr Microbiol. 2000;41: 101-5. [ Links ]
55. López C. Eucalyptus nitens: Una alternativa que se proyecta. Lignum. 2006;90: 39-41. [ Links ]
56. Mafia RG, Alfenas AC, Maffia LA, Ferreira EM, Siqueira L. Efeito de rizobacterias o enraizamento e crescimento de clones de Eucalipto em diferentes condições de propagação clonal. R Árvore. 2007;31: 813-21. [ Links ]
57. Magallan P, Dion P. Importancia de los microorganismos promotores de crecimiento vegetal para los pequeños productores de Bolivia. Curso práctico-teórico de microbiología agrícola. Cochabamba-Bolivia, Fundación PROINPA; 2009. [ Links ]
58. Maliha R, Khalil S, Ayub N, Alam S, Latif F. Organic acids production and phosphate solubilization by microorganisms (PSM) under in vitro conditions. Pak J Biol Sciences. 2004;7: 187-96. [ Links ]
59. Mardad I, Serrano A, Soukri A. Solubilization of inorganic phosphate and production of organic acids by bacteria isolated from a Moroccan mineral phosphate deposit. Afr J Microbiol Res. 2013;7: 626-35. [ Links ]
60. Marra LM, de Oliveira SM, Fonsêca Sousa Soares CR, de Souza Moreira FM. Solubilisation of inorganic phosphates by inoculant strains from tropical legumes. Sci Agric. 2011;68: 603-9. [ Links ]
61. Mohammad G, Prasad R. Influence of microbial fertilizers on biomass accumulation in polypotted Eucalyptus calmadulensis. J Trop For. 1998;4: 74-7. [ Links ]
62. Mohan V, Radhaskrihnan A. Screening of phosphate solubilizing bacterial isolates for the growth improvement of Tectona grandis Linn. Res J Microbiol. 2012;7: 101-13. [ Links ]
63. Nautiyal CS. An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiol Lett. 1999;170: 265-70. [ Links ]
64. Nelson LM. Plant growth promoting rhizobacteria (PGPR): prospects for new inoculants. Plant Manag Network. 2004. doi: 10.1094/CM-2004-0301-05-RV. [ Links ]
65. Ngamau NC, Matiru VN, Tani A, Muthuri WC. Isolation and identification of endophytic bacteria of bananas (Musa spp.) in Kenya and their potential as biofertilizers for sustainable banana production. Afr J Microbiol Res. 2012;6: 6414-22. [ Links ]
66. O'Reilly C, Keane M, Morrissey N. The importance of plant size for successful forest plantation establishment. Coford connects. Boletín Nº5, 2002, Dublin, Ireland. [ Links ]
67. Pal KK, Tilak KVBR, Saxena AK, Dey R, Singh CS. Suppression of maize root diseases caused by Macrophomina phaseolina, Fusarium moniliforme and Fusarium germinearum by plant growth promoting rhizobacteria. Microbiol Res. 2001;156: 209-23. [ Links ]
68. Pantos O, Cooney RP, Le Tissier MDA, Barer MR, O'Donnell AG, Blythell JC. The bacterial ecology of a plague-like disease affecting the Caribbean coral Montastraea annularis. Environ Microbiol. 2003;5: 370-82. [ Links ]
69. Paredes M, Espinosa D. Ácidos orgánicos producidos por rizobacterias que solubilizan fosfato; una revisión crítica. Terra Latinoam. 2010;28: 61-70. [ Links ]
70. Patten CL, Glick BR. Role of Pseudomonas putida indole-acetic acid in development of the host plant root system. Appl Environ Microbiol. 2002;68: 3795-801. [ Links ]
71. Penrose DM, Glick BR. Levels of 1-aminocyclopropane-1-carboxylic acid (ACC) in exudates and extracts of canola seeds treated with plant growth-promoting bacteria. Can J Microbiol. 2001;47: 368-72. [ Links ]
72. Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria. Physiol plantarum. 2003;118: 10-5. [ Links ]
73. Persello-Cartieaux F, Nussaume L, Robaglia C. Tales from the underground: molecular plant-rhizobacteria interactions. Plant Cell Environ. 2003;26: 189-99. [ Links ]
74. Puente ML, García JE, Pathauer P, Perticari A. Inoculation with Azospirillum brasilense is a useful tool in Eucalyptus globulus managemenent. Amer-Eurasian J Agri Environm Sci. 2010;8: 124-30. [ Links ]
75. Ramos Solano B, Pereyra de la Iglesia MT, Probanza A, Lucas Garcia JA, Megias M, Gutierrez Manero FJ. Screening for PGPR to improve growth of Cistus ladanifer seedlings for reforestation of degraded mediterranean ecosystem. Plant Soil. 2006;287: 59-68. [ Links ]
76. Ran LX, Liu CY, Wu GJ, Van Loon LC, Bakker PAH. Suppression of bacterial wilt in Eucalytpus urophylla by fluorescent Pseudomonas spp. in China. Biol Control. 2005;32: 111-20. [ Links ]
77. Ran LX, Li ZN, Wu GJ, van Loon LC, Bakker PAH. Induction of systemic resistance against bacterial wilt in Eucalyptus urophylla by fluorescent Pseudomonas spp. Eur J Plant Pathol. 2005;113: 59-70. [ Links ]
78. Read TD, Salzberg SL, Pop M, Shumway M, Umayam L, Jiang L, Holtzapple E, Busch JD, Smith KL, Schupp JM, Solomon D, Keim P, Fraser CM. Comparative genome sequencing for discovery of novel polymorphisms in Bacillus anthracis. Science. 2002;296: 2028-33. [ Links ]
79. Saharan BS, Nehra V. Plant growth promoting rhizobacteria: a critical review. Life Sci Med Res. 2011;21: 1-30. [ Links ]
80. Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol Biol Evol. 1987;4: 406-25. [ Links ]
81. Saleem M, Arshad M, Hussain S, Bhatti AS. Perspective of plant growth promoting rhizobacteria (PGPR) containing ACC deaminase in stress agriculture. J Ind Microbiol Biotechnol. 2007;34: 635-48. [ Links ]
82. Saraf M, Kumar Jha C, Pate D. The role of ACC deaminase producing PGPR in sustainable agriculture. En: Maheshwari DK, editor. Plant growth and health promoting bacteria. Münster, Germany, Springer, 2010, p. 365-86. [ Links ]
83. Sariah M, Sariam O, Radziah O, Zainal Abidin MA. Rice seed bacterization for promoting germination and seedling growth under aerobic cultivation system. Aust J Crop Sci. 2010;6: 170-5. [ Links ]
84. Spaepen S, Vanderleyden J, Remans R. Indole-3-acetic acid in microbial and microorganism plant signaling. FEMS Microbiol Rev. 2007;31: 425-48. [ Links ]
85. Stewart GS, Johnstone K, Hagelberg E, Ellar DJ. Commitment of bacterial spores to germinate. A measure of the trigger reaction. Biochem. 1981;7: 101-6. [ Links ]
86. Tamura K, Nei M, Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method. Proc Natl Acad Sci USA. 2004;101: 11030-5. [ Links ]
87. Teixeira DA, Alfenas AC, Mafia R, Ferreira E, Siqueira LA, Maffia L, Mounteer AH. Rhizobacterial promotion of eucalypt rooting and growth. Braz J Microbiol. 2007;38: 118-23. [ Links ]
88. Tsavkelova EA, Klimova SY, Cherdyntseva TA, Netrusov AI. Microbial producers of plant growth stimulators and their practical use: a review. Appl Biochem Microbiol. 2006;42: 117-26. [ Links ]
89. Turner J, Backman P. Factors relating to peanut yield increases following Bacillus subtilis seed treatment. Plant Dis. 1989;73: 347-53. [ Links ]
90. Vyas P, Gulati A. Organic acid production in vitro and plant growth promotion in maize under controlled environment by phosphate-solubilizing fluorescent Pseudomonas. BMC Microbiol. 2009;9: 174-81. [ Links ]
91. Weise T, Kai M, Piechulla B. Bacterial ammonia causes significant plant growth inhibition. Plos One. 2013;8: e63538. [ Links ]
92. Zakry Fitri AA, Halimi MS, Khairuddin R, Osumanu HA. Variable responses on early development of shallot (Allium ascalonicum) and mustard (Brassica juncea) plants to Bacillus cereus inoculation. Malays J Microbiol. 2012;8: 47-50. [ Links ]














