Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541
Rev. argent. microbiol. vol.47 no.3 Ciudad Autónoma de Buenos Aires set. 2015
http://dx.doi.org/10.1016/j.ram.2015.06.006
ARTÍCULO ESPECIAL
http://dx.doi.org/10.1016/j.ram.2015.06.006
Interrogantes en la tecnología de la inoculación de semillas de soja con Bradyrhizobium spp.
Queries related to the technology of soybean seed inoculation with Bradyrhizobium spp.
Aníbal R. Lodeiro
Laboratorio de Interacciones entre Rizobios y Soja (LIRyS), IBBM-Facultad de Ciencias Exactas, UNLP y CCT-La Plata CONICET, La Plata, Buenos Aires, Argentina
Correo electrónico: lodeiro@biol.unlp.edu.ar
Recibido el 5 de mayo de 2014; aceptado el 6 de junio de 2015
Disponible en Internet el 9 de setiembre de 2015
© 2015 Asociación Argentina de MicrobiologÃa. Publicado por Elsevier España, S.L.U. Este es un artÃculo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/).
Resumen
Con el fin de aprovechar la fijación simbiótica de nitrógeno, el cultivo de soja se inocula con cepas seleccionadas de Bradyrhizobium japonicum, Bradyrhizobium diazoefficiens o Bradyrhizobium elkanii (conjuntamente referidas como Bradyrhizobium spp.). El método más común de hacerlo es la inoculación en semillas, ya sea que esta se realice en el momento previo a la siembra o que se utilicen semillas preinoculadas o pretratadas mediante el tratamiento profesional de semillas. La metodología de inoculación no debe limitarse a recubrir las semillas con rizobios vivos, sino que también debe optimizar las chances de esos rizobios para infectar las raíces y nodular. Para ello los rizobios inoculados deben estar en una cantidad y un estado tales que les permitan superar la competición ejercida por los rizobios de la población alóctona del suelo, los cuales usualmente son menos eficaces para la fijación de nitrógeno y así diluyen el efecto de la inoculación sobre el rendimiento. Esta optimización requiere resolver algunos interrogantes, que son abordados en el presente artículo. Concluyo que los aspectos que requieren más investigación son la adhesión y supervivencia de los rizobios en las semillas, la liberación de los rizobios una vez que las semillas se depositan en el suelo y el movimiento de los rizobios desde las inmediaciones de las semillas hasta los sitios de infección en las raíces.
Palabras clave: Bradyrhizobium; Soja; Inoculación; Competición; Supervivencia; Movilidad;
Abstract
With the aim of exploiting symbiotic nitrogen fixation, soybean crops are inoculated with selected strains of Bradyrhizobium japonicum, Bradyrhizobium diazoefficiens or Bradyrhizobium elkanii (collectively referred to as Bradyrhizobium spp.). The most common method of inoculation used is seed inoculation, whether performed immediately before sowing or using preinoculated seeds or pretreated seeds by the professional seed treatment. The methodology of inoculation should not only cover the seeds with living rhizobia, but must also optimize the chances of these rhizobia to infect the roots and nodulate. To this end, inoculated rhizobia must be in such an amount and condition that would allow them to overcome the competition exerted by the rhizobia of the allochthonous population of the soil, which are usually less effective for nitrogen fixation and thus dilute the effect of inoculation on yield. This optimization requires solving some queries related to the current knowledge of seed inoculation, which are addressed in this article. I conclude that the aspects that require further research are the adhesion and survival of rhizobia on seeds, the release of rhizobia once the seeds are deposited in the soil, and the movement of rhizobia from the vicinity of the seeds to the infection sites in the roots.
Keywords: Bradyrhizobium; Soybean; Inoculation; Competition; Survival; Motility.
Introducción
La soja, como todas las leguminosas, se caracteriza por poseer dos vías distintas para la captación y asimilación de nutrientes nitrogenados. Una de ellas parte de compuestos nitrogenados solubles que se encuentran disponibles en la solución del suelo y la otra requiere la asociación con rizobios fijadores de nitrógeno. Los rizobios son procariotas que incluyen α y β-proteobacterias, y pueden existir tanto en vida libre en el suelo como asociados simbióticamente con las raíces de las leguminosas formando nódulos. Sin embargo, solo los rizobios que se encuentran dentro de los nódulos son capaces de fijar nitrógeno. Allí, los rizobios encuentran un ambiente con baja presión parcial de O2, lo que permite la expresión y actividad del complejo nitrogenasa. Este complejo cataliza la reducción de N2 atmosférico a NH4+, el cual queda disponible para la planta. En compensación, los rizobios dentro del nódulo reciben protección y energía por parte de la planta58,67,81. Esta asociación simbiótica es altamente específica, y en particular la soja es nodulada por un número reducido de especies de rizobios, entre las que se encuentran Bradyrhizobium japonicum, Bradyrhizobium diazoefficiens, Bradyrhizobium elkanii y Ensifer fredii22.
El proceso de nodulación es complejo y se desarrolla en varias etapas, que incluyen los siguientes eventos: un intercambio de señales moleculares que permiten el reconocimiento simbiótico entre la planta y la bacteria, la adhesión de la bacteria a la superficie radical, la infección de la raíz por dentro de los pelos radicales, la diferenciación y el desarrollo del nódulo en la planta disparados por moléculas del rizobio, la invasión de los nódulos y la diferenciación de los rizobios dentro de los nódulos a las formas capaces de catalizar la fijación de N256. La complejidad de este proceso se debe a que el rizobio debe ser estrictamente reconocido por la planta como un simbionte no patogénico, y a que la planta invierte mucha energía en el desarrollo de los nódulos y su posterior mantenimiento. Por ello, la planta también regula el número total de nódulos que se forman en su sistema radical mediante la monitorización del aporte que aquellos realizan a su nutrición nitrogenada55,70,71.
Para aprovechar la alternativa de la fijación simbiótica de N2 en los cultivos de soja se emplean inoculantes, producidos y comercializados por más de 70 empresas en nuestro país, los cuales son formulados con rizobios activos capaces de asociarse con la planta. Las especies más utilizadas en los inoculantes actuales son B. japonicum y B. diazoefficiens, y anteriormente se utilizó también B. elkanii. En particular, el INTA recomienda la cepa B. japonicum E109, la que, por lo tanto, se incluye en la mayoría de los inoculantes66.
La soja es la leguminosa con mayor superficie sembrada en Argentina, con 20 millones de hectáreas7. En este cultivo se observa un uso generalizado de inoculantes: en una encuesta realizada por el Proyecto Inocular del INTA a nivel nacional, el 94 % de los productores consultados manifestó usar «siempre o casi siempre» inoculantes, esta proporción llegó al 100 % en el centro de Santa Fe, sur de Entre Ríos y el NEA66. Sin embargo, también es cierto que la respuesta a la inoculación en términos de rendimiento del cultivo dista de ser óptima, y si se siguen utilizando inoculantes, ello obedece principalmente a su muy bajo costo y simplicidad de aplicación, más que a un resultado concreto y reproducible. Es indudable que la inoculación forma parte de cualquier metodología de agricultura sustentable y, por lo tanto, el aumento de su eficiencia es un objetivo en sí mismo.
Visto desde esta perspectiva, el problema no se agota en asegurar que los inoculantes contengan un alto título de células viables y con larga vida media, sino que además resulta importante asegurar que con su aplicación el cultivo de soja produzca una buena simbiosis en términos de nodulación y fijación de N2. Estos aspectos suelen estar condicionados por diversos factores que actúan después de la inoculación, entre ellos el manejo del cultivo y factores ambientales bióticos y abióticos que influyen sobre la performance del inoculante durante la siembra y la nodulación. Por lo tanto, es interesante preguntarnos si es posible que en la formulación y la aplicación del inoculante puedan contemplarse estos factores postinoculación. La respuesta en muchos casos es que sí: por ejemplo, pueden desarrollarse formulaciones o seleccionarse cepas para tolerar condiciones edafoclimáticas adversas a nivel local12,52,80, puede evaluarse la afinidad de ciertas cepas por determinadas variedades14,28,74, pueden formularse inoculantes combinados con otras especies procariotas para aprovechar propiedades promotoras del crecimiento vegetal en la rizosfera45, etc. No obstante, por razones de espacio, no se hará aquí una revisión completa de todos estos aspectos, por lo que me centraré en las condiciones que debería reunir el inoculante para superar un problema de origen biológico conocido como el problema de la competición para la nodulación. Dado que ya se ha revisado este problema en una publicación anterior63, me limitaré a describir sus aspectos relevantes para la formulación y aplicación de inoculantes a semillas de soja.
El problema de la competición para la nodulación
Al ser la soja una planta oriunda del Lejano Oriente, en la mayoría de los suelos argentinos no existían rizobios noduladores de esta especie antes de su introducción como cultivo en nuestro país. Esto motivó que las primeras inoculaciones produjeran notables aumentos de rendimiento en suelos pobres en nitrógeno, lo cual aún se sigue observando en ciertas zonas marginales recién incorporadas al cultivo. Sin embargo, la reiterada inoculación a lo largo de varios años llevó al establecimiento de poblaciones alóctonas de rizobios noduladores de soja en el suelo. Estas poblaciones sufrieron luego cambios genéticos y hoy las poblaciones alóctonas de rizobios noduladores de soja poseen una gran diversidad genotípica, al punto que resulta difícil encontrar los genotipos de los inoculantes originales12,44,52. Estos rizobios de la población alóctona del suelo están muy bien adaptados a las condiciones edafoclimáticas locales en lo que respecta a, por ejemplo, pH, temperatura, estado hídrico o presencia de metales pesados o de glifosato12, con lo cual suelen ocupar la mayoría de los nódulos, aun cuando el cultivo se haya inoculado con un inoculante de buena calidad42,52.
La fijación de N2 de una planta depende tanto de la eficacia de cada nódulo como del número total de nódulos. Si la mayor parte de los nódulos está ocupada por rizobios de la población alóctona del suelo, la tasa de fijación de N2 de la planta estará determinada en gran medida por la capacidad promedio de fijar N2 que posea dicha población, la cual, como es esperable, en general es inferior (y a veces muy inferior) a la de la cepa seleccionada que se usó para inocular. Así, se viene observando que los aumentos de rendimiento promedio en parcelas inoculadas con respecto a parcelas sin inocular no superan el 6 al 10 % (promedio de más de 700 ensayos desde 1990 hasta 2007)66. Por otro lado, en ensayos donde se determinó el aporte de la fijación simbiótica de N2 a la biomasa de la parte aérea en forma discriminada del aporte del nitrógeno del suelo, se observó que un 60-65 % del nitrógeno provino de la fijación simbiótica de N2, sin que se observaran diferencias entre parcelas inoculadas y sin inocular66. Esto significa que la inoculación no está aportando a reducir el uso del nitrógeno del suelo, el que constituye el 35-40 % del nitrógeno asimilado por el cultivo de soja.
Dado que alrededor del 75 % del nitrógeno adquirido por la planta se exporta al grano, una porción significativa del nitrógeno del suelo es retirada durante la cosecha. Por ejemplo, con un rendimiento modesto, de 2500 kg por hectárea, se estarían retirando del suelo entre 54 y 61 kg de nitrógeno por hectárea cada año. Tal como se expresa en la investigación llevada a cabo por Piccinetti et al.66, esto ocurre en todas las zonas sojeras del país, independientemente de las características edafoclimáticas locales o de la calidad del manejo y la conservación del suelo, lo cual convierte al problema de la competición para la nodulación en un cuello de botella de carácter general. Por este motivo considero que debe encararse este problema como prioritario en toda investigación sobre la mejora de la inoculación, y además, que debe contemplarse a la hora de formular y aplicar el inoculante, aun cuando sea este un problema que ocurre después de la inoculación, e incluso después de la siembra. En otras palabras, de nada sirve poseer inoculantes muy bien formulados, de larga vida media y preparados con cepas cuidadosamente seleccionadas si después descuidamos su competitividad para nodular y nos encontramos con que el 90 % de los nódulos terminan ocupados por cepas de la población alóctona del suelo42.
El problema tiene otra arista aún más acuciante. Como se ha mencionado, en Argentina se siembran anualmente cerca de 20 millones de hectáreas con soja, pero el ritmo de aumento de la superficie sembrada parece haberse amesetado desde la campaña 2009/20107. Dejando de lado posibles aspectos económico-financieros, este amesetamiento podría indicar que la ocupación de la superficie cultivable está llegando al límite. Por lo tanto, cualquier incremento de la producción que pueda lograrse de aquí en adelante no será por incorporación de más hectáreas, sino por incrementos en la productividad por hectárea, lo cual implica mayor extracción de nutrientes por unidad de superficie de suelo. Dicho de otro modo: si el mejoramiento vegetal logra variedades de soja más productivas pero no se mejora en paralelo la fijación simbiótica de N2, la tasa de extracción de nitrógeno del suelo y su consecuente degradación aumentarán.
Objetivos de la inoculación
La manera más usual de inocular la soja es mezclar las semillas con el inoculante inmediatamente antes de la siembra, a razón de 3 a 4 ml de inoculante líquido por kilogramo de semilla. De esta manera, las semillas quedan recubiertas con el inoculante, aunque la distribución del mismo entre las distintas semillas suele ser heterogénea66. Esta técnica, además de ser simple, es de una gran practicidad, ya que no requiere labores adicionales de pre o postsiembra, tampoco requiere un equipamiento especial en la sembradora. Asimismo, es adecuada para tratamientos de preinoculación, los cuales se realizan con equipos especiales mucho antes de la siembra, asegurando una distribución más homogénea del inoculante, y para la incorporación del inoculante en el tratamiento profesional de semillas, que se realiza con equipamiento especializado e incluye la dosificación exacta de este y otros componentes de presiembra, como fungicidas, micronutrientes y estimuladores de la germinación, con lo cual podría brindársele al productor una semilla tratada e inoculada, lista para sembrar y con la dosis adecuada de cada componente. En particular, la preinoculación y el tratamiento profesional de semillas están considerados como prácticas que proveen la dosis adecuada a cada semilla, lo que evita las grandes variaciones de dosificación que son comunes en los tratamientos de inoculación manual. Sin embargo, los objetivos de la inoculación no deben limitarse solo al recubrimiento de las semillas con un gran número de rizobios vivos, sino que, como se indicó anteriormente, también deben contemplar que un adecuado número de rizobios vivos lleguen a ponerse en contacto con las raíces, las colonicen y las infecten, en presencia de una población alóctona de rizobios noduladores de soja. Esto puede lograrse si se toma en consideración que el número de rizobios inoculado por semilla sea tal que equipare el número de rizobios competidores que encontrará la futura raíz en desarrollo, y que el estado fisiológico de los rizobios inoculados sea tal que favorezca una adecuada colonización rizosférica y posterior infección. Estimo que, más allá de las condiciones locales (las cuales incluyen, obviamente, los genotipos de las poblaciones de rizobios noduladores de soja presentes), estos 2 aspectos, número y calidad fisiológica de los rizobios inoculados, son de carácter general y deben ser considerados. Por lo tanto, es necesario poseer una estimación de cuál podría ser el número de rizobios adecuado y prestar atención a qué estado fisiológico se desea lograr en el momento de la infección radical.
Las poblaciones alóctonas de rizobios noduladores de soja son, además de variadas, bastante densas. En varios suelos se han registrado poblaciones alóctonas del orden de 105 a 106 de rizobios noduladores de soja por gramo de suelo42,52. Se podría suponer que una plántula de soja que posee el primer par de hojas juveniles completamente desarrollado tiene una raíz principal y de 4 a 8 raíces secundarias, cada una de las cuales posee un diámetro aproximado de 1 mm y un largo de unos 10 cm. Este sería el sistema radical que debería ser colonizado e invadido por los rizobios del inoculante para lograr una buena nodulación temprana, que es la que aporta la mayor tasa de fijación de N2. Mediante un cálculo teórico que no incluye el volumen de raíz aportado por los pelos radicales, el sistema radical estaría constituido por 7 cilindros de 0,5 mm de radio por 10 cm de largo cada uno. El volumen acumulado de estos 7 cilindros sería entonces de 0,55 cm3, y considerando una densidad aparente del suelo de 1,3 g/cm3, el establecimiento de esas raíces desplazaría 0,71 g de suelo (en peso fresco). Es decir que con las densidades de rizobios alóctonos mencionadas, la inoculación debería posicionar a una población del orden de 7 × 104 -7 × 105 rizobios por raíz en estas primeras etapas del crecimiento de la plántula, como para tener un número de rizobios inoculados equivalente al número de rizobios competidores de la población del suelo. Con respecto al estado fisiológico deseable, la metodología de inoculación debe garantizar que los rizobios: 1) se adhieran a las semillas; 2) sobrevivan allí hasta después de la siembra; 3) se liberen de las semillas una vez sembradas y sobrevivan en el suelo hasta la germinación, 4) y se trasladen en el suelo hasta las raíces en crecimiento y colonicen rápidamente la rizosfera en la zona infectable (fig. 1). Estas acciones son el prerrequisito para que puedan penetrar los pelos radicales antes de que maduren e invadir así los nódulos en formación.
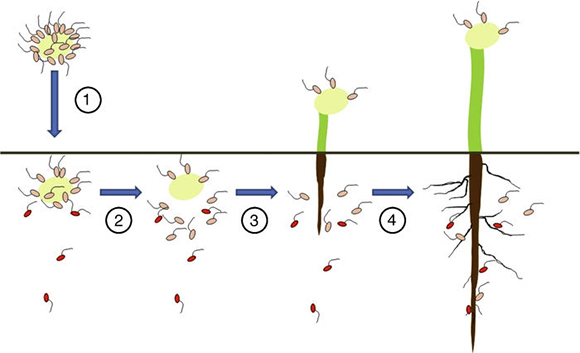
Figura 1. Etapas que podrían limitar la competición de los rizobios inoculados con los de la población alóctona del suelo. Los rizobios inoculados se representan en rosa y los de la población alóctona del suelo, en rojo. Los números en círculos indican las etapas del proceso. Etapa 1: las semillas con los rizobios adheridos se siembran en un suelo que contiene rizobios alóctonos distribuidos uniformemente en el perfil. Etapa 2: luego de la inoculación y la siembra ocurre mortandad entre los rizobios inoculados. Etapa 3: dependiendo del grado de adhesión irreversible alcanzado, algunos rizobios se desprenden de las superficies seminales mientras que otros quedan adheridos a los tegumentos. Las semillas germinan y los cotiledones emergen del suelo llevando unidos los rizobios adheridos irreversiblemente a los tegumentos; además, puede ocurrir mortandad de los rizobios liberados al suelo. Etapa 4: parte de los rizobios sobrevivientes pueden trasladarse por movimientos activos o pasivos hasta las zonas infectables de las raíces en crecimiento, mientras que los rizobios de la población alóctona no necesitan hacerlo puesto que ya estaban distribuidos en el perfil de suelo.
A la luz de los resultados descriptos en la sección precedente, se deduce que la técnica de la inoculación necesita sustanciales mejoras para superar la competición ejercida por los rizobios de la población alóctona del suelo durante las etapas mencionadas, con el fin de poner suficiente cantidad de los rizobios inoculados en contacto con las raíces para colonizarlas e infectarlas al nivel requerido. Para ello es necesario resolver varios interrogantes que permanecen como un vacío en el conocimiento en lo que respecta a la eficacia de la inoculación de semillas de leguminosas (y de soja en particular), interrogantes que, curiosamente y pese al enorme número de publicaciones existente, aún persisten. A continuación, planteo dichos interrogantes y propongo las líneas experimentales que, a mi juicio, sería necesario abordar para avanzar en su elucidación.
Adhesión de los rizobios a las superficies de las semillas
Este es uno de los aspectos en los que, si bien ha sido muy investigado en diversas especies de bacterias y plantas, prácticamente se carece de resultados generados en sistemas semejantes a la realidad de la inoculación en semillas. En efecto, el protocolo usual para las investigaciones de adhesión de bacterias a semillas (u otras superficies) consiste en una esterilización superficial de las semillas —casi siempre con hipoclorito de sodio y alcohol, seguido de varios lavados con agua estéril—, y luego la inmersión de las semillas en una suspensión que contiene las bacterias cuya adhesión se quiere medir, las cuales generalmente provienen de cultivos en fase de crecimiento exponencial. Finalmente, se lava para eliminar las bacterias débilmente adheridas y se cuenta el remanente, firmemente adherido a la superficie seminal. A veces, incluso las semillas se dejan germinar antes de realizar el ensayo de adhesión17,23,35,54,61,77,84,90. Este protocolo contrasta con la práctica de la inoculación en semillas en tres aspectos esenciales: a) se usan bacterias en fase de crecimiento exponencial en vez de bacterias en fase estacionaria, como las que se encuentran en un inoculante líquido; b) se usan semillas mojadas y a veces completamente embebidas en vez de las semillas secas, listas para almacenar o sembrar, y c) se usa un gran volumen de inóculo, que usualmente excede varias veces el volumen de la semilla, en vez del pequeño volumen usado en la práctica de la inoculación. Además, es frecuente que en los ensayos de adhesión las semillas permanezcan sumergidas durante algunas horas en la suspensión de bacterias antes de ser lavadas en vez de dejarse secar al aire, como en la práctica de la inoculación. Por lo tanto, las conclusiones que reseñaré a continuación, obtenidas en los mencionados trabajos, deben tomarse con cautela a la hora de extrapolarlas a la inoculación sobre semillas a fin de ponderar las características fisiológicas del inóculo.
La adhesión bacteriana tanto a semillas como a raíces, y también a superficies abióticas, es un proceso que requiere varias horas y consta de dos etapas: una primera etapa de adhesión reversible y una segunda etapa de adhesión irreversible18,72,76. Si bien no está claro hasta qué punto estas etapas son sucesivas o coexisten durante cierto intervalo, parece ser que la adhesión reversible es rápida (de 2 a 4 h), mientras que la irreversible requiere un contacto prolongado de los rizobios con la semilla (alrededor de 12 h). Esto indicaría que aun cuando las semillas se inoculen y se siembren enseguida, el tiempo que transcurre desde la inoculación hasta que las semillas germinan permitiría que ocurra la adhesión irreversible. Sin embargo, el porcentaje de rizobios que llegan a adherirse de esta manera puede ser bajo. Se ha estimado que solo del 10 al 15 % de las células de un cultivo de B. diazoefficiens son capaces de adherirse a las raíces de soja, y de ellas, menos de una cuarta parte llegan a manifestar la adhesión irreversible85.
En otros estudios llevados a cabo por la Red de Control de Calidad de Inoculantes (REDCAI) para determinar las condiciones de recuento de viables sobre semillas inoculadas, se ha propuesto como parámetro el factor de recuperación (FR), que mide el porcentaje de células viables recuperadas de las semillas con respecto a la cantidad inoculada luego de 10 min desde la inoculación60. Si bien no es estrictamente una medida de la adhesión, el método de inoculación y recuento es más parecido a la práctica de la inoculación en semillas que las metodologías descritas anteriormente. El resultado promedio del FR obtenido por seis laboratorios de la REDCAI empleando B. japonicum y semillas de soja fue 12 ± 10 %60, lo cual es congruente con el resultado mencionado con anterioridad.
Estudios con mutantes han indicado que entre las adhesinas responsables de la adhesión reversible se encuentran los polisacáridos de superficie y los flagelos, mientras que la adhesión irreversible parece estar mediada por fibrillas de celulosa18,72,76. Además, se ha reportado la participación de cationes como Ca2+, Mg2+ y Fe3+ y un número de estructuras extracelulares y proteínas, entre ellas fimbrias y lectinas tanto vegetales como bacterianas, aunque en este aspecto no existe un patrón generalizable a todas las especies de rizobios. El estado de crecimiento del inóculo también desempeña un papel: las bacterias en fase estacionaria son las menos capaces para realizar la adhesión30,38,39,88.
De todas maneras, no debería preferirse una adhesión demasiado fuerte de los rizobios a las semillas luego de la inoculación, y en absoluto debería favorecerse la adhesión irreversible. La idea de la inoculación es que la semilla actúe simplemente como «medio de transporte» para los rizobios, pero estos deberían liberarse al suelo tan pronto como la semilla es sembrada para comenzar el proceso de colonización de la rizosfera. De lo contrario, ya que la soja es una planta de germinación epigea, los rizobios adheridos en forma irreversible a la superficie seminal serían llevados fuera del suelo por los cotiledones, que suelen emerger con los tegumentos aún adheridos. Lamentablemente, pocos estudios se centraron en los factores que permiten a los rizobios liberarse de las superficies seminales, y tampoco hay estudios comparativos acerca de la eficiencia para la colonización rizosférica por parte de rizobios inoculados en semillas de plantas de germinación epigea o hipogea.
Supervivencia de los rizobios sobre las semillas
Los rizobios poseen una baja tasa de supervivencia sobre las semillas, la cual depende, entre otros factores, de la edad del inóculo, de la eventual presencia de contaminantes y el tipo de aquellos, y del grado de sequedad de la semilla20. Se ha descripto que existen dos fases de mortandad: una primera fase bastante rápida, del orden de 4 h, donde muere la mayor parte de los rizobios inoculados, y una segunda fase de decaimiento más lento, que usualmente se estabiliza alrededor de las 24 h59. Así, en semillas de soja inoculadas con B. diazoefficiens muere el 75 % de los rizobios dentro de las primeras 2 h luego de la inoculación, el 90 % luego de 24 h y el 95 % luego de 48 h80. Observaciones similares se realizaron en Bradyrhizobium sp. aplicado a semillas de lupino73. En B. japonicum se ha observado una tasa de supervivencia de entre 5 y 10 % a las 24 h a 30 °C; la supervivencia puede aumentar si se disminuye la temperatura de almacenaje o se utilizan protectores como sacarosa o carboximetil celulosa59. Se ha informado que a tiempos más largos, del orden de semanas, la supervivencia se reduce entre un 70 y 90 % del valor que tenía a las 24 h21. Asimismo, se ha observado que en 24 h se incrementa la cantidad de bacterias en estado viable pero no cultivable, lo cual es importante, ya que se ha correlacionado el número de nódulos producido con la cantidad de bacterias cultivables49.
Las causas por las cuales se da esta mortandad parecen circunscribirse principalmente a la desecación que sufren los rizobios luego de la inoculación y, en menor medida, a los contaminantes y a la acción de sustancias tóxicas tanto provenientes de las semillas, como agregadas durante la inoculación20. Además, si las condiciones de almacenamiento no son adecuadas, la alta temperatura puede también influir negativamente en la supervivencia, y ello se debe, en parte, al efecto de la temperatura sobre la desecación21,59. La desecación induce una serie de respuestas en B. diazoefficiens, entre ellas la biosíntesis de trehalosa, de polisacáridos extracelulares, de pili y de enzimas relacionadas con los mecanismos de reparación del ADN15. Sin embargo, la tolerancia de esta especie a las condiciones de desecación imperantes en la superficie de la semilla es baja y se cree que a esto obedece la mayor parte de la tasa de mortandad49,59,80.
Para aliviar estos efectos se han realizado varias investigaciones con diversas sustancias que podrían actuar como protectores. Con respecto a la desecación, se han probado sustancias capaces de retener agua como la polivinil pirrolidona, la goma arábiga o los mismos exopolisacáridos bacterianos; también se han ensayado osmoprotectores como la trehalosa, la sacarosa o la maltosa, o sustancias para el encapsulamiento, como alginato o ciertos coloides20. En todos los casos se ha observado una mejora de la supervivencia, aunque esta varía con la sustancia y la especie de rizobio, y no se llega a una protección total. La identidad de las sustancias tóxicas producidas por las semillas, así como sus mecanismos de acción, son menos conocidos y, por lo tanto, las pruebas realizadas son más empíricas. Entre las sustancias tóxicas mejor caracterizadas se encuentran los polifenoles y se ha reportado un buen efecto protector del caseinato de sodio o de potasio20.
El efecto negativo de la temperatura obviamente se evita cuidando las condiciones de almacenaje. Sin embargo, dicho efecto resulta difícil de evitar durante la siembra, momento en que la semilla puede entrar en contacto con un suelo a alta temperatura superficial o quedar expuesta al sol por unos momentos. En todos estos casos, los protectores de la desecación pueden desempeñar un papel también frente a la temperatura, aunque se ha reportado que los rizobios aguantan más el calor seco que el húmedo87.
Finalmente, debe tenerse en cuenta que la supervivencia de los rizobios inoculados a las semillas puede verse amenazada cuando además del inoculante se agregan otras sustancias, tales como fungicidas, insecticidas, micronutrientes o estimuladores de la germinación. No siempre estas sustancias resultan inocuas. Por ejemplo, los fungicidas e insecticidas pueden tener cierto grado de toxicidad para los rizobios, o los micronutrientes y estimuladores del crecimiento pueden contener metales pesados tóxicos24. En todos estos casos, las sustancias en sí pueden ser de baja toxicidad pero las concentraciones que se alcanzan en la superficie de la semilla en íntimo contacto con los rizobios pueden ser lo suficientemente altas como para que, aun con una baja toxicidad, la dosis resulte letal a mediano plazo. Este aspecto es particularmente relevante para las semillas preinoculadas y para el tratamiento profesional de semillas, todo lo cual requiere de una mayor investigación para descartar este tipo de efectos tóxicos sobre los rizobios.
En particular, debería consensuarse un protocolo para medir la supervivencia de los rizobios sobre las semillas a lo largo del tiempo desde la inoculación, y con él probar cada una de las variables mencionadas. Existen propuestas a este respecto. Una de ellas consiste en evaluar la cultivabilidad a través de métodos simples como el recuento en placa a distintos tiempos, para establecer la cinética de aparición de colonias o la medida del porcentaje de colonias mayores de 0,95 mm luego de 8 días de cultivo a 30 °C en medio YM, ya que estas medidas podrían correlacionar con la capacidad de nodulación del inoculante49. Otra propuesta se basa en extraer las bacterias de las semillas y realizar el recuento de viables en un medio YM selectivo suplementado con vancomicina y pentacloronitrobenceno59. Los autores realizaron un ajuste de la función bifásica del decaimiento de la supervivencia de los rizobios sobre las semillas y propusieron un parámetro de supervivencia relativa estimada al tiempo en el cual se estabiliza el porcentaje de bacterias sobrevivientes59.
Liberación de los rizobios al suelo
Esta etapa no debe considerarse como disociada de la inoculación, ya que es la etapa previa a la formación de los nódulos y es donde se inicia la competencia directa de los rizobios con los otros microorganismos del suelo, entre ellos, otras cepas de rizobios capaces de nodular la misma planta. Sin embargo, se trata de un área de vacancia sobre la que debería trabajarse más para lograr mejoras en la tecnología de la inoculación. Algunas preguntas básicas aún no respondidas acerca de la facilidad con que las bacterias se liberan de la superficie seminal una vez que entran en contacto con el suelo son si dicha liberación depende del tipo de adhesinas intervinientes; si podría tener relación con el estado fisiológico inducido en la bacteria por las condiciones de crecimiento del inóculo; si los protectores, adhesivos, plaguicidas y otros componentes que se agregan en la semilla preinoculada desempeñan un papel, cuál es la influencia de las características del suelo (p. ej., su contenido hídrico), si la liberación requiere que las bacterias adquieran un estado planctónico o si puede mejorarse por selección artificial.
Si suponemos que el estado adherido a la superficie seminal es similar al estado sésil que se encuentra formando biopelículas, el tipo de adhesinas intervinientes puede influir sobre la reversibilidad de la adhesión. Así, la liberación de los rizobios desde las semillas debería requerir su diferenciación al estado planctónico, en el que pueden nadar79. Los estados sésil y planctónico se distinguen entre sí por la expresión de ciertos componentes de superficie; los más notorios son, las adhesinas y los polisacáridos de superficie, que son más abundantes en el estado sésil, y los flagelos, que se expresan en el estado planctónico y están ausentes en el estado sésil. Por lo tanto, las condiciones de crecimiento del inóculo podrían condicionar el estado de los rizobios sobre las semillas, ya que se sabe que estas influyen, por ejemplo, sobre el tipo de adhesinas producidas16,76, sobre la cantidad de polisacáridos extracelulares40,62,68,69 o sobre la síntesis de flagelos2,13. Por otra parte, el contenido hídrico y de materia orgánica del suelo debería condicionar al menos en parte la tendencia de los rizobios de la biopelícula formada sobre las semillas a pasar al estado natatorio79, con lo cual las condiciones edáficas al momento de la siembra podrían ser claves.
Si bien el tema de la transición entre estados sésil y planctónico recién empieza a estudiarse en Bradyrhizobium, existe abundante información en otras bacterias (como Escherichia coli, Salmonella, Caulobacter crescentus, Vibrio, Pseudomonas y Bacillus) que indica que dicha transición está regulada en forma coordinada46,50. Los determinantes ambientales que inducen estos cambios no se conocen bien, pero parece ser que tanto el nivel de humedad del ambiente como la presencia de sustancias de deshecho en las biopelículas maduras podrían ser responsables de que se dispare la transición del estado de biopelícula al planctónico. Lo que sí ha sido bien caracterizado es el segundo mensajero que a nivel intracelular actúa como intermediario entre la señal ambiental y el desencadenamiento de la respuesta de transición de un estado a otro. Se trata de un nucleótido modificado llamado diguanilato cíclico (c-di-GMP), cuyo nivel intracelular depende de la acción conjunta de diguanilato ciclasas que catalizan su síntesis y fosfodiesterasas que catalizan su degradación89.
Dentro de la célula existen múltiples diguanilato ciclasas y fosfodiesterasas, y se cree que su acción modifica los niveles de c-di-GMP en forma localizada. A su vez, el nivel de c-di-GMP modifica de forma alostérica la actividad de ciertas proteínas vinculadas con la expresión génica26, y en los casos en los cuales los genes están relacionados con la movilidad o la formación de biopelículas, se ha concluido que, de modo general, altos niveles de c-di-GMP disparan la expresión de genes requeridos para la formación de biopelículas y para la eyección de los flagelos e inhiben la expresión de genes requeridos para la síntesis de flagelos, mientras que bajos niveles de c-di-GMP tienen el efecto contrario9,89. En B. subtilis, además, se ha descripto un circuito regulatorio consistente en un conmutador epigenético que mantiene una biestabilidad entre el estado móvil y el sésil11. Sería de interés estudiar estas actividades en rizobios, para ver si se puede lograr acelerar el proceso de liberación de los rizobios de las semillas una vez que estas entran en contacto con el suelo.
Más allá de conocer el detalle molecular del proceso de liberación de los rizobios desde una biopelícula, la selección recurrente es un procedimiento que podría utilizarse para obtener cepas más propensas a liberarse cuando la semilla inoculada entra en contacto con el suelo. Este procedimiento ya fue utilizado con éxito para obtener cepas con movilidad aumentada1, y si bien se desconocen los detalles moleculares que condujeron al aumento de movilidad, existe la ventaja de que al no haber sido manipuladas genéticamente, estas bacterias seleccionadas pueden liberarse al medio ambiente sin el riesgo que entraña un organismo genéticamente modificado. Un posible método podría ser sembrar semillas inoculadas en pequeñas bandejas con suelo estéril y al cabo de un corto tiempo preestablecido, recuperar los rizobios liberados, cultivarlos y reinocularlos para repetir el ciclo de modo de ir seleccionando aquellas bacterias que se liberen más rápidamente de las semillas.
Una vez que los rizobios se liberaron de las semillas, deben sobrevivir en el suelo hasta que las semillas germinan. En este período deben enfrentar factores tales como la alta temperatura, común en la época de siembra de la soja, la desecación en la capa superficial del suelo, el ataque de predadores, la presencia de antibióticos naturales y la radiación ultravioleta (si están cerca de la superficie), para los que son más vulnerables en el estado planctónico que en el estado de biopelícula79. Para conocer los determinantes de la supervivencia durante este período se requerirían mediciones a campo o en microcosmos con suelo no estéril empleando semillas inoculadas con mutantes y con inóculos en distintos estados fisiológicos, realizando recuentos de viables entre la siembra y la germinación a distintas temperaturas y niveles de humedad. Si bien estos aspectos no pueden controlarse a través de la formulación del inoculante y la tecnología de aplicación, sería importante poseer una buena estimación de la magnitud de la mortandad de los rizobios liberados al suelo en distintas condiciones edafoclimáticas, con el fin de calibrar mejor el número de rizobios cultivables que es necesario asegurar por semilla con la inoculación.
Colonización rizosférica temprana y movilidad en el suelo
Luego de haberse liberado en el suelo, los rizobios inician el proceso de colonización rizosférica. Este proceso depende de varios factores, tanto ambientales como de la bacteria, y ha sido objeto de revisiones recientes3,19,34,43,45,65. El proceso de colonización rizosférica suele ser muy largo en relación con el proceso de infección temprana de las raíces, por lo cual no debe considerarse como una etapa previa de la infección. Antes bien, ambos procesos son simultáneos y para los fines del análisis que propongo aquí estimo conveniente enfocarme en los medios por los cuales los rizobios pueden iniciar la colonización rizosférica llegando desde la semilla inoculada al sitio de infección, para luego tratar de estimar cuál podría ser la proporción de los rizobios inoculados que efectivamente logran una infección exitosa.
En plantas que se infectan por hilos de infección, como la soja, las infecciones solo pueden ocurrir en una región acotada de la raíz, conocida como la región de los pelos radicales emergentes6. Esto es así porque el evento previo a la formación del hilo de infección es el característico enrulado del pelo radical, que atrapa los rizobios en una especie de bolsillo, desde el cual comienzan a disociar la pared celular de la punta del pelo radical produciendo una invaginación de aquella; es allí por donde una célula rizobiana inicia la infección. Una vez que la infección se inició, la progenie de esa célula va invaginando la pared celular hacia el interior del pelo radical y así avanza hasta las capas corticales y subcorticales, donde invadirá el nódulo en desarrollo25,48. Este proceso requiere que el pelo radical esté en activo crecimiento polar, dado que es así como se produce el enrulado (por crecimiento diferencial a uno y otro lado del tubo que constituye el pelo) y la invaginación de la pared celular64,91. Los pelos radicales en activo crecimiento se encuentran en la zona de los pelos radicales emergentes, cercana a la punta de la raíz, y se ha estimado que esa región permanece en dicho estado durante unas 5-6 h, luego de las cuales los pelos radicales ya maduraron y dejan de ser infectables6. Considerando además que la raíz avanza a unos 2,5 mm por hora, se deduce que el desplazamiento de los rizobios en sentido vertical desde el sitio donde se depositó la semilla para «perseguir» las zonas de pelos radicales emergentes conforme estas se hunden en el suelo debería ser significativo.
Las bacterias pueden desplazarse en el suelo de dos maneras: por movimiento pasivo, llevadas por el movimiento del agua o por la mesofauna, o bien por movimiento autopropulsado por flagelos o pili. En el caso de B. diazoefficiens, se ha podido evidenciar el movimiento impulsado por flagelos tanto en suelo como en vermiculita inundada2,13. El movimiento impulsado por flagelos a su vez puede ocurrir en el seno de un líquido y, en ese caso, se trata de natación o swimming, o sobre superficies húmedas, en cuyo caso se trata de verbenear o swarming10,27. Este último movimiento no parece tener importancia en suelos13, por lo cual me voy a referir al movimiento de natación.
La natación bacteriana es en general muy rápida y se observa como carreras más o menos rectilíneas, interrumpidas por bruscos cambios de dirección o tumbos, tras los cuales se retoman las carreras en otra dirección53 (fig. 2A). A pesar de aparentar ser un movimiento al azar, se trata de un movimiento orientado, ya que la duración de las carreras manteniendo la dirección se incrementa conforme la bacteria se acerca a un quimioatrayente, como, por ejemplo, una fuente de nutrientes, o se acorta si la bacteria se acerca a un quimiorrepelente, como, por ejemplo, sustancias potencialmente tóxicas (fig. 2B). Esto sucede porque la duración de las carreras está gobernada por un sistema conocido como quimiotaxis, mediante el cual las bacterias perciben gradientes de concentración de quimioatrayentes o quimiorrepelentes, a los cuales responden modificando el sentido o la velocidad de rotación de los flagelos, esto es lo que lleva a los cambios de dirección4,8,29,75.
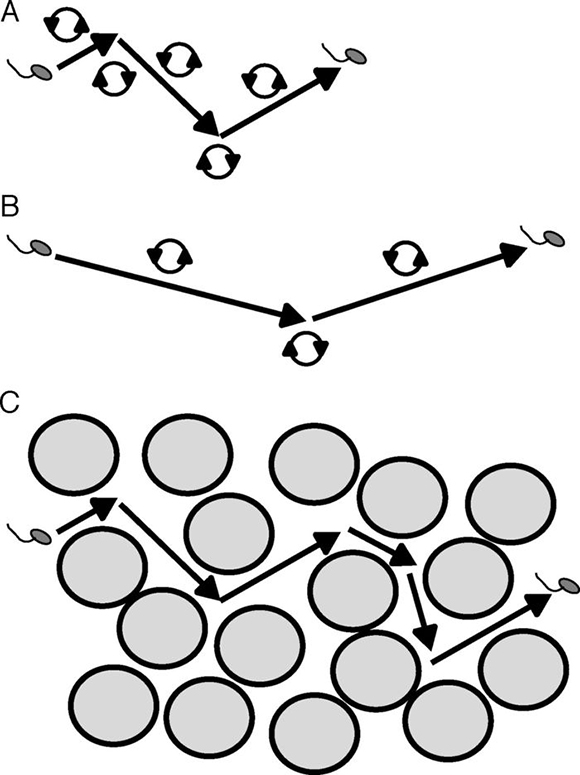
Figura 2. Movilidad y quimiotaxis. A) El movimiento típico de una bacteria consta de carreras (flechas) interrumpidas por bruscos cambios de dirección o tumbos. Durante las carreras, el flagelo gira en un sentido (círculos con flechas); los tumbos se producen por cambios del sentido o de la velocidad de rotación del flagelo. B) En presencia de un quimioatrayente, disminuye la frecuencia de tumbos y se alarga la longitud de las carreras, lo que se conoce como quimiotaxis positiva. C) En un medio poroso como el suelo, puede ser más importante la capacidad de cambiar de dirección que la quimiotaxis positiva para recorrer una cierta distancia neta.
Se han realizado muchos estudios de la movilidad y la quimiotaxis de varias especies de rizobios, pero desafortunadamente la mayoría de ellos emplearon medios líquidos homogéneos y hay muy pocos estudios realizados en medios porosos o suelo2,13,31,37,47,51. Los medios líquidos homogéneos y los porosos difieren en aspectos clave. En los medios líquidos homogéneos, la difusión de sustancias atrayentes o repelentes es rápida; sin embargo, los medios porosos tienen canales tortuosos que, según su diámetro y el contenido de humedad del medio, pueden contener agua o aire, con lo cual la difusión tanto de bacterias como de sustancias atrayentes o repelentes ocurre a una tasa mucho menor32,36,57,83.
Si consideramos que un poro capilar del suelo capaz de retener agua a capacidad de campo posee un diámetro de hasta unos 50 μm y que la velocidad con que B. diazoefficiens se desplaza por natación es de unos 30 μm/s33, podemos estimar que esta bacteria es capaz de recorrer de lado a lado un poro semejante en algo más de un segundo. Sin embargo, esta especie cambia de dirección cada aproximadamente 0,60 s (Quelas et al., resultados no publicados), es decir, que podría recorrer en una dirección rectilínea aproximadamente un tercio del diámetro del poro antes de cambiar de dirección. La quimiotaxis positiva hacia ciertos solutos, como podrían ser los exudados de semilla o de raíz, aumenta el tiempo transcurrido entre cambios de dirección haciendo que el desplazamiento de la bacteria sea más rectilíneo4. Este tiempo entre cambios de dirección podría incrementarse hasta 3 o 4 s, lo que le permitiría a la bacteria recorrer unos 90 a 120 μm antes de cambiar de dirección. Pero ello excede el diámetro del poro aproximadamente al doble. Si consideramos que la tortuosidad del suelo es tal que los canales cambian de dirección en una distancia aproximada de un diámetro de poro, se observa que la quimiotaxis positiva en un suelo no sería tan determinante como sí lo sería la capacidad de cambiar de dirección para acompañar la tortuosidad del medio (fig. 2C). Se requieren más investigaciones para dilucidar este importante aspecto de la distribución de los rizobios en el suelo, en particular, estudios de la natación en medios tortuosos.
De todas maneras, se han realizado diversas mediciones de la velocidad con que rizobios como B. diazoefficiens u otras bacterias como Pseudomonas se desplazan en el suelo a capacidad de campo. Los resultados indican velocidades de dispersión de a lo sumo 1-5 mm/h (0,3-1,4 μm/s), lo cual señala una vez más la dificultad que poseen estas bacterias para desplazarse en ese medio tortuoso5,13,78,84. Dado que esta velocidad es del mismo orden que la velocidad de elongación de la raíz6, cuya zona de pelos radicales emergentes se aleja continuamente de las semillas inoculadas, parecería que, aun cuando los rizobios no hayan llegado a formar una biopelícula madura y se puedan liberar rápidamente de la superficie de la semilla antes de que esta germine, su velocidad de natación les alcanzaría apenas para acompañar la elongación de la raíz. Esto dejaría un tiempo muy exiguo para que los rizobios se adhieran a la superficie del pelo radical y produzcan su enrulado, antes de que el pelo radical madure. Por lo tanto, la autopropulsión de los rizobios mediante su sistema de movilidad y quimiotaxis podría ser de utilidad solo en distancias cortas, como, por ejemplo, para posicionarse en pelos inmaduros una vez que la zona de los pelos radicales emergentes ha sido colonizada.
Para la colonización de la rizosfera (que incluye a los pelos radicales emergentes), los rizobios deben desplazarse mucho más rápidamente y esto lo pueden hacer nadando por los macroporos si el suelo está anegado (p. ej., durante una lluvia), o mediante desplazamientos pasivos llevados por las corrientes de percolación o adheridos a superficies de mesofauna, como nematodes, lombrices o insectos2,31,47. Esto es congruente con resultados que muestran que mutantes no móviles tanto de rizobios como de Pseudomonas colonizan la rizosfera con similar eficiencia que los tipos silvestres móviles en suelos o medios porosos a capacidad de campo2,84. Sin embargo, este tipo de desplazamiento pasivo no posee orientación hacia los sitios infectables de las raíces, los cuales solo podrían ser alcanzados al azar.
Conclusión
En los apartados anteriores he considerado las etapas principales de la inoculación de las semillas y las situadas entre ella y el inicio de la nodulación, y he analizado los aspectos que podrían determinar cuellos de botella entre una etapa y otra. Estos aspectos podrían condensarse en una estimación como la que propongo a continuación (véase también la figura 1):
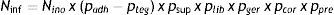
Donde:
Ninf: número de rizobios capaces de iniciar infecciones en los pelos radicales emergentes.
Nino: número de rizobios inoculados en la semilla.
padh: proporción de los rizobios inoculados que se adhieren a las semillas.
pteg: proporción de los rizobios adheridos que son llevados fuera del suelo sobre los tegumentos.
psup: proporción de los rizobios sobrevivientes sobre las semillas al momento de la siembra.
plib: proporción de los rizobios que son liberados al suelo desde las semillas luego de la siembra.
pger: proporción de los rizobios que sobreviven en el suelo entre la siembra y la germinación.
pcor: proporción de los rizobios que por movimientos autopropulsados o pasivos son capaces de alcanzar y colonizar la superficie de la raíz.
ppre: proporción de la raíz con pelos radicales emergentes (zona infectable).
Solo unos pocos de estos parámetros p han sido cuantificados, y aun para los que sí lo han sido, en muchos casos hay que rediseñar los experimentos de modo tal que reproduzcan las condiciones naturales o de práctica agronómica, como, por ejemplo, la movilidad autopropulsada en suelos y la adhesión a semillas evaluada con protocolos que contemplen las condiciones de inoculación. No obstante, la información disponible permite realizar una serie de estimaciones como para tener una idea del valor deseable de la variable Nino para alcanzar un dado valor de la variable Ninf.
padh: se ha señalado que en experimentos realizados en suspensión líquida, la proporción de rizobios capaces de adherirse a raíces o semillas es de aproximadamente el 10-15 %, y en las estimaciones del FR realizadas por REDCAI el promedio fue 12 %. Por lo tanto, para un cálculo optimista, considero padh = 0,15.
pteg: no existe información al respecto, con lo cual, para hacer un cálculo conservador supongo que, del total de adhesión, un 10 % de rizobios presenta adhesión firme y otro 10 % adicional permanece con adhesión reversible en los tegumentos cuando los cotiledones emergen del suelo, totalizando así un 20 % de los rizobios inicialmente adheridos. Por lo tanto: pteg = 0,03.
psup: los datos de la literatura indican que en el momento de la siembra el porcentaje de supervivencia es de entre el 1 y el 10 %. Permítaseme suponer que con protectores adecuados puede alcanzarse el límite superior, con lo cual psup = 0,1.
plib: tampoco existen datos al respecto, de modo que para hacer un cálculo conservador supongo que el 90 % de los rizobios son liberados entre la siembra y la germinación, con lo cual estimo plib = 0,9.
pger: tampoco hay datos al respecto. Para hacer un cálculo optimista supongo que la tasa de supervivencia en el suelo es muy alta y, por lo tanto, pger = 1,0.
pcor: este aspecto tampoco ha sido estudiado lo suficiente. Para estimar este parámetro considero que los rizobios que alcanzan la zona de los pelos radicales emergentes lo suficientemente rápido como para iniciar la colonización de las zonas infectables lo hacen por desplazamiento pasivo (agua de percolación, mesofauna). Si este es el caso, dicho desplazamiento no sería dirigido y, por lo tanto, ocurriría homogéneamente en una semiesfera centrada en la semilla. Si consideramos raíces de una longitud de 10 cm (véase más arriba), el volumen de la semiesfera sería de unos 2 × 103 cm3. Según los cálculos realizados más arriba, el volumen total de dichas raíces sería de 0,55 cm3, con lo cual la proporción de volumen de la semiesfera ocupado por raíces sería 2,75 × 10−4, y esta sería la proporción de rizobios que alcanzaría las raíces al azar, de donde el valor de pcor = 2,75 × 10−4.
ppre: esta proporción se conoce y es en promedio el 20 % de la raíz, con lo cual ppre = 0,2.
Según estas estimaciones, Ninf = Nino x (5,9 × 10−7 ). Este resultado se ajusta a la observación de que bastan 10-100 rizobios por gramo de suelo para competir eficazmente con un inoculante aplicado en semillas82. Además, la estimación está dominada por el parámetro pcor, que es 2 a 3 órdenes de magnitud más bajo que los otros, lo cual guarda relación con el hallazgo de que la posición de los rizobios en el sustrato de enraizamiento es determinante de la competitividad para nodular41, y que rizobios no móviles compiten eficazmente con la cepa salvaje móvil en un sustrato a capacidad de campo2. Por lo tanto, si, como indiqué más arriba, se desea equiparar el número de bacterias capaces de iniciar la infección con el número de rizobios competidores del suelo, debería obtenerse un Ninf de entre 1,4 × 104 a 1,4 × 105 rizobios por zona infectable de raíz, y el inóculo inicial debería ser, por lo tanto, entre 2,4 × 1010 a 2,4 × 1011 rizobios por semilla. Evidentemente, este rango está lejos de lo alcanzable actualmente por la inoculación en semillas y aun por el tratamiento profesional de semillas, pero podría reducirse a 4,9 × 104 a 4,9 × 105 rizobios inoculados por semilla si los rizobios se duplicaran al menos una vez en el suelo luego de liberarse de las semillas. Este rango de valores es fácilmente alcanzable si se considera una inoculación de 3-4 ml por kilogramo de semilla con un inoculante que contenga del orden de 1 × 109 a 1 × 1010 rizobios vivos por mililitro. En la mayoría de los casos, con inoculantes de buena calidad en cuanto a título, se considera que sobre la semilla se establecen aproximadamente 8,0 × 104 rizobios por semilla, de acuerdo también con la reglamentación y los marbetes de los inoculantes comerciales. Este valor es fácilmente alcanzable con el rango antedicho si se considera padh = 0,15. Por supuesto, los cálculos que he realizado son muy estimativos y además hay suelos donde las poblaciones competidoras están cerca del límite inferior de densidad poblacional. Además, la estimación de pcor considera que los rizobios se mueven de forma pasiva isotrópicamente desde la semilla, pero podría ser que aun cuando el movimiento fuera pasivo, exista alguna dirección preferencial (p. ej., que el movimiento impulsado por el agua de percolación tenga una dirección predominante en sentido vertical descendente). De todos modos, considero que un Nino de 4,9 × 105 rizobios inoculados por semilla podría asegurar una buena competitividad para nodular bajo diversas circunstancias, incluyendo el régimen de lluvias y la densidad de la población alóctona competidora. Este valor de Nino sí puede ser alcanzado con un inoculante líquido que contenga del orden de 109 rizobios vivos por mililitro, pero deberían asegurarse las condiciones fisiológicas en el inoculante como para que la duplicación en el suelo ocurra en un tiempo razonable. Podría argüirse que esto efectivamente sucede debido al conocido efecto rizosférico, responsable de que las poblaciones bacterianas aumenten de manera significativa en la rizosfera debido a la exudación de nutrientes desde la raíz86. Sin embargo, nuevamente debe tenerse en cuenta el tiempo requerido para que este efecto tenga lugar: la raíz debe haber crecido y exudado nutrientes antes de que se manifieste el efecto rizosférico, y considerando que nos estamos refiriendo a rizobios que provienen de la semilla y deben realizar una infección temprana, este fenómeno no podría ocurrir antes de que la zona de los pelos emergentes haya madurado. Por otro lado, si los rizobios deben moverse mediante sus flagelos, necesariamente van a encontrarse en estado planctónico, el cual es mucho más susceptible de ser afectado por predadores y sustancias antibacterianas que el estado de biopelícula. Eso reduciría el tamaño de la población móvil. Así, no hay certeza de que la población de rizobios inoculados podrá duplicarse antes de iniciar la infección de las raíces.
Por lo tanto, quedan señaladas las áreas donde a mi criterio se requiere mayor investigación y desarrollo con el fin de lograr el Ninf adecuado. Estas serían, principalmente, la adhesión reversible y la supervivencia de los rizobios sobre las semillas, la liberación de los rizobios luego de la siembra y la dispersión, supervivencia y multiplicación de los rizobios en el suelo.
Responsabilidades éticas
Protección de personas y animales
El autor declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
El autor declara que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
El autor declara que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses.
Agradecimientos
El autor es investigador independiente del CONICET y profesor adjunto de la Facultad de Ciencias Exactas, Universidad Nacional de La Plata. El trabajo del autor es financiado por la ANPCyT y el CONICET.
1. Althabegoiti MJ, López GarcÃa SL, Piccinetti C, Mongiardini EJ, Pérez Giménez J, Quelas JI, Perticari A, Lodeiro AR. Strain selection for improvement of Bradyrhizobium japonicum competitiveness for nodulation of soybean. FEMS Microbiol Lett. 2008; 282:115-23. [ Links ]
2. Althabegoiti MJ, Covelli JM, Pérez Giménez J, Quelas JI, Mongiardini EJ, López MF, López GarcÃa SL, Lodeiro AR. Analysis of the role of the two flagella of Bradyrhizobium japonicum in competition for nodulation of soybean. FEMS Microbiol Lett. 2011; 319:133-9. [ Links ]
3. Babalola OO. Beneficial bacteria of agricultural importance. Biotechnol Lett. 2010; 32:1559-70. [ Links ]
4. Baker MD, Wolanin PM, Stock JB. Systems biology of bacterial chemotaxis. Curr Opin Microbiol. 2006; 9:187-92. [ Links ]
5. Barton JW, Ford RM. Determination of effective transport coefficients for bacterial migration in sand columns. Appl Environ Microbiol. 1995; 61:3329-35. [ Links ]
6. Bhuvaneswari TV, Turgeon BG, Bauer WD. Early events in the infection of soybean (Glycine max L. Merr) by Rhizobium japonicum. I. Localization of infectible root cells. Plant Physiol. 1980; 66:1027-31. [ Links ]
7. Bolsa de Cereales. Soja 2014/15: Perspectivas al 14/10/2014. Informe de pre-campaña N.° 10. [On-line; consultado 11 Mar 2015]. Disponible en: http://www.bolsadecereales.com.ar/ver-informes-precampana-112. [ Links ]
8. Borrok MJ, Kolonko EM, Kiessling LL. Chemical probes of bacterial signal transduction reveal that repellents stabilize and attractants destabilize the chemoreceptor array. ACS Chem Biol. 2008; 3:101-9. [ Links ]
9. Brown J, Faulds-Pain A, Aldridge P. The coordination of flagellar gene expression and the flagellar assembly pathway. En: Jarrel K.F., editors. Pili and Flagella, current research and future trends. Trowbridge: Caister Academic Press; 2009. 99-120. [ Links ]
10. Butler MT, Wang O, Harshey RM. Cell density and mobility protect swarming bacteria against antibiotics. Proc Natl Acad Sci U S A. 2010; 107:3776-81. [ Links ]
11. Chai Y, Norman T, Kolter R, Losick R. An epigenetic switch governing daughter cell separation inBacillus subtilis. Genes Dev. 2010; 24:754-65. [ Links ]
12. Covelli JM. Biofertilización con Bradyrhizobium japonicum para la agricultura sustentable en soja: aspectos ecofisiológicos del problema de la competición para la nodulación. Tesis doctoral de la Facultad de Ciencias Exactas 2013. Universidad Nacional de La Plata. [ Links ]
13. Covelli JM, Althabegoiti MJ, López MF, Lodeiro AR. Swarming motility in Bradyrhizobium japonicum. Res Microbiol. 2013; 164:136-44. [ Links ]
14. Cregan PB, Keyser HH, Sadowsky MJ. Host plant effects on nodulation and competitiveness of theBradyrhizobium japonicum serotype strains constituting serocluster 123. Appl Environ Microbiol. 1989; 55:2532-6. [ Links ]
15. Cytryn EJ, Sangurdekar DP, Streeter JG, Franck WL, Chang WS, Stacey G, Emerich DW, Joshi T, Xu D, Sadowsky MJ. Transcriptional and physiological responses of Bradyrhizobium japonicum to desiccation-induced stress. J Bacteriol. 2007; 189:6751-62. [ Links ]
16. Danhorn T, Hentzer M, Givskov M, Parsek MR, Fuqua C. Phosphorus limitation enhances biofilm formation of the plant pathogen Agrobacterium tumefaciens through the PhoR-PhoB regulatory system. J Bacteriol. 2004; 186:4492-501. [ Links ]
17. Darsonval A, Darrasse A, Durand K, Bureau C, Cesbron S, Jacques M-A. Adhesion and fitness in the bean phyllosphere and transmission to seed of Xanthomonas fuscans subsp. fuscans. Mol Plant-Microbe Interact. 2009; 22:747-57. [ Links ]
18. Dazzo FB, Truchet GL, Sherwood JE, Hrabak EM, Abe M, Pankratz SH. Specific phases of root hair attachment in the Rhizobium trifolii-clover symbiosis. Appl Environ Microbiol. 1984; 48:1140-50. [ Links ]
19. De la Peña C, Loyola Vargas VM. Biotic interactions in the rhizosphere: A diverse cooperative enterprise for plant productivity. Plant Physiol. 2014; 166:701-19. [ Links ]
20. Deaker R, Roughley RJ, Kennedy IR. Legume seed inoculation technology âa review. Soil Biol Biochem. 2004; 36:1275-88. [ Links ]
21. Deaker R, Hartley E, Gemell G. Conditions affecting shelf-life of inoculated legume seed. Agriculture. 2012; 2:38-51. [ Links ]
22. Delamuta JR, Ribeiro RA, Ormeño Orrillo E, Melo IS, MartÃnez Romero E, Hungria M. Polyphasic evidence supporting the reclassification of Bradyrhizobium japonicum group ia strains asBradyrhizobium diazoefficiens sp. nov. Int J Syst Evol Microbiol. 2013; 63:3342-51. [ Links ]
23. Espinosa Urgel M, Salido A, Ramos JL. Genetic analysis of functions involved in adhesion ofPseudomonas putida to seeds. J Bacteriol. 2000; 182:2363-9. [ Links ]
24. Fan L-M, Ma Z-Q, Liang J-Q, Li H-F, Wang E-T, Wei G-H. Characterization of a copper-resistant symbiotic bacterium isolated from Medicago lupulina growing in mine tailings. Bioresour Technol. 2011; 102:703-9. [ Links ]
25. Gage DJ. Infection and invasion of roots by symbiotic, nitrogen-fixing rhizobia during nodulation of temperate legumes. Microbiol Mol Biol Rev. 2004; 68:280-300. [ Links ]
26. Galperin MY. Bacterial signal transduction network in a genomic perspective. Environ Microbiol. 2004; 6:552-67. [ Links ]
27. Harshey RM. Bacterial motility on a surface: Many ways to a common goal. Annu Rev Microbiol. 2003; 57:249-73. [ Links ]
28. Hayashi M, Shiro S, Kanamori H, Mori-Hosokawa S, Sasaki-Yamagata H, Sayama T, Nishioka M, Takahashi M, Ishimoto M, Katayose Y, Kaga A, Harada K, Kouchi H, Saeki Y, Umehara Y. A thaumatin-like protein, Rj4, controls nodule symbiotic specificity in soybean. Plant Cell Physiol. 2014; 55:1679-89. [ Links ]
29. Hazelbauer GL, Falke JJ, Parkinson JS. Bacterial chemoreceptors: High-performance signaling in networked arrays. Trends Biochem Sci. 2007; 33:9-19. [ Links ]
30. Ho SC, Wang JL, Schindler M. Carbohydrate binding activities of Bradyrhizobium japonicum. II. Isolation and characterization of a galactose-specific lectin. J Cell Biol. 1990; 111:1639-43. [ Links ]
31. Horiuchi J, Prithiviraj B, Bais HP, Kimball BA, Vivanco JM. Soil nematodes mediate positive interactions between legume plants and Rhizobium bacteria. Planta. 2005; 222:848-57. [ Links ]
32. Jiménez Sánchez C, Wick LY, Ortega Calvo JJ. Chemical effectors cause different motile behavior and deposition of bacteria in porous media. Environ Sci Technol. 2012; 46:6790-7. [ Links ]
33. Kanbe M, Yagasaki J, Zehner S, Göttfert M, Aizawa SI. Characterization of two sets of subpolar ï¬agella in Bradyrhizobium japonicum. J Bacteriol. 2007; 189:1083-9. [ Links ]
34. Lagunas B, Schäfer P, Gifford ML. Housing helpful invaders: The evolutionary and molecular architecture underlying plant root-mutualist microbe interactions. J Exp Bot. 2015; 66:2177-86. [ Links ]
35. Lee Y, Seo H, Yeom J, Park W. Molecular characterization of the extracellular matrix in aPseudomonas putida dsbA mutant: Implications for acidic stress defense and plant growth promotion. Res Microbiol. 2011; 162:302-10. [ Links ]
36. Liu J, Ford RM, Smith JA. Idling time of motile bacteria contributes to retardation and dispersion in sand porous medium. Environ Sci Technol. 2011; 45:3945-51. [ Links ]
37. Liu R, Tran VM, Schmidt EL. Nodulating competitiveness of a nonmotile Tn7 mutant ofBradyrhizobium japonicum in nonsterile soil. Appl Environ Microbiol. 1989; 55:1895-900. [ Links ]
38. Lodeiro AR, Favelukes G. Early interactions of Bradyrhizobium japonicum and soybean roots: Speciï¬city in the process of adsorption. Soil Biol Biochem. 1999; 31:1405-11. [ Links ]
39. Lodeiro AR, Lagares A, MartÃnez EN, Favelukes G. Early interactions of Rhizobium leguminosarumbv. phaseoli and bean roots: Specificity in the process of adsorption and its requirements of Ca2+ and Mg2+ ions. Appl Environ Microbiol. 1995; 61:1571-9. [ Links ]
40. López GarcÃa SL, Vázquez TEE, Favelukes G, Lodeiro AR. Improved soybean root association of N-starved Bradyrhizobium japonicum. J Bacteriol. 2001; 183:7241-52. [ Links ]
41. López GarcÃa SL, Vázquez TEE, Favelukes G, Lodeiro AR. Rhizobial position as a main determinant in the problem of competition for nodulation in soybean. Environ Microbiol. 2002; 4:216-24. [ Links ]
42. López GarcÃa SL, Perticari A, Piccinetti C, Ventimiglia L, Arias N, De Battista JJ, Althabegoiti MJ, Mongiardini EJ, Pérez Giménez J, Quelas JI, Lodeiro AR. In-furrow inoculation and selection for higher motility enhances the efficacy of Bradyrhizobium japonicum nodulation. Agron J. 2009; 101:357-63. [ Links ]
43. López GarcÃa SL, López MF. Rhizosphere colonization by plant growth promoting rhizobacteria. En: Lodeiro A.R., editors. Bacterial populations: Basic and applied aspects of their evolution. Kerala: Transworld Research Network; 2010. 161-92. [ Links ]
44. López S, Pastorino GN, MartÃnez Alcántara V, Salvucci D, Balatti PA. Los rizobios que nodulan la soja en sitios con ambientes nativos y cultivados de la Argentina. En: Albanesi A.S., editors. MicrobiologÃa agrÃcola. Un aporte de la Investigación en Argentina. 2.a ed. Tucumán: Magna Publicaciones; 2013. 237-52. [ Links ]
45. Lugtenberg B, Kamilova F. Plant-growth-promoting rhizobacteria. Annu Rev Microbiol. 2009; 63:541-56. [ Links ]
46. Macnab R. Flagella and motility. En: Neihardt F.C., editors. Escherichia coli and Salmonella.Cellular and molecular biology. 2nd ed. Washington DC: ASM Press; 1996. 123-45. [ Links ]
47. Madsen EL, Alexander M. Transport of Rhizobium and Pseudomonas through soil. Soil Sci Soc Am J. 1982; 46:557-60. [ Links ]
48. Mateos PF, Baker DL, Petersen M, Velázquez E, Jiménez Zurdo JI, MartÃnez Molina E, Squartini A, Orgambide G, Hubbell DH, Dazzo FB. Erosion of root epidermal cell walls by Rhizobiumpolysaccharide-degrading enzymes as related to primary host infection in the Rhizobium-legume symbiosis. Can J Microbiol. 2001; 47:475-87. [ Links ]
49. Maurice S, Beauclair P, Giraud J-J, Sommer G, Hartmann A, Catroux G. Survival and change in physiological state of Bradyrhizobium japonicum in soybean (Glycine max L. Merril) liquid inoculants after long-term storage. World J Microbiol Biotechnol. 2001; 17:635-43. [ Links ]
50. McCarter LL. Regulation of ï¬agella. Curr Opin Microbiol. 2006; 9:180-6. [ Links ]
51. McDermott TR, Graham PH. Bradyrhizobium japonicum inoculant mobility, nodule occupancy, and acetylene reduction in the soybean root system. Appl Environ Microbiol. 1989; 55:2493-8. [ Links ]
52. Melchiorre M, de Luca MJ, González Anta G, Suárez P, López C, Lascano R, Racca RW. Evaluation of bradyrhizobia strains isolated from field-grown soybean plants in Argentina as improved inoculants. Biol Fertil Soils. 2011; 47:81-9. [ Links ]
53. Mitchell JG, Kogure K. Bacterial motility: Links to the environment and a driving force for microbial physics. FEMS Microbiol Ecol. 2006; 55:3-16. [ Links ]
54. Morales GarcÃa YE, Juárez Hernández D, Aragón Hernández C, Mascarua Esparza MA, Bustillos Cristales MR, Fuentes RamÃrez LE, MartÃnez Contreras RD, Muñoz Rojas J. Growth response of maize plantlets inoculated with Enterobacter spp., as a model for alternative agriculture. Rev Argent Microbiol. 2011; 43:287-93. [ Links ]
55. Mortier V, Holsters M, Goormachtig S. Never too many? How legumes control nodule numbers. Plant Cell Environ. 2012; 35:245-58. [ Links ]
56. Oldroyd GE, Murray JD, Poole PS, Downie JA. The rules of engagement in the legume-rhizobial symbiosis. Annu Rev Genet. 2011; 45:119-44. [ Links ]
57. Olson MS, Ford RM, Smith JA, Fernández EJ. Quantification of bacterial chemotaxis in porous media using magnetic resonance imaging. Environ Sci Technol. 2004; 38:3864-70. [ Links ]
58. Patriarca EJ, Tatè R, Ferraioli S, Iaccarino M. Organogenesis of legume root nodules. Int Rev Cytol. 2004; 234:201-62. [ Links ]
59. Penna C, Massa R, Olivieri F, Gutkind G, Cassán F. A simple method to evaluate the number of bradyrhizobia on soybean seeds and its implication on inoculant quality control. AMB Express. 2011; 1:21. [On-line] http://www.amb-express.com/content/1/1/21Â
60. Penna C, Benintende S, Chiavelini J, Albanesi A, Cassan F, González Fiqueni MF, Lett L, Perticari A, Rossi A, Toresani S, Massa R. Recuento de rizobios viables sobre semilla. En: Albanesi A., Benintende S., Cassán F., Perticari A., editors. Manual de procedimientos microbiológicos para la evaluación de inoculantes. Ciudad Autónoma de Buenos Aires: Asociación Argentina de MicrobiologÃa; 2013. 55-9. [ Links ]
61. Penyalver R, Oger PM, Su S, Alvarez B, Salcedo CI, López MM, Farrand SK. The S-adenosyl-L-homocysteine hydrolase gene ahcY of Agrobacterium radiobacter K84 is required for optimal growth, antibiotic production, and biocontrol of crown gall disease. Mol Plant-Microbe Interact. 2009; 22:713-24. [ Links ]
62. Pérez Giménez J, Althabegoiti MJ, Covelli JM, Mongiardini EJ, Quelas JI, López GarcÃa SL, Lodeiro AR. Soybean lectin enhances biofilm formation by Bradyrhizobium japonicum in the absence of plants. Int J Microbiol. 2009; 2009:719367. [On-line; consultado 11 Mar 2015]. Disponible en:http://www.hindawi.com/journals/ijmicro/2009/719367/
63. Pérez Giménez J, Quelas JI, Lodeiro AR. Competition for nodulation. En: El-Shemy HA, editor. Soybean/Book 3. Physiology and biochemistry. Rijeka, InTech Open Access Publisher, 2011, p. 139-166. [On-line; consultado 11 Mar 2015]. Disponible en: http://www.intechopen.com/books/soybean-physiology-and-biochemistry/competition-for-nodulation. [ Links ]
64. Perrine-Walker FM, Lartaud M, Kouchi H, Ridge RW. Microtubule array formation during root hair infection thread initiation and elongation in the Mesorhizobium-Lotus symbiosis. Protoplasma. 2014; 251:1099-111. [ Links ]
65. Philippot L, Raaijmakers JM, Lemanceau P, van der Putten WH. Going back to the roots: the microbial ecology of the rhizosphere. Nat Rev Microbiol. 2013; 11:789-99. [ Links ]
66. Piccinetti C, Arias N, Ventimiglia L, DÃaz Zorita M, Murua L, Sánchez H, Ferraris G, Mousegne F, Fontanetto H, Sá Pereira E, Capurro J, Enrico JM, López C, Carrizo AS, Salvagiotti F, Collino D, Perticari A. Efectos positivos de la inoculación de soja sobre la nodulación, la FBN y en los parámetros de producción del cultivo. En: Albanesi A.S., editors. MicrobiologÃa agÃcola. Un aporte de la investigación en Argentina. 2.a ed. Tucumán: Magna Publicaciones; 2013. 283-97. [ Links ]
67. Prell J, Poole P. Metabolic changes of rhizobia in legume nodules. Trends Microbiol. 2006; 14:161-8. [ Links ]
68. Quelas JI, López GarcÃa SL, Casabuono A, Althabegoiti MJ, Mongiardini EJ, Pérez Giménez J, Couto A, Lodeiro AR. Effects of N-starvation and C-source on exopolysaccharide production and composition in Bradyrhizobium japonicum. Arch Microbiol. 2006; 186:119-28. [ Links ]
69. Quelas JI, Mongiardini EJ, Casabuono A, López GarcÃa SL, Althabegoiti MJ, Covelli JM, Pérez Giménez J, Couto A, Lodeiro AR. Lack of galactose or galacturonic acid in Bradyrhizobium japonicumUSDA 110 exopolysaccharide leads to different symbiotic responses in soybean. Mol Plant-Microbe Interact. 2010; 23:1592-604. [ Links ]
70. Reid DE, Ferguson BJ, Gresshoff PM. Inoculation-and nitrate-induced CLE peptides of soybean control NARK-dependent nodule formation. Mol Plant-Microbe Interact. 2011; 24:606-18. [ Links ]
71. Reid DE, Li D, Ferguson BJ, Gresshoff PM. Structure-function analysis of the GmRIC1 signal peptide and CLE domain required for nodulation control in soybean. J Exp Bot. 2013; 64:1575-85. [ Links ]
72. Robledo M, Rivera L, Jiménez Zurdo JI, Rivas R, Dazzo F, Velázquez E, MartÃnez Molina E, Hirsch AM, Mateos PF. Role of Rhizobium endoglucanase CelC2 in cellulose biosynthesis and biofilm formation on plant roots and abiotic surfaces. Microb Cell Fact. 2012; 11:125. [On-line; consultado 11 Mar 2015]. Disponible en: http://www.microbialcellfactories.com/content/11/1/125
73. Roughley RJ, Gemell JG, Thompson JA, Brockwell J. The number of Bradyrhizobium sp. (Lupinus) applied to seed and its effect on rhizosphere colonization, nodulation and yield of lupin. Soil Biol Biochem. 1993; 25:1453-8. [ Links ]
74. Sadowsky MJ, Cregan PB. The soybean Rj4 allele restricts nodulation by Bradyrhizobium japonicum serogroup 123 strains. Appl Environ Microbiol. 1992; 58:720-3. [ Links ]
75. Schmitt R. Sinorhizobial chemotaxis: A departure from the enterobacterial paradigm. Microbiology. 2002; 148:627-31. [ Links ]
76. Smit G, Swart S, Lugtenberg BJJ, Kijne JW. Molecular mechanisms of attachment of Rhizobiumbacteria to plant roots. Mol Microbiol. 1992; 6:2897-903. [ Links ]
77. Smith GB, Wollum AG. Bacterial culture history affects the attachment of Bradyrhizobium japonicumto host Glycine max roots. Can J Microbiol. 1991; 37:730-6. [ Links ]
78. Soby S, Bergman K. Motility and chemotaxis of Rhizobium meliloti in soil. Appl Environ Microbiol. 1983; 46:995-8. [ Links ]
79. Stoodley P, Sauer K, Davies DG, Costerton JW. Biofilms as complex differentiatied communities. Annu Rev Microbiol. 2002; 56:187-209. [ Links ]
80. Streeter JG. Factors affecting the survival of Bradyrhizobium applied in liquid cultures to soya bean [Glycine max (L.) Merr.] seeds. J Appl Microbiol. 2007; 103:1282-90. [ Links ]
81. Terpolilli JJ, Hood GA, Poole PS. What determines the efficiency of N2-fixing Rhizobium-legume symbioses. Adv Microb Physiol. 2012; 60:325-89. [ Links ]
82. Thies JE, Singleton PW, Bohlool BB. Influence of the size of indigenous rhizobial populations on establishment and symbiotic performance of introduced rhizobia on field-grown legumes. Appl Environ Microbiol. 1991; 57:19-28. [ Links ]
83. Tufenkji N. Modeling microbial transport in porous media: Traditional approaches and recent developments. Adv Water Res. 2007; 30:1455-69. [ Links ]
84. Turnbull GA, Morgan JAW, Whipps JM, Saunders JR. The role of bacterial motility in the survival and spread of Pseudomonas fluorescens in soil and in the attachment and colonisation of wheat roots. FEMS Microbiol Ecol. 2001; 36:21-31. [ Links ]
85. Vesper SJ, Bauer WD. Characterization of Rhizobium attachment to soybean roots. Symbiosis. 1985; 1:139-62. [ Links ]
86. Walker TS, Bais HP, Grotewold E, Vivanco JM. Root exudation and rhizosphere biology. Plant Physiol. 2003; 132:44-51. [ Links ]
87. Wilkins J. The effects of high temperature on certain root-nodule bacteria. Aust J Agric Res. 1967; 18:299-304. [ Links ]
88. Wisniewski J-P, Monsigny M, Delmotte FM. Purification of an α-L-fucoside binding protein fromRhizobium lupini. Biochimie. 1994; 76:121-8.
89. Wolfe AJ, Visick KL. Get the message out: cyclic-di-GMP regulates multiple levels of flagellum-based motility. J Bacteriol. 2008; 190:463-75. [ Links ]
90. Yaryura PM, León M, Correa OS, Kerber NL, Pucheu NL, GarcÃa AF. Assessment of the role of chemotaxis and bioï¬lm formation as requirements for colonization of roots and seeds of soybean plants by Bacillus amyloliquefaciens BNM339. Curr Microbiol. 2008; 56:625-32. [ Links ]
91. Zepeda I, Sánchez López R, Kunkel JG, Bañuelos LA, Hernández Barrera A, Sánchez F, Quinto C, Cárdenas L. Visualization of highly dynamic f-actin plus ends in growing Phaseolus vulgaris root hair cells and their responses to Rhizobium etli nod factors. Plant Cell Physiol. 2014; 55:580-92. [ Links ]Â














