Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. vol.49 no.1 Ciudad Autónoma de Buenos Aires mar. 2017
http://dx.doi.org/10.1016/j.ram.2016.11.002
ORIGINAL
http://dx.doi.org/10.1016/j.ram.2016.11.002
Sensibilidad in vitro de Trichoconiella padwickii a diversos principios activos usados como fungicidas en el cultivo del arroz
In vitro susceptibility of Trichoconiella padwickii to various active ingredients used as fungicides in the cultivation of rice
Alfonso D. Lovato Echeverriaa,*, Susana A. Gutiérreza, Marcelo A. Carmonab
a. Fitopatología, Facultad de Ciencias Agrarias, Universidad Nacional del Nordeste, Corrientes, Argentina
b. Fitopatología, Facultad de Agronomía, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina
Recibido el 12 de octubre de 2015; aceptado el 23 de noviembre de 2016
Disponible en Internet el 9 de marzo de 2017
*Autor para correspondencia.
Correo electrónico: alfodamian@gmail.com (A.D. Lovato Echeverria).
0325-7541/C 2017 Asociación Argentina de Microbiología. Publicado por Elsevier Espana, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/).
Resumen
El objetivo de este trabajo fue evaluar in vitro la sensibilidad micelial de Trichoconiella padwickii a diferentes principios activos por medio del cálculo de la concentración inhibitoria media (CI50). Para ello se realizaron siembras de discos de inóculo en agar poroto con distintas concentraciones (0,1; 1; 10; 30, 50; 100 y 1.000 mg/l) de diversos fungicidas. A los 7 días se midió el diámetro de crecimiento de la colonia (cm). Los datos obtenidos se ajustaron a modelos de regresión no lineal. La sensibilidad se clasificó utilizando la escala de Edgington. Los resultados obtenidos demuestran que el patógeno es muy sensible a los productos que actúan sobre la cadena respiratoria (quinone outside inhibitors QoI y succinate dehydrogenase inhibitors SDHI) y la membrana celular (multisitio), y moderadamente sensible a los que interfieren en la división celular (metil benzimidazol carbamatos MBC), en la síntesis de ácidos nucleicos (fenilamidas PA) y en la transducción de la señal osmótica (actividad multisitio). Este trabajo es el primer antecedente sobre la sensibilidad in vitro de T. padwickii a principios activos fungicidas.
Palabras clave
Patógeno de Semilla; CI50; Fungicida.
Abstract
The aim of this study was to evaluate in vitro the mycelial susceptibility of Trichoconiella padwickii to different active ingredients through average median concentration IC50 calculation. Inoculum disks were seeded on bean agar at different concentrations (0.1; 1; 10; 30, 50; 100 and 1000 mg/l) of various fungicides. After seven days the colony diameter was measured. The data obtained were fitted to nonlinear regression models. Susceptibility was classified using the scale proposed by Edgington. The results show that the pathogen is very sensitive to products that act on the respiratory chain (quinone outside inhibitors QoI and succinate dehydrogenase inhibitors SDHI) and cell membrane (multi-site contact activity), and moderately sensitive to those products interfering with cell division (methyl benzimidazole carbamates MBC), synthesis of nucleic acids (phenylamides PA) and osmotic signal transduction (multi-site contact activity). This work is the first record on the sensitivity of T. padwickii.
Keywords
Seed-borne pathogen; IC50; Fungicides.
Introducción
La semilla de arroz (Oryza sativa L.) es portadora de numerosos patógenos que causan enfermedades en el cultivo y además es un eficiente medio de transporte y supervivencia en la naturaleza. El potencial epidémico del patógeno varía entre especies, razas y ecosistemas22. En la región del nordeste de Argentina, el cultivo es afectado por enfermedades fúngicas que merman el rendimiento y la calidad de la producción9,11. De los patógenos de semillas identificados, se destaca la presencia de Trichoconiella padwickii (Ganguly) B.L. Jain (sinónimo Alternaria padwickii Ganguly M.B Ellis 1971, por presentar alta prevalencia (mayor del 90%) y niveles de incidencia que superan el 73%, con una eficiencia de transmisión a coleoptilos de arroz de hasta el 28%9,14,19.
Este hongo tiene amplia distribución mundial y es considerado uno de los principales microorganismos presentes en semillas de arroz2,16,17,31. Como estrategia de control del patógeno, la utilización de productos químicos es vista como una medida eficiente y de resultados inmediatos, aunque su constante uso promueve la selección de cepas resistentes. Esta resistencia se manifiesta como una variación genética heredable, que conduce a la pérdida o a la disminución de la sensibilidad al principio activo25,28. Conocer la respuesta de los patógenos a las diversas familias de fungicidas es importante dentro del contexto del manejo integrado de plagas, porque permite proyectar estrategias de control compatibles7,28.
Los ensayos de sensibilidad de fungicidas in vitro consisten en la exposición del patógeno a concentraciones crecientes de principios activos. A la concentración del fungicida que inhibe en un 50% el crecimiento micelial la llamamos concentración inhibitoria media (mg/l) (CI50). Un valor bajo de CI50 indica una alta acción fungicida6,7,24,28.
Actualmente, si bien existen antecedentes de control químico de T. padwickii, los estudios disponibles no aportan información sobre la sensibilidad del patógeno, dato que es necesario para entender la disparidad de resultados que informan distintos autores. Los estudios realizados con T. padwickii in vitro son escasos y no incluyen terápicos de semillas o fungicidas. Algunos antecedentes se refieren a productos con efectos similares, como aceites esenciales, quitosanos y derivados del metabolismo de plantas como Decalepsis hamiltni Wight & Arn13,21,23. Ante la escasez de investigación en esta temática, se planteó como objetivo determinar la CI50 de diversos principios activos habitualmente utilizados como fungicidas frente a T. padwickii.
Materiales y métodos
Aislamiento del patógeno
Para detectar la presencia de T. padwickii se sembraron 400 semillas de arroz de la variedad IRGA 424 (variedad susceptible al patógeno y la más sembrada en la región)9,19 en placas que contenían medio de cultivo agar poroto, al que se le agregó sulfato de estreptomicina, a razón de 100 mg/l. Las placas se incubaron durante 8-12 días con un régimen de 12 h luz, 12 h oscuridad, a 25 ± 2 °C. Se consideró semilla infectada a aquella que presentó estructuras del patógeno (conidióforos, conidios y/o esclerocios). Como carácter de diagnóstico inequívoco, la bibliografía14 menciona la liberación de pigmentos rosados al medio de cultivo; este dato se tuvo en cuenta y junto con los caracteres morfológicos citados facilitó el diagnóstico.
Bioensayo de sensibilidad
Se utilizaron los siguientes productos químicos o combinaciones: 1) difenoconazol 3,69% + metalaxil 0,31%; 2) difenoconazol 3%; 3) iminoctadina 30%; 4) fluxapyroxad 5% + epoxiconazol 5% + piraclostrobin 8,1%; 5) tebuconazol 6%; 6) piraclostrobin 13,3% + epoxiconazol 5%; 7) carbendazim 50% + tiram 50%; 8) piraclostrobin 5% + tiofanatometílico 45%; 9) trifloxistrobin 37,5% + ciproconazol 16%; 10) azoxistrobin 20% + 8% ciproconazol; 11) fluodioxonil 2,5% + metalaxil 1%; 12) carbendazim 10% + tiram 10%; 13) tebuconazol 1,5% + tiram 50%, y 14) carboxina 20% + tiram 20%. Con cada uno de los fungicidas se preparó una solución madre de 1/100, de la cual se tomaron diversas alícuotas afines de obtener concentraciones de 0,1; 1; 10; 30; 50; 100 y 1.000 (mg/l) de principio activo en medio agar poroto. La cantidad necesaria para cada concentración se calculó sobre la base de la siguiente fórmula: C1V1= C2V228.
Posteriormente, discos de micelio de T. padwickii procedentes de colonias de 10-12 días de edad se sembraron en placas de Petri que contenían las concentraciones de los principios activos. Las cajas se incubaron en estufa a 25 ± 2 °C, durante 7 días. Con los datos obtenidos se realizaron análisis de regresión no lineal entre el porcentaje de inhibición del crecimiento del micelio y el logaritmo de la concentración de los productos más uno (Log ppm + 1)29,30,33. Se trabajó con el software estadístico Infostat versión 20138. Como criterio de ajuste se utilizó el cuadrado medio del error. En la tabla 1 se aporta información actualizada sobre el grupo químico al que pertenece cada principio activo, el mecanismo y modo de acción, el riesgo de resistencia inherente, y el código al que pertenece según la FRAC 201512. El grado de sensibilidad se clasificó empleando la escala propuesta por Edgington et al.10 (tabla 2).
Tabla 1 Clasificación de los diferentes principios activos usados según la FRAC Code List 2015

a - MBC: metil benzimidazol carbamato; PA: fenilamidas; PP: fenilpirrol; Qol: quinone outside inhibitor; SDHI: inhibidor de la succinato deshidrogenasa.
Tabla 2 Escala de sensibilidad de Edgington et al.10. Escala de sensibilidad basada en la CI50 (mg/l)

Resultados y discusión
Los resultados obtenidos se detallan en la tabla 3; a partir de estos se concluye que el hongo T. padwickii es muy sensible a la mezcla de fungicidas pertenecientes a la familia de los triazoles y estrobilurinas, a excepción del ciproconazol en mezcla con trifloxistrobin y azoxistrobin, a los que resultó moderadamente sensible. El difenoconazol demostró ser el más potente de todos los principios activos registrando el valor más bajo de CI50 (0,05 mg/l).
Tabla 3 Ecuaciones de regresión utilizadas para el cálculo de la concentración inhibitoria media (CI50)
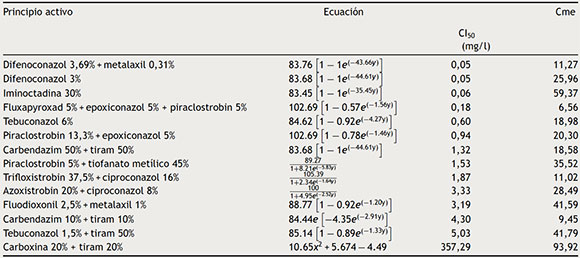
Cme: cuadrado medio del error.
Estos resultados son congruentes con las conclusiones de Malavolta et al.20 y Cardoso et al.5, quienes demostraron que el uso de estos fungicidas durante la floración y el llenado de granos en el cultivo de arroz disminuyen de manera significativa la incidencia del patógeno en las semillas.
El fluxapyroxad (un inhibidor de la succinato deshidrogenasa), combinado con epoxiconazol y piraclostrobin, presentó una CI50 de 0,18 mg/l; en cambio, con la mezcla de los 2 últimos la CI50 fue de 0,94 mg/l (tabla 3). Surge de esto que el agregado de dicho principio activo al formulado resulta eficiente, debido a que disminuye de manera considerable la sensibilidad. Otro fungicida al que T. padwickii resultó muy sensible fue iminoctadina, perteneciente a la familia de las guanidinas3,26.
Con respecto a las mezclas de carbendazim + tiram y piraclostrobin + metiltiofanato, se observó que el hongo resultó moderadamente sensible. Estos resultados son importantes porque los benzimidazoles se clasifican como de alto riesgo de resistencia (tabla 1) y se encuentran entre los principios activos más recomendados para el control de patógenos de semillas en general3,15,26,27.
Según los datos obtenidos, T. padwickii resulta resistente a la mezcla de carboxina + tiram; sin embargo, la carboxina es específica contra basidiomicetes que causan royas, carbones y enfermedades ocasionadas por Rhizoctonia solani Kühn y algunos dematiáceos del género Alternaria3,26. Sin embargo, este principio activo, al igual que el fluxapyroxad, presenta riesgo de resistencia media a alta4,12 y es el más recomendado para el control de patógenos de semillas de arroz15,32. El efecto del tiram deriva del radical isotiocianato (-N = C = S-), que ejerce su acción a altas concentraciones porque compite con el Cu2+ y Fe3+ disponible en las células del hongo3,26.
Según Mohana et al.23, para conseguir una inhibición del crecimiento de T. padwickii del 100% es necesaria una dosis de tiram de 2.000 mg/l. En otro trabajo similar, Lim18 estudió el efecto de distintos ditiocarbamatos (mancozeb, zineb, propineb, maneb y ferbam) en el crecimiento micelial de Colletrotichum gloesporioides Penz & Sacc, y concluyó que la CI50 de estos principios activos es superior a 500 mg/l. Teniendo en cuenta esto último, ese autor propone una escala de sensibilidad distinta a la de Edgington et al.10, en la que clasifica al patógeno como resistente cuando la CI50 supera los 700 mg/l. Ahmed et al.1 estudiaron el comportamiento del mancozeb en el crecimiento micelial de Bipolaris oryzae Breda de Haan e informaron resultados concordantes con aquellos.
El tebuconazole en combinación con el tiram logró reducir la CI50 al rango de moderadamente sensible (CI50 = 5,03 mg/l); sin embargo, el tebuconazole resulta aún más efectivo al 6% y en la mencionada formulación se encontraba al 1,5% (tabla 3).
El fluodioxonil en mezcla con metalaxil presentó una CI50 de 3,19 mg/l (moderadamente sensible). Este fungicida impide la transducción de la señal osmótica, lo que determina la ausencia de control en la presión que ejerce la membrana celular; esto causa la inestabilidad y, en consecuencia, la muerte del hongo. Sin embargo, Vicente et al.30 concluyeron que este principio activo resulta ineficiente para el control de T. padwickii (por debajo del 25%). Esto se fundamenta en la moderada sensibilidad comentada anteriormente. El metalaxil, por su parte, bloquea la actividad de la ARN polimerasa I, pero este principio activo es altamente específico para Oomycetes3,26.
Los resultados obtenidos hasta el momento demuestran la necesidad de remplazar la mezcla carboxina + tiram por el difenoconazol al 3% y de ir rotando con los otros principios activos utilizados, a fin de disminuir la presión de selección sobre cepas resistentes. Esto responde al hecho de que T. padwickii se presenta en niveles de prevalencia cercanos al 100% e incidencia mayor del 73%, lo que lo hace un patógeno con alto riesgo de presentar resistencia. Además, existe una estrecha relación entre el patógeno y la semilla, que dificulta el control debido a que el patógeno es capaz de dañar los tejidos más internos de la semilla19.
Este trabajo constituye un primer aporte al conocimiento de la sensibilidad de T. padwickii a diversos principios activos usados como fungicidas. Por ello, es importante seguir estudiando la sensibilidad en otras cepas con el objetivo de armar una línea de base y estudiar la variación que existe a nivel poblacional.
Responsabilidades éticas
Protección de personas y animales
Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
1. Archana B, Prakash HS. Survey of seed-borne fungi associated with rice seed in India. J Pure Appl Microbio. 2013;3:25-8. [ Links ]
2. Ahmed FM, Islam NM, Anam MK, Islam MT. Effect of fungicide against Bipolaris oryzae of rice under in vitro conditions. Pak J Phytopathol. 2002;1:4-7.
3. Arregui MC, Puricell E. Mecanismo de acción de plaguicidas. Dow AgroSciences, Rosario Argentina. 2008:208.
4. Avenot HF, Michailides TJ. Progress in understanding molecular mechanisms and evolution of resistance to succinate dehydrogenase inhibiting (SDHI) fungicides in phytopathogenic fungi. Crop Prot. 2010;29:643-51.
5. Cardoso G, Farias CRJ, Deible A, Rossatto PM. Efeito de fungicida no controle em graos ocasionado por Alternaria padwickii (Ganguly) e Curvularia lunata (Wakker). En XII Encontro Pos- Graduaçao, 2011, Resumen. Universidade Federal de Pelotas. Brasil.
6. Chen YJ, Jao WX, Wan TC, Ga O, Yang X, Zhan AF. Effect of epoxiconazole on rice blast and rice grain yield in China. Eur J Plant Pathol. 2013;136:567-628.
7. Damicone J. Fungicide resistance management. Oklahoma State University 2009 On-line cosnultado 24 Sept 2015. Disponible en: http://pods.dasnr.okstate.edu/docushare/dsweb/Get/Document-2317/F-7663web.pdf.
8. Di Rienzo JA, Casanoves F, Balzarini MG, Gonzalez L, Tablada M, Robledo CW InfoStat versión 2013. Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. consultado 23 Jun 2013. Disponible en: http://www.infostat.com.ar.
9. Echeverria AL, Gutiérrez SA, Carmona MA. Transmisión de Trichoconiella padwickii a coleoptilos de arroz. Trop Plant Pathol. 2013;38:346-8.
10. Edgington LV, Khew KL, Barron GL. Fungitoxic spectrum of benzimedazoles compounds. Phytophatology. 1971;61:42-4.
11. Farias CRJ, Afonso APS, Brançao MF, Pierobom CR. Ocorrencia de Alternaria padwickii (Ganguly) em sementes de arroz (Oryza sativa L.) (Poaceae) produzidas em quatro regioes orizicolas do Rio Grande do Sul e seu efeito sobre plântulas. Arq Inst Biol. 2007;74:245-9.
12. Fungicide Resistance Action Comite (Frac). CodeList On-line Disponible en: http://www.frac.info/docs/default-source/publications/frac-code-list/frac-code-list-2015-finalC2AD7AA_36764.pdf?sfvrsn=4. Consultado el 20 de septiembre del 2015.
13. Gonzales DR, Triana AC, Coca BM, Arrebato MR, Pedroso AR. Actividad antifúngica in vitro de la quitosana Sigma frente a hongos fitopatógenos causantes del manchado del grano en el cultivo de arroz (Oryza sativa L.). Fitosanidad. 2009;13:101-8.
14. Gutiérrez SA, Carmona MA, Reis EM. Methods for detection of Alternaria padwickii in rice seeds. J Phytopathol. 2010;158:523-6.
15. Huangh SW, Wang L, Liu LM, Tang SQ, Xhu DE, Savary S. Rice spikelet rot disease in China-2. Pathogenicity test, assessment of the importance of the disease, and preliminary evaluation of control options. Crop Prot. 2011;30:10-7.
16. Huynh VN, Ashok G. Efficacy of seed treatment in improving seed quality in rice. Omonrice. 2005;13:42-51.
17. Islam MS, Rahman H, Perver Z, Mahmud MR, Alam A. Studies on seed-borne fungi in rice cultivars grown in non-saline tidal zones of Patuakhali and their effect on seed germination. Bangladesh Research Publication Journal. 2012;6:286-90.
18. Lim TK. Chemical control of mango anthracnose in Malaysia. In vitro fungitoxicity of selected chemicals. Pertanika. 1980;3:5-9.
19. Lovato Echeverría AD, Carmona MA, Gutiérrez SA. Localization of Trichoconiella padwickii in different components of rice grain. Acta Adv Agric Sci. 2014;2:12-6.
20. Malavolta VMA, Parisi JJD, Takada HM, Martins C. Efeito de diferentes níveis de incidencia de Bipolaris oryzae em sementes de arroz sobre aspectos fisiológicos, transmissao do patógeno as plántulas e produçao. Summa Phytopathol. 2002;28:336-40.
21. Nguefack GE, Wulff JB, Dongmo FR, Fouelefack D, Fotio JM, Torp J. Effect of plants extracts and essential oil on the control of brown spot disease tillering, number of panicles and yield increase in rice. Eur J Plant Pathol. 2013;137:871-82.
22. Mew TW, Gonzales P. A handbook of rice seedborne fungi. Los Banos, Laguna: International Rice Research Institute.; 2002. p. 83.
23. Mohana DC, Sridharamurty S, Koteshwara AR. Antifungal activity of 2-hydrxy -4-methoxybenzaldehyde isolated from Decalepsis hamiltonii (Wight y ARN.) on seed-borne fungi causing biodeterioration of paddy. J Plant Prot Res. 2002;49:250-6.
24. Ramirez EM, Montoya MM, Villegas SJ, Torres JMC. Metodología de evaluación de la sensibilidad a fungicidas QoI-Fenamidone: Caso de estudio Phytophtora infestans (Mont.) de Barry. Rev Fac Nal Agr Medellín. 2009;62:4773-82.
25. Russell PE. Sensitivity baselines in fungicide resistance research and management. Crop Life International, Brussels. 2004. On line consultado 24 Sep 2015. Disponible en: http://www.frac.info/docs/default-source/publications/monographs/monograph-3.pdf?sfvrsn=8.
26. Satomauro A, Faretra F. Fungicides and their role in disease management. En: Wheeler NM, Bradley RJ, editores. Fungicides. Classification, role in disease management and toxicity effects. New York: Nova Publishers; 2013. p. 67-89.
27. Silva Lobos VL. Efeito do tratamento químico de semente de arroz no controle da brusone nas folhas e na qualidade sanitária e fisiológica das sementes. Trop Plant Pathol. 2008;33:162-6.
28. Van den Bosch F, Paveley N, Shaw M, Hobbelen P, Oliver R. The dose rate debate: Does the risk of fungicide resistance increase or decrease with dose? Plant Pathol. 2011;60:597-606.
29. Vargas LFM, Martínez SEM. Importancia de los métodos estadísticos para el cálculo de la CE50 y CE95 de algunos isotiocianatos evaluados contra Rhizoctonia solani (Kühn). Agron Colomb. 2010;2:57-66.
30. Vicente LP, Figueroa MP, Miranda MP. Efectividad del fludioxonil en la desinfección de semillas de arroz contra patógenos fúngicos. Centro Agrícola. 2009;36:49-56.
31. Uma V, Wesely EG. Seed borne fungi of rice from south Tamil Nadu. J Acad Indus Res. 2013;1:612-4.
32. Schuch ZJ, Filho OAL, Peske ST, Costadura LM, Brancao MF, Roshental MD. Qualidade fisiológica e sanitária de sementes de arroz com diferentes graus de umidade e tratadas com fungicidas. Rev Bras Sementes. 2006;28:45-53.
33. Zhao LY, Chen Y, Schaffner DW. Comparison of logistic regression and linear regression in modeling percentage data. Appl Environ Microbiol. 2001;67:2129-35.














