Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista argentina de microbiología
versión impresa ISSN 0325-7541versión On-line ISSN 1851-7617
Rev. argent. microbiol. vol.50 no.2 Ciudad Autónoma de Buenos Aires jun. 2018
http://dx.doi.org/10.1016/j.ram.2017.03.011
ORIGINAL
https://doi.org/10.1016/j.ram.2017.03.011
Crecimiento y eficiencia fotoquímica del fotosistema II en plántulas de 2 variedades de Capsicum annuum L. inoculadas con rizobacterias u hongos micorrícicos arbusculares
Growth and photochemical efficiency of photosystem II in seedlings of two varieties of Capsicum annuum L. inoculated with rhizobacteria and arbuscular mycorrhizal fungi
Azareel Angulo-Castroa, Ronald Ferrera-Cerratoa,*, Alejandro Alarcóna, Juan José Almaraz-Suáreza, Julián Delgadillo-Martíneza, Maribel Jiménez-Fernándezb y Oscar García-Barradasc
a Microbiología, Edafología, Campus Montecillo, Colegio de Posgraduados, Texcoco, Estado de México, México
b Instituto de Ciencias Básicas, Universidad Veracruzana, Xalapa, Veracruz, México
c Unidad de Servicios de Apoyo en Resolución Analítica (SARA), Universidad Veracruzana, Xalapa, Veracruz, México
Recibido el 25 de octubre de 2015; aceptado el 2 de marzo de 2017
Disponible en Internet el 18 de octubre de 2017
*Autor para correspondencia.
Correo electrónico: rferreracerrato@gmail.com (R. Ferrera-Cerrato).
0325-7541/© 2017 Asociación Argentina de Microbiología. Publicado por Elsevier Espana, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/).
RESUMEN
Una alternativa para el manejo sustentable en el cultivo de Capsicum annuum L. se ha enfocado en el uso de bacterias promotoras del crecimiento vegetal (BPCV) y hongos micorrícicos arbusculares (HMA). Esta investigación seleccionó BPCV y HMA sobre la base de su efecto en plantas de chile Bell Pepper y jalapeño. Se utilizaron 5 cepas bacterianas aisladas de diferentes localidades del estado de México (P61 [Pseudomonas tolaasii], A46 [P. tolaasii], R44 [Bacillus pumilus], BSP1.1 [Paenibacillus sp.] y OLs-Sf5 [Pseudomonas sp.]) y 3 tratamientos con HMA (H1 [consorcio aislado de la rizosfera de chile en el estado de Puebla], H2 [Rhizophagus intraradices]y H3 [consorcio aislado de la rizosfera de limón del estado de Tabasco]). Además, se incluyó un tratamiento fertilizado (solución Steiner 25%) y un testigo absoluto. Plántulas de chile jalapeño «Caloro» y pimiento Bell Pepper «California Wonder» fueron inoculadas con HMA en el momento de la siembra y con BPCV 15 días después de emerger, y crecidas bajo condiciones de cámara de ambiente controlado. En chile jalapenño, la mejor cepa bacteriana fue P61 y el mejor tratamiento de HMA fue el H1; en Bell Pepper la mejor cepa fue R44 y los mejores HMA fueron el H3 y el H1. Estos microorganismos incrementaron el crecimiento de plántulas de chile jalapenño y Bell Pepper en comparación con el testigo sin fertilizar. Asimismo, P61 y R44 beneficiaron positivamente la capacidad fotosintética del PSII.
PALABRAS CLAVE
Hongos micorrícicos; Rizobacterias; Promoción de crecimiento
ABSTRACT
Plant growth promoting rhizobacteria (PGPR) and arbuscular mycorrhizal fungi (AMF) are a biological alternative for the sustainable management of Capsicum annuum L. This research work evaluated the effects of both PGPR and AMF on bell pepper and jalapeno pepper plants. Five bacterial strains isolated from several locations in Estado de Mexico were used: [P61 (Pseudomonas tolaasii), A46 (P. tolaasii), R44 (Bacillus pumilus), BSP1.1 (Paenibacillus sp.), and OLs-Sf5 (Pseudomonas sp.)], and three treatments with AMF [H1 (consortium isolated from pepper crops in the State of Puebla), H2 (Rhizophagus intraradices), and H3 (consortium isolated from the rhizosphere of lemon trees, State of Tabasco)]. In addition, a fertilized treatment (Steiner nutrient solution at 25%) and an unfertilized control were included. Seedlings of "Caloro" jalapeno pepper and "California Wonder" bell pepper were inoculated with AMF at seed sowing, and PGPR were inoculated after 15 days of seedling emergence; seedlings were grown under plant growth chamber conditions. P61 bacterium and H1 AMF consortia were the most effective microorganisms for jalapeno pepper whereas R44 bacterium and AMF H3 and H1 were the most effective for bell peppers, when compared to the unfertilized control. Furthermore, P61 and R44 bacteria showed beneficial effects on PSII efficiency.
KEYWORDS
Mycorrhizal fungi; Rhizobacteria; Growth promotion
Introducción
México es uno de los principales países productores de chile en el mundo y con mayor diversidad genética de Capsicum17,47. Las variedades de chile más cultivadas en el norte del país son Bell Pepper y jalapeño, cuyo manejo demanda altas cantidades de fertilizante químicos, que no son completamente aprovechados por las plantas. Esto se traduce en altos costos de producción y contaminación potencial en el suelo25,51,60. Los fertilizantes nitrogenados son los más utilizados en cultivos hortícolas y su sobreúso genera impactos ambientales a gran escala, que ponen en peligro la sostenibilidad de los ecosistemas al causar eutrofización y contribuir al calentamiento global, al ser una fuente importante de óxido nitroso (N2O)13,19,29.
Una alternativa al problema de la sobrefertilización es el uso de bacterias promotoras del crecimiento vegetal (BPCV) y de hongos micorrícicos arbusculares (HMA), con los cuales es posible desarrollar sistemas amigables con el ambiente (agricultura ecológica), reducir la aplicación de fertilizantes químicos y mantener una producción sostenible23. Las BPCV cohabitan en la rizosfera y pueden beneficiar la salud vegetal, estimular el crecimiento de las plantas y proteger contra patógenos56; además, pueden reducir los efectos del estrés abiótico y favorecer el rendimiento de los cultivos al participar en el reciclaje de nutrimentos y en la fertilidad del suelo6,21.
Los HMA son importantes en la agricultura ecológica por los beneficios que tienen en los cultivos al actuar como movilizadores de agua y nutrientes, entre ellos fósforo, cinc y cobre, y como agentes de control biológico35,36,55 . También pueden aumentar la tolerancia de las plantas a diversos factores de estrés abióticos, tales como sequía, niveles excesivos de elementos tóxicos, salinidad y desequilibrios o deficiencias de nutrientes43,48,64. Algunas hortalizas que en su inicio requieren una etapa de vivero, como es el caso del chile (Capsicum annuum L.), pueden tener beneficios por la inoculación de HMA10.
Algunos estudios muestran el beneficio de BPCV y HMA en plántulas de chile. Flores et al.18 observaron que Azospirillum brasilense y Pantoea dispersa favorecen la nutrición por nitrógeno y el crecimiento de plántulas de pimiento, especialmente cuando Azospirillum y Pantoea se combinaron con bajos niveles de NO3. Asimismo, la bacteria Klebsiella pneumoniae y el HMA Glomus intraradices favorecieron la altura, la longitud de la raíz y el peso seco de plantas de chile con respecto a plantas sin inoculación49. La inoculación de G. intraradices y Gigaspora margarita en 8 diferentes genotipos de pimiento en condiciones de cámara de crecimiento llevó a un mayor peso seco en comparación con plantas no inoculadas53. Además, los efectos favorables de la colonización con HMA en el crecimiento de Capsicum annuum cv. 11B 14 se han relacionado con una mejor adaptación a condiciones de salinidad32.
A pesar de los beneficios mencionados, se tiene limitada información sobre el efecto de bacterias como Paenibacillus sp., Pseudomonas sp. y Bacillus pumilus, así como sobre el efecto de consorcios micorrícicos arbusculares en la promoción del crecimiento vegetal en plántulas de chile. Por lo anterior, la presente investigación se enfocó en evaluar el efecto de 5 cepas de BPCV y de algunos HMA sobre el crecimiento y la eficiencia del PSII de plántulas de chile Bell Pepper y jalapeño, en condiciones controladas.
Materiales y métodos
Material vegetal y condiciones del experimento
El experimento se llevó a cabo en una cámara de ambiente controlado (28°C, 70% de humedad relativa, 12 h de fotoperíodo). Se utilizaron semillas de chile jalapeño variedad jalapeño M.P.A «Caloro» (Semillas Caloro, Mexicana Industrial de Insumos Agropecuarios S.A. de C.V., Guadalajara, Jalisco, México) y semillas de chile Bell Pepper variedad pimiento «California Wonder» (Distribuidora Rancho Los Molinos S.A. DE C.V., Tepoztlan, Morelos, México), ambas con germinación mayor del 89%. En adelante, estas variedades se nombrarán como chile jalapeno y pimiento Bell Pepper, respectivamente.
Material microbiológico
Se utilizaron las cepas bacterianas A46 y P61 (Pseudomonas tolaasii), R44 (6. pumilus), BSP1.1 (Paenibacillus sp.) y OLs-Sf5 (Pseudomonas sp.). Además, se utilizaron 3 inóculos de HMA: H1, H2 y H3. El H1 fue un consorcio aislado de la rizosfera de chile en el estado de Puebla, compuesto por Funneliformis aff. geosporum y Claroideoglomus sp. Tras su recolección, este material, que contenía 2.590 esporas por 100 g de suelo seco, fue almacenado a 4°C. El inóculo H2 consistió en raíces frescas de cultivo trampa con pasto Lolium multiflorum colonizado en un 86% por Rhizofagus intraradices. El inóculo H3 consistió en raíces frescas de L. multiflorum con 93% de colonización por un consorcio de HMA compuesto por Rhizophagus fasciculatus, Glomus sp. y Archaeospora sp., aislado de la rizosfera de limón del estado de Tabasco. Estos consorcios fúngicos se consideraron en función del beneficio que aportan a sus hospedantes; todos ellos están continuamente propagados en condiciones de invernadero para uso en investigación.
Preparación del inóculo bacteriano
Cada una de las cepas bacterianas fue crecida en caldo nutritivo a 28°C durante 72 h. Los cultivos obtenidos se centrifugaron a 7000 rpm 15 min para separar el concentrado microbiano, que fue resuspendido en agua destilada estéril y se volvió a centrifugar 2 veces más, con el propósito de eliminar los nutrientes residuales. La concentración de células bacterianas en los inóculos P61, R44, OLs-Sf5, A46 y BSP1.1 fue 1,68 x 108, 2,45 x 108, 3,73 x 108, 8,6 x 108, y 4.0 x 105 UFC/ml, respectivamente.
Algunas características reportadas para los géneros o las especies de las BPCV utilizadas en este experimento son las siguientes: P tolaasii y Pseudomonas sp. producen auxinas y solubilizan fosfato12,41; Paenibacillus sp. y B. pumilus promueven el crecimiento, solubilizan fosfato y producen auxinas24,34. Estas características fueron corroboradas en las cepas utilizadas en este experimento, se verificó que P61 y A46 solubilizan fosfato y producen auxinas y sideróforos, mientras que R44, OLs-Sf5 y BSP1.1 producen auxinas y solubilizan fosfato46 (Almaraz-Suárez, resultados no publicados).
Siembra e inoculación
La siembra se realizó en charolas de unicel de 200 cavidades; estas se cortaron en secciones de 20 cavidades cada una (una sección por tratamiento). Se sembró una semilla por cavidad, se empleó un sustrato conformado por arena, turba y perlita (2:1:1 v/v), previamente esterilizado (121°C durante 3h, en 2 días consecutivos).
La inoculación por los HMA H2 y H3 se realizó al momento de la siembra, colocando 0,5 g de fragmentos de raíces del pasto (L. multiflorum) a una profundidad de 2cm del cepellón. Por otra parte, el HMA H1 se mezcló al momento de la siembra con el sustrato en una proporción de 1:4 v/v. La inoculación de las cepas bacterianas se llevó a cabo 15 días después de la germinación del material vegetal, colocando 2 ml de inóculo por planta dirigidos a la raíz; el testigo con fertilización (solución de Steiner al 25%) y el testigo sin fertilización se mantuvieron sin inoculación. En el caso del testigo con fertilización, se utilizó la solución de Steiner ajustada a una conductividad eléctrica de 0,5 ds/m, con los siguientes componentes (mg/l): Ca(NO3)2•4H2O (265,5); KNO3 (78); K2SO4 (67,5); MgSO4•7H2O (123) y KH2PO4 (34), con el pH ajustado a 6,5.
Variables evaluadas
Después de 70 días, las plantas fueron evaluadas y cosechadas; se les midieron la altura de planta, el diámetro de tallo, el volumen radical, el número de hojas, el área foliar, el peso seco de hojas y total, la eficiencia fotoquímica del PSII (Fv/Fo) y la colonización micorrícica. El área foliar específica se estimó dividiendo el área foliar por el peso seco de las hojas (cm/g). El volumen radical se midió utilizando la técnica de desplazamiento de agua8: la raíz completa se sumergió en una probeta graduada con un determinado volumen de agua, el volumen de agua desplazado por la raíz se expresó en cm3. El área foliar fue determinada con un medidor de área foliar marca LICOR (LI 3000, Inc. Lincoln, NE, EE. UU.). Labiomasa seca se obtuvo tras secar (70°C, 72 h) y pesar por separado hojas, tallos y raíces en una balanza analítica (Sartorius, Modelo Analytic AC 210S, Illinois, EE. UU.). La eficiencia fotoquímica del PSII (Fv/Fo) se midió con un fluorómetro OS-30p+ (Opti-Sciences), considerando lecturas en la hoja más joven completamente desarrollada. El porcentaje de colonización micorrícica se evaluó con la técnica de clareo y tinción45.
Tratamientos y diseño experimental
El experimento contempló un diseno experimental completamente al azar con 10 tratamientos (5 cepas de BPCV, 3 inóculos de HMA y 2 testigos, uno con fertilización química y el otro como testigo absoluto, sin fertilizar) y 15 repeticiones cada uno. Esto originó un total de 150 unidades experimentales por cada variedad de chile. Los datos fueron analizados mediante el programa SAS para Windows52, realizando un análisis de varianza y una prueba de comparación de medias (LSD, a = 0,05).
Resultados
En las figuras 1 y 2 se muestran algunos parámetros de crecimiento global evaluados en el pimiento Bell Pepper y en el chile jalapeño, respectivamente. Se observa que los tratamientos inoculados con HMA mostraron mayor altura de planta en ambos cultivares de chile (figs. 1 A y 2A); en el pimiento Bell Pepper, el tratamiento con H1 fue superior (p ≤ 0,05) a los demás tratamientos (fig. 1 A), mientras que en el chile jalapeño, los tratamientos H1 y H3 llevaron a una mayor altura de planta (fig. 2 A). En cuanto a la inoculación con bacterias, las plantas de pimiento Bell Pepper inoculadas con A46, P61, OLs-Sf5 y BSP1.1 mostraron mayor altura (p ≤ 0,05) con respecto al testigo y al testigo fertilizado (fig. 1 A). En el caso del chile jalapeño, la inoculación con bacterias no produjo efectos significativos en la altura en comparación con el testigo y el testigo fertilizado (fig. 2 A).
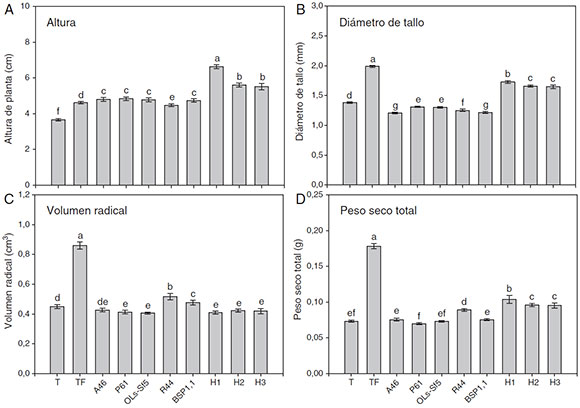
Figura 1 Altura (A), diámetro de tallo (B), volumen radical (C) y peso seco total (D) de plantas de chile pimiento Bell Pepper después de 70 días. Se muestran medias ± error estándar; n = 15. Letras idénticas sobre las barras indican ausencia de diferencia significativa (LSD, α = 0,05). A46: Pseudomonas tolaasii; P61: Pseudomonas tolaasii; OLs-Sf5: Pseudomomas sp.; R44: Bacillus pumilus; BSP1.1: Paenibacillus sp.; H1: Funneliformis aff. geosporum y Claroideoglomus spp.; H2: Rhizophagus intraradices; H3: Rhizophagus fasciculatus, Glomus sp. y Archaeospora sp.; T: testigo absoluto; TF: testigo fertilizado.

Figura 2 Altura (A), diámetro de tallo (B), volumen radical (C) y peso seco total (D) de plantas de chile jalapeño después de 70 días. Se muestran medias± error estándar; n = 15. Letras idénticas sobre las barras indican ausencia de diferencia significativa (LSD, α = 0,05).A46: Pseudomonas tolaasii; P61: Pseudomonas tolaasii; OLs-Sf5: Pseudomomas sp.; R44: Bacillus pumilus; BSP1.1: Paenibacillus sp.; H1: Funneliformis aff. geosporum y Claroideoglomus spp.; H2: Rhizophagus intraradices; H3: Rhizophagus fasciculatus; Glomus sp. y Archaeospora sp.; T: testigo absoluto; TF: testigo fertilizado.
Puede notarse en las mismas figuras que los testigos fertilizados fueron los tratamientos que mostraron mayor diámetro de tallo en ambos cultivares de chile, como se observa en la figuras 1 B y 2B. En pimiento Bell Pepper, el tratamiento con H1 fue superior (p ≤ 0,05) a los demás tratamientos, pero inferior al testigo fertilizado (fig. 1 B), mientras que en el chile jalapeño fue la inoculación con el consorcio H3 la que superó en este parámetro (p ≤ 0,05) a los demás tratamientos con HMA (fig. 2 B). Por otra parte, la inoculación de pimiento Bell Pepper con bacterias llevó en todos los casos a un menor diámetro de tallo (p ≤ 0,05) comparado con el testigo y el testigo fertilizado (fig. 1 B). No sucedió lo mismo en el caso del chile jalapeño, en el que la inoculación con bacterias llevó a un diámetro de tallo superior (p ≤ 0,05) que en el testigo sin fertilizar; la cepa R44 mostró el mejor desempenño en este sentido comparada con el resto de los inóculos bacterianos (fig. 2 B).
En las figuras 1 C y 2 C se observa que el testigo fertilizado mostró el mayor volumen radical en ambos cultivares de chile. Asimismo, se advierte en la figura 1 C que en el pimiento Bell Pepper, los tratamientos inoculados con las bacterias R44 y BSP1.1 mostraron mayor volumen radical con respecto a las inoculaciones A46, P61 y OLs-Sf5, también al testigo sin fertilizar y a los tratamientos inoculados con HMA (p ≤ 0,05). En las plantas de chile jalapeño, aquellas inoculadas con las bacterias A46, P61 y OLs-Sf5 fueron las que superaron en volumen radical al testigo sin fertilizar (p ≤ 0,05) (fig. 2C). La inoculación de HMA tuvo un efecto negativo en el volumen radical con respecto al testigo (fig. 2 C).
El testigo con fertilización en ambos cultivares de chile mostró el mayor peso seco total, como se observa en las figuras 1 D y 2 D. En pimiento Bell Pepper, el tratamiento con el consorcio de HMA H1 derivó en un peso seco total superior (p ≤ 0,05) al de los demás tratamientos, excepto que el testigo fertilizado; algo muy similar se observó para el chile jalapeno: con H1 se obtuvo un peso seco total significativamente mayor que con los demás tratamientos (p ≤ 0,05), excepto que el testigo fertilizado y el inoculado con la bacteria P61. Respecto de la inoculación con bacterias, se observa en la figura 1 D que las plantas de pimiento Bell Pepper inoculadas con R44 fueron las únicas de ese cultivar que mostraron mayor peso seco total que el testigo sin fertilizar (p ≤ 0,05), mientras que en chile jalapeno esto ocurrió con las inoculadas con P61 (p ≤ 0,05).
En las figuras 3 y 4 se muestran los parámetros foliares evaluados en esta investigación. Se observa que el testigo fertilizado mostró un mayor número de hojas en ambos cultivares de chile (figs. 3A y 4A). En pimiento Bell Pepper, solo los tratamientos inoculados con las bacterias A46, Ols-Sf5 y R44 fueron en este sentido superiores al testigo (p ≤ 0,05) (fig. 3 A). En cambio, en las plantas de chile jalapeño, con todas las bacterias ensayadas se obtuvo un mayor número de hojas que en el testigo (fig. 4 A). En lo que respecta a los tratamientos con HMA, H2 y H3 inoculados en plantas de pimiento Bell Pepper llevaron a un incremento significativo (p ≤ 0,05) en el número de hojas respecto del testigo (fig. 3 A), mientras que en chile jalapeño los 3 inó-culos micorrícicos, H1, H2 y H3, se asociaron a un mayor número de hojas que en el testigo (fig. 4 A).

Figura 3 Número de hojas (A), área foliar (B), peso seco de hojas (C) y área foliar específica (D) de plantas de chile pimiento Bell Pepper después de 70 días. Se muestran medias ±error estándar, n = 15. Letras idénticas sobre las barras indican ausencia de diferencia significativa (LSD, α = 0,05).A46: Pseudomonas tolaasii; P61: Pseudomomas tolaasii; OLs-Sf5: Pseudomomas sp.; R44: Bacillus pumilus; BSP1.1: Paenibacillus sp.; H1: Funneliformis aff. geosporum y Claroideoglomus spp.; H2: Rhizophagus intraradices; H3: Rhizophagus fasciculatus, Glomus sp., y Archaeospora sp.; T: testigo absoluto; TF: testigo fertilizado.

Figura 4 Número de hojas (A), área foliar (B), peso seco de hojas (C), área foliar específica (D) de plantas de chile Jalapeño después de 70 días. Se muestran medias ±error estándar, n = 15. Letras idénticas sobre las barras indican ausencia de diferencia significativa (LSD, α = 0,05).A46: Pseudomonas tolaasii; P61: Pseudomomas tolaasii; OLs-Sf5: Pseudomomas sp.; R44: Bacillus pumilus; BSP1.1: Paenibacillus sp.; H1: Funneliformis aff. geosporum y Claroideoglomus spp.; H2: Rhizophagus intraradices; H3: Rhizophagus fasciculatus, Glomus sp. y Archaeospora sp.; T: testigo absoluto; TF: testigo fertilizado.
En ambos cultivares de chile, el testigo con fertilización alcanzó la mayor área foliar, como se muestra en las figuras 3B y 4B (p ≤ 0,05). En cuanto a los tratamientos biológicos, se advierte en la figura 3 B que la inoculación de las plantas de pimiento Bell Pepper con las bacterias A46, P61 y R44 llevó a una mayor área foliar en comparación con el testigo (p ≤ 0,05), mientras que con la aplicación de los 3 tratamientos de HMA (H1, H2 y H3) se obtuvieron áreas foliares superiores respecto del testigo. En el caso de las plantas de chile jalapenño, aquellas inoculadas con las bacterias P61 y R44 mostraron efectos significativamente positivos (p ≤ 0,05) en área foliar en comparación con el testigo (fig. 4 B).
El testigo fertilizado también mostró mayor peso seco de hoja en ambos cultivares de chile, tal como se observa en las figuras 3C y 4C. En pimiento Bell Pepper, el único tratamiento bacteriano que llevó a un aumento significativo (p ≤ 0,05) de este parámetro fue el de las inoculadas con R44, que superó a los demás tratamientos con BPCV y al testigo (fig. 3C). En chile jalapeño fueron las inoculadas con P61 aquellas que tuvieron mayor peso seco de hojas en comparación con las demás tratamientos bacterianos y con el testigo (fig. 4C). En lo referido al desempeño de los HMA, en las plantas de pimiento Bell Pepper solo las inoculadas con H3 mostraron un peso seco de hojas superior (p ≤ 0,05) al observado para los demás tratamientos, excepto el testigo fertilizado (fig. 3 C). En las plantas de chile jalapenño, las inoculadas con el consorcio H1 superaron en peso seco de hojas (p ≤ 0,05) a los demás tratamientos, excepto al H3 y al testigo fertilizado (fig. 4C).
En la figura 3 D se observa que las plantas de pimiento Bell Pepper inoculadas con la bacteria P61 mostraron mayor área foliar específica en comparación con los demás tratamientos (p ≤ 0,05), mientras que en las de chile jalapeño el testigo fertilizado fue el que mostró mayor área foliar específica respecto de los demás tratamientos a igual nivel de significación estadística (fig. 4 D). En cuanto a la inoculación con HMA, no se observaron efectos positivos en este parámetro en comparación con el testigo ni con el testigo fertilizado en ambos cultivares de chile (figs. 3 y 4).
Por último, la figura 5 muestra el efecto de los tratamientos sobre la eficiencia fotosintética del fotosistema II (PSII) (Fv/Fo). Se aprecia que la aplicación del fertilizante mineral llevó a un incremento significativo con respecto al resto de los tratamientos. En el caso del pimiento Bell Pepper, no se observaron diferencias significativas (p ≤ 0,05) entre las diferentes BPCV, y los valores de Fv/Fo fueron en su mayoría significativamente mayores que los obtenidos con la inoculación de los HMA (fig. 5 A). En el chile jalapeno, los valores de Fv/Fo no mostraron diferencias significativas (p ≤ 0,05) entre los tratamientos inoculados con las bacterias respecto del testigo, y el menor valor se obtuvo en el tratamiento inoculado con R. intraradices (H2), cuyo Fv/Fo fue incluso significativamente menor que el del testigo (fig. 5 B).

Figura 5 Eficiencia fotoquímica del fotosistema II expresada como Fv/Fo en plantas de chile pimento Bell Pepper (A) y jalapeño (B) después de 70 días. Se muestran medias± error estándar, n = 8. Letras idénticas sobre las barras indican ausencia de diferencia significativa (LSD, α = 0,05).A46: Pseudomonas tolaasii; P61: Pseudomomas tolaasii; OLs-Sf5: Pseudomomas sp.; R44: Bacillus pumilus; BSP1.1: Paenibacillus sp.; H1: Funneliformis aff. geosporum y Claroideoglomus spp.; H2: Rhizophagus intraradices; H3: Rhizophagus fasciculatus, Glomus sp., y Archaeospora sp.; T: testigo absoluto; TF: testigo fertilizado.
La colonización micorrícica total mostró diferencias significativas (p ≤ 0,05) entre los tratamientos inoculados con hongos micorrícicos en ambos cultivares de chile. El consorcio H3 fue más infectivo en ambos cultivares: 47,2% en pimiento Bell Pepper y 42,3% en chile jalapeño; el inóculo H2 mostró una colonización del 32,8% en chile jalapeño. El inóculo H1 mostró baja infectividad (menor del 5%) en ambos cultivares. No se observó presencia de arbúsculos en ningún cultivar. La presencia de vesículas en el cultivar Bell Pepper solo se observó cuando se inoculó con H3 (19,3%) y en jalapeno los tratamientos H2 y H3 produjeron un 17,4 y un 27,8% de vesículas, respectivamente (tabla 1).
Tabla 1 Colonización de los HMA en plantas de chile (Capsicum annuum) pimento Bell Pepper y jalapeno

Discusión
Las cepas bacterianas que mostraron mayor efecto en altura de planta, área foliar, diámetro de tallo y volumen radical con respecto al testigo sin fertilizar en ambos cultivares de chile fueron P61 y R44, mientras que los HMA más efectivos en altura de planta, diámetro de tallo y peso seco de la planta correspondieron a los consorcios H1 y H3. Estos resultados reflejan la relevancia que tienen los microorganismos en el desarrollo de plántulas de interés hortícola, pues permitirían reducir la demanda de insumos agrícolas, especialmente fertilizantes químicos26. Las prácticas de siembra y trasplante son comunes en los sistemas agrícolas, de ahí que es importante producir plántulas sanas, para lograr un alto rendimiento después del trasplante. Cabe hacer la consideración de que el empleo de mano de obra en la producción de plántulas en almácigos o durante el trasplante es obligatorio, por lo que se puede aprovechar esa etapa para inocular con microorganismos beneficiosos. En una producción directa a campo esto resultaría más costoso y los microorganismos podrían tener mayor dificultad para colonizar la rizosfera de la planta4,50.
Los beneficios de las cepas bacterianas utilizadas en este experimento en la promoción del crecimiento vegetal han sido documentados en diferentes cultivos como nabo (Brassica napus), pimiento Bell Pepper (Capsicum annum L.), pepino (Cucumis sativus) y tomate (Solanum lycopersicum). Los mecanismos que tienen estas bacterias para promover el crecimiento se relacionan con la producción de sideróforos, la solubilización de fosfatos y la síntesis de indoles12,15,27,30,44,61 .
En el caso de los HMA, sus efectos favorables se han reportado en plantas de pimiento Bell Pepper (Capsicum annum L.) y avena (Avena sativa), se destacan entre ellos la producción de biomasa aérea y radical, algunos parámetros fisiológicos y la acumulación de fósforo44,62. Dichos resultados se relacionan con los hallazgos del presente estudio en ambas variedades de chile. Los HMA promueven el crecimiento vegetal debido a una mayor absorción de nutrimentos como fósforo y nitrógeno, entre otros1,11,40,42,44.
Se obtuvieron diferencias significativas en los cultivares de C. annum aquí ensayados al ser inoculados con las cepas P61 (P tolaasii) y R44 (B. pumilus): respecto de la mayoría de las variables evaluadas se observaron efectos positivos con estos tratamientos. Kangetal.31 reportaron resultados similares al inocular 2 cepas endófitas (Pseudomomas sp. y Pantoea sp.) en plántulas de pimiento, dichas cepas promovieron el crecimiento en el 16,6 y el 17,2%, respectivamente, y el peso fresco total en el 27,7 y el 15,3%, respectivamente. No existen reportes en cuanto a la inoculación con P. tolaasii y B. pumilus en estas variedades de chile; no obstante, el efecto favorable de la inoculación de BPCV en el crecimiento y demás características relacionadas con la calidad de plántulas ha sido estudiado por Díaz et al.14 y por Brutti et al.9 en tomate y lechuga.
En líneas generales, en los 2 cultivares de C. annuum se observó un mayor efecto positivo en parámetros de crecimiento (altura, diámetro de tallo, área foliar y peso seco foliar y total) por la inoculación con HMA en comparación con la inoculación con BPCV. Este efecto se atribuye fundamentalmente a la actividad fisiológica de los HMA, la cual favorece el crecimiento, el desarrollo y el vigor de las plantas, como ha sido discutido por Smith y Smith54.
El volumen radical, en cambio, evidenció mayor respuesta por la inoculación de las bacterias que por la de los HMA. Este efecto se puede relacionar con que, en las plantas micorrizadas, las hifas del hongo exploran de forma más efectiva el suelo y ayudan a absorber y a asimilar los nutrimentos en las plantas, es decir, actúan como una extensión de las raíces, por lo que la planta no requiere de mayor desarrollo radical para absorber y asimilar nutrimentos20.
Por su parte, Aguirre-Medina y Kohashi-Shibata2 encontraron que la inoculación con HMA incrementó el desarrollo de la parte aérea, pero provocó un menor peso seco de la raíz en plántulas de frijol. Por otro lado, Soti et al.57 observaron una respuesta similar en Lygodium microphyllum, al obtener una correlación negativa entre la micorrización y el crecimiento de la raíz, sin afectar el desarrollo de la parte aérea de la planta. Lo anterior indica que la respuesta en el crecimiento de la raíz de una planta micotrófica podría estar mediada por los HMA.
La medición de la eficiencia fotoquímica del PSII basada en la fluorescencia de la clorofila es una técnica efectiva, no invasiva, para detectar daños en el PSII7, y el parámetro Fv/Fo indica el potencial de la capacidad fotosintética del PSII 63. En ambos cultivares de chile, las plantas testigo con fertilización mostraron mayores valores de Fv/Fo que los tratamientos inoculados con BPCV o con HMA; esto se debe a que la plántula, al tener todos los nutrimentos en forma proporcional, no sufre estrés y ello se refleja en lecturas altas de Fv/Fo38. Russo y Perkins-Veazie50 encontraron que no hubo respuestas en términos de clorofila en plántulas de pimiento Bell Pepper inoculadas con BPCV o con HMA, ya sea solos o en combinación. En cambio, el testigo sin fertilizar mostró los valores de Fv/Fo más bajos; esto se atribuye a la limitada disponibilidad de nutrimentos en el cepellón de la plántula, lo que puede ocasionar un estrés por deficiencia de elementos nutritivos, ya que la eficiencia fotosintética está relacionada con una disminución en el contenido de nitrógeno de la hoja, en el contenido de clorofila y en el área foliar39. Por otra parte, las plantas con HMA mostraron valores de Fv/Fo similares al testigo, pero menores que los tratamientos inoculados con BPCV y que el testigo con fertilización. Lo anterior puede relacionarse con un mayor consumo de fotoasimilados por el hongo simbionte, lo que ocasionaría un estrés a la planta que se reflejaría en valores bajos de Fv/Fo54; no obstante, algunos estudios demuestran que los HMA aceleran la actividad foto-sintética en la planta hospedera16,22. En este caso, los HMA, al promover el crecimiento vegetal, pudieron haber agotado los nutrientes en el sustrato; esto llevaría a un estrés nutrimental en las plántulas al final del experimento, momento en el cual se tuvieron lecturas de Fv/Fo bajas, lo que indica un estrés vegetal63. Esta situación no ocurrió en las plantas fertilizadas, en las que se registraron los valores de Fv/Fo más altos.
La promoción del crecimiento por parte de los HMA o de las BPCV en ambos cultivares de chile se relaciona con un mayor crecimiento en la parte aérea, que puede ser el resultado de diversos mecanismos, como la fijación de nitrógeno y la solubilización de fosfato, o la producción de diferentes fitohormonas (ácido indolacético, ácido giberélico y citoquininas), que favorecen la expansión foliar, lo que a su vez propicia el aprovechamiento de recursos33,59.
El incremento de la eficiencia fotoquímica del PSII, representado con el parámetro Fv/Fo, está relacionado con la promoción del crecimiento en ambos cultivares de chile, principalmente por la inoculación de las cepas P61, R44 y BSP1.1 con respecto al testigo absoluto, lo que indica un beneficio en el PSII de las plantas65. Por tanto, la fluorescencia de la clorofila tiene valor en el diagnóstico precoz de la vitalidad o vigor de la planta, incluso antes de diagnosticarse a simple vista 58.
La colonización micorrícica fue baja con el consorcio H1 y el inóculo H2 en el pimiento Bell Pepper y con el consorcio H1 en el chile jalapeño, sin embargo; hubo una respuesta favorable a los HMA en altura de planta, diámetro de tallo, peso seco total, número de hojas y área foliar, lo cual indica que la extensión de la colonización micorrícica no siempre es un indicador claro del beneficio potencial que puede representar para su planta hospedante3,28.
Los HMA H1 y H3 y las BPCV P61 y R44 incrementaron el crecimiento de las plántulas de chile jalapeño y de pimiento Bell Pepper. A pesar de la baja colonización micorrícica, los HMA produjeron efectos favorables en la altura de planta, el diámetro de tallo y el peso seco de la planta. En el caso de las BPCV, los principales beneficios se relacionaron con la altura de planta, el área foliar, el diámetro del tallo y el volumen radical con respecto al testigo sin fertilización. Además, las BPCV produjeron un aumento en la Fv/Fo en comparación con el testigo sin fertilizar, lo que se relaciona con el aumento de la capacidad fotosintética del PSII. No obstante, la utilización solo de BPCV o de HMA no es suficiente para obtener beneficios comparables con los que se logran con la fertilización química. Se requieren nuevos experimentos orientados a la búsqueda de dosis óptimas de fertilización química, compatibles con la actividad fisiológica de las BPCV y los HMA en las plantas.
Estos microorganismos pueden ser utilizados para reforzar el desarrollo de plántulas de chile jalapenño y pimiento Bell Pepper, para que estas lleguen al campo con más facultades adaptativas contra los diferentes tipos de estrés que pudieran presentarse después del trasplante. Aunque en este trabajo de investigación no se estudió la interacción entre los dos diferentes tipos de microorganismos, no se descarta la posibilidad de que exista un efecto sinérgico entre estos. Al respecto, existen estudios que demuestran un efecto positivo en la promoción del crecimiento vegetal cuando se mezclan BPCV y HMA5,37.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Financiación
Trabajo financiado por el proyecto CONACYT-SAGARPA 180797, Subproyecto: Preparación de formulaciones de bio-fertilizantes.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses en el presente manuscrito científico.
Agradecimientos
A. Angulo-Castro agradece el apoyo del CONACYT durante sus estudios de doctorado. Los autores agradecen el apoyo de 2 revisores anónimos que contribuyeron al mejoramiento del presente manuscrito.
1. Adhya TK, Kumar N, Reddy G, Podile AR, Bee H, Bindiya S. Microbial mobilization of soil phosphorus and sustainable P management in agricultural soils. Curr Sci. 2015;108:1280-7. [ Links ]
2. Aguirre-Medina JF, Kohashi-Shibata J. Dinámica de la colonización micorrízica y su efecto sobre los componentes del rendimiento y contenido de fósforo en fríjol común. Agric Téc Méx. 2002;28:23-33. [ Links ]
3. Alarcón A, Ferrera-Cerrato R. Manejo de la micorriza arbuscular en sistemas de propagación en plantas frutícolas. Terra Latinoam. 1999;17:179-91. [ Links ]
4. Anith KN, Sreekumar A, Sreekumar J. The growth of tomato seedlings inoculated with co-cultivated Piriformospora indica and Bacillus pumilus. Symbiosis. 2015;65:9-16. [ Links ]
5. Armada E, Probanza A, Roldán A, Azcón R. Native plant growth promoting bacteria Bacillus thuringiensis and mixed or individual mycorrhizal species improved drought tolerance and oxidative metabolism in Lavandula dentata plants. J Plant Physiol. 2016;192:1-12. [ Links ]
6. Babalola OO. Beneficial bacteria of agricultural importance. Biotechnol Lett. 2010;32:1559-70. [ Links ]
7. Baker NR. Chlorophyll fluorescence: A probe of photosynthesis in vivo. Annu Rev Plant Biol. 2008;59:89-113. [ Links ]
8. Bohm W. Root parameters and their measurement. In: Methods of studying root systems. Springer-Verlag. Berlin, Heidelberg: New York Press; 1979, p. 125-138. [ Links ]
9. Brutti L, Alvarado P, Rojas T, Martensson A. Tomato seedling development is improved by a substrate inoculated with a combination of rhizobacteria and fungi. Acta Agric Scand Sect B Soil Plant Sci. 2015;65:170-6. [ Links ]
10. Castillo CR, SotomayorSL, Ortiz CO, Leonelli CG, Borie BF, Rubio HRR. Effect of arbuscular mycorrhizal fungi on an ecological crop of chili peppers (Capsicum annuum L.). Chil J Agric Res. 2009;69:79-87. [ Links ]
11. Dabrowska G, Baum C, Trejgell A, Hrynkiewicz K. Impact of arbuscular mycorrhizal fungi o the growth and expression of gene encoding stress protein-metallothionein BnMT2 in the non-host crop Brassica napus L. J Plant Nutr Soil Sci. 2014;177:459-67. [ Links ]
12. Dell'Amico E, Cavalca L, Andreoni V. Improvement of Brassica napus growth under cadmium stress by cadmium-resistant rhizobacteria. Soil Biol Biochem. 2008;40:74-84. [ Links ]
13. Diaz RJ, Rosenberg R. Spreading dead zones and consequences for marine ecosystems. Science. 2008;321:926-9. [ Links ]
14. Díaz VP, Ferrera-Cerrato R, Almaraz-Suárez JJ, Alcanzar GG. Inoculación de bacterias de crecimiento en lechuga. Terra Lati-noam. 2001;19:327-35. [ Links ]
15. Egamberdiyeva D. The effect of plant growth promoting bacteria on growth and nutrient uptake of maize in two different soils. Appl Soil Ecol. 2007;36:184-9. [ Links ]
16. Elhindi KM, El-Din AS, Elgorband AM. The impact of arbuscular mycorrhizal fungi in mitigating salt-induced adverse effects in sweet basil (Ocimum basilicum L.). Saudi J Biol Sci. 2017;24:170-9, http://dx.doi.org/10.10167j.sjbs.2016.02.010. [ Links ]
17. FAOSTAT. 2013. Food and Agriculture Organization of the United Nations Statistics Division [On line] [consultado 21 Sept 2015]. Disponible en: http://faostat3.fao.org/browse/Q/QC/S. [ Links ]
18. Flores P, Fenoll J, Hellin P. Aparicio-Tejo P. Isotopic evidence of significant assimilation of atmospheric-derived nitrogen fixed by Azospirillum brasilense co-inoculated with phosphate-solubilising Pantoea dispersa in pepper seedling. Appl Soil Ecol. 2010;46:335-40. [ Links ]
19. Galloway JN, Townsend AR, Erisman JW, Bekunda M, Cai Z, Freney JR, Sutton M. Transformation of the nitrogen cycle: Recent trends, questions, and potential solutions. Science. 2008;320:889-92. [ Links ]
20. Garg N, Chandel S. Arbuscular mycorrhizal networks: Process and functions. A review. Agron Sustain Dev. 2010;30:581-99. [ Links ]
21. Glick BR. Plant growth-promoting bacteria: Mechanisms and applications. Scientifica. 2012;2012:1-15. [ Links ]
22. Goicoechea N, Baslam M, Erice G, Irigoyen JJ. Increased photosynthetic acclimation in alfalfa associated wit arbuscular mycorrhizal fungi (AMF) and cultivated in greenhouse under elevated CO2. J Plant Physiol. 2014;171:1774-81. [ Links ]
23. Gomiero T, Pimentel D, Paoletti MG. Environmental impact of different agricultural management practices: conventional vs. organic agriculture. Crit Rev Plant Sci. 2011;30:95-124. [ Links ]
24. Govindasamy V, SenthilkumarM. Bacillus and Paenibacillus spp: Potential PGPR for sustainable agriculture. In: Maheshwari DK, (ed.). Plant growth and health promoting bacteria. Berlin, Heidelberg: Springer Berlin Heidelberg; 2011. p. 333-64. [ Links ]
25. Gyaneshwar P Kumar GN, Parekh LJ, Poole PS. Role of soil microorganisms in improving P nutrition of plants. Plant Soil. 2002;245:83-93. [ Links ]
26. Hartmann M, Frey B, Mayer J, Mader P Widmer F. Distinct soil microbial diversity under long-term organic and conventional farming. ISME J. 2015;9:77-94. [ Links ]
27. Herman MAB, Nault BA, Smart CD. Effects of plant growth-promoting rhizobacteria on bell pepper production and green peach aphid infestations in New York. Crop Prot. 2008;27:996-1002. [ Links ]
28. Hess JL, Shiffler AK, Jolley VD. Survey of mycorrhizal colonization in native, open-pollinated, and introduced hybrid maize in villages of Chiquimula, Guatemala. J Plant Nutr. 2005;28:1843-52. [ Links ]
29. Hoben JP, Gehl RJ, Millar N, Grace PR, Robertson GP. Nonlinear nitrous oxide (N2O) response to nitrogen fertilizer in on-farm corn crops of the US Midwest. Glob Chang Biol. 2011;17:1140-52. [ Links ]
30. Huang X, Zhang N, Yong X, Yang X, Shen Q. Biocontrol of Rhizoctonia solani damping-off disease in cucumber with Bacillus pumilus SQR-N43. Microbiol Res. 2012;167:135-43. [ Links ]
31. Kang SH, Cho HS, Cheong H, Ryu CM, Kim JF, Park SH. Two bacterial entophytes eliciting both plant growth promotion and plant defense on pepper (Capsicum annuum L.). J Microbiol Biotech-nol. 2007;17:96-103. [ Links ]
32. Kaya C, Ashraf M, Sonmez O, Aydemir S, Tuna AL, Cullu MA. The influence of arbuscular mycorrhizal colonisation on key growth parameters and fruit yield of pepper plants grown at high salinity. Sci Hortic. 2009;121:1-6. [ Links ]
33. Kloepper JW, Gutierrez-Estrada A, Mclnroy JA. Photoperiod regulates elicitation of growth promotion but not induced resistance by plant growth-promoting rhizobacteria. Can J Microbiol. 2007;53:159-67. [ Links ]
34. Kumar A, Prakash A, Johri BN. Bacillus as PGPR in cro ecosystem. In: Maheshwari DK, (ed.). Bacteria in agrobiology crop ecosystems. Berlin Heidelberg: Springer-Verlag; 2011. p. 37-59. [ Links ]
35. Lehmann A, Rillig MC. Arbuscular mycorrhizal contribution to copper, manganese and iron nutrient concentrations in crops -A meta-analysis. Soil Biol Biochem. 2015;81:147-58. [ Links ]
36. Marques APGC, Oliveira RS, Rangel AOSS Castro PML. Zinc accumulation in Solanum nigrum is enhanced by different arbuscular mycorrhizal fungi. Chemosphere. 2006;65:1256-63. [ Links ]
37. Mohamed AA, Eweda WEE, Heggo AM, Hassan EA. Effect of dual inoculation with arbuscular mycorrhizal fungi and sulphur-oxidising bacteria on onion (Allium cepa L.) and maize (Zea mays L) grown in sandy soil under greenhouse conditions. Ann Agric Sci. 2014;59:109-18. [ Links ]
38. Moreno SG, Vela HP, ÁlvarezMOS. La fluorescencia de la clorofila a como herramienta en la investigación de efectos tóxicos en el aparato fotosintético de plantas y algas. REB. 2008;27:119-29. [ Links ]
39. Nakano H, Makino A, Mae T. The effect of elevated partial pressures of CO2, on the relationship between photosynthetic capacity and N content in rice leaves. Plant Physiol. 1997;115:191-8. [ Links ]
40. Nandjui J, Rosin D, Voko R, Kouadio ANM, Fotso B, Tano Y, Zeze A. Assessment of the occurrence and abundance of mycorrhizal fungal communities in soils from yam (Dioscorea spp.) cropping fields in Dabakala, North Cote d'Ivoire. Afr J Agric Res. 2013;8:5572-84. [ Links ]
41. Noori SMS, Saud MH. Potential plant growth-promoting activity of Pseudomonas sp. isolated from paddy soil in Malaysia as biocontrol agent. J Plant Pathol Microb. 2012;3:2 -5. [ Links ]
42. Oliveira RS, Boyer LR, Carvalho MF, Jeffries P, Vosátka M, Castro PML, Dodd JC. Genetic, phenotypic and functional variation within a Glomus geosporum isolate cultivated with or without the stress of a highly alkaline anthropogenic sediment. Appl Soil Ecol. 2010;45:39-48. [ Links ]
43. Ortas I. Effect of selected mycorrhizal inoculation on phosphorus sustainability in sterile and non-sterile soils in the Harran Plain in South Anatolia J Plant Nutr. 2003;26:1-17. [ Links ]
44. Padmavathi T, Dikshit R, Seshagiri S. Effect of Rhizophagus spp. and plant growth-promoting Acinetobacter junii on Solanum lycopersicum and Capsicum annuum. Rev Bras Bot. 2015;38:273-80. [ Links ]
45. Phillips JM, Hayman DS. Improved procedures fir clearing and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. British Mycological Society. 1970;55:158-61. [ Links ]
46. Pineda-Mendoza DY. Potencial de tres cepas de rizobacterias como antagonistas de Rhizoctonia solani en chile serrano (Capsicum annuum L.). Tesis de maestría en edafología. Colegio de Posgraduados, Área de Microbiología; 2015. Montecillo, Estado de México. México. [ Links ]
47. Ramírez J. El chile. CONABIO. Biodiversitas. 1996;8:8-14. [ Links ]
48. Rouphael Y, Cardarelli M, Colla G. Role of arbuscular mycorrhizal fungi in alleviating the adverse effects of acidity and aluminum toxicity in Zucchini squash. Sci Hortic. 2015;188:97-105. [ Links ]
49. Rueda-Puente EO, Murillo-Amador B, Castellanos-Cervantes T, García-Hernández JL, Tarazón-Herrera MA, Moreno Medina S, Gerlach-Barrera LE. Effects of plant growth promoting bacteria and mycorrhizal on Capsicum annuum L. var. aviculare ([Dierbach] D'Arcy and Eshbaugh) germination under stressing abiotic conditions. Plant Physiol Biochem. 2010;48:724-30. [ Links ]
50. Russo VM, Perkins-Veazie P. Yield and nutrient content of bell pepper pods from plants developed from seedlings inoculated, or not, with microorganisms. Hort Science. 2010;45:352-8. [ Links ]
51. Salazar-Jara FI, Juárez-López P. Requerimiento macronutrimen-tal en plantas de chile (Capsicum annuum L.). Revista Bio Ciencias. 2013;2:27-34. [ Links ]
52. SAS Institute Inc. The SAS system for windows version 9.0. North Carolina: SAS Institute Inc. Cary; 2002. [ Links ]
53. Sensoy S, Demir S, Turkmen O, Erdinc C, Savur OB. Responses of some different pepper (Capsicum annuum L.) genotypes to inoculation with two different arbuscular mycorrhizal fungi. Sci Hortic. 2007;113:92-5. [ Links ]
54. Smith SE, Smith FA. Fresh perspectives on the roles of arbuscula mycorrhizal fungi in plant nutrition and growth. Mycologia. 2012;104:1-13. [ Links ]
55. Smith SE, ManjarrezM, Stonor R, McNeill A, Smith FA. Indigenous arbuscula mycorrhizal (AM) fungi contribute to wheat phosphate uptake in a semi-arid field environment, shown by tracking with radioactive phosphorus. Appl Soil Ecol. 2015;96:68-74. [ Links ]
56. Son JS, Sumayo M, Hwang YJ, Kim BS, Ghim SY. Screening of plant growth-promoting rhizobacteria as elicitor of systemic resistance against gray leaf spot disease in pepper. Appl Soil Ecol. 2014;73:1-8. [ Links ]
57. Soti PG, Jayachandran K, Koptur S, Volin JC. Effect of soil pH on growth, nutrient uptake, and mycorrhizal colonization in exotic invasive Lygodium microphyllum. Plant Ecol. 2015;216: 989-98. [ Links ]
58. Strasser RJ, Tsimilli-Michael M, Srivastava A. Analysis of the chlorophyll a fluorescence transient. In: Papageorgiou GC, Govindjee, (eds.). Chlorophyll a fluorescence: A signature of photosynthesis, advances in photosynthesis and respiration series. Rotterdam: Kluwer Academic; 2004. p. 321-62. [ Links ]
59. Swain MR, Naskar SK, Ray RC. Indole-3-acetic acid production and effect on sprouting of yam (Dioscorea rotunata L.) minisetts by Bacillus subtilis isolated from culturable cowdung microflora. Pol J Microbiol. 2007;56:103-10. [ Links ]
60. Villarreal-Romero M, Hernández-Verdugo S, Sánchez-Peña P, García-Estrada RS, Osuna-Enciso T, Parra-Terrazas SADA. Efecto de cobertura del suelo con leguminosas en rendimiento y calidad del tomate. Terra Latinoam. 2006;24:549-56. [ Links ]
61. Viruel E, Lucca ME, Siñeriz F. Plant growth promotion traits of phosphobacteria isolated from Puna, Argentina. Arch Microbiol. 2011;193:489-96. [ Links ]
62. Xun F, Xie B, Liu S, Guo C. Effect of plant growth-promoting bacteria (PGPR) and arbuscular mycorrhizal fungi (AMF) inoculation on oats in saline-alkali soil contaminated by petroleum to enhance phytoremediation. Environ Sci Pollut R. 2015;22:598-608. [ Links ]
63. Zhang M, Tang S, Huang X, Zhang F, Pang Y, Huang Q, Yi Q. Selenium uptake, dynamic changes in selenium content and its influence on photosynthesis and chlorophyll fluorescence in rice (Oryza sativa L.). Environ Exp Bot. 2014;107:39-45. [ Links ]
64. Zhao R, Guo W, Bi N, Guo J, Wang L, Zhao J, Zhang J. Arbuscular mycorrhizal fungi affect the growth, nutrient uptake and water status of maize (Zea mays L.) grown in two types of coal mine spoils under drought stress. Appl Soil Ecol. 2015;88: 41 -9. [ Links ]
65. Zubek S, Turnau K, Tsimilli-Michael M, Strasser RJ. Response of endangered plant species to inoculation with arbuscular mycorrhizal fungi and soil bacteria. Mycorrhiza. 2009;19:113-23. [ Links ]














