Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista argentina de microbiología
Print version ISSN 0325-7541On-line version ISSN 1851-7617
Rev. argent. microbiol. vol.50 no.3 Ciudad Autónoma de Buenos Aires Sept. 2018
http://dx.doi.org/10.1016/j.ram.2017.07.007
ORIGINAL
https://doi.org/10.1016/j.ram.2017.07.007
Dinámica de la diversidad temporal de los hongos micorrícicos arbusculares de Larrea tridentata (Sesse & Mocino ex DC) Coville en un ecosistema semiárido
Temporal diversity dynamics of the arbuscular mycorrhizal fungi of Larrea tridentata (Sesse & Mocino ex DC) Coville in a semi-arid ecosystem
Genoveva Hernández-Zamudioa, Jorge Sáenz-Matab,*, Alejandro Moreno-Reséndezc, Gamaliel Castañeda-Gaytánb, Alfredo Ogazc, Santos Carballar-Hernándezd y Laura Hernández-Cuevase
a Departamento de Agroecología de la Coordinación de Carreras Agronómicas, Universidad Autónoma Agraria Antonio Narro, Unidad Laguna, Torreón, Coahuila, México
b Facultad de Ciencias Biológicas, Universidad Juárez del Estado de Durango, Gómez Palacio, Durango, México
c Departamento de Suelos de la Coordinación de Carreras Agronómicas, Universidad Autónoma Agraria Antonio Narro, Unidad Laguna, Torreón, Coahuila, México
d Área de Microbiología, Posgrado de Edafología, Colegio de Posgraduados-Montecillo, Montecillo, Estado de México, México
e Centro de Investigación en Genética y Ambiente, Posgrado en Ciencias Biológicas, Universidad Autónoma de Tlaxcala, Tlaxcala, México
Recibido el 18 de enero de 2017; aceptado el 21 de julio de 2017
Disponible en Internet el 7 de diciembre de 2017
*Autor para correspondencia.
Correo electrónico: jsaenz_mata@ujed.mx (J. Sáenz-Mata).
0325-7541/© 2017 Asociación Argentina de Microbiología. Publicado por Elsevier España, S.L.U. Este es un artículo Open Access bajo la licencia CC BY-NC-ND (http://creativecommons.org/licenses/by-nc-nd/4.0/).
Resumen
Los hongos micorrícicos arbusculares (HMA) de los ambientes áridos y semiáridos son importantes para el desarrollo de las plantas que crecen bajo estrés biótico y abiótico en áreas naturales o en agroecosistemas. Existe poca información sobre la diversidad temporal de los HMA en plantas perennes de ecosistemas áridos en el norte de México. En este estudiose evaluaron la colonización micorrícica y la diversidad temporal de los HMA en la rizosfera de Larrea tridentata, planta perenne de amplia distribución en el Desierto Chihuahuense. Se obtuvieron muestras de la rizosfera y de raíces de 15 plantas, en 3 fechas de muestreo del año 2015. Se encontró un total de 17 especies de HMA, distribuidas en 12 géneros y 7 familias dentro del phylum Glomeromycota. La especie más abundante fue Funneliformis geosporum.
Esta especie pertenece a la familia Glomeraceae, la única que estuvo representada con varios géneros en L. tridentata. El mayor porcentaje de micorrización se presentó en febrero, con un 83,22%, en septiembre fue del 75,27% y en mayo del 65,27%. El muestreo realizado en febrero presentó el mayor número de especies (16), seguido por el de mayo (15) y el de septiembre (12). El análisis estadístico mostró diferencias significativas en el número de esporas entre los muestreos de febrero y los de mayo y septiembre.
PALABRAS CLAVE
Glomeromycota; Desierto Chihuahuense; Colonización micorrícica; Comunidad de HMA; Larrea tridentata; Parámetros ecológicos
Abstract
Arbuscular mycorrhizal fungi (AMF) of arid and semiarid ecosystems are important for the development of plants that grow under biotic stress in wild or in agro-ecosystems. There is little information on the temporal diversity of these organisms in perennial plants from arid ecosystems in northern Mexico. On this study, the mycorrhizal colonization and the temporal diversity of AMF in the rhizosphere of Larrea tridentata, perennial plant abundant in the Chihuahuan Desert region were explored. Samples of the rhizosphere and roots of fifteen plants in each of the three sampling dates during the 2015 year were obtained. A total of 17 species of HMA belonging to 12 genera and 7 families within the phylum Glomeromycota in all three sampling dates were found. Funneliformis geosporum was the dominant species belonging to the family Glomeraceae which possess the highest genera number on L. tridentata.The highest mycorrhization percentage was in February with 83.22, followed by September and May with 75.27 and 65.27%, respectively. A maximum of 16 AM fungal species were isolated and identified from L. tridentata rhizosphere in February, 15 species in May and 12 species in September. Statistical analysis showed significant differences between sampling dates in the spores number.
KEYWORDS
Glomeromycota; Chihuahuan Desert; Mycorrhizal colonization; AMF community; Larrea tridentata; Ecological parameters
Introducción
Los hongos micorrícicos arbusculares (HMA) pertenecen al phylum Glomeromycota39. Son simbiontes obligados que forman una asociación mutualista con las raíces de más del 80% de las plantas terrestres41. Estos organismos proporcionan a las plantas mayor acceso a los nutrientes minerales del suelo, en especial al fósforo y al nitrógeno9,29,41. Además de aumentar la superficie de absorción del agua48, mejoran la resistencia al estrés biótico45 y abiótico20, sobre todo en ecosistemas áridos y semiáridos1.
Como grupo funcional, estos hongos muestran poca o ninguna especificidad respecto de sus plantas hospedantes47. Estas asociaciones plantas-HMA forman comunidades que presentan cambios a través del espacio y del tiempo, que pueden estar determinados por distintos factores en los ecosistemas40. El estudio de la diversidad de los HMA en las comunidades rizosféricas es importante debido a que estos influyen en gran medida en la dinámica de los ecosistemas, ya que promueven la diversidad de las plantas y el mantenimiento de la productividad23. Las especies de HMA varían en su potencial para promover el crecimiento de las plantas y su adaptación a los factores bióticos y abióticos24.
Se han realizado trabajos en los que se analiza la dinámica temporal de los HMA en ecosistemas áridos. Sanchez-Castro et al.34 mostraron la existencia de diferencias intraanuales moderadas pero significativas en la composición de especies en las comunidades de los HMA que colonizan plantas de Rosmarinus officinalis y Timo zygis en un ecosistema mediterráneo semiárido del sureste de España. Carballar-Hernández et al.8 reportaron cambios de la diversidad de HMA en la rizosfera de Agave potatorum a lo largo de las distintas estaciones del año en un ecosistema semiárido en el estado de Oaxaca, México.
Debido a que no existe información sobre la distribución, la abundancia y la dinámica temporal de las comunidades de los HMA en ambientes áridos y semiáridos del Desierto Chihuahuense, en el norte de la República Mexicana, el objetivo de este estudio fue evaluar la variación temporal de la diversidad y el grado de colonización micorrícica en las raíces de Larrea tridentata (Sesse & Mocino ex DC) Coville.
L. tridentata es un arbusto de la familia Zygophyllaceae que predomina en las zonas de desierto del norte de México, en los estados de San Luis Potosí, Coahuila, Chihuahua, Durango, Sonora, Zacatecas, Baja California Norte y Baja California Sur, y también en el suroeste de los Estados Unidos, en Arizona, California, Nevada, Texas y Nuevo México33, donde forma islas de fertilidad que influyen en la abundancia y distribución de plantas anuales nativas y no nativas dentro de estos ecosistemas35.
Materiales y métodos
Sitio de muestreo
El estudio se realizó en la Reserva Ecológica Municipal Sierra y Cañón de Jimulco (REM-SCJ), ubicada dentro del Municipio de Torreón, en la parte suroeste del estado de Coahuila de Zaragoza, entre los paralelos 24°56'18" y 25°17' 52" de latitud norte y los meridianos 103° 30'34" y 103°05'15" de longitud oeste, en el centro del Desierto Chihuahuense19 (fig. 1). El clima en la zona es de 2 tipos principales: seco o estepario (BSo) y muy seco o desértico (BW). Este último es el que domina dentro de la reserva, ocupando el 56,63% de su superficie; se localiza sobre sierras, valles, bajadas y llanuras. El clima de tipo seco o estepario cubre la superficie restante (43,37%) y se localiza sobre todo en la parte central de la reserva, distribuido principalmente sobre sierras en una franja horizontal de este a oeste5. El tipo de vegetación presente en el área corresponde a un matorral semidesértico xerófilo, dominado en este caso por L. tridentata. Las asociaciones vegetales incluyen la presencia de especies como Fouqueria splendens, Jatropha dioica, Prosopis glandulosa, Acacia berlandieri, Lippia graveolens, Euphorbia antisyphilitica, Yucca carnerosana y Agave lecheguilla, entre otras33.
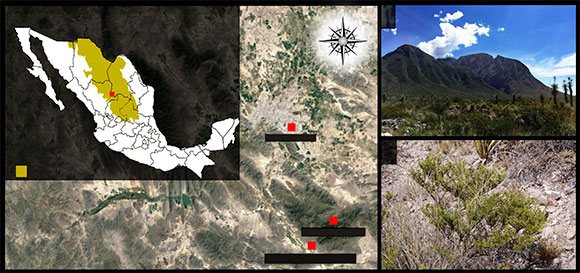
Figura 1 Área de muestreo Reserva Ecológica Municipal Sierra y Cañón de Jimulco (REM-SCJ). A) Ubicada en la parte suroeste del estado de Coahuila de Zaragoza, México. B) Fotografías del área de muestreo. C) Larrea tridentata del área muestreada.
Muestreos
Se seleccionaron al azar 15 individuos de L. tridentata de tamaño semejante, separados de otras plantas para asegurar que la rizobiota proviniera del suelo circundante a esos ejemplares. Se recolectaron raíces y suelo a una profundidad de entre 2 y 15 cm. Los muestreos se realizaron en 3 meses distintos del 2015: febrero, mayo (temporada de sequía) y septiembre (temporada de lluvias). Es importante resaltar que de acuerdo con los registros del Servicio Meteorológico Nacional, en el mes de febrero de ese año se presentaron lluvias atípicas en el área de muestreo.
El suelo se pasó por un tamiz de 2 mm de malla y se secó a temperatura ambiente durante 72 h, para luego almacenarse en bolsas de polietileno y refrigerarse a 4 °c hasta su procesamiento. Además, se tomaron 3 muestras de 1000 g de suelo para el análisis físico y químico.
Análisis físico y químico del suelo
La textura se determinó por el método del hidrómetro de Bouyoucos y el pH con un medidor de electrodo de vidrio en una relación de suelo-agua 1-2,5 (p/v). El porcentaje de carbono total y la materia orgánica se determinó por el método de oxidación húmeda de Walkley y Black46, mientras que el porcentaje total de nitrógeno se midió por el método de micro-Kjeldahl. El fósforo disponible se ensayó por el método de Bray y Kurtz6.
Análisis del porcentaje de micorrización
Las raíces frescas se lavaron con agua corriente para eliminar cualquier residuo de suelo. Luego fueron clareadas usando KOH al 10% y teñidas con azul de tripano. Se examinaron 10 segmentos de aproximadamente 1 cm de largo. Para realizar la evaluación de las estructuras morfológicas características de los HMA, se realizaron observaciones en el microscopio óptico a través del objetivo de 40× empleando el método de Phillips y Hayman31. Para ello se efectuaron 3 pasajes equidistantes por laminilla. Al revisar un campo óptico, se le otorgó el valor de 1 para la evaluación total toda vez que se encontró alguna estructura de los HMA (hifas, vesículas o arbúsculos), independientemente de la intensidad de micorrización7.
Determinación del número de esporas y morfo-especies de HMA
Se extrajeron las esporas de HMA de 50 g de suelo seco de la rizosfera de cada planta muestreada. Para ello se utilizó el método de tamizado en húmedo y decantación, seguido por centrifugación en gradiente de sacarosa al 20 y 60%18. Las esporas sanas se colocaron en una placa de Petri para la observación directa bajo un microscopio estereoscópico (40×), en donde se separaron sobre la base de sus características morfológicas; posteriormente, se determinó el número de esporas. Para la identificación, cada tipo de esporas se montó en alcohol polivinílico, ácido láctico y glicerol (PVLG)25 y reactivo de Melzer7 en proporción 1: 1 (v/v). La identificación de las especies de HMA se realizó con base en las características morfológicas de las esporas, como describen Schenck y Perez36. Las características observadas se registraron, compararon y contrastaron con las que aparecen en las descripciones disponibles en los sitios web de la Colección Internacional de Cultivos de HMVA (http://invam.wvu.edu/) y en la Colección de Glomeromycota del Profesor Janusz Blaszkowski, taxónomo de Glomeromycota del Departamento de Patología de Plantas de la Universidad de Agronomía de Szczecin, Polonia (http://www.zor.zut.edu.pl/Glomeromycota/Taxonomy.html).
Para la designación de las especies se usó la nomenclatura de Glomeromycota propuesta por Schübler et al.38 y Schübler y Walker39, disponible en la página web Phylogeny and taxonomy of Glomeromycota (arbuscular mycorrhizal [AM] and related fungi [http://www.amf-phylogeny.com/]). Las esporas se analizaron bajo microscopio óptico (40× y 100×) con contraste de interferencia de Nomarski; las dimensiones se obtuvieron con una reglilla micrométrica acoplada al ocular (Nikon Optiphot II, Nikon, Tokio, Japón).
Análisis ecológico
Los parámetros ecológicos se determinaron para cada una de las fechas de muestreo y también como un resultado global. Los parámetros describen la estructura de las comunidades de los HMA comprendiendo la riqueza de especies, la abundancia de esporas, la frecuencia de aislamiento15, la abundancia relativa y los índices de equidad y dominancia, además de la biodiversidad entre las fechas de muestreo27.
La riqueza es el número total de especies identificadas (S). La abundancia es el número total de esporas (n E) de las especies de los HMA encontradas en 50 g de suelo rizosférico. La frecuencia de aislamiento (Fi) de cada especie i en cada una de las fechas de muestreo se calculó de acuerdo con la siguiente ecuación:
Fi = Ji/K,
donde Ji es el número de muestras en las que se presentó la especie i y K es el número total de muestras15.
La abundancia relativa (pi) es el número de esporas de cada una de las morfoespecies dividido entre el total de esporas y multiplicado por 100; este parámetro indica la capacidad de esporulación de cada una de las especies de los HMA27.
La diversidad se calculó por el índice de Shannon-Wiener que expresa la uniformidad de los valores de importancia a través de todas las especies de la muestra. Se calculó de acuerdo con Magurran27 aplicando la siguiente fórmula:
Hí = Σpiln pi,
donde pi es la abundancia relativa de cada especie identificada, y se calcula por la siguiente fórmula: pi= ni/N, donde ni es el número de esporas de una especie y N es el número total de esporas en todas las muestras.
El índice de Pielou mide la proporción de la diversidad observada en cada fecha de muestreo con relación a la máxima diversidad esperada. Su valor va de 0 a 1, de tal forma que 1 corresponde a situaciones donde todas las especies son igualmente abundantes y viene dada por:
J‘=H’/H’máx,
donde H’máx es el valor máximo de H, se estima por: H’máx = Ln(S)27.
El índice de dominancia de Simpson manifiesta la probabilidad de que 2 individuos tomados al azar de una muestra sean de la misma especie y se calcula mediante la siguiente fórmula:
Λ= Σpi2
El índice de Sorensen fue usado para determinar la similitud entre las composiciones de las comunidades de los HMA de las 3 fechas de muestreo (diversidad beta), el índice cualitativo de Sorensen se calculó mediante la siguiente fórmula:
Is = 2C/A+ B,
donde A y B son el número de especies en las muestras A y B, respectivamente, y C es el número de especies compartidas por las 2 muestras. El índice de Sorensen cuantitativo se calculó por medio de:
IScuant=2pN/aN + bN,
donde aN y bN son el número total de esporas en las muestras A y B, respectivamente, y pN es la sumatoria de la abundancia más baja de cada una de las especies compartidas por las 2 muestras27.
Evaluación del esfuerzo de muestreo
La evaluación del esfuerzo de muestreo y la comparación de la riqueza entre fechas de muestreo se efectuaron mediante el uso de modelos ajustados a curvas de acumulación de especies; se utilizaron los estimadores de diversidad no paramétricos Chao2 y Jackknife de primer orden27, cuyo objetivo es conocer el total de especies de una comunidad, mostrando el número de especies acumuladas conforme se aumenta el esfuerzo de muestreo, hasta un máximo donde no se registran nuevas especies (asíntota). La expresión matemática del modelo de Chao2 es la siguiente:
Chao2 = Sobs + (L2/2M),
donde Sobs es el número de especies conocidas; L = número de especies que ocurren solo en una muestra (singletons: especies con un individuo); y M = número de especies que ocurren exactamente en 2 muestras (doubletons: especies que cuentan con 2 individuos).
La expresión matemática del modelo de Jackknife es:
Jack 1 = Sobs + L (m − 1/m),
donde m = número de muestras. Para el cálculo de la riqueza y abundancia de especies se usó el modelo de MaoTau y en la construcción de la curva de acumulación se usó el programa EstimateS 8.2. Las gráficas se editaron con líneas suavizadas para una mejor representación13.
Análisis estadístico
Los análisis de varianza (ANOVA) y la prueba de comparación de medias por el método de Tukey al 0,05 de probabilidad de error se utilizaron para examinar la relación entre el número de especies, el número de esporas, las características físicas y químicas del suelo de las comunidades de los HMA. Todos los análisis se realizaron utilizando el software estadístico SPSS versión 17.0 para Windows42.
Resultados y discusión
Análisis físicos y químicos del suelo
La mayoría de los parámetros físicos y químicos de los suelos estudiados no presentaron diferencias significativas (p <0,05) entre las 3 fechas de muestreo (Tabla 1). Los suelos son suelos calcáreos, medianamente alcalinos, no salinos y no sódicos. Los niveles de nitratos fueron bajos y los de fósforo medios. Solo es significativa la diferencia en el nivel de nitratos del muestreo realizado en septiembre, que tuvo un incremento del 92,14% con respecto al contenido de febrero
Diferentes letras indican diferencias estadística significativas (p<0,05).
MO: materia orgánica; N-NO3: nitrógeno como nitratos; P: fósforo; CaCO3: carbonatos totales.
y del 55,58% en comparación con el de mayo (Tabla 1). Al respecto, Zheng et al.50 reportaron que no existe gran influencia del nitrógeno sobre la diversidad de las comunidades de HMA.
Tabla 1 Caracterización física y química del suelo rizosférico de Larrea tridentata

Riqueza y composición de especies
De las 17 morfoespecies aisladas, 15 fueron identificadas a nivel de especie y 2 a nivel de género (Tabla 2). Se encontró que estas pertenecían a 7 familias (Acaulosporaceae, Ambisporaceae, Diversisporaceae, Entrophosporaceae, Gigasporaceae, Claroideoglomeraceae y Glomeraceae). Los géneros encontrados fueron Funneliformis, Glomus, Dominikia, Septoglomus, Ambispora, Claroideoglomus, Acaulospora, Diversispora, Entrophospora, Rizophagus, Sclerocystis y Scutellospora. La mayor riqueza específica de HMA se obtuvo en febrero (16 especies); en mayo se encontraron 15 especies y en septiembre 12 especies. La familia Glomeraceae fue la mejor representada con 9 especies que constituyeron el 52,94% del total, seguida por Ambisporaceae y Claroideoglomeraceae, con 11,76% cada una.
Tabla 2 Especies de HMA identificadas en suelo rizosférico de Larrea tridentata
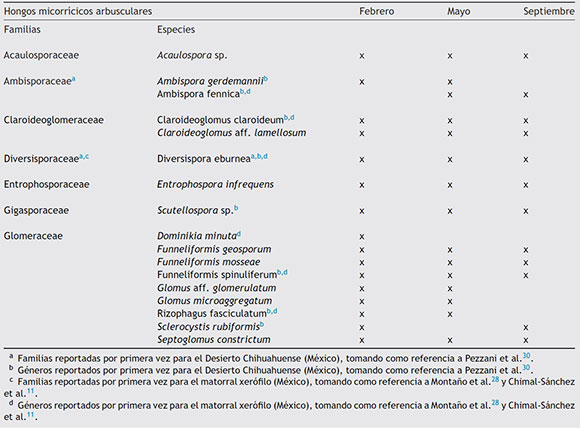
La presencia predominante de la familia Glomeraceae hallada en este estudio coincide con lo observado por de Souza et al.16 en Brasil para Mimosa tenuiflora, una fabácea de ecosistemas semiáridos; también con los resultados obtenidos por Carballar-Hernández et al.8 para A. potatorum en ecosistemas semiáridos del estado de Oaxaca, México y con los de Bai et al.4, quienes encontraron una diversidad de 13 especies, la mayoría de ellas de la familia Glomeraceae, en un estudio de la influencia del pastoreo en plantas del desierto.
Asimismo, estos hallazgos concuerdan con los de Chaudhary et al.10, quienes reportaron 42 especies de HMA en plantas del género Artemisia-familia Asteraceae- en el sur de Utah (EE. UU.); el 50% de aquellas eran miembros de la familia Glomeraceae. Estos autores propusieron que los ecosistemas áridos se caracterizan por presentar una alta diversidad de HMA, pero una baja biomasa fúngica.
En el presente estudio se reportan 2 nuevas familias (Ambisporaceae y Diversisporaceae) y 7 nuevos géneros (Ambispora, Claroideoglomus, Diversispora, Scutellospora, Funneliformis, Rizophagus y Sclerocystis) para el área del Desierto Chihuahuense, tomando como referencia lo reportado por Pezzani et al.30. Además se reportó una nueva familia (Diversisporaceae) y 5 nuevas especies (Ambispora fennica, Claroideoglomus claroideum, Diversispora eburnea, Dominikia minuta, Funneliformis spinuliferum y Rizophagus fasciculatum) para el tipo de vegetación de matorral xerófilo, tomando como referencia lo reportado por Montaño et al.28 y Chimal-Sánchez et al.11.
Abundancia de esporas de HMA
Se apreciaron diferencias significativas (p <0,05) en el número de esporas aisladas de la rizosfera de L. tridentata en el muestreo de febrero con respecto a los de mayo y septiembre (Tabla 3). El mayor número de esporas se aisló en febrero (859 esporas) y el menor en septiembre (221 esporas). Las especies con mayor abundancia de esporas en las 3 fechas de muestreo fueron Funneliformis geosporum y Acaulospora sp. A estas le siguieron en abundancia Claroideoglomus aff. lamellosum en febrero; C. claroideum en mayo y Septoglomus constrictum en septiembre. La especie más abundante en todas las fechas fue F. geosporum; esta especie además presentó diferencias significativas (p <0,05) al comparar fechas de muestreo: en febrero se contó un mayor número de esporas (264) en relación con mayo (113 esporas) y septiembre (81 esporas) (Tabla 3). Esta especie fue la de mayor abundancia relativa en todas las fechas de muestreo, con una frecuencia de aislamiento igual o mayor del 93,33%. Estos resultados coinciden con los encontrados por Carballar-Hernández et al.8 para A. potatorum en ecosistemas semiáridos del estado de Oaxaca, México.
Tabla 3 Variables de abundancia y riqueza de las morfoespecies de HMA presentes en Larrea tridentata
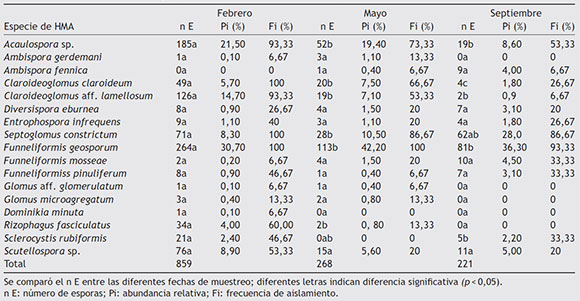
Lo anterior indica que F. geosporum es una especie de hongo que produce muchas esporas de manera sostenida, fenómeno que le permite tener una distribución temporal amplia dentro del ecosistema; esta esporulación constante puede explicarse por el hecho de que los miembros de la familia Glomeraceae colonizan con éxito raíces de nuevos hospedantes a partir de diferentes tipos de propágulos (esporas, fragmentos de raíz micorrizada y micelio externo)44, lo que les suministra recursos para la producción constante y cuantiosa de esporas. Adicionalmente, se ha reportado que esta especie de HMA se adapta fácilmente a diferentes condiciones ambientales y a sus cambios bruscos22.
Porcentaje de micorrización
El tipo de micorrización en L. tridentata es Arum debido a la presencia de arbúsculos17. El porcentaje de micorrización más alto se presentó en febrero con un 83,22% y el más bajo en mayo con un 65,48%. Estos resultados concuerdan con los obtenidos por Collier et al.12 para la misma especie en el norte del Desierto Chihuahuense, quienes hallaron un 72% de micorrización y con los obtenidos por Zhang et al.49, que fueron del 70% en plantas de Robinia pseudoacacia en zonas semiáridas. No obstante, difieren de los informados por Pezzani et al.30 en gramíneas del Desierto Chihuahuense, donde el mayor porcentaje de colonización micorrícica fue del 33%.
En el mismo sentido, fueron los resultados del trabajo realizado en L. tridentata durante un periodo de 2 años en el desierto de Mojave donde los valores máximos de colonización fueron del 30-40% después de la precipitación de verano y otoño, aunque se mantuvieron por debajo del 20% durante todo el resto del tiempo2.
Los resultados obtenidos en este estudio pueden explicarse por la disponibilidad de agua en la región durante el año de muestreo, ya que hubo una acumulación de 87,16 mm de lluvia en el mes de febrero, precipitación inusual para este ecosistema, que en promedio presenta 210 mm al año. Al respecto, se ha documentado que la colonización se incrementa durante la temporada de lluvias debido a que la humedad favorece la germinación de esporas de HMA y el crecimiento hifal21,32.
Parámetros ecológicos
La diversidad estimada a través del índice de ShannonWiener presentó un valor más alto para el muestreo de febrero con relación a los de mayo y septiembre (Tabla 4). Eso indica que la comunidad fue más diversa en ese momento del año. En septiembre, la comunidad de HMA presentó mayor equidad y baja dominancia. La dominancia (índice de Simpson) fue mayor en mayo, con 0,24, y menor en febrero, con 0,18 (Tabla 4); estos resultados coinciden con los reportados por Carballar-Hernández et al.8, quienes evaluaron la diversidad de HMA asociados a la rizosfera de A. potatorum en Oaxaca, México8.
Tabla 4 Parámetros ecológicos de las comunidades de HMA presentes en la rizosfera de Larrea tridentata
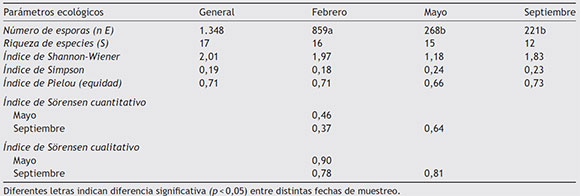
En cuanto a la equidad (índice de Pieluo), el muestreo de septiembre donde la comunidad de los HMA presentó un valor mayor. Estos resultados coinciden con los reportados por Carballar-Hernández et al.8. Aunque difieren de los reportados por Dandan y Zhiwei15 en una comunidad de HMA al sureste de China.
La evaluación de la diversidad beta por medio del índice Sorensen (Tabla 4) mostró que las comunidades de febrero y septiembre presentaron mayor diferencia en la composición de especies, mientras que las de mayo y septiembre presentaron mayor similitud entre sí. Estos resultados difieren de los obtenidos por Carballar-Hernández et al.8, los cuales reportaron mayor uniformidad entre las comunidades. Ya han sido documentados cambios en la diversidad de los HMA relacionados con factores espaciales y temporales3,15,40.
Curvas de acumulación de especies
Los valores de riqueza de HMA estimados por el método de Jackknife 1 revelaron que los muestreos no representaron adecuadamente la riqueza de los HMA, excepto los de septiembre. El modelo de Jackknife para la acumulación de especies de HMA mostró un aumento en el número de especies en los muestreos de febrero y mayo (fig. 2). Para el mes de febrero, con las 15 muestras de suelo rizosférico no se alcanzó la asíntota en la acumulación de especies, es decir, la riqueza de especies es mayor que lo encontrado. En contraste, el muestreo de mayo se estabilizó a partir de la muestra 13 y el de septiembre a partir de la muestra 9. El estimador Chao2 predijo 22 especies para el muestreo de febrero, 17 para el de mayo y 13 para el de septiembre. Estos modelos se han aplicado en algunos estudios de HMA sobre diversidad14,26,37,43.
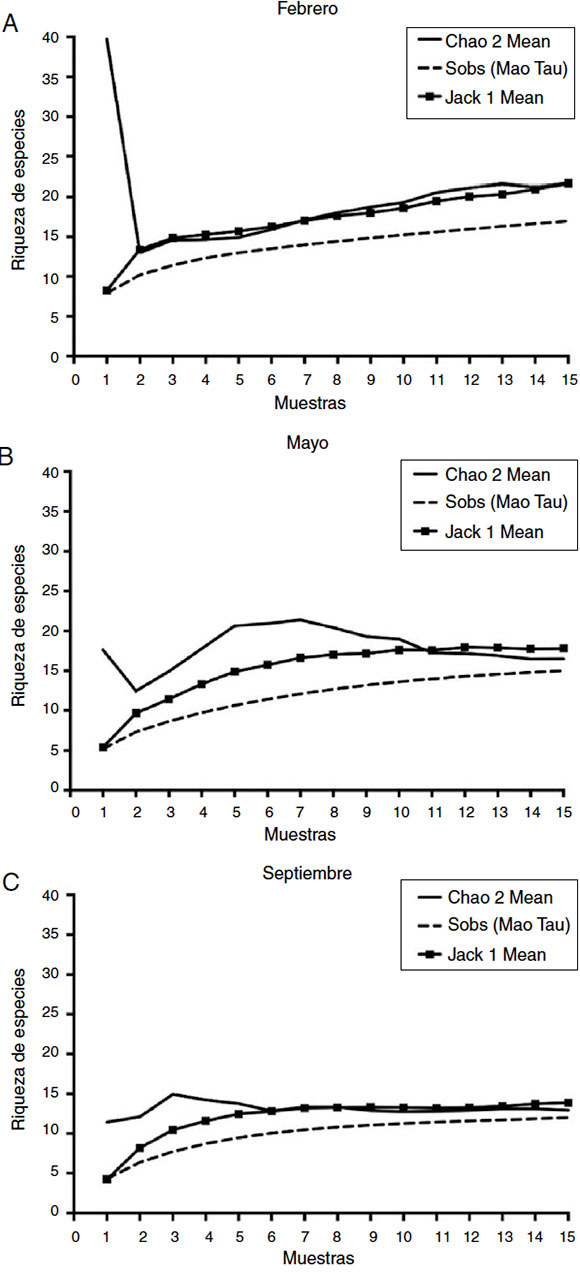
Figura 2 Curvas de acumulación de especies de HMA en L. tridentata. A) Muestreo de febrero. B) Muestreo de mayo. C) Muestreo de septiembre. Estimadores Jackknife 1, Sobs (Mao Tao) y Chao2.
Las curvas de acumulación de especies de HMA destacan la importancia de la toma de muestras en diferentes fechas e indican el potencial de encontrar especies raras con un mayor esfuerzo de muestreo y que, sumadas a aquellas que son comunes y a las que no son tan raras, integran los diferentes conjuntos de especies de las comunidades de HMA a lo largo del tiempo en ambientes particulares, en este caso, en ecosistemas semiáridos. La importancia de los ensamblajes de especies de HMA radica en que diferentes especies, además de cumplir distintas funciones, pueden ser más o menos eficaces, de manera que se complementan entre sí.
En conclusión, la riqueza específica y la abundancia de las especies de HMA varían a lo largo del año en la rizosfera de L. tridentata, lo que se traduce en un cambio en la diversidad. La mayor abundancia de especies de HMA de esporas pequeñas puede deberse a que estas tienen más probabilidad de sobrevivencia en ambientes áridos y semiáridos. Los altos porcentajes de micorrización en L. tridentata durante todo el año indican que dadas las condiciones de aridez, la micorrización es de gran importancia para la adaptación de esta planta a tales ambientes, lo que, aunado a la diversidad y abundancia de esporas encontradas en su rizosfera, refuerza la importancia de L. tridentata como isla de fertilidad para la preservación de los ecosistemas áridos y semiáridos.
Responsabilidades éticas
Protección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Al Biol. Ruben Palacio Rodriguez y Biol. Benjamin Nava Reyes, por la asistencia técnica brindada en campo. A la Ing. Karla Adriana Tungui Calderon por el apoyo en el aislamiento de esporas.
1. Allen MF. Mycorrhizal fungi: Highways for water and nutrients in arid soils. Vadose Zone J. 2007;6:291-7. [ Links ]
2. Apple ME, Thee CI, Smith-Longozo VL, Cogar CR, Wells CE, Nowak RS. Arbuscular mycorrhizal colonization of Larrea tridentata and Ambrosia dumosa roots varies with precipitation and season in the Mojave Desert. Symbiosis. 2005;39: 131-5. [ Links ]
3. Arias R, Heredia-Abarca G, Sosa V, Fuentes-Ramírez L. Diversity an abundance of arbuscular mycorrhizal fungi spores under different coffee production systems and in a tropical montane cloud forest patch in Veracruz Mexico. Agroforest Syst. 2012;85:179-93. [ Links ]
4. Bai G, Bao Y, Du G, Qi Y. Arbuscular mycorrhizal fungi associated with vegetation and soil parameters under rest grazing management in a desert steppe ecosystem. Mycorrhiza. 2013;23:289-301. [ Links ]
5. Blanco-Contreras E, Jimenez G, Hernandez-Zamudio G, Valencia M, Morales A, García R, Briones M, Orona A, Orona A, Borroel V, Quiroz F Rubio E, Pérez E. Plan de manejo de la Reserva Ecológica Municipal Sierra y Cañón de Jimulco (REM-SCJ). Torreón Coah. 2003. [ Links ]
6. Bray RH, Kurtz L. Determination of total, organic, and available forms of phosphorus in soils. Soil Sci. 1945;59:39-46. [ Links ]
7. Brundrett M, Bougher N, Dell B, Grove T, Malajczuk N. Working with mycorrhizas in forestry and agriculture. Canberra Australian Centre for International Agricultural Research; 1996. [ Links ]
8. Carballar-Hernández S, Palma-Cruz FJ, Hernández-Cuevas L, Robles C. Arbuscular mycorrhizal potential and mycorrhizal fungi diversity associated with Agave potatorum Zucc. in Oaxaca Mexico. Ecol Res. 2013;28:217-26. [ Links ]
9. Carreón-Abud Y, Soriano-Bello E, Martínez-Trujillo M. Role of arbuscular mycorrhizal fungi in the uptake of phosphorus by micropropagated blackberry (Rubus fruticosus var. brazos) plants. En: Velázquez E, Rodríguez-Barrueco C, editores. First International Meeting on Microbial Phosphate Solubilization. Netherlands: Springer; 2007. p. 161-9.
10. Chaudhary VB, O'Dell TE, RilligMC, Johnson NC. Multiscale patterns of arbuscular mycorrhizal fungal abundance and diversity in semiarid shrublands. Fungal Ecol. 2014;12:32-43. [ Links ]
11. Chimal-Sánchez E, García-Sánchez R, Hernández-Cuevas LV. Gran riqueza de hongos micorrizógenos arbusculares en el Valle del Mezquital, Hidalgo México. Rev Mex Micol. 2015;41: 14-26. [ Links ]
12. Collier SC, Yarnes CT, Peter Herman R. Mycorrhizal dependency of Chihuahuan Desert plants is influenced by life history strategy and root morphology. J Arid Environ. 2003;55:223-9. [ Links ]
13. Colwell RK, Mao CX, Chang J. Interpolating, extrapolating, and comparing incidence-based species accumulation curves. Ecology. 2004;85:2717-27. [ Links ]
14. Coutinho ES, Fernandes GW, Berbara RLL, Valério HM, Goto BT. Variation of arbuscular mycorrhizal fungal communities along an altitudinal gradient in rupestrian grasslands in Brazil. Mycorr-hiza. 2015;25:627-38. [ Links ]
15. Dandan Z, Zhiwei Z. Biodiversity of arbuscular mycorrhizal fungi in the hot-dry valley of the Jinsha River, southwest China Appl. Soil Ecol. 2007;37:118-28. [ Links ]
16. de Souza TA, Rodriguez-Echeverria S, de Andrade LA, Freitas H. Arbuscular mycorrhizal fungi in Mimosa tenuiflora (Willd.) Poirfrom Brazilian semi-arid. Braz J Microbiol. 2016;47: 359-66. [ Links ]
17. Dickson S, Smith FA, Smith SE. Structural differences in arbuscular mycorrhizal symbioses: More than 100 years after Gallaud, where next? Mycorrhiza. 2007;17:375-93. [ Links ]
18. Gerdemann JW, Nicolson TH. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. T Brit Mycol Soc. 1963;46:235-44. [ Links ]
19. Gobierno del Estado de Coahuila. Ordenamiento ecológico del territorio. Ayuntamiento Municipal de Torreón, 2002. [ Links ]
20. Guo X, Gong J. Differentia effects of abiotic factors and host plant traits on diversity and community composition of root-colonizing arbuscular mycorrhizal fungi in a salt-stressed ecosystem. Mycorrhiza. 2014;24:79-94. [ Links ]
21. He F, Tang M, Zhong SL, Yang R, Huang L, Zhang HQ. Effects of soil and climatic factors on arbuscular mycorrhizal fungi in rhi-zosphere soil under Robinia pseudoacacia in the Loess Plateau, China. Eur J Soil Sci. 2016;67:847-56. [ Links ]
22. He L, Yang H, Yu Z, Tang J, Xu L, Chen X. Arbuscular mycorr-hizal fungal phylogenetic groups differ in affecting host plants. Ecology. 2014;80:1142-9. [ Links ]
23. Hiiesalu I, Partel M, Davison J, Gerhold P Metsis M, Moora M, et al. Species richness of arbuscular mycorrhizal fungi: associations with grassland plant richness and biomass. New Phytol. 2014;203:233-44. [ Links ]
24. Jansa J, Smith FA, Smith SE. Are there benefits of simultaneous root colonization by different arbuscular mycorrhizal fungi? New Phytol. 2008;177:779-89. [ Links ]
25. Koske RE, Tessier B. A convenient, permanent slidemounting medium. Mycol Soc Am Newslett. 1983;34:1-59. [ Links ]
26. Lara-Pérez LA, Noa-Carrazana JC, Hernández-González S, Alarcón-Gutiérrez E, Sánchez-Velásquez LR, Zulueta-Rodríguez R, et al. Diversity and colonization of arbuscular mycorrhizal fungi in the tre fern Aísophiía firma in rainy and dry season. Symbiosis. 2014;62:143-50. [ Links ]
27. Magurran AE. Measuring biological diversity. Oxford: Blackwell; 2004. [ Links ]
28. Montaño N, Alarcón A, Camargo-Ricalde S, Hernández-Cuevas L, Álvarez-Sánchez J, González-Chávez M, Gavito M, Sánchez-Gallen I, Ramos-Zapata J, Guadarrama P Maldonado-Mendoza I, Catillo-Agüero S, Gracía-Sánchez R, Trejo D, Ferrera-Cerrato R. Research on arbuscular mycorrhizae in Mexico: An historical synthesis and future prospects. Symbiosis. 2012;57: 111-26. [ Links ]
29. Olsson O, Olsson PA, Hammer EC. Phosphorus and carbon availability regulate structural composition and complexity of AM fungal mycelium. Mycorrhiza. 2014;24:443-51. [ Links ]
30. Pezzani F, Montana C, Guevara R. Associations between arbuscular mycorrhizal fungi an grasses in the successional context of a two-phase mosaic in the Chihuahuan Desert. Mycorrhiza. 2006;16:285-95. [ Links ]
31. Phillips JM, Hayman DS. Improved procedures for clearing root and staining parasitic and vesicular-arbuscular mycorrhi-zal fungi for rapid assessment of infection. T Brit Mycol Soc. 1970;55:158-218. [ Links ]
32. Ramos-Zapata JA, Guadarrama P Navarro-Alberto J, Orellana R. Arbuscular mycorrhizal propagules in soils from a tropical forest and an abandoned cornfield in Quintana Roo Mexico: Visual comparison of most-probable-number estimates. Mycorrhiza. 2011;21:139-44. [ Links ]
33. Rzedowski J, Huerta L. Vegetación de México. Limusa: Noriega Editores; 1994. [ Links ]
34. Sanchez-Castro I, Ferrol N, Cornejo P Barea JM. Temporal dynamics of arbuscular mycorrhiza fungi colonizing roots of representative shrub species in a semi-arid Mediterranean ecosystem. Mycorrhiza. 2012;22:449-60. [ Links ]
35. Schafer JL, Mudrak EL, Haines CE, Parag HA, Moloney KA, Holzapfel C. The association of native and non-native annual plants with Larrea tridentata (creosote bush) in the Mojave and Sonoran Deserts J Arid Environ. 2012;87:129-35. [ Links ]
36. Schenck NC, Perez Y. Manual for the identification of VA mycorrhizal fungi. Gainesville, FL: Synergistic Publications; 1988. [ Links ]
37. Schilling AC, Batista JLF. Curva de acumulaçao de espécies e suficiencia amostral em florestas tropicais. Rev Bras Bot. 2008;31:179-87. [ Links ]
38. Schüßler A, Schwarzott D, Walker C. A new fungal phylum, the Glomeromycota: Phylogeny and evolution. Mycol Res. 2001;105:1413-21. [ Links ]
39. Schüßler A, Walker C. The Glomeromycota: a species list with new families and new genera. Glucester, UK. 56 p. 2010. [ Links ]
40. Shi ZY, Zhang LY, Li XL, Feng G, Tian CY, Christie P. Diversity of arbuscular mycorrhizal fungi associated with desert ephemerals in plant communities of Junggar Basin northwest China. Appl Soil Ecol. 2007;35:10-20. [ Links ]
41. Smith S, Read D. Mycorrhizal symbiosis. Amsterdam: Academic Press; 2008. [ Links ]
42. SPSS, IBM. SPSS Base 17.0 for Windows. Chicago, IL: IBM SPSS; 2008. [ Links ]
43. Stürmer SL, Stürmer R, Pasqualini D. Taxonomic diversity and community structure of arbuscular mycorrhizal fungi (phylum Glomeromycota) in three maritime sand dunes in Santa Catarina state, south Brazil. Fungal Ecol. 2013;6:27-36. [ Links ]
44. Varela-Cervero S, López-García Á, Barea JM, Azcón-Aguilar C. Differences in the composition of arbuscular mycorrhizal fungal communities promoted by different propagule forms from a Mediterranean shrubland. Mycorrhiza. 2016;26:489-96. [ Links ]
45. Veresoglou SD, Rillig MC. Suppression of fungal and nematode plant pathogens through arbuscular mycorrhizal fungi. Biol Lett. 2012;8:214-7. [ Links ]
46. Walkley A, Black IA. An examination of the Degtjareff method for determining soil organic matter, and a proposed modification of the chromic acid titration method. Soil Sci. 1934;37: 29-38. [ Links ]
47. Willis A, Rodrigues BF, Harris PJC. The ecology of arbuscular mycorrhizal fungi. Crit Rev Plant Sci. 2013;32:1-20. [ Links ]
48. Zhang H, Franken P. Comparison of systemic and local interactions between the arbuscular mycorrhizal fungus Funneliformis mosseae and the root pathogen Aphanomyces euteiches in Medi-cago truncatula. Mycorrhiza. 2014;24:419-30. [ Links ]
49. Zhang H, Liu Z, Chen H, Tang M. Symbiosis of arbuscular mycorrhizal fungi and Robinia pseudoacacia L improves root tensile strength and soil aggregate stability. PLoS One. 2016;11:e0153378. [ Links ]
50. Zheng Y, Chen L, Luo CY, Zhang ZH, Wang SP, Guo LD. Plant identity exerts stronger effect than fertilization on soil arbuscular mycorrhizal fungi in a sown pasture. Microbial Ecol. 2016;72:647-58. [ Links ]














