La delafloxacina es una nueva fluoroquinolona (FQ) con características en su estructura química que la diferencian de los demás antibióticos de este grupo comercializados con anterioridad. Ha demostrado actividad frente a un amplio rango de bacterias, tanto gram positivas como gram negativas, incluyendo Staphylococcus aureus, estafilococos coagulasa negativos (ECN), estreptococos p-hemolíticos, Streptococcus pneumoniae, enterococos, enterobacterias y Pseudomonas aeruginosa, entre otras1,5,11,14. En diversos estudios previos, la delafloxacina ha demostrado ser más activa que otras FQ frente a cocos gram positivos; incluso, se halló sensibilidad in vitro a delafloxacina en aislados considerados resistentes a ciprofloxacina/levofloxacina10,11,14,15. Por ende, su actividad in vitro no puede ser extrapolada de la observada con otras fluoroquinolonas.
La delafloxacina ha sido aprobada para el tratamiento de infecciones bacterianas agudas de la piel y partes blandas (IPyPB) y está siendo evaluada contra neumonía adquirida en la comunidad. Está disponible en formulaciones tanto para uso endovenoso como oral1,12. Dadas las características farmacocinéticas-farmacodinámicas de este nuevo antibiótico y su actividad in vitro, un uso clínico potencialmente favorable podría ser el tratamiento de IPyPB y de infecciones osteoarticulares1,12.
En este trabajo se evaluó la actividad in vitro de la dela-floxacina mediante el método epsilométrico y el de difusión por discos frente a microorganismos locales contemporáneos, aislados de IPyPB y de infecciones osteoarticulares, en comparación con la actividad de la ciprofloxacina y la levofloxacina. Se estudiaron 181 aislamientos clínicos, incluyendo 84 S. aureus (40 SARM y 44 SASM), 46 ECN (30 Staphylococcus epidermidis, 10 Staphylococcus lugdunensis, 3 Staphylococcus caprae, 2 S Staphylococcus haemolyticus y 1 Staphylococcus capitis), 23 Klebsiella pneumoniae y 28 P. aeruginosa, provenientes de IPyPB o de infecciones osteoarticulares. Todos los microorganismos estudiados fueron obtenidos en el período 2017-2019, de pacientes adultos atendidos en nuestra institución. La identificación de los microorganismos fue realizada mediante MALDI-TOF (Bruker Daltonics, EE. UU.) y la sensibilidad a los antibióticos determinada mediante el sistema automatizado Phoenix (Becton Dickinson, EE. UU.).
Se determinaron las concentraciones inhibitorias mínimas (CIM) de las tres fluoroquinolonas (delafloxacina, ciprofloxacina y levofloxacina) mediante el método epsilo-métrico (Liofilchem, Italia) y el de difusión por discos (5 ^g; Oxoid para ciprofloxacina y levofloxacina y Liofilchem para delafloxacina), siguiendo los lineamientos del Instituto de Estándares de Laboratorio Clínico (CLSI)2. Para la categori-zación de la sensibilidad de los aislamientos, se utilizaron los puntos de corte establecidos por el CLSI para ciprofloxacina y levofloxacina3, y los de la FDA para IPyPB para delaflo-xacina (se utilizaron los puntos de corte sugeridos para S. haemolyticus con las diferentes especies de ECN incluidas)6.
Se evaluó la concordancia entre esos métodos para la categorización de sensibilidad frente a delafloxacina, considerándose aceptables discrepancias <10%, con discrepancias mayores < 3% y discrepancias muy mayores < 1,5%4,8,13.
Como control de calidad de los procedimientos se incluyeron las cepas S. aureus ATCC 29213, S. aureus ATCC 25923, E. coli ATCC 25922 y P aeruginosa ATCC 35218, con los rangos publicados por el CLSI para ciprofloxacina y levofloxacina3, y los propuestos por Pfaller et al.14 para delafloxacina.
El análisis estadístico se realizó con el programa R Core Team versión 2020 (The R Project for Statistical Computing, Viena, Austria). Para comparar las CIM de las tres FQ se aplicó la prueba de Wilcoxon-Mann-Whitney para variables pareadas no paramétricas (distribución no normal por prueba de Shapiro). Para la comparación de la sensibilidad de las tres FQ se utilizó comparación de proporciones. En ambas pruebas se consideró un p < 0,05 para significación estadística.
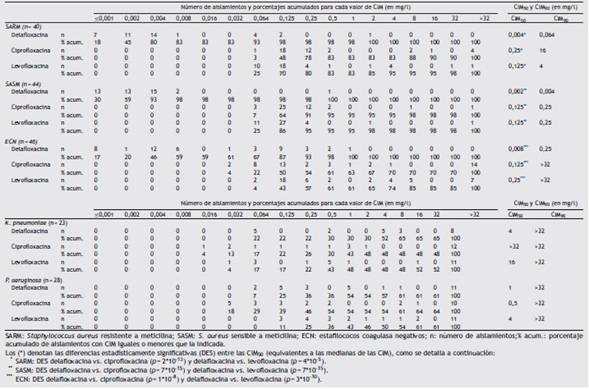
En la tabla 1 se detalla la distribución de las CIM de las tres FQ frente a las bacterias estudiadas, así como los porcentajes acumulados de aislamientos en función de las CIM y los respectivos valores de CIM50 y CIM90. Las CIM de delafloxacina fueron estadísticamente menores (p < <0.01) que las CIM de ciprofloxacina y levofloxacina para SARM, SASM y ECN; en promedio, fueron >100 veces menores que las respectivas CIM de levofloxacina y >60 veces menores que las de ciprofloxacina. Las CIM de delafloxacina fueron menores que las CIM de ciprofloxacina y levofloxacina en todos los aislamientos de estafilococos evaluados (figuras suplementarias A, B y c). No se observó una diferencia estadísticamente significativa (p >0,05) al comparar las CIM de las tres FQ frente a bacilos gram negativos (figuras suplementarias D y E).
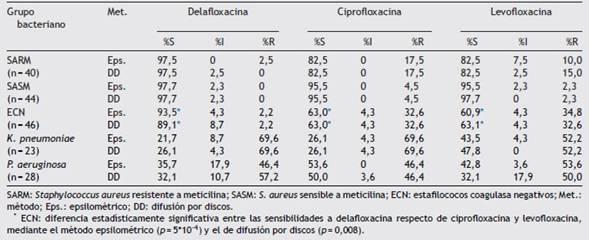
Tabla 2: Porcentajes de sensibilidad y resistencia según el método epsilométrico (CIM) y el método de difusión por discos
SARM: Staphylococcus aureus resistente a meticilina; SASM: S. aureus sensible a meticilina; ECN: estafilococos coagulasa negativos; Met.: método; Eps.: epsilométrico; DD: difusión por discos.
* ECN: diferencia estadísticamente significativa entre las sensibilidades a delafloxacina respecto de ciprofloxacina y levofloxacina, mediante el método epsilométrico (p = 5*10-4) y el de difusión por discos (p = 0,008).
En la tabla 2 se muestran los porcentajes de aislamientos por categoría de sensibilidad (sensibles/intermedios/resistentes) según el método epsilométrico y el de difusión por discos. Los porcentajes de sensibilidad a delafloxacina en ECN fueron estadísticamente mayores que los correspondientes a ciprofloxacina y levofloxacina (p<0,01), mientras que la diferencia no alcanzó significancia estadística en SARM (p =0,06). De los 18 aislamientos de ECN con resistencia o sensibilidad intermedia a ciprofloxacina o levofloxacina, 15 mostraron CIM de delafloxacina en el rango de sensibles. En forma similar, de los 9 aislamientos de S. aureus resistentes a ciprofloxacina y levofloxacina (7 SARM y 2 SASM), 7 fueron sensibles in vitro a delafloxacina (6 SARM y 1 SASM). Los porcentajes de sensibilidad y resistencia de las tres FQ no fueron estadísticamente diferentes entre sí (p>0,05) ni para K. pneumoniae ni para P aeruginosa.
La correlación entre el método de difusión por discos y el método epsilométrico para la delafloxacina se muestra en la figura 1 (A, S. aureus; B, ECN). La concordancia categórica en S. aureus fue del 98,8%, con un 1,2% de discrepancias menores (por un único aislamiento de SARM). A su vez, en ECN, la concordancia categórica fue del 91,3%, con un 8,7% de discrepancias menores (4 de 46 aislamientos). Con respecto a los bacilos gram negativos, las concordancias categóricas entre el método de difusión por discos y el epsilométrico para la delafloxacina fueron del 95,7% en K. pneumoniae (discrepancias menores de 4,3%) y del 89,3% en P aeruginosa (discrepancias menores de 10,7%). No se observaron discrepancias mayores ni muy mayores en ninguna de las bacterias estudiadas. En todos los ensayos, las cepas utilizadas como control de calidad dieron resultados dentro de los rangos esperados.
Según nuestros resultados, la actividad in vitro de la delafloxacina frente a estafilococos fue mayor que la observada con ciprofloxacina y levofloxacina (CIM menores, con significancia estadística), en concordancia con lo informado en estudios previos5,10,11. Asimismo, nuestros resultados son similares a los de trabajos publicados anteriormente, en los que también se observó que, si bien las CIM de la delafloxacina en aislamientos resistentes a otras FQson más altas que las de aislamientos sensibles a todas las FQ, permanecen en valores por debajo o cercanos al punto de corte de sensibilidad para la delafloxacina5,10,11,14,15. Tanto en los ensayos iniciales realizados por Nilius et al.11, como en el estudio publicado con posterioridad por Remy et al.15, así como en el de McCurdy et al.10, basado en un ensayo clínico de fase 3, se observó que en los aislamientos de S. aureus no sensibles a ciprofloxacina/levofloxacina, las mutaciones únicas en gyrA o en grlA fueron las más comunes.
Esta actividad diferencial de la delafloxacina respecto de otras FQ en estafilococos resalta la importancia de la evaluación de sensibilidad in vitro en forma independiente, al menos para aislamientos no sensibles a otras FQ (no se pueden extrapolar las resistencias).
Los altos niveles de resistencia a FQ en los aislamientos de K. pneumoniae y R aeruginosa incluidos en este estudio pueden deberse a que estas bacterias están implicadas en escenarios complicados, tales como infecciones crónicas recidivantes, infecciones en pacientes multitratados o asociadas al cuidado de la salud. Si bien no observamos diferencias estadísticamente significativas en las actividades de las tres FQ en K. pneumoniae y R aeruginosa, se requeriría ensayar un mayor número de bacilos gram negativos para ser concluyentes al respecto. En este sentido, no obstante, estudios previos que incluyeron mayor cantidad de bacilos gram negativos mostraron resultados similares a los nuestros, con actividades semejantes al comparar entre las diferentes fluoroquinolonas5,9.
La evaluación de la sensibilidad de nuevos antibióticos en microbiología clínica en nuestra región se basa, fundamentalmente, en el método de difusión por discos o, alternativamente, en el método epsilométrico, ya que los métodos automatizados no los incluyen y las técnicas de microdilución no suelen estar disponibles7,8,13. En
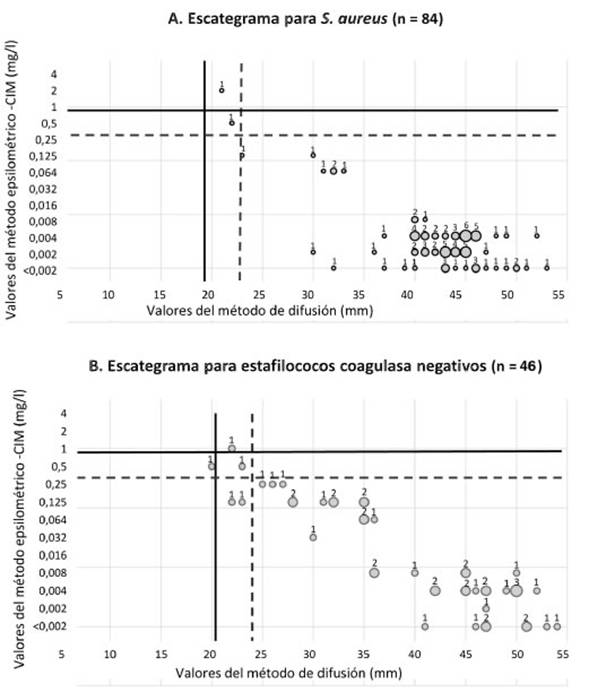
Figura 1: Correlación de la actividad in vitro de la delafloxacina según el método epsilométrico y el de difusión por discos para S. aureus (A) y estafilococos coagulasa negativos (B).
Líneas cortadas: puntos de corte de sensibilidad (< 0,25 mg/l para S. aureus y S. haemolyticus, y >23 mm para S. aureus o > 24 mm para S. haemolyticus)
Líneas continuas: puntos de corte de resistencia (> 1 mg/l para S. aureus y S. haemolyticus, y < 19 mm para S. aureus o < 20 mm para S. haemolyticus)
El tamano de los círculos es proporcional a la cantidad de aislamientos con esos valores (el n se indica arriba de cada círculo).
nuestro estudio observamos concordancia entre el método de difusión por discos y el método epsilométrico para S. aureus, ECN y K. pneumoniae, sin observarse discrepancias mayores ni muy mayores. Por lo tanto, ambos métodos resultan equivalentes para evaluar la sensibilidad in vitro a delafloxacina en estas bacterias. Por su parte, en P aeru-ginosa, la concordancia categórica fue del 89,3%, menor a la deseable (>90%), si bien todas debidas a discrepancias menores.
Para esta valoración de la correlación entre los métodos ensayados, nuestro estudio tiene algunas limitaciones. Por un lado, no utilizamos el método de referencia de dilución en caldo. No obstante, investigaciones previas han demostrado correlación entre la microdilución y el método epsilomé-trico y con la difusión por discos para evaluar la sensibilidad in vitro a delafloxacina, con concordancias categóricas superiores al 90% y con solo errores menores, cercanos al 8%9,14. Por otro lado, el número de aislamientos incluidos en nuestro estudio (en particular, pocos aislamientos de S. aureus no sensibles a delafloxacina) es insuficiente para una evaluación acabada de correlación entre métodos4. Esta limitación es habitual para el momento en que se incorporan nuevos antibióticos7. De todas maneras, resulta importante disponer de estos primeros resultados sobre esta nueva fluoroquinolona frente a aislamientos locales contemporáneos.
En resumen, la delafloxacina mostró mayor actividad in vitro que la ciprofloxacina y la levofloxacina frente a estafilococos, tanto SARM, SASM como ECN. El método de difusión por discos mostró concordancia con el método epsilométrico para evaluar la actividad in vitro de la delafloxacina en estafilococos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
El presente trabajo fue financiado en parte por Eurofarma Laboratorios, S.A.
Anexo. Material adicional
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.ram.2021.02.012.












 uBio
uBio