Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.12 n.2 Mendoza jul./dic. 2005
Áreas de acción en un ensamble de roedores del Desierto del Monte (Mendoza, Argentina)
Valeria E. Corbalán y Ricardo A. Ojeda
Instituto Argentino de Investigaciones de las Zonas Áridas, CRICYT (CONICET), Av. Ruiz Leal s/ n, Parque Gral. San Martín, 5500, Mendoza, Argentina. corbalan@lab.cricyt.edu.ar, rojeda@lab.cricyt.edu.ar.
ABSTRACT: Home range of a rodent population in the Monte desert (Mendoza, Argentina). In the central portion of the Monte desert four small rodent species coexist: Graomys griseoflavus, Akodon molinae, Eligmodontia typus, and Calomys musculinus . Using the Convex Polygon Method, we assessed the home range of these species at different habitats and made comparisons among species, and between sexes and different seasons of the year. We found that home range did not differ among species, but there is a tendency to increase range size as the species corporal size increases. Overlapping of home range was different at different seasons of the year, probably due to different population densities, but home range size was constant along the year. Habitat type and sex affect home range only for G. griseoflavus and A. molinae, respectively.
Key words. Cricetid rodents. Home range. Monte desert.
INTRODUCCIÓN
El área de acción ("home range") de un mamífero está definida como aquella donde el animal desarrolla sus actividades diarias normales tales como forrajeo, apareamiento y cuidado de las crías, incluyendo conductas de exploración y de contacto (Burt, 1943).
El tamaño del área de acción está determinado por las necesidades energéticas de cada especie (Lindstedt et al., 1986; Haskell et al., 2002); es decir, puede estar afectado por el tamaño corporal, la calidad del hábitat, la distribución y abundancia del alimento, la densidad poblacional, el sexo, la edad, la condición social y la actividad reproductiva (Mazurkiewicz, 1971; Maza et al., 1973; Webster y Brooks, 1981; Wolff, 1985; Lindstedt et al., 1986; Heinemann et al., 1995; Gentile et al., 1997; Ribble y Stanley, 1998; Pires et al., 1999; Priotto y Steinmann, 1999; Jetz et al., 2004). Las especies de mayor tamaño requieren más energía, en términos absolutos, para mantener su metabolismo (Kotler et al., 1994), y muchas veces existe una relación positiva entre tamaño corporal y área de acción (Shenbrot et al., 1999; Kelt y Van Vuren, 2001; Haskell et al., 2002; Jetz et al., 2004). En hábitats más pobres, el tamaño del área de acción suele ser mayor que en los más ricos ya que el animal necesita explorar un área mayor en la búsqueda de recursos tales como alimento. El sexo también puede influir en el tamaño del área, teniendo generalmente los machos áreas mayores para permitir el acceso a varias hembras (Gentile et al., 1997; Ribble y Stanley, 1998). Por otro lado, a altas densidades poblacionales, los individuos responden restringiendo su área de acción o aumentando la superposición espacial con individuos de la misma especie o de otras (Gentile et al., 1997; Ribble y Stanley, 1998). Las especies más agresivas (o "dominantes") tienden a excluir a las especies subordinadas, resultando en una baja superposición espacial para las primeras y una alta superposición en las segundas (O`Farrell, 1980).
Los roedores constituyen uno de los componentes más conspicuos de sistemas desérticos, donde las presiones climáticas y antrópicas contribuyen a la formación de un paisaje altamente heterogéneo. Generalmente sus poblaciones son grandes, proveen alimento para las especies de carnívoros y crean hábitats para muchas especies de vertebrados e invertebrados debido a la construcción de sus cuevas (Shenbrot at al., 1999). En la parte central del desierto de Monte, Argentina, cuatro especies de roedores cricétidos coexisten en los tres tipos principales de hábitat de la región: el algorrobal, el jarillal y el medanal. Ellas son Calomys musculinus, Eligmodontia typus, Graomys griseoflavus y Akodon molinae. Las dos primeras, especies de menor tamaño corporal (17- 23 g), difieren en cuanto a características morfológicas que hacen posible la explotación de distintos hábitats. E. typus posee largas patas traseras con callosidades peludas, y bullas timpánicas infladas, que le permiten evadir más eficientemente a los depredadores y explotar áreas abiertas y suelo arenoso, percibiendo el medanal como el hábitat óptimo para la reproducción y supervivencia (Corbalán, 2004; Corbalán et al., en prep.). En cambio para C. musculinus, carente de estas características morfológicas, el hábitat óptimo es el jarillal (Corbalán, 2004; Corbalán et al., en prep.). Akodon molinae, la especie de tamaño intermedio (40 g), también alcanza su mayor densidad en el jarillal, mientras que G. griseoflavus , la especie de mayor tamaño (56 g), es dominante en el algarrobal (Corbalán, 2004; Corbalán y Ojeda, 2004; Corbalán et al., en prep.).
Se cuenta hoy con varios estudios ecológicos, fisiológicos y etológicos de roedores del desierto del Monte (Ojeda, 1989; Giannoni et al., 1996; Campos, 1997; Borruel et al., 1998; Gonnet, 1998; Gonnet y Ojeda, 1998; Díaz y Ojeda, 1999). Sin embargo, la información sobre la organización social y espacial de estas especies aún es limitada, especialmente en lo referido al área de acción y su papel en la coexistencia de estas especies. Contreras y Rosi (1981) reportaron un área de acción promedio de 366.07 m 2 para C. musculinus cordovensis . El territorialismo fue observado en algunas especies del género Akodon (Contreras y Rosi, 1981), lo que ha llevado a generalizar este comportamiento como característico de los akodontinos (Gentile et al., 1997). Para el resto de las especies no hay información, salvo el diámetro del área de acción de 31 m para E. typus (Pearson et al., 1987).
En este estudio describimos las áreas de acción de estas cuatro especies de roedores, en hábitats característicos de una localidad del Monte central, y examinamos la influencia del sexo, el tamaño corporal y la estación en el tamaño del área de acción de las especies.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en la Reserva de la Biósfera de Ñacuñán (34º 02' S, 67º 58' W), Mendoza, Argentina, desde junio de 1999 hasta abril de 2001. El área pertenece al bioma del Monte (Cabrera y Willink, 1980), donde el clima es semiárido con estacionalidad marcada, presentando veranos cálidos y húmedos e inviernos fríos y secos. La precipitación media anual es de 330 mm . En enero, el promedio de las temperaturas máximas y mínimas es 32.4ºC y 16ºC , respectivamente, y en Julio es 14.9ºC y -0.9ºC (Guevara et al., 1996).
En la reserva existen tres hábitats representativos del Monte que por su extensión son considerados los más importantes: el algarrobal, el jarillal y el medanal. El algarrobal está compuesto por un estrato arbóreo discontinuo de Prosopis flexuosa, uno arbustivo de Larrea divaricata y uno herbáceo de gramíneas perennes y anuales. El jarillal se caracteriza por un estrato arbustivo de L. cuneifolia y uno herbáceo donde predominan las gramíneas. El medanal es el hábitat más simple, que representa un área abierta con árboles y arbustos dispersos (Roig, 1971).
Individuos de las cuatro especies de roedores fueron capturados con trampas de captura viva (tipo Sherman) cebadas con avena arrollada. Se establecieron dos grillas de 7 x 7 estaciones de trampeo (con separación de 15 m entre las estaciones) en cada uno de los tres hábitats de la reserva. Se realizaron 7 campañas de muestreo en el algarrobal (julio, agosto, octubre y diciembre de 1999, mayo y noviembre de 2000, y abril de 2001), 8 en el jarillal (junio, julio, agosto, octubre y diciembre de 1999, mayo y noviembre de 2000, y abril de 2001) y 6 en el medanal (agosto y octubre de 1999, febrero, mayo y noviembre de 2000, y abril de 2001). Cada campaña consistió en 4-7 noches consecutivas de trampeo. Por la mañana, las trampas fueron revisadas y los individuos capturados fueron marcados, pesados, sexados y liberados en el sitio de captura. El área de acción fue calculada a partir de las capturas y recapturas de los individuos dentro de cada campaña de muestreo. Para ello se utilizó el Método del Mínimo Polígono Convexo (Stickel, 1954; Jenrich y Turner, 1969) con inclusión de borde.
Utilizando los datos de los individuos que registraban tres o más capturas, se determinó el número mínimo de capturas necesarias para calcular el área de acción en cada especie. Este número fue establecido sobre la base de la estabilización de una curva al graficar el área obtenida en función del número de capturas (Pires et al, 1999). Así, tres capturas fueron suficientes para E. typus (n = 72), A. molinae (n = 69) y C. musculinus (n = 24), mientras que para G. griseoflavus (n = 59) fueron necesarias al menos cinco. Por ello, sólo se incluyeron 12 individuos de esta última especie en los análisis estadísticos.
Las áreas calculadas fueron comparadas entre sexos y entre especies. Se usó la prueba U de Mann Whitney en comparaciones de dos conjuntos de datos y la prueba de Kruskal Wallis para más de dos comparaciones (Siegel, 1991). La posible relación entre el peso y el área de acción es de tipo y = a*X b (donde y = área; X = peso; a = constante característica para cada taxón; b = pendiente; West et al., 1997; Haskell et al., 2002). Las variables fueron previamente transformadas al log 10 , lo que permitió el uso de una regresión lineal del tipo log 10 y = log 10 a + b log 10 x. Esta relación fue realizada con los promedios de cada especie (área promedio y peso promedio), con todo el conjunto de datos (áreas y pesos de todos los individuos de todas las especies) y para cada especie separadamente (áreas y pesos de todos los individuos de cada especie). Para estas regresiones se utilizó el peso obtenido en la primera captura de cada individuo. La comparación entre distintas épocas del año fue realizada con el test U de Mann Whitney. Estas épocas fueron establecidas sobre la base del registro de distintas densidades poblacionales, siendo el otoño (abril y mayo) la época de mayor densidad para todas las especies en todos los hábitats, mientras que el resto de los meses correspondió a la época de menor densidad (Corbalán, 2004; Corbalán y Ojeda, 2004). Las crías fueron excluidas de todos los cálculos.
Con el objeto de investigar potenciales interacciones interespecíficas en las tres comunidades estudiadas, se calculó un índice de superposición espacial en cada período de trampeo. Debido a que en este estudio no pudieron calcularse las áreas de acción de todos los individuos de la población, se consideró más apropiado calcular la superposición de los sitios de captura que la superposición de áreas. Se utilizó el índice de superposición de O'Farrell (1980)
IS i = (M i ∩ M j ) / M iTot (Ec. 1)
donde M i ∩ M j es el número de sitios de captura (microhábitats) que la especie i comparte con individuos de la especies j; y M iTot es el número total de sitios de captura para la especie i.
El valor de este índice multiplicado por 100 expresa el grado de superposición en porcentaje.
El mismo índice fue adaptado para evaluar la superposición espacial entre sexos dentro de una misma especie y entre individuos del mismo sexo. Estas estimaciones fueron realizadas sólo para los adultos en la época reproductiva.
RESULTADOS
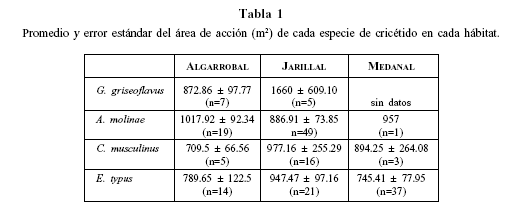
El mayor tamaño de área de acción fue registrado para G. griseoflavus (promedio y error estándar = 1201 ± 270.1 m 2 ), mientras que el área de A. molinae fue de 924 ± 58.36 m2, la de C. musculinus fue de 911 ± 172.5 m2 y la de E. typus de 812.9 ± 54.79 m2. Al comparar las áreas de las distintas especies entre sí, no se encontraron diferencias significativas (K-W = 4.54, P = 0.21, n = 177). En la Tabla 1 se detallan los valores de las áreas de cada especie en cada hábitat.
No se encontraron diferencias significativas entre las áreas de acción de machos y hembras de G. griseoflavus (U = 16, P = 1, n machos = 8, n hembras = 4), E. typus (U = 543, P = 0.67, n machos = 34, n hembras = 37) ni C. musculinus (U = 41.5, P = 0.36, n machos = 14, n hembras = 10). Sin embargo, se encontró que los machos de A. molinae tienen un área de acción mayor que las hembras de esa especie (U = 232.5, P = 0.01, n machos = 24, n hembras = 33).
El área de acción promedio de cada especie aparentemente no depende del peso promedio de la especie (pendiente = 1.95; R2 = 0.78; P = 0.11; n = 4). Considerando el total de los individuos, en cambio, se encontró una asociación positiva altamente significativa entre ambas variables pero que explica muy poco de la variabilidad total de los datos (pendiente = 1.86; R2 = 0.06; P <0.01; n = 170). Eligmodontia typus, A. molinae y C. musculinus no mostraron una relación entre tamaño del individuo y el área (pendiente = 1.99, R2 = 0.01, P = 0.35, n = 68; pendiente = 1.04, R 2 = 0.0002, P = 0.89, n = 66; pendiente = 2.45, R 2 = 0.10, P = 0.14, n = 24, respectivamente). En cambio, se encontró que el área de acción de G. griseoflavus aumenta al aumentar el peso de los individuos (pendiente = 51.28, R2 = 0.33, P = 0.05, n = 12; Fig. 1).
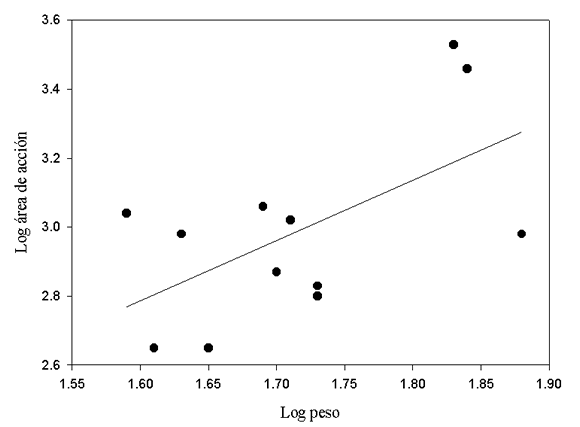
Fig. 1. Relación entre el peso y el área de acción de G. griseoflavus en el desierto del Monte.
Los tamaños de las áreas de acción no pudieron compararse para las distintas épocas en G. griseoflavus y C. musculinus debido a la baja densidad registrada en algunos meses. En A. molinae y E. typus se encontró que el tamaño del área de acción es similar en las distintas épocas (U = 115.5; P = 0.28 , n = 69 para A. molinae ; U = 162, P = 0.3 , n = 72 para E. typus ).
En los meses de otoño (abril-mayo, la época de mayor densidad poblacional), la superposición interespecífica es mayor que en los restantes meses (Tabla 2). Mientras que en el jarillal y en el algarrobal los índices de superposición fueron altos durante el otoño (alcanzando valores máximos de 92% y 88% respectivamente), los valores de superposición en el medanal fueron menores, con un máximo de 67%.

La superposición intersexual (machos sobre hembras) en la época reproductiva fue baja. La mayor superposición se registró en G. griseoflavus, mientras que la menor se registró en A. molinae (Tabla 3).

La superposición espacial intrasexual también fue baja en todas las especies, aunque los valores de la superposición entre hembras resultaron ligeramente menores a la superposición entre machos (Tabla 3).
DISCUSIÓN
Las áreas de acción no difirieron significativamente entre las distintas especies de cricétidos que coexisten en el Desierto del Monte. Resultados similares se encontraron previamente en al menos una localidad desértica (en Nevada, USA) para roedores heterómidos (O' Farrell, 1978). Si bien se observa una tendencia hacia un incremento del área en las especies de mayor tamaño, registrándose el área promedio más grande en la especie de mayor tamaño (G. griseoflavus) y la más pequeña para E. typus , esta relación no está apoyada estadísticamente. Algunos autores no encontraron relación entre el tamaño corporal y el área de acción en distintas especies de roedores (O' Farrell, 1978; Gentile et al., 1997). Otros autores (Brown et al, 1993; Kelt y Van Vuren, 1999) sostienen que la relación entre masa corporal y área de acción es no-lineal y depende de restricciones energéticas, correspondiendo las áreas más pequeñas a las especies con una masa corporal ≈ 100 g, y las más grandes a las especies muy grandes y muy pequeñas (Brown y Maurer, 1989). Así, las especies menores de 100 g tendrían una pendiente negativa al graficar masa corporal y área de acción. En este estudio, sin embargo, todas las especies son menores de 100 g y puede observarse una tendencia a que el área sea mayor en las especies de mayor tamaño. A nivel específico, se observa esta tendencia sólo en G. griseoflavus, ya que los individuos más grandes de esta especie se movieron en un área más grande que los individuos más pequeños. El tipo de hábitat parece no influir en el tamaño del área de acción de la mayoría de las especies estudiadas, ya que las áreas fueron similares en los tres. Sin embargo, pudo observarse que las áreas de acción de G. griseoflavus en el jarillal son mayores a las encontradas en el algarrobal. Este resultado podría indicar que en el jarillal esta especie debe recorrer áreas más extensas en busca de alimento, mientras que en el algarrobal encontraría mayor disponibilidad de hojas de algarrobo, las cuales constituyen un alto porcentaje de su dieta (Campos, 1997; Campos et al., 2001).
Cuando se analiza el uso del espacio de una especie se podría esperar que, a nivel poblacional, un incremento en la densidad conlleve un incremento en la superposición espacial o en un decrecimiento en el tamaño del área de acción (O' Farrell, 1980). La misma situación podría esperarse en cuanto al ensamble. En este estudio se encontraron diferencias en la superposición espacial de las especies en distintas épocas del año, siendo mayor la superposición durante el otoño en correspondencia con la mayor densidad de individuos. La superposición interespecífica puede ser usada como un índice de particionamiento espacial y podría mostrar una diferenciación de hábitat. O´Farrell (1980) propone que las especies hábitat-generalistas mostrarán una superposición espacial alta, con respecto a las especies hábitat-especialistas. Hasta el momento no se ha demostrado un alto grado de selectividad a nivel de microhábitat en las especies que componen el ensamble (Corbalán, en prensa), por lo que podría esperarse una superposición espacial alta de las especies en cualquier momento del año. La baja superposición espacial en los muestreos de invierno y verano simplemente puede reflejar la baja densidad poblacional (y la consecuente carencia de datos de captura) y no un particionamiento de microhábitats.
Si bien se han encontrado estas diferencias en la superposición espacial interespecífica en distintas épocas, el tamaño del área de acción se mantuvo constante a lo largo del año, al menos para A. molinae y E. typus. Este mismo patrón fue registrado para Akodon cursor en Brasil (Gentile et al., 1997). Además, en A. cursor las áreas de los machos fueron mayores que las áreas de las hembras, tal como fue encontrado en este estudio para A. molinae, reforzando la idea de que ésta es una característica compartida por distintas especies del género Akodon.
En conclusión, no se han encontrado parámetros que tengan una fuerte influencia en el área de acción de todas las especies de este ensamble de roedores desérticos, aunque la época del año parece influir en el grado de superposición espacial interespecífico. En Graomys griseoflavus, el tamaño del área de acción se relaciona con el tipo de hábitat, mientras que el sexo influye en el tamaño del área de A. molinae.
AGRADECIMIENTOS
Agradecemos a todos los que han colaborado en el trabajo de campo: Guillermo Debandi, Paula Taraborelli, Emilce Rombola, Néstor Viñals, Carlos Vazquez, Ana M. Scollo y Mariana Dacar. También agradecemos a Mónica Díaz y dos revisores anónimos por las sugerencias en el manuscrito. Este estudio fue financiado por el CONICET (PIP 4684).
LITERATURA CITADA
BORRUEL N, CM CAMPOS, SM GIANNONI y CE BORGHI. 1998. Effect of herbivorous rodents (cavies and tuco-tucos) on a shrub community in the Monte desert, Argentina. Journal of Arid Environments 39:33-37. [ Links ]
BROWN JH y BA MAURER. 1989. Macroecology: the division of food and space among species on continents. Science 243:1145-1150. [ Links ]
BROWN JH , PA MARQUET y ML TAPER. 1993. Evolution of body size: consequences of an energetic definition of fitness. American Naturalist 142:573-584. [ Links ]
BURT WH. 1943. Territoriality and home range concepts as applied to mammals. Journal of Mammalogy 24:346-352. [ Links ]
CABRERA A y A WILLINK. 1980. Biogeografía de América Latina. Secretaría General de la organización de los Estados Americanos. Serie de Biología. Monografías nro 13. Washington, DC. [ Links ]
CAMPOS CM. 1997. Utilización de recursos alimentarios por mamíferos medianos y pequeños del Desierto del Monte. Tesis de Doctorado en Ciencias Biológicas, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba, Córdoba, Argentina. [ Links ]
CAMPOS CM, RA OJEDA, S MONGE y M DACAR. 2001. Utilization of food resources by small and medium-sized mammals in the Monte desert biome, Argentina. Austral Ecology 26:142-149 [ Links ]
CONTRERAS JR y MI ROSI. 1981. Investigaciones sociobiológicas acerca de roedores silvestres de Mendoza. Serie Científica Año IV, Nº 22: 12-17. [ Links ]
CORBALÁN V. 2004. Uso de hábitat y ecología poblacional de pequeños mamíferos del desierto del Monte central, Mendoza, Argentina. Tesis Doctoral, Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata. [ Links ]
CORBALÁN V. En prensa. Microhabitat selection by murid rodents in the Monte desert of Argentina. Journal of Arid Environments. [ Links ]
CORBALÁN V y R OJEDA. 2004. Spatial and temporal organisation of small mammal communities in the Monte desert, Argentina. Mammalia 68:5-14 [ Links ]
DÍAZ GB y RA OJEDA. 1999. Kidney structure and allometry of Argentine desert rodents. Journal of Arid Environments 41:453-461. [ Links ]
GENTILE R, PS D'ANDREA y R CERQUEIRA. 1997. Home ranges of Philander frenata and Akodon cursor in a Brazilian restinga (coastal shrubland). Mastozoología Neotropical 4:105-112. [ Links ]
GIANNONI SM, CE BORGHI y VG ROIG. 1996. The burrowing behavior of Ctenomys eremophilus (Ctenomyidae, Rodentia) in relation with substrata hardness. Mastozoología Neotropical 3:5-12. [ Links ]
GONNET JM. 1998. Influencia del pastoreo sobre poblaciones de aves y mamíferos herbívoros en la región de la Reserva de la Biósfera "Ñacuñán", Mendoza, Argentina. Tesis Doctoral en Ciencias Biológicas, Universidad Nacional de Córdoba, Córdoba, Argentina. [ Links ]
GONNET JM y RA OJEDA. 1998. Habitat use by small mammals in the arid Andean foothills of the Monte Desert of Mendoza, Argentina. Journal of Arid Environment 38:349-357. [ Links ]
GUEVARA JC, CR STASSI y OR ESTEVEZ. 1996. Effect of cattle grazing on range perennial grasses in the Mendoza plain, Argentina. Journal of Arid Environment 34:205-213. [ Links ]
HASKELL JP, ME RITCHIE y H OLFF. 2002. Fractal geometry predicts varying body size scaling relationships for mammal and bird home ranges. Nature 418:527-530. [ Links ]
HEINEMANN KM, N GUTHMANN, M LOZADA y JA MONJEAU. 1995. Area de actividad de Abrothrix xanthorhinus (Muridae, Sigmodontinae) e implicancias para su estrategia reproductiva. Mastozoología Neotropical 2:23-30. [ Links ]
JENRICH RI y FB TURNER. 1969. Measurement of Non-circular Home Range. Journal of Theoretical Biology 22:227-237. [ Links ]
JETZ W, C CARBONE, J FULFORD y JH BROWN. 2004. The scaling of animal space use. Science 306:266-268. [ Links ]
KELT DA y D VAN VUREN. 1999. Energetic constraints and the relationship between body size and home range area in mammals. Ecology 80:337-340. [ Links ]
KELT DA y D VAN VUREN. 2001. The ecology and macroecology of mammalian home range area. The American Naturalist 157:637-645. [ Links ]
KOTLER BP, JS BROWN y WA MITCHELL. 1994. The role of predation in shaping the behavior, morphology and community organisation of desert rodents. Australian Journal of Zoology 42:449-466. [ Links ]
LINDSTEDT SL, BJ MILLER y SW BUSKIRK. 1986. Home range, time, and body size in mammals. Ecology 67:413-418. [ Links ]
MAZA BG, NR FRENCH y AP ASCHWANDEN. 1973. Home range dynamics in a population of heteromyid rodents. Journal of Mammalogy 54:405-425. [ Links ]
MAZURKIEWICZ M. 1971. Shape, size and distribution of home ranges of Clethrionomys glareolus (Schreber, 1780). Acta Theriologica 16:23-60. [ Links ]
O' FARRELL MJ. 1978. Home range dynamics in a sagebrush community. Journal of Mammalogy 59:657-668. [ Links ]
O' FARRELL MJ. 1980. Spatial relationships of rodents in a sagebrush community. Journal of Mammalogy 61:589-605. [ Links ]
OJEDA RA. 1989. Small mammal responses to fire in the Monte desert, Argentina. Journal of Mammalogy 70:416- 420. [ Links ]
PEARSON OP, S MARTIN y J BELLATI. 1987. Demography and reproduction of the silky desert mouse ( Eligmodontia ) in Argentina . Fieldiana Zoology 23:433-446. [ Links ]
PIRES AS, FAS FERNANDEZ y D De FREITAS. 1999. Patterns of space use by Micoureus demerarae (Marsupialia: Didelphidae) in a fragment of Atlantic forest in Brazil . Mastozoología Neotropical 6:39-45. [ Links ]
PRIOTTO JW y AR STEINMANN. 1999. Factors affecting home range size and overlap in Akodon azarae (Muridae: Sigmodontinae) in natural pasture of Argentina . Acta Theriologica 44:37-44. [ Links ]
RIBBLE DO y S STANLEY. 1998. Home ranges and social organization of syntopic Peromyscus boylii and P. truei . Journal of Mammalogy 79:932-941. [ Links ]
ROIG FA. 1971. Flora y vegetación de la Reserva Forestal de Ñacuñán. Deserta 1:25-232. [ Links ]
SHENBROT GI, BR KRASNOV y KA ROGOVIN. 1999. Spatial ecology of desert rodent communities. Springer Verlag, Berlín. [ Links ]
SIEGEL S. 1991. Estadística no paramétrica aplicada a las ciencias de la conducta. Ed. Trillas , Mexico . [ Links ]
STICKEL LF. 1954. A comparison of certain methods of measuring ranges of small mammals. Journal of Mammalogy 35:1-15. [ Links ]
WEBSTER AB y RJ BROOKS. 1981. Social behavior of Microtus pennsylvanicus in relation to seasonal changes in demography. Journal of Mammalogy 62:738-751. [ Links ]
WEST GB, JH BROWN y BJ ENQUIST. 1997. A general model for the origin of allometric scaling laws in Biology. Science 276:122-126. [ Links ]
WOLFF JO. 1985. The effects of density, food, and interespecific interference on home range size in Peromyscus leucopus and Peromyscus maniculatus. Canadian Journal of Zoology 63:2657-2662 [ Links ]
Recibido 7 marzo 2005.
Aceptación final 3 octubre 2005.














