Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.13 n.1 Mendoza ene./jun. 2006
Classes de desenvolvimento em marsupiais: um método para animais vivos
Joana Macedo, Diogo Loretto, Marcus Vinícius Vieira, e Rui Cerqueira
Universidade Federal do Rio de Janeiro, Departamento de Ecologia, Laboratório de Vertebrados, CP 68020- Rio de Janeiro - RJ, CEP. 21941-590-Brasil <joanasm@terra.com.br>
Key words. Age classes. Atlantic Forest. Dentition. Development classes. Didelphidae. Marsupial.
Determinar a idade dos organismos é uma necessidade freqüente em biologia. Muitas são as tentativas de determinar a idade dos organismos, como anéis de crescimento em vegetais (Raven et al., 1996), anéis de deposição de conchina em Bivalvia, diferentes ínstares de desenvolvimento em Hexapoda holometabólicos (Ruppert y Barnes, 1996), diferenças em plumagem de aves (Sick, 1984), deposição de anéis de cemento e dentina ou seqüência de erupção e desgaste dentário em mamíferos de médio e grande porte (Southwood y Henderson, 2000). Problema reconhecidamente maior é determinar a idade em campo, parâmetro que ampliaria o entendimento da dinâmica das populações (D'Andrea et al., 1994), dispensando o sacrifício de animais silvestres.
Para os mamíferos, muitas tentativas de estimar a idade já foram feitas com estudos sobre animais em cativeiro (Cerqueira, 1984; Motta, 1988; Cerqueira et al., 1989; D'Andrea et al., 1994; Hingst, 1998; De Conto, 2002) e de coleções científicas (Tyndale-Biscoe y Mackenzie, 1976; Tribe, 1990; Vidigal, 1996). Porém, algumas destas estimativas são baseadas em caracteres morfológicos que são de difícil observação em campo, como por exemplo, medidas do crânio e pós-crânio.
Uma característica muito usada é o padrão de erupção dentária. Ele tem forte ligação com a bionomia, sendo portanto, parâmetro importante para marcar os estágios de vida dos mamíferos, o que permite estudos em que as idades são estimadas em dias (Motta, 1988; D'Andrea et al., 1994). No entanto, na maioria dos estudos populacionais e demográficos a idade em dias não é tão relevante, pois para entender os processos de mortalidade, recrutamento, emigração e imigração uma divisão em classes etárias é suficiente, se estas corresponderem a fases do desenvolvimento (Lima et al, 2001).
A divisão em classes etárias deve ter sentido biológico, marcando os estágios de vida do organismo, não podendo ser uma divisão arbitrária. Deve-se considerar fatores relevantes para a vida do organismo, como a passagem de um estágio para outro (Hossler et al., 1994). Isto foi verificado por Fonseca y Kieruff (1989) e Cunha y Vieira (2002) ao detectarem diferenças comportamentais de uso do espaço de marsupiais neotropicais correlacionadas à idade dos indivíduos. Em outros casos o tamanho de prole está relacionado ao tamanho e idade de fêmeas de marsupiais (Julien-Laferrière y Atramentowicz, 1990), assim como a dieta e estratégias de forrageamento à idade de uma espécie de roedor onívoro (Clark, 1980).
Os marsupiais têm um padrão de erupção e substituição de dentes que não mudou muito desde o Cretáceo (Cifelli y Muizon, 1998). Nos Didelphidae a seqüência de erupção dos dentes é semelhante na maioria das espécies (para descrição detalhada ver Tribe, 1990). A fórmula P3 M4 é facilmente observada e somente o último pré-molar tem precedente decíduo (Tyndale-Biscoe y Mackenzie, 1976; Cifelli y Muizon, 1998), embora alguns estudos enfatizem que este dente seja na verdade o primeiro molar (para descrição detalhada ver Astúa de Moraes et al., 2001).
Pode-se, então, usar o padrão de erupção dentária para dividir os marsupiais didelfídeos em classes etárias (Tyndale-Biscoe y Mackenzie, 1976; Tribe, 1990; D'Andrea et al., 1994), correspondendo a quatro fases da vida destes organismos: lactentes ou filhotes na bolsa, jovens imaturos sexualmente, sub-adultos sexualmente ativos, e adultos. Estações reprodutivas, períodos de recrutamento e tabelas de vida podem ser relacionados a estas fases, permitindo uma avaliação precisa da demografia das populações (D'Andrea et al., 1994).
Neste estudo dividimos sete espécies de marsupiais didelfídeos nas quatro classes de desenvolvimento acima descritas usando um método simples, de fácil aplicação em animais vivos. As espécies estudadas foram Didelphis aurita Wied-Neuwied, 1826, Marmosops incanus (Lund, 1840), Metachirus nudicaudatus (Desmarest, 1817), Philander frenatus (Olfers, 1818), Gracilinanus microtarsus (Wagner, 1842), Micoureus paraguayanus Miranda-Ribeiro, 1936 e Caluromys philander (Linnaeus, 1758).
Foram usados dados de dois estudos de marcação-e-recaptura em duas localidades no Parque Nacional da Serra dos Órgãos, no município de Guapimirim, Rio de Janeiro. Um dos estudos durou dois anos, de 1999 à 2001, e foi feito na Sede Guapimirim do Parque (22º 29' 37'' S, 43º 00' 05'' W). O outro é feito na localidade do Garrafão (22º 28' 34'' S, 42º 59' 41'' W), foi iniciado em 1997 e já tem seis anos de duração. Nos dois estudos a amostragem foi bimestral, com cinco noites de captura em cada amostragem. No total foram usadas cinco grades de armadilhagem, sendo três no Garrafão, com 25 estações de captura cada. O esforço total de captura para as duas áreas foi de 43 755 armadilhas-noite.
O estágio de erupção dentária e a fase do desenvolvimento de 281 fêmeas das sete espécies foram verificados com base no último molar funcional da arcada dentária superior. Consideramos a arcada superior por serem dela os últimos dentes a eclodirem, ou seja, o animal só terá a dentição completa quando os últimos molares superiores nascerem.
Foram consideradas apenas as capturas dentro da estação reprodutiva de cada espécie, que foi determinada pela presença de fêmeas com sinais de atividade reprodutiva. Filhotes presos às tetas ou tetas inchadas e com leite foram os sinais reprodutivos considerados. A gravidez não foi considerada uma vez que é de difícil e subjetiva percepção, já que os filhotes nascem pouco desenvolvidos. Os machos não apresentam sinais confiáveis de atividade reprodutiva que possam ser observados em campo, por isso não foram usados para testar o método.
Foram verificadas a dentição e a condição reprodutiva de 281 fêmeas das sete espécies. Na classe I (filhotes), ficaram agrupados os lactentes dos quais não se pode examinar a dentição. Na classe II (jovens) ficaram os indivíduos que apresentam como último molar superior o primeiro (M¹) (Fig. 1) ou o segundo (M²). Neste estágio os indivíduos já são independentes da mãe mas ainda sexualmente imaturos. A classe III (sub-adultos) foi representada pelos indivíduos com o terceiro molar superior funcional (M³), sendo formada por jovens sexualmente ativos. Na classe IV (adultos) ficaram os animais com dentição completa (M4) e sexualmente ativos (Tabela 1).
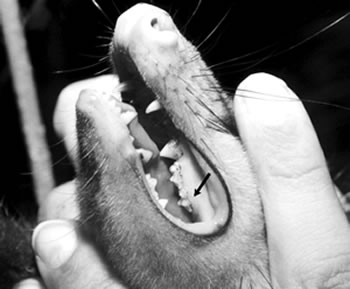
Fig. 1. Jovem de D. aurita, com o primeiro molar superior funcional. Foto: Diogo Loretto.

Para cada classe de desenvolvimento foi contado o número de fêmeas que seguiam o modelo acima descrito e o número de fêmeas que não seguiram o modelo. Para isto foram verificadas quantas fêmeas da classe dos jovens estavam sexualmente imaturas (ajuste) ou já reproduzindo (exceções), assim como para as outras classes, onde neste caso, a ausência de sinais reprodutivos caracteriza as exceções ao modelo.
A divisão em classes usando o último molar funcional da arcada superior mostrou-se adequada para separar as fêmeas nas quatro classes pré-estabelecidas, embora tenhamos amostras pequenas de G. microtarsus, M. paraguayanus e C. philander. Apesar disto, a eficácia do método é grande, pois de todas as fêmeas foram classificadas corretamente 94.6%. É razoável supor que essa fórmula seja aplicável também aos machos, já que a maturidade sexual é atingida em períodos similares aos das fêmeas da mesma idade, conforme observações em Philander frenatus e em Didelphis aurita criados em cativeiro (D'Andrea et al., 1994; Motta, comunicação pessoal).
O uso de um método mais robusto de divisão é vantajoso em relação aos métodos espécie-específicos, uma vez que pode ser aplicado em qualquer espécie, a despeito das pequenas variações no padrão de erupção dos dentes (para descrição detalhada ver Tribe, 1990 e Vidigal, 1996). Além disso, uma divisão em classes de desenvolvimento permite o uso de modelos demográficos baseados em estágios de vida, e não de idades (Sauer y Slade, 1987; Caswel, 2001). Sugerimos a utilização deste método como critério para a análise de estrutura etária de marsupiais neotropicais vivos.
Gostaríamos de agradecer as pessoas que de alguma forma ajudaram neste trabalho, Carlos E.V. Grelle, Fernando A.S. Fernandez, Ricardo Finotti e Amanda C. Mendes por valiosas críticas e sugestões em versões preliminares deste estudo. FUJB, CNPq, PIBIC/CNPq, PROBIO (MMA - GEF), PRONEX financiaram este estudo.
LITERATURA CITADA
ASTÚA DE MORAES D, B LEMOS e R CERQUEIRA. 2001. Supernumerary molars in Neotropical opossums (Didelphimorphia, Didelphidae). Mammalian Biology 66:193-203. [ Links ]
CASWELL H. 2001. Matrix population models. Sinauer Associates, Inc. Publishers, Sunderland, Massachusetts, Second edition 722 pp. [ Links ]
CERQUEIRA R. 1984. Reproduction du Didelphis albiventris au Nord-est du Bresil (Polyprodontia, Didelphidae). Mammalia 48(1):95-104. [ Links ]
CERQUEIRA R, LO SALLES e MV VIEIRA. 1989. Habitats and reproduction of Rhiphidomys cearanus (Rodentia, Cricetidae). Ciência e Cultura 42:1009-1013. [ Links ]
CIFELLI RL e C DE MUIZON. 1998. Tooth eruption and replacement pattern in early marsupials: Modalités de l'éruption et du remplacement dentaires chez les marsupiaux anciens. Comptes Rendus de l'Académie des Sciences - Series IIA - Earth and Planetary Science 326(3):215-220. [ Links ]
CLARK DA. 1980. Age and sex-dependent foraging strategies of a small mammalian omnivore. Journal of Animal Ecology 49:549-563. [ Links ]
CUNHA AA e MV Vieira. 2002. Support diameter, incline and vertical movements of four didelphid marsupials in the Atlantic Forest of Brazil. Journal of Zoology 258:419-426. [ Links ]
D'ANDREA PS, R CERQUEIRA e ED HINGST. 1994. Age estimation of the Gray Four Eyed Opossum, Philander opossum (Didelphimorphia: Didelphidae). Mammalia 58(2):283-291. [ Links ]
DE CONTO V. 2002. Genética quantitativa e variação microgeográfica de Akodon cursor (Rodentia: Sigmodontinae) em fragmentos florestais no estado do Rio de Janeiro. Dissertação de mestrado, Universidade Federal do Rio de Janeiro, Departamento de genética 122 pp. [ Links ]
FONSECA GAB e MC KIERULFF. 1989. Biology and natural history of brazilian Atlantic Forest small mammals. Bulletin of Florida State Museum Biological Sciences 34(3):99-152. [ Links ]
HINGST E, PS D'ANDREA, RT ANTORI e R ERQUEIRA. 1998. Breeding of Philander frenata (Didelphimorphia, Didelphidae) in captivity. Laboratory Animals 2: 434-438. [ Links ]
HOSSLER RJ, JB MCANISH e JD HARDER. 1994. Maternal denning behavior and survival of juveniles in opossums in southeastern New York. Journal of Mammalogy 75(1):60-70. [ Links ]
JULIEN-LAFERRIÈRE D e M ATRAMENTOWICZ. 1990. Feeding and reproduction of three didelphid marsupials in two Neotropical forests (French Guiana). Biotropica 22(4):404-415. [ Links ]
LIMA M, NC STENSETH, NG YOCCOZ e FM JAKSIC. 2001. Demography and population dynamics of the mouse opossum (Thylamys elegans) in semi-arid Chile: seasonality, feedback structure and climate. Proceeding of the Royal Society of London 268:2053-2064. [ Links ]
MOTTA MFD. 1988. Estudo do desenvolvimento extra-uterino de Didelphis aurita (Wied, 1826) em cativeiro - Investigação de critérios para estimativa de idade. Dissertação de mestrado, Universidade federal do Rio de Janeiro/ Museu Nacional, Rio de Janeiro 105 pp. [ Links ]
RAVEN PH, RF EVERT e H CURTIS. 1996. Biologia Vegetal. Quinta edição. Editora Guanabara Koogan SA., Rio de Janeiro. [ Links ]
RUPPERT EE e RD BARNES. 1996. Zoologia dos Invertebrados. Sexta edição. Editora Roca, São Paulo. [ Links ]
SAUER JR e NA SLADE. 1987. Size-based demography of vertebrates. Annual Review of Ecology and Systematics 18:71-90. [ Links ]
SICK H. 1984. Ornitologia Brasileira. Vol. 1. Terceira edição. Editora da Universidade de Brasília. [ Links ]
SOUTHWOOD TRE e PA HENDERSON. 2000. Ecological Methods. Third Edition. Blackwell Science, Oxford 575 pp. [ Links ]
TRIBE CJ. 1990. Dental age classes in Marmosa incana and others Didelphoids. Journal of Mammalogy 71(4):566-569. [ Links ]
TYNDALE-BISCOE CH e RB MACKENZIE. 1976. Reproduction in Didelphis marsupialis and D. albiventris in Colombia. Journal of Mammalogy 57:249-265. [ Links ]
VIDIGAL VCS. 1996. http://www-mcnair.Berkeley.Edu/96journal/Vidigal.html, em 14/08/2003. [ Links ]
Recibido 9 octubre 2003.
Aceptación final 23 mayo 2005.














