Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Mastozoología neotropical
versão impressa ISSN 0327-9383versão On-line ISSN 1666-0536
Mastozool. neotrop. v.14 n.2 Mendoza jul./dez. 2007
Redescripción y posición filogenética del ratón selvático Akodon sylvanus (Rodentia: Cricetidae: Sigmodontinae)
J. Pablo Jayat¹, Pablo E. Ortiz², Ulyses F. J. Pardiñas³ y Guillermo D'Elía4
¹ Laboratorio de Investigaciones Ecológicas de las Yungas (LIEY), Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Casilla de Correo 34, 4107 Yerba Buena, Tucumán, Argentina. ² Cátedra de Paleozoología II, Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Miguel Lillo 205, 4000 San Miguel de Tucumán, Tucumán, Argentina. ³ Centro Nacional Patagónico, casilla de correo 128, 9120 Puerto Madryn, Chubut, Argentina. 4 Departamento de Zoología, Universidad de Concepción, casilla 160-C, Concepción, Chile.
RESUMEN: Recientes trabajos de campo en los alrededores de la localidad tipo de Akodon sylvanus nos han permitido colectar ejemplares de esta forma pobremente conocida. En este trabajo se genera por primera vez una hipótesis filogenética explícita que incluye a este taxón. El análisis filogenético junto con las comparaciones morfológicas efectuadas demuestran que A. sylvanus constituye una especie válida diferente de A. azarae y A. pervalens, dos taxones que en su momento fueron considerados como parte de la misma entidad. Además, nuestro análisis filogenético sugiere que A. sylvanus pertenece al grupo de especies de A. boliviensis. Es así que se brinda una diagnosis enmendada para A. sylvanus, que incluye caracteres morfológicos (cuanti y cualitativos) y datos moleculares (citocromo b). Finalmente, este estudio extiende la distribución geográfica conocida para A. sylvanus mediante la adición de varias localidades nuevas en las provincias de Jujuy y Salta, básicamente restringidas a un ambiente de Yungas entre los 700 y 2300 m de altitud.
Abstract: Redescription and phylogenetic position of the Silvan Mouse Akodon sylvanus (Rodentia: Cricetidae: Sigmodontinae). Recent field work conducted near the type locality of Akodon sylvanus provided new specimens of this poorly known form. In this paper we provide a phylogenetic hypothesis that for the first time includes A. sylvanus. Phylogenetic and morphologic analyses show that A. sylvanus represents a valid biological species, different from A. azarae and A. pervalens, two taxa at times considered as part of the same biological species that A. sylvanus. Furthermore, our analysis suggest that A. sylvanus belong to the A. boliviensis species group. We present an emended diagnosis of A. sylvanus, which includes morphological (quanti- and qualitative analyses) and molecular (cyt b sequences) data. Finally, we summarize its known distribution, adding several new recording localities in the Argentinean provinces of Jujuy and Salta, and provide data on its natural history.
Palabras clave. Argentina. Akodon pervalens. Akodon sylvanus. Filogenia. Taxonomía.
Key words. Argentina. Akodon pervalens. Akodon sylvanus. Phylogeny. Taxonomy.
INTRODUCCIÓN Y ANTECEDENTES
Entre los roedores sigmodontinos, Akodon Meyen, 1833 constituye -con ca. 41 especies consideradas válidas desde el norte de América del Sur hasta Patagonia- uno de los géneros más especiosos y ampliamente distribuidos (Musser y Carleton, 2005). No obstante los importantes avances efectuados en su conocimiento integral, el estatus de muchas de sus formas nominales permanece como uno de los tópicos más confusos de la sistemática de los cricétidos americanos. En efecto, para numerosas especies sólo se cuenta con una breve descripción original, la mayoría de las cuales están basadas en unos pocos especímenes colectados hace más de un siglo. Adicionalmente, las limitadas revisiones taxonómicas concretadas a la fecha han incluido un número comparativamente pequeño de especies, generalmente en un contexto geográfico restringido (e.g., Myers, 1989; Myers y Patton, 1989; Hershkovitz, 1990; Myers et al., 1990; Patton y Smith, 1992; Christoff, 1997; Geise et al., 1998, 2001; Christoff et al., 2000; Pardiñas et al., 2003).
En territorio argentino ocurre la mayor diversidad del género, particularmente en la región noroeste del país. Lamentablemente, las revisiones generales efectuadas han incluido escasos ejemplares de Argentina (cf. Myers, 1989; Myers et al., 1990); a la par, los análisis taxonómicos basados en especímenes de dicha procedencia son pocos (e.g. Bianchi et al., 1971; Barquez et al., 1980; Kajon et al., 1984; Vitullo et al., 1986; Blaustein et al., 1992) y muchas veces limitados a una provincia en particular (e. g., Díaz, 1999). En líneas generales puede decirse que el estatus taxonómico de las poblaciones de Akodon del noroeste argentino es aún pobremente comprendido.
Entre las especies menos estudiadas de esta región se destaca Akodon sylvanus, originalmente descripta por Thomas (1921) sobre una serie de ejemplares colectados por Emilio Budin en la sierra de Santa Bárbara (Jujuy). En 1925 Thomas erigió una subespecie nueva para este taxón, A. sylvanus pervalens, con localidad tipo en Caraparí (Bolivia). A partir de entonces el estatus de ambos taxones ha fluctuado largamente en correlato con su casi virtual desconocimiento. Yepes (1933) indicó la presencia de pervalens en Argentina, para la localidad de Aguaray (Salta) y listó ambas subespecies en su reseña de los roedores argentinos (Yepes, 1935), posición seguramente emanada de Gyldenstolpe (1932) y seguida igualmente por Ellerman (1941). Cabrera (1961) fue el primer autor en postular un panorama distinto, el cual signaría el tratamiento taxonómico ulterior de estas formas. Así y sin justificación explícita -aunque seguramente basado en las apreciaciones de Thomas (1921)- sylvanus fue incluido en la sinonimia de A. azarae (Fischer) mientras que pervalens fue subsumido en la de A. varius Thomas. Llamativamente, Cabrera (1961) omitió la referencia de este último para Argentina efectuada por Yepes (1933). En su revisión del grupo de especies de A. varius, Myers (1989) trató tentativamente a azarae y sylvanus como especies diferentes, mientras que pervalens fue considerado como distinto de varius y similar a A. cursor. En forma independiente, Hershkovitz (1990) consideró como probablemente conespecíficos a A. arenicola hunteri Thomas y A. sylvanus, pero excluyendo a A. azarae de esta sinonimia. Con respecto a pervalens, fue listada por este autor como sinónimo de A. serrensis Thomas. Este panorama fue parcialmente descartado por Musser y Carleton (1993) quienes trataron nuevamente como válido a sylvanus y a pervalens como subespecie del mismo. Anderson (1997) postuló dudosamente la validez de A. pervalens para los registros de Bolivia. Corresponde a Díaz (1999) -quien consideró a sylvanus como especie válida y diferente de pervalens - el primer aporte a su conocimiento con posterioridad a su descripción original, basándose en un nuevo examen de la serie tipo y ejemplares adicionales de Jujuy. Finalmente, Musser y Carleton (2005) propiciaron la consideración de sylvanus y pervalens como especies plenas, pero explicitando las numerosas incertidumbres en torno a la validez de ambos taxones.
Con el objetivo de superar el panorama reseñado en este trabajo se redescribe A. sylvanus y se brinda una diagnosis enmendada para la especie, se amplia su rango distribucional y se adicionan datos sobre su historia natural. A la luz de los resultados de un análisis filogenético original basado en secuencias de ADN mitocondrial, se compara a A. sylvanus con especies filogenéticamente cercanas y con especies morfológicamente similares que habitan en el noroeste argentino. Finalmente, se efectúan comentarios sobre el estatus de A. pervalens.
MATERIALES Y MÉTODOS
El material estudiado proviene de colecciones efectuadas por uno de los autores (JPJ) en proximidades (< 6 km) de la localidad tipo de Akodon sylvanus. Los ejemplares obtenidos fueron referidos a A. sylvanus sobre la base de la comparación con la descripción original de Thomas (1921) así como con fotografías del holotipo depositado en The Natural History Museum (NHM, Londres, Inglaterra). Además, la revisión de colecciones mastozoológicas permitió reconocer ejemplares adicionales de la especie para numerosas localidades del extremo norte de la región del noroeste argentino.
Se realizó un análisis filogenético basado en secuencias del genoma mitocondrial correspondientes a las primeras 801 bases del gen que codifica para el citocromo b. El muestreo taxonómico incluyó un ejemplar topotipo de A. sylvanus y otros 30 taxones considerados actualmente como especies válidas de Akodon (Musser y Carleton, 2005) disponibles en GENBANK. Se consideró un espécimen por especie con la excepción de A. iniscatus y A. aerosus, especies para las cuales se incluyeron especímenes de dos subespecies y de A. azarae, especie bajo la que se ha sinonimizado a A. sylvanus y que a su vez puede constituir un complejo de especies (D'Elía et al., datos no publicados). Como grupo externo se usaron haplotipos de Deltamys kempi y Necromys obscurus, especies de géneros integrantes junto con Akodon de la división Akodon de la tribu Akodontini (D'Elía, 2003). En el Apéndice 1 se detallan los 37 ejemplares incluidos en el análisis, su determinación taxonómica y la fuente de sus secuencias (generadas en este estudio o GENBANK). Un segundo espécimen de A. sylvanus fue secuenciado con el fin de tener una aproximación a los valores de divergencia intraespecífica. Las secuencias reportadas en este trabajo fueron obtenidas siguiendo el protocolo de laboratorio detallado en D'Elía et al. (2003). Las mismas fueron depositadas en GENBANK con los siguientes números de acceso DQ683180-83 y EF166037. Las secuencias fueron alineadas utilizando el programa Clustal X (Thompson et al., 1997) usando para cada parámetro de alineación los costos por defecto. Las secuencias alineadas fueron sometidas a un análisis de máxima parsimonia (Farris, 1982) usando el programa PAUP* (Swofford, 2000). La estrategia de búsqueda consistió en 200 réplicas heurísticas usando adiciones de secuencias al azar, donde los caracteres fueron tratados como desordenados y se les dio igual peso. El apoyo relativo de los clados fue estimado de dos maneras. Se realizaron 1000 réplicas de Jackknife (Farris et al., 1996) con la eliminación de 33% de los caracteres y 5 incorporaciones de secuencias al azar. Los nodos con menos de 50% de apoyo se dejaron colapsar. En segundo lugar, para cada nodo se estimaron los índices de Bremer (Bremer, 1994) usando un archivo de comandos escrito con el programa TreeRot (Sorenson, 1999). Las sinapomorfias moleculares fueron documentadas en PAUP* y visualizadas en MacClade 3.05 (Maddison y Maddison, 1992). Sólo aquellos cambios que se mantuvieron independientemente del tipo de transformación de caracteres empleado (i.e., ACCTRAN o DELTRAN) fueron considerados. Los valores de divergencia genética brindados son valores observados de divergencia y fueron estimados con PAUP* ignorando los sitios con información desconocida. Además, se compararon las distancias genéticas entre ejemplares de especies de Akodon seleccionadas: A. azarae, A. boliviensis, A. dolores, A. molinae, A. philipmyersi, A. siberiae, A. sp., y A. sylvanus.
Los resultados del análisis filogenético constituyeron la guía para la comparación morfológica y genética ulterior. De esta forma y para lograr una adecuada caracterización, A. sylvanus fue comparado con A. azarae, A. boliviensis, A. budini, A. lutescens caenosus, A. pervalens, A. simulator, A. spegazzinii spegazzinii, A. s. tucumanensis, A. toba y una especie aún no descripta con poblaciones en las provincias de Córdoba y San Luis (Akodon sp.).
En la descripción del cráneo se siguieron, parcialmente, los trabajos de Wahlert (1985), Voss (1988), Myers et al. (1990) y Abdala y Díaz (2000). La nomenclatura utilizada en la descripción de la dentición sigue a Reig (1977). Para la descripción morfométrica se emplearon cuatro medidas externas estándar y el peso, tomados a partir de datos de etiquetas y catálogos, y algunos descriptores craneanos medidos con calibre digital (0.02 mm de precisión). Para las medidas del cráneo se sigue, en general, el criterio de Myers et al. (1990). Las siglas de las medidas utilizadas son: LT (largo total), LC (longitud cola), LP (longitud pata con uña), LO (longitud oreja), P (peso), CIL (longitud cóndilo-incisivo), RL (longitud rostro), ZB (Ancho cigomático), BB (Ancho caja craneana), IOC (constricción interorbitaria), MTRL (longitud serie molar superior), NL (longitud nasales), RW2 (ancho rostro en región media), DL (longitud diastema), IFL (longitud foramen incisivo), OCW (ancho entre cóndilos occipitales) y ZP (ancho placa cigomática). Adicionalmente, se registraron LMC (Longitud máxima del cráneo), PP (puente del paladar), LM (longitud mandíbula sin incisivo) y SMI (longitud serie molar inferior), medidas no referidas por Myers et al. (1990).
La variación morfométrica de A. sylvanus en relación con las distintas clases de edad (definidas de acuerdo a Myers, 1989) se expresa mediante estadísticas descriptivas univariadas. La misma, más un Análisis de Componentes Principales (ACP), se empleó en la comparación con representantes topotípicos de A. lutescens caenosus, A. spegazzinii spegazzinii, A. s. tucumanensis, A. simulator glaucinus, A. s. simulator y A. s. tartareus. Otras especies incluidas en el análisis fueron A. boliviensis y A. budini. Las estadísticas descriptivas univariadas se realizaron sobre ejemplares de edad 3 e incluyó todas las medidas mencionadas para la descripción de A. sylvanus. El ACP se realizó sobre una matriz de 12 variables (CIL, PP, MTRL, IFL, ZP, ZB, BB, IOC, RW2, NL, RL y OCW) para 81 individuos clase de edad 2 (18 A. sylvanus, 24 A. lutescens caenosus, 15 A. spegazzinii spegazzinii, 18 A. s. tucumanensis, y 6 A. boliviensis). Esta fue la edad con un mayor número de individuos para las especies involucradas en el análisis. Los componentes principales fueron extractados a partir de la matriz de varianza-covarianza luego de la transformación de las medidas a sus logaritmos (base 10). Los ejes del análisis fueron interpretados de acuerdo al signo y magnitud de los pesos de las variables analizadas y sólo se tuvieron en cuenta los ejes estadísticamente significativos de acuerdo al test de Jackson (1993).
Todos los especímenes examinados en este trabajo y las siglas de las colecciones a las que pertenecen se indican en el Apéndice 1.
RESULTADOS
Análisis filogenético
El análisis de máxima parsimonia arrojó un árbol más corto (1245 pasos; IC = 0.319; IR = 0.543, Fig. 1). La topología alcanzada corrobora en gran medida las obtenidas por Smith y Patton (2007) en su reciente análisis filogenético del género Akodon y la de Pardiñas et al. (2005), en el marco de la descripción de A. philipmyersi. Las diferencias principales entre los resultados de estos tres estudios no refieren a la composición de los distintos grupos de especies (sensu Smith y Patton, 2007), sino a las relaciones entre los mismos. Son justamente estas relaciones las que obtienen los menores valores de apoyo en los tres estudios. En esta contribución solamente será discutida la posición filogenética de A. sylvanus. Esta especie forma parte del grupo de especies de A. boliviensis (sensu Smith y Patton, 2007; ver también Myers et al., 1990), si bien este clado está poco apoyado (Jackknife: JK < 50%, índice de Bremer: IB = 1). Dentro del mismo, A. sylvanus aparece como especie hermana de A. sp. (JK = 50 %; IB = 1) y, a su vez, el clado A. sylvanus - A. sp. es hermano (JK = 100 %; IB = 5) del clado A. boliviensis-A. spegazzini. Es así que A. sylvanus está distantemente relacionada con A. azarae; son necesarios 10 pasos adicionales sobre el árbol más corto para que ambas especies aparezcan como hermanas y se necesitan 31 pasos adicionales a la topología más parsimoniosa para que A. azarae, tal cual es hoy entendida, sea parafilética respecto a A. sylvanus.

Fig. 1. Representación como filograma del árbol más parsimonioso (longitud = 1245 pasos, IC = 0.319, IR = 0.543) obtenido en el análisis de máxima parsimonia de las primeras 801 bases del gen que codifica para el citocromo b. Los números sobre las ramas indican valores de jackknife (sólo >50%, a la izquierda) e índice de Bremer (a la derecha) de los nodos. Arg = Argentina, PY = Paraguay, UY = Uruguay.
Comparación genética
La distancia genética observada entre pares de especies de Akodon varía desde 1.3% (A. molinae - A. dolores) hasta 15.0% (A. philipmyersi - A. siberiae). Las comparaciones que involucran a A. sylvanus tienen un rango de 4.6% (A. boliviensis y A. sp.) a 11.9 % (A. iniscatus). El valor observado entre A. sylvanus y su especie hermana, A. sp. (4.6%), es cercano al promedio encontrado para pares de especies hermanas de Akodon (promedio para 11 comparaciones = 4.4%; rango: 1.3% para el par A. molinae - A. dolores - 10.4% para el par A. azarae - A. philipmyersi). La variación intraespecífica observada en A. sylvanus (dos ejemplares secuenciados) es de 0.1 %.
Análisis morfométrico
De acuerdo con la estadística descriptiva univariada A. sylvanus puede distinguirse claramente de la mayoría de las especies de Akodon del noroeste argentino y de aquellas formas con las que fuera tradicionalmente sinonimizado (véanse Tablas 1 y 2). En el ACP (Fig. 2; Tabla 3) los tres primeros componentes principales resumen el 86.9% de la variación total. El componente principal I explica el 75.7% de la varianza y separa a las especies por medidas tales como la longitud cóndilo-incisivo, longitud de nasales y longitud y ancho del rostro. Los componentes principales II y III (6.4% y 4.8% de variación explicada, respectivamente) no fueron significativos de acuerdo al test heurístico de Jackson (1993) y, por lo tanto, no fueron analizados. El gráfico multivariado en dos dimensiones de los componentes principales I y II (Fig. 2) y los pesos de las variables en el CP1 (véase Tabla 3) muestran que A. sylvanus es la especie de mayor tamaño entre los representantes del grupo boliviensis presentes en el noroeste argentino y se caracteriza por tener un cráneo largo, rostro relativamente ancho y alargado y arcos cigomáticos expandidos.

Fig. 2. Distribución en el espacio bidimensional (componentes principales I y II) resultante de la matriz de varianza-covarianza de las 12 medidas cráneo-dentarias para cada uno de los ejemplares de Akodon (n = 81) analizados. Todos los ejemplares analizados pertenecen a la clase de edad 2.

Redescripción de A. sylvanus
Akodon sylvanus Thomas, 1921
Akodon sylvanus Thomas, Ann. & Mag. Nat. Hist., 9, 7:184. 1921
Akodon sylvanus sylvanus Gyldenstolpe, Kungl. Sv. Vetensk. Akad., 11(3):104. 1932.
Akodon azarae sylvanus Cabrera, Rev. Mus. Arg. Cs. Nat. "B. Rivadavia", 4(2):441. 1961.

Fig. 3. Vistas dorsal, ventral y lateral del cráneo y labial de la mandíbula en Akodon sylvanus (JPJ 580). Escala = 10 mm.

Fig. 4. Vistas dorsal, ventral y lateral del cráneo y labial de la mandíbula en (de izquierda a derecha) Akodon pervalens (holotipo NHM 25.2.1.55) y A. sylvanus (holotipo NHM 21.1.1.27). Escala = 10 mm. Fotografías gentileza del British Museum of Natural History, © The Natural History Museum, London.
Holotipo (Fig. 4): B.M. 21.1.1.27. Número original 1019 (col. Emilio Budin). Macho adulto.
Localidad tipo: "Sierra de Santa Barbara, S.E. Jujuy. Type from Sunchal, 1200 m " (Thomas, 1921:185). Sunchal (24º 15' S, 64º 26' W, 1454 m, departamento Santa Bárbara, provincia de Jujuy) es -hoy día- poco más que una casa situada unos 4 km al W de El Fuerte y unos 6 km al NE de La Herradura (carta topográfica #2563 del Instituto Geográfico Militar denominada "Monte Quemado", año 1957, escala 1:500000).
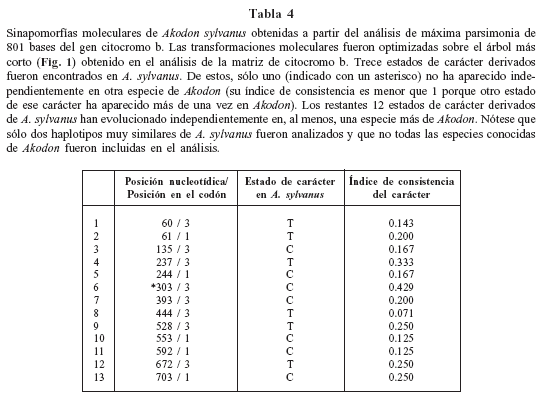
Diagnosis enmendada: A. sylvanus es un miembro de la subfamilia Sigmodontinae (sensu Reig, 1980) distinguible de todas las otras especies de Akodon por la siguiente combinación de caracteres: coloración dorsal uniforme, castaño olivácea salpicada de pelos negros y apenas contrastante con la región ventral; anillo periocular ausente o pobremente desarrollado; mancha blanca en la quijada apenas insinuada; tamaño grande en el contexto del grupo boliviensis (valores promedio CIL = 24.66, MTRL = 4.34 y IFL = 6.27); incisivos ortodontes; hipsodoncia intermedia para el género; cráneo relativamente estrecho y alargado, con rostro alargado (valores promedio NL = 9.92 y RL = 10.23), arcos cigomáticos relativamente poco expandidos (13.26 en promedio para ZB) y caja craneana poco globosa (promedio para BB = 12.09); región interorbitaria sin rebordes sobresalientes. Las sinapomorfías moleculares se listan en la Tabla 4 (nótese que las secuencias de algunas de las especies de Akodon no fueron analizadas).
Descripción: coloración dorsal uniforme, castaño oliva salpicada de pelos negros, lo cual le confiere una tonalidad general oscura. Mejillas y zona delante de los hombros levemente más claras que el dorso. Quijada con unos pocos pelos completamente blancos que no llegan a formar una mancha notable. En algunos ejemplares se observa -apenas insinuado- un anillo periocular. Coloración ventral más clara que la dorsal sin ser fuertemente contrastante. Región inguinal que puede presentar coloración más intensa que el resto del vientre. Existen dos tipos de pelos en la región dorsal: pelos cortos bicoloreados con región basal (>90% de la longitud del pelo) gris oscura y extremo castaño amarillento y pelos de guarda completamente negros que sobresalen entre 5 y 7 mm en región posterior. Pelos del vientre con patrón bicoloreado, base gris y extremo anteado. Orejas que no se diferencian de la coloración dorsal y tapizadas internamente con pelos bicoloreados de base negruzca y extremo castaño amarillento. Coloración de pata anterior y posterior castaño grisáceo levemente oscuro, con pelos de la región dorsal bicoloreados, de bases negruzcas y extremo blanquecino. Vibrisas ungueales blanquecinas que superan levemente el extremo distal de las uñas. Garras anteriores y posteriores con desarrollo normal en el contexto del resto de los representantes del género. En la región ventral de patas anteriores se observan tres almohadillas interdigitales y dos metacarpales levemente mayores y subiguales entre sí. En las posteriores se observan cuatro almohadillas interdigitales en la base de las falanges, una tenar de tamaño similar a las anteriores y una hipotenar alargada que se extiende hasta la base de la almohadilla interdigital 1. Cola levemente bicoloreada, castaño oscuro en la región dorsal y ventralmente blanquecina. Escamas pequeñas, regulares y apenas visibles a simple vista.
Cráneo (Figs. 3 y 4) relativamente estrecho y alargado, con rostro alargado, arcos cigomáticos levemente expandidos y caja craneana poco globosa. Nasales bien desarrollados, acuminados anteriormente y en su extremo posterior sobrepasan el borde posterior de los premaxilares. Muesca cigomática con desarrollo moderado. Región interorbitaria de ancho intermedio para el género y levemente divergente hacia atrás, con bordes redondeados en su porción anterior y algo más rectos en la posterior, sin formar márgenes filosos. Sutura fronto-parietal con forma de U; interparietal pequeño que lateralmente no alcanza a contactar las crestas mastoideas. Crestas temporales y mastoideas escasamente desarrolladas, a excepción de aquellos individuos adultos viejos. En vista lateral el cráneo es apenas curvado. Nasales que sobrepasan el extremo anterior de premaxilares. Placa cigomática de ancho intermedio para el género, con borde anterior recto o levemente cóncavo y raíz dorsal apenas retrasada respecto a la ventral. Proceso hamular de desarrollo variable en las poblaciones estudiadas, con extremo posterior expandido. Foramen postglenoideo de mayor tamaño que el subescamosal en la mayoría de los individuos, pudiendo ser subiguales. Forámenes incisivos de longitud variable; típicamente extendidos hasta el nivel del protocono del M1, aunque en algunos individuos juveniles sobrepasan el hipoflexo. Paladar sin forámenes ni surcos desarrollados y con extremo posterior que alcanza el nivel alveolar del M3 o levemente por delante. Fosa mesopterigoidea de tamaño intermedio para el género, con forma de lira apenas insinuada y borde anterior redondeado o cuadrangular, sin proceso palatino medio. Vacuidades esfenopalatinas de tamaño intermedio para el género. Fosas parapterigoideas relativamente excavadas, divergentes posteriormente, anchas en comparación a la mesopterigoidea y con márgenes externos convexos. Foramen oval que alcanza, en general, el doble de tamaño del M3. Bullas de tamaño promedio para el género con tubos de Eustaquio cortos y anchos. Patrón de circulación carotideo de tipo I (sensu Voss, 1988), con arteria carótida común bifurcada detrás de la bulla para formar las arterias carótidas externa e interna. Esta última da origen a la arteria estapedial y penetra en la caja craneana a través del canal carotídeo, entre la bulla y el basioccipital.
Rama horizontal de la mandíbula delicada y baja. Proceso coronoides con extremo curvado hacia atrás que alcanza mayor altura que el cóndilo. Proceso angular al mismo nivel o levemente por delante del cóndilo. Proyección capsular de desarrollo moderado ubicada levemente por detrás del extremo del coronoides o en una misma línea. Crestas masetéricas superior e inferior que se extienden anteriormente hasta el nivel del borde anterior del protocónido del m1 y por encima del forámen mentoniano.
Incisivos superiores delicados, ortodontes y de color amarillento anaranjado. Las descripciones de la estructura de los molares se basaron exclusivamente en ejemplares de edad 1 y 2. Longitud de serie molar intermedia para el género, con hipsodoncia bien desarrollada en comparación con los representantes del grupo boliviensis y sin alcanzar el grado observado en Akodon budini. Superficie oclusal de molares de tipo crestada (sensu Hershkovitz, 1962). M1 con procíngulo bien desarrollado y flexo anteromediano penetrante. Cónulos anterolabial y anterolingual subiguales. Cúspides principales del lado lingual dispuestas levemente por delante respecto de las del lado labial. Anterolofo-parastilo bien desarrollado que alcanza, en la mayoría de los ejemplares, el margen lateral del molar. Mesolofo de desarrollo variable; en algunos ejemplares se extiende casi hasta el margen del diente. Posterolofo casi completamente coalescente con metacono. Sin vestigios de protostilo aunque un enterolofo apenas insinuado constituye una muesca en el reborde de esmalte. Procíngulo del M2 escasamente desarrollado, con paraflexo visible aunque de menor desarrollo comparado con el del M1, y protoflexo apenas insinuado. Mesolofo de menor tamaño que el del M1 y posterolofo apenas visible, casi completamente unido al metacono. M3 con dos flexos labiales (paraflexo apenas desarrollado y un metaflexo bien desarrollado) y uno lingual (hipoflexo notorio). En algunos ejemplares el metaflexo forma una isla evidente. Procíngulo del m1 bien desarrollado con fléxido anteromediano penetrante y conúlidos anterolabial y anterolingual subiguales. Protostílido bien desarrollado y ectolófido (ectostílido) presente. Metastílido diminuto dispuesto en la base del metafléxido. Sobre la cara anterior del entocónido se observa un remanente del mesolófido y un mesostílido. Posterolófido alargado y posterofléxido penetrante. Longitud del m2 > 80% del m1. Procíngulo poco desarrollado reducido a un protostílido en el extremo anterolabial del molar. Protofléxido de desarrollo similar al del m1. Ectolófido (ectostílido) y mesolófido ausentes. El m3 con hipofléxido y mesofléxido bien desarrollados que dan al molar una forma de S. Protofléxido poco penetrante, enmarcado por un protostílido en el margen anterolabial del molar. Un remanente del posterofléxido forma una pequeña isla de esmalte en ejemplares juveniles.
Akodon sylvanus (n = 10) presenta 7 vértebras cervicales, 13 torácicas, 7 lumbares, un número variable de caudales (27-29) y 13 costillas.
Medidas: la morfometría comparada por clases de edades se resume en la Tabla 1.
Variaciones: los individuos de proximidades de la localidad tipo muestran una coloración general homogénea, con un castaño ocráceo más intenso en algunos ejemplares. La principal variación en la forma general del cráneo se observa entre individuos de distintas edades, con juveniles que presentan caja craneana proporcionalmente ancha y senos frontales y muesca cigomática menos desarrollados. El proceso hamular del escamoso es extremadamente delgado en algunos individuos e intermedio o relativamente grueso en otros. El borde anterior de la fosa mesopterigoidea puede ser redondeado o cuadrangular. La proyección capsular de la mandíbula varía ligeramente desde apenas un reborde hasta una leve protuberancia. Aunque en general la coloración del esmalte de la cara anterior de los incisivos superiores es amarillento anaranjado se observaron individuos en los que es amarillenta e incluso blanquecina.
Las muestras de río Las Capillas, El Simbolar y áreas próximas al Parque Nacional Baritú mantienen el patrón general de coloración aunque presentan tonalidades algo más intensas, con tintes rojizos. En comparación con la muestra cuasi-topotípica, los individuos de río Las Capillas presentan una fosa mesopterigoidea notoriamente ancha y con proceso palatino medio, mientras que algunos de los ejemplares de El Simbolar muestran esta fosa levemente más estrecha.
Comparaciones: ya que Akodon sylvanus spp. (incluyendo a A. pervalens) fueron considerados como sinónimos de A. azarae, resulta adecuado efectuar una comparación entre estos taxones. Fue Thomas (1921:184-185) al momento de describir A. sylvanus quien planteó su similitud con A. azarae, juicio que fue llevado al extremo por Cabrera (1961). Más allá de la variabilidad que ostenta A. azarae, con sus numerosas formas nominales (e.g., A. a. bibianae, A. a. arenicola), se distingue de A. sylvanus por una sumatoria de rasgos, entre otros: coloración dorsal agutí uniforme, cráneo delicado con arcos cigomáticos escasamente divergentes, placa cigomática ancha y rostro proporcionalmente corto, frontales de bordes suavemente redondeados y caja craneana globosa (Fig. 5). Los molares comparten con A. sylvanus su condición mesodonte. Métricamente, A. azarae es más pequeño que A. sylvanus en casi todas las medidas consideradas, particularmente en la longitud de la pata y oreja (Tabla 2). La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de A. azarae y A. sylvanus varía entre 8.5 y 8.9%.

Fig. 5. Vistas dorsal (superior) y ventral (inferior) del cráneo (de izquierda a derecha) de A. simulator (JPJ 1192), A. budini (JPJ 351), A. sylvanus (JPJ 580),
A. azarae (CNP 564), A. spegazzinii spegazzinii (JPJ 1205), A. boliviensis (JPJ 1330) y A. lutescens (JPJ 306). Escala = 10 mm.
Akodon pervalens -originalmente descripto como subespecie de A. sylvanus - es una forma notablemente más grande y robusta (Tabla 2 y Fig. 4). Aunque la piel de su holotipo es similar a la de los ejemplares cuasi-topotípicos de A. sylvanus, puede distinguirse por su cráneo, que presenta rostro y región interorbitaria anchos, arcos cigomáticos claramente más expandidos, fosa mesopterigoidea levemente más ancha y fosas parapterigoideas notoriamente más estrechas. Además, en vista dorsal la región interorbitaria presenta una forma de "reloj de arena" claramente menos divergente que en A. sylvanus. El holotipo y un ejemplar adicional de la serie tipo de A. pervalens muestran una tendencia a la proodoncia no observada en ninguno de los especímenes de A. sylvanus examinados.
Akodon sylvanus presenta un tamaño notablemente mayor que el de A. lutescens caenosus para todas las medidas estudiadas (Tabla 2, Figs. 2 y 5). Se diferencia de esta especie, además, por la coloración general levemente más oscura, olivácea y con menos contraste entre dorso y vientre; menor desarrollo del anillo periocular; cráneo más robusto con caja craneana más ancha y senos frontales más desarrollados; muescas cigomáticas más anchas y profundas y rostro notablemente más alargado. La fosa mesopterigoidea es más ancha y las parapterigoideas más profundas y expandidas. El tamaño del foramen oval es aproximadamente el doble que el observado en A. lutescens. Los incisivos superiores son ortodontes en A. sylvanus y claramente opistodontes en A. lutescens, en tanto que los molares de A. sylvanus son notoriamente más hipsodontes. La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de A. lutescens y A. sylvanus es de 6.8%.
Akodon spegazzinii tucumanensis es quizás el taxón que presenta mayor similitud morfológica con A. sylvanus, con una coloración general altamente variable que incluye ejemplares castaño amarillentos, rojizos e incluso casi negros. Para este rasgo, las poblaciones de A. s. tucumanensis prácticamente indistinguibles de A. sylvanus son aquellas de pastizales de altura. El anillo periocular y la mancha blanca en la quijada, menos desarrollados en A. sylvanus, pueden ayudar a distinguir externamente estas formas. Akodon sylvanus es, en promedio, mayor para casi todas las medidas analizadas (Tabla 2 y Fig. 2). Se destacan la longitud cóndilo-incisivo, del rostro y los nasales y, en menor medida, de las series dentarias superior e inferior. El ancho del rostro y la distancia entre los bordes externos de los cóndilos occipitales son también importantes en la distinción de ambas especies. A. sylvanus presenta muescas cigomáticas proporcionalmente menos desarrolladas; senos frontales más globosos; foramen oval más desarrollado; fosas parapterigoideas más excavadas, anchas y de márgenes externos que tienden a ser más convexos; foramen magnum notoriamente mayor. No obstante, es preciso destacar la gran variabilidad para todos estos caracteres en las distintas poblaciones de A. s. tucumanensis examinadas. La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de A. spegazzinii tucumanensis y A. sylvanus es de 5.0%.
Los ejemplares de A. spegazzinii spegazzinii son notablemente más claros, con una tonalidad amarillenta y en algunos ejemplares rojiza que contrasta con la coloración oscura de A. sylvanus. Akodon s. spegazzinii presenta, además, un anillo periocular bien desarrollado. Akodon sylvanus es algo mayor para casi todas las medidas analizadas (Tabla 2 y Fig. 2), sobre todo aquellas de longitud del cráneo tales como el rostro, nasales, diastema y forámenes incisivos. En contraste, en relación al tamaño del cráneo, el ancho de la placa cigomática, la longitud de la serie molar y el desarrollo de las muescas cigomáticas son mayores en A. s. spegazzinii. Esta forma también presenta un cráneo menos robusto, con caja craneana levemente menos globosa y rostro algo más corto. La fosa mesopterigoidea y la hipsodoncia están más desarrolladas en A. sylvanus (Fig. 5).
Akodon simulator presenta un patrón de coloración general muy diferente, con las regiones dorsal, lateral y ventral contrastantes. El dorso, sobre todo la región posterior, es ocráceo, los laterales grisáceos y el vientre blanquecino o anteado. Además, presenta una mancha blanca notable en la región de la garganta y quijada ausentes en A. sylvanus. Akodon simulator es una especie claramente mayor (Tabla 2), en particular para la longitud total del cráneo, longitud de la serie molar superior, ancho cigomático y del rostro. Contrariamente, A. simulator presenta bullas timpánicas proporcionalmente pequeñas (Fig. 5).
Akodon toba presenta un mayor contraste entre la coloración dorsal y ventral del cuerpo que A. sylvanus, con el vientre gris blanquecino o crema y pelos notoriamente más largos. Akodon toba es de mayor tamaño y presenta un cráneo fuertemente curvado, arcos cigomáticos bien desarrollados y expandidos, muescas cigomáticas profundas y anchas, rostro corto con respecto al tamaño del cráneo, región interorbitaria cuadrangular que puede presentar un reborde notorio, crestas mastoideas inusualmente bien desarrolladas y molares con escasa hipsodoncia. La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de A. toba y A. sylvanus es de 11.5 %.
Akodon budini presenta una coloración general similar a la de A. sylvanus, con escaso contraste entre el dorso y el vientre. Sin embargo, algunos ejemplares de A. budini presentan una mancha de color blanco en la zona de la garganta y mentón ausentes en A. sylvanus. El cráneo de A. budini es mayor para casi todas las medidas estudiadas (Tabla 2) con la caja craneana notoriamente más globosa y ancha, región interorbitaria relativamente más estrecha y una hipsodoncia claramente mayor (Fig. 5). La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de A. budini y A. sylvanus es de 11.6%.
Akodon sp. (= " A. boliviensis " de Córdoba, véase Polop, 1989) puede distinguirse de A. sylvanus por la coloración de la piel más clara y con tintes rojizos, tamaño general del cráneo más pequeño con perfil dorsal más curvado, caja craneana menos globosa, rostro más corto y menos aguzado, muescas cigomáticas mas anchas y profundas, entre otras características. La divergencia genética observada en haplotipos del gen del citocromo b recobrados en individuos de Akodon sp. y A. sylvanus es de 4.6%.
Distribución: la distribución conocida de A. sylvanus (excluyendo pervalens) estuvo durante décadas restringida a su localidad tipo (Thomas, 1921) y a un registro adicional para Bolivia (Pino, Tarija, véase Thomas, 1926; Anderson, 1997). Díaz (1999) fue el primer autor en reportar especímenes para una nueva localidad en la sierra de Santa Bárbara (Jujuy). Nuestra revisión de material depositado en colecciones reveló ejemplares de A. sylvanus en río Las Capillas, en el centro de la provincia de Jujuy y en numerosas localidades en los alrededores del Parque Nacional Baritú, en el norte de la provincia de Salta (Apéndices 1 y 2 y Fig. 6).

Fig. 6. Localidades de registro de Akodon sylvanus en Argentina. Para la referencia de los números, véase el Apéndice 2.
Hábitat: la mayoría de los registros provienen de la ecorregión de Las Yungas (sensu Burkart et al., 1999; véase Brown et al., 2001) y pastizales de neblina asociados a las mismas. Existen registros para la selva pedemontana, selva montana y área de transición de los bosques montanos con pastizales de neblina, con un rango altitudinal de 700 a 2300 m. Adicionalmente, se colectaron especímenes en pastizales asociados a ambientes de Chaco Serrano (sensu Burkart et al., 1999).
Historia natural: Akodon sylvanus ha sido registrada junto a otras 10 especies de sigmodontinos. En La Herradura, a pocos kilómetros de la localidad tipo y en pastizales asociados a ambientes chaqueños, fue documentada junto a Akodon lutescens, A. simulator, Oligoryzomys cf. O. flavescens, Oligoryzomys sp. y Oxymycterus paramensis. En zonas pedemontanas de Yungas, en los alrededores de la sierra de Santa Bárbara (e.g., Finca El Piquete), fue registrada en simpatría con A. simulator, Oligoryzomys cf. O. chacoensis, O. cf. O. flavescens, Oligoryzomys sp., Oryzomys legatus, Rhipidomys austrinus y Calomys fecundus. En selvas montanas del área de Baritú coexiste junto a A. simulator, Oligoryzomys sp., O. legatus y O. paramensis. Además, en la cumbre de la sierra del Centinela, en pastizales de neblina asociados a bosques montanos de Yungas, junto a A. sylvanus se capturaron Necromys lactens, O. cf. O. flavescens, O. paramensis y Phyllotis osilae nogalaris.
La mayor parte de los ejemplares de A. sylvanus capturados en invierno estuvieron reproductivamente inactivos mientras que a partir de fines de agosto y principios de setiembre se registraron los primeros individuos con signos de actividad.
Akodon sylvanus es una especie frecuentemente capturada en su área de distribución. Durante nuestras campañas esta especie representó el 40% de las capturas de sigmodontinos en La Herradura (n = 50 sigmodontinos capturados) y un 60% en sierra del Centinela (n = 46). Akodon sylvanus parece reemplazar, en el centro-norte de las Yungas de Argentina y ambientes asociados, a A. spegazzinii, especie dominante en numerosos ambientes del extremo sur de la región, cuyos registros más septentrionales se encuentran en la sierra de Metán, centro de la provincia de Salta.
DISCUSIÓN
La historia taxonómica de A. sylvanus es ciertamente caótica cuando se pondera la cantidad de formas nominales intervinientes (azarae, hunteri, serrensis, varius, cursor) y las opiniones controvertidas de los diversos autores. La mayor parte de estos juicios taxonómicos no fueron generados en el marco de estudios detallados. Más aún, hasta este trabajo A. sylvanus no había sido incluido en análisis filogenético alguno.
Los análisis morfológicos, morfométricos y filogenéticos llevados a cabo indican que A. sylvanus es un taxón distinguible del resto de las especies del género, por lo que debe ser considerado como especie válida. En contraste con la opinión de Cabrera (1961), A. sylvanus no se relaciona con A. azarae, de la cual es además marcadamente diferente a nivel morfológico y genético (8.5-8.9% de divergencia observada). A pesar de que el material de A. pervalens examinado es escaso (Apéndice 1) y que este taxón no fue incluido en el análisis filogenético, los rasgos morfológicos y medidas apoyan su clara separación de A. sylvanus. En ningún ejemplar de la serie examinada de A. sylvanus descriptores tales como la longitud total del cráneo, el ancho cigomático y la longitud de forámenes incisivos alcanzan los valores observados en A. pervalens (cf. Thomas, 1925). La consideración de A. pervalens como especie plena -sostenida por algunos autores (Myers, 1989; Anderson, 1997; Díaz, 1999)- y la evaluación de sus relaciones filogenéticas, requiere de estudios más profundos que incluyan nuevo material topotípico.
El análisis filogenético efectuado indica que A. sylvanus pertenece al grupo de especies de A. boliviensis (sensu Smith y Patton, 2007; ver también Myers et al., 1990), en donde Akodon sp. resulta la especie hermana. Ambas especies muestran una divergencia genética observada de 4.6%, valor que corresponde al promedio de las comparaciones entre pares de especies hermanas del género Akodon (4.4%, n = 11). Al mismo tiempo, la distinción a nivel específico entre estas dos especies encuentra sustento adicional en diferencias morfológicas claras ya referidas previamente. Akodon sp. es una forma dominante en los pastizales de altura (> 1000 m) de las sierras Grande, Comechingones y aledañas (Córdoba y San Luis; Polop, 1989), tradicionalmente citada como A. boliviensis (e. g., Pinna Senn et al., 1992). Se necesitan estudios adicionales para esclarecer los límites de las especies del grupo de A. boliviensis, así como los procesos involucrados en la radiación de las mismas.
Como ha ocurrido con numerosas especies de sigmodontinos, el estatus taxonómico incierto y la falta de descripciones detalladas han impedido una correcta determinación de los ejemplares y propiciado errores en las distribuciones inferidas. Así, numerosos ejemplares de A. sylvanus fueron previamente determinados como A. budini por Díaz (1999) para la provincia de Jujuy (véase Apéndice 1). Estos especímenes carecen de los rasgos característicos de A. budini como ser una caja craneana y fosa mesopterigoidea anchas, marcada hipsodoncia y serie molar superior extensa. Otros especímenes de la provincia de Salta asignados a A. spegazzinii por Díaz et al. (2000) y Gil y Heinonen (2003) corresponden, en realidad, a A. sylvanus en virtud de su mayor tamaño, rostro relativamente robusto y fosa mesopterigoidea más ancha, entre otros caracteres (véase Apéndice 1). Nuestros estudios indican que A. sylvanus estaría restringido a los sectores centro y norte de las Yungas de Argentina habitando en todos los pisos altitudinales, en tanto que A. spegazzinii se encontraría en el centro-sur de la región noroeste, sin que se haya registrado hasta el momento un área de contacto entre ambas. La distribución de A. sylvanus en Bolivia, reseñada por Anderson (1997) bajo A. pervalens, debe estudiarse nuevamente a base de un análisis de los ejemplares depositados en colecciones.
Por último cabe mencionar que el estatus taxonómico de numerosas especies de sigmodontinos del noroeste argentino es aún incierto, lo que ha impedido conocer gran parte de su biología e historia natural. Formas nominales como Akodon alterus Thomas, A. leucolimnaeus Cabrera, A. orbus Thomas, Bolomys negrito Thomas, Graomys edithae Thomas, Oxymycterus akodontius Thomas, Reithrodon caurinus Thomas, entre otras, son sólo conocidas por escasos o únicos ejemplares, persistiendo sus estatus taxonómicos conflictivos. Ya en el nuevo milenio, los estudios que incluyan revisiones morfológicas y genéticas con series topotípicas serán piedras angulares para demarcar la real diversidad de este importante grupo de roedores.
Especímenes estudiados
Todos los ejemplares fueron utilizados en las comparaciones de la morfología cualitativa; aquellos empleados en análisis morfométricos se señalan con un asterisco; aquellos utilizados en el análisis molecular están seguidos del correspondiente número de acceso a GENBANK. Las siglas de museos, colecciones y catálogos de campo personales, son los siguientes: CBF, Colección Boliviana de Fauna, La Paz, Bolivia; CML, Colección de Mamíferos Lillo, Universidad Nacional de Tucumán, Tucumán, Argentina; CNP, Colección de Mamíferos del Centro Nacional Patagónico, Puerto Madryn, Chubut, Argentina; JPJ, catálogo de campo de Jorge P. Jayat (ejemplares a ser depositados en la CML); MACN, Museo Argentino de Ciencias Naturales "Bernardino Rivadavia", Buenos Aires, Argentina; MLP, Museo de La Plata, La Plata, Argentina; MMPMa, Museo de Ciencias Naturales y Tradicional de Mar del Plata "Lorenzo Scaglia", Mar del Plata, Argentina; UMMZ, University of Michigan, Museum of Zoology, Ann Arbor; UNRC, Colección de Mamíferos de la Universidad Nacional de Río Cuarto, Río Cuarto, Córdoba, Argentina. Akodon aerosus (1).-PERU: CUZCO: 72 km NE Paucartambo (MVZ 171679: M35703).
Akodon aerosus baliolus (1).-PERU: CUZCO: Puno: 4 km NNE Ollachea (MVZ 172818: M35704).
Akodon aff. A. cursor (1).-BRASIL: BAHIA: Estação Experimental Djalma Bahia (EDH 30: AF184053).
Akodon affinis (1).-COLOMBIA: Risaralda: Corregimiento La Florida (ICN 16547: AY196164).
Akodon albiventer (1).-CHILE: Tarapacá: Parinacota (FMNH 129978: AY494838).
Akodon azarae (68).-ARGENTINA: BUENOS AIRES: La Balandra (MLP 8.VIII.00.7*, 8.VIII.00.11*, 8.VIII.00.12*), Monte Veloz (MLP 15.V.97.03*, 15.V.97.04*, 15.V.97.05*, 15.V.97.07*, 15.V.97.10*, 15.V.97.15*, 15.V.97.28*, 15.V.97.38*), Punta Lara (MLP 5.VI.00.5*, 10.VIII.00.6*, 9.VI.99.5*, 9.VI.99.2*, 9.VI.99.4*), Punta Piedras (MLP 3.IX.01.19*, 10.IX.01.3*), Punta Indio (CNP 751: AY702963), Sierra de la Ventana (MLP 5.II.96.40*, 5.II.96.73*, 5.II.96.41*, 5.II.92.10*, 16.V.01.5*, 14.IX.99.70*, 5.II.96.30*, 5.II.96.34*. 5.II.96.38*, 14.IX.99.72*), La Matanza (UMMZ 110445*), Hurlingham (UMMZ 109223*, 111009*), Ciudad de Buenos Aires (UMMZ 111010*), Hudson (MLP 8.IV.97.47*, 8.IV.97.46*), Monte Veloz (MLP 15.V.97.1*, 15.V.97.2*, 15.V.97.4*, 15.V.97.5*, 15.V.97.6*, 15.V.97.7*, 15.V.97.9*, 15.V.97.10*, 15.V.97.11*, 15.V.97.15*, 15.V.97.18*, 15.V.97.21*, 15.V.97.22*, 15.V.97.24*, 15.V.97.25*, 15.V.97.37*, 15.V.97.38*, 15.V.97.39*, 15.V.97.40*). ENTRE RÍOS: arroyo Perucho Verna (MLP 7.IV.99.10*, 7.IV.99.11*, 8.V.00.3*, 8.V.00.4*, 8.V.00.6*, 8.V.00.8*, 11.VIII.99.22*), Paraná (MACN 14906*), San Pascual (MLP 27.XII.01.30*), Paraná (MACN 17788*, 18594*). FORMOSA: 17 km O Mayor Villafañe (CNP 564). PARAGUAY: PARAGUARI (GD 264: DQ444328). URUGUAY: San José: Kiyu (GD 327: AY702964).
Akodon boliviensis (14).-ARGENTINA: SALTA: 1 km ENE de Rodeo Pampa, km 59 de Ruta Provincial Nº 7, 3080 m (JPJ 1330); aprox. 15 km al W de Escoipe, sobre Ruta Provincial Nº 33, 2680 m (JPJ 53*, 54*, 55*, 58*, 59*, 69*, 77*, 1042*); Azul Cuesta, aprox. 9 km al S de Nazareno, 3286 m (JPJ 673). BOLIVIA: LA PAZ: Mecapaca (CBF 537, 539, 638*). PERU: Puno: 12 km S Santa Rosa (MVZ 171607: M35691).
Akodon budini (64).-ARGENTINA: JUJUY: a 4 km al N de Tiraxi, sobre Río Tesorero, ruta 29 (CML 4613); a 11 km de San Antonio, Cerro El Morado (CML 4605-4608, 4611); Abra de Cañas, El Monolito, 1700 m (CML 1789-1794, 1796, 1798-1802, 1806-1808); Abra de Cañas, El Monolito, 1707 m (CML 1775, 1776); Arroyo La Horqueta, 3 km al SE de las Lagunas de Yala (CML 4603); Cerro Morado, sobre Río Morado, 11 km al NW de San Antonio (CML 4604); El Duraznillo, Cerro Calilegua, 2600 m (CML 1738-1741, 1743-1751); León (MMPMa 2192* y 10 ejemplares s/n); León, Arroyo La Tablada (MMPMa 1245*, 1251*, 1258, 1260*); Tiraxi, ruta 29, sobre Río Tiraxi (CML 4612). SALTA: Los Helechos, P. N. Baritú, Fca. Jakulica, 1200 m (MACN 20666); PN Baritú, angosto Río Baritú, 1600 m (CML 5532; MACN 20662); PN Baritú, Fca. Jakulica, Los Helechos, 1200 km (CML 5524, 5526); PN Baritú, Fca. Jakulica, Sierra Las Pavas (CML 5529); P. N. Baritú, Sierra de Las Pavas, Fca. Jakulica, 1200 m (MACN 20667); Pampa Verde, aprox. 8 km al OSO de Los Toldos y al S del Cerro Bravo, 2400 m (JPJ 336*, 351*, JPJ 368: EF166037).
Akodon dayi (1).-BOLIVIA: SANTA CRUZ: Parque Nacional Noël Kempff Mercado (LHE 1268: AY605059).
Akodon cursor (1).-BRASIL: Saõ Paulo: Ilha do Cardoso (FMNH 141604: AF184052).
Akodon dolores (1).-ARGENTINA: SAN LUIS: Papagayos (UP PY16: AY273904).
Akodon fumeus (1).-BOLIVIA: Chuquisaca: Rinconada del Bufete, (LHE 1262:AY605061)
Akodon iniscatus (1).-ARGENTINA: Río Negro: 10 km S Comallo (MVZ 182655: AY273917)
Akodon iniscatus nucus (1).-ARGENTINA: Neuquén, Estáncia La Porteña (UP 442: AY605062).
Akodon juninensis (1).-Peru: JUNIN: 22 km N La Oroya (MVZ 173038: M35698).
Akodon kofordi (1).-PERU: PUNO: Agualani (MVZ 171665: M35697).
Akodon lindberghi (5).--BRASIL: Minas Gerais (MN 48026: AF184057).
Akodon lutescens (71).-- Argentina: CATAMARCA: 6 km SW of hwy 9 on hwy 18, el. 5000' (CML 3304); aprox. 2 km al SE de Huaico Hondo, sobre Ruta Provincial Nº 42, al E del Portezuelo, 1992 m (JPJ 398, 400, 414); Las Chacritas, aprox. 28 km al NNW de Singuil, sobre Ruta Provincial Nº 1, 1888 m (JPJ 517*, 533*, 542*). JUJUY: a 11 km de San Antonio, sobre Río Morado, Cerro El Morado (CML 4620-4622); arroyo La Horqueta, 6 km al SE de las lagunas de Yala (CML 4958); Bárcena, aprox. 3 km al S, sobre Ruta Nacional Nº 9, 1808 m (JPJ 623*, 628*, 635*, 642*, 648*, 654*, 656*, 666*); Cerro Morado, sobre Río Morado, 11 km al NW de San Antonio (CML 4626, 4959, 4960); El Duraznillo, Cerro Calilegua, 2600 m (CML 1734); La Herradura, 12 km al SW de El Fuerte, sobre Ruta Provincial Nº 6, 1428 m (JPJ 574*, 579*, 581*, 583*, 585*, 601*, 603*, 609*); León, Arroyo La Tablada (MMPMa 1241*, 1243*, 1254*); Termas de Reyes, aprox. 15 km al N, sobre Ruta Provincial Nº 4 (JPJ 310*, 313*, 314*, 328*, 331*, 332*); Termas de Reyes, mirador, sobre Ruta Provincial Nº 4 (JPJ 127*, 299*, 306*, 320*); Tiraxi, 1.5 km al E, sobre ruta 29 (CML 4972-4974); Tiraxi, ruta 29, sobre Río Tiraxi (CML 4627, 4961, 4962-4966, 4968, 4969). SALTA: 1 km ENE de Rodeo Pampa, km 59 de Ruta Provincial Nº 7, 3080 m (JPJ 1321*, 1322*); Campo Quijano (MACN 17492); Pampa Verde, aprox. 8 km al OSO de Los Toldos y al S del Cerro Bravo, 2400 m (JPJ 339*, 346*, 350*, 359*, 360*, 364*, 366*); aprox. 10 km al S de Hualinchay, sobre el camino a Lara, 2300 m (JPJ 492); Hualinchay, sobre el camino a Cafayate, 1861 (JPJ 179*, 196*). PERU: PUNO: 12 km S Santa Rosa (MVZ 171612: M35693).
Akodon mimus (1).-PERU: PUNO: 14 km W Yanahuaya (MVZ 171752: M35710).
Akodon molinae (1).-ARGENTINA (AK 222: AY494839).
Akodon mollis (1).-PERU: PIURA: "Machete" on Zapalache Carmen trail (LSUMZ 27007: U03546).
Akodon montensis (46).- PARAGUAY: CORDILLERA: Minas Cue (UMMZ 174969: AY195864).
Akodon mystax (1).-BRASIL: Río de Janeiro (MN 48041).
Akodon orophilus (1).-PERU: JUNIN: 16 km NNE Palca (MVZ 173057: M35699).
Akodon paranaensis (1).--BRASIL: Río Grande do Sul: Venancio Aires (CIT 1131: AY195866).
Akodon pervalens (2).-BOLIVIA: TARIJA: Caraparí, 1000 m (BMNH 25.2.1.55, holotipo; 25.2.1.56, paratipo).
Akodon simulator (117).-ARGENTINA: CATAMARCA: Agua del Gauchi, aprox. 1 km al E del Mogote Los Cocos, 2024 m (JPJ 1278*, 1303*); El Alamito, Campo del Pucará (CML 4633, 4634); El Rodeo, 0.5 km W of Hwy 4, el. 4500 ft. (CML 3365, 3366, 3369, 3370); Junta Suma, Las Estancias (CML 1755); Mogote Las Trampas, aprox. 15 km al NW de Chumbicha, 2300 m (JPJ 1418); unión entre las rutas provinciales Nº 9 y 18, 3.4 km al S, sobre Ruta Provincial Nº 18, 1529 m (JPJ 27*, 1128*). JUJUY: 12 km W de Fraile Pintado, sobre Río Ledesma (CML 4854); 2.5 km W El Bananal, 437 m (CML 4900-4906); a 11 km NW de San Antonio, sobre Río Morado, Cerro El Morado (CML 4635-4637); a 2.5 km del Arroyo Santa Rita, sobre camino a El Fuerte (CML 2040); Abra de Santa Laura, sobre Ruta Nacional N°9, 1397 m (CML 4887-4891, 4893); Arroyo El Cano, a 7 km del río El Saladillo (CML 4862); Cerro Morado, sobre Río Morado, 11 km al NW de San Antonio (CML 4638-4651); El simbolar, 25 km al SW de Palma Sola (CML 1992, 1993, 2020, 2022-2024, 2044); La Herradura, 12 km al SW de El Fuerte, sobre Ruta Provincial Nº 6, 1428 m (JPJ 608*); Laguna La Brea (CML 4855-4859); Laguna La Brea, sobre ruta 1, 3 km de Las Siete Aguas (CML 4860, 4861); límite entre Salta y Jujuy, Abra de Santa Laura, sobre Ruta Nacional 9 (CML 4894); Parque Nacional Calilegua, bomba de YPF, en las márgenes del Arroyo Sauzalito (CML 2934, 2935); Río Blanco, aprox. 9 km al E de San Antonio, sobre Río Blanco (CML 4895-4897); ruta 83, camino a Valle Grande, 9 km al N de San Francisco (CML 3747-3750); Yuto, INTA, 400 m (CML 4899). LA RIOJA: Cuesta La Cébila, a km de Chumbicha, sobre ruta 60 (CML 3751-3755). SALTA: 1° angosto río Pescado, finca Jakulica, 650 m (MACN 20681); 27 km al O de Aguas Blancas (MACN 17517, 17535); Aguaray (MACN 3223); Aguaray, 600 m (MACN 3226, 3227); Aguaray. FCCNA, 700 m (MACN 30311, 30312); aprox. 21 km (por ruta) al WNW de Vespucio, sobre el Río Seco, 532 m (JPJ 1495*, 1506*, 1510*); Cafayate (CML 852, 853); Campo Quijano (MACN 17504, 17505, 17518); Campo Quijano aprox. 5 Km al NO, Km 30 de la ruta Nacional 51 (Quebrada del Toro), alt. aprox. 1600 m (JPJ 109*); cerro Chaguar, snias. del Porongal, 1200 m (MACN 20687); cerro Chaguar, snias. Porongal, 1250 m (MACN 20688); desembocadura Arroyo Santelmita, 700 m (MACN 20690); El Corralito,aprox. 23 Km al SO de Campo Quijano, sobre ruta Nac. Nº 51 (JPJ 147*, 148*); Embarcación (MACN 16439); Finca Falcón, aprox. 3 km al NW del pozo de agua N° 5, cercanías del Río Seco, 704 m (JPJ 1396*); finca Jakulica, 1° angosto río Pescado, 650 m (MACN 20679, 20680); finca Jakulica, 2° angosto río Pescado, 650 m (MACN 20686); finca Jakulica, casa vialidad, Río Pescado, 658 m (MACN 20685); finca Jakulica, srras. de Las Pavas, cerca angosto río Pescado, 650 m (MACN 20682); Metán, El Desmonte (MACN 30369); Metán, El Desmonte, 500 m (MACN 30370); nacimiento Quebrada Santa Rosa, 950 m (MACN 20689); P. N. Baritú, Las Juntas Lipeo-Bermejo (MACN 20678). TUCUMAN: a 15 km de San Pedro de Colalao, sobre ruta hacia Hualinchay (CML 6107); aprox. 10 km al S de Hualinchay, sobre el camino a Lara, 2300 m (JPJ 437*); Hualinchay, sobre el camino a Cafayate, 1861 (JPJ 174*, 234*); Villa Nougues, aprox. 2 km al N, sobre Ruta Provincial Nº 338, a la altura de la antena repetidora del Canal 10 de televisión (JPJ 265*, 266*, 280*, 288*).
Akodon philipmyersi (1).-ARGENTINA: MISIONES: Estancia Santa Inés (CNP 739: AY702965).
Akodon reigi (1).-URUGUAY: LAVALLEJA: Paso Averías (MNHN 3682: AY195865).
Akodon siberiae (1).-BOLIVIA (NK 12801: AY273909).
Akodon sp. (7).-ARGENTINA: Córdoba: Pampa de Achala (UP AC008: AY196165, UNRC 2805, 10145, 10178, 50151). SAN LUIS: Cerro de Oro (UNRC 8270, 8680).
Akodon spegazzinii (50).-ARGENTINA: CATAMARCA: Agua del Gauchi, aprox. 1 km al E del Mogote Los Cocos, 2024 m (JPJ 1236*, 1256*, 1290*); aprox. 10 km al E de Los Varela, sobre Ruta Provincial Nº 4, Sierra de Humaya, 2006 m (JPJ 1308); Las Chacritas, aprox. 28 km al NNW de Singuil, sobre Ruta Provincial Nº 1, 1888 m (JPJ 521*, 528*, 534*, 537*, 544*, 545* 546*, 555*, 561*); Loma Atravezada, aprox. 3 km al NO del puesto de Leandro Vega, NO de Chumbicha (JPJ 1158*, 1160*, 1161*, 1163*, 1164*, 1165*, 1166*, 1171*). TUCUMAN: aprox. 7 km al NO de la finca de la familia Usandivara, Altos de Medina, 1717 m (JPJ 809*, 812*, 815*, 817*, 819*, 821*, 822*, 825*, 828*, 830*, 838*, 840*, 842*, 843*, 844*, 846*, 847*, 850*); aprox. 16 km de Hualinchay, sobre el camino a Lara, 2750 m (JPJ 744*); ruta 307, km 72 (MMPMa 2381, 2384*, 2395); Sobre ruta 307, km 72 (MMPMa 2383*, 2386*, 2388*, 2393); Tafí del Valle (CML 2058, 2061); Tafí del Valle, 2500 m (CML 934).
Akodon spegazzinii spegazzinii (49).-ARGENTINA: SALTA: aprox. 15 km al W de Escoipe, sobre Ruta Provincial Nº 33, 2680 m (JPJ 56*, 76*, 80*, 88*, 1035*, 1038*, 1044*, 1046*, 1047*, 1049*, 1050*, 1058*); aprox. 2 km al NNE de Cachi Adentro, sobre el camino a Las Pailas, 2567 m (JPJ 1199*, 1205*); Cachi Adentro, sobre Río Cachi, 2490 m (JPJ 1194*); Cuesta del Obispo, aprox. 5 km al NE de Piedra del Molino, sobre Ruta Provincial Nº 33, 3174 m (JPJ 1211). TUCUMAN: Camino a Amaicha, km 83 (CML 698*, 701*, 710*); Camino a Amaicha, Ruta Provincial 307, km 83 (CML 697*); Carapunco, km 81 de la Ruta Provincial N° 307, 2960 m (JPJ 1065*, 1066*, 1076*, 1077*, 1079*, 1081*, 1088*, 1089*, 1090*, 1091*, 1092*); Cerro Muñoz (CML 669, 1928); El Infiernillo (MMPMa 2374*, 2378*, 2379*, 2380, 2382, 2385*, 2390*, 2392*, 2394*); El Infiernillo, 3000 m (CML 691*); Infiernillo, 3000 m (CML 692); Ruta 307, km 84, 3000 m (El Infiernillo) (CML 4630-4632); Ruta 307, km 84, 3000 m, El Infiernillo (CML 3773); Tafí del Valle, km 83, 2900 m (CML 1837).
Akodon spegazzinii tucumanensis (156).-ARGENTINA: CATAMARCA: aprox. 2 km al SE de Huaico Hondo, sobre Ruta Provincial Nº 42, al E del Portezuelo, 1992 m (JPJ 406*, 410*, 427*, 786*, 794*, 800*, 806*); Cuesta del Clavillo, 5 km al SW de la banderita (CML 4956, 4957, 4064, 4065); unión entre las rutas provinciales Nº 9 y 18, 3,4 km al S, sobre Ruta Provincial Nº 18, 1529 m (JPJ 1121*, 1125*, 1135*, 1141*, 1155*). TUCUMAN: aprox. 10 km al S de Hualinchay, sobre el camino a Lara, 2300 m (JPJ 448*, 479*, 484*, 486*, 500*, 755*, 759*, 972*); Cumbre del Taficillo, al NE de Las Agüitas, Parque Biológico Sierra de San Javier (JPJ 115*); Cumbre del Taficillo, Las Agüitas, Parque Biológico Sierra de San Javier (CML 4038*, 4041); Dique Escaba, 500 m al N, por ruta 358 (CML 4976, 4977); Dique San Ignacio (CML 2896); Horco Molle (CML 2815); Hualinchay, sobre el camino a Cafayate, 1861 (JPJ 157*, 160*, 226*, 248*); La Aguadita (CML 4941-4944); La Cruz, Cumbre del Taficillo, Parque Biológico Sierra de San Javier, 1907 m (JPJ 856*, 857*, 858*, 859*, 860*, 861*,862*, 863*, 864*, 865*, 866*, 867*, 868*, 869*, 871*, 872*, 873*, 874*, 875*, 876*, 877*, 878*, 879*, 880*, 881*, 882*, 883*, 884*, 885*, 886*, 887*, 888*, 889*, 890*, 891*, 892*, 893*, 895*, 896*, 867*, 898*, 899*, 900*, 901*, 902*, 903*, 904*, 905*, 906*, 907*, 908*, 909*, 910*, 912*, 913*, 914*, 915*, 916*, 917*, 918*, 919*); La Florida (Reserva)- Pueblo Viejo (CML 6090*); Las Agüitas, cumbre del Taficillo (CML 4018*, 4022*, 4023*, 4025*, 4027*, 4028*, 4029*, 4031, 4033*, 4034*, 4035, 4037, 4040; 4042); Parque Biológico Sierra de San Javier, área de la Residencia Universitaria, a metros del Laboratorio de Investigaciones Ecológicas de Las Yungas (LIEY) (JPJ 1190* DQ683182); Piedras Coloradas, sobre ruta 307, km 21 (CML 4108); Quebrada Cainzo (CML 1630); Reserva la Florida, 7 km al O. de Ibatín, sobre Río Pueblo Viejo (CML 5007*, 5009*, 5010*); Reserva La Florida, Pueblo Viejo (CML 6089*); Reserva Provincial Aguas Chiquitas (CML 4989); Reserva Provincial Aguas Chiquitas (El Cadillal) (CML 6009, 6011, 6016); Reserva Provincial Aguas Chiquitas, Arroyo Aguas Chiquitas (CML 4988, 4990); Reserva Provincial Aguas Chiquitas, El Cadillal (CML 4884, 4982, 4983, 4985, 4986); Reserva Provincial Los Sosa, El Indio, Río Los Sosa, Ruta 307 (CML 6039, 6040, 6042); Reserva Provincial Santa Ana, sobre Río El Saltón (CML 6030, 6047, 6068, 6070*, 6072*, 6074, 6078, 6081); Villa Nougues, aprox. 2 km al N, sobre Ruta Provincial Nº 338, a la altura de la antena repetidora del Canal 10 de televisión (JPJ 257*, 261*, 263*, 264*, 267*, 269*, 270*, 272*, 273*, 281*, 283*, 284*, 285*).
Akodon sylvanus (93).-ARGENTINA: JUJUY: a 2.5 km del Arroyo Santa Rita, sobre camino a El Fuerte (CML 2039); El Simbolar, 25 km al SW de Palma Sola (CML 1985, 1987*, 1988, 1990*, 1991*, 1996, 2027*, 2028, 2029*, 2031, 2032*, 2035*, 2099*, 2100*, 2101*, 2103*, 2110*, 2111*, 2112*); Finca El Piquete, márgenes del Río Volcán, aprox. a 5 km del cruce del Río Tamango y la senda maderera, 973 m (JPJ 1107, 1110); La Antena, Sierra del Centinela, al S de El Fuerte, 2350 m (JPJ 925* DQ683181, 926*, 927*, 928*, 929*, 930*, 931*, 932*, 934*, 935*, 937*, 938*, 939*, 941*, 943*, 944*, 945*, 946*, 947*, 948*, 949*, 950*, 951*, 959*, 960*, 963*, 968*); La Herradura, 12 km al SW de El Fuerte, sobre Ruta Provincial Nº 6, 1428 m (JPJ 576*, 577*, 578*, 580*, 584*, 586*, 589*, 590* DQ683180, 592*, 593*, 594*, 596*, 600*, 602*, 604*, 605*, 611*, 615*); Río Las Capillas, 15 km al N de Las Capillas, por ruta 20 (CML 5034*, 5036*, 5037*, 5038*, 5039*, 5040, 5041*, 5042); Sierra de Santa Barbara, S.E. Jujuy. Type from Sunchal, 1200 m (BMNH 21.1.1.27, holotipo). SALTA: finca Jakulica, Sierra de Las Pavas (CML 5522*); Parque Nacional Baritú, angosto Río Baritú, 1600 m (CML 5516, 5534*; MACN 20663, 20664); Parque Nacional Baritú, Arroyo Santa Rosa, 900 m (MACN 20671); Parque Nacional Baritú, Baritú, 1600 m (CML 5539*); Parque Nacional Baritú, boca Arroyo Santelmita (MACN 20673); Parque Nacional Baritú, cerro Chaguar, 1200 m (MACN 20669); Parque Nacional Baritú, Las Pavas, 1° angosto Río Pescado, finca Jakulica, 1200 m (MACN 20665); Parque Nacional Baritú, naciente Arroyo Santa Rosa, 900 m (CML 5535*); Parque Nacional Baritú, nacientes Arroyo Santelmita (MACN 20670); Parque Nacional Baritú, nacientes Arroyo Santelmita, 900 m (MACN 20668); Parque Nacional Baritú, nacientes del Arroyo Santelmita, 900 m (CML 5512*, 5533*); Sierra Las Pavas, vencindades de Finca Jakulica (CML 5536*); Vado de Arrazayal (CML 1071*).
Akodon subfuscus (1).-PERU: Arequipa: 15 km S Callalli (MVZ 174109: M35695).
Akodon toba: (6).-ARGENTINA: SALTA: Los Colorados, 17 km al E de Santo Domingo (CML 3017-3020, 5192). PARAGUAY: Presidente Hayes: 9 km NE Juan de Zalazar (UMMZ 133965: U03527).
Akodon torques (1).-PERU: Cuzco: 32 km NE Paucartambo (MVZ 17120: M35700).
Akodon varius (3).-BOLIVIA: COCHABAMBA: 1.3 km al W Jamachuma, 2800 m (CBF 3490, 3601, 3609).
Deltamys kempi (1).-URUGUAY: San José: Ruta 1 sobre Arroyo Cufre (MNHN 4151: AY195862).
Necromys obscurus (1).-URUGUAY: San José: El Relincho (EV 1028: DQ683183)
Ejemplares reidentificados en este trabajo como A. sylvanus
CML 2039 identificado como A. fumeus y CML 5034 y 5036-5042 como A. budini por Díaz (1999). CML 5512, 5516, 5522, 5533-5536 y 5539 identificados por Díaz et al. (2000) como A. s. spegazzinii. CML 5512, 5516, 5522, 5533-5536 y 5539 y MACN 20663-20665, 20668-20671 y 20673 identificados por Gil y Heinonen (2003) como A. spegazzinii.
Lista de localidades de registro de A. sylvanus en Argentina; se indica nombre de la localidad, altitud (cuando está disponible el dato), provincia y departamento (ambos entre paréntesis) y coordenadas geográficas en formato decimal y 5 decimales de precisión (tomadas con GPS u obtenidas con la herramienta hawths tools de ArcGis [v.9]). Los números corresponden a los empleados en la Fig. 6.
1. 2.5 km del arroyo Santa Rita, sobre camino a El Fuerte (Jujuy, Santa Bárbara) 24.25791° S, 64.41958° W.
2. El Simbolar, 25 km al SW de Palma Sola (Jujuy, Santa Bárbara) 24.14291° S, 64.40458° W.
3. Finca El Piquete, márgenes del Río Volcán, app. A 5 km del cruce del Río Tamango y la senda maderera, 973 m (Jujuy, Santa Bárbara) 24.18564° S, 64.55949° W.
4. Finca Jakulica, Sierra de Las Pavas (Salta, Santa Victoria) 22.66875° S, 64.57541° W.
5. La Antena, Sierra del Centinela, al S de El Fuerte, 2350 m (Jujuy, Santa Bárbara) 24.29901° S, 64.38591° W.
6. La Herradura, 12 km al SW de El Fuerte, sobre Ruta Provincial Nº 6, 1428 m (Jujuy, Santa Bárbara) 24.30158° S, 64.49408° W.
7. Parque Nacional Baritú, angosto Río Baritú, 1600 m (Salta, Santa Victoria) 22.50708° S, 64.75958° W.
8. Parque Nacional Baritú, arroyo Santa Rosa, 900 m (Salta, Santa Victoria) 22.57791° S, 64.59875° W.
9. Parque Nacional Baritú, boca arroyo Santelmita (Salta, Santa Victoria) 22.51708° S, 64.59875° W.
10. Parque Nacional Baritú, cerro Chaguar, 1200 m (Salta, Santa Victoria) 22.55708° S, 64.59291° W.
11. Parque Nacional Baritú, Las Pavas, 1° angosto Río Pescado, finca Jakulica, 1200 m (Salta, Santa Victoria) 22.66958° S, 64.56458° W.
12. Parque Nacional Baritú, nacientes arroyo Santelmita (Salta, Santa Victoria) 22.56125° S, 64.61041° W.
13. Río Las Capillas, 15 km al N de Las Capillas, por ruta 20 (Jujuy, Dr. Manuel Belgrano) 24.02958° S, 65.10375° W.
14. "Sunchal, 1200 m " (Jujuy, Santa Bárbara) 24.25208° S, 64.44708° W. Localidad tipo.
15. Vado de Arrayasal (Salta, Orán) 22.68300° S, 64.60000° W.
AGRADECIMIENTOS
D. Miotti, Z. Juri y S. Zamora participaron en los trabajos de campo. J. Vargas (CBF), R. Barquez (CML), O. Vaccaro y E. Varela (MACN), O. Scaglia y D. Romero (MMPMa) y J. Polop y M. Torres (UNRC) permitieron el acceso a los repositorios consultados. R. Harbord, D. Hathaway, P. Jenkins y R. Calvocoressi facilitaron para su estudio y publicación las figuras de los holotipos de A. sylvanus y A. pervalens conservados en el BMNH. Este trabajo se llevó a cabo con el apoyo institucional del laboratorio de Investigaciones Ecológicas de las Yungas (LIEY) y fue parcialmente solventado con subsidios otorgados por la Fundación Proyungas, el Consejo de Investigaciones de la Universidad Nacional de Tucumán (CIUNT) y fondos aportados por el Consejo de Investigaciones Científicas y Tecnológicas (CONICET).
LITERATURA CITADA
ABDALA F y MM DÍAZ. 2000. Anatomía craneana de Akodon albiventer (Rodentia, Muridae, Sigmodontinae). Iheringia, Sér. Zool. 88:33-50. [ Links ]
ANDERSON S. 1997. Mammals of Bolivia, taxonomy and distribution. Bulletin of the American Museum of Natural History 231:652 pp. [ Links ]
BARQUEZ RM, DF WILLIAMS, MA MARES y HH GENOWAYS. 1980. Kariology and morphometrics of three species of Akodon (Mammalia: Muridae) from northwestern Argentina. Annals of Carnegie Museum 49:379-403. [ Links ]
BIANCHI NO, OA REIG, OJ MOLINA y FN DULOUT. 1971. Cytogenetics of the South American Akodont rodents (Cricetidae). I. A progress report of Argentinian and Venezuelan forms. Evolution 25:724-736. [ Links ]
BLAUSTEIN SA, RC LIASCOVICH, LI APFELBAUM, LD ALEFFE, RM BARQUEZ y OA REIG. 1992. Correlates of systematic differentiation between two closely related allopatric populations of the Akodon boliviensis group from NW Argentina (Rodentia: Cricetidae). Zeitschrift für Säugetierkunde 57:1-13. [ Links ]
BREMER K. 1994. Branch support and tree stability. Cladistics 10:295-304. [ Links ]
BROWN AD, HR GRAU, LR MALIZIA y A GRAU. 2001. Argentina. Pp. 623-659, en: Bosques Nublados del Neotrópico (M Kappelle y AD Brown, eds.). Instituto Nacional de Biodiversidad (INBio). Costa Rica. [ Links ]
BURKART R, N BARBARO, RO SANCHEZ y DA GÓMEZ. 1999. E co-regiones de la Argentina. Administración de Parques Nacionales, PRODIA, 1-43. [ Links ]
CABRERA A. 1961. Catálogo de los mamíferos de América del Sur. Revista del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" e Instituto Nacional de Investigación de las Ciencias Naturales 4:309-732. [ Links ]
CHRISTOFF AU. 1997. Contribuição a sistemática das espécies do gênero Akodon (Rodentia: Sigmodontinae) do leste do Brasil: estudos anatômicos, citogenéticos e de distribuição geográfica. Tesis doctoral, Universidade de São Paulo, São Paulo, Brasil. [ Links ]
CHRISTOFF AU, V FAGUNDES, IJ SBALQUEIRO, MS MATTEVI y Y YONENAGA-YASSUDA. 2000. Description of a new species of Akodon (Rodentia: Sigmodontinae) from southern Brasil. Journal of Mammalogy 81:833-851. [ Links ]
D'ELÍA G. 2003. Phylogenetics of Sigmodontinae (Rodentia, Muroidea, Cricetidae), with special reference to the akodont group, and with additional comments on historical biogeography. Cladistics 19:307-323. [ Links ]
D'ELÍA G, EM GONZÁLEZ, y UFJ PARDIÑAS. 2003. Phylogenetic analysis of sigmodontine rodents (Muroidea), with special reference to the akodont genus Deltamys. Mammalian Biology 68:351-364 [ Links ]
DÍAZ MM. 1999. Mamíferos de la Provincia de Jujuy: sistemática, distribución y ecología. Tesis doctoral inédita, Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, San Miguel de Tucumán, Argentina. [ Links ]
DÍAZ MM, JK BRAUN, MA MARES y RM BARQUEZ. 2000. An update of the taxonomy, systematics, and distribution de mammals of Salta Province, Argentina. Occasional Papers, Sam Noble Oklahoma Museum of Natural History 10:1-52. [ Links ]
ELLERMAN JR. 1941. The families and genera of living rodents. Vol II. Family Muridae. British Museum (Natural History), London, 690 pp. [ Links ]
ESRI. 2005. ArcGis (v 9). Environmental Systems Research Institute, Inc. [ Links ]
FARRIS JS. 1982. The logical basis of phylogenetic analyis. Pp. 7-36, en: Advances in Cladistics: Proceedings of the Second Meeting of the Willi Hennig Society (N Planick y V Funk., eds.). Columbia University Press, New York. [ Links ]
FARRIS JS, VA ALBERT, M KÄLLERSJÖ, D LIPSCOMB y AG KLUGE. 1996. Parsimony jackknifing outperforms neighbor-joining. Cladistics 12:99-124. [ Links ]
GEISE L, FC CANAVEZ y HN SEUÁNES. 1 998. Comparative kariology in Akodon (Rodentia, Sigmodontinae) from southeastern Brazil. Journal of Heredity 89:158-163. [ Links ]
GEISE L, MF SMITH y JL PATTON. 2001. Diversification in the genus Akodon (Rodentia: Sigmodontinae) in southeastern South America: mitochondrial DNA sequence analysis. Journal of Mammalogy 82:92-101. [ Links ]
GIL G y SH HEINONEN. 2003. Lista comentada de los mamíferos del Parque Nacional Baritú (Salta, Argentina). Acta Zoológica Lilloana 47:117-135. [ Links ]
GYLDENSTOLPE N. 1932. A manual of Neotropical sigmodont rodents. Kunglia Svenska Vetenskapsakademiens Handlingar, Stockholm 11:164 pp. [ Links ]
HERSHKOVITZ P. 1962. Evolution of Neotropical cricetine rodents (Muridae) with special reference to the phyllotine group. Fieldiana: Zoology 46:1-524. [ Links ]
HERSHKOVITZ P. 1990. Mice of the Akodon boliviensis size class (Sigmodontinae, Cricetidae), with the description of two new species from Brazil. Fieldiana Zoology 57:1-35. [ Links ]
JACKSON DA. 1993. Stopping rules in principal components analysis: a comparison of heuristical and statistical aproaches. Ecology 74:2204-2214. [ Links ]
KAJON AE, OA SCAGLIA, C HORGAN, C VELAZQUEZ, MS MERANI y OA REIG. 1984. Tres nuevos cariotipos de la Tribu Akodontini (Rodentia, Cricetidae). Revista del Museo Argentino de Ciencias Naturales 48:461-469. [ Links ]
MADDISON WP y DR MADDISON. 1992. MacClade. Analysis of Phylogeny and Character Evolution. Sunderland: Sinauer Associates, Inc. [ Links ]
MUSSER GM y MD CARLETON. 1993. Family Muridae. Pp. 501-756, en: Mammal species of the world: a taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Smithsonian Institution Press, Washington. [ Links ]
MUSSER GM y MD CARLETON. 2005. Superfamily Muroidea. Pp. 894-1531, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Third ed. Johns Hopkins University Press, Baltimore, M.D. [ Links ]
MYERS P. 1989. A preliminary revision of the varius group of Akodon (A. dayi, dolores, molinae, neocenus, simulator, toba, and varius). Pp. 5-54, en: Advances in Neotropical Mammalogy (K Redford y J Eisenberg, eds.). The Sandhill Crane Press, Inc. Gainesville, Estados Unidos. [ Links ]
MYERS P y JL PATTON. 1989. A new species of Akodon from the cloud forest of eastern Cochabamba departament, Bolivia (Rodentia: Sigmodontinae). Occasional Papers of the Museum of Zoology, The University of Michigan 720:1-18. [ Links ]
MYERS P, JL PATTON y MF SMITH. 1990. A review of the boliviensis group of Akodon (Muridae: Sigmodontinae) with emphasis on Perú and Bolivia. Miscellaneous Publications of the Museum of Zoology, University of Michigan 177:1-89. [ Links ]
PARDIÑAS UFJ, G D'ELÍA y S CIRIGNOLI. 2003. The genus Akodon (Muroidea: Sigmodontinae) in the southern interior Atlantic rainforest and the neighboring "campos" (Argentina, Misiones): an update. Mammalian Biology 68:129-143. [ Links ]
PARDIÑAS UFJ, G D'ELÍA, S CIRIGNOLI y P SUAREZ. 2005. A new species of Akodon (Rodentia, Cricetidae) from the northern Campos grasslands of Argentina. Journal of Mammalogy 86:462-474. [ Links ]
PATTON JL y MF SMITH. 1992. Evolution and systematics of akodontine rodents (Muridae: Sigmodontinae) of Perú, with emphasis on the genus Akodon. Memorias del Museo de Historia Natural, UNMSM 21:83-103. [ Links ]
PINNA SENN E, GD DE BARALE, JJ POLOP, MI ORTIZ, MC PROVENSAL y JA LISANTI. 1992. Estudio cariotípico y morfométrico en una población de Akodon sp. (Rodentia, Cricetidae) de Pampa de Achala. Mendeliana 10:59-70. [ Links ]
POLOP J. 1989. Distribution and ecological observations of wild rodents in Pampa de Achala, Córdoba, Argentina. Studies on Neotropical Fauna & Environment 24:53-59. [ Links ]
REIG O. 1977. A proposed unified nomenclature for the enameled components of the molar teeth of the Cricetidae (Rodentia). Journal of Zoology (London) 181:227-241. [ Links ]
REIG O. 1980. A new fossil genus of South American cricetid rodents allied to Wiedomys, with an assessment of the Sigmodontinae. Journal of Zoology (London) 192:257-281. [ Links ]
SMITH MF y JL PATTON. 2007. Molecular phylogenetics and diversification of South American grass mice, genus Akodon. Pp. 827-858, en: The Quintessential Naturalist: Honoring the Life and Legacy of Oliver P. Pearson (DA Kelt, E Lessa, JA Salazar-Bravo y JL Patton, eds.). University of California Publications in Zoology. [ Links ]
SORENSON MD. 1999. TreeRot, version 2. Boston University, Boston, MA. [ Links ]
SWOFFORD D. 2000. PAUP*: Phylogenetic Analysis Using Parsimony (*and other methods), version 4.0. Sinauer Associates, Inc., Publishers, Sunderland, Massachusetts. [ Links ]
THOMAS O. 1921. New Rhipidomys, Akodon, Ctenomys, and Marmosa from the Sierra Santa Barbara, S.E. Jujuy. Annals and Magazine of Natural History 7(9):183-187. [ Links ]
THOMAS O. 1925. The Spedan Lewis South American exploration.- I. On mammals from southern Bolivia. Annals and Magazine of Natural History 15(9):575-582. [ Links ]
THOMAS O. 1926. The Spedan Lewis South American exploration.- II. On mammals collected in the Tarija Department, southern Bolivia. Annals and Magazine of Natural History 17(9):318-328. [ Links ]
THOMPSON JD, TJ GIBSON, F PLEWNIAK, F JEANMOUGIN y DG HIGGINS. 1997. The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucleic Acids Research 24:4876-4882. [ Links ]
VITULLO AD, MS MERANI, OA REIG, AE KAJON, O SCAGLIA, MB ESPINOSA y A PEREZ-ZAPATA. 1986. Cytogenetics of south american akodont rodents (Cricetidae): New karyotypes and chromosomal banding patterns of Argentinian and Uruguayan forms. Journal of Mammalogy 67:69-80. [ Links ]
VOSS RS. 1988. Systematics and ecology of Ichthyomyinae rodents (Muroidea): Patterns of morphological evolution in a small adaptative radiation. Bulletin of the American Museum of Natural History 188:259-493. [ Links ]
WAHLERT JH. 1985. Cranial foramina of Rodents. Pp. 311-332, en: Evolutionary relationships among rodents, a multidisciplinary analysis (WP Luckett y JL Hartenberger, eds.). New York: Plenum Press. [ Links ]
YEPES J. 1933. Nuevos roedores para la fauna argentina. Revista Chilena de Historia Natural 37:46-49. [ Links ]
YEPES J. 1935. Epítome de la sistemática de los roedores argentinos. Revista del Instituto de Bacteriología 7:213-269. [ Links ]
Recibido 12 junio 2006.
Aceptación final 20 diciembre 2006.














