Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.15 n.1 Mendoza ene./jun. 2008
Identificación de morfogremios como aproximación al estudio de reparto de recursos en ensambles de carnívoros terrestres
Sonia C. Zapata1, Alejandro Travaini1, 2, Miguel Delibes3 y Rolando Matínez-Peck1
1 Centro de Investigaciones de Puerto Deseado, Unidad Académica de Caleta Olivia, Universidad Nacional de la Patagonia Austral (UNPA-UACO). Av. de la Prefectura Naval s/n, 9050-Puerto Deseado, Santa Cruz.
2 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
3 Estación Biológica de Doñana (CSIC), Av. de María Luisa s/n, 41013, Sevilla, España
RESUMEN: Utilizamos una aproximación ecomorfológica para examinar la diversidad trófica dentro de dos ensambles de carnívoros terrestres: uno del NE de Santa Cruz, Patagonia Argentina y otro del Parque Nacional de Doñana. Seleccionamos 16 medidas relacionadas con la forma y tamaño de los dientes y mandíbulas de los carnívoros. Con estas medidas se construyeron índices dentales y mandibulares, que permiten cuantificar la proporción de estructuras dentales relacionadas con la función de trituración en oposición a la función cortante, y distintos aspectos de la forma mandibular relacionados con el momento de fuerza de los músculos responsables de la fuerza ejercida en la mordida y en la masticación. Los índices fueron utilizados como ejes de gráficos tridimensionales (morfoespacios) para inferir la diversidad potencial de la dieta en las distintas especies (morfogremios). Los carnívoros fueron agrupados en cuatro (Santa Cruz) y tres (Doñana) morfogremios, siguiendo un gradiente carnivoría-omnivoría-insectivoría/herbivoría. En general, el patrón morfológico de los dos ensambles fue similar. Los felinos con patrones dentales especializados para el consumo de carne en un extremo del morfoespacio, los mustélidos con patrones dentales especializados en el consumo de invertebrados y alimentos de origen vegetal en el otro, y el resto de las especies, con patrones dentales generalizados, en el centro del mismo. Estas últimas pertenecieron a diferentes Familias del Orden: cánidos, vivérridos y herpéstidos. Las posiciones relativas ocupadas por cada especie dentro del morfoespacio resultante del análisis, junto con información previa sobre sus dietas, fueron utilizadas para inferir reparto de recursos tróficos entre las mismas.
ABSTRACT: Morphoguilds identification as an approach to the study of resource partitioning in assemblages of terrestrial carnivores. We used an ecomorphological approach to examine trophic diversity in two terrestrial carnivore assemblages: one from NE Santa Cruz province (Argentinean Patagonia), and the other from Doñana National Park (SO Spain). We selected 16 measures related with the shape and size of carnivore mandibles and teeth. Measures were used deriving morphometric (dental and mandible) ratios which allowed us to quantify the proportion of dental structures related with grinding function as opposed to slicing function, and different aspects of mandibular shape related with the moment arm of muscles responsible to the biting and chewing strength. Ratios were used as axes of three dimensional graphs (morphospaces) where the potential diet diversity of the different predators could be inferred (morphoguilds). Carnivore species from Santa Cruz and Doñana were grouped in the morphospace in 4 and 3 morphoguilds respectively, following a carnivory-omnivory-insectivory/herbivory gradient. In general, the apamorphological pattern was similar in both assemblages. Felids and mustelids with a specialized dental pattern for consumption of meat, cluster in one of the extremes of the morphospace; mustelids with specialized dental patterns for grinding invertebrates and vegetal materials, score in the opposite side; and the rest of species, with generalized dental patterns, scatter in the center. The last group of species belongs to different families of the Order such as canids, viverrids and herpestids. The relative position of each species in the morphospace and previous information of their diets were used to infer resource partitioning among them.
Palabras clave. Carnívoros; Ecomorfología; España; Gremios tróficos; Morfología dental; Patagonia.
Key words. Carnivores; Dental morphology; Dietary guilds; Ecomorphology; Patagonia; Spain.
INTRODUCCIÓN
Una aproximación para poder entender la forma en que las especies se reparten los recursos se basa en la supuesta relación funcional entre la morfología de las estructuras asociadas a la alimentación y ciertas características del recurso utilizado, como el tamaño de las presas (Wainwright, 1994). La aproximación se fundamenta en la premisa de que algunas adaptaciones morfológicas de los organismos reflejan sus relaciones ecológicas (Van Valkenburgh, 1995). Esta aproximación, denominada"ecomorfológica" (Van Valkenburgh, 1988) ha sido empleada por varios autores (e.g. Hespenheide, 1971, 1973; Karr y James, 1975; Cody y Money, 1978; Dayan et al., 1989, 1990; Dayan y Simberloff, 1994; Wainwright, 1994; Spencer, 1995; Jones, 1997).
Según Ricklefs y Cox (1977) los análisis morfológicos presentan muchas ventajas para el estudio de las relaciones dentro de la comunidad, utilizando la morfología como un subrogado del patrón de utilización de recursos por las especies. Por un lado, se puede obtener fácilmente una variedad de medidas morfológicas a partir de especímenes de museos o registros publicados. Por otro lado, la morfología sería independiente de fluctuaciones ambientales a corto plazo, dado que reflejaría las fuerzas de selección a la que las especies fueron sometidas en el largo plazo. Tiene, por lo tanto, el potencial de permitir realizar comparaciones más amplias, ya sea entre hábitats, regiones o taxones (Ricklefs y Travis, 1980).
Si existe reparto de recursos entre especies basado en una selección del tamaño o alguna otra característica de las presas, sería de esperar que el aparato trófico fuese el carácter que mejor lo refleje (Dayan et al., 1989, 1990; Dayan y Simberloff, 1994). Resulta entonces importante establecer qué características específicas del aparato trófico están más asociadas con la alimentación.
Los tipos de alimentación y la morfología dental de los miembros del Orden Carnivora son muy variados. A diferencia de otros grupos, los carnívoros retuvieron una dentición versátil, con dientes diferentes adaptados para cortar carne, romper huesos y triturar insectos y frutos. Esa versatilidad ha llevado a la evolución de patrones dentales (y dietas asociadas a esos patrones) divergentes dentro del Orden, presumiblemente como resultado de la competencia por el alimento (Van Valkenburgh, 1995). Así, la forma y tamaño de los dientes de los carnívoros reflejan de algún modo las proporciones de carne, huesos, invertebrados y vegetales que son capaces de consumir (Van Valkenburgh, 1988, 1989, 1995; Van Valkenburgh y Wayne, 1994; Biknevicius y Van Valkenburgh, 1996). También son importantes las mandíbulas, que junto con los dientes que alojan y los músculos responsables de su oclusión, constituyen el segundo componente más importante del aparato trófico de los carnívoros (Ewer, 1973; Radinsky, 1981, 1985). Distintos autores han estimado la fuerza relativa ejercida en la mordida y en la masticación de los carnívoros a partir del estudio de la morfología de sus mandíbulas (Emerson y Radinsky, 1980; Radinsky, 1985; Kieser, 1995; Christiansen y Adolffssen, 2005).
Una vez seleccionadas aquellas características del aparato trófico de los carnívoros más asociadas con la alimentación, es posible construir un morfoespacio dental-mandibular/dietario (con las medidas que representen esas características), en el cual queden asignadas las posiciones relativas de cada especie (Van Valkenburgh, 1989; Palmquist et al., 1999; Márquez y Fariña, 2003). Se espera que las especies se agrupen en el morfoespacio de acuerdo con sus similitudes en la morfología de sus aparatos tróficos, lo que revelaría la existencia de adaptaciones morfológicas convergentes, por un lado, y de un legado filogenético común, por otro.
En el presente trabajo utilizamos una aproximación ecomorfológica para examinar la diversidad trófica dentro en dos ensambles de carnívoros: uno proveniente del NE de Santa Cruz, Patagonia Argentina y otro del Parque Nacional de Doñana, SO de España. El primer ensamble se compone de seis especies, e incluye el puma (Felis concolor), el gato de pajonal (Oncifelis colocolo), el zorro colorado (Pseudalopex culpaeus), el zorro gris (Pseudalopex griseus), el zorrino patagónico (Conepatus humboldtii) y el hurón menor (Galictis cuja). El segundo ensamble se compone de cinco especies: el lince ibérico (Lynx pardinus), el zorro europeo (Vulpes vulpes), el tejón (Meles meles), el meloncillo (Herpestes ichneumon) y la gineta (Genetta genetta).
Específicamente, nuestros objetivos fueron: 1) caracterizar las especies de los dos ensambles sobre la base de la morfología de sus aparatos tróficos, identificando y describiendo aquellas estructuras más estrechamente asociadas a la alimentación por medio de la utilización de índices morfométricos; 2) definir un morfoespacio utilizando índices morfométricos en el que queden asignadas las posiciones relativas de cada especie para identificar morfogremios dentro de ese espacio; 3) inferir el reparto de los recursos tróficos entre las distintas especies a partir de la posición relativa que ocupe cada especie dentro del morfoespacio dental-mandibular/ dietario resultante del análisis (Ricklefs y Travis, 1980; Wainwright, 1994).
La especialización morfológica que puede acompañar al reparto de recursos en carnívoros ha sido sugerida en los estudios de Dayan et al. (1989, 1990, 1992), Dayan y Simberloff (1994), Márquez y Fariña (2003), Meiri et al. (2005) y ha sido comprobada con datos empíricos de campo por Jones (1997).
MATERIALES Y MÉTODOS
Los cráneos de carnívoros de Santa Cruz, provinieron de animales muertos recolectados en el campo (actualmente depositados en la Colección del Centro de Investigaciones de Puerto Deseado) y del Museo Argentino de Ciencias Naturales Bernardino Rivadavia (ver Apéndice). Los cráneos de los carnívoros de Doñana provinieron de la Colección de mamíferos de la Estación Biológica de Doñana (CSIC) (ver Apéndice). Solamente utilizamos cráneos de animales adultos, los cuales separamos de los juveniles teniendo en cuenta el grado de fusión de las suturas craneales, la oclusión del foramen apical de los dientes caninos y el grado de desgaste de los dientes (Zapata et al., 1995, 1997 a y b). Dado que los métodos multivariados morfométricos requieren matrices de datos completas (i.e. todos los caracteres deben estar presentes para todos los individuos), y dado el carácter fragmentario de algunos cráneos examinados, los valores de los datos faltantes fueron estimados a partir de los datos existentes (Little y Rubin, 1987). Para este fin utilizamos el método de componentes principales, optimizando la matriz de covarianza de los propios datos, en un proceso recurrente e iterativo (PC method; Jolliffe, 1982; Krzanowski, 1988) descrito en Strauss et al. (2003).
Debido a la ausencia de datos de sexo en la mayoría de los especímenes y al pequeño tamaño de la muestra (al menos para Santa Cruz) no se discriminó entre sexos en el análisis morfológico.
Medidas e índices seleccionados
Las seis especies de carnívoros de Santa Cruz y las cinco de Doñana fueron comparadas en términos de la similitud de su morfología dental y mandibular, basada en 16 medidas relacionadas con la forma y el tamaño de los dientes y las mandíbulas (Fig. 1). Estas medidas fueron tomadas con calibre digital, con una precisión de 0.01mm. Las mismas fueron seleccionadas a partir de los trabajos de Ewer (1973), Emerson y Radinsky (1980), Radinsky (1981, 1985), Van Valkenburgh (1989, 1995), Van Valkenburgh y Koepfli (1993), Van Valkenburgh y Wayne (1994) y Biknevicius y Van Valkenburgh (1996), y se listan a continuación: 1) LTC: longitud total del cráneo, medida como la distancia entre el borde anterior del premaxilar y el cóndilo occipital; 2) TRI: longitud de la zona cortante del primer molar inferior (trigónido); 3) TAP: longitud máxima antero-posterior del talónido del primer molar inferior (zona de trituración); 4) TML: longitud máxima medio-lateral (ancho) del talónido del primer molar inferior; 5) M1IL: longitud máxima antero-posterior del primer molar inferior; 6) M2IL: longitud máxima antero-posterior del segundo molar inferior; 7) M2IA: longitud máxima medio-lateral del segundo molar inferior; 8) P4SAP: longitud máxima antero-posterior del premolar superior 4; 9) M1SL: longitud máxima medio-lateral del primer molar superior; 10) M1SA: longitud máxima antero-posterior del primer molar superior; 11) CSLM: longitud máxima del canino superior; 12) CSAP: longitud máxima antero-posterior del canino superior; 13) CSML: longitud máxima medio-lateral del canino superior; 14) LD: longitud del dentario, medida como la distancia entre el margen posterior del cóndilo mandibular y el margen anterior del primer incisivo; 15) MM: longitud del proceso angular de la mandíbula, medida como la distancia desde el punto medio del cóndilo mandibular al borde ventral del ángulo mandibular; 16) MT: longitud del proceso coronoideo de la mandíbula, medida como la distancia desde el punto medio del cóndilo mandibular al ápex del proceso coronoideo de la rama ascendente.
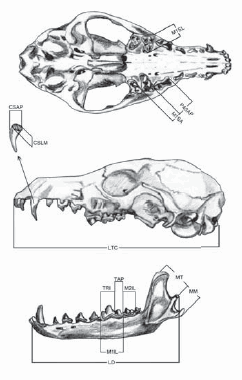
Fig. 1. Medidas craneales y mandibulares que se tomaron para este estudio. Los índices basados en estas medidas se indican en la sección Materiales y Métodos.
Las medidas fueron combinadas para la elaboración de índices dentales y mandibulares que permiten cuantificar la forma de los dientes, sus dimensiones en relación al tamaño del cráneo, la proporción de los dientes o estructuras dentales relacionadas con la función de trituración en oposición a la función cortante de los mismos y distintos aspectos de la forma de la mandíbula (relacionados con el momento de fuerza de los músculos asociados a la fuerza ejercida en la mordida y en la masticación). En particular, las relaciones entre las tendencias alimenticias de los carnívoros y los caracteres morfométricos han sido establecidos en los trabajos anteriormente citados.
Los índices utilizados en este trabajo fueron: 1) TRC: tamaño relativo del área de corte del primer molar inferior (carnicero), medido como la longitud del trigónido dividido por la longitud máxima antero-posterior del primer molar inferior (TRI/M1L); 2) ARTI: área relativa de trituración de los molares inferiores, medida como la raíz cuadrada de la suma de las áreas del talónido del primer molar inferior y del segundo molar inferior dividido por el largo del trigónido del primer molar inferior. El área de los dientes se estima como el producto del ancho máximo y largo máximo del talónido y del molar 2 respectivamente ([TAP x TLM] + [M2L x M2A])1/2/ TRI; 3) ARTS: área relativa de trituración de los molares superiores: medida como la raíz cuadrada del área del molar 1 superior dividido por la longitud máxima anteroposterior del cuarto premolar superior (carnicero). El área del molar 1 se estima como su ancho máximo por su largo máximo (MS1L x MS1A)1/2/ P4SAP; 4) TAC: tamaño del área de corte (trigónido) del primer molar inferior relativo a la longitud del dentario, medido como la longitud antero-posterior del trigónido dividido por la longitud del dentario (TRI/ LD); 5) VMT: estimador del momento de fuerza del músculo temporal medido como la longitud del proceso coronoideo de la mandíbula dividido por la longitud del dentario (MT/LD); 6) VMM: estimador del momento de fuerza del músculo masetero medido como la longitud del proceso angular de la mandíbula dividido por la longitud del dentario (MM/LD); 7) TC: tamaño relativo del canino superior, medido como la raíz cuadrada del área basal del canino superior estimada como longitud máxima antero-posterior del canino superior multiplicada por longitud máxima medio-lateral del canino superior (CSAP x CSML)1/2; 8) LCA: longitud del canino superior relativo a la longitud del cráneo, medido como la longitud máxima del canino superior dividido por la longitud total del cráneo (CSLM/LTC).
Método de análisis de los datos: descripción multivariada del morfoespacio
Los índices dentales y mandibulares de las especies de carnívoros de ambos ensambles fueron calculados a partir de las medidas transformadas a logaritmos decimales. Las transformaciones logarítmicas tienden a producir distribuciones multivariadas normales de las especies en el morfoespacio (Ricklefs y Travis, 1980; Ricklefs y Miles, 1994). Van Valkenburgh (1988, 1989), Van Valkenburgh y Koepfli (1993) y Van Valkenburgh y Wayne (1994) demostraron que la utilización de índices morfológicos (como los que utilizamos en este estudio) en contraposición a la utilización de las medidas, proveían una descripción más directa de la forma de las estructuras tróficas, aunque al usar los índices hay que tener en cuenta los problemas derivados de la existencia de alometrías. Los valores de los índices fueron utilizados para realizar gráficos tridimensionales (morfoespacios) en los cuales se puede observar la diversidad potencial de la dieta de las especies de predadores, utilizando tres de los índices como ejes del morfoespacio. En todos los casos se eligió LCA (longitud relativa del canino superior) y otros dos índices como ejes del morfoespacio. LCA está directamente correlacionado con la masa corporal de los carnívoros incluidos en nuestro estudio, ajustando de esta forma el efecto del tamaño.
RESULTADOS
Descripción de las características específicas del aparato trófico asociadas con la alimentación en los carnívoros de Santa Cruz
En la Tabla 1 figuran los valores promedio y las desviaciones estándar de las variables morfológicas (índices dentales y mandibulares) calculados para las seis especies de carnívoros de Santa Cruz. Solamente dos de tales índices, relacionados con el tamaño y la forma del canino superior y con la longitud relativa del canino superior en relación a la longitud del cráneo (TC y LCA), estuvieron directamente correlacionados con el peso del predador (Rs = 0.94 y 1, respectivamente, para TC y LCA, p<0.01, verificado mediante el ajuste secuencial de Bonferroni). Los índices relacionados con la función cortante de los molares carniceros (TRC y TAC) de los depredadores alcanzaron, como era de esperar, los mayores valores para los félidos. Sus molares carniceros están altamente especializados para esta función, al estar formados solamente por el trigónido y carecer de talónido (porción distal del molar cuyas cúspides romas se relacionan con la trituración de los alimentos). Los menores valores fueron alcanzados por P. griseus y Conepatus (Tabla 1), cuyos molares carniceros tienen talónidos muy desarrollados. P. culpaeus y Galictis presentaron el mismo valor para el tamaño del área de corte de los molares inferiores y no existieron diferencias significativas para este índice entre ambas especies (Tabla 1). Sin embargo, Galictis mostró un tamaño mayor del área de corte de los molares carniceros al relacionar esta medida con la longitud del dentario (TAC), aunque las diferencias entre las dos especies no fueron significativas. Los valores de ambos índices fueron significativamente mayores para P. culpaeus comparado con P. griseus (Tabla 1).
Tabla 1
Valores medios ± desviación estándar de las variables morfológicas (índices dentales y mandibulares) calculados a partir de las medidas tomadas a los cráneos de las 6 especies de carnívoros de Santa Cruz. Los nombres de los índices se describen en Materiales y Métodos. Los números entre paréntesis indican los pares de especies para los cuales la media no difiere en forma significativa a un nivel de p < 0.05 (prueba de la t de Student, verificado mediante el ajuste secuencial de Bonferroni): 1, P. concolor; 2, P. culpaeus, 3, O. colocolo; 4, P. griseus; 5, G. cuja; 6, C. humboldtii.
Por el contrario, los índices relacionados con la función de trituración de los molares inferiores y superiores (ARTI y ARTS), alcanzaron los mayores valores para P. griseus y Conepatus, y los menores para los félidos y Galictis (Tabla 1). Las áreas de trituración, tanto de los molares superiores como de los inferiores, fueron mayores para P.griseus comparado con P. culpaeus (Tabla 1), lo que indica que los molares del primero están más adaptados para triturar los alimentos (menor grado de carnivoría). Para el tamaño del canino, P. griseus y Galictis no mostraron diferencias significativas (TC, Tabla 1). En cuanto a la longitud relativa de los caninos (LCA), las diferencias fueron significativas entre todos los predadores. Finalmente, hemos observado que Conepatus tiene un gran desarrollo del músculo masetero, por lo que el valor de VMM para este zorrino es más alto que para Galictis (Tabla 1). Las diferencias para este índice no fueron significativas entre Conepatus y Oncifelis, Conepatus y P. griseus, a pesar del pequeño tamaño del primero, ni entre Oncifelis y P. griseus y el primero con P. culpaeus. Por otro lado, el estimador del momento de fuerza del músculo temporal (VMT) alcanzó los valores más altos para Puma y Galictis y los más bajos para los cánidos, aunque las diferencias en los valores de VMT no fueron significativas entre P. culpaeus, Oncifelis y Conepatus, ni entre Oncifelis y Galictis, Galictis y Conepatus; ni entre el primero y Puma (Tabla 1).
Descripción de las características específicas del aparato trófico asociadas con la alimentación en los carnívoros de Doñana
En la Tabla 2 figuran los valores promedio y las desviaciones estándar de los índices dentales y mandibulares calculados para las cinco especies de carnívoros de Doñana. Para este ensamble, el índice que relaciona la longitud del canino con la longitud del cráneo estuvo positivamente correlacionado con la masa del predador, aunque la correlación no fue significativa (Rs = 0.9, p = 0.03, no significativa luego de aplicado el ajuste secuencial de Bonferroni). Los índices relacionados con la función cortante de los molares carniceros alcanzaron los mayores valores para el lince ibérico (Lynx pardinus), el único felino del ensamble. El menor valor de TRC fue para el tejón (Meles meles), cuyos molares carniceros tienen trigónidos muy poco desarrollados. Para este índice, no existieron diferencias significativas entre las especies más pequeñas del ensamble, el meloncillo y la gineta (Herpestes ichneumon y Genetta genetta), aunque el tamaño del trigónido en relación a las dimensiones del cráneo fue mayor para Herpestes. (Tabla 2). Ambos índices fueron significativamente mayores para el zorro europeo (Vulpes vulpes) respecto a Meles, aunque ambas especies tienen un tamaño corporal similar.
Tabla 2
Valores medios ± desviación estándar de las variables morfológicas (índices dentales y mandibulares) calculados a partir de las medidas tomadas a los cráneos de las 5 especies de carnívoros del Parque Nacional de Doñana. Los nombres de los índices se describen en Materiales y Métodos. Los números entre paréntesis indican los pares de especies para los cuales la media no difiere en forma significativa a un nivel de p < 0.05 (prueba de la t de Student, verificado mediante el ajuste secuencial de Bonferroni): 1, L. pardinus; 2, V. vulpes 3, M. meles 4, H. ichneumon, 5, G.genetta
Por el contrario, los índices relacionados con la función de trituración de los molares inferiores y superiores, alcanzaron los mayores valores para Vulpes y Meles y los menores para el lince (Tabla 2). Esto indica que los molares de ambas especies están más adaptados para triturar los alimentos que los de las otras especies del ensamble, lo que evidencia un régimen más omnívoro. Entre Herpestes y Genetta no existieron diferencias significativas entre las áreas de trituración tanto de los molares superiores como de los inferiores (Tabla 2). Para el tamaño del canino, Lynx y Meles no mostraron diferencias significativas, y fueron las especies que alcanzaron los valores más altos para este índice (TC, Tabla 2). Por otra parte, Herpestes muestra los caninos significativamente mayores que Genetta. En cuanto a la longitud relativa de los caninos no existieron diferencias significativas entre Vulpes y Lynx ni entre Herpestes y Genetta, aunque la longitud relativa de los caninos de Herpestes es mayor que la de Genetta. Resulta extraño que Lynx, el único felino, y además la especie de mayor tamaño del ensamble, no tenga los caninos más grandes que el resto de las especies. Finalmente, de los dos índices relacionados con el momento de fuerza de los músculos utilizados para la oclusión de la mandíbula, hemos observado que Meles muestra un gran desarrollo del músculo temporal, por lo que el valor de VMT para este mustélido es el más alto de las especies estudiadas y su tamaño difiere de forma significativa del resto (Tabla 2). Por otra parte, las diferencias para este índice no fueron significativas entre Lynx y Vulpes, ni entre este último y Herpestes. El menor valor de VMT fue para Genetta. Por otro lado, VMM alcanzó el valor más alto para Lynx y los más bajos para Meles y Genetta. Entre estas dos últimas especies no existieron diferencias significativas para este índice, ni tampoco entre Herpestes y Vulpes (Tabla 2).
Identificación de morfogremios dentro del ensamble de carnívoros de Santa Cruz
En la Fig. 2a se observa la posición que ocupa cada una de las seis especies en el morfoespacio derivado del uso de tres índices morfológicos como ejes: LCA, ARTS y TAC. La elección de estos índices para generar el primer morfoespacio se basó en que dos de ellos indican funciones opuestas, la de corte por un lado y la de trituración por el otro. Como fue descrito más arriba, las especies que tienen una gran área de corte en sus molares carniceros poseen un escaso desarrollo del área de trituración de los mismos, y se espera que ocupen posiciones opuestas que en el morfoespacio. De este modo, los félidos se separan del resto por presentar el mayor tamaño del área de corte de sus molares carniceros y la menor área de trituración de sus molares superiores respecto a las otras especies. En el lado opuesto del morfoespacio se encuentra Conepatus, cuyos molares presentan una gran área de trituración, estando adaptados para triturar alimentos resistentes, como frutos e insectos, mostrando de superposición con P. griseus. De este modo, se puede observar un gradiente de carnivoría-omnivoríainsectivoría/ herbivoría, quedando los cánidos y Galictis en el centro del morfoespacio. Entre estas tres especies, no existen diferencias significativas en los promedios de las áreas de corte de sus molares carniceros; sin embargo Galictis presenta un área mayor. Alternativamente, las diferencias en las áreas de trituración de los molares son significativas, siendo mayores en P. griseus y menores en Galictis, lo que indica que esta última es la más carnívora de las tres especies. Dentro del morfoespacio Puma y P. culpaeus se destacan además por tener caninos más desarrollados, dado que los valores más altos de LCA corresponden a estas dos especies. El reemplazo de TAC por TRC (Fig. 2b), mostró una separación entre estos tres grupos incluso más evidente. Cuando se excluye a los félidos del morfoespacio (Fig. 2, c y d), Galictis se separa claramente de las otras tres especies, mientras que existe algo de superposición entre Conepatus y P. griseus. Observamos que Conepatus y P. griseus se superponen por tener un gran desarrollo de las áreas de trituración de sus molares post-carniceros, aunque ésta es mayor en Conepatus. Galictis y P. culpaeus ocupan cada uno posiciones independientes; sin embargo este último sigue estando en el centro del morfoespacio, siendo por lo tanto más omnívoro que Galictis. El morfoespacio generado del uso de VMT y TAC (Fig. 2e), sitúa a P. griseus y a Conepatus en un extremo del morfoespacio, escasamente superpuestos, a Galictis, Oncifelis y P. culpaeus en el centro, y a Puma solo, separado del resto. Por último, VMM en relación a TAC (Fig. 2f), separa del resto a Puma y Galictis por un lado, y a dos grupos con escasa superposición por el otro, el formado por Oncifelis y P. culpaeus, y el que integran P. griseus y Conepatus.
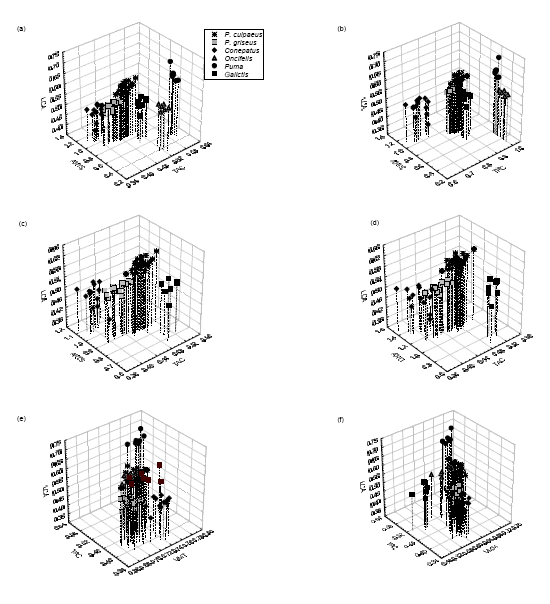
Fig. 2. Morfoespacios derivados del uso de los distintos índices morfométricos donde se ubican seis (a, b, e, f) y cuatro (c, d) especies de carnívoros de Santa Cruz. Para los nombres de los índices ver la sección Materiales y Métodos. (a): LCA, ARTS y TAC; (b): LCA, ARTS y TRC; (c): LCA, ARTS y TAC; (d) LCA, ARTI Y TAC; (e) LCA, TAC Y VMT; (f) LCA, TAC y VMM.
Teniendo en cuenta las posiciones relativas de las seis especies en los morfoespacios derivados de la combinación de los diferentes índices morfométricos, hemos identificado cuatro morfogremios. El primero formado por Puma, quien se segrega del resto de los carnívoros del ensamble por su alto grado de especialización dental y mandibular y por su gran tamaño corporal que le permite explotar presas de gran tamaño. El segundo formado por Oncifelis y Galictis, Oncifelis con un patrón dental especializado para el consumo de carne y Galictis cuya ubicación en el morfoespacio estuvo más cercana a los félidos, lo que sugiere especialización para el consumo de carne. El tercer morfogremio formado por P. culpaeus; los cánidos poseen un patrón dental generalizado, aunque P. culpaeus, de tamaño significativamente mayor que P. griseus, muestra una mayor tendencia hacia la carnivoría. Por último, el cuarto morfogremio se compone por P. griseus y Conepatus. El patrón dental de Conepatus, especializado para el consumo de invertebrados o frutos, sugiere su segregación trófica del resto y la superposición alimenticia con P. griseus, con el cual se superpone en el morfoespacio.
Identificación de morfogremios dentro del ensamble de carnívoros de Doñana
Como ocurre con los carnívoros del ensamble de Santa Cruz, Lynx se separa del resto de las especies por sus adaptaciones dentarias a una dieta carnívora, esto es, presentan el mayor tamaño del área de corte de sus molares carniceros y la menor área de trituración de sus molares superiores respecto de las otras especies (Fig. 3 a y b). En el lado opuesto del morfoespacio se encuentra Meles, cuyos molares presentan una gran área de trituración por lo que están adaptados para esa función. También se puede observar un gradiente de carnivoría-omnivoría-insectivoría/herbivoría, quedando Herpestes, Genetta y Vulpes en el centro del morfoespacio. Entre estas tres especies existen diferencias significativas en los promedios de las áreas de corte de sus molares carniceros, presentando Vulpes un área mayor. Sin embargo, el área de trituración de los molares superiores de Vulpes es mayor que la de las otras dos especies, por lo que resulta difícil identificar a la más carnívora de las tres según estos índices. Cuando se excluye a Lynx (el único félido del ensamble) del morfoespacio (Fig. 3c), Meles y Vulpes se separan claramente de las otras especies, mientras que existe algo de superposición entre las dos restantes. El mismo patrón se observa en el morfoespacio generado al reemplazar ARTS por ARTI (Fig. 3d) en uno de los ejes del morfoespacio. Por otro lado, Herpestes, Genetta y Vulpes tienen un desarrollo similar de las áreas de trituración de sus molares postcarniceros. Estas tres especies estarían más capacitadas para consumir carne que Meles, al presentar un tamaño mayor del área de corte de sus molares en contraposición con las áreas de trituración de los mismos (Fig. 3, c y d). El morfoespacio generado por VMT y TAC (Fig. 3e), sitúa a Lynx y Vulpes en un extremo del morfoespacio, y a Herpestes y Genetta en otro. Meles permanece separado del resto, dado que en los mustélidos la mayor fuerza la ejerce el temporal, lo que explicaría su posición hacia la derecha del morfoespacio, donde los valores de VMT son mayores (Fig. 3e). Por último, no se observa una separación clara entre las distintas especies considerando a VMM en relación a TAC (Fig. 3f).

Fig. 3. Morfoespacios derivados del uso de índices morfométricos donde se ubican cinco (a, b, e, f) y cuatro (c, d) especies de carnívoros de Doñana. Para los nombres de los índices ver la sección Materiales y Métodos. (a): LCA, ARTS y TAC; (b): LCA, ARTS y TRC; (c): LCA, ARTS y TAC; (d) LCA, ARTI y TAC; (e) LCA, TAC Y VMT; (f) LCA, TAC y VMM.
Teniendo en cuenta las posiciones relativas de las cinco especies en los morfoespacios derivados de la combinación de los diferentes índices morfométricos, hemos identificado tres morfogremios: 1) el formado por Lynx, quien se segrega del resto de los carnívoros del ensamble por su alto grado de especialización dental y mandibular para el consumo de carne; 2) el formado por Meles, cuyo patrón dental está especializado para el consumo de invertebrados; y 3) el formado por Vulpes, Herpestes y Genetta. Las tres últimas especies poseen un patrón dental generalizado, sin adaptaciones especiales para algún tipo de dieta en particular. Sin embargo, el tamaño significativamente mayor de Vulpes sugiere que este cánido puede alimentarse de presas más grandes y segregarse de las otras dos especies.
DISCUSIÓN
Morfogremios de Santa Cruz y Doñana
Diversos estudios ecomorfológicos de especies actuales sugieren que los morfogremios de mamíferos predadores terrestres de gran tamaño son predecibles, sin importar dónde o cuándo hayan existido (Van Valkenburgh, 1991, 1995). Cada uno contiene ecomorfos generalistas (zorros, civetas, chacales) en el centro del morfoespacio. Separados de este núcleo central y dejando espacios entre sí, se encuentran otros tres grupos: los especialistas en el consumo de carne (felinos), los especialistas en el consumo de carne y huesos (hienas) y las especies poco carnívoras de gran tamaño (úrsidos). Solamente el núcleo central incluye a más de una familia del Orden Carnívora (Van Valkenburgh, 1991, 1995). Este patrón de dispersión de las especies en el morfoespacio es iterativo en el curso de la evolución, a pesar de las diferencias significativas en la composición filogenética de las especies, pudiendo estar ausentes los ecomorfos tipo hienas y/o úrsidos (Van Valkenburgh, 1988, Palmquist et al., 1999; Purvis et al., 2001).
Estos estudios también sugieren que los patrones resultantes del reparto de recursos entre carnívoros simpátricos permanecieron estables por millones de años y reflejan, probablemente, la prevención de la competencia interespecífica y aspectos relacionados con la abundancia de los recursos alimenticios (Van Valkenburgh, 1995). Además, los estudios ecomorfológicos en carnívoros se limitan a especies depredadoras de gran tamaño, cuyas masas sobrepasan los siete kilos, bajo el supuesto de que la competencia interespecífica por los recursos presa será relativamente intensa entre ellas (ver Van Valkenburgh, 1995 y referencias citadas allí). Del mismo modo, las especies depredadoras de pequeño tamaño como las de nuestro estudio pueden ser competidoras potenciales, si se superponen en el uso de los recursos (Keddy, 2001) y si éstos son limitantes (Wiens, 1989).
En nuestro estudio, los carnívoros del ensamble de Santa Cruz fueron agrupados en cuatro morfogremios, mientras que los de Doñana se agruparon en tres. En general, el patrón morfológico de los dos ensambles es similar, hecho que no es sorprendente por las afinidades taxonómicas de algunas de las especies de ambos ensambles. Por lo tanto, el efecto de la filogenia es un factor importante a considerar en los estudios ecomorfológicos, porque se esperaría que especies relacionadas cercanamente sean morfológicamente similares independientemente de su dieta (Rickleff y Miles, 1994; Palmquist et al., 1999; Popowics, 2003). Sin embargo, puede ocurrir que las diferencias morfológicas entre las especies se desvíen de lo que se espera por filogenia (Van Valkenburgh, 1991; Popowics, 2003; Meiri et al., 2005). Por ejemplo, en los cánidos, las similitudes en el tamaño del área de trituración de sus molares post carniceros y en el tamaño del área de corte de los molares carniceros entre P. culpaeus y Vulpes reflejen probablemente sus relaciones filogenéticas cercanas (Bininda Emonds et al., 1999). Sin embargo, P. griseus difiere claramente de su pariente más cercano (P. culpaeus, Wayne et al., 1989) por el énfasis en las áreas de trituración de sus molares post carniceros.
En ambos ensambles los felinos fueron ubicados en un extremo del morfoespacio, los mustélidos con patrones dentales especializados en el consumo de invertebrados y alimentos de origen vegetal en el otro extremo, y el resto de las especies en el centro del mismo. Cabe resaltar que Galictis (un mustélido) no se superpone con el resto y ocupa una posición más cercana a los félidos. Las especies que ocuparon las posiciones centrales de ambos morfoespacios (Santa Cruz y Doñana) pertenecieron a diferentes familias del Orden Carnívora (cánidos, herpéstidos y vivérridos) concordando con el patrón general antes descrito. También en el extremo del morfoespacio correspondiente a aquellas especies con adaptaciones dentales para el consumo de invertebrados y frutos, se ubicaron Conepatus, Meles y P. griseus (Mustelidae y Canidae respectivamente.
Inferencia de patrón de reparto de recursos a partir de los morfogremios identificados en el ensamble de Santa Cruz
Los carnívoros del ensamble de Santa Cruz se agrupan en el morfoespacio según un gradiente carnivoría-omnivoría-insectivoría/ herbivoría, sobre la base de las adaptaciones de los molares carniceros y post-carniceros para uno u otro tipo de dieta, y por el tamaño relativo de sus dientes caninos (Greaves, 1983; Van Valkenburgh, 1989, 1995; Biknevicius y Van Valkenburgh, 1996). En un extremo del morfoespacio se encuentran los félidos, Puma y Oncifelis, especies estrictamente carnívoras. Sus adaptaciones dentarias y craneanas responden al patrón general de la Familia, que incluye a los miembros del orden denominados "hipercarnívoros" (Ewer, 1973). Claramente, Puma se encuentra solo en un extremo del morfoespacio porque además es el carnívoro de mayor tamaño del ensamble. Diversos estudios han demostrado que los grandes felinos como el puma son capaces de matar presas mayores que su propio tamaño (ver Gomez de Oliveira, 1994, y referencias citadas allí) y tienden a segregarse más, por el tipo de presas que consumen, que aquellos carnívoros que se alimentan de presas más pequeñas (Schoener, 1974). En nuestra área de estudio, el NE de la provincia de Santa Cruz, el puma se alimenta fundamentalmente de edentados, liebres europeas (Lepus europaeus) y guanacos (Lama guanicoe), estos últimos de mayor tamaño que el propio puma, y no existe superposición trófica con ninguno de los otros carnívoros del ensamble (Zapata, 2005). Sin embargo, cabe aclarar que el puma mata y consume presas de tamaño muy variado a lo largo de su rango (Sunquist y Sunquist, 2002). Incluso en el noroeste de Neuquén el puma forma un gremio trófico con el zorro colorado por converger ambas especies en el consumo de liebre europea.
En el centro del morfoespacio se encuentran los cánidos y Galictis, aunque no existe superposición entre las tres especies. Galictis posee más adaptaciones a una dieta carnívora que los cánidos (Ewer, 1973; King, 1989; Van Valkenburgh, 1989). Nuestras observaciones de su morfología dental, mandibular y craneal son concordantes con las descripciones generales de las especies del género Mustela. Como los miembros de este género, Galictis cuja posee un gran desarrollo de los dientes caninos y del trigónido del primer molar inferior, y un escaso desarrollo del talónido y de los molares postcarniceros con función de trituración. Además, los procesos pre y postglenoideo en Galictis están tan desarrollados que resulta dificultoso separar las mandíbulas del cráneo (Zapata, 2005). Esta condición, que indica que Galictis tiene una mordida particularmente potente, ha sido relacionada con una mayor eficiencia en el cierre de las mandíbulas en aquellos mustélidos que se alimentan de presas más grandes que ellos (Ewer, 1973; Biknevicius y Van Valkenburgh, 1996). Por su morfología, es esperable que Galictis esté especializado en una dieta carnívora y que pueda llegar a consumir presas de tamaño mayor que el propio. Esto es coherente con los resultados de estudios de campo sobre su dieta (Diuk-Wasser y Cassini, 1998; Delibes et al., 2003; Zapata et al., 2005a), y con su asignación al mismo morfogremio que Oncifelis. En efecto, el NE de Santa Cruz ambas especies convergen en el consumo de micromamíferos durante la estación cálida. Sin embargo, durante la estación fría Galictis aumentó el consumo de lagomorfos y se segregó tróficamente de Oncifelis, cuya dieta se basó en micromamíferos durante las dos estaciones (Zapata, 2005).
Los cánidos del ensamble, probablemente las especies filogenéticamente más cercanas entre sí de este estudio (Wayne et al., 1989), muestran diferencias morfológicas importantes, a pesar de que las similitudes en el diseño de sus aparatos tróficos los identifican como omnívoros. P. culpaeus posee caninos relativamente más desarrollados, una mordida más potente (estimada por el mayor momento de fuerza de los músculos de oclusión de las mandíbulas) y una mayor área relativa de corte de los molares carniceros que las de P. griseus. Este último posee mayor área relativa de trituración de sus molares. Tales características, asociadas al mayor tamaño corporal de P. culpaeus, indican que éste está mejor capacitado para capturar y consumir presas de mayor tamaño que P. griseus. Como ocurre con otras especies de cánidos simpátricos que mostraron diferencias en el tamaño de sus molares carniceros, las diferencias podrían haber sido el resultado de una selección hacia la captura y consumo de presas de mayor tamaño por parte de P. culpaeus (Dayan et al., 1992). Sin embargo, diferentes estudios mostraron que si bien ambos zorros son potencialmente capaces de consumir el mismo tipo de presas, en simpatría P. culpaeus excluye a P. griseus de los hábitats con mejor calidad de presas, como la liebre europea y los roedores, segregándose ambos tróficamente (Johnson et al., 1996; Zapata et al., 2005 b). El menor tamaño del zorro gris y sus adaptaciones morfológicas para triturar artrópodos y alimentos de origen vegetal le permiten sobrevivir explotando este tipo de recursos (Zapata et al., 1998, 2005b).
En el otro extremo del morfoespacio se encuentra Conepatus. Sus molares carniceros están adaptados para la trituración de alimentos, con talónidos muy desarrollados y planos, al igual que los molares postcarniceros. La región cortante del M1 se encuentra reducida, y es la menor de todas las especies del ensamble. El gran desarrollo del músculo masetero, que ejerce su mayor fuerza en la oclusión mandibular (Ewer, 1973), en combinación con la gran superficie de trituración de los molares, sugieren su especialización dietaria. Conepatus tiene capacidad de consumir alimentos duros como vegetales y caparazones de artrópodos. Conepatus y P. griseus se superponen en el morfoespacio por la capacidad trituradora de sus molares, por lo que se espera que se superpongan tróficamente, a pesar de la diferencia de tamaño corporal. En efecto, estas dos especies muestran alta superposición en la dieta durante la primavera y el verano, cuando aumenta la abundancia de artrópodos en Santa Cruz. Aunque se segregan tróficamente durante el otoño y el invierno cuando los invertebrados son escasos (Zapata, 2005).
Inferencia de patrón de reparto de recursos a partir de los morfogremios identificados en el ensamble de Doñana
En un extremo del morfoespacio se encuentra el único félido del ensamble, Lynx, una especie estrictamente carnívora con adaptaciones dentales y craneales que responden al patrón general de la familia Felidae. Es interesante el tamaño y la longitud de los caninos de los linces estudiados, cuyos valores no han sido los más altos del ensamble. La longitud de los caninos superiores de Lynx, estimada como su longitud máxima dividida por la longitud del cráneo, es similar a la de Oncifelis, el felino más pequeño del ensamble de Patagonia. El tamaño de los caninos se ha relacionado con el tamaño de presa que los félidos y mustélidos son capaces de cazar (Dayan et al., 1989, 1990; Dayan y Simberloff, 1994). Probablemente la longitud de los caninos de Lynx refleje una adaptación para matar a su presa principal, Oryctolagus cuniculus, un lagomorfo pequeño, con una masa promedio de 800 gramos en Doñana (Delibes 1980; Beltrán y Delibes, 1991). El lince ibérico mata a los conejos mordiendo la nuca o el cuello en su parte dorsal, produciendo la muerte instantánea siempre por descoyuntamiento o rotura de la columna vertebral o la caja craneana (Delibes, 1980). El conejo ha tenido un papel muy importante en la evolución del lince ibérico, pues ambas especies se han originado en la Península Ibérica y no existen dudas acerca de que el lince no puede sobrevivir sin esta presa principal (Delibes, 1980; Palomares et al., 2001). Tal especialización dietaria podría implicar su superposición trófica con otras especies del ensamble de Doñana, por ejemplo el zorro europeo (Travaini, 1994), quien también consume conejos, aunque Lynx es también capaz de cazar presas de gran tamaño, como ciervos jóvenes (Cervus elephus) y gamos (Dama dama) (Delibes, 1980). Por su tamaño corporal, significativamente mayor que el del resto de los carnívoros, se espera además que se segregue por ser capaz de consumir presas de gran tamaño (Schoener, 1974). En el centro del morfoespacio se encuentra el único cánido del ensamble junto a las especies más pequeñas, Herpestes y Genetta, con superposición entre las tres, pero sobre todo entre las dos últimas. El diseño morfológico de Herpestes y Genetta es muy similar, aunque Herpestes posee caninos más robustos que Genetta pero de menor longitud. Además, el mayor desarrollo del músculo masetero de Herpestes sugiere que esta especie está capacitada para triturar alimentos duros, como caparazones de insectos o crustáceos. Sin embargo, la mayor longitud relativa de los caninos de Genetta, en relación a su pequeño tamaño corporal, sugiere que esta especie podría ser más predadora que Herpestes. Diversos estudios han señalado a Genetta como especialista en el consumo de micromamíferos (ver Palomares y Delibes, 1991). Estudios realizados en Doñana han mostrado que Herpestes y Vulpes poseen una gran plasticidad trófica, superponiéndose o separándose troficamente entre ellos y con las otras especies del ensamble, dependiendo del momento en el que sus dietas hayan sido estudiadas, lo cual es consistente con sus patrones dentales generalizados (Zapata, 2005).
En el otro extremo del morfoespacio se encuentra Meles, ya que sus molares carniceros, adaptados para la trituración de alimentos duros, poseen talónidos muy desarrollados y planos, al igual que sus molares poscarniceros. La región cortante del M1 se encuentra reducida, siendo la menor de todas las especies del ensamble. Como sugirió Popowicks (2003) la morfología dental de Meles refleja una clara especialización para el consumo de invertebrados. También las adaptaciones mandibulares y craneales le permiten ocluir las mandíbulas de manera que se bloquean a modo de bisagra evitando su desarticulación, cuando tritura alimentos vegetales (Macdonald, 1992). Su especialización en el consumo de este tipo de alimentos sugiere una separación trófica del resto de las especies del ensamble. Sin embargo, un estudio realizado en Doñana mostró que Meles se alimenta de conejos cuando éstos son abundantes (Martín et al., 1995), superponiéndose tróficamente con Lynx. No obstante, cuando la población de conejos disminuyó en Doñana, Meles pasó a alimentarse de insectos y frutos (Zapata, 2005), lo que es consistente con su patrón dental especializado.
CONCLUSIONES
Los resultados obtenidos en este trabajo sugieren que los morfogremios de ensambles de predadores de pequeño tamaño también son predecibles. Excluyendo al puma, la única especie de gran tamaño, el patrón de dispersión de las especies de Santa Cruz y Doñana en sus correspondientes morfoespacios es similar. Ambos contienen ecomorfos especialistas en el consumo de carne en un extremo, ecomorfos generalistas en el centro y ecomorfos especialistas en el consumo de invertebrados en el extremo opuesto. Estos últimos están ausentes en los morfogremios conformados por especies de gran tamaño, debido a que los invertebrados no pueden sustentar las demandas energéticas de carnívoros de masa corporal mayor a 21.5 kg, incluso bajo condiciones excepcionales de densidades de presas y tiempo de forrajeo (Carbone et al., 1999; Muñoz García y Williams, 2005).
Por otra parte se concluye que los patrones de reparto de recursos tróficos entre carnívoros simpátricos pueden ser inferidos a partir del análisis de los morfogremios. Sin embargo, estos patrones deberán ser contrastados con estudios de campo para evaluar el poder predictivo de los morfogremios.
Lista de ejemplares examinados en Argentina y España. El material se encuentra depositado en las colecciones de mamíferos del Museo Argentino de Ciencias Naturales Bernardino Rivadavia (MACN) de Buenos Aires, Argentina, y en la Colección de mamíferos de la Estación Biológica de Doñana, España (EBD); los ejemplares recolectados en la provincia de Santa Cruz se encuentran depositados en el Centro de Investigaciones de Puerto Deseado, Santa Cruz, Argentina (CIPD): Pseudalopex griseus: CIPD 1-18. Pseudalopex culpaeus: CIPD 40 - 72. Puma concolor: MACN 13939, 20629; CIPD 35 -39. Oncifelis colocolo: CIPD 29 - 34. Galictis cuja: MACN 16520, 13939; CIPD 73 - 77. Conepatus humboldtii: MACN 2874, 2872, 2873; CIPD 19 - 28). Vulpes vulpes: EBD 19786, 19823, 19821, 19756, 19830, 19824, 8313, 19888,19780, 19768, 19764, 19782. Lynx pardinus: EBD 19110, 23122, 1371, 22651, 20711, 17993, 7106, 7427, 7428, 8740, 4373, 1403. Meles meles: EBD 22318, 22322, 24985, 23153, 7964, 23221, 514, 482, 2942, 8007, 7512, 7964. Herpestes ichneumon: EBD 24986, 20712, 20536, 23530, 23149, 20710, 23288, 21609, 23735, 21677, 23528, 25909. Genetta genetta: EBD 25908, 1479, 1597, 1589, 1583, 1586, 1592, 23328, 1881, 1591, 1575, 1588.
AGRADECIMIENTOS
Agradecemos especialmente a Diego Procopio por su colaboración en la recolección y limpieza de los cráneos de Patagonia y a Juan Zanón y Julieta Pedrana por su ayuda en la construcción de las figuras. A Pepe Cabot, responsable de la colección de mamíferos de la Estación Biológica de Doñana (CSIC, España), su gentileza al ponerla a nuestra disposición. Agradecemos a Paul Palmquist y a otro revisor (anónimo) por sus comentarios para mejorar este manuscrito y a David Flores sus sugerencias de mejora de escritura y formato. Agradecemos muy especialmente a Rubén Barquez y Silvina Pereyra quienes gentilmente retocaron las figuras para lograr una buena calidad de impresión. Este trabajo fue financiado por los Proyectos UNPA PI 29/B013 y 29/B050, CONICET (PEI 6065), Secretaría de Agricultura, Ganadería y Pesca de la Nación (SAGPyA Nos. 613/96, 716/97 y 925/97) y una beca UNPA -Acuerdo Nro. 167/03 otorgada a SCZ para realizar el viaje a España.
LITERATURA CITADA
1. BELTRÁN JF y M DELIBES. 1991. Ecología trófica del lince Ibérico en Doñana durante un período seco. Doñana Acta Vertebrata 18:113-122. [ Links ]
2. BIKNEVICIUS AR y B VAN VALKENBURGH. 1996. Design for killing: craniodental adaptations of predators. Pp. 393-428, en: Carnivore behavior, ecology and evolution (JL Gittleman, ed.). Vol. 2, Cornell University Press, Ithaca, Nueva York. [ Links ]
3. BININDA-EMONS ORP, JL GITTLEMAN y A PURVIS. 1999. Building large trees by combining phylogenetic information: a complete phylogeny of the extant Carnivora (Mammalia). Biological Reviews 74:143-175. [ Links ]
4. CARBONE C, GM MACE, SG ROBERTS y DW MACDONLAD. 1999. Energetic constraints on the diet of terrestrial carnivores. Nature 402:286-288. [ Links ]
5. CHRISTIANSEN P y JS ADOLFFSSEN. 2005. Bite forces, canine strength and skull allometry in carnivores (Mammalia, Carnivora). Journal of Zoology 266:133-151. [ Links ]
6. CODY ML y HA MONEY. 1978. Convergence versus nonoconvergence in Mediterranean-climate ecosystems. Annual Review of Ecology and Systematics 9:265-321. [ Links ]
7. DAYAN T, D SIMBERLOFF, E TCHERNOV y Y YOMTOV. 1989. Inter and intra specific character displacement in mustelids. Ecology 70:1526-1539. [ Links ]
8. DAYAN T, D SIMBERLOFF, E TCHERNOV y Y YOMTOV. 1990. Feline canines: community-wide character displacement among the small cats of Israel. American Naturalist 136:39.60. [ Links ]
9. DAYAN T, D SIMBERLOFF, E TCHERNOV y Y YOMTOV. 1992. Canine carnassials: character displacement in the wolves, jackals and foxes of Israel. Biological Journal of the Linnean Society 45:315- 331. [ Links ]
10. DAYAN T y D SIMBERLOFF. 1994. Character displacement, sexual dimorphism, and morphological variation among British and Irish mustelids. Ecology 75:1063-1073. [ Links ]
11. DELIBES M. 1980. Feeding Ecology of the Spanish Lynx in the Coto Doñana. Acta Theriologica 25:309- 324. [ Links ]
12. DELIBES M, A TRAVAINI, S ZAPATA y F PALOMARES. 2003. Alien mammals and the trophic position of the lesser grison (Galictis cuja) in Argentinean Patagonia. Canadian Journal of Zoology 81:157-162. [ Links ]
13. DIUK-WASSER MA y M CASSINI. 1998. A study of minor grisons and a preliminary analysis of their role in the control of rabbits in Patagonia. Studies on Neotropical Fauna and Environment 33:3-6. [ Links ]
14. EMERSON SB y LB RADINSKY. 1980. Functional analysis of sabertooth cranial morphology. Paleobiology 6:295-312. [ Links ]
15. EWER RF. 1973. The Carnivores. Cornell University Press, Ithaca, NY. U.S.A. [ Links ]
16. GOMES DE OLIVEIRA T. 1994. Neotropical cats. Ecology and conservation. Universidade Ferderal do Maranhao, EDUFMA, Sao Luis, MA, Brasil. [ Links ]
17. GREAVES WS. 1983. A functional analysis of carnassial biting. Biological Journal of the Linnean Society 20:353-363. [ Links ]
18. HESPENHEIDE HA. 1971. Food preference and the extent of overlap in some insectivorous birds, with special reference to the Tyrannidae. Ibis 113:59-72. [ Links ]
19. HESPENHEIDE HA. 1973. Ecological inferences from morphological data. Annual Review of Ecology and Systematics 4:213-229. [ Links ]
20. JOHNSON WE, TK FULLER y WL FRANKLIN. 1996. Sympatry in canids: a review and assessment. Pp. 189-219, en: Carnivore Behaviour, Ecology and Evolution (JL Gittleman, ed.). Vol. 2. Cornell University Press. [ Links ]
21. JOLLIFE IT.1982. A note on the use of principal components in regression. Journal of the Royal Statistical Society, Series C (Applied Statistics) 31:300- 303. [ Links ]
22. JONES M. 1997. Character displacement in Australian dasyurid carnivorores: size relationships and prey size patterns. Ecology 78:2569-2587. [ Links ]
23. KARR J y FC JAMES. 1975. Ecomorphological configurations and convergent evolution. Pp. 258-291, en: Ecology and evolution of communities (ML Cody y J Diamond, eds.). Cambridge, Massachussets. [ Links ]
24. KEDDY PA. 2001. Competition. Kluwer Academic Publisher. [ Links ]
25. KIESER JA. 1995. Gnathomandibular morphology and character displacement in the bat-eared fox. Journal of Mammalogy 76:542-550. [ Links ]
26. KING C. 1989. The advantages and disadvantages of small size to weasels, Mustela species. Pp. 302-334, en: Carnivore behavior, ecology and evolution (JL Gittleman, ed.). Chapman and Hall, London. [ Links ]
27. KRZANOWSKI WJ. 1988. Missing value imputation in multivariate data using the singular value decomposition of a matrix. Biometrical letters 25:31-39. [ Links ]
28. LITTLE RJA y DB RUBIN. 1987. Statistical analysis with missing data. Wiley, New York. [ Links ]
29. MACDONALD D. 1992. The velvet claw. A natural history of the carnivores. BBC books, Londres. [ Links ]
30. MÁRQUEZ A y RA FARIÑA. 2003. Dental morphology and diet in canids and procyonids from Uruguay. Mammalia 67:567-573. [ Links ]
31. MARTIN R, A RODRÍGUEZ y M DELIBES. 1995. Local feeding specialization by badgers (Meles meles) in a mediterranean environment. Oecologia 101:45-50. [ Links ]
32. MEIRI S, T DAYAN y D SIMBERLOFF. 2005. Variability and correlations in carnivore crania and dentition. Functional Ecology 19:337-343. [ Links ]
33. MUÑOZ-GARCÍA A y JB WILLIAMS. 2005. Basal Metabolic rate in Carnivores is associated with diet alter controlling for phylogeny. Physiological and biochemical Zoology 78:1039-1056. [ Links ]
34. PALMQUIST P, A ARRIBAS y B MARTÍNEZ-NAVARRO. 1999. Ecomorphological study of large canids from the lower Pleistocene of southeastern Spain. Lethalia 32:75-88. [ Links ]
35. PALOMARES F y M DELIBES.1991. Alimentación del meloncillo Herpestes ichneumon y de la gineta Genetta genetta en la Reserva Biológica de Doñana, S.O de la Península Ibérica. Doñana Acta Vertebrata 18:5-20. [ Links ]
36. PALOMARES F, M DELIBES, E REVILLA, J CALZADA y JM FEDRIANI. 2001. Spatial ecology of the Iberian lynx and abundance of its primary prey, the European rabbit, in a heterogeneous environment. Wildlife Monographs 148:1-36. [ Links ]
37. POPOWICS TE. 2003. Postcanine dental form in the Mustelidae and Viverridae (Carnivora: Mammalia). Journal of Morphology 256:322-341. [ Links ]
38. PURVIS A, GM MACE y JL GITTLEMAN. 2001. Past and future carnivore extinctions: a phylogenetic perspective. Pp. 11-34, en: Carnivore Conservation (JL Gittleman, SM Funk, D Macdonald y RK Wayne, eds.). Cambridge University Press, UK. [ Links ]
39. RADINSKY LB. 1981. Evolution of skull shape in carnivores. 1. Representative modern carnivores. Biological Journal of the Linnean Society 15:369-368. [ Links ]
40. RADINSKY LB. 1985. Approaches in evolutionary morphology: a search for patterns. Annual Review in Ecology and Systematics 16:1-14. [ Links ]
41. RICKLEFS RE y GW COX. 1977. Morphological similarity and ecological overlap among passerine birds on St. Kitts, British West Indies. Oikos 29:60-66. [ Links ]
42. RICKLEFS RE y J TRAVIS. 1980. A morphological approach to the study of avian community organization. Auk 97:321-338. [ Links ]
43. RICKLEFS RE y DB MILES. 1994. Ecological and evolutionary inferences from morphology: an ecological perspective. Pp. 13-41, en: Ecological Morphology. Integrative Organismal Biology (PC Wainwright y SM Reilly, eds.). The University of Chicago Press. Chicago and London. [ Links ]
44. SCHOENER TW. 1974. Resource partitioning in ecological communities. Science 185:27-39. [ Links ]
45. SPENCER LM. 1995. Morphological correlates of dietary resource partitioning in the African Bovidae. Journal of Mammalogy 76:448-471. [ Links ]
46. STRAUSS RE, NM ATANASSOV y J ALVES DE OLIVEIRA. 2003. Evaluation of the principal-component and expectation-maximization methods for estimating missing data in morphometric studies. Journal of Vertebrate Paleontology 23:284-296. [ Links ]
47. SUNQUIST M y F SUNQUIST. 2002. Wild cats of the World. The University of Chicago Press. Chicago and London. [ Links ]
48. TRAVAINI A. 1994. Demografía de la población de zorros (Vulpes vulpes) del Parque Nacional de Doñana. Tesis Doctoral inédita, Universidad Autónoma de Madrid, España. [ Links ]
49. VAN VALKENBURGH B. 1988. Trophic diversity in past and present guilds of large predatory mammals. Paleobiology 14:155-173. [ Links ]
50. VAN VALKENBURGH B. 1989. Carnivore dental adaptations and diet: a study of trophic diversity within guilds. Pp. 410-436, en: Carnivore behavior, ecology and evolution (JL Gittleman, ed.). Cornell University Press, Ithaca, NY. Estados Unidos de América. [ Links ]
51. VAN VALKENBURGH B. 1991. Iterative evolution of hypercarnivory in canids: evolutionary inteactions among sympatric predators. Paleobiology 17:340- 362. [ Links ]
52. VAN VALKENBURGH B. 1995. Tracking ecology over geological time: evolution within guilds of vertebrates. Trends in Ecology and Evolution 2:71-76. [ Links ]
53. VAN VALKENBURGH B y KP KOEPFLI. 1993. Cranial and dental adaptations to predation in canids. Pp. 15-37, en: Mammals as predator (N Dunstone y ML Gorman, eds. [ Links ]).
54. VAN VALKENBURGH B y RK WAYNE. 1994. Shape divergence associated with size convergence in sympatric East African jackals. Ecology 75:1567-1581. [ Links ]
55. WAINWRIGHT PC. 1994. Functional morphology as a tool in ecological research. Pp. 42-60, en: Ecological Morphology. Integrative Organismal Biology (PC Wainwright y SM Reilly, eds.). The University of Chicago Press. Chicago and London. [ Links ]
56. WAYNE RK, B VAN VALKENBURGH, PW KAT, TK FULLER, WE JOHNSON y SJ O'BRIEN. 1989. Genetic and morphological divergence among sympatric canids. Journal of Heredity 80:447-454. [ Links ]
57. WIENS JA. 1989. The ecology of birds communities. Vol. 2. Processes and variations. Cambridge University Press, Cambridge. [ Links ]
58. ZAPATA SC. 2005. Reparto de recursos en gremios de carnívoros: una aproximación ecológica y morfológica. Tesis Doctoral inédita, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. [ Links ]
59. ZAPATA SC, A TRAVAINI y M DELIBES. 1995. Comparación entre varias técnicas de estimación de la edad en zorros, Vulpes vulpes, de Doñana (sur de la Península Ibérica). Doñana Acta Vertebrata 22:29- 50. [ Links ]
60. ZAPATA SC, MC FUNES y AJ NOVARO. 1997a. Estimación de la edad en el zorro colorado patagónico (Pseudalopex culpaeus). Mastozoología Neotropical 4:145-150. [ Links ]
61. ZAPATA SC, R GARCÍA PEREA, JF BELTRÁN, P FERRERAS y M DELIBES. 1997b. Age determination of Iberian Lynx (Lynx pardinus) using canine radiograph and cementum annuli enumeration. Zeitschrift für Säugetierkunde 62:119-123. [ Links ]
62. ZAPATA SC, A RAVAINI y M DELIBES. 1998. Neither large nor small: intermediate-sized food items for the cubs of the Patagonian gray fox (Pseudalopex griseus). Canadian Journal of Zoology 76:2281-2284. [ Links ]
63. ZAPATA SC, A TRAVAINI, M DELIBES y R. MARTÍNEZ-PECK. 2005a. Annual food habits of the lesser grison (Galictis cuja) at the southern limit of its range. Mammalia 69:85-88. [ Links ]
64. ZAPATA SC, A TRAVAINI, M DELIBES y R. MARTÍNEZ-PECK. 2005b. Food habits and resource partitioning between gray and culpeo foxes in southeastern Argentine Patagonia. Studies on Neotropical Fauna and Environment 40:97-103. [ Links ]
Recibido 19 junio 2006.
Aceptación final 31 julio 2007.














