Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.15 n.2 Mendoza jul./dic. 2008
Ensamble de murciélagos en sitios con diferente grado de perturbación en un bosque montano del Parque Nacional Carrasco, Bolivia
Aideé Vargas Espinoza1*, Luis. F. Aguirre1, 2, M. Isabel Galarza1 y Edgar Gareca2
1 Centro de Estudios en Biología Teórica y Aplicada, Programa para la Conservación de Murciélagos de Bolivia, Urbanización Las Magnolias II, casa C30, Cochabamba, Bolivia,
*<chiroderma@gmail.com>;
2 Centro de Biodiversidad y Genética, Facultad de Ciencias y Tecnología, Universidad Mayor de San Simón, Cochabamba, Bolivia, <laguirre@fcyt.umss.edu.bo>.
RESUMEN: Los bosques montanos en Bolivia se caracterizan por ser sitios con alta diversidad y endemismo y por las amenazas que enfrentan debido a las actividades humanas, principalmente agrícolas. Evaluamos los ensambles de murciélagos en el bosque de pie de monte del Santuario de Vida Silvestre Cavernas de Repechón del Parque Nacional Carrasco en función de los efectos de perturbación producida por actividades agrícolas tradicionales durante 11 meses consecutivos. Se encontró que el ensamblaje total de murciélagos estaba compuesto por 36 especies basado en una muestra de 2518 individuos representantes de las familias Phyllostomidae y Vespertilionidae. La especie más abundante en todos los ambientes fue Carollia perspicillata; en barbechos, bosques jóvenes y maduros C. brevicauda fue la segunda especie más abundante, mientras que Artibeus lituratus lo fue en cultivos. Los frugívoros fueron el gremio mejor representado en cuanto a número de especies y número de individuos. Los sitios más semejantes en cuanto a la composición de especies fueron barbechos y bosque maduros; los bosques jóvenes fueron menos semejantes a los primeros y los cultivos fueron los sitios más diferentes a todos. Debido a que los sitios de estudio fueron mucho más pequeños en relación a la matriz de bosque secundario dominante, la mayoría de las especies de murciélagos estarían usando esos lugares como sitios de paso.
ABSTRACT: Assemblage of bats in sites with varying degrees of disturbance in montane forests of Carrasco National Park, Bolivia. Montane forests in Bolivia are characterized by sites with high biodiversity and endemism but are also faced by threats due to human activities, mainly agriculture. For a period of 11 months, we evaluated the effect of human disturbance due to traditional agricultural activities on bat communities in a montane forest in the foothills of the Santuario de Vida Silvestre Cavernas de Repechón, Carrasco National Park. We found that the total community contained 36 species based on a sample of 2518 individuals belonging to Phyllostomidae and Vespertilionidae. The most abundant species in all sites was Carollia perspicillata; in abandoned fields, young forest and mature forest C. brevicauda was the second most abundant species, whereas in agricultural lands Artibeus lituratus was the most common. Fruit-eating bats were the best represented trophic guild in terms of species and abundance. The sites with most similar species composition were abandoned fields and mature forests. Young forests were less similar to abandoned fields, and agricultural lands differed most from all other sites. Because the study sites were small compared with the larger matrix consisting mostly of secondary forest, most of the bat species are probably using these sites as commuting areas.
Palabras clave. Bolivia; Chiroptera; Comunidades; Perturbación; Yungas.
Key words. Bolivia; Chiroptera; Communities; Disturbance; Yungas.
INTRODUCCIÓN
El incremento de las actividades humanas altera y degrada hábitats naturales, lo que conduce a la perdida de la biodiversidad en todo el mundo. Esta pérdida es especialmente rápida en los trópicos, donde se encuentra la mayor biodiversidad del mundo (Huston, 1994). Ecosistemas maduros continúan disminuyendo a tasas alarmantes, y los efectos de las actividades humanas sobre la biodiversidad van desde dramáticos hasta sutiles. Estos efectos antropogénicos han dado como resultado una matriz seminatural, que consiste en parches de hábitat con diferentes grados de perturbación (Franklin, 1993). Se piensa que la conversión masiva de hábitats naturales en fragmentos pequeños y aislados es la mayor causa de la extinción de especies y de la mayor importancia para aspectos de conservación (Whitmore, 1997; Pim y Raven, 2000). Es por esta razón que el mantenimiento de la diversidad tropical viene a ser de gran importancia. Sin embargo, al momento de implementar programas efectivos para preservar la diversidad biológica tanto en áreas protegidas como en hábitats afectados, es esencial comprender cuáles son los factores más importantes que determinan la composición de especies en las comunidades y sus interacciones con el medio ambiente a escala espacial y temporal (Lim y Engstrom, 2001; Patterson et al., 2003 ).
Los murciélagos son particularmente diversos y abundantes en los trópicos (Fenton, 1992). En el neotrópico existen cerca de 220 especies (Emmons y Feer, 1999), que son relativamente fáciles de encontrar y representan el segundo mayor orden de mamíferos en términos de número de especies (Simmons, 2005). Debido a su dramática radiación ecológica y evolutiva, los murciélagos ocupan virtualmente cada nivel trófico, siendo desde consumidores primarios hasta terciarios. Se alimentan de fruta, insectos, néctar, polen, peces, sangre, vertebrados y hojas, y en muchos casos seleccionan hábitats específicos (Hill y Smith, 1985; Fenton, 1992; Kalko, 1998; Patterson et al., 2003). Son importantes en los procesos ecológicos a través de las interacciones, como la dispersión de semillas, polinización de plantas y regulación de las poblaciones de insectos (Fleming, 1988; 1993; Whittaker, 1993; Medellín y Gaona, 1999).
Su diversidad, abundancia e importancia en ecosistemas tropicales los sitúa como organismos de investigación ecológica y sus respuestas a la fragmentación de bosques y perturbación de hábitat, especialmente en tierras bajas, han recibido atención (Fenton et al., 1992; Schulze et al., 2000; Bernard y Fenton, 2002; Aguirre et al., 2003; Gorresen y Willig, 2004). Se ha demostrado que las comunidades de murciélagos responden a cambios en su hábitat (e.g. Gorresen y Willig, 2004); muchas veces tienden a ser menos diversas y dominadas por pocas especies en hábitats deforestados (Reis y Muller, 1995), en algunos casos especies incrementan su número, tal como sucede con Desmodus rotundus y Carollia perspicillata o disminuyen como sucede con los Phyllostominae (Medellín et al., 2000). A pesar de la cantidad de investigaciones y continuas revisiones en el tema, poco se conoce sobre los ensambles de murciélagos y sus respuestas a la degradación del hábitat, especialmente en ambientes montanos.
En Bolivia, existen muchos ambientes alterados, entre estos el bosque húmedo montañoso conocido como Yungas. Estos bosques debido a su topografía y a la alta actividad agrícola ejercida por la densa población humana son una de las regiones más impactadas del país (Ribera, 1992) habiendo sido catalogadas como vulnerables por el documento de evaluación mundial de eco-regiones (Olson y Dinerstein, 1998). El bosque montano de Yungas es un área muy rica en especies. Está considerada como centro de diversidad de varios grupos sensibles a clima húmedo y es el centro de endemismo más importante de Bolivia, con alta diversidad, especialmente en altitudes medianas (Ibisch y Mérida, 2003). En estos ambientes, la vida silvestre se encuentra afectada por la ampliación de la frontera agrícola, explotación forestal, cacería, comercio ilegal de especies y turismo desorganizado (MDSP, 2001). En el Parque Nacional Carrasco, ubicado en el departamento de Cochabamba, la zona de Yungas de pie de monte constituye una franja importante dentro de toda el área. Esta zona se encuentra parcialmente protegida, con presencia de pequeñas parcelas agrícolas y otras en regeneración.
La evaluación de los efectos de la perturbación sobre los patrones y procesos ecológicos en áreas especificas produce información importante sobre la cual basar decisiones de manejo y conservación, por lo que el estudio del ensamblaje de las especies de murciélagos puede dar información útil incluso para la toma de decisiones (Medellín et al., 2000).
En esta investigación nuestro objetivo fue el de evaluar cómo se diferencian los ensambles de murciélagos en el bosque de pie de monte del Santuario de Vida Silvestre Cavernas de Repechón del Parque Nacional Carrasco, en función de los efectos de la perturbación producida por actividades agrícolas tradicionales.
MATERIALES Y MÉTODOS
Área de estudio
La investigación fue realizada en el departamento de Cochabamba, Bolivia, en el pie de monte del Santuario de Vida Silvestre Cavernas de Repechón que forma parte del Parque Nacional Carrasco (17°03'42" S, 65°28'27" O). Esta zona tiene una altitud de 450 msnm, la temperatura media anual es de 24 ºC, y la precipitación está entre 5630 y 6253 mm anuales. El área se caracteriza por tener cuevas, serranías y valles aluviales (Fig. 1), con elementos de selvas amazónicas pluviales hiperhúmedas bien drenadas del subandino inferior, descritas como la serie de Talauma boliviana y Eschweilera coriaceae (Navarro y Maldonado, 2002).
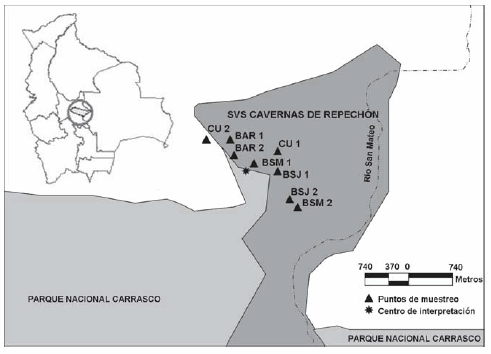
Fig. 1. Mapa de ubicación de los puntos de muestreo en el Santuario de Vida Silvestre Cavernas de Repechón (SVS Cavernas de Repechón), Parque Nacional Carrasco. Donde CU: Cultivo; BAR: Barbecho; BSM: Bosque Secundario Maduro; BSJ: Bosque Secundario Joven.
Diseño del estudio y muestreo
En un área de 35.5 hectáreas dentro del Santuario, se delimitaron cuatro ambientes con diferentes grados de intervención humana: bosques maduros, bosques secundarios, barbechos y cultivos. Cada ambiente contó con una réplica y la distancia entre réplicas fue mayor a 500 m para asegurar la independencia entre ellas (Medellín et al., 2000). Los bosques maduros se caracterizaron por ser los ambientes mejor conservados, con una edad mayor a los 25 años, con doseles entre 35-40 m, área basal 23.6 y una diversidad de 4.24. Los bosques secundarios fueron ambientes en regeneración con una edad entre 10-12 años, la altura de dosel entre 30-35 m, área basal 16.6 y una diversidad de 4.02.
Los barbechos fueron cultivos abandonados por un tiempo de 0.5 años, con doseles entre 5-10 m, área basal 0.105 y una diversidad de 2.8. Finalmente, los cultivos se caracterizaron por ser ambientes homogéneos (monocultivos) con predominancia de cítricos.
El trabajo se realizó durante 11 meses consecutivos a partir de mayo de 2003 hasta abril de 2004. Las evaluaciones fueron realizadas ocho días por mes, en fases de luna nueva y cuarto creciente, excepto durante el mes de julio y parte del mes de septiembre. En cada sitio de estudio se colocaron 10 redes/noche (8 redes de 6 m, una red de 9 m y una red de 12 m) durante dos noches consecutivas, de igual forma en la réplica. Las redes fueron abiertas al atardecer (entre las 18:30 a 19:30) hasta la media noche (entre las 00:30 a 01:30) a una altura de 50 cm del suelo. Los individuos capturados fueron medidos, identificados y posteriormente liberados, preservando aquellas muestras de identificación difícil en etanol al 90%. Las especies fueron identificadas con la ayuda de claves dicotómicas y descripción de especies (Medellín et al., 1985; Anderson, 1997; Emmons y Feer, 1999; La Val y Rodríguez, 2002).
Análisis
Para interpretar los resultados se realizaron curvas de acumulación de especies de cada uno de los sitios muestreados con ayuda del programa EstimateS501, con datos aleatorizados 50 veces y comparada con el estimador Jacknife1 (Colwell, 1997). Este método nos permitió estimar la representatividad de las comunidades de murciélagos en los diferentes ambientes.
Cuantificamos y comparamos la diversidad entre sitios mediante curvas rango-abundancia. La similitud entre los diferentes sitios fue medida y comparada mediante el índice de similitud proporcional SP = S min (pi1, pi2), donde pi1 y pi2 son los valores de las especies comparadas (Feinsinger, 2004) y el análisis de agrupamiento en el programa Statistica (Versión 5.0, Statsoft Inc.).
Para determinar si las categorías tróficas variaban de acuerdo al tipo de perturbación estudiada, los murciélagos fueron divididos en distintos gremios. Consideramos que existe gran cantidad de literatura que describe las estrategias tróficas de murciélagos (Patterson et al., 2003), y pese a que es difícil la caracterización de los mismos, en este trabajo utilizamos una modificación a los criterios propuestos por Kalko (1998) y en base a las observaciones de las heces de los individuos colectados durante el estudio (Morales, 2005). En base al principal alimento consumido se caracterizó a los individuos en los siguientes gremios: hematófagos, los que se alimentan de sangre; nectarívoros, de néctar; omnívoros, de una combinación de frutas e insectos; frugívoros de dosel, de una dieta compuesta principalmente de frutos del género Ficus; frugívoros de sotobosque, de una dieta compuesta principalmente de frutos de arbustos y árboles de los géneros Piper y Solanum; insectívoros, de insectos en el aire; y finalmente, acechadores, de insectos acechándolos desde un punto fijo.
Los datos de abundancia de los diferentes gremios de murciélagos presentes en cada hábitat se ajustaron a una distribución de Poisson (Quinn y Keough, 2003). Se realizaron análisis de varianza de acuerdo a la teoría de los modelos lineales generalizados (Littel et al., 1996) utilizando el proc genmod de SAS v. 8.00 y el estadístico de Wald (SAS Institute Inc., 2001). Los análisis se realizaron para cada gremio y para el total, en cada caso la variable de respuesta fue la abundancia de murciélagos por tiempo de apertura de red y el factor de diseño fue el sitio, con cuatro niveles: bosque maduro, bosque joven, barbecho y cultivo. Si se encontraban diferencias significativas entre sitios, se realizaban comparaciones planificadas utilizando el método estadístico de Wald (contrastes de un grado de libertad) entre el bosque maduro y los otros hábitats, con la finalidad de comparar el sitio con "menor" intervención antropogénica con los otros sitios con mayor intervención.
RESULTADOS
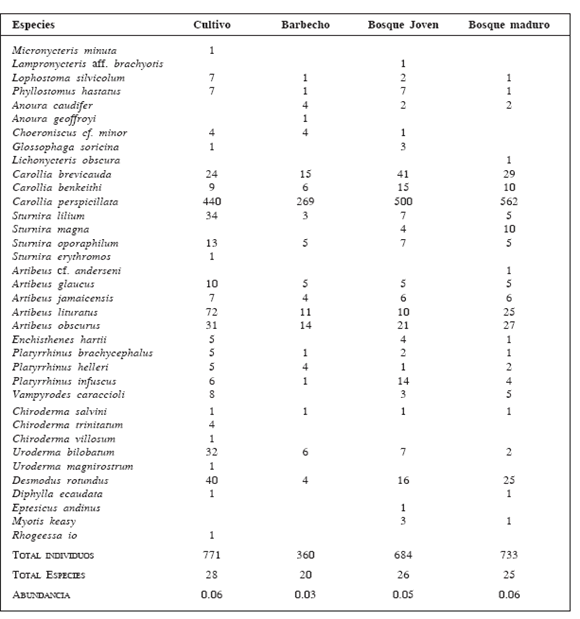
En 79 noches, con un esfuerzo de 50 794.74 m x h de red, capturamos 2518 murciélagos de 36 especies, lo cual nos arroja una abundancia de 0.05 ind/m x h. Las familias representadas fueron Phyllostomidae, con 33 especies y Vespertilionidae con tres especies (Tabla 1). La especie más abundante del ensamblaje total fue Carollia perspicillata, con un valor de abundancia de 0.0348 ind/m x h, seguida por Artibeus lituratus, muy por debajo de la primera, con 0.0023 ind/m x h. El sitio con el mayor número de especies fue el cultivo (28), mientras que el barbecho fue el sitio donde se registró el valor más bajo en número de especies (20); tanto el bosque joven como el maduro presentaron números similares (26 y 25, respectivamente). Los sitios con mayor abundancia de murciélagos fueron el cultivo y bosque maduro (0.06 ind/m x h), en el bosque joven se capturaron 0.05 ind/m x h y en el barbecho fue donde se capturaron menos murciélagos (0.03 ind/m x h; Tabla 1).
Tabla 1
Composición de la comunidad de murciélagos en cuatro sitios del Santuario de Vida Silvestre Cavernas de Repechón, Parque Nacional Carrasco entre mayo 2003-abril 2004.
La curva de acumulación para los cuatro sitios, mostró que existe una tendencia al continuo incremento de las especies de murciélagos con el muestreo. Sin embargo, a pesar de la adición de nuevas especies, se observó que en todos los ambientes se registraron más del 75% de las especies hacia la mitad de la investigación (Fig. 2). De acuerdo al estimador Jacknife1 en el ambiente de cultivo es posible registrar otras siete especies más, en barbecho otras seis, en bosque joven otras siete, y en bosque maduro se esperan otras nueve especies.
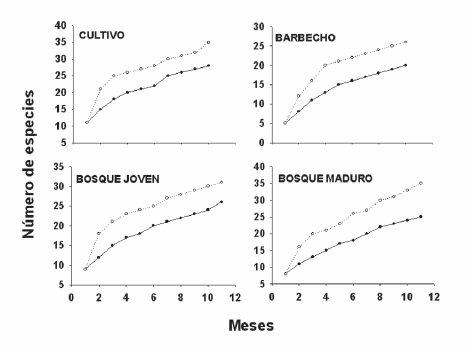
Fig. 2. Curvas de acumulación de especies de cada sitio muestreado en el Santuario de Vida Silvestre Cavernas de Repechón, Parque Nacional Carrasco entre mayo de 2003 y abril de 2004. La línea continua y círculos sólidos representan al número de especies observadas. La línea punteada y círculos abiertos representan al número de especies esperadas con el estimador Jacknife.
La abundancia en cada uno de los ambientes evaluados muestra que C. perspicillata fue la especie más abundante en cada uno de estos, presentando valores tan altos de captura que las siguientes especies en orden de abundancia se encuentran hasta 20 veces por debajo de la primera. En barbechos, bosques jóvenes y bosques maduros C. brevicauda es la segunda especie más abundante, mientras que en cultivo es A. lituratus (Fig. 3).
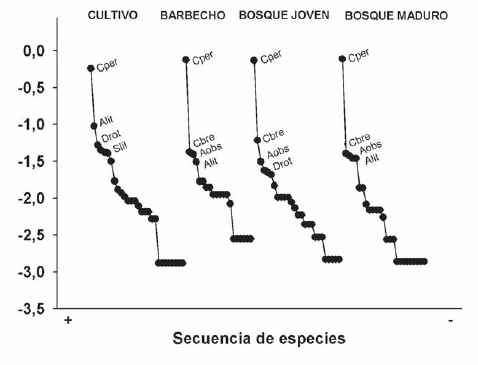
Fig. 3. Diagrama de rango-abundancia de la comunidad de murciélagos en los cuatro ambientes muestreados en el Santuario de Vida Silvestre Cavernas de Repechón, Parque Nacional Carrasco entre mayo 2003 a abril 2004. Donde: Cper: Carollia perspicillata, Alit: Artibeus lituratus, Drot: Desmodus rotundus, Slil: Sturnira lilium, Cbre: Carollia brevicauda, Aobs: Artibeus obscurus.
Los frugívoros fueron el gremio dominante en todos los ambientes, en este grupo se incluyen especies de murciélagos de sotobosque y algunas especies que se mueven en el dosel. Los insectívoros se presentaron como el segundo gremio más importante en el cultivo y en el bosque maduro, mientras que el gremio de los nectarívoros lo fue en el barbecho y el bosque joven. Considerando la abundancia total de murciélagos, se encontró un número similar de los mismos al comparar entre bosque maduro y bosque joven (P [χ2 > 1.69] = 0.193) y entre bosque maduro y cultivo (P[χ2 > 0.96] = 0.327). Sin embargo, el número de murciélagos encontrados en barbecho fue cerca de la mitad del número encontrado en bosque maduro (P [χ2 > 122.06] < 0.001). Se observó también que los insectívoros, nectarívoros, omnívoros e insectívoros acechadores no presentaron diferencias significativas al realizar las comparaciones entre el bosque maduro y los otros hábitats (insectívoros: P [χ2 > 3.17] = 0.367, nectarívoros: P [χ2 > 3.07] = 0.381, omnívoros: P [χ2 > 6.63] = 0.085, acechadores: P [χ2> 7.66] = 0.054, Fig. 4). Por su parte, los murciélagos frugívoros especialistas de Ficus y los frugívoros especialistas de Solanum-Piper presentaron abundancias diferentes en los ambientes más degradados (cultivo y barbecho) en relación al más conservado (bosque maduro), para especialistas en Ficus (P [χ2 > 107.64] < 0.001) y para especialistas en Solanum-Piper (P [χ2 > 117.54] < 0.001). De esta manera, se observó más del doble de individuos especialistas de Ficus en cultivo que en bosque maduro (P [χ2 > 40.97] < 0.001) y cerca de la mitad de estos individuos en barbecho (P [χ2 > 8.38] = 0.004). Para el caso de los especialistas en Solanum y Piper, en barbecho se observó la mitad de individuos presentes en bosque maduro (P [χ2 > 18.56] < 0.001), y en cultivo se encontró tres cuartos de la abundancia de bosque maduro (P [χ2 > 8.73] = 0.003). El otro gremio especialista, que incluyó a las especies hematófagas, presentó abundancias similares en cultivo (P [χ2 > 3.30]= 0.069) y en bosque joven (P [χ2 > 2.33] = 0.126) en relación a bosque maduro; mientras que la abundancia en barbecho fue cerca de seis veces menor que en bosque maduro (P [χ2 > 12.15] < 0.001).
El análisis de similitud proporcional mostró al barbecho y al bosque maduro como los sitios más similares y al cultivo y bosque maduro como los más diferentes (Tabla 2). En función de este índice se agruparon las comunidades de murciélagos de los distintos ambientes observándose dos grandes conjuntos: uno conformado por tres ambientes, en el que barbecho y bosque maduro forman un subconjunto a una distancia de ligamiento de 11, y asociado a este a una distancia de 16 se encuentra el bosque joven, el cultivo se encuentra como un ambiente plenamente separado de los tres primeros (Fig. 5).
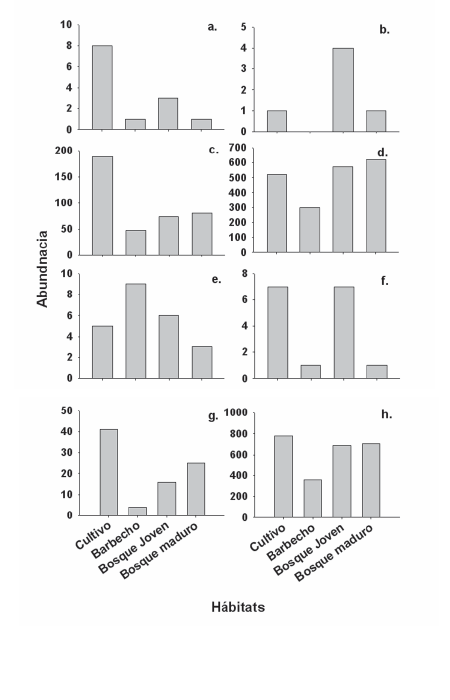
Fig. 4. Abundancia de los diferentes gremios tróficos encontrados en el Parque Nacional Carrasco según los hábitats estudiados. a.= Insectívoros acechadores, b.= Insectívoros, c. = Frugívoros de dosel especialistas en Ficus, d.= Frugívoros de sotobosque especialistas en Piper y Solanum, e.= Nectarívoros, f.= Omnívoros, g.= Hematófagos, h.= Total.
Tabla 2
Índices de similitud proporcional de la comunidad de murciélagos entre cuatro ambientes del Santuario de Vida Silvestre Cavernas de Repechón.
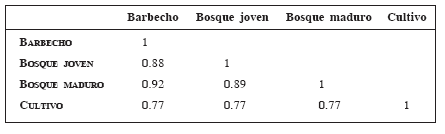
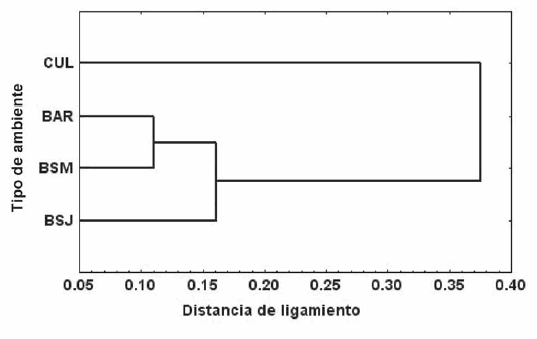
Fig. 5. Dendrograma de similitud entre comunidades de murciélagos de cuatro sitios del Santuario de vida Silvestre Cavernas de Repechón, Parque Nacional Carrasco. Donde CUL: Cultivo; BAR: Barbecho; BSM: Bosque Secundario Maduro; BSJ: Bosque Secundario Joven. Con ligamiento promedio pareado y Distancia Euclidiana.
DISCUSIÓN
El análisis de los datos obtenidos en este estudio, sugieren que en cuanto a composición y similitud proporcional de capturas, las zonas de cultivo son las áreas que se diferencian más del conjunto, mientras las más similares fueron barbechos y bosques maduros; estas diferencias son debidas principalmente a aumentos sutiles en abundancia de stenodermatinos y la presencia de insectívoros en estos sitios.
Los frugívoros fueron el gremio dominante en todos los sitios evaluados; insectívoros acechadores fueron importantes en los cultivos y bosques maduros y nectarívoros lo fueron en barbechos y bosques jóvenes. Murciélagos especialistas de Ficus y Piper-Solanum mostraron abundancias diferentes en los sitios más perturbados respecto de los más conservados. La gran abundancia de Carollia perspicillata caracterizó a todos los sitios, en los que siempre fue notoria la gran diferencia en proporción de capturas respecto de otras especies. Especies de mayor tamaño son más abundantes en áreas abiertas como el cultivo.
Después de 11 meses de muestreo de la fauna de murciélagos en el Santuario de Vida Silvestre Cavernas de Repechón, los registros reflejan aproximadamente entre el 30 a 32% del total de fauna de quirópteros en Bolivia (Salazar-Bravo et al., 2003; Aguirre, 2007) y el 66% de lo reportado en todo el Parque Nacional Carrasco (Vargas et al., 2005). Nuestros resultados mostraron una gran abundancia de filostómidos, principalmente frugívoros, con alta dominancia de C. perspicillata en todos los sitios muestreados, donde otras especies consideradas también abundantes se encuentran muy por debajo de la primera. La abundancia de C. perspicillata en el ensamblaje total (0.0348 ind/m x h) nos muestra que es un sitio con perturbación intermedia (Medellín et al., 2000).
No cabe duda que debido al método de captura (redes de neblina de sotobosque), se encuentra ausente todo el gremio de los insectívoros aéreos de lugares abiertos y una fracción importante de los insectívoros aéreos de bosques densos, pues el primer grupo vuela muy por encima del dosel del bosque y por otro lado se sabe que los insectívoros aéreos realmente detectan y evitan las redes de neblina (Simmons y Voss, 1998). Sin embargo, se presume que insectívoros aéreos de espacios abiertos son menos comunes en los ambientes estudiados debido a que pocas especies han sido detectadas con los métodos acústicos puestos a prueba en la zona (Barboza et al., datos no publicados) y en general este tipo de murciélagos prefiere ambientes tropicales donde aprovechan cursos de aguas tranquilas o alumbrados públicos para forrajear y obtener su alimento.
Consideramos que la riqueza de filostómidos, obtenida en los diferentes ambientes, refleja una fracción importante dentro de la comunidad de murciélagos neotropicales, puesto que para obtener una buena representación de la distribución y abundancia relativa de este grupo es necesario un esfuerzo de captura substancial (Kalko y Handley, 2001). Los protocolos de captura en los que utilizamos 20 redes de neblina abiertas durante seis horas/ noche nos permitieron registrar tanto especies comunes como especies raras (Kalko et al., 1996). La curva de acumulación en función del tiempo mostró un aumento continuo en el número de especies nuevas, aspecto que pudo estar influenciado en algunos casos por la llegada temporal de especies típicas de lugares más bajos (p.e., Chiroderma spp.) o de tierras altas (Anoura geoffroyi y Sturnira erythromos) posiblemente en busca de alimento o de refugios temporales.
Respecto a la distribución de especies en cada uno de los sitios, es notoria la dominancia de C. perspicillata en cada uno de ellos. Esto refleja su condición de frugívoro de sotobosque que explota ambientes de sucesión secundaria, cuyos tamaños poblacionales están dictados por la perturbación de estos ambientes (Fleming, 1988; Gorchov et al., 1993; Clarke et al., 2005) que son determinantes en la ecología de forrajeo de las especies (Schulze et al., 2000; Gorresen y Willig, 2004) o por la explosión y presencia de frutos el año completo (tales como Piper spp.) en contraste con otros que pueden ser escasos (Gilbert, 1980; Fleming, 1985; Thies, 1998). Esto explica la abundante presencia de esta especie en todos los ambientes estudiados que a pesar de las diferencias estructurales aparentemente se comportan como ambientes que representan una matriz de bosque secundario en regeneración. Esta situación de alta abundancia de Carolliinae es conocida también para otros sitios de bosque húmedos tropicales de tierras bajas y con crecimiento secundario sucesional (Fenton et al., 1992; Medellín et al., 2000; Selaya, 2001). Otro factor importante y que podría ser determinante para la alta abundancia de C. perspicillata es la presencia de refugios disponibles (cuevas) en el área de estudio, donde esta especie se refugia de modo constante (Siles, 2002). Debido a la proximidad de estas cuevas a dos de los sitios (bosque maduro, bosque joven) que fueron evaluados es posible que hubiese existido una mayor probabilidad de captura de esta especie en estos sitios.
Especies raras dentro de la comunidad, como algunos insectívoros acechadores, fueron más abundantes en cultivo, al contrario de lo que se podría esperar para bosques maduros, donde se ha observado que este grupo es más diverso y abundante (Fenton et al., 1992; Medellín et al., 2000). Es posible que estos insectívoros (Lophostoma silvicolum y Mycronycteris minuta) se muevan en todos los sitios como si se tratase de un continuo del bosque, o hayan encontrado mayor disponibilidad de alimento en el cultivo; se ha observado que para la mayoría de grupos de insectos la riqueza es generalmente alta y la abundancia total es más baja en bosques no perturbados, comparados con áreas cultivadas (Power, 1996).
En lo que respecta a la similitud entre los sitios, no se observaron grandes diferencias entre las comunidades de murciélagos de los ambientes estudiados, mostrándose un comportamiento similar en los diagramas de rango- abundancia. Con estos resultados y considerando la enorme complejidad de interacciones presentes en estos ambientes, nos inclinamos a pensar que toda el área de trabajo se encuentra dominada por una sola comunidad en la que frugívoros de tamaño pequeño son las especies más abundantes y que las áreas muestreadas son pequeñas superficies modificadas dentro de una matriz mayor que amortigua grandes cambios en la misma, y continúa funcionando como una unidad para este grupo de animales. Aunque cada ambiente presente pequeñas particularidades específicas, en el futuro es necesario conocer si un incremento en el tamaño de los fragmentos por las actividades antrópicas podría modificar en el tiempo a la comunidad de murciélagos.
AGRADECIMIENTOS
Agradecemos por el constante apoyo en campo a los guardaparques y guías del campamento Guacharos, R. Portugues, E. Jaimes, P. Mamani y J. Saavedra. Al director del Parque Nacional Carrasco, Hugo Antezana por todo su apoyo y a Rodrigo Fanola por la elaboración del mapa. A todos los auxiliares que participaron en las campañas a la zona durante esta etapa: A. Selaya, L. Siles, A. Muñoz, R. Morales, M. Crespo, J.C. Pérez, K. Barboza, R. Quinteros, M. Hinojosa, E. Alba, J. Espindola, C. Medrano, E. Limachi, R. Vargas, F. Terceros, V. Colque, C. Orozco y G. Navarro. Este trabajo fue financiado por The John D. and Catherine T. MacArthur Foundation a través de Wildlife Trust y datos adicionales con fondos provenientes del Premio Whitley a L. F. Aguirre (The Whitley Fund for Nature). Deseamos agradecer a los revisores anónimos, a Jorge Salazar-Bravo y a Teresa Tarifa por sus comentarios y correcciones a la redacción del texto, y a Erik Mattisen por el resúmen en inglés. Este trabajo fue presentado en el Primer Congreso Nacional de Mastozoología en Bolivia, realizado el 2005 en la ciudad de Cochabamba, Bolivia. Esta publicación es la contribución 19 de la Wildlife Trust Alliance.
LITERATURA CITADA
1. AGUIRRE LF, L LENS, R VAN DAMME y E MATTHYSEN. 2003. Consistency and variation in the bat assemblage inhabiting two forests islands within a neotropical savanna in Bolivia. Journal of Tropical Ecology 19:367-374. [ Links ]
2. AGUIRRE LF (Ed.). 2007. Historia Natural, Distribución y Conservación de los Murciélagos de Bolivia. Editorial: Centro de Ecología y Difusión Simón I. Patiño. Santa Cruz, Bolivia. [ Links ]
3. ANDERSON S. 1997. Mammals of Bolivia: Taxonomy and distribution Bulletin of the American Museum of Natural History 231:1-652. [ Links ]
4. BERNARD E y MB FENTON. 2002. Species diversity of bats (Mammalia: Chiroptera) in forests fragments, primary forests, and savannas in Central Amazonia, Brazil. Canadian Journal of Zoology 80:1124-1140. [ Links ]
5. CLARKE FM, DV PIO y PA RACEY. 2005. A comparison of logging systems and bat diversity in the Neotropics. Conservation Biology 19:1194-1204. [ Links ]
6. COLWELL RK. 1997. EstimateS: Statistical estimation of species richness and shared species from samples. Version 5. User's Guide and application published at: http://viceroy.eeb.uconn.edu/estimates [ Links ]
7. EMMONS L y F FEER. 1999. Mamíferos de los Bosques Húmedos de América Tropical. Una Guía de Campo. FAN. Santa Cruz de la Sierra, Bolivia. [ Links ]
8. FEINSINGER P. 2004. El Diseño de Estudios de Campo para la Conservación de la Biodiversidad. Editorial FAN, Santa Cruz de la Sierra, Bolivia. [ Links ]
9. FENTON MB. 1992. Bats. Facts On File, Inc. New York. [ Links ]
10. FENTON MB, L ACHARYA, L AUDET, D HICKEY, MB MERRIMAN, C OBRIST y M SYME. 1992. Phyllostomid bats (Chiroptera: Phyllostomidae) as indicators of habitat disruption in the Neotropics. Biotropica 24:440-446. [ Links ]
11. FLEMING TH. 1985. Coexistence of five sympatric Piper (Piperaceae) species in a tropical dry forest. Ecology 66(3):688-700 [ Links ]
12. FLEMING TH. 1988. The Short-tailed fruit bat. University of Chicago Press, Chicago. [ Links ]
13. FLEMING TH. 1993. Plant-visiting bats. American Scientist 81:461-647. [ Links ]
14. FRANKLIN JF. 1993. The fundamentals of ecosystem management whit applications in the Pacific Northwest. Pp. 127-145, en: Defining Sustainable Forestry (GH Aplet, N Johnson, JT Olson y VA Sample, eds.), Island Press, Washington D.C. [ Links ]
15. GILBERT LE. 1980. Food web organization and the conservation of neotropical diversity. Pp. 11-33, en: Conservation biology, an evolutionary-ecological perspective (ME Soule y BA Wilcox, Ed.) Sinauer, Sunderland, Massachusetts. [ Links ]
16. GORCHOV DL, D CORNEJO, C ASCORRA y M JARAMILLO. 1993. The role of seed dispersal in the natural regeneration of rain forest alter stripcutting in the Peruvian Amazon. Vegetatio 107/ 108:339-349. [ Links ]
17. GORRESEN PM y MR WILLIG. 2004. Landscape responses of bats to habitat fragmentation in Atlantic Forest of Paraguay. Journal of Mammalogy 85:688- 697. [ Links ]
18. HILL JE y D SMITH. 1985. Bats, a natural history. Texas University Press, Austin. [ Links ]
19. HUSTON M. 1994. Biological Diversity. The coexistence of species on changing landscapes. Cambridge University Press, New York. [ Links ]
20. IBISCH PL y G MERIDA (eds.). 2003. Biodiversidad: La riqueza de Bolivia. Estado de conocimiento y conservación. Ministerio de Desarrollo Sostenible. Editorial FAN, Santa Cruz de la Sierra, Bolivia. [ Links ]
21. KALKO EKV, CO HANDLEY y D HANDLEY. 1996. Organization, diversity, and long-term dynamics of a Neotropical bat community. Pp. 503-553, en: Longterm studies in vertebrate communities (M Cody y J Smallwood, eds.). Academic Press, Los Angeles. [ Links ]
22. KALKO E. 1998. Organisation and diversity of tropical bat communities through space and time. Zoology 101:281-297. [ Links ]
23. KALKO EKV y CO HANDLEY Jr. 2001. Neotropical bats in the canopy: diversity, community, structure, and implications for conservation. Plant Ecology 153:319-333. [ Links ]
24. LA VAL, RK y B RODRIGUEZ-H. 2002. Murciélagos de Costa Rica/Costa Rica Bats. Santo Domingo de Heredia, Instituto Nacional de Biodiversidad. Costa Rica. [ Links ]
25. LIM BK y MD ENGSTROM. 2001. Species diversity of bats (Mammalia: Chiroptera) in Iwokrama Forest, Guyana, and the Guianan subregion: implications for conservation. Biodiversity and Conservation 10:613-657. [ Links ]
26. LITTELL R, G MILLIKEN, W STROUP y R WOLFINGER. 1996. SAS® System for Mixed Models. Cary, NC: SAS Institute Inc. [ Links ]
27. MEDELLIN RA, DE WILSON y D NAVARRO. 1985. Micronycteris brachyotis. Mammalian Species 251:1-4 [ Links ]
28. MEDELLIN R y O GAONA. 1999. Seed dispersal by bats and birds in forest and disturbed habitats in Chiapas, México. Biotropica 31:432-441 [ Links ]
29. MEDELLIN R, M EQUIHUA y M AMIN. 2000. Bat diversity and abundance as indicators of disturbance in Neotropical Rainforests. Conservation Biology 14:1666-1675. [ Links ]
30. MDSP. 2001. Estrategia Nacional de conservación y uso sostenible de la biodiversidad. La Paz. Bolivia. [ Links ]
31. MORALES R. 2005. Composición y sobreposición alimentaria de murciélagos frugívoros en el Santuario de Vida Silvestre Cavernas de Repechón (Cochabamba - Bolivia). Tesis de Licenciatura en Biología inédita. Facultad de Ciencias y Tecnología, Universidad Mayor de San Simón, Cochabamba, Bolivia. [ Links ]
32. NAVARRO G y M MALDONADO. 2002. Geografía Ecológica de Bolivia: Vegetación y Ambientes Acuáticos. Editorial: Centro de Ecología Simón I. Patiño-Departamento de Difusión. Cochabamba, Bolivia. [ Links ]
33. OLSON D y E DINERSTEIN. 1998. The Global 200: A representation approach to conserving the Earth´s most biologically valuable Ecoregions. Conservation Biology 12(3):502-515. [ Links ]
34. PATTERSON BD, MR WILLIG y R STEVENS. 2003. Trophic strategies, niche partitioning, and patterns of ecological organization. Pp: 536-579, en: Bat Ecology (TH Kunz y MB Fenton, eds.). University of Chicago Press, Chicago, Illinois. [ Links ]
35. PIMM SL y O RAVEN. 2000. Extincion by numbers. Nature 403:843-845. [ Links ]
36. POWER AG. 1996. Arthropod diversity in forest patches and agroecosystems of tropical landscapes. Pp. 91- 110, en: Forest patches in tropical landscapes (J Schelhas y R Greenberg, eds.). Island Press, Washington D.C. [ Links ]
37. QUINN G y M KEOUGH. 2003. Experimental design and data analysis for biologists. Cambridge University Press. United Kingdom. [ Links ]
38. REIS NR y MF MULLER. 1995. Bat diversity of forest and open areas in a subtropical region of south Brazil. Ecología Austral 5:31-36. [ Links ]
39. RIBERA MO 1992. Regiones Ecológicas. Pp. 9-72, en: Conservación de la Biodiversidad en Bolivia (M Marconi ed.). CBC-Bolivia, USAID/Bolivia. La Paz, Bolivia. [ Links ]
40. SALAZAR-BRAVO J, T TARIFA, LF AGUIRRE, E YENSEN y T YATES. 2003. Revised Checklist of Bolivian Mammals. Occasional Papers, Museum of Texas Tech University 220:1-27. [ Links ]
41. SAS INSTITUTE INC. 2001. Software, version 8.00. SAS Institute, Cary, NC. [ Links ]
42. SCHULZE MD, NE SEAVY y DF WHITACRE. 2000. A comparison of the phyllostomid bat assemblages in undisturbed Neotropical forest and forest fragments of a flash-and-burn farming mosaic in Peten, Guatemala. Biotropica 31(1):174-184. [ Links ]
43. SELAYA A. 2001. Estructura de la comunidad de murciélagos en tres tipos de bosque en el Valle del Sacta (Chapare-Cochabamba). Tesis de Licenciatura en Biología inédita. Facultad de Ciencias y Tecnología, Universidad Mayor de San Simón, Cochabamba, Bolivia. [ Links ]
44. SILES L. 2002. Algunos Patrones de Uso por Murciélagos en las Cavernas de Repechón (Parque Nacional Carrasco - Cochabamba). Tesis de Licenciatura en Biología inédita. Facultad de Ciencias y Tecnología, Universidad Mayor de San Simón, Cochabamba, Bolivia. [ Links ]
45. SIMMONS N y R VOSS. 1998. The mammals of Paracou, French Guiana. A Neotropical Lowland Rainforest Fauna, Part 1. Bats. Bulletin of the American Museum of Natural History 237:1-219. [ Links ]
46. SIMMONS NB. 2005. Order Chiroptera. Pp. 312-529, en: Mammal species of the world: a taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Maryland. [ Links ]
47. THIES W. 1998. Resource and habitat use in two frugivorous bat species (Phyllostomidae: Carollia perspicillata and C. castanea) in Panama: Mechanisms of coexistence. Unpublished Ph. D. thesis. University of Tübingen. Germany. [ Links ]
48. VARGAS A, MI GALARZA y LF AGUIRRE. 2005. Guía de Murciélagos del Parque Nacional Carrasco. Ed. Conservación Internacional-Bolivia. La Paz, Bolivia. [ Links ]
49. WHITMORE TC. 1997. Tropical forest disturbance, disappearance and species lost. Pp: 3-12, en: Tropical Forest Remmants: Ecology, management, and conservation of fragmented communities. (WF Laurance y RO Bierregaard eds. [ Links ]).
50. WHITTAKER JO Jr. 1993. Bats, bettles and bugs: more big brown bats mean less agricultural pests. Bats 11(1):23. [ Links ]
Recibido 4 febrero 2006.
Aceptación final 12 junio 2008.














