Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.16 n.1 Mendoza ene./jun. 2009
ARTÍCULOS Y NOTAS
Análisis de la variabilidad craneométrica en Ctenomys talarum (Rodentia, Ctenomyidae)
César M. García Esponda1*, Germán J. Moreira1,2, Enrique R. Justo3 y Luciano J. M. De Santis1
1 Cátedra de Anatomía Comparada, Facultad de Ciencias Naturales y Museo, calle 64 s/n (esq. 120), 1900 La Plata, Argentina .
2 Comisión de Investigaciones Científicas de la provincia de Buenos Aires (CIC),
3 Cátedra de Biología de Cordados, Facultad de Ciencias Exactas y Naturales, Uruguay 151, 6300 Santa Rosa, Argentina.
*[Correspondencia: <cesponda@fcnym.unlp.edu.ar>]
RESUMEN: Se llevó a cabo un análisis morfométrico craneano en cinco poblaciones de Ctenomys talarum, las cuales representan a las tres subespecies nominales reconocidas para esta especie de tuco-tuco (i.e., C. t. talarum, C. t. recesus y C. t. occidentalis). Se analizaron la variación geográfica craneana y el dimorfismo sexual. Para el estudio de variación geográfica, se llevaron a cabo dos análisis discriminantes, uno a partir de los datos originales y otro a partir de datos a los que se les eliminó previamente el efecto del tamaño, es decir, los cambios en las proporciones del cráneo debidos a la variación en el tamaño de los especímenes. Los resultados obtenidos indicaron que en esta especie existe un dimorfismo sexual significativo, por lo que los análisis de variación geográfica fueron realizados separadamente en ambos sexos. Los resultados de dichos análisis mostraron que, tanto en machos como en hembras, las diferencias significativas observadas entre las poblaciones son debidas principalmente al tamaño del cráneo. Una vez eliminado el efecto del mismo, las diferencias entre las localidades son mucho menores. Asimismo, la variación geográfica craneana observada no mostró una correlación clara con las tres subespecies de C. talarum, por lo que estos resultados no sustentan el reconocimiento de las mismas. En el género Ctenomys, el tamaño parece constituir un carácter evolutivo muy importante, tanto a niveles intraespecífico como interespecífico.
ABSTRACT: Analysis of craniometric variation in Ctenomys talarum (Rodentia, Ctenomyidae). A morphometric analysis on the skull of five populations of Ctenomys talarum was performed; these populations represent the three subspecies recognized for this species of tuco-tuco (i.e. C. t. talarum, C. t. recesus y C. t. occidentalis). We analyzed the skull geographic variation and the sexual dimorphism. When studying the geographic variation, two types of discriminant analyses were performed: one from the raw data and another from scale-corrected data, after a method that removes the information related to size was applied. We observed a significant sexual dimorphism in C. talarum; in consequence analyses of geographic variation were conducted separately in males and females. Results from these analyses showed significant differences between populations that were mainly due to the overall size of the skull, both in males and females. After influence of size was removed, differences between populations (due to shape differences on the skull) were less significant. Likewise, the geographic craniometric variation observed was not in agreement with the three nominal species of C. talarum, therefore, these results do not support their recognition. In the genus Ctenomys, size is assumed to be a very important evolutive character, both at the intraspecific as well as the interspecific levels.
Palabras clave. Ctenomys talarum; Craneometría; Variación geográfica; Dimorfismo sexual; Argentina.
Key words. Ctenomys talarum; Craniometry; Geographic variation; Sexual dimorphism; Argentina.
INTRODUCCIÓN
Los tuco-tucos (género Ctenomys de Blainville, 1826) son roedores caviomorfos que presentan una amplia distribución en América del Sur, desde los 17º hasta los 54º de latitud sur (Cabrera, 1961; Reig et al., 1990). Este género se caracteriza por su modo de vida subterráneo y por su politipismo, con alrededor de 56 especies actuales reconocidas (Reig et al., 1990). Esta gran diversidad específica se debe a una explosiva cladogénesis que tuvo lugar durante el Pleistoceno temprano (Reig et al., 1990), la cual habría sido causada principalmente por reordenamientos cromosómicos (e.g. Reig y Kiblisky, 1969; Ortells, 1995). En contraposición a esta gran variabilidad cariotípica, las distintas especies de tuco-tucos exhiben una relativa homogeneidad morfológica, a pesar de la diversidad de ambientes que habitan a lo largo de su amplia distribución (Reig et al., 1990). Pese a que diferentes mamíferos subterráneos presentan un conjunto de caracteres morfológicos similares debido a presiones selectivas impuestas por ese modo de vida particular (Nevo, 1979; 1999), distintos factores ambientales, como la textura del suelo o el tipo de vegetación, podrían generar diferencias adaptativas entre poblaciones o entre especies (Busch et al., 2000). En este sentido, se han publicado algunas contribuciones que exploran la variabilidad de la morfología craneana de Ctenomys, tanto a nivel interespecífico (e.g. Reig et al., 1965; Anderson et al., 1987; Rosi et al., 1992; Kelt y Gallardo, 1994; Freitas, 2005; Massarini y Freitas, 2005; Tiranti et al., 2005) como intraespecífico (e.g. Freitas y Lessa, 1984; Marinho y Freitas, 2000; Freitas, 2005; D´Anatro y Lessa, 2006).
Ctenomys talarum Thomas, 1898 es un tucotuco de pequeño tamaño (Redford y Eisenberg, 1992; Medina et al., 2007) que está representado por tres subespecies con distribuciones disyuntas (Justo et al., 2003): C. t. talarum Thomas, 1898, en la región costera de la provincia de Buenos Aires desde Magdalena hasta Santa Clara del Mar; C. t. recesus Thomas, 1912, en la región costera de la provincia de Buenos Aires desde Necochea hasta Bahía Blanca; y C. t. occidentalis Justo, 1992, en la región central de la provincia de La Pampa. Dos de estas subespecies viven en simpatría con otras dos especies de tuco-tucos: C. t. recesus comparte su rango de distribución geográfica con C. australis y C. t. occidentalis lo hace con C. azarae. Un análisis de la variación morfológica de diferentes poblaciones de C. talarum permitiría una mejor interpretación de los patrones de variación geográfica de esta especie y, eventualmente, de sus relaciones con otras especies de tuco-tucos. Los objetivos del presente análisis fueron explorar la variación craneométrica en distintas poblaciones de C. talarum y tratar de establecer la potencial correlación de la misma con las subespecies nominales reconocidas.
MATERIALES Y MÉTODOS
Se estudiaron 151 cráneos de individuos adultos de C. talarum procedentes de las provincias de La Pampa y Buenos Aires, Argentina. Los ejemplares se encuentran depositados en las colecciones del Museo de La Plata (La Plata), Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» (Buenos Aires) y Museo Municipal de Ciencias Naturales «Lorenzo Scaglia» (Mar del Plata) (Apéndice). Para su análisis, el material fue agrupado por localidad (Fig. 1) y sexo: La Pampa, Estancia La Florida, Departamento de Toay (36º 12´ S, 65º 06´ O; 17♀♀ , 12♂♂); Buenos Aires, Bahía Blanca (38º 44´ S, 62º 16´ O; 5♀♀, 12♂♂); Tres Arroyos (38º 22´ S, 60º 16´ O; 5♀♀, 22♂♂); Necochea (38º 34´ S, 58º 45´; 12♀♀, 9♂♂); Punta Indio (35º 18´ S, 57º 15´ O; 30♀♀; 27♂♂).
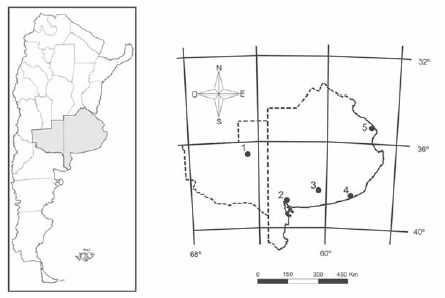
Fig. 1. Localidades de procedencia del material estudiado de C. talarum. 1, Estancia La Florida; 2, Bahía Blanca; 3, Tres Arroyos; 4, Necochea; 5, Punta Indio
Los individuos fueron considerados adultos teniendo en cuenta el desarrollo relativo de la cresta occipital y el grado de convexidad de los huesos parietales y occipital (i.e. los individuos que presentaban la región posterior del cráneo fuertemente convexa y la cresta occipital poco desarrollada fueron considerados como subadultos y no se incluyeron en este estudio). D´Anatro y Lessa (2006), en su estudio sobre Ctenomys rionegrensis, utilizan el grado de cierre de la sutura basioccipitalbasiesfenoides para determinar la edad relativa de los especímenes; sin embargo, en el presente análisis no fue posible establecer una correlación clara entre este rasgo y la edad.
Se tomaron 12 medidas craneanas utilizando un calibre digital (0.01 mm de precisión; Fig. 2); las mismas están basadas en otras publicaciones sobre el género Ctenomys (e.g. Reig et al. 1965; Langguth y Abella, 1970; Contreras y Contreras, 1984; Rosi et al., 1992; Marinho y Freitas, 2000): longitud basilar (LB), longitud palatilar (LP), longitud de los nasales (LN), ancho de los nasales (AN), diámetro del foramen preorbitario (FPO), ancho interorbitario (AIO), ancho bicigomático (ABC), ancho bimastoideo (ABM), longitud de la serie dentaria superior (SDS), longitud del diastema inferior (DI), longitud de la mandíbula (LM) y altura de la rama mandibular (AM).

Fig. 2. Medidas tomadas sobre el cráneo de Ctenomys talarum: longitud basilar (LB), longitud palatilar (LP), longitud de los nasales (LN), ancho de los nasales (AN), diámetro del foramen preorbitario (FPO), ancho interorbitario (AIO), ancho bicigomático (ABC), ancho bimastoideo (ABM), longitud de la serie dentaria superior (SDS), longitud del diastema inferior (DI), longitud de la mandíbula (LM) y altura de la rama mandibular (AM).
Se calcularon la media (X), el desvío estándar (DE) y el coeficiente de variación (CV = DE * 100/X) para cada sexo en cada una de las cinco localidades de estudio. Se evaluó el grado de dimorfismo sexual mediante métodos univariados (ANOVA) y multivariados (MANOVA).
En distintos estudios morfométricos, frecuentemente se ha intentado separar dos rasgos particulares de los organismos: tamaño y forma. Por ejemplo, en un análisis de componentes principales (ACP), la variabilidad representada por el primer componente (CP1) es interpretada como «tamaño» (cuando todos los coeficientes presentan el mismo signo y no difieren ostensiblemente en magnitud), mientras que la expresada por los restantes componentes es interpretada como «forma» (e.g. Bookstein, 1989). La variación de tamaño reflejada por el primer componente principal se debe a un patrón de crecimiento alométrico, que sería compartido por todos los individuos incluidos en el análisis. La variación observada en los componentes principales de «forma» sería aquella que no puede ser explicada mediante alometría. Se han desarrollado varios métodos mediante los cuales se intentó normalizar el tamaño, es decir, eliminar los cambios en las proporciones (cambios alométricos) que son debidos a la variación en el tamaño (e.g. Burnaby, 1966; Humphries et al. 1981; Thorpe, 1983; Lleonart, 2000). En este estudio, utilizamos el método propuesto por Lleonart et al. (2000) y que fuera aplicado en una dimensión multivariada por Marroig y Cheverud (2004). Como primer paso se llevó a cabo un análisis de componentes principales a partir de la matriz de varianzacovarianza de los datos transformados a sus logaritmos naturales y se tomó al primer componente principal (CP1) como el factor que representa el tamaño general. Se aplicó entonces la fórmula de Lleonart at al. (2000):
Y*i = Yi (Xo/Xi)b
donde Yi es el valor de un determinado rasgo o variable del individuo i; Xi es el antilogaritmo de la coordenada (score) del individuo i en el CP1 y representa el tamaño general de ese individuo; Xo es el tamaño promedio de todos los individuos calculado como la media de las coordenadas del CP1 transformadas a sus antilogaritmos; Y*i es el valor teórico calculado para un determinado rasgo o variable del individuo i que correspondería a ese tamaño promedio (Xo) y b es el coeficiente del CP1 para esa variable o rasgo.
En resumen, este método elimina el efecto de la variación de tamaño, llevando a todos los individuos a un tamaño promedio, pero simultáneamente ajustando sus formas a este nuevo tamaño según un patrón alométrico.
La variabilidad craneométrica entre las distintas poblaciones de C. talarum fue estudiada mediante análisis discriminantes realizados separadamente para cada sexo. Por un lado, estos análisis se realizaron a partir de los datos originales y, por otro lado, a partir de datos a los que se les había eliminado el efecto del tamaño y crecimiento alométrico mediante la metodología descripta anteriormente. A partir de las distancias de Mahalanobis al cuadrado entre las localidades, se construyeron dendrogramas utilizando el método UPGMA (unweighted pair-group method arithmetic average) con la finalidad de visualizar más fácilmente las relaciones entre las poblaciones.
Los análisis estadísticos se realizaron utilizando el programa STATISTICA versión 6.0 (StatSoft Inc., 2001).
RESULTADOS
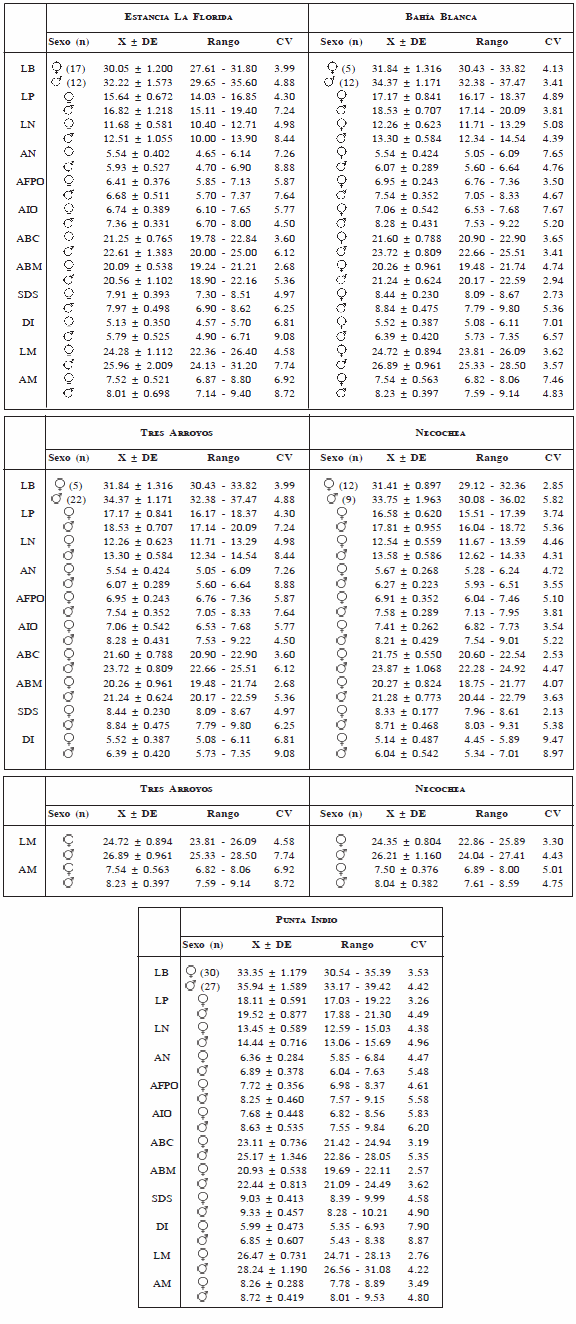
Los datos básicos de cada localidad se muestran en la Tabla 1. Los individuos de Estancia La Florida presentaron CVs mayores que los de las otras localidades. La longitud del diastema inferior (DI) fue la única medida que mostró una variabilidad relativamente alta en todas las localidades. En general, los machos exhibieron CVs más altos que los de las hembras, a excepción de la población de Tres Arroyos.
Tabla 1. Datos básicos de medidas craneanas (en mm) de Ctenomys talarum para cada localidad y sexo. n: número de especimenes; X, media; DE: desvío estándar; CV: coeficiente de variación; para las abreviaturas de las variables craneométricas véase el texto.
Los ANOVAs mostraron diferencias significativas entre machos y hembras en todas las variables (P < 0.001). El MANOVA mostró diferencias significativas tanto entre sexos ( Λ de Wilks = 0.433, g. l. = 12, 130, P < 0.001) como entre las localidades analizadas (Λ de Wilks = 0.111, g. l. = 48, 502, P < 0.001); sin embargo, la interacción sexo por localidad no resultó significativa (Λ de Wilks= 0.66, g. l. = 48, 502, P > 0.05), de manera que el grado de dimorfismo sexual sería similar en las distintas localidades.
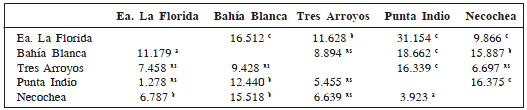
El análisis discriminante realizado a partir de los datos originales de los machos mostró diferencias significativas entre las poblaciones (Λ de Wilks= 0.102, F = 4.307, g. l. = 48, 256, P < 0.001). Solamente las dos primeras funciones discriminantes fueron significativas (P < 0.0001) explicando el 65.2 % y el 23.8% de la variación total, respectivamente. En el gráfico bivariado de estas dos funciones se observa una cierta separación de las poblaciones, especialmente a lo largo de la primera función discriminante (Fig. 3a). Esta función puede ser interpretada como un factor de tamaño, ya que todas las variables presentan una correlación positiva y relativamente alta con la misma. Además, esta interpretación se ve reforzada por la alta correlación (r = 0.91, P < 0.01) entre la misma y el CP1 de un análisis de componentes principales, extraído a partir de una matriz de varianza-covarianza de los datos originales (datos no presentados aquí). En la Fig. 3a puede observarse que los machos de Estancia La Florida son los de menor tamaño y los de Punta Indio y Bahía Blanca, los mayores. Las variables que presentaron la mayor correlación con la segunda función discriminante fueron el ancho de los nasales (correlación positiva) y el ancho interorbitario (correlación negativa). El 78% de los machos fueron clasificados correctamente en relación con su localidad de procedencia. Todas las distancias de Mahalanobis al cuadrado entre las poblaciones resultaron significativas, a excepción de las observadas entre Punta Indio- Bahía Blanca y Tres Arroyos-Necochea (Tabla 2). El dendrograma refleja las grandes distancias observadas entre los machos de Estancia La Florida y los de las otras localidades y la similitud entre las poblaciones de Punta Indio-Bahía Blanca y Necochea-Tres Arroyos (Fig. 4a).

Fig. 3. Gráficos de distribución de los machos de C. talarum en las dos primeras funciones discriminantes obtenidas a partir de a) datos originales y b) datos a los cuales se eliminó el efecto de la variación de tamaño (nótese que en este último caso sólo la primera función discriminante es significativa). Para cada población se muestran la media y la elipse obtenida a partir de los intervalos de confianza del 95%. ● Estancia La Florida; ■ Bahía Blanca; ○ Tres Arroyos; +Necochea; ▲ Punta Indio.
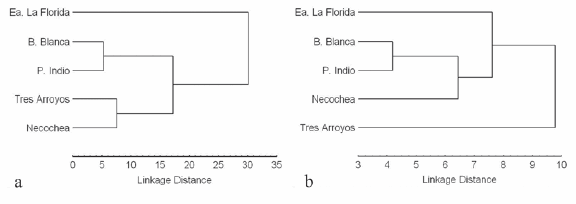
Fig. 4. Dendrogramas construidos a partir de las distancias de Mahalanobis al cuadrado entre machos de cinco poblaciones de C. talarum, calculadas a partir de datos originales y b) datos a los cuales se eliminó el efecto de la variación de tamaño.
Tabla 2. Matriz de distancias de Mahalanobis al cuadrado entre machos de cinco poblaciones de C. talarum, calculada a partir de los datos originales (por arriba de la diagonal) y a partir de datos a los que se les eliminó el efecto de la variación de tamaño (por debajo de la diagonal). a P < 0.05; b P < 0.01; c P < 0.001, ns P > 0.05.

El segundo análisis discriminante llevado a cabo en los machos, a partir de datos corregidos sobre el efecto de la variación de tamaño, también tuvo resultados significativos (Λ de Wilks = 0.288, F = 2.034, g. l. = 48, 256, P < 0.0002); sin embargo, en este caso, sólo difirieron significativamente los machos de Tres Arroyos con los de las otras localidades (a excepción de Necochea, Tabla 2). Únicamente la primera función discriminante resultó significativa, explicando el 63.1% de la variación total (Fig. 3b). El ancho de los nasales y el ancho interorbitario fueron las variables que presentaron la mayor correlación positiva y negativa con la misma, respectivamente. Esta función presentó una correlación de 0.98 (P < 0.01) con la segunda función discriminante obtenida a partir de los datos originales, reforzando de esta manera la interpretación de que la primera función discriminante del primer análisis representaba un factor de tamaño. En este segundo análisis discriminante, la correcta clasificación de los individuos se redujo al 69.5%. Las distancias de Mahalanobis al cuadrado se redujeron notablemente, presentando únicamente valores significativos las de la población de Tres Arroyos. El dendrograma construido a partir de las mismas refleja principalmente las diferencias de esta última población respecto de las demás (Fig. 4b).
El análisis discriminante a partir de los datos originales de las hembras también arrojó resultados significativos (Λ de Wilks = 0.046, F = 5.237, g. l. = 48, 206, P < 0.0001), observándose diferencias significativas entre casi todos los pares de poblaciones, a excepción de Tres Arroyos - Necochea y Tres Arroyos - Bahía Blanca (Tabla 3). Las tres primeras funciones discriminantes resultaron significativas, explicando el 76.2%, 11.9% y 9% de la variación total entre localidades, respectivamente. El 92.8% de las hembras fue clasificado correctamente en relación a su localidad de procedencia. En este análisis, la primera función discriminante también puede ser interpretada como un factor de tamaño, presentando una correlación de 0.93 (P < 0.01) con el CP1 extraído a partir de una matriz de varianza-covarianza de los datos originales (datos no presentados aquí). En la Fig. 5a se observa cómo la distribución de los especímenes a lo largo de este eje reflejaría fundamentalmente las diferencias en tamaño. Al igual que en el caso de los machos, las hembras de Punta Indio y las de Estancia La Florida son las de mayor y menor tamaño, respectivamente. El largo de los nasales y el largo del diastema inferior fueron las variables que presentaron las mayores correlaciones positiva y negativa, respectivamente, con la segunda función discriminante. A diferencia de lo observado en los machos, en el dendrograma de las hembras (Fig. 6a) puede verse que las hembras de Punta Indio son las que presentan las mayores distancias con las otras poblaciones.

Fig. 5. Gráficos de distribución de las hembras de C. talarum en las dos primeras funciones discriminantes obtenidas a partir de a) datos originales y b) datos a los cuales se eliminó el efecto de la variación de tamaño. Para cada población se muestran la media y la elipse obtenida a partir de los intervalos de confianza del 95%. ● Estancia La Florida; ■ Bahía Blanca; ○ Tres Arroyos; +Necochea; ▲ Punta Indio.

Fig. 6. Dendrogramas construidos a partir de las distancias de Mahalanobis al cuadrado entre hembras de cinco poblaciones de C. talarum, calculadas a partir de datos originales y b) datos a los cuales se eliminó el efecto de la variación de tamaño.
Tabla 3. Matriz de distancias de Mahalanobis al cuadrado entre hembras de cinco poblaciones de C. talarum, calculada a partir de los datos originales (por arriba de la diagonal) y a partir de datos a los que se les eliminó el efecto de la variación de tamaño (por debajo de la diagonal). a P < 0.05; b P < 0.01; c P < 0.001, ns P > 0.05.
En el segundo análisis discriminante de las hembras, efectuado a partir de datos corregidos sobre el efecto de la variación de tamaño, también se observaron diferencias significativas entre las poblaciones (Λ de Wilks = 0.225, F = 0.028, g. l. =48, 206, P < 0.001). Nótese que, tanto en machos como en hembras, los análisis discriminantes a partir de los datos corregidos presentan Λ de Wilks con valores más altos que los obtenidos a partir de los datos originales, lo que indica que el grado de separación entre las poblaciones disminuye una vez eliminado el efecto del tamaño. Las dos primeras funciones discriminantes resultaron significativas (P < 0.001 y P > 0.05, respectivamente) explicando el 44.7% y el 37.9% de la variación total, respectivamente (Fig. 5b). La primera función discriminante también presentó una correlación alta (r = 0.92, P < 0.01) con la segunda función del análisis a partir de los datos originales. La correcta clasificación de las hembras en relación a sus localidades de origen disminuyó al 62.3%. Respecto del primer análisis, las distancias de Mahalanobis al cuadrado se redujeron, especialmente las de Punta Indio, sin embargo, algunas distancias continuaron siendo significativas (Tabla 3). El dendrograma obtenido a partir de estas distancias muestra una topología muy diferente (Fig. 6b) que el obtenido a partir de los datos originales.
DISCUSIÓN
El grado de dimorfismo sexual ha sido poco explorado en el género Ctenomys. Se ha observado la existencia de dimorfismo sexual en la morfología de la cintura pélvica en dos especies de este género (Ubilla y Altuna, 1987), así como diferencias significativas entre sexos mediante el análisis de variables craneométricas (e. g. Kelt y Gallardo, 1994; Marinho y Freitas, 2000; Freitas, 2005). Por ejemplo, en un análisis de componentes principales llevado a cabo en C. minutus, Freitas (2005) observa diferencias significativas entre sexos en el primer componente pero no en el segundo; concluyendo entonces que las principales diferencias entre machos y hembras son debidas al tamaño. En el presente estudio, también observamos diferencias significativas entre sexos en C. talarum mediante los ANOVAs y MANOVA realizados. Además, observamos diferencias significativas (P< 0.001) entre machos y hembras no sólo en el primer componente de un análisis de componentes principales (ANOVA de las coordenadas del componente; datos no presentados aquí), sino también en el segundo y tercer componentes (P < 0.05 y P < 0.001, respectivamente). Estos resultados alientan a explorar con mayor profundidad el grado de dimorfismo sexual en las distintas especies de Ctenomys y a evaluar la existencia del mismo en el momento de decidir combinar datos de machos y hembras para llevar a cabo análisis estadísticos.
Existen algunos estudios morfométricos donde se explora la variación geográfica de Ctenomys en una dimensión multivariada; algunos de ellos presentan datos craneométricos conjuntamente con datos citogenéticos (e. g. Marinho y Freitas, 2000; Freitas, 2005; Massarini y Freitas, 2005; Tiranti et al., 2005; D´Anatro y Lessa, 2006), mientras que otros utilizan solamente variables morfométricas para inferir relaciones taxonómicas entre especies o subespecies (e. g. Rosi et al., 1992). En nuestro análisis observamos que, tanto en machos como en hembras, las principales diferencias entre las distintas poblaciones estudiadas de C. talarum son debidas al tamaño del cráneo, ya que este carácter (reflejado en la primera función discriminante) contribuiría a la diferenciación entre localidades con un porcentaje mayor al 60%. Una vez eliminado el efecto del tamaño, las distancias de Mahalanobis al cuadrado entre poblaciones disminuyen notablemente y la mayoría de ellas no son significativas (si bien el resultado de este segundo análisis discriminante sí lo es). Freitas (2005) y D´Anatro y Lessa (2006) también observan diferencias significativas entre distintas poblaciones de las especies C. minutus y C. rionegrensis, respectivamente. Sin embargo, a diferencia de lo observado en C. talarum, Freitas (2005) concluye que, a nivel intraespecífico, el tamaño es un factor importante solamente en la diferenciación entre sexos, mientras que D´Anatro y Lessa (2006) no hallan una correlación significativa entre la función discriminante y el centroide de tamaño. Por otro lado, Freitas (2005) y Vasallo y Mora (2007) consideran que, a nivel interespecífico, el tamaño es el carácter más variable e informativo del género Ctenomys. Además, los últimos autores interpretan que la conservación de ciertas proporciones craneanas o de un patrón craneano básico podría estar relacionada, por ejemplo, con la preservación de la capacidad y eficacia para cavar con los dientes. Medina et al. (2007) observan que, a lo largo de la distribución geográfica del género Ctenomys, las especies de tuco-tucos siguen un patrón contrario a la regla de Bergmann. El modo subterráneo de vida aislaría en gran medida a estos roedores de las condiciones ambientales externas, por lo que el gradiente de tamaño corporal observado estaría más probablemente relacionado con otros factores como la estacionalidad, la disponibilidad de recursos o la intensidad de depredación (Medina et al., 2007).
La variación craneométrica de las distintas poblaciones estudiadas de C. talarum no mostró una correlación clara con las tres subespecies nominales reconocidas para esta especie. Únicamente en el primer análisis efectuado en las hembras, las poblaciones se agruparían en correspondencia con las subespecies nominales (Figs. 5a y 6a), pero esta situación se modifica una vez eliminado el efecto del tamaño (Figs. 5b y 6b); por lo tanto, las poblaciones de esta especie no pueden ser discriminadas claramente mediante la forma del cráneo. En otras especies de tuco-tucos, se han obtenido resultados disímiles; por ejemplo, Tiranti et al. (2005) tampoco han podido discriminar las poblaciones de C. pundti mediante rasgos morfométricos, mientras que, como se mencionara más arriba, Freitas (2005) y D´Anatro y Lessa (2006) sí han obtenido resultados positivos para C. minutus y C. rionegrensis, respectivamente. Es interesante tener en cuenta las relaciones entre las especies C. talarum y C. pundti ya que, sobre la base de similitudes cromosómicas, craneométricas y del tipo de espermatozoide, Tiranti et al. (2005) las consideran como dos especies filogenéticamente relacionadas, las cuales habrían divergido recientemente. Además, estos autores sostienen que las poblaciones de tuco-tucos del este de la provincia de La Pampa, correspondientes al grupo «talaroide» (Tiranti y Massarini, 1998, 1999), deberían ser referidas a la especie C. pundti y no a la subespecie C. t. occidentalis, como propone Justo (1992). El análisis morfométrico de Tiranti et al. (2005) incluye especímenes provenientes de El Guanaco, localidad muy cercana a la localidad tipo de esta subespecie (i.e. Estancia La Florida). En nuestro análisis, la población de Estancia La Florida se diferencia de las restantes principalmente por presentar un menor tamaño ya que, una vez eliminado el efecto del mismo, ésta no presenta diferencias significativas con la mayoría de las otras poblaciones. De manera similar, Medina et al. (2007) observan una relación negativa significativa entre el tamaño corporal y la longitud terrestre entre las tres subespecies de C. talarum.
En resumen, los cráneos de las distintas poblaciones estudiadas de C. talarum difieren entre sí principalmente debido a su tamaño; asimismo, la variación geográfica craneana observada no se corresponde de manera clara con las tres subespecies nominales, por lo que estos resultados no sustentan el reconocimiento de las mismas. En el género Ctenomys, el tamaño parece ser un carácter evolutivo muy importante, tanto a niveles intraespecífico como interespecífico.
Especímenes de C. talarum estudiados. Los ejemplares pertenecen a las colecciones del Museo de La Plata (MLP), Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» (MACN) y Museo Municipal de Ciencias Naturales «Lorenzo Scaglia» (MMPMa).
Estancia La Florida, Departamento de Toay, La Pampa: (17♀♀) MLP 26.IX.08.6, MLP 26.IX.08.2, MLP nº prov. J011, MLP 26.IX.08.4, MLP 26.IX.08.5, MLP 26.IX.08.7, MLP 26.IX.08.11, MLP 26.IX.08.12, MLP 26.IX.08.13, MLP nº prov. J036, MLP 26.IX.08.16, MLP 26.IX.08.17, MLP 26.IX.08.19, MLP 2-V-00.5, MLP 2-V-00.6, MLP 2- V-00.7, MLP 2-V-00.8, (12♂♂) MLP 26.IX.08.1, MLP 30-V-01.19, MLP 26.IX.08.3, MLP 26.IX.08.8, MLP 26.IX.08.9, MLP 26.IX.08.10, MLP nº prov. J022, MLP nº prov. J030, MLP 26.IX.08.14, MLP 26.IX.08.15, MLP 26.IX.08.18, MLP 26.IX.08.20; Bahía Blanca, Buenos Aires: (5♀♀) MACN 20087, MACN 20088, MLP 27-VI-97.2, MLP 27-XII-01.52, MLP 27-VI-97.1, (12♂♂) MACN 19918, MACN 19919, MACN 19920, MACN 19924, MACN 19970, MACN 19973, MACN 19974, MACN 20098, MACN 20100, MACN 20102, MACN 20103, MACN 20104; Tres Arroyos, Buenos Aires: (5♀♀) MACN 19832, MACN 20006, MACN 20007, MMPMa 4823, MMPMa 4822, (22♂♂) MACN 19617, MACN 19802, MACN 19810, MACN 19811, MACN 19826, MACN 19874, MACN 20012, MACN 20013, MACN 20014, MACN 20016, MACN 20017, MACN 20018, MACN 20049, MACN 20050, MACN 20051, MACN 20053, MACN 20054, MACN 20055, MACN 20056, MMPMa 4825, MMPMa 4834, MMPMa 4833; Necochea, Buenos Aires: (12♀♀) MMPMa 4000, MMPMa 4001, MMPMa 4002, MMPMa 4003, MMPMa 4006, MMPMa 4030, MMPMa 4033, MMPMa 4039, MMPMa 4041, MMPMa 4042, MMPMa 4044, MMPMa 4095, (9♂♂) MMPMa 2819, MMPMa 4031, MMPMa 4032, MMPMa 4034, MMPMa 4035, MMPMa 4037, MMPMa 4038, MMPMa 4040, MMPMa 4043; Punta Indio, Buenos Aires: (30♀♀) MLP 26-VIII-01-2, MLP 10-V-87.3, MLP 10- V-87.9, MLP 10-XI-95.6, MLP 1-VIII-00.10, MLP 1-VIII-00.11, MLP 1-VIII-00.12, MLP 1-VIII-00.7, MLP 1-VIII- 00.8, MLP 1-XI-95.13, MLP 1-XI-95.8, MLP 1-XI-95.9, MLP 20-III-78.1, MLP 20-III-78.3, MLP 23-VIII-01-2, MLP 23-VIII-01-5, MLP 26-VIII-01.9, MLP 26-VIII-01-7, MLP 27-4-92, MLP 2-V-00.2, MLP 3-XI-95.3, MLP 3-XI-95.4, MLP nº prov. P1, MLP 26.IX.08.27, MLP 26.IX.08.28, MLP 26.IX.08.29, MLP 26.IX.08.30, MLP nº prov. P4, MLP 26.IX.08.21, MLP 26.IX.08.22, (27♂♂) MLP 10-V-87.2, MLP 10-V-87.7, MLP 10-V-87.8, MLP 10-V-87-4, MLP 10-V-87-6, MLP 10-XI-95-7, MLP 1-VIII-00.13, MLP 1-VIII-00.14, MLP 1-VIII-00.9, MLP 20-III-78.4, MLP 20-III- 78.7, MLP 21-III-78.19, MLP 23-VIII-01-12, MLP 23-VIII-01-4, MLP 23-VIII-01-7, MLP 26-VIII-01.11, MLP 26-VIII- 01.3, MLP 26-VIII-01.6, MLP 26-VIII-01-8, MLP 3-VIII-99.1, MLP 3-XI-95.1, MLP 26.VIII.01.1, MLP 26.IX.08.26, MLP 26.IX.08., MLP 26.IX.08.23, MLP 26.IX.08.24, MLP 26.IX.08.25.
AGRADECIMIENTOS
Agradecemos a los encargados de las colecciones mastozoológicas del Museo de La Plata, Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» y Museo Municipal de Ciencias Naturales «Lorenzo Scaglia» por permitirnos el acceso a los ejemplares estudiados. También agradecemos la lectura crítica de una versión preliminar del manuscrito por parte de Diego Verzi y Sergio Tiranti. C. M. García Esponda agradece especialmente a G. Marroig por su ayuda en la aplicación del método para normalizar el tamaño. Las sugerencias de dos revisores anónimos contribuyeron a mejorar este trabajo.
LITERATURA CITADA
1. ANDERSON S, TL YATES y JA COOK. 1987. Notes on Bolivian mammals 4: the genus Ctenomys (Rodentia, Ctenomyidae) in the eastern lowlands. American Museum Novitates 2891:1-20. [ Links ]
2. BOOKSTEIN FL. 1989. «Size and shape»: a comment on semantics. Systematic Zoology 38:173-180. [ Links ]
3. BURNABY TP. 1966. Growth-invariant discrimination functions and generalized distances. Biometrics 22:96-110. [ Links ]
4. BUSCH C, CD ANTINUCHI, JC DEL VALLE, MJ KITTLEIN, AI MALIZIA, AI VASALLO y RR ZENUTO. 2000. Population ecology of subterranean rodents. Pp. 193-226, en: Life underground: The biology of subterranean rodents (EA Lacey, JL Patton y GN Cameron, eds.). The University of Chicago Press, Chicago y Londres. [ Links ]
5. CABRERA A. 1961. Catálogo de los mamíferos de América del Sur. Revista del Museo Argentino de Ciencias Naturales «Bernardino Rivadavia», Ciencias Zoológicas 4:309-732. [ Links ]
6. CONTRERAS JR y AMC CONTRERAS. 1984. Craneología y craneometría del género Ctenomys II. Craneometría. Historia Natural 4:245-248. [ Links ]
7. D´ANATRO A y EP LESSA. 2006. Geometric morphometric analysis of geographic variation in the Río Negro tuco-tuco, Ctenomys rionegrensis (Rodentia: Ctenomyidae). Mammalian Biology 71:288-298. [ Links ]
8. FREITAS TRO. 2005. Analysis of skull morphology in 15 species of the genus Ctenomys, including seven karyologically distinct forms of Ctenomys minutus (Rodentia: Ctenomyidae). Pp. 131-154, en: Mammalian diversification: from chromosomes to phylogeography (a celebration of the career of James L. Patton) (EA Lacey y P Myers, eds). University of California Publications in Zoology 133, Berkeley. [ Links ]
9. FREITAS TRO y EP LESSA. 1984. Cytogenetics and morphology of Ctenomys torquatus (Rodentia: Octodontidae). Journal of Mammalogy 65:637-642. [ Links ]
10. HUMPHRIES JM, FL BOOKSTEIN, B CHERNOFF, GR SMITH, RL ELDER y SG POSS. 1981. Multivariate discrimination by shape in relation to size. Systematic Zoology 30:291-308. [ Links ]
11. JUSTO ER. 1992. Ctenomys talarum occidentalis: una nueva subespecie de tuco-tuco (Rodentia: Octodontidae) en La Pampa, Argentina. Neotrópica 38:35-40. [ Links ]
12. JUSTO ER, LJM DE SANTIS y MS KIN. 2003. Ctenomys talarum. Mammalian Species 730:1-5. [ Links ]
13. KELT DA y MH GALLARDO. 1994. A new species of tuco-tuco, genus Ctenomys (Rodentia: Ctenomyidae) from Patagonian Chile. Journal of Mammalogy 75:338-348. [ Links ]
14. LANGGUTH A y A ABELLA. 1970. Las especies uruguayas del género Ctenomys (Rodentia: Octodontidae). Comunicaciones Zoológicas del Museo de Historia Natural de Montevideo 129:1- 20. [ Links ]
15. LLEONART J, J SALAT y GJ TORRES. 2000. Removing allometric effects of body size in morphological analysis. Journal of Theoretical Biology 205:85-93. [ Links ]
16. MARINHO JR y TRO FREITAS. 2000. Intraspecific craniometric variation in a chromosome hybrid zone of Ctenomys minutus (Rodentia, Hystricognathi). Mammalian Biology 65:226-231. [ Links ]
17. MARROIG G y JM CHEVERUD. 2004. Cranial evolution in sakis (Pithecia, Platyrrhini) I: interspecific differentiation and allometric patterns. American Journal of Physical Anthropology 125:266-278. [ Links ]
18. MASSARINI AI y RTO FREITAS. 2005. Morphological and citogenetics comparison in species of the Mendocinus-group (genus Ctenomys) with emphasis in C. australis and C. flamarioni (Rodentia- Ctenomyidae). Caryologia 58:21-27. [ Links ]
19. MEDINA AI, DA MARTI y CJ BIDAU. 2007. Subterranean rodents of the genus Ctenomys (Caviomorpha, Ctenomyidae) follow the converse to Bergman´s rule. Journal of Biogeography 34:1439-1454. [ Links ]
20. NEVO E. 1979. Adaptive convergence and divergence of subterranean mammals. Annual Review of Ecology and Systematics 10:269-308. [ Links ]
21. NEVO E. 1999. Mosaic evolution of subterranean mammals. Regression, progression and global convergence. Oxford University Press, Oxford. [ Links ]
22. ORTELLS MO. 1995. Phylogenetic analysis of G-banded karyotypes among the South American subterranean rodents of the genus Ctenomys (Caviomorpha: Octodontidae), with special reference to chromosomal evolution and speciation. Biological Journal of the Linnean Society 54:43-70. [ Links ]
23. REDFORD KH y JF EISENBERG. 1992. Mammals of the Neotropics. The southern cone. Vol. 2. Chile, Argentina, Uruguay, Paraguay. The University of Chicago Press, Chicago y Londres. [ Links ]
24. REIG OA y P KIBLISKY. 1969. Chromosome multiformity in the genus Ctenomys (Rodentia, Octodontidae), a progress report. Chromosoma 28:211-244. [ Links ]
25. REIG OA, JR CONTRERAS y MJ PIANTANIDA. 1965. Contribución a la elucidación de la sistemática de las entidades del género Ctenomys (Rodentia, Octodontidae). I. Relaciones de parentesco entre muestras de ocho poblaciones de tuco-tucos inferidas del estudio estadístico de variables del fenotipo y su correlación con las características del cariotipo. Universidad Nacional de Buenos Aires, Facultad de Ciencias Exactas y Naturales, Contribuciones Científicas, Serie Zoológica 2:301-352. [ Links ]
26. REIG OA, C BUSCH, MO ORTELLS y JR CONTRERAS. 1990. An overview of evolution, systematics, population biology, cytogenetics, molecular biology and speciation in Ctenomys. Pp. 71- 96, en: Evolution of subterranean mammals at the organism and molecular levels (E Nevo y OA Reig, eds.). Alan R. Liss, Nueva York. [ Links ]
27. ROSI MI, JA SCOLARO y F VIDELA. 1992a. Distribución y relaciones sistemáticas entre poblaciones del género Ctenomys (Rodentia, Ctenomyidae) de la provincia de Mendoza (Argentina). Miscellania Zoologica 16:207-222. [ Links ]
28. STATSOFT INC., 2001. STATISTICA 6.0 (data analysis software system), version 6, www.statsoft.com. [ Links ]
29. THOMAS O. 1898. Descriptions of two new Argentine rodents. Annals and Magazine of Natural History (London), Series 7, 1:283-286. [ Links ]
30. THOMAS O. 1912. A new genus of opossum and a new tuco-tuco. Annals and Magazine of Natural History (London), Series 8, 9:239-241. [ Links ]
31. THORPE RS. 1983. A review of the numerical methods for recognising racial differentiation. Pp. 404-423, en: Numerical taxonomy (J Felsenstein, ed.). NATO ASI Series, vol. 1, Springer-Verlag, Berlin. [ Links ]
32. TIRANTI SI, FJ DYZENCHAUZ, ER HASSON y AI MASSARINI. 2005. Evolutionary and systematic relationships among tuco-tucos of the Ctenomys pundti complex (Rodentia: Octodontidae): a cytogenetic and morphological approach. Mammalia 69:69- 80. [ Links ]
33. TIRANTI SI y AI MASSARINI. 1998. Variación cromosómica en el grupo Ctenomys mendocinus (Rodentia: Ctenomyidae) en el área central de Argentina. 12 Jornadas Argentinas de Mastozoología, Misiones, Argentina, Addenda: 2. [ Links ]
34. TIRANTI SI y AI MASSARINI. 1999. Consideraciones acerca del género Ctenomys en la provincia de La Pampa (Rodentia Octodontidae). 7 Jornadas Pampeanas de Ciencias Naturales, Santa Rosa, Argentina: 313-318. [ Links ]
35. UBILLA M y CA ALTUNA. 1987. Morfología diferencial y dimorfismo sexual en la pelvis de Ctenomys pearsoni Lessa y Langguth, 1983 y C. rionegrensis Langguth y Abella, 1970 (Rodentia: Octodontidae). Iheringia 66:33-42. [ Links ]
36. VASALLO AI y MS MORA. 2007. Interspecific scaling and ontogenetic growth patterns of the skull in living and fossil ctenomyid and octodontid rodents (Caviomorpha: Octodontoidea). Pp. 945-968, en: The quintessential naturalist: honouring the life and legacy of Oliver Pearson (DA Kelt, EP Lessa, J Salazar-Bravo y JL Patton, eds.). University of California Publications in Zoology 134, Berkeley. [ Links ]
Recibido 16 noviembre 2007.
Aceptado 10 octubre 2008.
Editor asociado: D Flores














