Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. v.16 n.1 Mendoza ene./jun. 2009
ARTÍCULOS Y NOTAS
Micromamíferos (Didelphimorphia y Rodentia) del Parque Nacional Lihué Calel, La Pampa, Argentina
Pablo Teta1*, Javier A. Pereira2, Natalia G. Fracassi2, Silvina B. C. Bisceglia2, 3 y Sofía Heinonen Fortabat4
1 Departamento de Ecología, Genética y Evolución, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Universitaria, Av. Intendente Güiraldes 2160, Pabellón II, 4º Piso, C1428EHA Ciudad Autónoma de Buenos Aires, Argentina.
2 Asociación para la Conservación y el Estudio de la Naturaleza, Barrio Cardales Village, UF 90, Ruta 4 km 5.5, 2814 Los Cardales, Campana, Buenos Aires.
3 Laboratorio de Ecología Ambiental y Regional, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad de Buenos Aires.
4 The Conservation Land Trust Argentina, CC 45, 3470 Mercedes, Corrientes, Argentina.
*[Correspondencia: <antheca@yahoo.com.ar>]
RESUMEN. Se estudió la comunidad de pequeños mamíferos terrestres (<500 g) del Parque Nacional Lihué Calel (37°57'S, 65°33'O, provincia de La Pampa, Argentina) en 1993 y entre los años 2003 y 2006. Se documentaron datos sobre hábitat, ecología, reproducción y estructura de la población en los marsupiales Lestodelphys halli y Thylamys pallidior, los cricétidos Akodon azarae, Akodon molinae, Calomys musculinus, Eligmodontia typus, Graomys griseoflavus, Oligoryzomys longicaudatus y Reithrodon auritus y los caviomorfos Ctenomys cf. C. azarae, Galea musteloides, Microcavia australis y Tympanoctomys barrerae.
ABSTRACT. Small mammals (Didelphimorphia and Rodentia) from Parque Nacional Lihue Calel, La Pampa Province, Argentina. We studied the terrestrial small mammal (<500 g) assemblage from Parque Nacional Lihué Calel (37°57'S, 65°33'O, La Pampa Province, Argentina) in 1993 and 2003-2006. Information about habitat, ecology, reproduction, and population structure is provided for the didelphid marsupials Lestodelphys halli and Thylamys pallidior, the cricetid rodents Akodon azarae, Akodon molinae, Calomys musculinus, Eligmodontia typus, Graomys griseoflavus, Oligoryzomys longicaudatus, and Reithrodon auritus, and the caviomorph rodents Ctenomys cf. C. azarae, Galea musteloides, Microcavia australis, and Tympanoctomys barrerae.
Palabras claves. Área de acción; Historia natural; Lihué Calel; Monte de Llanuras y Mesetas; Pequeños mamíferos.
Key words. Home range; Lihué Calel; Monte Desert; Natural history; Small mammals.
INTRODUCCIÓN
La mastofauna de la provincia de La Pampa es probablemente una de las mejor conocidas del territorio argentino (Siegenthaler, 2004). Para los pequeños mamíferos terrestres (peso <500 g) existe abundante información distribucional, basada tanto en datos de trampeos, como en el análisis de egagrópilas de aves rapaces (véase una síntesis en Siegenthaler, 2004). Desde una perspectiva taxonómica, las poblaciones pampeanas de varias especies, principalmente de roedores cricétidos, han sido estudiadas a través de varias contribuciones (e.g., Hershkovitz, 1962; Tiranti, 1989, 1997, 1998a, b). Contrastando claramente con este panorama, los aspectos básicos de la historia natural y ecología de roedores y marsupiales de pequeño tamaño permanecen todavía pobremente documentados.
Para el Parque Nacional Lihué Calel (PNLC), Massoia (1988) y De Santis et al. (1988) registraron ocho especies de pequeños mamíferos no voladores a partir del estudio de egagrópilas de la lechuza Tyto alba. Bonaventura et al. (1998), en uno de los pocos estudios disponibles a nivel de comunidades para La Pampa, analizaron la diversidad, riqueza, equitatividad y biomasa de roedores sigmodontinos en distintas unidades de vegetación dentro de este parque. Otras referencias para el PNLC incluyen el registro de especies raras en la provincia, como la comadrejita patagónica Lestodelphys halli (Birney et al., 1996) o la rata vizcacha colorada Tympanoctomys barrerae (Justo et al., 1985).
En este trabajo se presenta una síntesis de distintos aspectos de la historia natural de los micromamíferos del PNLC. Además, se discute desde un punto de vista zoogeográfico el ensamble de especies registrado. La información documentada se basa principalmente en los resultados de trabajos de campo realizados en el parque en 1993 y entre los años 2003 y 2006 y publicaciones previas.
MATERIALES Y MÉTODOS
Área de estudio
El Parque Nacional Lihué Calel (37°57'S, 65°33'O, 32300 ha) se encuentra ubicado en el centro-sur de la provincia de La Pampa, Argentina (Fig. 1). El área de estudio se incluye en la ecorregión del Monte de Llanuras y Mesetas (sensu Burkart et al., 1999), y corresponde mayormente a un pastizal-arbustal serrano y periserrano (Cano et al., 1980). En el estrato arbóreo están representados elementos marginales de la ecorregión del Espinal, como Prosopis caldenia y P. flexuosa, que se presentan en forma de ejemplares aislados o formando pequeños bosques. En el estrato arbustivo se destacan Larrea divaricata, Condalia microphylla, Lycium chilense, Prosopis alpataco y Chuquiraga erinacea. En el estrato herbáceo las especies más importantes son Stipa sp., Poa sp., Aristida subulata, Digitaria californica, Medicago minima y Schismus barbatus. En las laderas serranas predominan las comunidades de Hyalis sp. (Cano et al., 1980). Las áreas de roca expuesta representan aproximadamente un 25% del paisaje. Hacia el Norte se extiende el Salitral Levalle, que incluye sectores de médanos y sistemas de lagunas y salares, que se caracterizan por marcados cambios florísticos según la concentración de sales en el suelo.

Fig. 1. Mapa del área de estudio, Parque Nacional Lihué Calel (La Pampa, Argentina), indicando la posición de las grillas de captura de pequeños mamíferos y sitios de colecta de egagrópilas y fecas (las líneas negras en el mapa de la derecha indican los principales caminos).
El clima es fuertemente estacional, con veranos húmedos y cálidos e inviernos fríos y secos. La temperatura media es de 24.7 ºC para enero y de 8.9 ºC para julio. Las precipitaciones se concentran mayormente entre la primavera y el otoño, con una media de 498 ± 141 (DE) mm por año (período 1986-2002).
METODOLOGÍA
Los muestreos de pequeños mamíferos (<500g) fueron realizados en septiembre y octubre de 1993, julio y octubre de 2003, enero, abril, julio y octubre de 2004, febrero, mayo, agosto y octubre de 2005, y enero y mayo de 2006 con trampas de captura viva tipo Sherman. En 1993 se utilizaron 4 grillas de 10x10 trampas, con una separación entre estaciones de 10 m (8100 m2 de superficie). En cada muestreo, entre los años 2003-2006, se ubicaron entre 3 y 5 grillas de 5x9 (3200 m2)ó 6x9 (4000 m2) trampas, con 10 m de distancia entre una estación y la siguiente. Las trampas fueron dispuestas en los distintos ambientes más representativos del parque, incluyendo ambientes arbustivos mixtos (2005-2006), herbazal pastizal (2005-2006), jarillal abierto (2003-2004), jarillal denso (1999 y 2004), jarillal quemado (1993 y 2005), roquedales (2003-2006)y pastizal denso (2003-2005).
Una caracterización detallada de los ambientes de jarillal abierto, jarillal denso, pastizal denso y roquedal puede ser consultada en Bonaventura et al. (1998). El arbustal mixto corresponde a una comunidad de L. divaricata, Larrea cuneifolia, Geoffroea decorticans, Prosopis alpataco, C. microphylla y Lycium sp.; generalmente se presentan como ambientes cerrados, con elevada cobertura arbustiva (>70%) y de gramíneas en el estrato herbáceo (>80%) y con una altura de la vegetación que alcanza o supera 1.70 m. Insertos en esta matriz arbustiva se destacan algunos ejemplares aislados de Prosopis caldenia y parches de Cortaderia selloana. El herbazal-pastizal puede ser definido como una comunidad sucesional, que aparece después del fuego, y que está dominada por la maleza exótica Centaurea solstitialis (con una cobertura total cercana al 80%). Los jarillales quemados corresponden a comunidades de Larrea spp. afectados por incendios entre 3-10 meses antes de los trampeos. En este tipo de ambientes, en las parcelas estudiadas en 1993 se registraron coberturas de 20%-30% de arbustos y 25%-40% de gramíneas; 20%-30% de suelo desnudo y altura media de la vegetación de 1.30 m. Otras especies vegetales asociadas a los jarillales quemados incluyeron, en orden de importancia, a Stipa gesnerioides, S. tennuisima, Poa sp., Bromus sp., Erodium sp., Schinus sp., Acantolepia sp., Plantago sp., G. decorticans, P. alpataco, Condalia sp., Baccharis sp., Dancus sp., Lycium sp, y Conisa sp., entre otras.
El número de trampas utilizadas en cada sitio, las fechas de muestreo, los ambientes relevados y el éxito de captura (número de capturas/número efectivo de trampas/noche x 100) se resumen en la Tabla 1. En cada muestreo las trampas estuvieron activas por 4-9 días consecutivos, utilizándose como cebo una mezcla de grasa vacuna y pasta de maní. Paralelamente, se establecieron de dos a tres líneas de captura muerta para asegurar una muestra adecuada de individuos para estudios sistemáticos en cada muestreo entre julio de 2003 y febrero de 2005. Estos ejemplares serán depositados en el Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» (MACN), Buenos Aires.
Tabla 1. Éxito de captura (número de capturas/número efectivo de trampas/noche x 100) para pequeños mamíferos (<500 g) en el Parque Nacional Lihué Calel (La Pampa, Argentina), discriminado según las distintas unidades de vegetación muestreadas.

Los animales capturados fueron identificados, medidos, pesados y marcados por corte de falanges antes de ser liberados. Las medidas registradas fueron las siguientes (en mm, tomadas con calibre manual [precisión de 0,01 mm], Tabla 2): longitud cabeza-cuerpo (LCC [se optó por esta medida, en lugar del largo total, ya que era más adecuada para la estimación de la edad]); longitud de la cola (LC); longitud de la pata (LP); longitud de la oreja (LO), y peso (P) en gramos. Para cada ejemplar se determinó, además, sexo y estado reproductivo. Las hembras amamantando, con signos de preñez o con vaginas abiertas fueron consideradas como reproductivamente activas. Entre los machos se distinguió entre ejemplares con los testículos escrotales y abdominales; la presencia de testículos escrotales, si bien no es indicación certera de actividad reproductiva, da una idea de la madurez sexual (Pearson, 1983). La taxonomía utilizada corresponde a la discutida por Pardiñas et al. (2003, 2005). Además, algunos ejemplares fueron revisados para la obtención de ectoparásitos. Los mismos fueron coleccionados manualmente utilizando pinzas de punta fina y estiletes, examinando exhaustivamente el pelaje de los roedores de modo de asegurar la extracción total de los artrópodos. Luego fueron fijados en alcohol 70%, preparados y determinados siguiendo las técnicas convencionales (a la fecha, sólo se dispone de identificaciones para los parásitos hallados sobre Akodon molinae).
Tabla 2. Medidas externas registradas para ejemplares adultos de pequeños mamíferos (<500 g) del Parque Nacional Lihué Calel (La Pampa, Argentina). En el renglón superior se anotan media y desvío estándar y en los renglones inferiores rango y número de ejemplares medidos (entre paréntesis). Ver abreviaturas en materiales y métodos.

Para Akodon azarae, A. molinae, Calomys musculinus y Graomys griseoflavus se calculó la edad relativa de cada individuo a partir de la longitud conjunta de la cabeza más el cuerpo, siguiendo, con modificaciones según el caso, los criterios de De Villafañe (1981a [Akodon azarae], 1981b [Calomys musculinus]); Puig y Nani (1981 [Graomys griseoflavus]). La edad relativa para A. molinae fue estimada sobre la base de los datos presentados por Piantanida (1987) y Varela y Polop (1991) para Akodon dolores, por tratarse de una especie sinmórfica y probablemente conespecifica con Akodon molinae (Pardiñas et al. 2005; Braun et al., 2008). Los datos de reproducción y estructura de la población (Fig. 2) combinan información de cuatro años de trabajo en el parque (1993, 2003-2005), permitiendo de este modo un mejor análisis de los patrones promedio para cada variable en el área de estudio.
Fig. 2. Estructura promedio de la población en los roedores sigmodontinos A. azarae, A. molinae, C. musculinus y G. griseoflavus en verano, otoño, invierno y primavera en el Parque Nacional Lihué Calel (La Pampa, Argentina). Las barras grises representan la proporción de ejemplares, discriminados por sexo [m = machos; h = hembras] y edad, sobre el total de individuos capturados para cada estación. La edad (en meses [considerando 1 mes = 28 días]) se calculó a partir de la longitud cabeza-cuerpo (en mm), siguiendo los criterios de De Villafañe (1981a [A. azarae], 1981b [C. musculinus]); Piantanida (1987 [A. molinae]); Puig y Nani (1981 [G. griseoflavus]).
Las áreas de acción fueron calculadas a partir de las capturas y recapturas de los individuos dentro de una misma sesión de muestreo, considerando solamente los ejemplares capturados en agosto y octubre de 2005 y enero y mayo de 2006 (en otras sesiones no se recapturaron ejemplares o las capturas no fueron suficientes para realizar los cálculos). Para estimar el área de acción se utilizó el Método del Mínimo Polígono convexo con inclusión de borde (véase Corbalán y Ojeda, 2005 y las referencias allí citadas). Siguiendo a Corbalán y Ojeda (2005), solo se consideraron para los cálculos a aquellos individuos adultos con tres o más capturas (hasta cinco en nuestros trampeos). Dado el limitado número de ejemplares estudiados, estos datos deben considerarse como preliminares.
Adicionalmente, se estudiaron cerca de 60 egagrópilas de la lechucita vizcachera (Aves, Strigidae) y 162 de la lechuza de campanario Tyto alba (Aves, Tytonidae) coleccionadas irregularmente entre junio de 2002 y agosto de 2007 y 182 fecas del gato montés Leopardus geoffroyi (Carnivora, Felidae) colectadas estacionalmente entre agosto de 2005 y mayo de 2006 (Tabla 3). Las egagrópilas y fecas fueron disgregadas manualmente. Los restos óseos cráneo-dentarios fueron determinados a partir de la comparación con materiales de referencia depositados en el MACN.
Tabla 3. Micromamíferos depredados por Athene cunicularia (Aves, Strigidae), Tyto alba (Aves, Tytonidae) y Leopardus geoffroyi (Mammalia, Felidae) en el Parque Nacional Lihué Calel (La Pampa, Argentina). Los valores se expresan como porcentaje sobre el total de individuos registrados (para un detalle mayor véase Fracassi et al., 2004; Bisceglia et al., 2008).
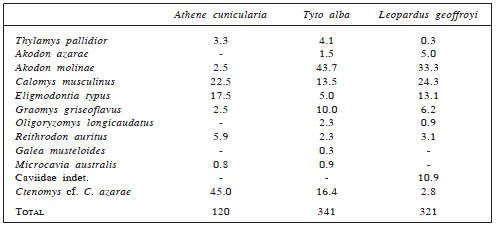
Para cada especie, además, se incluyó información relevante tomada de la bibliografía, particularmente aquella referida a capturas realizadas en la provincia de La Pampa. Las especies que no fueron capturadas durante los muestreos, pero que fueron registradas en el parque a través de otras metodologías (e.g., a partir de egagrópilas) o por otros investigadores también fueron incluidas en la lista, anotándose la información disponible como comentarios.
RESULTADOS
Durante los muestreos (ca. 11720 trampas/ noche) se capturaron 644 individuos, correspondientes a nueve taxones, en las siguientes proporciones: Calomys musculinus (31.2%), Akodon molinae (27.0%), Akodon azarae (19.4%), Graomys griseoflavus (15.2%), Oligoryzomys longicaudatus (2.02%), Galea musteloides (1.86%), Eligmodontia typus (1.24%), Thylamys pallidior (1.24%) y Reithrodon auritus (0.78%). Adicionalmente, en egagrópilas de las lechuzas Athene cunicularia y Tyto alba y en fecas de Leopardus geoffroyi se registraron restos de Ctenomys cf. C. azarae y Microcavia australis. Para el PNLC también han sido citados Lestodelphys halli (Birney et al., 1996) y Tympanoctomys barrerae (Justo et al., 1985).
Seguidamente se anotan para cada especie datos de hábitat, ecología y comportamiento, reproducción, estructura de la población y comentarios.
Orden Didelphimorphia Gill, 1872
Familia Didelphidae Gray, 182
Lestodelphys halli (Thomas, 1921)
Comentarios.-Registrada para el PNLC a partir de un ejemplar capturado por O. Pearson en un roquedal con abundante cobertura de gramíneas (Birney et al., 1996). En la colección de fauna de este mismo parque se halla depositado (sin número) un segundo ejemplar para la provincia de La Pampa, colectado en 2007 en las inmediaciones de Laguna La Amarga (38º 12' S, 66º 05' O; Puelches), 40 km al S del PNLC. Lestodelphys halli se distribuye en forma fragmentaria en el Monte de Llanuras y Mesetas y de modo más o menos continuo por las estepas arbustivas de la Patagonia (Birney et al., 1996, 2003).
Thylamys pallidior (Thomas, 1902)
Hábitat.-T. pallidior prefiere hábitat arbustivos (Tabeni y Ojeda, 2003); en el parque se capturaron seis ejemplares en un roquedal, siempre en las cercanías de arbustos. Un individuo fue coleccionado en una comunidad arbustiva mixta y otro en un pastizal denso de Stipa sp. (Tabla 1).
Ecología y comportamiento.-Mayormente nocturna y de hábitos escansoriales. En el Monte de Llanuras y Mesetas de Mendoza se comporta como una especie omnívora, aunque con una marcada tendencia hacia la insectivoría (Campos et al., 2001). Ocasionalmente se han encontrado ejemplares en habitaciones humanas (e.g., galpones, talleres) dentro del parque (M. Romero, comentario personal). Registrada con frecuencias minoritarias entre los micromamíferos consumidos por A. cunicularia, T. alba y L. geoffroyi (Tabla 3).
Comentarios.-Los ejemplares capturados en el PNLC son indistinguibles, al menos desde el punto de vista morfológico, de otros individuos coleccionados en el Monte de Llanuras y Mesetas, incluyendo material procedente de Mendoza (PT, observación personal.). Seguimos la posición de Braun et al. (2005), quienes refieren las poblaciones del sector central de esta unidad florística, incluyendo algunas muy cercanas a la provincia de La Pampa, como T. pallidior.
Orden Rodentia Bowdich, 1821
Familia Cricetidae Fischer de Waldhein, 1817
Akodon azarae (Fischer, 1829)
Hábitat.-A. azarae prefiere pastizales y pajonales (Crespo, 1966; Mills et al., 1991). En La Pampa es una especie frecuente en bordes de campos cultivados, particularmente hacia la mitad oriental de la provincia (Tiranti, 1992). En el parque ha sido registrada en ambientes de herbazal-pastizal, arbustal mixto y pastizales densos de Stipa sp. También hallada en jarillales densos y roquedales (Tabla 1). En los muestreos realizados por Bonaventura et al. (1998), esta especie fue abundante en pajonales altos de C. selloana, aunque también fue registrado en pastizales ralos de Stipa sp., comunidades serranas de Hyalis sp., bosques densos y ralos de P. caldenia y en ambientes arbustivos dominados por Larrea divaricata.
Ecología y comportamiento.-Especie nocturna (Zuleta, 1989) o activa durante todas las horas del día (Contreras, 1979; Priotto y Polop, 1997) y de hábitos alimenticios omnívoros. El área de acción para los machos varió entre 500 m2 (n = 1) y 750- 1450 m2 (n = 2), para el arbustal mixto y el herbazal- pastizal, respectivamente; en las hembras fue de 830 ± 354.6 m2 (n = 5) y 716.6 ± 115.1 m2 (n = 3), para el arbustal mixto y el herbazal-pastizal, respectivamente. El promedio, considerando los registros para distintos hábitats, fue de 787.5 ± 281.3 m2 para las hembras (n = 8) y de 900 ± 442.4 m2 para los machos (n = 3). Pese a ser una de las especies mejor representadas en las trampas, A. azarae tuvo una participación minoritaria en las egagrópilas de lechuzas y en las fecas de L. geoffroyi (Tabla 3).
Reproducción.-Se capturaron hembras con la vagina abierta en enero (n = 4/4) y octubre (n = 6/ 8). Se registraron machos con los testículos escrotales en enero (13/19) y octubre (6/8). Dos hembras preñadas, con seis fetos cada una, fueron coleccionadas en octubre y enero.
Estructura de la población.-La distribución de los grupos de edades en la población muestra una marcada orientación hacia las clases juveniles en otoño e invierno, sugiriendo que la estación reproductiva es prolongada. En la población de primavera, y en menor medida en la de verano, se registra una distribución más homogénea de las distintas clases etarias (Fig. 2).
Comentarios.-Distintos aspectos de la ecología e historia natural de esta especie han sido documentados en los agroecosistemas pampeanos de las provincias de Buenos Aires y Córdoba (e.g., De Villafañe, 1981a; Zuleta, 1989; Mills et al., 1991, 1992; Bilenca et al., 1992; Bilenca, 1993; Bilenca et al., 1994; Bilenca y Krávetz, 1995, 1998; Ellis et al., 1998; Priotto y Steinmann, 1999; Busch et al., 2001) y en la ecorregión del Espinal del sudoeste de Buenos Aires (Contreras, 1979).
Akodon molinae Contreras, 1968
Hábitat.-A. molinae ocupa preferentemente ambientes arbustivos y forestados con elevada cobertura de mantillo (Tabeni y Ojeda, 2003); en el parque ha sido capturada en ambientes de arbustal mixto y de herbazal-pastizal y en comunidades arbustivas de L. divaricata. También registrada, aunque en menor medida, en laderas rocosas serranas (Tabla 1). Bonaventura et al. (1998) la indican principalmente para bosques densos y ralos de P. caldenia y arbustales de Larrea sp., y en menor medida, para comunidades serranas de Hyalis sp. y pajonales de C. selloana.
Ecología y comportamiento.-Especie de hábitos mayormente nocturnos y de alimentación omnívora, con tendencia a la insectivoría (Contreras, 1979; Giannoni et al., 2005). El área de acción para los machos fue de 786.4 ± 317.1 m2 (n = 3), 916.6± 202.1 m2 (n = 3) y 550 m2 (n = 1), para el arbustal mixto, el herbazal-pastizal y el roquedal, respectivamente; en las hembras se registraron territorios de 750 ± 331.6 m2 (n = 6) y 950 m2 (n = 1), para el arbustal mixto y el roquedal, respectivamente. El área de acción promedio, considerando los registros para distintos hábitats, fue de 778.6 ± 312.1 m2 para las hembras (n = 7) y de 793.3 ± 296.3 m2 para los machos (n = 7). Registrada como componente mayoritario en la dieta de T. alba y L. geoffroyi; en cambio, fue escasamente depredada por la lechuza A. cunicularia (Tabla 3). Se identificaron los siguientes ectoparásitos en los ejemplares capturados: Dermanyssoidea: Laelapinae: Androlaelaps rotundus, Androlaelaps fahrenholzi; Haemogamasinae: Eulaelaps stabularis; Siphonaptera: Stephanocircidae: Craneopsylla minerva wolffhuegeli; Rhopalopsyllidae: Polygenis (Neopolygenis) atopus y Polygenis (Polygenis) platensis. En otoño se registró un ejemplar parasitado por Rogenhofera grandis (Diptera, Cuterebridae).
Reproducción.-Se capturaron hembras con la vagina abierta o amamantando en septiembre (2/5), octubre (n = 12/13) y enero (n = 6/6) y preñadas en octubre (n = 4) y enero (n=1). En una hembra capturada en octubre se observaron seis cicatrices uterinas. Se registraron machos con los testículos escrotales en octubre (12/15) y enero (12/15).
Estructura de la población.-Las pirámides de edad muestran una marcada orientación hacia las clases de edad adulta a lo largo de todo el año (Fig. 2).
Comentarios.-Distintos aspectos de la historia natural de A. molinae han sido estudiados en el Monte de Llanuras y Mesetas de Mendoza (e.g., Ojeda, 1989; Gonnet y Ojeda, 1998; Campos et al., 2001; Taraborelli et al., 2003; Corbalán y Ojeda, 2004, 2005; Giannoni et al., 2005; Corbalán, 2006) y en el Espinal del sudoeste de Buenos Aires (Contreras, 1979). El estatus taxonómico de las poblaciones en La Pampa ha sido estudiado por Tiranti (1998b).
Calomys musculinus (Thomas, 1913)
Hábitat.-Esta especie prefiere roquedales, pastizales densos y ambientes arbustivos con elevada cobertura (Gonnet y Ojeda, 1998; Corbalán, 2004, 2006). En La Pampa es muy abundante en pasturas y agroecosistemas (Tiranti, 1994). En el parque se capturó en todos los hábitats muestreados con excepción del jarillal quemado (Tabla 1). Bonaventura et al. (1998) la registran principalmente en roquedales, pero también documentan capturas en comunidades serranas de Hyalis sp., pajonales de cortadera, bosques densos y ralos de P. caldenia, jarillales abiertos y pastizales ralos de Stipa sp.
Ecología y comportamiento.-Especie de hábitos mayormente nocturnos y de alimentación omnívora, con tendencia hacia la granivoría (Giannoni et al., 2005). El área de acción para los machos varió entre 450-1550 m2 (n = 2) y 516.6 ± 144.3 m2 (n = 3), para el arbustal mixto y el herbazal-pastizal, respectivamente; en las hembras fue de 500-550 m2 (n = 2), 500-950 m2 (n = 2) y 662.5 ± 217.4 m2 (n = 4), para el arbustal mixto, el herbazal-pastizal y el roquedal, respectivamente. El área de acción promedio, considerando los registros para distintos hábitats, fue de 643.8 ± 202.6 m2 para las hembras (n = 8) y de 710.0 ± 481.4 m2 para los machos (n = 5). Registrada con frecuencias moderadas entre los micromamíferos depredados por A. cunicularia, T. alba y L. geoffroyi (Tabla 3).
Reproducción.-Se capturaron hembras con la vagina abierta, preñadas o amamantando en los meses de enero (6/6) y octubre (3/3) y machos con los testículos escrotales en enero (26/33), octubre (9/13) y abril (1/1). En dos hembras preñadas, coleccionadas en octubre, se registraron 5 y 8 fetos, respectivamente.
Estructura de la población.-La población en otoño esta mayormente compuesta por individuos juveniles, indicando que el reclutamiento de los mismos ocurre en buena medida entre la primavera y finales del verano. La proporción de ejemplares adultos es mayor en invierno y primavera, equilibrándose hacia el verano la participación en la población de las distintas clases de edad (Fig. 2).
Comentarios.-Distintos aspectos de la historia natural de C. musculinus han sido extensamente estudiados en los agroecosistemas de las provincias de Buenos Aires y Córdoba (e.g., Mills et al., 1991, 1992; Ellis et al., 1998; Busch et al., 2000; Steinmann et al., 2005) y en el Monte de Llanuras y Mesetas de Mendoza (e.g., Ojeda, 1989; Gonnet y Ojeda, 1998; Corbalán y Ojeda, 2004, 2005; Giannoni et al., 2005; Corbalán, 2006).
Eligmodontia typus Cuvier, 1837
Hábitat.-E. typus prefiere áreas abiertas, con suelo desnudo y arbustos dispersos (Ojeda, 1989; Corbalán y Debandi, 2006); es una especie oportunista, que puede alcanzar elevadas frecuencias en sectores sometidos a algún tipo de impacto antrópico (e.g., sobrepastoreo; Tiranti, 1994). En el parque se capturaron ejemplares en pastizales densos de Stipa sp. (n = 2) y roquedales serranos (n = 2). Otros dos individuos se registraron en una comunidad arbustiva mixta y en un herbazal-pastizal, respectivamente (Tabla 1). Bonaventura et al. (1998) la indican principalmente para pastizales densos y ralos de Stipa sp. y, en menor medida, para comunidades serranas de Hyalis sp. y pajonales de Cortaderia selloana.
Ecología y comportamiento.-Especie de hábitos nocturnos y de alimentación omnívora con tendencia a la insectivoría (Giannoni et al., 2005). Registrada con frecuencias minoritarias entre los micromamíferos depredados por T. alba, pero con participaciones moderadas en los conjuntos generados por A. cunicularia y L. geoffroyi (Tabla 3).
Reproducción.-Se capturó una hembra con siete embriones en octubre. En enero se registró un macho con testículos escrotales y una hembra con la vagina abierta. El hallazgo de ejemplares juveniles en abril sugiere que la estación reproductiva se extendería hasta finales del verano.
Comentarios.-Distintos aspectos de la historia natural de E. typus han sido estudiados en el Monte de Llanuras y Mesetas de Mendoza (e.g., Ojeda, 1989; Gonnet y Ojeda, 1998; Campos et al., 2001; Taraborelli et al., 2003; Corbalán y Ojeda, 2004, 2005; Giannoni et al., 2005; Corbalán, 2006, Corbalán y Debandi, 2006). El estatus taxonómico de las poblaciones en La Pampa ha sido estudiado por Tiranti (1997)
Graomys griseoflavus (Waterhouse, 1837)
Hábitat.-G. griseoflavus ocupa diferentes tipos de hábitat, pero muestra cierta preferencia por los ambientes arbustivos y forestados (Gonnet y Ojeda, 1998; Corbalán, 2004, 2006). En el parque es una especie frecuente en ambientes de arbustal mixto, herbazal-pastizal y roquedales (especialmente en las porciones bajas y medias de las laderas serranas). Se han capturado unos pocos individuos en un pastizal denso de Stipa sp. y en jarillales (Tabla 1). Bonaventura et al. (1998) la registran principalmente en bosques densos de P. caldenia, arbustales densos y ralos de Larrea sp. y en comunidades serranas de Hyalis sp. También, pero en menor medida, en bosques ralos de P. caldenia y en pajonales de C. selloana.
Ecología y comportamiento.-Especie de hábitos nocturnos y costumbres escansoriales (Hershkovitz, 1962). En los estómagos de tres individuos capturados en invierno se encontró abundante material vegetal finamente masticado. Usualmente construye sus nidos en huecos de troncos o ramas o utiliza los nidos abandonados de algunas aves (Hershkovitz, 1962). Se registraron nidos construidos con palitos y gramíneas en grietas entre las rocas y ocasionalmente ha sido hallada en habitaciones humanas dentro del parque (e.g., galpones, talleres). G. griseoflavus está representada de manera minoritaria a moderada en las dietas de las lechuzas y de L. geoffroyi (Tabla 3).
Reproducción.-Se capturaron hembras con la vagina abierta, preñadas o amamantando en enero (8/11), abril (4/5) y octubre (3/3) y machos con los testículos escrotales en los meses de enero (7/ 10), abril (3/7) y octubre (4/7). Dos hembras preñadas, coleccionadas en abril, tenían 4 y 5 embriones respectivamente.
Estructura de la población.-Se orienta mayormente hacia las clases de edad juvenil. La evidencia disponible, aunque limitada en el caso de invierno y primavera, indica que la estación reproductiva es prolongada, con reclutamiento de ejemplares juveniles desde principios de primavera hasta comienzos del invierno. El mayor número de ejemplares adultos, incluyendo individuos probablemente sobre-invernantes, se registró hacia la primavera-verano (Fig. 2).
Comentarios.-Distintos aspectos de la historia natural de G. griseoflavus han sido estudiados en el Monte de Llanuras y Mesetas de Mendoza (e.g., Rosi, 1983; Ojeda, 1989; Gonnet y Ojeda, 1998; Campos et al., 2001; Taraborelli et al., 2003; Corbalán y Ojeda, 2004, 2005; Giannoni et al., 2005; Corbalán, 2006; Corbalán y Debandi, 2006). El estatus taxonómico de las poblaciones en La Pampa ha sido estudiado por Tiranti (1998a).
Oligoryzomys longicaudatus (Bennet, 1832)
Hábitat.-O. longicaudatus se encuentra principalmente en ambientes arbustivos (Pardiñas et al., 2005). En La Pampa ha sido registrado en bosques abiertos de G. decorticans con abundante cobertura de gramíneas cespitosas en el estrato herbáceo y en comunidades mixtas de C. selloana y Baccharis sp. (Tiranti, 1989). En el parque se capturaron 12 ejemplares en ambientes arbustivos mixtos y uno en un herbazal-pastizal.
Ecología y comportamiento.-Especie de hábitos nocturnos y escansoriales, cuya ecología e historia natural en el Monte de Llanuras y Mesetas resultan mayormente desconocidas. En la Patagonia se alimenta principalmente de granos, frutas e insectos (Pearson, 1983). Registrada como componente minoritario entre los micromamíferos depredados por T. alba y L. geoffroyi (Tabla 3).
Reproducción.-Se registraron machos con los testículos escrotales en enero (1/1) y octubre (1/1) y hembras con la vagina abierta en enero (1/1) y octubre (1/1).
Comentarios.-Las poblaciones de Buenos Aires, geográficamente las más cercanas a las poblaciones pampeanas, han sido referidas por Massoia (1973) como O. l. pampanus (pero véase Palma et al., 2005). Distintos aspectos de la ecología e historia natural de esta especie han sido ampliamente estudiados en la Patagonia argentina y el sur de Chile (Kelt, 1994; Pearson, 1995 y las referencias allí citadas).
Reithrodon auritus (Fischer, 1814)
Hábitat.-R. auritus ocupa preferentemente pastizales y estepas abiertas con buena cobertura de hierbas cortas, verdes y tiernas (Pearson, 1988). En el parque se capturaron cinco ejemplares en comunidades arbustivas abiertas de L. divaricata; en cuatro casos en sectores previamente afectados por el fuego (Tabla 1). En julio de 2004, ocho meses después de un incendio, se contaron al menos 14 bocas activas de cuevas de R. auritus en una parcela de 0.5 ha, con cobertura arbustiva <10 % y estrato herbáceo denso, mayormente compuesto por una carpeta de hierbas verdes y bajas (<25 cm), entre las que se destacaban por su abundancia Medicago minima, Glandularia sp., Conisa sp. y Baccharis sp.
Ecología y comportamiento.-Especie principalmente nocturna, de hábitos sociales gregarios y de alimentación herbívora (Pearson, 1988). Registrada con frecuencias minoritarias entre los micromamíferos depredados por A. cunicularia, T. alba y L. geoffroyi (Tabla 3).
Reproducción.-Se registró un macho con los testículos escrotales (1/1) y una hembra con la vagina abierta (1/1) en octubre. Una hembra preñada, capturada en febrero, tenía tres embriones.
Comentarios.-Distintos aspectos de la ecología e historia natural de R. auritus, principalmente de las poblaciones patagónicas, han sido sintetizados por Pardiñas y Galliari (2001).
Familia Caviidae Fischer de Waldheim, 1817
Galea musteloides Meyen, 1832
Hábitat.-G. musteloides prefiere pastizales y comunidades arbustivas (Tabeni y Ojeda, 2003); en el parque se capturaron cinco ejemplares en jarillales densos de L. divaricata y L. cuneifolia, cuatro en una comunidad arbustiva mixta y otros dos en un pastizal denso de Stipa sp. y en un herbazal-pastizal, respectivamente (Tabla 1). También observado en pastizales de gramíneas en áreas rocosas y en ambientes parcialmente disturbados en los alrededores del camping y la intendencia.
Ecología y comportamiento.-Especie de hábitos diurnos y de alimentación herbívora (Campos et al., 2001). Ocasionalmente registrada en egagrópilas de A. cunicularia y T. alba y en fecas de L. geoffroyi (Tabla 3).
Reproducción.-Se registraron machos con los testículos escrotales en enero (2/3) y octubre (2/4) y hembras con la vagina abierta en enero (1/1) y octubre (1/1).
Comentarios.-Distintos aspectos de la ecología y el comportamiento social de G. musteloides han sido estudiados por Rood (1972) en el sudoeste de Buenos Aires.
Microcavia australis (I. Geoffroy Saint Hilaire y d'Orbigny 1833)
Ecología y comportamiento.-Especie de hábitos diurnos y de alimentación herbívora (Campos et al., 2001). Ocasionalmente registrada en egagrópilas de A. cunicularia y T. alba y en fecas de L. geoffroyi (Tabla 3).
Comentarios.-Distintos aspectos de la ecología e historia natural de M. australis han sido sintetizados por Tognelli et al. (2001).
Familia Ctenomyidae Lesson, 1842
Ctenomys cf. C. azarae Thomas, 1903
Hábitat.-En el parque se registraron galerías correspondientes a este taxón en áreas de suelo arenoso, principalmente en lomas con vegetación graminosa y arbustiva dispersa, pero también en bosques abiertos, jarillales y comunidades arbustivas mixtas.
Ecología y comportamiento.-Su participación en la dieta de las lechuzas A. cunicularia y T. alba varió entre alta y moderada, respectivamente; registrada con frecuencias minoritarias entre los micromamíferos consumidos por L. geoffroyi.
Comentarios.-Las poblaciones del centro sur de La Pampa, incluyendo algunas muy cercanas al PNLC, han sido referidas en la literatura como C. azarae (Siegenthaler, 2004). Morfometría estudiada por Medina (2004); cariotipos y polimorfismos cromosómicos en Braggio et al. (1999) y Massarini et al. (1991a, b, 1998).
Familia Octodontidae Waterhouse, 1839
Tympanoctomys barrerae (Lawrence, 1941)
Comentarios.-Especie de distribución insularizada, restringida a salares y dunas en el Monte de Llanuras y Mesetas. T. barrerae fue citada para el PNLC a partir de ejemplares recuperados en egagrópilas de T. alba (Justo et al., 1985). De estar presente en el parque debería ser buscada en el sector correspondiente al salitral Levalle. Historia natural y ecología sintetizadas por Díaz et al. (2000).
DISCUSIÓN
Aspectos zoogeográficos
Para el PNLC se han documentado 13 especies de pequeños mamíferos, correspondientes a dos órdenes y cinco familias. Necromys benefactus y Oligoryzomys flavescens, dos sigmodontinos referidos para el PNLC por Heinonen Fortabat y Chebez (1997), deben ser excluidos de la mastofauna de esta unidad protegida, ya que no existen referencias documentadas o ejemplares en colecciones que avalen estos registros (cf. Galliari y Pardiñas, 2000; Siegenthaler, 2004; D'Elía et al., 2008). O. flavescens, sin embargo, ha sido registrado 20 km NO del PNLC, en Estancia Los Ranqueles (Tiranti, 1988).
Considerando las áreas de distribución para cada especie en La Pampa, los micromamíferos registrados en esta unidad protegida presentan una diversidad de distribuciones que puede resumirse en tres patrones básicos:
a) Un grupo de especies típicamente pampeanas, propias de pastizales y agroecosistemas (e.g., A. azarae, Calomys muculinus), que caracteriza los sectores más profundamente modificados de La Pampa (Justo y De Santis, 1982; De Santis et al., 1983; Massoia y Vetrano, 1988; Tiranti, 1992). A. azarae encuentra hacia el PNLC el límite sudoccidental de su distribución (cf. Siegenthaler, 2004). R. auritus también se asocia con este sector, aunque su distribución se continúa ampliamente en las ecorregiones pampeana y patagónica (Pardiñas et al., 2006). Del mismo modo, la distribución de C. musculinus se extiende largamente hacia el Oeste, sobre las estepas arbustivas de la Patagonia y el Monte. Pardiñas et al. (2005) sintetizaron los patrones básicos de distribución para los micromamíferos del sudoeste de Buenos Aires, reconociendo una división de mayor jerarquía entre el Monte de Llanuras y Mesetas y el Espinal y la ecorregión Pampeana. De acuerdo con estos autores, A. azarae y Calomys spp. son dominantes en los agroecosistemas de la ecorregión pampeana, sugiriendo que su presencia hacia el sur de Buenos Aires y centro de La Pampa podría vincularse con el avance de la frontera agrícola durante los últimos 100-150 años y un período de mayores precipitaciones durante los últimos 30 años.
b) Un grupo de especies de abolengo central, cuya distribución se extiende ampliamente por el Monte de Llanuras y Mesetas y del Espinal y que ocupan preferentemente ambientes arbustivos, subarbustivos y boscosos xerófilos (A. molinae, C. cf. C. azarae, E. typus, G. musteloides, G. griseoflavus, M. australis, T. pallidior; Montalvo et al., 1984; Tiranti, 1988, 1992, 1994). Hacia el Este, la distribución de estos taxones se continúa al menos hasta el sudoeste de la provincia de Buenos Aires. Por ejemplo, A. molinae y T. pallidior se registran hasta los cordones serranos de Ventania y E. typus y G. griseoflavus hasta los partidos bonaerenses de Monte Hermoso y Villarino, respectivamente (Pardiñas et al., 2005).
c) Un grupo de especies con geonemias discontinuas en el Monte de Llanuras y Mesetas, que incluye tanto taxones de estirpe patagónica (e.g. L. halli, O. longicaudatus), como central (e.g., T. barrerae). Se trata en todos los casos de elementos cuya distribución conocida para el Monte de Llanuras y Mesetas se restringe a unas pocas localidades, mayormente asociadas con la presencia de ciertos ambientes particulares, tales los casos de T. barrerae en dunas y salares (Díaz et al., 2000) o de O. longicaudatus en microambientes arbustivos mésicos (Palma et al., 2005). Considerando las áreas de distribución para estos taxones en el territorio de La Pampa, las presencias de L. halli y T. barrerae pueden referirse como marginales, ya que los registros para el PNLC representan los extremos más nororiental y sudoriental en la distribución de estos taxones, respectivamente (De Santis et al., 1988; Birney et al., 1996). Este patrón de distribución, sumado a las evidencias fósiles, indica que ambas especies tuvieron distribuciones más extendidas durante el Neógeno (Prado et al., 1985; Verzi et al., 2002).
Aspectos ecológicos
De acuerdo a lo expuesto en los resultados, los micromamíferos capturados en el PNLC se registran en parches de vegetación similares a los que típicamente ocupan en otras áreas de su rango de distribución. Asimismo, los datos obtenidos coinciden mayormente con los documentados previamente por Bonaventura et al. (1998).
Según sus preferencias de sustrato y alimentarias, los micromamíferos del PNLC se pueden clasificar de la siguiente forma: cursoriales-carnívoros: L. halli; cursorialesherbívoros: G. musteloides, M. australis, R. auritus; cursoriales-granívoro/omnívoros: C. musculinus, O. longicaudatus; cursorialesinsectívoro/ omnívoros: A. azarae, A. molinae; escansoriales-folívoro/omnívoro: G. griseoflavus; escansoriales-insectívoro/ omnívoros: Thylamys pallidior; fosoriales-herbívoros: Ctenomys cf. C. azarae; semifosoriales-herbívoros: T. barrerae. Los horarios de actividad, por otra parte, no difieren de los documentados en la bibliografía para estas mismas especies (véase Redford y Eisenberg, 1992). Con excepción de G. musteloides y M. australis, que desarrollan sus actividades durante el día, los pequeños mamíferos del PNLC tienen mayormente costumbres nocturnas.
Las áreas de acción promedio para A. molinae y C. musculinus fueron algo menores que las registradas para estas mismas especies en el Monte de Llanuras y Mesetas de Mendoza, pero mayor -en el caso de C. musculinus- que el valor indicado por Contreras y Rosi (1980) para un área agrícola de esta misma provincia. Para A. azarae, por otra parte, el área de acción promedio fue de dos a tres veces mayor que la documentada para esta misma especie en los agroecosistemas del norte de Buenos Aires (Zuleta, 1989) y el centro-sur de Córdoba (Priotto y Steinmann, 1999). Estas consideraciones, sin embargo, deben ser tomadas con cautela, ya que las áreas de acción calculadas en este estudio se basan en un número reducido de ejemplares y recapturas.
De acuerdo con los resultados documentados, los micromamíferos del PNLC se reproducirían estacionalmente, mayormente durante la primavera y el verano. Esta situación se refleja en la estructura de las poblaciones, con reclutamiento de ejemplares juveniles desde la primavera hasta principios del otoño. En otros casos (e.g., A. azarae, G. griseoflavus), la estación reproductiva parece prolongarse hasta finales del otoño o comienzos del invierno. Esta información coincide con la previamente publicada para otros ensambles de roedores sigmodontinos de latitudes medias de la Argentina, tanto para el sector central del Monte de Llanuras y Mesetas (e.g., Corbalán, 2004), como para los agroecosistemas de la región pampeana (e.g., Mills et al., 1992). En Mendoza, por ejemplo, el período reproductivo para A. molinae se extiende desde agosto hasta marzo (Navarro, 1991); y en G. griseoflavus, se ha indicado la presencia de individuos reproductivamente activos desde noviembre hasta mayo (Hershkovitz, 1962). Por su parte, en estudios llevados a cabo en la misma provincia por Corbalán et al. (2006) indican una estación reproductiva más restringida para A. molinae y G. griseoflavus, entre octubre y diciembre, y más extensa para C. musculinus, con reproducción en todas las estaciones menos en invierno. Para los agroecosistemas del nordeste de Buenos Aires, A. azarae y C. musculinus se reproducen mayormente entre los meses de septiembre-octubre y mayo-junio (Mills et al., 1992 y las referencias allí citadas). En el caso de los pequeños mamíferos del PNLC, igual que para el Monte mendocino o los agroecosistemas pampeanos, el período reproductivo coincide con la época de mayores precipitaciones, que es además la de mayor disponibilidad de recursos (véase O'Connell, 1982).
Bonaventura et al. (1998) registraron entre 1994 y 1995 cinco especies de cricétidos para el PNLC. En los muestreos realizados entre 2003 y 2006 se documentaron, además de siete cricétidos, un marsupial didélfido y un roedor cávido. Es probable que las diferencias entre los resultados presentados por Bonaventura et al. (1998) y los anotados en este trabajo se deban a diversos factores, relacionados tanto con fluctuaciones naturales en las poblaciones (e.g., para el período 2003- 2006, O. longicaudatus fue registrado sólo a partir de 2005), como con el mayor esfuerzo de muestreo que se realizó entre 2003-2006 (ca. 11700 trampas/noche vs 2160 trampas/ noche en 1994-1995).
Si bien los datos presentados en este trabajo son preliminares, constituyen los primeros antecedentes en ecología e historia natural para algunas especies de pequeños mamíferos en La Pampa. En una etapa superadora, sería deseable realizar nuevos estudios sobre las especies que ocurren en este ensamble. Aspectos tales como la organización espacial y temporal de las comunidades, selección de microhábitat, competencia interespecífica o dieta, requieren de estudios más detallados y a largo plazo.
AGRADECIMIENTOS
Tanto los trabajos de campo como las tareas de gabinete no hubieran sido posibles sin la colaboración desinteresada de numerosas personas, que prestaron materiales o brindaron información inédita o su ayuda en diferentes sentidos. Aún a riesgo de omitir algún nombre, hacemos extensivo nuestro agradecimiento a L. Antoniazzi, V. Battro, M. Borro, P. Beldoménico, M. Bertolini, M. Busch, R. Callicó Fortunato, V. Cosentino, V. Chillo, D. de Tommaso, C. Duco, Y. Davies, C. De Angelo, G. D'Elia, M. Di Bitteti, H. Erasum, H. Ferreyra, F. Gallego, G. García Ribeiro, J. Juber, L. La Sala, N. Lonné, D. Manzoli, G. Mateáis, P. Moreyra, E. Muschetto, N. Nigro, A. Paviolo, L. Pazos, D. Procopio, C. Redolazi, M. Sabatini, M. Uhart, O. Vaccaro y M. Zamero. Algunos aspectos taxonómicos fueron discutidos con G. D'Elia y U. Pardiñas. Los ectoparásitos fueron procesados y determinados por L. Antoniazzi, P. Beldoménico, M. Lareschi, D. Manzoli y M. Mastropaolo. M. M. Díaz, G. Martin, U. Pardiñas y un revisor anónimo contribuyeron con sus observaciones a mejorar substancialmente la claridad de este manuscrito. Agradecemos a los guardaparques A. J. Gómez, A. Mezzabotta, R. Milne y M. Romero por la hospitalidad y facilidades logísticas brindadas. La administración de Parques Nacionales, a través de C. Chehébar, concedió los permisos para realizar los trabajos en el área.
LITERATURA CITADA
1. BILENCA DN. 1993. Caracterización de los nichos ecológicos y organización de las comunidades de roedores cricétidos de la Región Pampeana. Tesis Doctoral inédita, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
2. BILENCA DN y FO KRAVETZ. 1995. Patrones de abundancia relativa en ensambles de pequeños roedores de la región pampeana. Ecología Austral 5:21-30. [ Links ]
3. BILENCA DN y FO KRAVETZ. 1998. Seasonal variation in microhabitat use and feeding habits of the pampas mouse Akodon azarae in agroecosystems of central Argentina. Acta Theriologica 43:195-203. [ Links ]
4. BILENCA DN, FO KRAVETZ y GO ZULETA. 1992. Food habits of Akodon azarae and Calomys laucha (Cricetidae, Rodentia) in agroecosystem of central Argentina. Mammalia 56:371-383. [ Links ]
5. BILENCA DN, GO ZULETA y FO KRÁVETZ. 1994. Latitudinal variation in litter size and length of the breeding season in populations of pampas mice, Akodon azarae. Mammalia 58:563-568. [ Links ]
6. BIRNEY EC, JA MONJEAU, CJ PHILLIPS, RS SIKES y I KIM. 1996. Lestodelphys halli: new information on a poorly known Argentine marsupial. Mastozoología Neotropical 3:171-181. [ Links ]
7. BISCEGLIA SBC, JA PEREIRA, P TETA y RD QUINTANA. 2008. Food habits of Geoffroy's cat (Leopardus geoffroyi) in the central Monte desert of Argentina. Journal of Arid Environments 72: 1120-1126. [ Links ]
8. BONAVENTURA SM, AM BALABUSIC, MC SABATINI, AM MIRANDA, F MARCELINO, F FERRERO y DM CONRADO. 1998. Diversidad y biomasa de pequeños roedores en el desierto del Monte, Argentina. Boletín de la Sociedad Biológica de Concepción, Chile 69:39-45. [ Links ]
9. BRAGGIO E, MD GIMÉNEZ, JR CONTRERAS, E JUSTO y CJ BIDAU. 1999. Karyotypic variation in populations of Ctenomys (Rodentia, Ctenomyidae) from La Pampa Province, Argentina. Caryologia 52:131-140. [ Links ]
10. BRAUN JK, RA VAN DEN BUSSCHE, PK MORTON y MA MARES. 2005. Phylogenetic and biogeographic relationships of mouse opossums Thylamys (Didelphimorphia, Didelphidae) in southern South America. Journal of Mammalogy 86:147-159. [ Links ]
11. BRAUN JK, BS COYNER, MA MARES y RA VAN DEN BUSSCHE. 2008. Phylogenetic relationships of South American grass mice of the Akodon varius group (Rodentia, Cricetidae, Sigmodontinae) in South America. Journal of Mammalogy 89: 768-777. [ Links ]
12. BURKART R, NO BÁRBARO, RO SÁNCHEZ y DA GÓMEZ 1999. Eco-regiones de la Argentina. Administración de Parques Nacionales. Buenos Aires. [ Links ]
13. BUSCH M, MH MIÑO y K HODARA. 2001. Habitat selection by Akodon azarae and Calomys laucha (Rodentia, Muridae) in Pampean agroecosystems at different spatial scales. Mammalia 65:29-48. [ Links ]
14. BUSCH M, MH MIÑO, JR DADÓN y K HODARA. 2000. Habitat selection by Calomys musculinus (Muridae, Sigmodontinae) in crop areas of the pampean region, Argentina Ecología Austral 10:15-26. [ Links ]
15. CAMPOS CM, RA OJEDA, S MONGE y M DACAR. 2001. Utilization of food resources by small and medium-sized mammals in the Monte desert biome, Argentina. Austral Ecology 26:142-149 [ Links ]
16. CANO E, G CASAGRANDE, H CONTI, J SALAZAR, LEA PLAZA, C PEÑA ZUBIATE, D MALDONADO PINEDO, H MARTINEZ, R HEVIA, C SCOPPA, B FERNANDEZ, M MONTES, J MUSTO y A PITTALUGA. 1980. Inventario Integrado de los Recursos Naturales de la Provincia de La Pampa. Instituto Nacional de Tecnología Agropecuaria. Ministerio de Economía y Asuntos Agrarios de la provincia de La Pampa. Facultad de Agronomía de la Universidad Nacional de La Pampa, 493 pp. [ Links ]
17. CONTRERAS JR. 1979. Ecología del ratón de campo Akodon azarae en la región semiárida del sudoeste bonaerense, Laguna Chasicó, partido de Villarino. Deserta (Mendoza) 4:15-24. [ Links ]
18. CONTRERAS JR y MI ROSI. 1980. Comportamiento territorial y fidelidad al hábitat en una población de roedores del centro de la Provincia de Mendoza. Ecología Argentina 5:17-29. [ Links ]
19. CORBALÁN V. 2004. Uso de hábitat y ecología poblacional de pequeños mamíferos del desierto del Monte central, Mendoza, Argentina. Tesis Doctoral inédita. Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata, La Plata, Argentina. [ Links ]
20. CORBALÁN V. 2006. Microhabitat selection by murid rodents in the Monte desert of Argentina. Journal of Arid Environments 65:102-110. [ Links ]
21. CORBALÁN V y G DEBANDI. 2006. Microhabitat use by Eligmodontia typus (Rodentia: Muridae) in the Monte Desert (Argentina). Mammalian Biology 71: 124-127. [ Links ]
22. CORBALÁN V y RA OJEDA. 2004. Spatial and temporal organisation of small mammal communities in the Monte desert, Argentina. Mammalia 68:5-14. [ Links ]
23. CORBALAN V y RA OJEDA. 2005. Áreas de acción en un ensamble de roedores del Desierto del Monte (Mendoza, Argentina). Mastozoología Neotropical 12:145-152. [ Links ]
24. CRESPO JA. 1966. Ecología de una comunidad de roedores silvestres en el partido de Rojas, provincia de Buenos Aires. Revista Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» (Argentina), Ecología 1:79-134. [ Links ]
25. D'ELÍA G, UFJ PARDIÑAS, JP JAYAT y J SALAZARBRAVO. 2008. Systematics of Necromys (Rodentia, Cricetidae, Sigmodontinae): species limits and groups, with comments on historical biogeography. Journal of Mammalogy 89:778-790. [ Links ]
26. DE SANTIS LJM, CI MONTALVO y ER JUSTO. 1983. Mamíferos integrantes de la dieta de Tyto alba (Aves, Strigiformes, Tytonidae) en la provincia de La Pampa, Argentina. Historia Natural 3:187-188. [ Links ]
27. DE SANTIS LJM, ER JUSTO, CI MONTALVO y M KIN. 1988. Mamíferos integrantes de la dieta de Tyto alba tiudara (Gray) en la provincia de La Pampa, Argentina. Actas de las Terceras Jornadas Pampeanas de Ciencias Naturales, Universidad Nacional de La Pampa, Serie Suplemento 4:165-175. [ Links ]
28. DE VILLAFAÑE G. 1981a. Reproducción y crecimiento de Akodon azarae azarae (Fischer, 1829). Historia Natural 1:193-204. [ Links ]
29. DE VILLAFAÑE G. 1981b. Reproducción y crecimiento de Calomys musculinus murillus (Thomas, 1916). Historia Natural 1:237-256. [ Links ]
30. DÍAZ GB, RA OJEDA, MH GALLARDO y S GIANNONI. 2000. Tympanoctomys barrerae. Mammalian Species 646:1-4. [ Links ]
31. ELLIS BA, JN MILLS, GE GLASS, KT MCKEE JR., DA ENRIA y E CHILDS. 1998. Dietary habits of the common rodents in an agroecosystem in Argentina. Journal of Mammalogy 79:1203-1220. [ Links ]
32. FRACASSI NG, J PEREIRA y P TETA. 2004. Efectos de la sequía sobre el comportamiento dietario de Tyto alba en el Parque Nacional Lihué Calel, La Pampa, Argentina. Actas del Primer Simposio Argentino sobre Investigación y Conservación de Rapaces, La Plata, Argentina, 30 pp. [ Links ]
33. GALLIARI CA y UFJ PARDIÑAS. 2000. Taxonomy and distribution of the sigmodontine rodents of genus Necromys in central Argentina and Uruguay. Acta Theriologica 45:211-232. [ Links ]
34. GIANNONI SM, CE BORGHI, M DACAR y CM CAMPOS. 2005. Main food categories in diets of sigmodontine rodents in the Monte (Argentina). Mastozoología Neotropical 12:181-187. [ Links ]
35. GONNET JM y RA OJEDA. 1998. Habitat use by small mammals in the arid Andean foothills of the Monte Desert of Mendoza, Argentina. Journal of Arid Environments 38:349-357. [ Links ]
36. HEINONEN FORTABAT S y JC CHEBEZ. 1997. Los mamíferos de los Parques Nacionales de la Argentina. Literature of Latin America (L.O.L.A.), Monografía Especial 14:1-76. [ Links ]
37. HERSHKOVITZ P. 1962. Evolution of Neotropical cricetine rodents (Muridae) withspecial reference to the phyllotine group. Fieldiana, Zoology 46:1-524. [ Links ]
38. JUSTO ER y LJM DE SANTIS. 1982. Alimentación de Tyto alba en la provincia de La Pampa. I (Strigiformes Tytonidae). Neotrópica 28:83-86. [ Links ]
39. JUSTO ER, CI MONTALVO y LJM DE SANTIS. 1985. Nota sobre la presencia de Tympanoctomys barrerae (Lawrence, 1941) en La Pampa (Rodentia: Octodontidae). Historia Natural 28:243-244. [ Links ]
40. KELT DA. 1994. The natural history of small mammals from Aisen Region, southern Chile. Revista Chilena de Historia Natural 67:183-207. [ Links ]
41. MASSARINI AI, MA BARROS, MO ORTELLS y OA REIG. 1991a. Evolutionary biology of fossorial ctenomyine rodents (Caviomorpha, Octodontidae). I. Chromosomal polymorphism and small karyotypic differentiation in Central Argentinian populations of tuco-tucos. Genetica 83:131-144. [ Links ]
42. MASSARINI AI, MA BARROS, VG ROIG y OA REIG. 1991b. Banded karyotypes of Ctenomys mendocinus (Rodentia, Octodontidae) from Mendoza, Argentina. Journal of Mammalogy 72:194-198. [ Links ]
43. MASSARINI AI, FJ DYZENCHAUZ y SI TIRANTI. 1998. Geographic variation of chromosomal polymorphism in nine populations of Ctenomys azarae, Tuco-tucos of the Ctenomys mendocinus group (Rodentia: Octodontidae). Hereditas 128:207-211. [ Links ]
44. MASSOIA E. 1973. Presencia y rasgos bioecológicos de Oryzomys longicaudatus pampanus, nueva subespecie en la provincia de Buenos Aires (Mammalia, Rodentia, Cricetidae). Revista de Investigaciones Agropecuarias, INTA, Serie 1, Biologia y Producción Animal 10:43-49. [ Links ]
45. MASSOIA E. 1988. Restos de mamíferos depredados por Bubo virginianus y cazadores desconocidos en el Parque Nacional Lihuél Calel, Departamento Lihuél Calel, provincia de La Pampa. Boletín Científico, Asociación para la Protección de la Naturaleza (APRONA) 6:4-9. [ Links ]
46. MASSOIA E y AS VETRANO. 1988. Análisis de regurgitados de Tyto alba de Villa Regina, General Roca, provincia de Río Negro. Boletín Científico, Asociación para la Protección de la Naturaleza (APRONA) 3:10-20. [ Links ]
47. MEDINA A. 2004. La adaptación a la vida subterránea y las reglas ecológicas clásicas: un análisis de alometría, dimorfismo sexual y variación geográfica en tuco-tucos (Rodentia: Ctenomyidae: Ctenomys). Tesis de Licenciatura, Universidad Nacional de Misiones, Misiones, Argentina. [ Links ]
48. MILLS JN, BA ELLIS, KT MCKEE, JI MAIZTEGUI y JE CHILDS. 1991. Habitat associations and relative densities of rodent populations in cultivated areas of central Argentina. Journal of Mammalogy 72:470- 479. [ Links ]
49. MILLS JN, BA ELLIS, KT MCKEE, JI MAIZTEGUI y JE CHILDS. 1992. Reproductive characteristics of rodent assemblages in cultivated regions of central Argentina. Journal of Mammalogy 73:515-526. [ Links ]
50. MONTALVO CI, ER JUSTO y LJM DE SANTIS. 1984. Alimentación de Tyto alba (Strigiformes, Tytonidae) en la provincia de La Pampa. II. Neotrópica 30:250- 252. [ Links ]
51. NAVARRO, MC. 1991. Ecología de Akodon molinae en el Monte Argentino. Tesis de licenciatura inédita, Facultad de Ciencias Naturales, Universidad Nacional de Tucumán, Argentina. [ Links ]
52. O'CONNELL MA. 1982. Population Biology of North and South American Grassland Rodents: A Comparative Review. Pp 167-185, en: Mammalian Biology in South America (MA Mares y HH Genoways, eds.). Special Publications Series. Pymatuning Laboratory of Ecology. University of Pittsburgh. [ Links ]
53. OJEDA RA. 1989. Small mammal responses to fire in the Monte Desert, Argentina. Journal of Mammalogy 70:416-420. [ Links ]
54. PALMA RE, E RIVERA-MILLA, J SALAZAR-BRAVO, F TORRES-PEREZ, UFJ PARDIÑAS, PA MARQUET, AE SPOTORNO, AP MEYNARD y TL YATES. 2005. Phylogeography of Oligoryzomys longicaudatus (Rodentia: Sigmodontinae) in temperate South America. Journal of Mammalogy 86:191-200. [ Links ]
55. PARDIÑAS UFJ y CA GALLIARI. 2001. Reithrodon auritus (Fischer, 1814). Mammalian Species 664:1-8. [ Links ]
56. PARDIÑAS UFJ, AM ABBA y ML MERINO. 2005. Micromamíferos (Didelphimorphia y Rodentia) del sudoeste de la provincia de Buenos Aires (Argentina): taxonomía y distribución. Mastozoología Neotropical 11:211-232. [ Links ]
57. PARDIÑAS UFJ, P TETA y G D'ELIA. 2006. Reithrodontini Vorontzov, 1959. Pp. 189-191, en: Mamíferos de Argentina: sistemática y distribución (RM Barquez, MM Díaz y RA Ojeda, eds.). Sociedad Argentina para el Estudio de los Mamíferos (SAREM), Mendoza. [ Links ]
58. PARDIÑAS UFJ, P TETA, S CIRIGNOLI y DH PODESTÁ. 2003. Micromamíferos (Didelphimorphia y Rodentia) de norpatagonia extra andina, Argentina: taxonomía alfa y biogeografía. Mastozoología Neotropical 10:69-113. [ Links ]
59. PEARSON OP. 1983. Characteristics of a mammalian fauna from forests in Patagonia, southern Argentina. Journal of Mammalogy 64:476-492. [ Links ]
60. PEARSON OP. 1988. Biology and feeding dynamics of a South American herbivorous rodent, Reithrodon. Studies on Neotropical Fauna and Environment 23:25-39. [ Links ]
61. PEARSON OP. 1995. Annotated keys for identifying small mammals living in or near Nahuel Huapi National Park or Lanín National Park, southern Argentina. Mastozoología Neotropical 2:99-148. [ Links ]
62. PIANTANIDA MJ. 1987. Distintos aspectos de la reproducción en la naturaleza y en cautiverio del roedor cricétido Akodon dolores. Physis, Sección C 45:47-58. [ Links ]
63. PRADO J, F GOIN y EP TONNI. 1985. Lestodelphys halli (Mammalia, Didelphidae) in Holocene deposits of Southeastern Buenos Aires Province (Argentina): Morphological and palaeoenvironmental considerations. Quaternary of South America and Antarctic Peninsula 3:93-107. [ Links ]
64. PRIOTTO JW y AR STEINMANN. 1999. Factors affecting home range size and overlap in Akodon azarae (Muridae: Sigmodontinae) in natural pasture of Argentina. Acta Theriologica 44:37-44. [ Links ]
65. PRIOTTO JW y JJ POLOP. 1997. Space and time use in syntopic populations of Akodon azarae and Calomys venustus (Rodentia, Muridae). Zeitschrift für Säugetierkunde 62:30-36. [ Links ]
66. PUIG S y NR NANI. 1981. Estudio del crecimiento y reproducción de Graomys griseoflavus (Waterhouse, 1837) en una colonia de laboratorio. Revista del Museo Argentino de Ciencias Naturales «Bernardino Rivadavia» 2:129-171. [ Links ]
67. REDFORD KH y JF EISENBERG. 1992. Mammals of the Neotropics, The Southern Cone, University of Chicago Press, Chicago. [ Links ]
68. ROOD JP. 1972. Ecological and behavioural comparisons of three genera of Argentine cavies. Animal Behaviour Monographs 5:1-83. [ Links ]
69. ROSI MI. 1983. Notas sobre la ecología, distribución y sistemática de Graomys griseoflavus (Waterhouse, 1837) (Rodentia, Cricetidae) en la provincia de Mendoza. Historia Natural 3:161-167. [ Links ]
70. SIEGENTHALER GB (Coord.). 2004. Relevamiento de vertebrados de la provincia de La Pampa. En: Inventario Integrado de los recursos naturales de la provincia de La Pampa. Instituto Nacional de Tecnología Agropecuaria, Universidad Nacional de La Pampa, Subsecretaría de Cultura de La Pampa. CD multimedia. [ Links ]
71. STEINMANN AR, JW PRIOTTO, EA CASTILLO y JJ POLOP. 2005. Size and overlap of home range in Calomys musculinus (Muridae: Sigmodontinae). Acta Theriologica 50:197-206. [ Links ]
72. TABENI S y RA OJEDA. 2003. Assessing mammal responses to perturbations in temperate aridlands of Argentina. Journal of Arid Environments 55:715- 726. [ Links ]
73. TARABORELLI P, V CORBALÁN y SM GIANNONI. 2003. Locomotion and escape modes in rodents of the Monte Desert (Argentina). Ethology 109:475- 485. [ Links ]
74. TIRANTI SI. 1988. Análisis de regurgitados de Tyto alba de la provincia de La Pampa. Boletín Científico, Asociación para la Protección de la Naturaleza 11:8-12. [ Links ]
75. TIRANTI SI. 1989. Tres roedores cricétidos nuevos para la fauna de la provincia de La Pampa. 1ra. Jornada Nacional de Fauna Silvestre, Actas 489-494. [ Links ]
76. TIRANTI SI. 1992. Barn Owl prey in southern La Pampa, Argentina. Journal of Raptor Research 26:89-92. [ Links ]
77. TIRANTI SI. 1994. Mammal prey of the Barn Owl (Tyto alba) in Parque Luro Reserve, La Pampa, Argentina. Hystrix 5:47-52. [ Links ]
78. TIRANTI SI. 1997. Cytogenetics of silky desert mice, Eligmodontia spp. (Rodentia: Sigmodontinae) in central Argentina. Zeitschrift für Säugetierkunde 62:37-42. [ Links ]
79. TIRANTI SI. 1998a. Cytogenetics of Graomys griseoflavus (Rodentia: Sigmodontinae) in central Argentina. Zeitschrift für Säugetierkunde 63:32-36. [ Links ]
80. TIRANTI SI. 1998b.Chromosomal variation in the scrub mouse Akodon molinae (Rodentia: Sigmodontinae) in central Argentina. Texas Journal of Science 50:223-228. [ Links ]
81. TOGNELLI MF, CM CAMPOS y RA OJEDA. 2001. Microcavia australis. Mammalian Species 648:1-4. [ Links ]
82. VARELA H y JJ POLOP. 1991. Variación morfométrica por edad y sexo en Akodon dolores -Rodentia, Cricetidae. Revista de la Universidad Nacional de Río Cuarto 1:51-61 [ Links ]
83. VERZI DH, EP TONNI, OA SCAGLIA y JO SAN CRISTÓBAL. 2002. The fossil record of the desertadapted South American rodent Tympanoctomys (Rodentia, Octodontidae). Palaeoenvironmental and biogeographic significance. Palaeogeography, Palaeoclimatology, Palaeoecology 179:149-158 [ Links ]
84. ZULETA GA. 1989. Estrategias de historia de vida en el ratón de pastizal pampeano Akodon azarae. Tesis Doctoral inédita, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina. [ Links ]
Recibido 7 marzo 2008.
Aceptado 7 octubre 2008.
Editor asociado: MM Díaz














