Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.16 no.2 Mendoza July/Dec. 2009
ARTÍCULOS Y NOTAS
Parásitos intestinales de Zaedyus pichiy (Xenarthra: Dasypodidae) de Mendoza, Argentina
M. Cecilia Ezquiaga1, Mariella Superina2 y Graciela T. Navone1
1 Centro de Estudios Parasitológicos y de Vectores (CEPAVE, CCT CONICET La Plata, UNLP). Calle 2 No. 584, (1900) La Plata, Argentina [Correspondencia: <gnavone@cepave.edu.ar>].
2 University of New Orleans, Department of Biological Sciences. Lakefront Campus. New Orleans, LA 70148-0001. USA.
RESUMEN: El piche Zaedyus pichiy es un pequeño armadillo que habita zonas áridas y semiáridas de Argentina y Chile. En este trabajo se estudiaron los parásitos intestinales de 53 piches silvestres de la Provincia de Mendoza, Argentina, y se evaluó la distribución de las especies parásitas halladas en la población hospedadora. Se analizaron las heces mediante técnicas de sedimentación y flotación, se estimaron las cargas parasitarias y se realizaron coprocultivos. El 93% de las muestras fueron positivas para protistas y/o helmintos. Entre los protistas, se observaron tres tipos diferentes de ooquistes de Eimeria (Coccidia, Eimeriidae), que sugieren la existencia de tres especies diferentes. Entre los helmintos, se identificaron huevos de Cestoda: Mathevotaenia sp. (Anoplocephalidae) y Nematoda: Trichuris sp. (Trichuridae); Aspidodera spp. (Aspidoderidae); Cyclobulura sp. (Subuluridae) y Trichostrongyloidea. Aspidodera spp. (79%) y Eimeria spp. (64%) fueron los más prevalentes, seguidos por Trichostrongyloidea (26%). Los restantes parásitos registraron prevalencias menores al 15%. Eimeria spp., Trichuris sp. y Cyclobulura sp. representan los primeros registros para Xenarthra en Argentina. Zaedyus pichiy es nuevo hospedador para Mathevotaenia sp. Las cargas parasitarias promedio fueron bajas para nematodes y moderadas para protistas. El monitoreo de las cargas parasitarias a lo largo del tiempo permitirá evaluar el impacto de actividades antrópicas y de factores ambientales sobre la salud poblacional de piches silvestres.
ABSTRACT: Intestinal parasites of Zaedyus pichiy (Xenarthra-Dasypodidae) from Mendoza, Argentina. The pichi Zaedyus pichiy is a small armadillo that lives in arid and semi-arid habitats of Argentina and Chile. We studied the intestinal parasites of 53 wild pichis from Mendoza Province, Argentina, and evaluated the distribution of the parasite species in the host population. We analyzed the feces by means of sedimentation and flotation techniques, estimated the parasite load, and performed fecal cultures. Ninety three percent of the samples were positive for protists and/or helminths. Among protists, we observed three different types of Eimeria (Coccidia, Eimeriidae) oocysts that suggest the existence of three different species. Among helminths, we identified eggs of Cestoda: Mathevotaenia sp. (Anoplocephalidae) and Nematoda: Trichuris sp. (Trichuridae); Aspidodera spp. (Aspidoderidae); Cyclobulura sp. (Subuluridae) and Trichostrongyloidea. Aspidodera spp. (79%) and Eimeria spp. (64%) were the most prevalent parasites, followed by Trichostrongyloidea (26%). The remaining parasites registered prevalences below 15%. Eimeria spp., Trichuris sp. and Cyclobulura sp. were recorded for the first time in a xenarthran host from Argentina. Zaedyus pichiy is a new host for Mathevotaenia sp. Mean parasite loads were low for nematodes and moderate for protists. Monitoring the parasite load of pichis over time will allow evaluating the impact of human activities and of environmental factors on the health of their wild populations.
Palabras clave. Armadillos; Cargas parasitarias; Helmintos; Prevalencia; Protistas.
Key words. Armadillos; Helminths; Parasite loads; Prevalence; Protists.
INTRODUCCIÓN
Los armadillos (Dasypodidae) comprenden, junto a osos hormigueros y perezosos, el Magnaorden Xenarthra. Son mamíferos muy primitivos, característicos y exclusivos de la región Neotropical. Están bien representados en América del Sur y particularmente en la República Argentina (Wilson y Reeder, 2005; Barquez et al., 2006). En la actualidad, unas 21 especies de armadillos se distribuyen en la selva neotropical, la puna, el monte y las zonas semiáridas de la Patagonia, entre los hábitats más frecuentes (Wetzel, 1985). Por sus particularidades anatómicas y fisiológicas son muy interesantes de ser estudiados, sin embargo no han recibido la debida atención por ser poco carismáticos (Abba et al., 2007). En lo que respecta al conocimiento de su fauna parasitológica, los primeros trabajos realizados se refieren a identificaciones y descripciones de especies endoparásitas (Navone y Lombardero, 1980; Chabaud et al., 1983; Navone, 1983, 1986, 1987a, 1987b; Notarnicola y Navone, 2003) y a la correlación de éstas con la distribución geográfica y los hábitos de alimentación de sus hospedadores (Navone, 1988, 1990, 1999). El conocimiento sobre ectoparásitos es algo más reciente y también más escaso (Autino y Lareschi, 1998; Lareschi y Mauri, 1998) y se restringe a los aportes realizados por Mauri y Navone (1993), quienes dieron a conocer las especies de ácaros, pulgas y garrapatas más comunes en la Argentina. Superina et al. (2004) mostraron la presencia de Amblyomma pseudoconcolor Aragão (Acari, Ixodidae) en Zaedyus pichiy (Desmarest, 1804) y Ezquiaga et al. (2008) señalaron la presencia de pulgas en armadillos de la Provincia de Buenos Aires.
Zaedyus pichiy es una pequeña especie de armadillo que habita zonas áridas y semiáridas de Argentina y Chile (Wetzel, 1985). Sus poblaciones silvestres han sufrido una significativa declinación desde que Darwin consideró a estos dasipódidos muy abundantes en la planicie patagónica (Keynes, 2000; Fonseca y Aguiar, 2004). Recientemente ha sido clasificada como Near Threatened (NT) por la UICN debido a fuertes presiones cinegéticas, y modificaciones y fragmentaciones de su hábitat (Fonseca y Aguiar, 2004; Superina et al., 2006). En este contexto, el estudio de la fauna parasitaria cobra importancia como aporte al manejo y la conservación de la especie.
Zaedyus pichiy se caracteriza por ser endémico del centro y sur de Argentina y Chile (Wetzel, 1985) y por ser un animal solitario, diurno, semifosorial y omnívoro-oportunista en sus hábitos alimenticios (Superina, 2008). Habita suelos arenosos y usa las madrigueras para protegerse de depredadores y del exceso de frío en invierno y calor en el verano (Superina, 2007). Parece ser el único xenartro que puede entrar en hibernación (Superina y Boily, 2007). En la provincia de Mendoza, se encuentra en las eco-regiones de la Estepa Patagónica y el Monte Bajo (Olson et al., 2001).
En el marco de una investigación sobre la historia natural y los patógenos presentes en poblaciones silvestres de Z. pichiy en la Provincia de Mendoza (Superina, 2007), se estudiaron los enteroparásitos a nivel poblacional con el objeto de identificar las especies presentes, determinar su distribución y evaluar el estado sanitario de la población estudiada. Se contribuye de este modo a la catalogación ilustrada de los enteroparásitos de Z. pichiy como herramienta diagnóstica y de utilidad en estudios parasitológicos de animales silvestres.
MATERIALES Y MÉTODOS
Entre octubre de 2001 y febrero de 2004 se capturaron 53 ejemplares de Z. pichiy en distintas localidades de la Provincia de Mendoza, Argentina. La mayoría de las capturas (N=45) fueron realizadas en el Departamento de Malargüe (35º58'S, 69º01'W) en la eco-región de la Estepa Patagónica (Olson et al., 2001). En esta eco-región, el clima es árido y el suelo arenoso volcánico, con una escasa vegetación (Candia et al., 1993, Candia y Dalmasso, 1995). El resto de las capturas se hicieron en los Departamentos de Lavalle (32º19'S, 67º58'W) (N=2); Santa Rosa (33º13'S, 67º57'W) (N=1); San Carlos (34º16'S, 69º07'W) (N=1); San Rafael (34º28'S, 67º33'W) (N=3); y General Alvear (34º38'S, 67º02'W) (N=1), en la eco-región del Monte Bajo (Olson et al., 2001). Esta región está caracterizada por llanuras y mesetas, con clima seco y suelos arenosos que favorecen el desarrollo de Prosopis y varias especies de la familia Zygophyllaceae (Peralta de Galmarini y Martínez Carretero, 1995).
Los animales fueron capturados a mano. Se les realizó un examen clínico, se colectó sangre mediante punción de la vena coccígea, muestras de materia fecal, y se los volvió a liberar en el sitio de captura (Superina et al., 2009; Superina y Mera y Sierra, 2008). Una parte de las heces fue conservada en Dicromato de Potasio (K2Cr2O7) al 2% para permitir el desarrollo de ooquistes de protistas, otra parte se conservó en solución fisiológica, y el resto se almacenó en formol al 10%. Para el análisis coproparasitológico se usaron las técnicas de Ritchie modificado (sedimentación) y Willis y Sheather (flotación) (Becerril Flores y Romero Cabello, 2004). Las observaciones se hicieron con un Microscopio óptico Olympus BH. Se tomaron las medidas correspondientes al diámetro de quistes de protistas y largo y ancho de huevos de helmintos. Las medidas se dan en micrómetros (μm) y los rangos se expresan entre paréntesis. Las car-gas parasitarias fueron estimadas mediante el uso de la cámara de Mac Master (Vignau et al., 2005) y se expresan como el promedio de ooquistes o huevos por gramo de heces (opg ó hpg, respectivamente) seguido por el rango observado entre paréntesis.
Con el fin de observar el desarrollo de ooquistes y huevos se realizaron coprocultivos utilizando una variante del método de Harada-Mori (Becerril Flores y Romero Cabello, 2004). La materia fecal conservada en solución fisiológica se colocó en una cápsula de Petri pequeña (50 mm de diámetro) sin tapa. Esta cápsula se colocó dentro de otra de mayor tamaño (100 mm de diámetro) con una fina capa de agua. La cápsula de mayor tamaño se tapó y se mantuvo a temperatura ambiente durante 20 días y luego a 23º C, por 25 días más. Se realizaron observaciones microscópicas periódicas con el fin de visualizar el desarrollo de ooquistes y huevos.
Otra forma de favorecer la esporulación de los ooquistes, fue conservar la materia fecal en Dicromato de Potasio. Luego en el laboratorio, se colocó la materia fecal en cápsulas de Petri y se mantuvo a temperatura ambiente por 10 días (Duszynski y Wilber, 1997).
Para evaluar la distribución de las diferentes especies enteroparásitas en la población hospedadora, se calculó la prevalencia (P) total y para cada sexo (Bush et al., 1997). Se aplicó el test de Z para determinar el nivel de significancia de las comparaciones realizadas (Morales y Pino, 1987). Se consideraron significativos los valores de P < 0.05. La identificación de Coccidea se basó en Lainson y Shaw (1982), para Nematoda se consultó a Anderson et al. (1974) y Navone (1986; 1987b; 1990) y para Cestoda a Navone (1988) y Khalil et al. (1994).
RESULTADOS
La totalidad de las muestras (N= 53) fueron procesadas por las técnicas de flotación y al 50% de las mismas se aplicó la técnica de sedimentación (Ritchie). En todos los casos la recuperación de formas parasitarias fue efectiva, no observándose diferencias en los resultados obtenidos, con la excepción que los métodos de flotación permitieron obtener preparaciones más límpidas y realizar el recuento en la cámara de Mac Master.
La observación macroscópica de la materia fecal permitió identificar restos vegetales y de exoesqueletos de insectos, comprobándose que la dieta del hospedador es parcialmente herbívora e insectívora. El 93% de las muestras estuvieron parasitadas al menos con alguna de las especies determinadas.
Se identificaron huevos de Cestoda, Mathevotaenia Akhumyan, 1946 (Cyclophyllidea: Anoplocephalidae) y Nematoda: Trichuris Roederer, 1761 (Adenophorea: Trichuroidea; Trichuridae); Trichostrongyloidea (Secernentea: Strongylida); Aspidodera Raillet y Henry, 1912 (Ascaridida: Heterakoidea: Aspidoderidae); y Cyclobulura Quentin, 1977 (Ascaridida: Subuluroidea: Subuluridae). Se encontraron ooquistes de protistas, que pudieron identificarse como pertenecientes al género Eimeria Schneider, 1875 (Coccidia, Eimeriidae). El estudio morfológico de los quistes se basó en el tamaño, forma y tipo de pared y permitió diferenciar tres especies (Eimeria sp. 1, Eimeria sp. 2 y Eimeria sp. 3; Fig. 1).
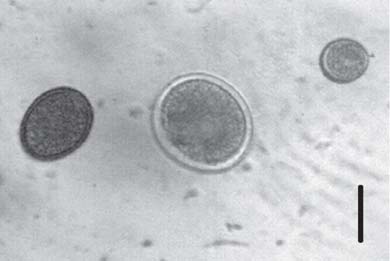
Fig. 1. Eimeria spp.: muestra comparativa de los tres tipos de quistes observados. Escala = 20 µm
Protozoa: Coccidia, Eimeriidae Eimeria sp. 1 (Fig. 2a)
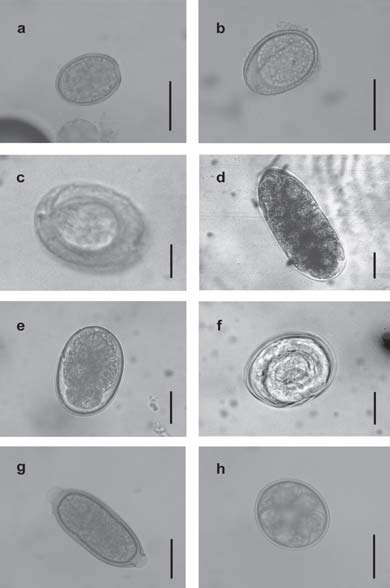
Fig. 2. Huevos y ooquistes en materia fecal de Zaedyus pichiy de la Provincia de Mendoza, Argentina: (a) Eimeria sp. 1, ooquiste con pared lisa y micrópila; (b) Eimeria sp. 2, ooquiste con pared ornamentada y sin micrópila; (c) Mathevotaenia sp., huevo con embrión hexacanto; (d) Trichostrongyloidea, huevo morulado; (e) Aspidodera sp., huevo morulado; (f) Cyclobulura sp., huevo larvado; (g) Trichuris sp., huevo con dos tapones polares; (h) Ooquiste de Coccidea; Adeleidae, parásito en tránsito. Escala = 20µm
Ooquistes redondeados, con pared lisa y micrópila; 21-24 x 18-21 μm (n=20).
Localidades.—Malargüe (Estepa Patagónica) y San Rafael (Monte Bajo).
Prevalencia total.—15%; machos y hembras: 7.5% (p>0.05).
Eimeria sp. 2 (Fig. 2b)
Ooquistes ovalados, con pared ornamentada y doble, de 1.3 μm de espesor, sin micrópila; 24-34 x 21-27 μm (n=20). Los esporoquistes miden 11.7 x 7.8-9.1 μm y el cuerpo residual del ooquiste de 5 μm de diámetro, se ubica en el extremo de cada esporoquiste (Fig. 3).
Localidades.—Malargüe, San Carlos (Estepa Patagónica), San Rafael, Lavalle y General Alvear (Monte Bajo).
Prevalencia total.— 64%; machos: 43%, hembras: 20% (p>0.05).
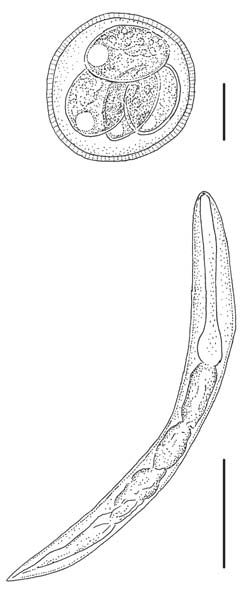
Fig. 3. Arriba: Eimeria sp. 2, ooquiste esporulado en cultivo con Dicromato de Potasio; escala = 10 μm. Abajo: Aspidodera sp., larva obtenida a los 13 días del inicio del cultivo con Harada-Mori; escala = 100 μm.
Eimeria sp. 3
Ooquistes ovalados, con pared ornamentada, sin micrópila, 39-48 x 30-45 μm (n=20).
Localidades.—Malargüe (Estepa Patagónica) y San Rafael (Monte Bajo).
Prevalencia total.—15%; machos y hembras: 7.5% (p>0.05). morulado; (e) Aspidodera sp., huevo morulado; .
Comentarios.—En Brasil, Diniz et al. (1997) encontraron "Coccidia" en cinco especies de armadillos (Dasypus novemcinctus Linnaeus, 1758; Euphractus sexcinctus Linnaeus, 1758; Priodontes maximus Kerr, 1792; Cabassous McMurtrie, 1831 y Tolypeutes Illiger, 1811). Duszynski et al. (2000) mostraron que la mayoría de las especies de Eimeria descriptas para dasipódidos fueron consideradas sinónimas o nomen nudum, señalándose que Eimeria dacunhai Levine, 1984 parásita de Cabassous sp., es la única especie válida hasta el momento. Sin embargo, entre los Eimeria que parasitan a Myrmecophagidae y Megalonychidae, la sistemática parece ser más precisa y hasta el presente 7 especies han sido descriptas y otras 2 no identificadas (Duszynski et al., 2000).
En Z. pichiy pudo observarse la presencia de tres tipos diferentes de ooquistes que se separan de los Eimeria spp. de otros xenartros por su morfología y tamaño. La presencia de Eimeria spp. en Z. pichiy constituye el primer registro de un Coccidea en un xenartro en Argentina y de la coexistencia de diferentes especies en la misma especie hospedadora.
Las cargas de ooquistes fueron clasificadas como bajas (> 100 y < 10000 opg), medianas (> 10000 y < 60000 opg) y altas (> 60000 opg), teniendo en cuenta el rango entre bajas y altas cargas observado en el total de animales examinados para el presente estudio.
Si bien las cargas parasitarias no pudieron ser discriminadas por tipo de quiste, el promedio de ooquistes por gramo de heces fue de 11861 opg (210-64400).
Los coprocultivos realizados en Dicromato de Potasio permitieron observar la esporulación de la especie de coccidio identificada como Eimeria sp. 2, hallada en el mayor número de muestras (64%; Fig. 3). Las especies identificadas como Eimeria sp. 1 y Eimeria sp. 3 no esporularon y fueron las que se encontraron en menor porcentaje (15%). Los cultivos realizados con la técnica de Harada-Mori no favorecieron el desarrollo de ooquistes.
Platyhelminthes: Cestoda, Cyclophyllidea, Anoplocephalidae Mathevotaenia sp. (Fig. 2c)
Huevos de 72-75 x 60-63 μm (n=15), la oncósfera mide 30 x 27 μm y el embrión hexacanto presenta ganchos dispuestos paralelamente que miden entre 11 y 17 μm.
Localidad.—Malargüe (Estepa Patagónica).
Prevalencia total.—9%; machos 5.6%, hembras 3.7% (p>0.05).
Comentarios.—Navone (1988) describió dos especies de Mathevotaenia Akhumyan, 1946 en Dasypodidae de Argentina: M. diminuta Navone, 1988 en Chaetophractus vellerosus Gray, 1865 de la provincia de Formosa y M. matacus Navone, 1988 en Tolypeutes matacus Desmarest, 1804 procedente de la provincia de Chaco. También redescribió otra especie, M. surinamensis Cohn, 1902 parásita de Dasypus novemcinctus Linnaeus, 1758. Mathevotaenia es además parásito de marsupiales en Argentina: M. argentinensis Campbell, Gardner y Navone, 2003 parasita a Didelphis albiventris Lund, 1840 y M. bivittata (Janicki, 1904) Yamaguti, 1959 es parásito de Micoureus demerarae (Thomas, 1905) Temminck, 1824 (= M. cinereus) (Campbell et al., 2003). Teniendo en cuenta que el tamaño y la morfología de los huevos de cestodes no permite su identificación a nivel específico, el hallazgo de Mathevotaenia sp. en Z. pichiy de Mendoza constituye la ampliación de la distribución geográfica y hospedatoria del género en Argentina, dado que hasta el presente se conocía su presencia en las provincias de Corrientes, Córdoba, Chaco, Formosa y Santiago del Estero (Navone, 1990).
Nematoda: Strongylida, Trichostrongyloidea (Fig. 2d)
Huevos de tamaño mediano, 84-85.5 x 42-45 μm (n=15). La cáscara es lisa y fina; morulado al momento de la puesta. Las paredes laterales son paralelas.
Localidades.— Malargüe (Estepa Patagónica), Santa Rosa, Lavalle y General Alvear (Monte Bajo).
Prevalencia total.—26%; machos 15%, hembras 11% (p>0.05).
Carga parasitaria.—589 hpg (116-1280).
Comentarios.—Los nematodes Trichostrongyloidea son frecuentemente hallados en Dasypodidae de Argentina. Navone (1987b) señaló la presencia de Trichohelix tuberculata Parona y Stossich, 1901 en Chaetophractus villosus Desmarest, 1804, y Maciela elongata Navone, 1987 y Moënnigia virilis Navone, 1987 en Tolypeutes matacus. Los huevos de T. tuberculata se diferencian de los observados en el presente estudio porque son de mayor tamaño (108 x 54 μm vs 84-85.5 x 42-45 μm); los de M. elongata y M. virilis son de menor tamaño (60 x 33 μm) y se diferencian de los huevos observados en Z. pichiy por su morfología. Por otra parte, Navone (1990) observó la presencia de Ancylostoma caninum (Strongylida, Ancylostomatoidea) en Z. pichiy procedente de la provincia de La Pampa. Al comparar el tamaño de los huevos se observa que los hallados en el presente trabajo son de mayor tamaño (84-85.5 x 4245 μm vs 56-65 x 37-43 μm). Futuros estudios sobre animales decomisados permitirán completar esta investigación al identificar los nematodes adultos que producen este tipo de huevos. El presente hallazgo permite incorporar a Z. pichiy al listado de hospedadores de nematodes Trichostrongyloidea.
Nematoda: Heterakoidea, Aspidoderidae Aspidodera spp. (Fig. 2e)
Huevos de tamaño mediano, 54-64 x 40-48 μm (n=40); morulados al momento de la puesta. La cáscara es lisa y gruesa, de un color amarillento.
Localidades.—Malargüe (Estepa Patagónica), San Rafael, Lavalle y General Alvear (Monte Bajo).
Prevalencia total.—79%; machos 49%, hembras 30% (p>0.05).
Carga parasitaria.—894 hpg (40-7240). Para estimar el valor de las cargas parasitarias de Aspidodera, se realizó la necropsia de un hospedador que fue decomisado muerto por las autoridades y cuya materia fecal fue analizada. Se identificaron los nematodes hallados, se contó el número de machos (74) y de hembras (63) de Aspidodera observándose que la proporción de machos vs hembras es aproximadamente 1:1. Ese número se correlacionó con la carga parasitaria evaluada por el método de Mac Master (240 hpg), a partir de ello se determinaron cargas parasitarias bajas (< 100), moderadas (>100 y < 1000) y altas (> 1000 hpg), teniendo en cuenta también el número de huevos observados para estas especies en el total de muestras procesadas.
El cultivo de materia fecal con la técnica de Harada-Mori permitió el desarrollo de los huevos de Aspidodera spp., que comenzaron el proceso de gastrulación a las 48 horas. A los 7 días se observó el desarrollo de larvas del primer estadio. A los 13 días se observó una larva eclosionada de 498 μm de largo y esófago con bulbo (Fig. 3). En los días subsiguientes no hubo modificaciones y sólo se observaron fragmentos de larvas.
Comentarios.—Los nematodes del género Aspidodera y las especies A. fasciata Schneider, 1866, A. scoleciformis Diesing, 1851 y A. vazi Proença, 1937 pueden encontrarse solas o asociadas en el intestino grueso y ciego de un mismo hospedador (Navone, 1990). Sin embargo estas especies no pueden diferenciarse por medio de sus huevos, pero el hecho de haber observado en la materia fecal de algunos ejemplares de Z. pichiy (N=8) especímenes adultos de A. fasciata y A. scoleciformis, permite sugerir que los huevos observados en el presente estudio corresponderían a estas especies de Aspidodera.
Nematoda: Subuluroidea: Subuluridae Cyclobulura sp. (Fig. 2f)
Huevos de tamaño mediano, 54-80 x 39-60 μm (n=15), con cáscara lisa y delgada, larvados al momento de la puesta.
Localidades.—Malargüe (Estepa Patagónica) y Lavalle (Monte Bajo).
Prevalencia total.—5.6 %, sólo en hospedadores machos. No se realizó test estadístico para determinar la existencia de diferencias significativas entre machos y hembras dado que este género sólo fue hallado en 3 individuos.
Carga parasitaria.—118 hpg (116-120).
Comentarios.—Cyclobulura sp. se encontró en muy pocos hospedadores. La subfamilia Labiobulurinae comprende tres géneros, Cyclobulura, Tarsubulura y Labiobulura (Quentin, 1977). Los hospedadores de estos géneros son xenartros, tupaidos, lorísidos asiáticos y marsupiales australianos. La única especie descripta para xenartros es Cyclobulura lainsoni Quentin, 1977 en Cyclopes didactylus Linnaeus, 1758 (Cyclopedidae) procedente de Belem, Brasil (Quentin, 1977). La presencia de Cyclobulura sp. en Z. pichiy sugiere la existencia de una nueva especie aún no descripta, basado en nematodes adultos colectados en hospedadores hallados muertos (Navone, com. pers.). Sin embargo la baja prevalencia observada de Cyclobulura sp. en esta especie hospedadora y el hecho de no haberse registrado en investigaciones realizadas sobre diferentes especies de dasipódidos en una amplia distribución geográfica (Navone, 1990), permite sugerir que Cyclobulura sp. es un parásito no habitual en este grupo de xenartros.
Nematoda: Trichuroidea: Trichuridae Trichuris sp. (Fig. 2g)
Huevos de 61.5 x 27 μm (n=9), con forma de limón y color ámbar. Presentan 2 tapones polares sobresalientes y transparentes.
Localidad.— Malargüe (Estepa Patagónica).
Prevalencia total.—4%, sólo en hospedadores machos. No se realizó test estadístico para determinar la existencia de diferencias significativas entre machos y hembras dado que este género sólo fue hallado en 2 individuos.
Carga parasitaria.—66 hpg (53-80).
Comentarios.—Talmage y Buchanan (1954) señalaron la presencia de Trichuris sp. en Dasypus hybridus Desmarest, 1804, Tolypeutes tricinctus Linnaeus, 1758 y Cabassous unicinctus Linnaeus, 1758 sin precisar la procedencia. Diniz et al. (1997) citaron a Trichuris sp. en armadillos en cautividad de Brasil. El hallazgo de Trichuris sp. en Z. pichiy constituye el primer registro para xenartros de Argentina. Sin embargo, la baja prevalencia observada en el presente estudio (4%) y la ausencia en otras áreas de distribución de xenartros (Navone, 1990) sugieren que Trichuris no es un parásito frecuente en estos hospedadores.
Parásitos en tránsito (Fig. 2h)
Ooquistes redondeados de tamaño mediano, 36-44 x 33-40 μm (n=10), esporulados en las heces con 8 ó 16 esporoquistes.
Localidades.—Malargüe (Estepa Patagónica) y San Rafael (Monte Bajo).
Prevalencia total.—20%; machos 13%, hembras 7% (p>0.05).
Carga parasitaria.—12265 opg (1600-53600).
Comentarios.—La presencia de parásitos de las presas en el contenido intestinal de un predador es lo que se conoce como parasitismo en tránsito (Fugassa y Guichón, 2005). En este sentido es común hallar parásitos de insectos en los hospedadores que predan sobre ellos. Los ooquistes observados en las heces de Z. pichiy corresponderían a apicomplejos Adeleidae que parasitan a invertebrados, principalmente grillos, coleópteros y anélidos (Lange y Wittenstein, 2001). Estudios realizados en marsupiales (Teixeira et al., 2003), señalaron la presencia de ooquistes de Adeleidae en las heces de Didelphis aurita Wied-Neuwied, 1826, cuya morfometría coincide con la observada en los ooquistes hallados en el presente trabajo. La resistencia de la pared de los ooquistes o esporoquistes de estos parásitos, les permite pasar a través del tracto intestinal del hospedador sin sufrir cambios en sus características morfológicas. Esta particularidad ha sido incorrectamente señalada por otros autores como pseudoparasitismo (Teixeira et al, 2003). De este modo, los Adeleidae serían frecuentes en el contenido intestinal de los depredadores de sus hospedadores invertebrados. Su presencia en las heces de Z. pichiy podría explicarse por los hábitos tróficos de estos hospedadores, que consumen preferentemente invertebrados del suelo.
DISCUSIÓN
Los resultados obtenidos en la población de Z. pichiy estudiada permiten indicar que el promedio de las cargas parasitarias fue moderado para protistas y bajo para nematodes. Respecto a los cestodes, sólo se sugiere su infección a través de la presencia de huevos en las heces, ya que no se calculan las cargas parasitarias por tratarse de helmintos hermafroditas y polizoicos (nuevos proglótidos son continuamente diferenciados desde el extremo anterior). Tanto en la Estepa Patagónica como en el Monte Bajo predominaron las formas parásitas monoxenas (Eimeria spp., Aspidodera spp., Trichostrongyloidea, Trichuris sp.), aunque también se hallaron parásitos de ciclo heteroxeno (Mathevotaenia sp., Cyclobulura sp.) que necesitan de un hospedador intermediario. La predominancia de formas monoxenas sugiere por un lado una dieta más herbívora que insectívora y por otro la ingesta de suelo. Consecuentemente, estómagos de piches del Departamento de Malargüe analizados por Superina (2007) contenían un promedio de 66% de arena y todos los ejemplares estudiados también habían ingerido materia vegetal. Esta última representaba el ítem predominante en 5 de 26 ejemplares examinados, mientras que otros piches habían ingerido una mayor cantidad de larvas y adultos de coleópteros (ítem predominante en 11 y 3 piches, respectivamente), hormigas (n=5), dípteros (n=1) o arácnidos (n=1). Unos pocos (n=2) habían ingerido vertebrados (lagartijas o pelos de mamíferos). En base a estos hallazgos los piches fueron clasificados como omnívoros oportunistas que se alimentan predominantemente de insectos (Superina, 2007) y ello se corresponde con la presencia de parásitos propios de coleópteros y de otros artrópodos. Sin embargo, a pesar de la frecuencia de insectos entre los ítems dominantes en la alimentación, no parecerían estar involucrados en la transmisión de endoparásitos para Z. pichiy, considerando la baja riqueza de parásitos heteroxenos hallados (2 especies), aunque la presencia de Cyclobulura sp. refuerza la hipótesis de las preferencias tróficas de Z. pichiy, dado que la única especie conocida del género, C. lainsoni, es parásita de Cyclopes didactylus, que es básicamente insectívoro (Eisenberg y Redford, 1999).
Entre los nematodes, Aspidodera spp. fue el más frecuente tanto en la Estepa Patagónica como en el Monte Bajo. Si bien no pueden diferenciarse las especies por medio de sus huevos, la observación de adultos de A. fasciata y A. scoleciformis en la materia fecal de algunos ejemplares examinados, confirma que ambas especies coexisten en Z. pichiy.
Los trichostrongylidos no mostraron preferencia por ningún ambiente en particular, y su prevalencia fue del 26%, menor a la observada en otros xenartros (e.g. C. villosus de la provincia de Buenos Aires), en los cuales Navone (1987b) observó un 64% de individuos parasitados por T. tuberculata, la especie de trichostrongylido más común en C. villosus.
Trichuris sp. se encontró sólo en dos machos provenientes de la Estepa Patagónica. De modo similar, Cyclobulura sp. sólo se encontró en tres individuos machos. En muchas especies de vertebrados los machos tienen tasas de parasitismo más altas que las hembras por razones fisiológicas o ecológicas (Wilson et al., 2002), pero en este caso, se requeriría de un mayor número de muestras para determinar si existe una explicación biológica para que Trichuris sp. y Cyclobulura sp. sólo parasiten hospedadores machos de Z. pichiy o si se trata de un efecto aleatorio.
La presente investigación pretende avanzar sobre el conocimiento del estado de salud de las poblaciones silvestres de Z. pichiy. Una leve a moderada carga parasitaria es normal en animales silvestres y no necesariamente está ligada a una manifestación clínica. Algunos parásitos pueden causar lesiones en sus sitios de infección por su localización (e.g intracelular en Eimeria spp.), por su modo de fijación (e.g. Trichuris sp.) o en distintos tejidos durante la migración larval. Efectivamente, el análisis histológico de 150 piches decomisados muertos por las autoridades, indicó que las lesiones más comunes en esta especie están relacionadas con la infestación con entero y ectoparásitos o migración larval (Superina et al., 2009). Sin embargo, el examen clínico y hematológico de los ejemplares muestreados para este estudio sugirió que su carga parasitaria no los afectó significativamente (Superina et al., 2009; Superina y Mera y Sierra, 2008). El monitoreo de sus cargas parasitarias a lo largo del tiempo permitirá evaluar el impacto de actividades antrópicas y de factores ambientales sobre la salud poblacional, ya que el estrés crónico afecta negativamente el sistema inmunológico de los animales y puede llevar a un incremento de las cargas parasitarias (Oppliger et al., 1998). En el caso de especies que están sometidas a la cacería furtiva y por lo tanto son decomisadas con cierta regularidad (e.g. Z. pichiy), es esencial contar con la información parasitológica de distintas poblaciones silvestres. En el caso de que existan diferencias entre la composición parasitaria de distintas poblaciones, el análisis coproparasitológico de un ejemplar decomisado podría ayudar a delimitar su área de origen y por lo tanto permitir su liberación en el hábitat apropiado. En este sentido, los avances en las investigaciones parasitológicas de animales silvestres y en particular de xenartros permitirán ampliar el conocimiento taxonómico de su fauna parasitaria, su distribución geográfica y el espectro de especies hospedadoras con el fin último de referenciar áreas, hospedadores y especies parasitarias asociadas. Si bien estudios previos pueden afirmar que hospedadores emparentados tienden a albergar especies parásitas relacionadas entre sí, los parásitos de una especie hospedadora en particular están determinados por el medio ambiente, los hábitos del hospedador y los cambios que éstos pudieron haber experimentado en el curso de la evolución (Navone, 1983).
AGRADECIMIENTOS
Agradecemos a los guardaparques que ayudaron en la toma de muestras, especialmente Guillermo Ferraris, Leonardo Orozco, Martín Palma y Facundo Martínez. A Cecilia Carballo por su asistencia técnica en el laboratorio y a los revisores anónimos que permitieron mejorar el manuscrito. Este estudio fue financiado por la University of New Orleans, Pittsburgh Zoo, y el IUCN Edentate Action Fund; por el CONICET y la UNLP.
LITERATURA CITADA
1. ABBA AM, SF VIZCAÍNO y MH CASSINI. 2007. Effects of land use on the distribution of three species of armadillos in the Argentinean pampas. Journal of Mammalogy 88:502-507. [ Links ]
2. ANDERSON RC, AG CHABAUD y S WILLMOTT. 1974. CIH Keys to the Nematode parasites of Vertebrates. Commonwealth Agricultural Bureaux, England. [ Links ]
3. AUTINO AG y M LARESCHI. 1998. Capítulo 27: Si phonaptera. Pp. 279-290, en: Biodiversidad de artrópodos argentinos. Una perspectiva biotaxonómica (JJ Morrone y S Coscarón, eds.) Ediciones Sur, La Plata. [ Links ]
4. BARQUEZ RM, MM DIAZ y RA OJEDA (eds.). 2006. Mamíferos de Argentina. Sistemática y distribución. Sociedad Argentina para el Estudio de los Mamíferos. [ Links ]
5. BECERRIL FLORES MA y R ROMERO CABELLO. 2004. Parasitología médica: de las moléculas a la enfermedad. McGraw-Hill Interamericana. [ Links ]
6. BUSH AO, KD LAFFERTY, JM LOTZ y AW SHOSTAK. 1997. Parasitology meets ecology on its own terms: Margolis et al. revisited. Journal of Parasitology 83:575-583. [ Links ]
7. CAMPBELL ML, SL GARDNER y GT NAVONE. 2003. A new species of Mathevotaenia (Cestoda: Anoplocephalidae) and other tapeworms from marsupials in Argentina. Journal of Parasitology 89:1181-1185. [ Links ]
8. CANDIA R, S PUIG, A DALMASSO, F VIDELA y MARTÍNEZ CARRETERO. 1993. Diseño del plan de manejo para la Reserva Provincial La Payunia (Malargüe, Mendoza). Multequina 2:5-87. [ Links ]
9. CANDIA R y AD DALMASSO. 1995. Dieta del guanaco (Lama guanicoe) y productividad del pastizal en la Reserva La Payunia, Mendoza (Argentina). Multequina 4:5-15. [ Links ]
10. CHABAUD AG, GT NAVONE y O BAIN. 1983. Description de Mazzia bialata n. sp., parasite de Dasypodidés. Attribution du genre aux Nématodes Spirocercidae. Bulletin du Museum National d'Histoire Naturelle (Paris) 4 (5), section A:175-179. [ Links ]
11. DINIZ LS, EO COSTA y PM OLIVEIRA. 1997. Clinical disorders in armadillos (Dasypodidae, Edentata) in captivity. Zentralblatt für Veterinärmedizin (B) 44:577-582. [ Links ]
12. DUSZYNSKI DW y PG WILBER. 1997. A guideline for the preparation of species descriptions in the Eimeriidae. Journal of Parasitology 83:333-336. [ Links ]
13. DUSZYNSKI DW, L COUCH y SJ UPTON. 2000. Coccidia (Eimeria and Isospora) of Xenarthra. http://kstate.edu/parasitology/worldcoccidia/XENARTHRA [ Links ]
14. EISENBERG JF y KH REDFORD. 1999. Mammals of the Neotropics 3. The central Neotropics. University of Chicago Press, Chicago. [ Links ]
15. EZQUIAGA MC, M LARESCHI, AM ABBA y GT NAVONE. 2008. Nuevos registros de pulgas (Siphonaptera) parásitas de dasipódidos (Mammalia: Xenarthra) en el noreste de la provincia de Buenos Aires, Argentina. Mastozoología Neotropical 15:193-196. [ Links ]
16. FONSECA GAB y JM AGUIAR. 2004. The 2004 Edentate Species Assessment Workshop. Edentata 6:1-26. [ Links ]
17. FUGASSA M y R GUICHÓN. 2005. Análisis paleoparasitológico de coprolitos hallados en sitios arqueológicos de Patagonia austral: definiciones y perspectivas. Magallania 33:13-19. [ Links ]
18. KEYNES R. 2000. Charles Darwin's zoology notes & specimen lists from H.M.S. Beagle. Cambridge University Press, Cambridge. [ Links ]
19. KHALIL LF, A JONES y RA BRAY. 1994. Keys to the Cestode Parasite of Vertebrates. CAB International, Cambridge. [ Links ]
20. LARESCHI M y R MAURI. 1998. Capítulo 58: Dermanyssoidea. Pp. 581-590, en: Biodiversidad de artrópodos argentinos. Una perspectiva biotaxonómica (JJ Morrone y S Coscarón, eds.). Ediciones Sur, La Plata. [ Links ]
21. LAINSON R y JJ SHAW. 1982. Coccidia of Brazilian Edentates: Eimeria cyclopei from the silky anteater, Cyclopes didactylus and Eimeria choloepi n.sp. from the two-toed sloth, Choloepus didactylus. Systematic Parasitology 4:269-278. [ Links ]
22. LANGE CE y E WITTENSTEIN. 2001. An Adelina sp. (Apicomplexa: Coccidia) found in Anurogryllus muticus (De Geer) (Orthoptera: Gryllidae). Journal of Invertebrate Pathology 77:83-84. [ Links ]
23. MAURI R y GT NAVONE. 1993. Ectoparásitos (Siphonaptera y Acari) más comunes en Dasypodidae (Mammalia: Xenarthra) de la República Argentina. Revista de la Sociedad Entomológica Argentina 52:121-122. [ Links ]
24. MORALES G y LA PINO. 1987. Parasitología cuantitativa. Fundación Fondo Editorial. Acta Científica Venezolana Eds. [ Links ]
25. NAVONE GT y O LOMBARDERO. 1980. Estudios parasitológicos en edentados argentinos. I. Pterygodermatites (Pterygodermatites) chaetophracti en Chaetophractus villosus y Dasypus hybridus (Nematoda Spirurida). Neotrópica 26:65-70. [ Links ]
26. NAVONE GT. 1983. Estudios parasitológicos en edentados argentinos. Tesis doctoral, Facultad de Ciencias Naturales y Museo, Universidad Nacional La Plata, La Plata, Argentina. [ Links ]
27. NAVONE GT. 1986. Estudios parasitológicos en edentados argentinos. II. Nematodes parásitos de armadillos: Aspidodera fasciata (Schneider, 1866); Aspidodera scoleciformis (Diesing, 1851) y Aspidodera vazi Proença, 1937. (Nematoda-Heterakoidea). Neotrópica 32:71-79. [ Links ]
28. NAVONE GT. 1987a. Descripción del macho de Pterygodermatites (Paucipectines) chaetophracti (Navone y Lombardero, 1980) Sutton, 1984 (Nematoda-Rictulariidae). Neotrópica 33:45-49. [ Links ]
29. NAVONE GT. 1987b. Estudios parasitológicos en edentados argentinos. III. Trichostrongylidos, Macielia elongata sp. nov; Moennigia virilis sp. nov. y Trichohelix tuberculata (Parona y Stossich, 1901) Ortlepp, 1922 (Molineidae-Anoplostrongylinae) parásitos de Chaetophractus villosus Desmarest y Tolypeutes matacus (Desmarest) (Xenarthra-Dasypodidae). Neotrópica 33:105-117. [ Links ]
30. NAVONE GT. 1988. Estudios parasitológicos en edentados argentinos. IV. Cestodes pertenecientes a la familia Anoplocephalidae Cholodkovshy, 1902, parásitos de dasipódidos. Neotrópica 34:51-61. [ Links ]
31. NAVONE GT. 1990. Estudio de la distribución, porcentaje y microecología de los parásitos de algunas especies de edentados argentinos. Studies on Neotropical Fauna and Environment 25:199-210. [ Links ]
32. NAVONE GT. 1999. Endoparásitos de Dasypodidae como potenciales indicadores de la ecología y evolución de sus hospedadores. 14 Jornadas Argentinas de Mastozoología, Salta, Resúmenes:20. [ Links ]
33. NOTARNICOLA J y GT NAVONE. 2003. Systematics and distribution of Orihelia anticlava (Molin, 1858) (Nematoda, Onchocercidae) from dasypodids of South America. Acta Parasitologica 48:103-110. [ Links ]
34. OLSON DM, E DINERSTEIN, ED WIKRAMANAYAKE, ND BURGESS, GVN POWELL, EC UNDERWOOD, JA D'AMICO, I ITOUA, HE STRAND, JC MORRISON, CJ LOUCKS, TF ALLNUTT, TH RICKETTS, Y KURA, JF LAMOREUX, WW WETTENGEL, P HEDAO y KR KASSEM. 2001. Terrestrial Ecoregions of the World: A New Map of Life on Earth. BioScience 51:933-938. [ Links ]
35. OPPLIGER A, J CLOBERT, J LECOMTE, P LORENZON, K BOUDJEMADI y HB JOHN-ALDER. 1998. Environmental stress increases the prevalence and intensity of blood parasite infection in the common lizard Lacerta vivipara. Ecology Letters 1:129-138. [ Links ]
36. PERALTA DE GALMARINI I y E MARTÍNEZ CARRETERO. 1995. Guías botánicas para la Provincia de Mendoza. II. Reserva Natural Telteca. Boletín de Extensión Científica (IADIZA, Ed.). INCA Editorial, Mendoza, Argentina. [ Links ]
37. QUENTIN JC. 1977. Cyclobulura lainsoni n. gen. n. sp., Nématode Subulure parasite d'un Xénarthre d'Amerique du Sud. Bulletin du Museum National d'Histoire Naturelle (Paris) 3e sér. nº 469, Zoologie 326: 771-776. [ Links ]
38. RANDOLPH, AF READ y A SKORPING. 2002. Chapter 2: Heterogeneities in macroparasite infections: patterns and processes. Pp. 6-44, en: Ecology of wildlife diseases (PJ Hudson, A Rizzoli, BT Grenfell, H Heesterbeek y AP Dobson, eds.). Oxford University Press, New York. [ Links ]
39. SUPERINA M, AA GUGLIELMONE, AJ MANGOLD, S NAVA y M LARESCHI. 2004. New distributional and host records for Amblyomma pseudoconcolor Aragão, 1908 (Acari: Ixodidae: Amblyomminae) in Argentina. Systematic and Applied Acarology 9:41-43. [ Links ]
40. SUPERINA M y MIEMBROS DEL EDENTATE SPECIALIST GROUP. 2006. Zaedyus pichiy. En: 2006 IUCN Red List of Threatened Species (IUCN, ed.). www.iucnredlist.org [ Links ]
41. SUPERINA M y P BOILY. 2007. Hibernation and daily torpor in an armadillo, the pichi (Zaedyus pichiy). Comparative Biochemistry and Physiology, Part A 148:893-898. [ Links ]
42. SUPERINA M. 2007. Natural history of the pichi (Zaedyus pichiy) in Mendoza Province, Argentina. PhD Dissertation, University of New Orleans, USA. [ Links ]
43. SUPERINA M. 2008. The ecology of the pichi Zaedyus pichiy in western Argentina. Pp. 313-318, en: The biology of the Xenarthra (SF Vizcaíno y WJ Loughry, eds.). University Press of Florida, Gainesville. [ Links ]
44. SUPERINA M, MM GARNER y RF AGUILAR. 2009. Health evaluation of free-ranging and captive pichis, Zaedyus pichiy (Mammalia, Dasypodidae) in Mendoza Province, Argentina. Journal of Wildlife Diseases 45:174-183. [ Links ]
45. SUPERINA M y R MERA Y SIERRA. 2008. Hematology and serum chemistry values in captive and wild pichis, Zaedyus pichiy (Mammalia, Dasypodidae). Journal of Wildlife Diseases 44:902-910. [ Links ]
46. TALMAGE RV y GD BUCHANAN. 1954. The armadillo. A review of its natural history, ecology, anatomy and reproductive physiology. Vol. 4. Rice Institute Pamphlet, Monographs in Biology. [ Links ]
47. TEIXEIRA M, GR ALBUQUERQUE, CWG LOPEZ y MVN FLORENTINO. 2003. An adeleid coccidia, a pseudoparasite of Didelphis aurita (Marsupialia: Didelphoidea). Revista Brasileira de Parasitologia Veterinária 12:43-45. [ Links ]
48. VIGNAU ML, LM VENTURINI, JR ROMERO, DF EIRAS y WU BASSO. 2005. Parasitología práctica y modelos de enfermedades parasitarias en los animales domésticos. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata. [ Links ]
49. WETZEL RM. 1985. Taxonomy and distribution of armadillos, Dasypodidae. Pp. 23-46, en: The Evolution and Ecology of Armadillos, Sloths and Vermilinguas (GG Montgomery, ed.). Smithsonian Institution Press, Washington, London. [ Links ]
50. WILSON K, ON BJØRNSTAD, AP DOBSON, S MERLER, G POGLAYEN, SE RANDOLPH, AF READ y A SKORPING. 2002. Chapter 2: Heterogeneities in macroparasite infections: patterns and processes. Pp. 6-44, en: Ecology of wildlife diseases (PJ Hudson, A Rizzoli, BT Grenfell, H Heesterbeek y AP Dobson, eds.). Oxford University Press, New York. [ Links ]
51. WILSON DE y DM REEDER. 2005. Mammal Species of the World. A Taxonomic and Geographic Reference (3rd ed), Johns Hopkins University Press. [ Links ]
Recibido 3 octubre 2007.
Aceptado 21 octubre 2008.
Editor asociado: A Autino














