Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.17 no.1 Mendoza Jan./June 2010
ARTÍCULOS Y NOTAS
Diferenciación morfológica en sigmodontinos (Rodentia: Cricetidae) de las Guayanas Venezolanas con relación a su locomoción y habitat
Belkis A. Rivas-Rodríguez1, Guillermo D'Elía2 y Omar Linares3
1 Museo de Ciencias, Caracas, Venezuela [Correspondencia: <belkisarivas@gmail.com>].
2 Departamento de Zoología, Universidad de Concepción, Concepción, Chile.
3 Departamento Ciencias de la Tierra, Universidad Simón Bolívar, Caracas, Venezuela.
RESUMEN: Reiteradamente se ha mencionado una presunta asociación entre morfología, tipos de locomoción y preferencia de hábitat en sigmodontinos. Sin embargo, pocos estudios han puesto a prueba este vínculo. La finalidad de este estudio fue poner a prueba dicha hipótesis mediante el estudio de sigmodontinos de la Guayana venezolana. Se analizaron ejemplares pertenecientes a 13 géneros clasificados en base a su locomoción (terrestres, trepadores-arbóreos y semiacuáticos) y hábitat (áreas boscosas y abiertas). Se tomaron diez medidas corporales y se caracterizaron estructuras externas (orejas, pata anterior y posterior, vibrisas rostrales, escamación de la cola). Un análisis de componentes principales distingue tres agrupaciones: A) géneros terrestres de áreas abiertas (Necromys, Sigmodon, Zygodontomys y Calomys); B) géneros semiacuáticos (Neusticomys, Holochilus y Nectomys); y C) géneros de áreas boscosas y Oligoryzomys. En paralelo, un análisis de agrupamiento define dos grupos mayores; uno conformado por los grupos A (excepto Calomys) y B (excepto Neusticomys) y otro por Calomys, Neusticomys y el grupo C que a su vez se separa en formas terrestres y trepadoras-arbóreas. En términos generales, los géneros que habitan un mismo hábitat son más similares morfológicamente entre sí que aquellos de otras áreas o que poseen otro tipo de locomoción. Los miembros de cada uno de los tres grupos mayores no están más emparentados filogenéticamente entre sí que con miembros de los otros grupos. Por lo tanto, al momento de inferir relaciones filogenéticas de sigmodontinos, los caracteres externos deben de ser considerados con precaución.
ABSTRACT: Morphological differentiation in sigmodontines (Rodentia: Cricetidae) of the Venezuelan Guayana in relation to their locomotion and habitat. The association among different morphotypes and locomotor types and habitat preference has been repeatedly mentioned in the sigmodontine literature; however, those associations have been seldom tested. The goal of the present study was to morphologically characterize and compare sigmodontines from Venezuelan Guayana in relation to their type of locomotion and habitat. Specimens belonging to 13 genera were classified on the basis of locomotion (terrestrial, climbing-arboreal, and semiaquatic) and habitat preference (forest and open areas). Ten body measurements were recorded and features of the ears, fore- and hindfoot, rostral vibrissae, and tail scales were scored. A principal component analysis distinguishes three groups: A) one composed of terrestrial forms from open areas (Necromys, Sigmodon, Zygodontomys, and Calomys); B) another form by semiaquatic genera (Neusticomys, Holochilus, and Nectomys); and C) the last one form by genera from forested areas plus Oligoryzomys. A cluster analysis defines two main groups: one formed by groups A (except Calomys) and B (except Neusticomys) and the other containing Calomys, Neusticomys, and the group C that in turns is subdivided into a subgroup of terrestrial forms and a subgroup of climbing-arboreal forms. Taken as a whole our results show that genera from a particular habitat are more similar to each other than to genera from other areas or those that posses a different locomotion type. Members of each of these three groups are not more closely related among them than to members of other groups. Therefore, inferring sigmodontine phylogenetic relationships from external characters should be undertaken with caution.
Palabras claves. Guayana; Modos de vida; Morfología; Roedores; Sigmodontinae; Venezuela.
Key words. Guayana; Life styles; Morphology; Rodents; Sigmodontinae; Venezuela.
INTRODUCCIÓN
La base de los estudios taxonómicos, sistemáticos y de historia natural en roedores ha estado centrada en el análisis de caracteres morfológicos. Así, muchas aproximaciones han interpretado patrones de variación morfológica en el contexto de la diversificación de linajes; repetidamente, ha sido considerado que los cambios morfológicos son producidos por procesos adaptativos (e.g., Voss, 1988; Verzi, 2002; Monteiro et al., 2003; Endo et al., 2004).
Dentro de los roedores, los Sigmodontinae constituyen la segunda subfamilia más diversa, representada por unos 84 géneros y más de 370 especies vivientes (Musser y Carleton, 2005; D'Elía et al., 2007). Ecológicamente, estos roedores también son muy diversos, presentando a lo largo de su extensa distribución geográfica una amplia gama de formas relacionadas con la dieta y la locomoción (e.g., Hershkovitz, 1960; Carleton, 1980; Voss, 1988; Weksler, 2006; Pardiñas et al., 2008). Al mismo tiempo, a la luz de análisis filogenéticos recientes (e.g., D'Elía, 2003a; Weksler, 2006), en los sigmodontinos es posible observar numerosos casos de convergencia morfológica como consecuencia de adaptaciones similares, principalmente, a la locomoción o a la dieta (e.g., el molar sigmoideo de Sigmodon y Holochilus; la sutura premaxilar-maxilar arqueada de Euneomys y Reithrodon).
Los sigmodontinos habitan una gran diversidad de ambientes, incluyendo bosques secos y húmedos, estepas, pastizales, sabanas, páramos y punas. En ellos encontramos diferentes tipos de locomoción tales como cursoriales (e.g., Akodon), cavadores (e.g., Chelemys), arbóreos (e.g., Rhipidomys) y semiacuáticos de zonas palustres (e.g., Holochilus); sin embargo, no existen formas estrictamente acuáticas ni planeadoras (D'Elía, 2003b).
Para los sigmodontinos se ha mencionado repetidamente la existencia de rasgos morfológicos que caracterizan cada tipo de locomoción y hábitat (Hershkovitz, 1969; Voss 1988; Emmons y Feer, 1990; Linares 1998). Sin embargo, hasta el presente existen pocos antecedentes donde se ponga a prueba el vínculo entre estados de carácter morfológico y diferentes modos de vida. Entre estos estudios se encuentra el realizado por Rivas y Linares (2006), en el cual se analizan los cambios de la forma de la pata posterior en relación a los modos de vida en nueve géneros de la Guayana venezolana.
En este estudio se amplía el análisis de Rivas y Linares (2006) mediante el examen de 13 géneros de sigmodontinos de la Guayana venezolana y la inclusión de caracteres de la cabeza, la cola y patas delanteras, además de aquellos previamente empleados. El objetivo de este trabajo es determinar los patrones morfológicos que exhiben los distintos géneros de sigmodontinos presentes en esta región y su relación con los tipos de locomoción y ambiente habitado.
MATERIALES Y METODOS
Se utilizaron 107 ejemplares (preservados en alcohol) pertenecientes a 13 géneros de sigmodontinos (Calomys, Euryoryzomys, Holochilus, Hylaeamys Necromys, Neacomys, Nectomys, Neusticomys, Oecomys, Oligoryzomys, Rhipidomys, Sigmodon, Zygodontomys). Debido a la escasez de individuos, las muestras de Calomys, Holochilus y Oligoryzomys se complementaron con ejemplares de otras regiones al norte de Venezuela. En el Apéndice 1 se indica la ubicación, procedencia y número de catálogo de dichos ejemplares.
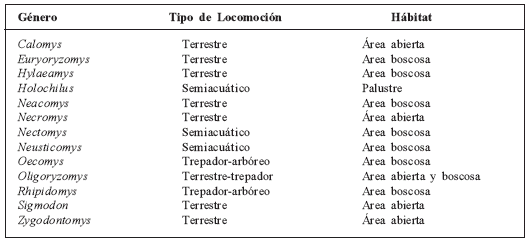
Los géneros estudiados se clasificaron de acuerdo a su forma de locomoción (Tabla 1) en: terrestres (realizan sus actividades principalmente sobre el suelo), trepadores-arbóreos (realizan sus actividades principalmente en árboles y arbustos, pero también se desplazan por el suelo) y semiacuáticos de zonas palustres (sus actividades se realizan parcialmente en cuerpos de agua). Con respecto al hábitat (lugar donde habitan), éste se dividió en dos grandes categorías: boscoso (incluyendo cualquier tipo de bosque) y abierto (incluye sabanas, herbazales y arbustales ralos). La información para clasificar a los distintos géneros se tomó de la literatura primaria y de obras de síntesis como Eisenberg (1989), Emmons y Feer (1990) y Linares (1998).
Tabla 1 Clasificación de los géneros de sigmodontinos estudiados de acuerdo al tipo de locomoción y hábitat.
A cada ejemplar se le tomaron las siguientes medidas: longitud corporal [LCC], longitud de la cola [LC], longitud de la pata posterior [LPP] y la longitud de la oreja [LO]. Además, se consideró la longitud máxima de tres (genales, superorbitales y mistaciales) de los cinco tipos de vibrisas rostrales (Fig. 1). También se midió la longitud de los dedos III y V de la pata posterior desde la base a nivel de la primera falange del dedo hasta el ápice de la garra; y la longitud de la garra del dedo III, medida realizada desde el extremo proximal del dedo hasta el ápice de la garra. Adicionalmente, se realizaron dibujos en cámara clara de la superficie palmar y plantar para registrar las diferentes formas de los cojinetes, así como la escamación de la cola.

Fig 1. Esquema de la disposición de los diferentes tipos de vibrisas que se observan en la cabeza de los mamíferos.
Debido a las diferencias de tamaño existentes entre los géneros, las comparaciones se realizaron transformado todas las variables a proporciones, relacionando cada una de ellas con respecto a la longitud corporal. Con la finalidad de observar la disposición de los diferentes géneros en el espacio conformado por las distintas proporciones corporales, se aplicó el Análisis de Componentes Principales (CP) a partir de la matriz de correlación. Utilizando los CP con mayor varianza explicada, se proyectaron todos los individuos de cada género en un plano bidimensional. Para este análisis se utilizó el programa SPSS 10 (Norusis, 1997). Adicionalmente, en base a 14 caracteres externos y discretos (ver Apéndice 2) se determinaron los patrones de similitud de los sigmodontinos mediante un UPGMA (unweighted pair-group method using arithmetic averages) usando STATISTICA v. 5.0 (Statsoft, 1997).
RESULTADOS
Descripción de los caracteres morfológicos
Orejas.-Las orejas de los sigmodontinos estudiados son, en general, de tamaño mediano y sobresalientes del pelaje, siendo fácilmente observables en todos los géneros, a excepción de Neusticomys el cual presenta orejas muy cortas y redondeadas (LO < 10% LCC). Los demás géneros presentan orejas de forma ovalada cubiertas por pelos finos, excepto Sigmodon y Holochilus, quienes presentan orejas grandes de forma redondeada, cubiertas por el pelaje corporal.
Vibrisas.-Las mistaciales o bigotes son las vibrisas más numerosas y largas; en algunos de los géneros (Euryoryzomys, Hylaeamys, Oecomys, Oligoryzomys, Neacomys y Rhipidomys) son generalmente más largas que la cabeza (LVM > 30% LCC). En Rhipidomys las vibrisas mistaciales son gruesas, en tanto que en los demás géneros son delgadas. Las vibrisas superorbitales y genales varían de dos a tres, siendo ambas mucho más delgadas y cortas que las misticiales. Estos dos tipos de vibrisas están ausentes en Neusticomys. En algunos géneros resultan ser poco visibles, llegando muchas veces a confundirse con el pelaje, como es el caso de Calomys, Sigmodon, Holochilus y Zygodontomys.
Pata Anterior (Fig. 2).-En los roedores sigmodontinos las patas anteriores se caracterizan por presentar cinco dedos con garras, de los cuales el pulgar es reducido y presenta una garra corta y redondeada. Los restantes dedos son en su mayoría largos, con garras cortas y curvas, siendo la excepción los géneros Necromys, Sigmodon y Zygodontomys, los cuales tienen dedos cortos y garras largas. Holochilus y Nectomys también presentan garras largas pero sus dedos son, asimismo, largos. En la superficie palmar se encuentran cinco cojinetes: dos carpales grandes de poca variación intergenérica y tres interdigitales de menor tamaño en la mayoría de los géneros (Fig. 2.1). En Oecomys y Rhipidomys los cojinetes interdigitales son de mayor tamaño, un poco menor que los carpales (Fig. 2.2).

Fig. 2. Esquema de la superficie palmar de la pata anterior de los roedores sigmodontinos, nótese la diferente extensión de los dedos y el tamaño de los cojinetes palmares: (1) Necromys, (2) Rhipidomys.
Pata Posterior (Fig. 3).-Estas patas presentan cinco dedos bien desarrollados, con garras comprimidas lateralmente y cubiertas dorsalmente por pelos largos. La superficie dorsal está cubierta por pelos delgados y muy cortos, mientras que la superficie plantar es desnuda. En la superficie plantar se encuentran seis cojinetes plantares, un tarsal, un metatarsal y cuatro interdigitales (Fig. 3). El tarsal, se encuentra próximo al talón, es alargado y levantado en la parte anterior en la mayoría de los géneros, resulta poco notorio en Nectomys y Holochilus en los cuales es casi plano. El metatarsal, ubicado en la zona media de la superficie plantar, es el cojinete más pequeño, siendo muy pequeño en Calomys, Holochilus, Neacomys y Nectomys, mientras que en Neusticomys, Oecomys y Rhipidomys es casi igual a los interdigitales. Los cojinetes interdigitales son cuatro y se encuentran en la región distal de la superficie plantar. En general los dos cojinetes laterales son más pequeños que los centrales. El tamaño de estos cojinetes varía entre los géneros (Fig. 3); Calomys y Nectomys presentan los cojinetes más pequeños, al contrario de lo que ocurre en Oecomys y Rhipidomys, en los cuales son grandes y levemente separados.

Fig. 3. Patrones de la superficie plantar de algunos géneros de sigmodontinos de la Guayana venezolana. 1. Calomys, 2. Necromys, 3. Sigmodon, 4. Rhipidomys, 5. Oecomys, 6. Oligoryzomys, 7. Neusticomys, este ultimo fue extraido de Voss (1988). En el recuadro interno se esquematiza la superficie plantar de la pata posterior, identificando los diferentes tipos de cojinetes plantares.
La mayoría de los géneros presentan un engrosamiento de la piel a nivel de los cojinetes interdigitales, lo cual permite un levantamiento de los mismos, siendo la excepción Calomys y Holochilus. En Oecomys y Neusticomys el levantamiento es más pronunciado, asemejándose a Rhipidomys, el cual presenta cojinetes muy desarrollados, engrosados en toda su extensión, con apariencia de verdaderas almohadillas.
Con respecto a los dedos, se puede observar que la extensión de los mismos varía desde muy cortos y anchos como es el caso de Sigmodon (Fig. 3.3) a muy largos y delgados como en Rhipidomys (Fig. 3.4). En algunos de los géneros la extensión del quinto dedo es menor a los dedos centrales, excepto en Calomys, Neacomys, Neusticomys, Oecomys, Rhipidomys y Oligoryzomys donde son casi iguales, con la diferencia que en Neusticomys, Oecomys y Rhipidomys este dedo es tan largo que sobrepasa la primera falange del cuarto dedo. Nectomys y Holochilus, además de poseer patas anchas y dedos relativamente largos, también muestran el desarrollo de una membrana interdigital delgada y corta (< 4 mm). Neusticomys no presenta membranas sino pelos muy rígidos que recuerdan un peine en el borde lateral de las patas (Fig. 3.7).
Las garras en estos sigmodontinos presentan tres tipos de variación: largas y poco curvadas, como en Necromys, Calomys, Sigmodon, Holochilus, Nectomys y Zygodontomys; cortas y curvadas, como en Euryoryzomys, Hylaeamys y Neacomys; y largas y curvadas como Oligoryzomys, Neusticomys, Oecomys y Rhipidomys.
Cola.-En estos sigmodontinos la longitud de la cola con respecto al cuerpo es variable. Necromys, Calomys, Sigmodon, Zygodontomys y Neusticomys tienen colas cortas (LC < 60% LCC); en tanto que los restantes géneros poseen colas largas a muy largas (LC > 60% LCC). La cola está cubierta de escamas epidérmicas, las cuales pueden estar dispuestas a manera de anillos, como en Rhipidomys, o dispuestas de manera imbricada como en los restantes géneros. Cada escama presenta tres pelos de tamaño variable; en extensión estos pelos cubren más de dos escamas excepto en Calomys, Euryoryzomys, Hylaeamys, Neacomys y Oligoryzomys donde sólo cubren dos o una escama. En Rhipidomys y Oecomys los pelos son mas largos a medida que se aproximan al ápice de la cola, llegando a formar un mechón en forma de pincel que puede alcanzar longitudes mayores a 6 mm, más frecuentemente en Rhipidomys que en Oecomys.
Análisis de Componentes Principales
De acuerdo a los resultados obtenidos mediante el ACP, se encontró que a partir de los tres primeros componentes la varianza explicada por las nueve medidas lineales es de 79.35%, donde el primer componente explica casi la mitad de la varianza observada (Tabla 2). La longitud de las vibrisas mistaciales y superorbitales, así como de la cola, fueron las variables que presentaron los mayores aportes a la varianza total del primer componente; para el segundo, las variables que más contribuyeron fueron las longitudes de los dedos III y V, mientras que para el tercer componente fueron las longitudes de la garra y la pata posterior. En la disposición de los 13 géneros de sigmodontinos en los dos primeros componentes principales (Fig. 4) se pueden distinguir tres agrupaciones. El primer grupo (A) está integrado por géneros terrestres de áreas abiertas (Necromys, Sigmodon, Zygodontomys y Calomys). El Grupo B está conformado por géneros semiacuáticos (Neusticomys, Holochilus y Nectomys), los que a su vez presentan importantes diferencias con respecto al primer componente. Por último, el grupo C está formado por géneros que habitan en áreas boscosas y Oligoryzomys quien aunque es un género que se encuentra en áreas abiertas, también habita forestas.
Tabla 2 Resultados del Análisis de Componentes Principales aplicado a las proporciones de los nueve caracteres externos de 107 especimenes de Sigmodontinae de la Guayana Venezolana.

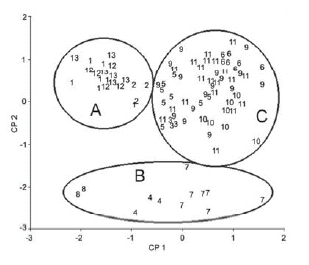
Fig. 4. Disposición de los individuos de cada género en los dos primeros componentes principales producto del análisis de 9 variables. 1. Necromys, 2. Calomys, 3. Eureoryzomys, 4. Holochilus, 5. Hylaeamys, 6. Neacomys, 7. Nectomys, 8. Neusticomys, 9. Oecomys, 10. Oligoryzomys, 11. Rhipidomys, 12. Sigmodon y 13. Zygodontomys.
Análisis de agrupamiento
La primera dicotomía del análisis de agrupamiento define dos grupos mayores de sigmodontinos (Fig. 5). En la primera agrupación se visualizan dos subgrupos: uno con géneros terrestres de áreas abiertas (Necromys, Sigmodon y Zygodontomys) excepto Calomys, que se une al grupo de géneros semiacuáticos (Nectomys y Holochilus) excepto Neusticomys. Este ultimo género se relaciona más con el segundo agrupamiento mayor donde encontramos a su vez dos subgrupos: el de géneros trepadores-arbóreos (Oecomys y Rhipidomys) y el de géneros terrestres de áreas boscosas (Euryoryzomys, Hylaemys y Neacomys) que incluye a Oligoryzomys. Aun cuando Calomys es un género categorizado como terrestre de áreas abiertas, según este análisis muestra mayor relación con el subgrupo de géneros terrestres de áreas boscosas.

Fig. 5. Resultados del análisis de agrupamiento, utilizando el método UPGMA sobre 14 caracteres externos (ver Apéndice 2) relevados en sigmodontinos de la Guayana Venezolana.
DISCUSION
Los resultados obtenidos en el presente trabajo corroboran lo encontrado por Rivas y Linares (2006) analizando un grupo menor de géneros y caracteres. Los géneros de sigmodontinos que habitan un mismo hábitat y, en menor medida, que comparten un tipo de locomoción, son más similares morfológicamente entre sí que con respecto a aquellos de otras áreas o que tienen otro tipo de locomoción. Es así que los tres grupos principales son los formados por sigmodontinos de áreas abiertas, de áreas boscosas y semiacuáticos. Es de hacer notar que dentro de los que comparten la modalidad de locomoción terrestre, los que habitan áreas boscosas se asemejan más a los trepadores-arbóreos que a los terrestres de áreas abiertas (Fig. 4). El tipo de hábitat es un mejor predictor de la morfología externa de los sigmodontinos que el tipo de locomoción. Aunque nótese que el grupo de los semiacuáticos está formado por géneros de áreas abiertas y áreas boscosas.
El grupo más disímil es el de los roedores semiacuáticos de áreas palustres. Dentro de estos, Neusticomys es marcadamente diferente de los restantes, debido principalmente a que presenta una cola corta, patas posteriores con cojinetes interdigitales grandes y ligeramente separados y con "peine" de pelos rígidos, orejas pequeñas y carencia de vibrisas supraorbitales y genales. Los otros géneros semiacuáticos estudiados (Nectomys, Holochilus) se caracterizan por presentar membranas interdigitales cortas, rasgo común con otros mamíferos que comparten este hábito (e.g., los roedores Amphynectomys savamis y Myocastor coypus, el mustélido Lontra longicaudis y el didélfido Chironectes minimus; Emmons y Feer, 1990; Linares, 1998), garras alargadas y poco curvadas y cojinetes plantares de tamaño reducido, características asimismo comunes con los sigmodontinos terrestres de áreas abiertas.
Dentro de los géneros terrestres es posible diferenciar a los que habitan áreas boscosas de aquellos que viven en áreas abiertas. La excepción a lo anterior la constituye Calomys, que habita fundamentalmente en áreas abiertas pero se agrupa con los géneros de áreas boscosas. Éstos últimos se caracterizan por presentar patas largas, dedos largos, garras cortas y curvadas, con vibrisas más largas que la cabeza y la cola igual o más larga que el cuerpo. Por otra parte, los sigmodontinos terrestres de áreas abiertas presentan patas posteriores largas, con los dedos muy cortos, garras largas y poco curvadas, colas muy cortas y las vibrisas son iguales o levemente más largas que la cabeza. En el caso de Calomys, presenta una disposición intermedia entre ambos grupos, sus patas son semejantes a los primeros, mientras que su cola y vibrisas se asemejan a las del segundo grupo. Es probable que esta condición se deba a que la especie estudiada (Calomys hummelincki) habita áreas -cardonales y sabanas muy abiertas, en suelos arenosos y pedregosos (Linares, 1998)- bastante distintas de las habitadas por los otros géneros (sabanas, pastizales y áreas arbustivas). Es de destacar que a lo largo de su amplia distribución, el género Calomys también se encuentra en áreas forestadas (e.g., bosque Atlántico Interior de Paraguay; D'Elía et al., 2008)
En relación a los géneros trepadores-arbóreos, estos presentan algunas semejanzas con los roedores terrestres de áreas boscosas, incluyendo la presencia de dedos largos, garras cortas y curvadas y una cola que sobrepasa el largo corporal. Los trepadores-arbóreos difieren de los demás géneros principalmente en que sus patas posteriores son distalmente cortas y anchas, presentan un quinto dedo muy alargado (ver también Rivas y Linares, 2006), sus cojinetes plantares y palmares son protuberantes y todas sus vibrisas son largas y abundantes. Según Hershkovitz (1960) la amplitud lateral del metatarso y alargamiento del quinto dedo son características adaptativas a un tipo de locomoción trepador-arbóreo, ya que permiten una mayor flexibilidad de la pata y una gran capacidad de aprehensión a las ramas y lianas por donde se movilizan. Similares características se encuentran en otros géneros presumiblemente arborícolas como Juliomys (Costa et al., 2007) y Rhagomys (Luna y Patterson, 2003). Es probable que el desarrollo de los cojinetes palmares y plantares en estos géneros tengan también relación con el tipo de locomoción, ya que siendo unas estructuras independientes y flexibles, pueden ser utilizados para amortiguar la caída, además de permitir una mayor aprehensión a las ramas (Hershkovitz, 1960). Otra característica que puede estar muy relacionada con el tipo de locomoción trepador-arbóreo es la presencia de largas y abundante vibrisas mistaciales. De acuerdo a Brown (1971) y Gunderson (1976), las vibrisas son estructuras con una importante función sensorial; en este sentido es probable que una de sus funciones esté relacionada con la capacidad de percepción del medio, por lo tanto sería una característica elemental para roedores que se desenvuelven en un ambiente heterogéneo, tridimensional y lleno de obstáculos.
Aun cuando Rhipidomys y Oecomys se han incluido en un mismo grupo de locomoción, en Rhipidomys las características antes mencionadas resultan ser más acentuadas que en Oecomys. Rhipidomys presenta vibrisas mistaciales más abundantes y gruesas y los cojinetes de las patas están tan desarrollados que se asemejan a almohadillas, como es el caso de las ardillas. Es probable que esta distinción se deba a que Rhipidomys sea más especialista en este tipo de locomoción que Oecomys.
Hershkovitz (1962, 1969, 1972) fue uno de los primeros en buscar intensamente relaciones entre forma y hábitos en Sigmodontinae. Este autor refiere que existen taxones especializados en vivir estrictamente en bosques o en hábitats abiertos, pero también existen otros que son generalistas o versátiles, que pueden encontrarse en diversos ambientes. Este es el caso de Oligoryzomys que a lo largo de su amplia distribución habita una gran diversidad de ambientes, incluyendo la Amazonia y la estepa patagónica. Morfológicamente, según nuestros análisis, Oligoryzomys se asemeja a los géneros de áreas boscosas, en particular con las terrestres, con quienes comparte patrones morfológicos de la pata posterior y una cola de gran extensión.
Por último es importante remarcar el hecho de que los miembros de cada uno de los tres grupos mayores (i.e., habitantes de áreas boscosas, habitantes de áreas abiertas, semiacuáticos) no están más emparentados filogenéticamente entre sí que con miembros de los otros grupos. Es así que dentro del grupo de áreas abiertas tenemos un Akodontini, un Phyllotini, un Oryzomyini y un Sigmodontini. Mientras que, por ejemplo, los orizominos también integran los restantes dos grupos principales. Este resultado, esperable, coincide con la hipótesis que la radiación de los sigmodontinos a los diferentes tipos de hábitat no ocurrió totalmente in situ, ni a partir de un único linaje invasor. Es por ello, que al momento de inferir relaciones filogenéticas, los caracteres externos deben ser considerados con precaución.
Especímenes de Sigmodontinae analizados en el presente estudio. Los mismos se encuentran depositados en las siguientes instituciones (todas en Venezuela): Museo de Historia Natural La Salle (MHNLS), Museo de la Estación Biológica Rancho Grande (EBRG), Museo de Ciencias Naturales (MCN).
Calomys hummelincki (4): Bolívar, 20 km NW Maripa, entre río Caura y Sipao, 40 m (EBRG-17267 al 17269); Guarico, Parcelamiento Peña de Mota, Altagracia de Orituco, 360 m (MHNLS-10893).
Euryoryzomys macconnelli (3): Bolívar, Los Pijiguaos, 160 KM SW Caicara del Orinoco, 700 m (MHNLS-8455); Reserva Forestal Imataca, Unidad V, Vivero, 180 m (EBRG-20099); 5.2 km NE de San. Ignacio de Yuruani, Gran Sabana, Parque Nacional Canaima, 860 m (MHNLS-8060).
Holochilus sciureus (3): Bolívar, 19 km NE Icabaru, 658 m (EBRG-16542, 16543); Monagas, 55 km SSE Maturin, Hato Mata de Bejuco, 18 m (EBRG-16544).
Hylaeamys megacephalus (8): Amazonas, río Sata, afluente del río Ventuari, 340 m (EBRG-18488); río Yatote, afluente del río Usete, 920 m (EBRG-18491); Tamatama, río Orinoco, 135 m (EBRG-12881, 16528, 16529); Bolívar, El Abismo, ca Icabaru, 500 m (MHNLS-6812); Reserva Forestal Imataca, Unidad V, cerca de El Vivero, 180 m (EBRG-20098); río Parapapoy, 430 m (EBRG-18492).
Neacomys guianae (8): Amazonas, río Orinoco, aprox. 15 km S de Ocamo (EBRG-17234); Bolívar, 5.2 km NE de San Ignacio de Yuruani, Gran Sabana, P.N. Canaima, 860 m (MHNLS-8049, 8064); Campamento El Buey, Unidad I, Reserva Forestal Imataca, 400 m, (EBRG-22345); El Vivero, Unidad V, Reserva Forestal Imataca, 180 m (EBRG- 20089); Embalse de Gurí (MCN-58); San Ignacio de Yuruani, Gran Sabana, Parque Nacional Canaima, 830 m (MHNLS-7837, 7843).
Necromys urichi (7): Amazonas, Cabecera Caño Culebra, 40 km NNW de La Esmeralda, 1400 m (EBRG-16504, 16505); Bolívar, San Ignacio de Yuruani, Gran Sabana, Parque Nacional Canaima, 860 m (MHNLS- 7823, 7835, 7884); Vía Campo Alegre, 12 km SO San Ignacio de Yuruani, Parque Nacional Canaima, 860 m (MHNLS-8056); Sucre, Cerro Negro, 10 km NW Caripe, 1600 m (EBRG-16503).
Nectomys rattus (6): Amazonas, Boca Mavaca, 84 km SSE de La Esmeralda, 138 m (EBRG-16545 al 16547); Koyowateri, río Orinoquito, Sierra Parima (MHNLS-8014); Bolívar, Salto Karuay, 19 km SW Kanavayen, Gran Sabana (MHNLS-10812); Reserva Forestal Imataca, Unidad V, cerca de vivero, 180 m (EBRG-20090).
Nectomys palmipes (2): Delta Amacuro, Cano Ibaruma, 38 km SE de Curiapo (MHNLS-10814, 10815).
Neusticomys venezuelae (2): Bolívar, Caño Icutu, río Caura, río Nichare (EBRG-16851); Serranía Los Pijiguaos, 140 km SW Caicara, 200-300 m (EBRG-11939).
Oecomys auyantepuy (2): Bolívar, Reserva Forestal Imataca, Unidad V, cerca de vivero, 180 m (EBRG-20093, 20094).
Oecomys concolor (1): Amazonas, Tamatama, río Orinoco (EBRG-12873).
Oecomys speciosus (8): Bolívar, Isla Chotacabra, Embalse Gurí, 280 m (MCN-1414); Isla Danto Machado, Embalse Gurí, 280 m (MCN-1357, 1362, 1407); Isla Iguana, Embalse Gurí (MCN-1412); Isla Perimetro, Embalse Guri-(MCN- 1410); Campamento Caurama, 10 km de Maripa (EBRG-23301, 23303).
Oecomys rex (2): Bolívar, Reserva Forestal Imataca, Unidad V, carr.Tumeremo-Bochinche, 180 m (EBRG-17456, 17457).
Oecomys sp. (1): Amazonas, Salto Yureba, Caño Yureba, Dpto. Atabapo (MHNLS-7318).
Oecomys trinitatis (3): Amazonas, Parima, Dpto. Atabapo (EBRG-11634); Bolívar, Reserva Forestal Imataca, Unidad V, cerca de vivero, 180 m (EBRG-17531); Río Cucurital, aprox. 3.5 km de la desembocadura del río Purumay, Parque Nacional Canaima, 150 m (MHNLS-11530).
Oligoryzomys fulvescens (8): Bolívar, 12 km SW San Ignacio de Yuruani, 850 m (MHNLS-7873); 700 m Paso Caruachi (MHNLS-10244); Los Pijiguaos, 140 KM SW Caicara del Orinoco, 700 m (EBRG-16460, MHNLS-8454); Río Chaveru, entre el Paují y Cantarrana, Gran Sabana, 900 m (MHNLS-7905); Sucre, Finca Vuelta Larga, 9.7 km SE de Guaraunos,10 m (MHNLS-8188, 8190); Monagas, Sector Guanipa, Reserva Forestal Guarapiche, 0 m (MHNLS-10694).
Rhipidomys leucodactylus (3): Bolívar, Serranía Los Pijiguaos, 140 km SW Caicara, 200-300 m (EBRG-11918, 11919); Isla Panorama, Embalse Guri-275 m (MCN-1409).
Rhipidomys macconnelli (8): Amazonas, Cerro Duida, cabecera del Caño Culebra, 40 km NNW de La Esmeralda (EBRG-11872, 11874); Cerro Duida, cabecera del Caño Negro, 32 km NW de La Esmeralda (EBRG-11871); Bolívar, Cabecera del Río Yuruani, 950 m (MHNLS-8970); La Arenera, sector La Escalera, km 118, Parque Nacional Canaima, 1050 m (MHNLS-10667); Salto El Danto, La Escalera, Carr. El Dorado-Sta. Elena, 1100 m (MHNLS-7679 al 7681).
Rhipidomys nitela (12): Bolívar, Afluente río Kukenan, Gran Sabana, 970 m (MHNLS-8897); Icabaru, 53 km NE Icabaru (EBRG-11811, 11812); Isla Danto Machado, Embalse Guri-275 m (MCN-1413); Isla Panorama, Embalse Guri-275 m (MCN-1411); Salto Karuay, 19 km SW Kanavayen, Gran Sabana (EBRG-21598; MHNLS-10646, 10647); San Ignacio de Yuruani, Gran Sabana, Parque Nacional Canaima, 830 m (MHNLS-7832); Serranía Los Pijiguaos, 140 km SW Caicara, 200-300 m (EBRG-11937, 11938); Uruyen, S Auyantepuy, valle Kamarata, 450 m (MHNLS-11252).
Sigmodon alstoni (8): Amazonas, 163 km ESE Puerto Ayacucho, río Manapiare, San Juan, 155 m (EBRG-16562); Bolívar, 46 km NE Icabaru, 800 m (EBRG-16469 al 16471, 16564); Salto Karuay, 19 km SW Kanavayen, Gran Sabana (MHNLS-10648, 10649, EBRG-21600).
Zygodontomys brevicauda (8): Amazonas, La Esmeralda, río Orinoco, 135 m (EBRG-16523); Bolívar, El Vivero, Unidad V, Reserva Forestal Imataca, 180 m (EBRG-20103, 21599); Isla Baya, Embalse Gurí, 270 m (MCN-1402); Isla Panorama, Embalse Gurí, 270 m (MCN-1405, 1406); Parque Loefling, Puerto Ordaz (MHNLS-6513); Quebrada Grande, Sector Culebra a 10 km de la desembocadura del Río Guaniamo, 210 m (MHNLS-10121).
Caracteres discretos extraídos de las observaciones y medidas realizadas a los ejemplares de 13 géneros de sigmodontinos de la Guayana venezolana. Los géneros están ordenados según su tipo de locomoción y hábitat (ver Tabla 1).


AGRADECIMIENTOS
Agradecemos a los Encargados y Directores de los diferentes museos venezolanos por la colaboración prestada, en especial al Museo de Historia Natural La Salle por permitir el desarrollo de este manuscrito. Finalmente, nuestro agradecimiento a los revisores que mediante sus sugerencias contribuyeron a mejorar el presente trabajo.
LITERATURA CITADA
1. BROWN JC. 1971. The description of mammals. 1. The external characters of the head. Mammal Review 1:151-168. [ Links ]
2. CARLETON M. 1980. Phylogenetic relationships in Neotomine-Peromyscine rodents (Muroidea) and a reappraisal of the dichotomy within New World Cricetinae. Miscellaneous Publications, Museum of Zoology, University of Michigan 157:1-146. [ Links ]
3. COSTA LP, SE PAVAN, YRL LEITE y V FAGUNDES. 2007. A new species of Juliomys (Mammalia: Rodentia: Cricetidae) from the Atlantic forest of southeastern Brazil. Zootaxa 1463:21-37. [ Links ]
4. D'ELÍA G. 2003a. Phylogenetics of Sigmodontinae (Rodentia, Muroidea, Cricetidae), with special reference to the akodont group, and with additional comments on historical biogeography. Cladistics 19:307-323. [ Links ]
5. D'ELÍA G. 2003b. Rats, mice, and relatives IV: Sigmodontinae. Pp. 263-279, en: Mammals V.Vol. 16 of Grzimek's Animal Life Encyclopedia (DG Kleiman, V Geist , M Hutchins y MC McDade, eds.). Thomson-Gale, Farmington Hills. [ Links ]
6. D'ELÍA G, UFJ PARDIÑAS, P TETA y JL PATTON. 2007. Definition and diagnosis of a new tribe of sigmodontine rodents (Cricetidae: Sigmodontinae), and a revised classification of the subfamily. Gayana 71:187-194. [ Links ]
7. D'ELÍA G, I MORA, P MYERS y RD OWEN. 2008. New and noteworthy records of Rodentia (Erethizontidae, Sciuridae, and Cricetidae) from Paraguay. Zootaxa 1784:39-57 [ Links ]
8. EMMONS L y F FEER. 1990. Neotropical rain forest mammals. University of Chicago Press, Chicago. [ Links ]
9. EISENBERG, JF. 1989. Mammals of the Neotropics. Vol. 1. Mammals of the northern Neotropics: Panama, Colombia, Venezuela, Guyana, Suriname, French Guiana. University of Chicago Press, Chicago. [ Links ]
10. ENDO H, J KIMURA, T OSHIDA, B STAFFORD, W RERKANMUAYCHOKE, T NISHIDA, M SASAKI, E HAYASHIDA y Y HAYASHI. 2004. Geographical and functional-morphological variations of the skull in the gray-bellied squirrel. Journal of Veterinary Medical Sciences 66:277-282. [ Links ]
11. GUNDERSON H. 1976. Mammalogy. McGraw-Hill, Inc., New York. [ Links ]
12. HERSHKOVITZ P. 1960. Mammals of northern Colombia, preliminary report Nº 8: arboreal rice rats, a systematic revision of the Subgenus Oecomys, Genus Oryzomys. Proceedings of the United States National Museum 110:513-568. [ Links ]
13. HERSHKOVITZ P. 1962. Evolution of Neotropical cricetine rodents (Muridae) with special reference to the phyllotine group. Fieldiana: Zoology 46:1-524. [ Links ]
14. HERSHKOVITZ P. 1969. The evolution of mammals on South Continents: VI. The recent mammals of the Neotropical region: A zoogeographic and ecological review. Quarterly Review of Biology 44:1-70. [ Links ]
15. HERSHKOVITZ P. 1972. The recent mammals of the Neotropical region: a zoogeographic and ecological review. Pp. 311-431, en: Evolution, mammals and southern continents (A Keast, FC Erk y B Glass, eds.). State University of New York Press, Albany. [ Links ]
16. LINARES OJ. 1998. Mamíferos de Venezuela. Sociedad Conservacionista Audubon de Venezuela (c), Caracas. [ Links ]
17. LUNA L y BD PATTERSON. 2003. A remarkable new mouse (Muridae: Sigmodontinae) from southeastern Peru with comments on the affinities of Rhagomys rufescens (Thomas, 1886). Fieldiana: Zoology 101:1-24. [ Links ]
18. MONTEIRO L, L DUARTE y S DOS REIS. 2003. Environmental correlates of geographical variation in skull and mandible shape of the punaré rat Thrichomys apereoides (Rodentia: Echimyidae). Journal Zoology, London 261:47-57. [ Links ]
19. MUSSER GM y MD CARLETON. 2005. Superfamily Muroidea. Pp. 894-1531, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.) Third ed. Johns Hopkins University Press, Baltimore. [ Links ]
20. NORUSIS MJ. 1997. SPSS professional statistics 7.5. SPSS Inc., Chicago. [ Links ]
21. PARDIÑAS UFJ, G D'ELÍA y P TETA. 2008. Una introducción a los mayores sigmodontinos vivientes: revisión de Kunsia Hershkovitz, 1966 y descripción de un nuevo género (Rodentia: Cricetidae). Arquivos do Museu Nacional, Rio de Janeiro 66:509-594. [ Links ]
22. RIVAS BA y OJ LINARES. 2006. Cambios en la forma de la pata posterior entre roedores sigmodontinos según su locomoción y hábitat. Mastozoología Neotropical 13:205-215. [ Links ]
23. STATSOFT, INC. 1997. STATISTICA for windows. Computer program manual, Tulsa. [ Links ]
24. VERZI D. 2002. Patrones de evolución morfológica en Ctenomyinae (Rodentia, Octodontidae). Mastozoología Neotropical 9:309-328. [ Links ]
25. VOSS R. 1988. Systematics and ecology of ichthyomyine rodents (Muroidea): patterns of morphological evolution in a small adaptive radiation. Bulletin of the American Museum of Natural History 188:259-493. [ Links ]
26. WEKSLER M. 2006. Phylogenetic relationships of oryzomine rodents (Muroidea: Sigmodontinae): separate and combined analyses of morphological and molecular data. Bulletin of the American Museum of Natural History 296:1-149. [ Links ]
Recibido 11 abril 2008.
Aceptado 15 diciembre 2009.
Editor asociado: R Barquez














