Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.17 no.1 Mendoza Jan./June 2010
ARTÍCULOS Y NOTAS
Hábitos alimenticios de Heteromys Australis (Rodentia: Heteromyidae) en el norte de la cordillera central de Colombia
Camilo Sánchez-Giraldo y Juan F. Díaz-N
Grupo de Mastozoología - CTUA, Instituto de Biología, Facultad de Ciencias Exactas y Naturales, Universidad de Antioquia, Apartado Aéreo 1226, Medellín, Colombia [Correspondencia: Camilo Sánchez-Giraldo <csg8213@gmail.com>].
RESUMEN: Proporcionamos los primeros registros de plantas (frutos, semillas) consumidas por Heteromys australis en un bosque premontano, norte de la Cordillera Central, Colombia. El 23.26% de los roedores capturados presentaron restos cuantificables en sus abazones. Encontramos restos de Wettinia kalbreyeri, W. fascicularis (Palmae), Pouteria sp. (Sapotaceae), Nectandra lineatifolia (Lauraceae), Chusquea sp. (Poacea) y una especie no identificada de la familia Sapotaceae. Las semillas de palmas representaron 51.51% del peso relativo de los restos, siendo probablemente un recurso disponible durante varios meses del año y uno de los más importantes en la dieta de este roedor.
ABSTRACT: Dietary habits of Heteromys australis (Rodentia: Heteromyidae) in the north of central Andes of Colombia. We present the first records of plants (fruits and seeds) consumed by the Southern Spiny Pocket Mouse, Heteromys australis in a Premontane Wet Forest, at north of the Central Andes of Colombia. Quantifiable remains were found in cheek pouches of 23.26% of all captured individuals. We recovered vegetal remains of Wettinia kalbreyeri, W. fascicularis (Palmae), Pouteria sp. (Sapotaceae), Nectandra lineatifolia (Lauraceae), Chusquea sp. (Poacea), and an unidentified species of Sapotaceae. Palm seeds represented 51.51% of the relative weight of remains; thus this could be an available resource during several months of the year and one of the most important for the diet of this rodent.
Palabras Clave. Abazones; Colombia; Dieta; Ratón Espinoso.
Key Words. Cheek pouches; Colombia; Diet; Spiny Mouse.
Heteromys y Liomys, heterómidos tropicales, al igual que los demás miembros de la familia Heteromyidae, son principalmente roedores granívoros, recolectores y consumidores de frutos y semillas, que pueden incluir ocasionalmente en sus dietas material vegetal adicional y artrópodos cuando éstos se encuentran disponibles (Janzen, 1982; Sánchez-Cordero y Fleming, 1993). A pesar de que existe una generalización de sus dietas, éstas han sido pobremente documentadas en comparación con otros géneros de heterómidos (e.g. asociados a desiertos) y para algunas de las especies la información continúa siendo incompleta o nula (Reichman y Price, 1993).
Entre las nueve especies incluidas dentro del género Heteromys (Anderson y Jarrín-V, 2002; Anderson, 2003; Anderson et al., 2006; Anderson y Timm, 2006), distribuidas a lo largo de los bosques húmedos y los bosques nublados de Centroamérica y el noroccidente de América del Sur (Anderson et al., 2006), sólo para dos existe información específica sobre los componentes de sus dietas. El consumo de semillas y frutos pertenecientes a 21 especies de plantas ha sido documentado para H. desmarestianus en poblaciones de América Central (Fleming, 1974; Martínez-Gallardo y Sánchez-Cordero, 1993); registros del uso de invertebrados (moluscos) son exclusivos para H. gaumeri en la Península de Yucatán en México (Hernández-Betancourt et al., 2005).
Para otras especies y subespecies de H. desmarestianus los registros disponibles proceden de comentarios anecdóticos sobre el almacenamiento de algunos restos en sus abazones. Semillas, frutos, material vegetal, coleópteros, caracoles, hongos y pequeños vertebrados (restos óseos de aves y reptiles) son registrados para poblaciones de H. d. crassirostris en Panamá (notas de campo de Charles Handley en Anderson, 1999). Restos de cangrejos y semillas pequeñas han sido encontrados en H. anomalus en Venezuela (Rood y Test, 1968) y en la isla de Trinidad (Allen y Chapman, 1893), e insectos y semillas fueron reportados para H. teleus en Ecuador (notas de campo de G.H.H. Tate en Anderson y Jarrín-V, 2002). No existen registros documentados sobre las especies de plantas o animales utilizadas por las demás especies del género.
El ratón espinoso de abazones, H. australis Thomas, 1901, es una especie terrestre que restringe su distribución al noroccidente de América del Sur en los bosques húmedos de la costa pacífica del noroccidente de Ecuador, occidente de Colombia y oriente de Panamá (Anderson, 1999). Se extiende a través de las laderas de los Andes Colombianos hasta los 2500 m de altura (Anderson, 1999), con una población disyunta en la Cordillera de Mérida al occidente de Venezuela (Anderson y Soriano, 1999). Considerado granívoro, la dieta de la especie es desconocida. En este trabajo documentamos el primer registro de las especies de plantas que forman parte de la dieta de este roedor en el norte de la Cordillera Central de Colombia.
Este estudio fue llevado a cabo en el área de bosque conocida como Monte Caracolí, ubicado en la Finca Costa Rica, vereda Guayabito, municipio de Amalfí, Departamento de Antioquia en el extremo norte de la Cordillera Central de los Andes de Colombia (6º 52' 25.0" N, 75º 05' 56.7" W, 1844 m snm). El área corresponde a la zona de vida transicional entre bosque muy húmedo y bosque pluvial premontano (bmh/bp-PM sensu Holdrige, 1967). Presenta una elevada humedad relativa (77-95 %), una precipitación anual promedio de 4000 mm y un régimen bimodal de lluvias, con una estación seca de diciembre a febrero y una de lluvias de septiembre a noviembre (Espinal, 1992). En general, está conformada por fragmentos de bosques secundario de diferentes tamaños, con un dosel que oscila entre 7 y 20 m y algunas áreas abiertas destinadas para la ganadería (Cuervo et al., 2001).
Durante el desarrollo de un inventario de mamíferos no voladores, entre enero de 2004 y julio de 2005, realizamos cinco muestreos correspondientes a 33 noches efectivas y a un esfuerzo total de 2449 trampas. Para la captura de los individuos utilizamos trampas tipo Sherman y trampas de golpe que fueron ubicadas aleatoriamente en líneas a lo largo del suelo del bosque, principalmente a los lados de diferentes cursos de agua. Cada uno de los roedores capturados fue medido, determinado su sexo y sus abazones revisados. Los contenidos encontrados en los abazones y dentro de las trampas fueron separados en semillas, frutos y otros restos vegetales, colectados e identificados hasta el nivel taxonómico más específico posible, lo cual dependió del tipo y calidad del material. Para cada resto fue registrado el peso seco (en gramos) y, solamente para semillas y frutos, el diámetro y la longitud máxima (en milímetros). La identificación de este material fue realizada con base en literatura especializada (e.g. Rios et al., 2004) y material de referencia colectado previamente en la zona y depositado en el Herbario de la Universidad de Antioquia, Medellín (HUA).
Los restos encontrados y los especímenes colectados (todos los individuos fueron liberados excepto aquellos capturados en trampas de golpe) fueron depositados en la Colección Teriológica de la Universidad de Antioquia, Medellín-Colombia (CTUA 03, 010, 012, 061).
Capturamos 43 individuos de la especie H. australis, 10 de ellos (el 23.26%) con restos en sus abazones. En un total de 28 restos (16.83 g) registramos cinco especies de plantas cuyos frutos, semillas u otras partes son usadas por este roedor: semillas y frutos de Nectandra lineatifolia (Lauraceae), semillas de Wettinia kalbreyeri, fragmentos de semillas de Wettinia fascicularis (Palmae), semillas y fragmentos de Pouteria sp. (Sapotaceae), una especie de la familia Sapotaceae que no pudo ser identificada, y hojas de Chusquea sp. (Poacea) (Tabla 1). Adicionalmente, encontramos varios fragmentos de semillas que no pudieron ser asignados a ninguna categoría taxonómica. Los restos de la especie de sapotácea no identificada y de N. lineatifolia fueron los encontrados con mayor frecuencia, 25.00% cada una (Tabla 1). En términos de peso relativo, los restos de W. kalbreyeri y N. lineatifolia fueron los principales ítems utilizados por H. australis, con 25.20% y 37.86% respectivamente. Las semillas de palma representaron en conjunto más de la mitad del peso relativo del total de los restos registrados (51.51%), mientras las hojas de Chusquea sp. solo alcanzaron el 0.06 % (Tabla 1).
Tabla 1 Especies de plantas cuyos restos fueron identificados en los abazones de Heteromys australis en el norte de la Cordillera Central, Colombia.
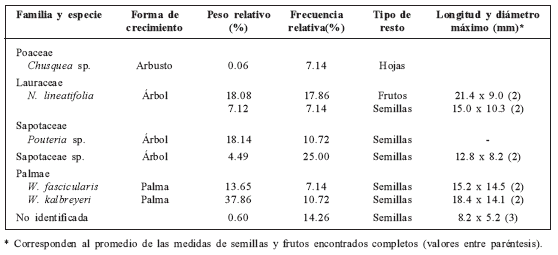
Las semillas y frutos de Pouteria sp. y N. lineatifolia fueron encontradas en abazones únicamente durante la época seca (febrero de 2004 y 2005), las semillas de W. kalbreyeri sólo en la época de mayor precipitación (octubre de 2004) y W. fascicularis en la de transición (abril y mayo de 2004). Registros personales y observaciones de otros investigadores en la zona evidenciaron la presencia de abundantes frutos caídos de ambas especies de palmas en los meses de abril y junio de 2004, julio y agosto de 2005 y febrero de 2006 (C. Zapata, C.A. Delgado-V y D. Marín comentarios personales). El uso de semillas de palmas ha sido registrado previamente en heterómidos tropicales y sugerido en algunos casos como parte fundamental de sus dietas (e.g. Fleming, 1974). Seis especies de palmas de los géneros Astrocaryum, Chamaedora, Bactris, Corozo y Scheelea son consumidas por Heteromys y Liomys en América Central (Fleming, 1974; Martínez-Gallardo y Sánchez-Cordero, 1993; Sánchez-Cordero y Fleming, 1993). El consumo de semillas del género Wettinia es nuevo para heterómidos, y aunque desconocemos su fenología en el área de estudio, es probable que las dos especies registradas de este género de palmas sean un recurso disponible la mayor parte del año y uno de los más importantes en la dieta de H. australis en el norte de la Cordillera Central.
Las cinco especies de plantas identificadas en los abazones de H. australis no fueron registradas en las dietas de otros miembros del género Heteromys, sin embargo las cuatro familias y dos de los géneros, Nectandra y Pouteria, son consumidas por otras especies de heterómidos tropicales. N. ambigens (Lauraceae) y P. sapota (Sapotaceae) se encuentran dentro las 21 especies (12 familias) consumidas por H. desmarestianus (Martínez- Gallardo y Sánchez-Cordero, 1993; Brewer y Rejmanek, 1999). Por su parte, entre las 40 especies (16 familias) utilizadas por Liomys, las familias Palmae y Poaceae (esta última representada por Lasiacis divaricada) son comunes en la dieta de Liomys y H. australis (Sánchez-Cordero y Fleming, 1993).
El transporte y consumo de material vegetativo (restos de flores, tallos y hojas) es ocasional en las especies de heterómidos; esto hace probable que la reducida proporción de hojas de Chusquea sp. registrada esté asociada a otro uso o a la recolección de un ítem particular más que a su consumo directo. En algunas poblaciones de heterómidos tropicales este tipo de restos ha sido considerado como material que probablemente sea utilizado en la construcción del nido y no en consumo (notas de campo de Charles Handley en Anderson, 1999). En aquellos heterómidos asociados a desiertos, la presencia en individuos jóvenes de material no apto para consumo (rocas, astillas o heces) puede ser a menudo el resultado de errores durante el forrajeo y la recolección (Reichman, 1975).
Las formas de crecimiento de las especies de plantas encontradas (Tabla 1) confirman que H. australis, como es sugerido para la mayoría de heterómidos, colecta semillas y frutos de la superficie del suelo y no directamente de las plantas como ha sido reportado en algunas especies de heterómidos desertícolas (e.g. Dipodomys) (Reichman y Price, 1993). Nuestros datos también indican que los miembros de la especie pueden transportar en sus abazones restos de semillas y frutos de entre 7.8 a 21.4 mm de longitud y 4.9 a 14.9 mm de diámetro (Tabla 1), alcanzando una carga máxima aproximada de 5.83 cm3 (3.42 y 2.41 cm3 por abazón) y una masa total de 4.2 g, que representó el 8.2% del peso del roedor que las transportaba (CTUA-061). Los frutos y semillas consumidos por H. australis se encuentran dentro del rango de tamaño de aquellos que son utilizados o removidos de la superficie del suelo por otras especies de heterómidos tropicales (10-70 mm) (Martínez-Gallardo y Sánchez-Cordero, 1993; Brewer y Rejmanek, 1999).
Las semillas y frutos removidos por heterómidos pueden ser transportados hasta sus nidos o enterrados en la superficie del suelo para ser almacenados, comportamiento que es común a todos los miembros de la familia y aparentemente variable entre especies (Fleming y Brown, 1975; Reichman y Price, 1993). Aunque los heterómidos tropicales son fundamentalmente consumidores de los ítems que remueven (Sánchez-Cordero y Fleming, 1993), incluso depredadores de semillas post-dispersas (Janzen, 1982), investigaciones recientes sugieren que podrían actuar como dispersores secundarios de algunas especies de plantas debido al entierro de semillas y frutos (scatterhoarding). Experimentos controlados de remoción de Astrocarium mexicanum (Palmae) y Ampelocera hottlei (Ulmaceae) han demostrado que una porción de las semillas removidas por H. desmarestianus pueden ser enterradas bajo el suelo (entre 6 y 18%) a una distancia del árbol parental de entre 3 y 14 m, y una pequeña fracción de éstas olvidadas incluso hasta alcanzar a germinar (Brewer y Rejmanek, 1999; Brewer, 2001). A pesar de que la corta distancia probablemente no aísla las semillas de la influencia del árbol parental, el hecho de ser enterradas puede disminuir la posibilidad de que sean consumidas por otros depredadores (Sánchez-Cordero y Martínez-Gallardo, 1998; Brewer, 2001).
Nuestros datos no permiten establecer ni cuantificar el papel de H. australis como dispersor secundario, y las señales de consumo sobre varias de las semillas encontradas indican que es depredador de éstas. Sin embargo, es posible que al igual que H. desmarestianus, pueda enterrar y olvidar parte de las semillas y frutos que remueve y tener un papel en la dispersión secundaria de las mismas. Asimismo, nuestras observaciones en campo indican que H. australis puede transportar las semillas de ambas especies de Wettinia lejos del árbol parental (en cuya base fueron observados gran cantidad de semillas y frutos caídos durante la fase de campo). Las capturas de individuos con restos en sus abazones siempre se presentaron en trampas alejadas de los adultos de las especies vegetales a las cuales correspondían, entre 5 y 10 m aproximadamente.
Especies de heterómidos tropicales son consideradas entre los agentes de remoción y depredación de semillas y frutos más importantes en los bosques secos de Centroamérica, y responsables de la remoción casi exclusiva de las semillas y frutos de algunas especies de plantas (Sánchez-Cordero y Fleming, 1993; Sánchez-Cordero y Martínez-Gallardo, 1998; Brewer y Rejmanek, 1999; Brewer, 2001; Briones-Salas et al., 2006). La remoción y selección por heterómidos tropicales es un proceso probablemente complejo, influenciado por el tipo de hábitat y las características de las semillas y frutos removidos (tamaño, contenido energético, presencia de toxinas y disponibilidad), que podría tener consecuencias en las comunidades vegetales de los sitios que habitan (Martínez-Gallardo y Sánchez-Cordero, 1993; Sánchez-Cordero y Martínez-Gallardo, 1998; Briones y Sánchez-Cordero, 1999). H. australis es la única especie de heterómido presente en la zona de estudio y en los bosques premontanos del centro y norte de la Cordillera Central. Evaluar su impacto en la remoción de semillas y frutos, los efectos de la características de frutos, semillas y el tipo hábitat en la selección y remoción, y su posible papel como dispersor secundario son futuras líneas de investigación que podrían permitir comprender la influencia de este roedor en la composición y abundancia de las comunidades vegetales a lo largo de su distribución.
Asimismo, análisis de contenidos de abazones y de los nidos deben ser llevados a cabo para proveer información adicional y detallada sobre el uso de otras especies vegetales, insectos, otros invertebrados o pequeños vertebrados y su importancia en la dieta de la especie. Finalmente, aunque la proporción de individuos con restos en sus abazones fue baja en esta investigación (solo 23% de los individuos), podríamos sugerir que respecto a otras metodologías utilizadas en el estudio de hábitos alimenticios (e.g. análisis de contenidos estomacales y heces), el análisis del contenido de los abazones en las especies del género permite la recuperación de restos menos fraccionados que pueden ser identificados con mayor facilidad y de manera muy sencilla.
AGRADECIMIENTOS
Este estudio fue realizado con el soporte financiero de la Organización para Estudios Tropicales (OET) y el Youth Activity Fund, The Explorers Club, NY. Agradecemos al biólogo Carlos A. Delgado por los comentarios al manuscrito y proporcionar desinteresadamente algunos de los registros; al biólogo Álvaro Idarraga (HUA) por su valiosa ayuda en la identificación de los restos; y a la familia Pérez Monrroy de la finca Costa Rica en el municipio de Amalfi por su colaboración durante las sesiones de campo.
LITERATURA CITADA
1. ALLEN JA y FM CHAPMAN. 1893. On a collection of mammals from the island of Trinidad, with descriptions of new species. Bulletin of the American Museum of Natural History 5:203-234. [ Links ]
2. ANDERSON RP. 1999. Preliminary review of systematic and biogeography of the spiny pocket mice (Heteromys) of Colombia. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales 23 (suplemento especial):613-630. [ Links ]
3. ANDERSON RP. 2003. Taxonomy, distribution, and natural history of the genus Heteromys (Rodentia: Heteromyidae) in Western Venezuela, with the description of a dwarf species from the Península de Paraguana. American Museum Novitates 3396:1-43. [ Links ]
4. ANDERSON RP y PJ SORIANO. 1999. The occurrence and biogeographic significance of the southern spiny pocket mouse Heteromys australis in Venezuela. International Journal of Mammalian Biology 64:121-125. [ Links ]
5. ANDERSON RP y P JARRÍN-V. 2002. A new species of spiny pocket mouse (Heteromyidae: Heteromys) endemic to western Ecuador. American Museum Novitates 3382:1-26. [ Links ]
6. ANDERSON RP y RM TIMM. 2006. A new montane species of spiny pocket mouse (Rodentia: Heteromyidae: Heteromys) from northwestern Costa Rica. American Museum Novitates 3509:1-38. [ Links ]
7. ANDERSON RP, M WEKSLER y DS ROGERS. 2006. Phylogenetic analyses of spiny pocket mice (Heteromyidae: Heteromyinae) based on allozymic and morphological data. Journal of Mammalogy 87:1218-1233. [ Links ]
8. BREWER SW. 2001. Predation and dispersal of large and small seeds of a tropical palm. Oikos 92:245-255. [ Links ]
9. BREWER SW y M REJMANEK. 1999. Small rodent as significant dispersers of tree seeds in a Neotropical forest. Journal of Vegetation Science 10:165-174. [ Links ]
10. BRIONES M y V SÁNCHEZ-CORDERO. 1999. Dietary value of fruits and seeds to spiny pocket mice (Liomys pictus) in a tropical deciduous forest in Mexico. Studies on Neotropical Fauna and Environment 34:65-71. [ Links ]
11. BRIONES-SALAS M, V SÁNCHEZ-CORDERO y G SÁNCHEZ-ROJAS. 2006. Multi-species fruit and seed removal in a tropical deciduous forest in Mexico. Canadian Journal of Botany 84:433-442. [ Links ]
12. CUERVO AM, PGW SALAMAN, TM DONEGAN y JM OCHOA. 2001. A New Species of Piha (Cotingidae: Lipaugus) from the Cordillera Central of Colombia. Ibis 143:353-368. [ Links ]
13. ESPINAL LS. 1992. Geografía Ecológica de Antioquia. Zonas de Vida. Medellín: Universidad Nacional de Colombia. Ed Lealon. FLEMING TH. 1974. The population ecology of two species of Costa Rican heteromyid rodents. Ecology 55:493-510. [ Links ]
14. FLEMING TH y GJ BROWN. 1975. An experimental analysis of seed hoarding and burrowing behavior in two species of Costa Rican heteromyid rodents. Journal of Mammalogy 56:301-316. [ Links ]
15. HERNÁNDEZ-BETANCOURT SF, J GÓMEZ GONZÁLEZ, JA CIMÉ POOL, S MEDINA PERALTA y CM EUÁN CANUL. 2005. First report of use of land snails for Heteromys gaumeri (Rodentia: Heteromyidae) in a subdeciduos forest in Yucatán, México. Acta Zoológica Mexicana (n.s.) 21(2):155-156. [ Links ]
16. HOLDRIDGE LR. 1967. Life zone ecology. Tropical Science Center. San José, Costa Rica. [ Links ]
17. JANZEN DH. 1982. Seed removal from fallen guanacaste fruits (Enterolobium cyclocarpum) by spiny pocket mice (Liomys salvini). Brenesia 19/20:425-429. [ Links ]
18. MARTÍNEZ-GALLARDO R y V SÁNCHEZCORDERO. 1993. Dietary value of fruits and seed to spiny pocket mice, Heteromys desmarestianus (Heteromyidae). Journal of Mammalogy 74:436-442 [ Links ]
19. REICHMAN OJ. 1975. Relationships of desert rodent diets to available resources. Journal of Mammalogy 56:731-751. [ Links ]
20. REICHMAN OJ y MV PRICE. 1993. Ecological aspects of heteromyid foraging. Pp. 539-574, en: Biology of the Heteromyidae (HH Genoways y JH Brown, eds.). Special Publication No. 10, The American Society of Mammalogist. [ Links ]
21. RIOS M, P GIRALDO y D CORREA. 2004. Guía de frutos y semillas de la cuenca media del río Otún. Fundación EcoAndina, WCS (Wildlife Conservation Society)-Colombia. [ Links ]
22. ROOD JP y FH TEST. 1968. Ecology of the spiny rat, Heteromys anomalus, at Rancho Grande, Venezuela. The American Midland Naturalist 79:89-102. [ Links ]
23. SÁNCHEZ-CORDERO V y TH FLEMING. 1993. Ecology of tropical heteromyids. Pp. 596-617, en: Biology of the Heteromyidae (HH Genoways y JH Brown, eds.). Special Publication No. 10, The American Society of Mammalogist. [ Links ]
24. SÁNCHEZ-CORDERO V y R MARTÍNEZGALLARDO. 1998. Postdispersal fruit and seed removal by forest-dewelling rodents in a lowland rainforest in Mexico. Journal of Tropical Ecology 14:139.151. [ Links ]
Recibido 15 diciembre 2007.
Aceptado 5 septiembre 2009.
Editor asociado: M Díaz














