Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.17 no.2 Mendoza dic. 2010
ARTÍCULOS
Efeito do gradiente floresta-cerrado-campo sobre a comunidade de pequenos mamíferos do alto do maciço do urucum, oeste do Brasil
Mauricio N. Godoi1, Nicolay L. da Cunha1 e Nilton C. Cáceres2
1 Programa de Pós-Graduação em Ecologia e Conservação, Universidade Federal do Mato Grosso do Sul (UFMS), Campo Grande, Mato Grosso do Sul, Brasil. <mauricioecologia@hotmail.com>.
2 Universidade Federal do Mato Grosso do Sul, Aquidauana, Mato Grosso do Sul, 79200-000, Brasil. Endereço atual: Laboratorio de Ecologia e Biogeografia, Departamento de Biologia, Universidade Federal de Santa Maria, Bairro Camobi, Santa Maria, Rio Grande do Sul, 97.110-970, Brasil. [Correspondência: <niltoncaceres@gmail.com>].
Recibido 9 junio 2009.
Aceptado 12 abril 2010.
Editor asociado: UFJ Pardiñas
RESUMO: O Maciço do Urucum é uma região montanhosa localizada na borda oeste do Pantanal, sendo caracterizado pelo contato entre ambientes florestais, savânicos e campestres. Acreditase que em paisagens como as do Maciço do Urucum, a estrutura da comunidade de pequenos mamíferos seja fortemente influenciada pela diversidade de habitats. Neste estudo procuramos determinar a influência do gradiente floresta-cerrado-campo sobre a estrutura da comunidade de pequenos mamíferos não-voadores no Maciço do Urucum, oeste do Brasil. Para amostrar as espécies de pequenos mamíferos foram utilizadas armadilhas de interceptação e queda, instaladas em manchas de floresta semidecídua, cerrado stricto sensu e em campos de altitude. No total, foram amostradas 10 espécies de pequenos mamíferos não-voadores, nove em florestas semidecíduas, quatro em cerrado stricto sensu e cinco nos campos de altitude. Entretanto, não houve diferença significativa entre os habitats amostrados quanto à abundância, riqueza e diversidade de espécies. As florestas semidecíduas apresentaram quatro espécies que foram exclusivas deste ambiente, enquanto os campos de altitude apresentaram apenas uma espécie exclusiva. Não houve forte influência do gradiente floresta-cerrado-campo sobre a estrutura da comunidade local de pequenos mamíferos, uma vez que nove espécies (90%) ocorreram em florestas semidecíduas. Uma razão para isto é o provável efeito de borda sobre os habitats florestais com relação às espécies de habitats abertos. Finalmente, as espécies registradas neste estudo foram divididas em dois grupos: as generalistas, registradas simultaneamente em florestas e áreas abertas, e as aparentemente especialistas, que só foram amostradas em florestas semidecíduas e nos campos.
ABSTRACT: Effect of the forest-savanna-grassland gradient on the small mammals of the high Urucum Mountains, west of Brazil. The Urucum Mountains comprehend a hilly region in western Brazil which lies in the western edge of the Pantanal wetlands, being characterized by the contact among forests, savannas and grasslands. It is usually known that the community structure of small mammals is strongly influenced by the habitat diversity. Based on this, we determined the influence of the forest-savanna-grassland gradient in the structure of the small mammal community in the Urucum Mountains. For sampling small mammal species, pitfall traps were installed within semideciduous forests, savannas and grasslands. In total, 10 species were recorded, nine in semideciduous forest, four in savanna and five in grassland. However, there is no significant difference between habitats in relation to abundance, richness and species diversity. Four species were recorded exclusively in the semideciduous forest, and only one was exclusively recorded in the grassland. There was no strong influence of the forest-savanna-grassland gradient on the structure of local small mammal community, since nine species (90%) occurred in semideciduous forest. A reason for this was a probable edge effect on forested habitats with regard to open habitat species. Finally, species recorded in this study were divided in two groups: the generalist species recorded simultaneously in forest and open habitats, and the apparently specialist species recorded only within forests or grasslands.
Palavras chave. Armadilhas de interceptação e queda; Composição de espécies; Marsupiais; Roedores; Uso de habitats.
Key words. Marsupials; Pitfall traps; Rodents; Species composition; Use of habitats.
INTRODUÇÃO
No Brasil, o grupo dos pequeños mamíferos não-voadores é representado por marsupiais didelfídeos e por pequeños roedores das familias Cricetidae e Echimyidae, que juntos formam o grupo ecológico mais diversificado e compreendem a maior parte da riqueza de mamíferos brasileiros (Reis et al., 2006). Atualmente, são reconhecidas cerca de 240 especies de pequeños mamíferos não-voadores no Brasil, representadas por 55 espécies de marsupiais e cerca de 185 espécies de pequeños roedores (Reis et al., 2006; Bonvicino et al., 2008; Voss e Jansa, 2009). Entretanto, acreditase que estes números devam ser aínda maiores em fungão de recentes revisões taxonómicas (Musser et al., 1998; Patterson, 2001; Weksler e Bonvicino, 2005; Weksler et al., 2006) e especialmente pelas descrigóes de novas espécies (Hershkovitz, 1990a,b; Bonvicino e Weksler, 1998; Bonvicino e Almeida, 2000; Langguth e Bonvicino, 2002; Bonvicino, 2003; Voss et al., 2005).
Apesar de muitos estudos caracterizarem as comunidades de pequeños mamíferos não-voadores em diferentes ecossistemas brasileiros, especialmente no Cerrado (Lacher e Alho, 2001; Lyra-Jorge et al., 2001; Bonvicino et al., 2005; Carmignotto, 2005) e na Mata Atlántica (Bergallo, 1994; Passamani et al., 2000; Geise et al., 2004; Pardini e Umetsu, 2006), ainda existem grandes lacunas de conhecimento sobre a distribuição geográfica das espécies em diferentes regiões do Brasil, como no Pantanal (Costa et al., 2005; Vieira e Palma, 2005). Ainda, pouco se conhece acerca da distribuição espacial das espécies de pequenos mamíferos não-voadores em regiões de contato entre ambientes florestais e áreas abertas (Mares et al., 1986; Bonvicino et al., 1996; Carmignotto, 2005).
Acreditase que em paisagens caracterizadas pelo contato de ambientes florestais com ambientes abertos, a composição e estrutura das comunidades de pequenos mamíferos sejam especialmente influenciadas pela diversidade de ambientes (Myers, 1982; Lacher et al., 1989; Bonvicino et al., 1996; Yánez et al., 1999; Lacher e Alho, 2001; Lyra-Jorge et al., 2001; Rodrigues et al., 2002; Carmignotto, 2005; Yahnke, 2006; Cáceres et al., 2007a) associada à grande especificidade das espécies de pequenos mamíferos no uso dos ambientes disponíveis (Mares et al., 1986; Lacher e Alho, 2001).
Os estudos que determinaram a variação na composição das comunidades de pequenos mamíferos em áreas de contato entre ambientes florestais e ambientes savânicos ou campestres revelaram grupos distintos de espécies, formados por aqueles que ocorrem em florestas e pelos que ocorrem em áreas abertas (Mares et al., 1986; Lacher e Alho, 2001; Lyra-Jorge et al., 2001). Assim, em uma determinada paisagem, as espécies de pequenos mamíferos parecem se distribuir de acordo com a presença e distribuição das diferentes fitofisionomias locais.
Outro fator apontado para explicar a variação na composição e riqueza de espécies em áreas de contato entre ambientes abertos e florestais é a complexidade ambiental (estratificação vertical) das fisionomias vegetais, sendo que fisionomias mais complexas apresentariam maior diversidade e disponibilidade de nichos e recursos, permitindo a coexistência de um número maior de espécies (August, 1983). Assim, ambientes mais complexos como as florestas apresentariam maior diversidade e desenvolvimento dos estratos verticais, especialmente dos estratos arbustivo e arbóreo, e desta forma poderiam conter uma riqueza maior de espécies de pequenos mamíferos, quando comparados a ambientes abertos que possuem menor diversidade e desenvolvimento dos estratos verticais (Pardini et al., 2005; Hannibal e Cáceres, no prelo).
No Brasil, os principais estudos apontando diferenças na estrutura de comunidades de pequenos mamíferos entre áreas de vegetação aberta e florestas foram realizados no Cerrado, onde as formações abertas são comumente mais abundantes e os ambientes florestais estão representados especialmente por matas ciliares e de galeria (Fonseca e Redford, 1984; Mares et al., 1986, 1989; Marinho Filho et al., 1994; Bonvicino et al., 1996). Muitos destes estudos registraram maior riqueza de espécies em ambientes florestais quando comparados às áreas abertas, sendo que a composição de espécies também variou entre as fisionomias (Alho, 1981; Fonseca e Redford, 1984; Alho et al., 1986; Mares et al., 1986; Bonvicino et al., 1996; Lyra-Jorge et al., 2001; Cáceres et al., 2007a).
O objetivo deste estudo foi testar a hipótese de que a composição, abundância, riqueza e diversidade de pequenos mamíferos não-voadores variam ao longo do gradiente floresta-cerrado-campo presente em altitudes elevadas do Maciço do Urucum, que margeia a borda oeste do Pantanal, no oeste do Brasil.
MATERIAIS E MÉTODOS
Este estudo foi realizado em uma área de propriedade da Mineração Corumbaense Reunidas (MCR), uma subsidiária do Grupo Rio Tinto, localizada no Maciço do Urucum, uma região montanhosa situada na borda oeste da planície pantaneira, no município de Corumbá, estado do Mato Grosso do Sul, Brasil (Fig. 1). O Maciço do Urucum é delimitado ao norte pelo rio Paraguai, a oeste pela fronteira com a Bolívia, e ao sul e leste pelas áreas de inundação do Pantanal, abrangendo cerca de 1300 km² de área. O clima da região é do tipo Awa, denominado tropical megatérmico, segundo a classificação de Köppen, com temperatura média do mês mais frio em torno de 18ºC, inverno seco, de abril a setembro, e verão chuvoso, de outubro a março. Segundo Soriano (1997), a temperatura média anual é de 25.1ºC, com precipitação média anual de 1070 mm, sendo que 68% das chuvas se concentram de novembro a março e 7% de junho a agosto.

Fig. 1. (A) Localização do Pantanal brasileiro em verde escuro nos estados de Mato Grosso do Sul (MS) e Mato Grosso (MT); (B) Maciço do Urucum (ponto vermelho) no Pantanal; Área de estudo na Morraria de Santa Cruz, Mineração Corumbaense Reunidas - Grupo Rio Tinto, Maciço do Urucum, Corumbá, Mato Grosso do Sul, oeste do Brasil (19°12'19.90"S; 57°34'34.38"W). F1-F6 (florestas semidecíduas), CE1-CE3 (cerrado s.s.) e CA1-CA3 (campos de altitude).
O Maciço do Urucum se localiza em uma região de ecótonos, caracterizada pelo contato entre savanas e florestas estacionais com influências biogeográficas de quatro biomas, a Floresta Amazônica, Pantanal, Cerrado e Chaco, sem distinção clara à qual bioma pertence (Ab'Saber, 1977; Cáceres et al., 2008). Assim, a paisagem da área de estudo é caracterizada por um mosaico de fisionomias florestais e savânicas distribuídas em função da topografia local. De forma geral, nas maiores altitudes, entre 800 a 1000 m acima do nível do mar, ocorrem formações campestres com arbustos esparsos, aqui definidos como campos de altitude, gradualmente substituídos com a redução da altitude por manchas de cerrado stricto sensu (s.s.) e campo cerrado, entre 800 a 900 m a.n.m. Nas áreas mais baixas e menos íngremes ocorrem manchas de cerradão e de florestas decíduas, presentes no Maciço do Urucum, mas não na área deste estudo, e semidecíduas, especialmente nos vales das montanhas, entre 150-900 m a.n.m. (Pott et al., 2000; Damasceno-Júnior et al., 2005). Embora este seja um padrão geral, nem sempre as fitofisionomias presentes no Maciço do Urucum se distribuem nesta seqüência, como em áreas onde ocorre uma transição abrupta entre os campos de altitude e florestas semidecíduas (Damasceno-Júnior et al., 2005).
Os campos de altitude são caracterizados pela alta densidade de gramíneas e outras plantas herbáceas com uma altura média de 30-40 cm, com arbustos e plantas herbáceas de maiores alturas distribuídas esparsamente. Segundo Damasceno-Júnior et al. (2005), a fitofisionomia predominante nos campos de altitude é o campo sujo, entretanto, o componente arbustivo diminui sua altura com o aumento da altitude, e em áreas com baixa densidade de arbustos a vegetação pode ser classificada como campo limpo. As áreas de cerrado s.s. e campo cerrado são similares aos campos de altitude em relação ao estrato herbáceo, entretanto apresentam o estrato arbustivo mais desenvolvido, além da presença de árvores esparsas. Devese também destacar que estas áreas apresentam sinais evidentes de queimadas, apresentando-se normalmente em estágio de recuperação (Damasceno-Júnior et al., 2005). As manchas de florestas estacionais semideciduais se distribuem em altitudes menores, nos vales e na base das montanhas, apresentando formato alongado e estreito, com dossel de 20-25 m de altura e sub-bosque pouco denso (Damasceno-Júnior et al., 2005; obs. pess.).
Neste estudo foram capturadas espécies de pequenos mamíferos não-voadores em todas as fisionomias vegetais presentes na área de estudo, ou seja, em manchas de florestas estacionais semideciduais, cerrado s.s. e campos de altitude. Na área de estudo, restrita aos 31.6 km2 de propriedade da MCR, as florestas semidecíduas ocupam cerca de 13.30 km², o que equivale a aproximadamente 42% da área, ocorrendo em faixas de 700 -810 m a.n.m. As áreas de cerrado s.s. ocupam cerca de 3.42 km² (11% da área) e se localizam em uma faixa de altitude que varia de 810 - 850 m a.n.m., enquanto as áreas campestres ocupam cerca de 6 km² (19% da área) e estão a 820 - 980 m a.n.m. O restante da área é ocupada por áreas em recuperação e por atividades antrópicas ligadas à minera-ção (Damasceno-Júnior et al., 2005).
As espécies de pequenos mamíferos não-voadores foram capturadas por meio de armadilhas de interceptação e queda (pitfall traps) estabelecidas em 12 pontos amostrais, sendo seis em florestas semidecíduas, três em cerrado s.s. e três nos campos de altitude. Neste estudo consideramos os pontos de coleta como unidades amostrais, e a distância entre estes variou de no mínimo 150 m ao valor máximo de 2800 m (Fig. 1).
Em cada ponto amostral foi estabelecida uma estação de captura constituída de duas linhas de armadilhas de interceptação e queda separadas por uma distância de 10-50 m. As linhas foram estabelecidas em forma de transectos com 50 m de comprimento, sendo que cada linha continha quatro baldes de 108 l, separados por 10 m de distância e conectados por tela mosquiteiro de 0,5 m de altura, com 10 m de tela além de cada um dos baldes externos. No total foram utilizados 96 baldes, igualmente distribuídos nos pontos amostrais, sendo que cada ponto amostral continha oito baldes.
Foram realizados 42 dias de coleta ao longo de seis etapas de campo nos anos de 2006 e 2007, com 24 dias de coleta na estação seca e 18 dias na estação úmida, sendo que todos os pontos de coleta foram amostrados simultaneamente. O esforço amostral totalizou 4032 baldesnoite, 2304 baldesnoite na estação seca e 1728 baldes-noite na úmida. Foram utilizados 2016 baldes-noite em florestas semidecíduas, 1008 baldes-noite em cerrado s.s. e 1008 baldes-noite nos campos de altitude, igualmente distribuídos entre as unidades amostrais.
Os animais capturados foram coletados para correta identificação em laboratório, utilizando caracteres morfológicos e auxílio de especialista (N. C. Cáceres), além de uma coleção de referência de espécies ocorrentes na área. Posteriormente, os espécimes coletados foram taxidermizados e depositados na coleção zoológica do Departamento de Zoologia da Universidade Federal de Santa Maria (UFSM). Dados dos espécimes tombados e n° de tombo estão no Anexo. A nomenclatura adotada neste estudo segue Gardner (2007) para marsupiais e Wilson e Reeder (2005) para roedores.
A estrutura da comunidade de pequenos mamíferos não-voadores foi comparada entre as fisionomias vegetais amostradas, sendo que a estrutura das comunidades foi expressa através da abundância, riqueza e diversidade de espécies, estimadas para cada ponto amostral e fisionomia vegetal. A riqueza de espécies, baseada no esforço amostral aplicado, foi estimada para toda a comunidade assim como para cada fisionomia vegetal separadamente (cerrado s.s., floresta semidecídua e campo de altitude) através do estimador Jackknife 1 (Jack1) com 1000 aleatorizações. Este método estima a riqueza de espécies somando a riqueza observada a um parâmetro calculado a partir do número de espécies raras e do número de amostras. As análises foram feitas utilizando o programa EstimateS 7.5 (Colwell, 2005). As espécies são consideradas raras quando ocorrem em apenas uma amostra (Santos, 2003), sendo que neste estudo uma amostra é definida como a ocorrência exclusiva em um único ponto amostral.
Também foi estimada a riqueza de espécies baseada no número de capturas (abundância) por pontos amostrais através do método de rarefação. Esta estimativa foi feita para cada ponto individualmente, cada fisionomia vegetal e para a comunidade como um todo. Para a comparação da riqueza de espécies entre cada fisionomia vegetal a rarefação foi realizada com 1000 interações através de um desenho de aleatorização de amostras independentes utilizandose o programa EcoSim 7 (Gotelli e Entsminger, 2001). Este método de rarefação permite a comparação entre amostras (fisionomias vegetais) de tamanhos (número de indivíduos) diferentes, por fornecer um valor de riqueza esperado para um tamanho padrão de amostra. Portanto, podese comparar a riqueza de espécies entre comunidades (Magurran, 1988), embora o resultado desta comparação dependa do tamanho padrão de amostra, que não deverá ser maior que o menor tamanho encontrado das amostras em questão.
A abundância das espécies de pequenos mamíferos foi definida como o número total de indivíduos de cada espécie capturado em cada ponto amostral e fisionomia vegetal. A diversidade de espécies foi estimada para cada ponto amostral e fisionomia vegetal separadamente, utilizando o Índice de Diversidade de Shannon-Wiener (H') (Magurran, 1988).
Para avaliar se existiram diferenças significativas entre os ambientes amostrados quanto à abundância, riqueza observada e diversidade de espécies foi utilizado o teste não paramétrico Kruskal-Wallis (Zar, 1999).
A dimensionalidade da comunidade de pequenos mamíferos terrestres foi reduzida através de análise multivariada. Ordenações foram realizadas através do método de Escalonamento Multidimensional Não-Métrico (NMDS) (Legendre e Legendre, 1998) a partir da matriz de abundância relativa das espécies capturadas (porcentagem de cada espécie em cada unidade amostral) usando o índice de associação Bray-Curtis (Ferreira, 1997). A ordenação com os dados quantitativos foi utilizada para capturar o padrão apresentado pelas espécies mais abundantes, pois estas terão as maiores contribuições para as diferenças entre sítios de coleta. Feito isso, verificamos a porcentagem de variância explicada por cada eixo na análise através de análise de regressão simples entre as distâncias originais da matriz de abundância com as distâncias obtidas pelo plano de ordenação. Para melhor compreensão dos resultados, foram feitas correlações das espécies registradas com os eixos obtidos pela ordenação, com o intuito de determinar a contribuição relativa de cada espécie para a distribuição dos pontos no plano de ordenação. Os eixos resultantes da ordenação que descreve a composição da comunidade foram usados como variáveis dependentes nos testes inferenciais do efeito das variáveis ambientais. O teste inferencial foi conduzido usando análise de variância multivariada (MANOVA) seguindo o modelo "[NMDS eixo 1 + NMDS eixo 2 ~ Formações vegetais (Floresta, Cerrado, Campo aberto)]" para [variáveis dependentes ~ variável independente categórica]. A estatística adotada para discriminar os grupos foi Pillai-Trace (Zar, 1999).
O teste de Mantel foi utilizado para testar a presença de autocorrelação espacial entre as variáveis dependentes (comunidade de pequenos mamíferos terrestres representada pela matriz de dissimilaridade de Bray-Curtis) e independentes (distância geográfica euclidiana entre unidades amostrais) através de 1000 permutações.
As análises de ordenação, testes inferenciais e teste de Mantel, além dos gráficos referentes a essas análises foram gerados com o pacote estatístico R (R Development Core Team, 2010).
RESULTADOS
Neste estudo foram capturados 71 indivíduos pertencentes a 10 espécies de pequenos mamíferos não-voadores, sendo três espécies de marsupiais da família Didelphidae, e sete espécies de roedores, seis da família Cricetidae e um da família Echimyidae (Tabela 1).
Tabela 1 Composição, abundância, sucesso de captura (%), riqueza observada, e diversidade (H') de pequenos mamíferos não-voadores para cada ponto amostral em florestas estacionais semideciduais (FES), cerrado stricto sensu (CE) e campos de altitude (CA) no alto do Maciço do Urucum, Corumbá, Mato Grosso do Sul, oeste do Brasil.
Nas florestas semidecíduas foram capturados 40 indivíduos pertencentes a nove espécies, com um sucesso de captura de 1,98%. Neste ambiente foram capturados os marsupiais Marmosops ocellatus (Tate, 1931) e Monodelphis kunsi (Pine, 1975) (Didelphidae) e os roedores Akodon toba (Thomas, 1921), Calomys callosus (Rengger, 1830), Necromys lasiurus (Lund, 1841), Oecomys bicolor (Thomas, 1860), Oligoryzomys chacoensis (Myers e Carleton, 1981), Oligoryzomys nigripes (Olfers, 1818) (Cricetidae) e Proechimys longicaudatus (Rengger, 1830) (Echimyidae). No cerrado s.s. foram capturados 21 indivíduos pertencentes a quatro espécies, com um sucesso de captura de 2,08%. Todas as espécies capturadas em cerrado s.s. foram roedores da família Cricetidae (A. toba, C. callosus, N. lasiurus e O. chacoensis). Nos campos de altitude foram capturados 10 indivíduos pertencentes a cinco espécies, com um sucesso de captura de 0,99%. Neste ambiente foram capturados dois marsupiais, Cryptonanus chacoensis (Tate, 1931) e M. kunsi, e três roedores cricetídeos, C. callosus, N. lasiurus e O. chacoensis (Tabela 1).
As espécies mais abundantes na área deste estudo foram O. chacoensis (N = 19; 26,7% das capturas), N. lasiurus (N = 12; 17,0%), O. nigripes (N = 11; 15,5%), C. callosus (N = 9; 12,6%) e A. toba (N = 8; 11,2%). As espécies menos abundantes foram M. kunsi e M. ocellatus (N = 4; 5,6%, para ambas), P. longicaudatus (N = 2; 2.8%), C. chacoensis e O. bicolor (N = 1; 1.4%, para ambas). Desta forma, as cinco espécies mais abundantes corresponderam a 83% dos indivíduos capturados, e as cinco espécies menos abundantes a 17% da abundância total. Os marsupiais corresponderam a 12.7% da abundância e os roedores a 87.3%, sendo os cricetídeos mais capturados que os echimyídeos, 84.5% e 2.8%, respectivamente. Nas florestas semidecíduas, a espécie mais abundante foi O. nigripes, seguida de O. chacoensis e C. callosus. No cerrado s.s., a espécie mais abundante foi O. chacoensis, seguida de N. lasiurus e A. toba, enquanto nos campos de altitude houve uma distribuição bem eqüitativa na abundância das espécies (Tabela 1).
A riqueza observada de espécies (n = 10) correspondeu a 84.5% da riqueza estimada para toda a área (Jack 1 = 11.83; ± 1.23), evidenciando que a maior parte das espécies localmente presentes foi registrada neste estudo através do esforço aplicado. A riqueza estimada de espécies foi maior em florestas semidecíduas (Jack1 = 10.66; ± 1.66), seguida dos campos de altitude (Jack1 = 6.33; ±1.33) e cerrado s.s. (Jack1 = 4.66; ± 0.66). Quando comparamos a riqueza baseada no menor número de indivíduos (campo de altitude, n = 10) um resultado similar é encontrado, entretanto com menor diferença quanto à riqueza estimada entre as fisionomias vegetais (Tabela 2). A curva de rarefação baseada no número de indivíduos mostra estabilidade quando os registros das três fisionomias vegetais são agrupados, porém, quando comparamos separadamente, somente as fisionomias de floresta e cerrado s.s. apresentaram tendência à estabilização (Fig. 2A). Para a comparação dentro de cada ponto amostral, apenas o ponto CE 2 apresentou estabilização quanto ao número de espécies registradas, enquanto os demais pontos provavelmente abrigam mais espécies que as reportadas no presente estudo (Figs. 2B, C e D).

Fig. 2. Curvas de rarefação para os pequenos mamíferos terrestres capturados no Maciço do Urucum, Corumbá, Mato Grosso do Sul, oeste do Brasil. (A) correspondentes às estimativas para a comunidade total, assim como para cada fisionomia vegetal separadamente, (B) para os pontos amostrados na "floresta semidecídua", (C) "cerrado s.s." e (D) "campo de altitude".
Tabela 2 Abundância observada, riqueza média, riqueza mediana, variância da riqueza e intervalo de confiança de espécies de pequenos mamíferos entre os três habitats distintos (Floresta, Cerrado e Campo), estimadas por rarefação para 10 indivíduos (menor número de pequenos mamíferos capturados no Campo), no Maciço do Urucum, Corumbá, Mato Grosso do Sul, oeste do Brasil.
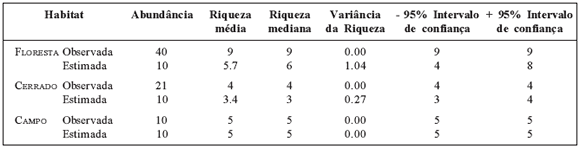
Não houve diferença significativa quanto à riqueza observada entre as fisionomias vegetais (H = 3.00; P = 0.24; - floresta semidecídua, 4.17 ± 1.17 (média ± D.P.), N = 6 (pontos amostrais); cerrado s.s., 3.00 ± 1.00, N = 3; campo de altitude, 2.67 ± 0.58, N = 3) (Tabela 1). Com relação à abundância, também não foram encontradas diferenças significativas (H = 3.51; P = 0.17) entre floresta semidecídua (6.66 ± 2.50), cerrado s.s. (7.00 ± 4.60) e campo de altitude (3.33 ± 0.60). Assim como as demais variáveis, não houve diferenga quanto á diversidade entre as formagoes vegetáis (floresta semidecídua: H' = 1.27 ± 0.27; cerrado s.s.: 0.98 ± 0.3; campo de altitude: 0.92 ± 0.25; H = 3.71; P = 0.17) (Tabela 1).
O teste de Mantel apontou que não existe autocorrelagao espacial entre as distâncias geográficas das unidades amostráis e a comunidade de pequeños mamíferos terrestres na área estudada (Mantel: r = 0.16; p=0.10).
A ordenagão NMDS recuperou o maior padrão da comunidade em duas dimensões (stress: 0.14; r2 = 0.69). Não houve forte influência do gradiente floresta-cerrado-campo sobre a estrutura da comunidade de pequeños mamíferos não-voadores, urna vez que a variagao em composigao de espécies representada pela ordenagao NMDS em duas dimensões não foi significativa entre os hábitats amostrados (MANOVA Pillai Trace = 0.48; F = 1.42: GL = 4 e 18; P = 0.27), considerandose um desenho de amostras aninhadas por fragmento (Fig. 3). Entretanto, se excluirmos o ponto F6 da ordenação e dos testes inferenciais, que é um ponto amostral inserido entre as unidades de cerrado e campo (Fig. 1), há forte tendência para existir um gradiente ambiental sobre a comunidade de pequenos mamíferos (NMDS, stress: 0.06; r² = 0.86; MANOVA Pillai Trace = 1.35; F 2, 7 = 7.34; GL = 4 e 14; P = 0.002).

Fig. 3. Ordenação NMDS (stress = 0.14, r² = 0.69) para composição e abundância da comunidade de pequenos mamíferos não-voadores em florestas semidecíduas (F1-F6), cerrado s.s. (CE1-CE3) e campos de altitude (CA1-CA3) no alto do Maciço do Urucum, Corumbá, Mato Grosso do Sul, oeste do Brasil. As contribuições relativas de cada espécie para a disposição dos pontos de coleta no plano de ordenação estão apontadas com setas e os valores de correlação entre parentêses (Obs. somente foram utilizadas as espécies que contribuiram com 0.45 ou mais).
Com relação à composição de espécies nas fisionomias vegetais, as espécies de pequenos mamíferos foram divididas em dois grupos principais: aquelas que se distribuem amplamente no gradiente de florestas e áreas abertas (cerrado s.s. e campos), e as que foram amostradas em apenas um tipo de ambiente, ou em florestas semidecíduas ou nos campos de altitude. Entre as espécies distribuídas tanto em florestas quanto em áreas abertas encontram-se o marsupial M. kunsi e os roedores A. toba, N. lasiurus, C. callosus e O. chacoensis. Dentre as demais, encontramse espécies florestais, como o marsupial M. ocellatus e os roedores O. bicolor, O. nigripes e P. longicaudatus, e urna aparentemente campestre, o marsupial C. chacoensis (Tabela 1; Fig. 3).
DISCUSSÃO
As 10 espécies de pequeños mamíferos amostradas na área deste estudo representam metade da diversidade do grupo já conhecida para o Macigo do Urucum, estando ausentes em nossa amostragem os marsupiais Didelphis albiventris, Micoureus constantiae, Philander opossum e Monodelphis domestica, e os roedores Oecomys mamorae, Oecomys paricola, Holochilus sciureus, Oligoryzomys fornesi, Euryoryzomys nitidus e Thrichomys pachyurus (Cáceres et al., 2008). Supondo que estas espécies ocorram na área deste estudo, suas ausências podem ter ocorrido em firngao do tipo de armadilha utilizada e dos tipos de habitats amostrados. Por exemplo, o roedor H. sciureus está associado a corpos d'água (Bonvicino et al., 2008) que estão ausentes ñas unidades amostráis estabelecidas neste estudo, e as espécies M. constantiae, O. mamorae e O. paricola são arborícolas e de hábitos florestais (Reis et al., 2006; Bonvicino et al., 2008) e conseqüentemente, são mais susceptíveis á captura em armadilhas instaladas no sub-bosque e dossel de ambientes florestais (Lambert et al., 2005; Santos-Filho et al., 2006). Mesmo que estas espécies ocorressem na área, elas seriam menos susceptíveis á captura em armadilhas de queda instaladas no solo e/ou em matas ripárias, como ocorreu neste estudo, já que corpos d'água são mais comuns em baixas altitudes do macigo.
Neste estudo a abundância, riqueza de especies e diversidade em florestas semidecíduas, cerrado s.s. e campos de altitude não foram significativamente diferentes, indicando que essas fisionomías vegetáis tendem a apresentar valores semelhantes de abundância e riqueza de pequeños mamíferos. Estes dados corroboram outros estudos que também não encontraran! diferengas na abundância e riqueza de espécies de pequenos mamíferos entre áreas abertas e ambientes florestais, apontando que o número de espécies que ocorrem em áreas abertas pode ser tão expressivo quanto o de ambientes florestais (Paglia et al., 1995; Talamoni e Dias, 1999; Lyra-Jorge et al., 2001; Carmignotto, 2005; Bonvicino et al., 2005).
Por outro lado, muitos estudos realizados em áreas de contato entre florestas e ambientes savânico-campestres, demonstraram que há maior abundância, riqueza e diversidade de pequenos mamíferos em áreas florestais, como apontado em alguns estudos realizados no Cerrado (Fonseca e Redford, 1984; Redford e Fonseca, 1986; Bonvicino et al., 1996; Lacher e Alho, 2001). Uma parte do aumento de riqueza de pequenos mamíferos em florestas, quando comparadas a áreas abertas, parece ocorrer em função do acréscimo de espécies com hábitos escansoriais e arborícolas, sendo que estas são menos abundantes ou mesmo ausentes em muitas áreas abertas. Armadilhas de interceptação e queda, como as utilizadas neste estudo, são mais eficientes na amostragem de espécies cursoriais, também amostrando espécies escansoriais e arborícolas, mas com menos eficiência que armadilhas live-trap (Shermann, Young e Tomahawk) instaladas no sub-bosque (Santos-Filho et al., 2006). Assim, algumas espécies de hábitos escansoriais e arborícolas podem não ter sido amostradas, caso ocorram nas florestas da área deste estudo, em função de não ter havido amostragem no sub-bosque. Conseqüentemente, a abundância, riqueza e diversidade de pequenos mamíferos podem não ter variado entre os pontos amostrais florestais e de áreas abertas, em função da não amostragem destas espécies.
A comunidade local de pequenos mamíferos pode ser caracterizada por dois grupos de espécies: o primeiro formado por espécies que se distribuem em florestas e áreas abertas ocorrendo preferencialmente nestas últimas, e o segundo grupo constituído por espécies que só ocorreram em um tipo de hábitat, com quatro espécies restritas às formações florestais e uma amostrada apenas nos campos de altitude. Desta forma, os dados aqui apresentados corroboram outros estudos que mostraram que, em áreas de contato entre ambientes florestais e áreas abertas, a comunidade de pequenos mamíferos não-voadores é composta tanto por espécies generalistas, quanto por especialistas no uso dos habitats, como observado no Cerrado (Alho, 1981; Fonseca e Redford, 1984; Bonvicino et al., 1996; Bonvicino et al., 1997; Lacher e Alho, 2001; Lyra-Jorge et al., 2001; Carmignotto, 2005; Cáceres et al., 2007a) e em outras formações onde ocorrem transições entre ambientes florestais e savânico-campestres (August, 1983; Geise et al., 2004; Yahnke, 2006).
Em áreas de contato entre formações abertas e ambientes florestais inseridas no Cerrado e em outros biomas como o Chaco, as espécies M. kunsi, A. toba, C. callosus, N. lasiurus e O. chacoensis têm sido amostradas especialmente em ambientes abertos, mas também podem ocorrer em ambientes florestais (Alho, 1981; Mares et al., 1986; Bonvicino et al., 1996; Lacher e Alho, 2001; Bonvicino et al., 2002; Carmignotto, 2005; Bonvicino et al., 2005; Yahnke, 2006; Cáceres et al., 2010). Já M. ocellatus, O. bicolor, O. nigripes e P. longicaudatus têm sido amostrados exclusivamente ou principalmente em ambientes florestais do Cerrado e de outros biomas adjacentes (Mares et al., 1986; Mares e Ernest, 1995; Bonvicino et al., 1996; Lacher e Alho, 2001; Lyra-Jorge et al., 2001; Carmignotto, 2005; Voss et al., 2004; Alho, 2005; Santos-Filho et al., 2006; Cáceres et al., 2007a, b, 2010). Já o marsupial C. chacoensis parece utilizar habitats campestres ou similares, inclusive campos inundados (Voss et al., 2005), entretanto informações sobre a preferência de habitats desta espécie são escassas na literatura. O marsupial Cryptonanus agricolai, de uma área próxima à área de estudo, no bioma Cerrado, utiliza o habitat florestal (cerradão) e preferencialmente o estrato arbóreo (Hannibal e Cáceres, no prelo), mostrando que o gênero pode ser mais generalista do que antes pensado (Voss et al., 2005).
Na área deste estudo não houve forte influência do gradiente floresta-cerrado-campo sobre a estrutura da comunidade local de pequenos mamíferos não-voadores, sendo que das 10 espécies capturadas, nove ocorreram em florestas semidecíduas, havendo apenas uma espécie (C. chacoensis) não ocorrendo nas florestas amostradas. Assim, não houve separação nítida de comunidades de pequenos mamíferos florestais, de cerrado s.s. e campestres, uma vez que houve muita sobreposição no uso do habitat pelas espécies.
As manchas de florestas semidecíduas localizadas nas áreas mais altas do Maciço do Urucum, apesar de abundantes, são naturalmente estreitas e fragmentadas, além de se encontrarem em contato direto com as manchas de cerrado s.s. e campos de altitude, sendo que a transição entre estes ambientes na região é bastante abrupta (Pott et al., 2000). Além disso, as linhas de armadilhas estabelecidas nas florestas semidecíduas localizavamse relativamente próximas às bordas das florestas, entre 20-90 m de distância, e também próximas às áreas de cerrado s.s. e de campos de altitude, entre 60-210 m. Desta forma, o grande número de espécies de áreas abertas encontradas nos ambientes florestais na área deste estudo pode ser explicado em grande parte pela proximidade entre habitats abertos e florestais, e pelo efeito de borda nas florestas semidecíduas, que poderiam permitir a expansão de espécies de áreas abertas para dentro das florestas (Malcolm, 1994; Gascon et al., 1999; Pires et al., 2005). Este é possivelmente o caso do ponto amostral F6, onde a espécie mais abundante foi o roedor O. chacoensis, espécie amostrada preferencialmente em ambientes abertos (Yahnke, 2006).
Fragmentos florestais comumente apresentam um aumento de exposição de suas bordas, sendo estas últimas mais sujeitas a alterações bióticas e abióticas quando comparadas ao interior dos fragmentos florestais. As alterações nas bordas de fragmentos florestais incluem, por exemplo, redução da cobertura de dossel, aumento da temperatura média e da incidência de ventos, além de aumento na densidade de árvores mortas e de deposição de serapilheira (Malcolm, 1994; Didham e Lawton, 1999), sendo que todos estes fatores podem afetar a composição, distribuição, abundância e riqueza de pequenos mamíferos, principalmente daqueles adaptados à floresta primária (Laurance, 1994; Stevens e Husband, 1998).
Já a composição das comunidades de pequenos mamíferos não-voadores das áreas de cerrado s.s. e dos campos de altitude amostrados neste estudo é caracterizada pela presença de espécies reconhecidamente habitantes de áreas abertas, e pela ausência de espécies florestais, concordando com outros estudos que reportaram fenômeno similar para áreas de contato entre ambientes florestais e áreas abertas (Lacher e Alho, 2001, Lyra-Jorge et al., 2001; Cáceres et al., 2007a). As áreas abertas amostradas neste estudo parecem suportar uma comunidade composta apenas por espécies típicas desses ambientes, não permitindo a coexistência destas com espécies florestais.
Assim, a comunidade de pequenos mamíferos das partes altas do Maciço do Urucum é composta por espécies generalistas no uso do habitat, que ocorrem tanto em florestas quanto em áreas abertas, e por espécies especialistas, principalmente por aquelas que ocorrem somente em florestas. Além disso, o gradiente floresta-cerrado-campo presente na área deste estudo não determinou variações na estrutura da comunidade local de pequenos mamíferos, uma vez que houve muita sobreposição no uso dos habitats pelas espécies presentes na área. Tal fato se deve possivelmente às características da paisagem nas partes altas do Maciço do Urucum, onde as florestas semidecíduas apresentam formato alongado e estreito, estando em contato direto e abrupto com as áreas abertas, permitindo assim a existência de um grande efeito de borda, com conseqüente expansão de espécies típicas de cerrado e de campos para dentro dos ambientes florestais. Isto é evidenciado quando retiramos da análise uma das áreas de floresta que estava bem inserida em meio às áreas abertas, demonstrando assim um resultado significativo para a presença de um gradiente floresta-cerrado-campo sobre a comunidade de pequenos mamíferos.
N° de registro, forma de preparação (L - em líquido; PC - pele e crânio), localidade de coleta e destino final (UFSM - Universidade Federal de Santa Maria, RS) dos espécimens coletados no Maciço do Urucum, Corumbá, Brasil.

AGRADECIMENTOS
Agradecemos à Mineração Corumbaense Reunidas - Grupo Rio Tinto - pela permissão de trabalhar em sua área no Maciço do Urucum e pelo suporte logístico. À CAPES pela bolsa de mestrado concedida à M. N. Godoi. À Vanda Ferreira (UFMS) por nos disponibilizar as armadilhas utilizadas neste estudo e pelo apoio logístico. À Josué Raizer (UFGD) pela ajuda com as análises estatísticas. À Wellington Hannibal pela ajuda com gráficos e análises. À Ana Paula Carmignotto, Helena de Godoy Bergallo, Maurício Graipel, Renata Pardini e Vânia Regina Pivello pelas críticas e sugestões. Nilton C. Cáceres é bolsista de produtividade do CNPq/Governo do Brasil.
LITERATURA CITADA
1. AB'SABER AN. 1977. Os domínios morfoclimáticos da América do Sul: primeira aproximação. Geomorfologia 52:1-21. [ Links ]
2. ALHO CJR. 1981. Small mammal populations of Brazilian cerrado: the dependence of abundance and diversity on habitat complexity. Revista Brasileira de Zoologia 4:223-230. [ Links ]
3. ALHO CJR. 2005. Intergradation of habitats of non-volant small mammals in the patchy Cerrado landscape. Arquivos do Museu Nacional Rio de Janeiro 63(1):41-48. [ Links ]
4. ALHO CJR, LA PEREIRA e AC PAULA. 1986. Patterns of habitat utilization by small mammal populations in cerrado biome of central Brazil. Mammalia 50:447-460. [ Links ]
5. AUGUST PV. 1983. The role of habitat complexity and heterogeneity in structuring tropical mammal com-munities. Ecology 64:1495-1513. [ Links ]
6. BERGALLO HG. 1994. Ecology of a small mammal community in an Atlantic Forest area in southeastern Brazil. Studies on Neotropical Fauna and Environment 29:197-217. [ Links ]
7. BONVICINO CR. 2003. A new species of Oryzomys (Rodentia, Sigmodontinae) of the subflavus group from the Cerrado of Central Brazil. Mammalian Biology 68:78-90. [ Links ]
8. BONVICINO CR e M WEKSLER. 1998. A new species of Oligoryzomys (Rodentia, Sigmodontinae) from Northeastern and Central Brazil. Zeitschrift für Säugetierkunde 63:90-103. [ Links ]
9. BONVICINO CR e FC ALMEIDA. 2000. Karyotype, morphology and taxonomic status of Calomys expulsus (Rodentia: Sigmodontinae). Mammalia 64(3):339-351. [ Links ]
10. BONVICINO CR, R CERQUEIRA e VA SOARES. 1996. Habitat use by small mammals of upper Araguaia river. Revista Brasileira de Biologia 56:761-767. [ Links ]
11. BONVICINO CR, SR FREITAS e PS D´ÁNDREA. 1997. Influence of bordering vegetation, width, and state of conservation of galery forest on the presence of small mammals. Pp. 147-167, em: Contribuição ao conhecimento do Cerrado (LL Leila e CH Saito, eds.). Brasília: Editora da UNB. [ Links ]
12. BONVICINO CR, SM LINDBERGH e LS MAROJA. 2002. Small non-flying mammals from conserved and altered areas of Atlantic forest and Cerrado: comments on their potential use for monitoring environment. Brazilian Journal of Biology 62(4B):765-774. [ Links ]
13. BONVICINO CR, B LEMOS e M WEKSLER. 2005. Small mammals of Chapada dos Veadeiros National Park (Cerrado of central Brazil): Ecologic, kariologic, and taxonomic considerations. Revista Brasileira de Biologia 65:395-406. [ Links ]
14. BONVICINO CR, JA DE OLIVEIRA e PS D'ANDREA. 2008. Guia de roedores do Brasil, com chaves para gêneros baseadas em caracteres externos. Rio de Janeiro, Centro PanAmericano de Febre Aftosa - OPAS/OMS. 120pp. [ Links ]
15. CÁCERES NC, MR BORNSCHEIN, WH LOPES e AR PERCEQUILLO. 2007a. Mammals of the Bodoquena Mountains, southwestern Brazil: an ecological and conservation analysis. Revista Brasileira de Zoologia 24(2):426-435. [ Links ]
16. CÁCERES NC, VL FERREIRA e AP CARMIGNOTTO. 2007b. The occurrence of the mouse opossum Marmosops ocellatus (Marsupialia, Didelphidae) in western Brazil. Mammalian Biology 72(1):45-48. [ Links ]
17. CÁCERES NC, AP CARMIGNOTTO, E FISCHER e CF SANTOS. 2008. Mammals from Mato Grosso do Sul, Brazil. Check List 4(3):321-335. [ Links ]
18. CÁCERES NC, RP NAPOLI, J CASELLA e W HANNIBAL. 2010. Mammals in a fragmented savannah landscape in south-western Brazil. Journal of Natural History 44: 491-512. [ Links ]
19. CARMIGNOTTO AP. 2005. Pequenos mamíferos terrestres do Bioma Cerrado: padrões faunísticos locais e regionais. Tese de Doutorado. Instituto de Biociências da Universidade de São Paulo USP - São Paulo - SP. 404 pp. [ Links ]
20. COSTA LP, YLR LEITE, SL MENDES e AD DITCHFIELD. 2005. Mammal conservation in Brazil. Conservation Biology 19:672-679. [ Links ]
21. COLWELL RK. 2005. EstimateS: Statistical estimation of species richness and shared species for samples. Version 7.5. Disponível em: URL <purl.oclc.org/estimates> [ Links ]
22. DAMASCENO-JÚNIOR G., IH ISHII, W MILLIKEN, A POTT, V POTT, J RATTER e J YESILYURT. 2005. Vegetation of the Morraria de Santa Cruz, Brazil. A preliminary report. Relatório Técnico. 40 pp. [ Links ]
23. DIDHAM RK e JH LAWTON. 1999. Edge structure determines the magnitude of changes in microclimate and vegetation structure in tropical forest fragments. Biotropica Vol. 31:17-30. [ Links ]
24. FERREIRA AM. 1997. Transformações de dados em medidas de semelhança e suas interpretações ecológicas. Revista Brasileira de Ecologia 1:111-114. [ Links ]
25. FONSECA GAB e KH REDFORD. 1984. The mammals of IBGE's ecological reserve and an analysis of the role of gallery forests in increasing diversity. Revista Brasileira de Biologia 44:517-523. [ Links ]
26. GARDNER AL. 2007. Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews and Bats. The University of Chicago Press. 690 pp. [ Links ]
27. GASCON C, TE LOVEJOY, RO BIERREGAARD, JR MALCOLM, PC STOUFFER, HL VASCONCELOS, WF LAURANCE, B ZIMMERMAN, M TOCHER e S BORGES. 1999. Matrix habitat and species richness in tropical forest remnants. Biological Conservation 91:223-229. [ Links ]
28. GEISE L, LG PEREIRA, DEP BOSSI e HG BERGALLO. 2004. Pattern of elevational distribution and richness of non-volant mammals in Itatiaia National Park and its surroundings, in southeastern Brazil. Brazilian Journal of Biology 64(3B):599-612. [ Links ]
29. GOTELLI NJ e GL ENTSMINGER. 2001. EcoSim: Null models software for ecology. Version 7.0. Acquired Intelligence Inc. e Kesey-Bear. http://homepages.together.net/~gentsmin/ecosim.htm. [ Links ]
30. HANNIBAL W e NC CÁCERES. In press. Use of vertical space by small mammals in gallery forest and woodland savannah in south-western Brazil. Mammalia. [ Links ]
31. HERSHKOVITZ P. 1990a. The Brazilian rodent genus Thalpomys (Sigmodontinae, Cricetidae) with a description of a new species. Journal of Natural History 24:763-783. [ Links ]
32. HERSHKOVITZ P. 1990b. Mice of the Akodon boliviensis size class (Sigmodontinae, Cricetidae), with the description of two new species from Brazil. Fieldiana Zoology New Series 57:1-35 [ Links ]
33. LACHER TE, MA MARES e CJR ALHO. 1989. The structure of a small mammal community in a central Brazilian savanna. Pp. 137-162, em: Advances in Neotropical Mammalogy (KH Redford e JF Eisenberg, eds.). The Sandhill Crane Press, Gainesville, Florida. [ Links ]
34. LACHER TE e CJR ALHO. 2001. Terrestrial small mammal richness and habitat associations in an Amazon Forest-Cerrado contact zone. Biotropica 33:171-181. [ Links ]
35. LAMBERT TD, JR MALCOLM e BL ZIMMERMAN. 2005. Variation in small mammal species richness by trap height and trap type in southeastern Amazonia. Journal of Mammalogy 86(5):982-990. [ Links ]
36. LANGGUTH A e CR BONVICINO. 2002. The Oryzomys subflavus species group, with description of two new species (Rodentia, Muridae, Sigmodontinae). Arquivos do Museu Nacional Rio de Janeiro 60 (4):285-294. [ Links ]
37. LAURANCE WF. 1994. Rainforest fragmentation and structure of small mammal communities in tropical Queensland. Biological Conservation 69:23-32. [ Links ]
38. LEGENDRE P e L LEGENDRE. 1998. Numerical ecol-ogy. 2nd English edition. Elsevier Science BV, Amsterdam. xv + 853 pages. [ Links ]
39. LYRA-JORGE MC, VR PIVELLO, ST MEIRELLES e M VIVO. 2001. Riqueza e abundância de pequenos mamíferos em ambientes de cerrado e floresta, na reserva de Cerrado Péde-Gigante, Parque Estadual de Vassununga (Santa Rita do Passa Quatro, SP). Naturalia 26:287-302. [ Links ]
40. MAGURRAN AE. 1988. Ecological diversity and its measurement. Princeton University Press, Princeton. [ Links ]
41. MALCOLM JR. 1994. Edge effects in central Amazonian forest fragments. Ecology 75:2438-2445. [ Links ]
42. MARES MA e KA ERNEST. 1995. Population and community ecology of small mammals in a gallery forest of Central Brazil. Journal of Mammalogy 76(3):750-768. [ Links ]
43. MARES MA, KA ERNEST e DD GETTINGER. 1986. Small mammal community structure and composition in the Cerrado province of Central Brazil. Journal of Tropical Ecology 2:289-300. [ Links ]
44. MARES MA, JK BRAUN e D GETTINGER. 1989. Observations on the distribution and ecology of the mammals of the Cerrado grasslands of central Brazil. Annals of the Carnegie Museum 58:1-60. [ Links ]
45. MARINHO-FILHO J, ML REIS, PS OLIVEIRA, EM VIEIRA e MN PAES. 1994. Diversity standards and small mammal numbers: conservation of the Cerrado biodiversity. Anais da Academia Brasileira de Ciências 66:149-157. [ Links ]
46. MUSSER GG, MD CARLETON, EM BROTHERS e AL GARDNER. 1998. Systematic studies of oryzomyine rodents (Muridae, Sigmodontinae): diagnoses and distributions of species formerly assigned to Oryzomys "capito". Bulletin of the American Museum of Natural History 236:1-376. [ Links ]
47. MYERS P. 1982. Origins and affinities of the mammal fauna of Paraguay. Pp. 85-94, em: Mammalian biology in South América (MA Mares e HH Genoways, eds.). Special Publication Series. Pymatuning Laboratory of Ecology. [ Links ]
48. PAGLIA AP, P MARCO-JÚNIOR, FM COSTA, RF PEREIRA e G LESSA. 1995. Heterogeneidade estrutural e diversidade de pequenos mamíferos em um fragmento de mata secundária de Minas Gerais, Brasil. Revista Brasileira de Zoologia 12(1):67-79. [ Links ]
49. PARDINI R, SM SOUZA, R BRAGA-NETO, JP METZGER. 2005. The role of forest structure, fragment size and corridors in maintaining small mammal abundance and diversity in an Atlantic forest landscape. Biological Conservation 124:253-266. [ Links ]
50. PARDINI R e F UMETSU. 2006. Pequenos mamíferos não-voadores da Reserva Florestal do Morro Grande - distribuição das espécies e da diversidade em uma área de Mata Atlântica. Biota Neotropica 6(2):1-22. [ Links ]
51. PASSAMANI M, SL MENDES e AG CHIARELLO. 2000. Non-volant mammals of the Estação Biológica de Santa Lúcia and adjacent areas of Santa Tereza, Espírito Santo, Brazil. Boletim do Museu de Zoologia Mello Leitão 11/12:201-214. [ Links ]
52. PATTERSON BD. 2001. Fathoming tropical biodiversity: continuing discovery of Neotropical mammals. Diversity and Distributions 7:191-196. [ Links ]
53. PIRES AS, FAS FERNANDEZ, D FREITAS e BR FELICIANO. 2005. Influence of edge and fireinduced changes on spatial distribution of small mam-mals in Brazilian Atlantic forest fragments. Studies on Neotropical Fauna and Environment 40(1):7-14. [ Links ]
54. POTT A, JSV SILVA, SM SALIS, VJ POTTI e MP SILVA. 2000. Vegetação e Uso da Terra. Pp. 111-131, em: Zoneamento ambiental da borda oeste do Pantanal: Maciço do Urucum e adjacências (JSV Silva, edit.). Brasília: Embrapa Comunicação e Transferência de Tecnologia. [ Links ]
55. R DEVELOPMENT CORE TEAM 2009. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org. [ Links ]
56. REDFORD KH e GAB FONSECA. 1986. The role of gallery forests in the zoogeography of the Cerrado's non-volant mammalian fauna. Biotropica 18:126-135. [ Links ]
57. REIS NR, AL PERACCHI, WA PEDRO e IP LIMA. 2006. Mamíferos do Brasil. Universidade Estadual de Londrina. Londrina - Paraná. 439 pp. [ Links ]
58. RODRIGUES FHG, L SILVEIRA, AT JÁCOMO, AP CARMIGNOTTO, AMR BEZERRA, D COELHO, H GARBOGGINI e J PAGNOZZI e 2002. Composição e caracterização da fauna de mamíferos do Parque Nacional das Emas, Goiás. Revista Brasileira de Zoologia 19(2):589-600. [ Links ]
59. SANTOS AJ. 2003. Estimativas de riqueza em espécies. Pp. 19-41, em: Métodos de estudos em Biologia da Conservação e Manejo da Vida Silvestre. (L Cullen-Júnior, R Rudran e C Valladares-Pádua, eds.). Curitiba - UFPR. [ Links ]
60. SANTOS-FILHO M, DJ DA SILVA e TM SANAIOTTI. 2006. Efficiency of four trap types in sampling small mammals in forest fragments, Mato Grosso, Brazil. Mastozoología Neotropical 13(2):217-225. [ Links ]
61. SORIANO BMA. 1997. Caracterização climática de Corumbá-MS. Embrapa. (Boletim de Pesquisa, 11), Corumbá. 25 pp. [ Links ]
62. STEVENS SM e TP HUSBAND. 1998. The influence of edge on small mammals: evidence from Brazilian Atlantic forest fragments. Biological Conservation 85:1-8. [ Links ]
63. TALAMONI SA e MM DIAS. 1999. Population and community ecology of small mammals in southeast-ern Brazil. Mammalia 63(2):167-181. [ Links ]
64. WEKSLER M e CR BONVICINO. 2005. Taxonomy of pigmy rice rats genus Oligoryzomys Bangs, 1900 (Rodentia, Sigmodontinae) of the Brazilian Cerrado, with the description of two new species. Arquivos do Museu Nacional Rio de Janeiro 63(1):113-130. [ Links ]
65. WEKSLER M, AR PERCEQUILLO e R VOSS. 2006. Ten New Genera of Oryzomyine Rodents (Cricetidae: Sigmodontinae). American Museum Novitates New York, NY. Nº 3537, 29 pp. [ Links ]
66. WILSON DE e DM REEDER. 2005. Mammal species of the world - a taxonomic and geographic reference. 3° edição. Baltimore. The John Hopkins University Press. [ Links ]
67. VIEIRA EM e ART PALMA. 2005. Pequenos mamíferos do Cerrado: distribuição dos gêneros e estrutura das comunidades nos diferentes habitats. Pp: 267-282, em: Biodiversidade, Ecologia e Conservação do Cerrado (A Scariot, JM Felfili e JC Souza-Silva, eds.). EMBRAPA, Brasília, DF. [ Links ]
68. VOSS RS e SA JANSA. 2009. Phylogenetic relation-ships and classification of didelphid marsupials, an extant radiation of New World metatherian mam-mals. Bulletin of the American Museum of Natural History 322:1-177. [ Links ]
69. VOSS RS, T TARIFA e E YENSEN. 2004. An introduction to Marmosops (Marsupialia, Didelphidae), with the description of new species from Bolivia and notes on the taxonomy and distribution of the Bolivian forms. American Museum Novitates 3466:1-40. [ Links ]
70. VOSS RS, DP LUNDE e SA JANSA. 2005. On the contents of Gracilinanus Gardner and Creighton, 1989, with the description of a previously unrecognized clade of small didelphid marsupials. American Museum of Natural History Nº 3482. [ Links ]
71. YAHNKE CJ. 2006. Habitat use and natural history of small mammals in the Central Paraguayan Chaco. Mastozoología Neotropical 13(1):103-116. [ Links ]
72. YÁÑEZ MA, F VERA, JA SIMONETTI e AA GREZ. 1999. Small mammals of forest islands of the Beni Biological Station, Bolívia. Mastozoologia Neotropical 6(2):135-138. [ Links ]
73. ZAR JH. 1999. Bioestatistical Analyses. 4º edição Pearson Education 663 pp. [ Links ]














