Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Mastozoología neotropical
versão impressa ISSN 0327-9383
Mastozool. neotrop. vol.17 no.2 Mendoza dez. 2010
ARTÍCULOS
La importancia de los nematodes Syphaciini (Syphaciinae-Oxyuridae) como marcadores especifícos de sus hospedadores*
María del Rosario Robles
Centro de Estudios Parasitológicos y de Vectores CEPAVE (CCT- CONICET La Plata; UNLP), Calle 2 N° 584, 1900 La Plata, Buenos Aires, Argentina <rosario@cepave.edu.ar>
Recibido 10 mayo 2010.
Aceptado 15 junio 2010. Editor asociado: G Navone
RESUMEN: La especificidad es uno de los principales atributos de los parásitos. El hallazgo de especies parásitas altamente específicas puede brindar información sobre los hospedadores. Además, la especificidad hospedatoria describe patrones de asociación actual que pueden reflejar la historia macroevolutiva. En este trabajo se analizó la especificidad hospedatoria de los nematodes Syphaciini (Oxyuridae) parásitos de roedores Muroidea (Rodentia) americanos y en particular de roedores akodontinos de Argentina. Por otra parte, con el fin de distinguir posibles eventos evolutivos, los conocimientos taxonómicos, ecológicos y los resultados de especificidad de los nematodes Syphaciini se integraron con la filogenia de los roedores Akodontini. Los resultados mostraron correspondencia entre especie parasita-género hospedador e indicaron que estos parásitos acompañan la diversificación de sus hospedadores. Por lo expuesto, se sugiere que estos nematodes serían de utilidad como marcadores taxonómicos de la historia evolutiva de sus hospedadores.
ABSTRACT: The importance of Syphaciini nematodes (Syphaciinae-Oxyuridae) as specific marker of their hosts. The specificity is one of the main features of parasites. The founding of highly specific parasite species can offer information on their hosts. Also, the host specificity describes patterns of current association that can reflect the macroevolutive history. The host specificity of the Syphaciini (Oxyuridae) nematode parasites of American Muroidea (Rodentia) and akodontine rodents was analyzed in this study. On the other hand, with the aim of distinguishing possible evolutionary events, the taxonomic-ecological knowledge and the results of specificity of Syphaciini were integrated with the phylogeny of the Akodontini rodents. The results showed correspondence between parasite specie-genus host and explain that these parasites accompany the diversification of their hosts. As regarded, it is suggested that these nematodes would be useful as taxonomic markers of the evolutionary history of their hosts.
Palabras clave. Especificidad; Nematodes; Oxyuridae; Roedores; Sigmodontinae
Key words. Nematodes; Specificity; Oxyuridae; Rodents; Sigmodontinae.
INTRODUCCIÓN
La especificidad es uno de los principales atributos de los parásitos y se relaciona con el número de especies hospedadoras explotadas por una población parásita. Las especies parásitas presentes en una sola especie hospedadora se denominan específicas, mientras que aquellas halladas en diferentes especies de hospedadores se refieren como generalistas (Poulin et al., 2006). Si bien conocer la especificidad hospedatoria es de central importancia para el estudio de la ecología y evolución de las especies parásitas (Adamson y Caira, 1994; Poulin, 1998), también el hallazgo de especies altamente específicas puede brindar información sobre sus hospedadores.
Para evitar interpretaciones erróneas acerca de las asociaciones parásito-hospedador es de fundamental importancia realizar identificaciones certeras de las especies parásitas y hospedadoras involucradas, efectuar un esfuerzo de muestreo considerable y utilizar una exacta definición operacional del término especificidad hospedatoria.
Tradicionalmente el número de especies hospedadoras explotadas por una especie parásita, o su rango de especies hospedadoras, fue utilizado como una medida simple de la especificidad (Lymbery, 1989). Sin embargo, esta concepción es inapropiada, ya que asume que todas las especies hospedadoras son igualmente adecuadas para la especie parásita. Rohde (1980, 1993) desarrolló índices de especificidad que además del número de especies hospedadoras tienen en cuenta la abundancia de las especies parásitas o la prevalencia relativa en sus diferentes hospedadores. No obstante, estos índices no consideran la identidad de los hospedadores y las relaciones entre éstos.
En este sentido, algunas de las especies hospedadoras explotadas por una especie parásita pueden ser cercanas filogenéticamente, mientras que otras pueden presentar relaciones más distantes. La especificidad hospedatoria describe patrones actuales de asociación parásito-hospedador que pueden reflejar su historia macroevolutiva. Así, la alta especificidad hospedatoria se relaciona principalmente con la coespeciación (o codivergencia), la cual es una condición necesaria para observar congruencia entre las filogenias de los parásitos y sus hospedadores (Hoberg, 1992; Hoberg et al., 1997; Nieberding y Morand, 2006). Descartando posibles errores metodológicos, la incongruencia entre las filogenias puede deberse a diferentes procesos, tales como el retraso de la especiación de los parásitos, cambios de hospedador (host switching), extinción (pérdida del parásito) o ausencia en el linaje hospedador (x- event, missing the boat), entre otros (Ronquist, 2003; Clayton et al., 2003; Poulin et al., 2006).
Poulin y Mouillot (2003, 2005) propusieron los índices STD y STD*, los cuales contemplan información taxonómica, filogenética y ecológica de las especies hospedadoras, proporcionando datos valiosos para el análisis de la especificidad hospedatoria.
Los roedores Muroidea Illiger, 1811 (Myomorpha-Rodentia) son excelentes modelos para evaluar la especificidad hospedatoria por la diversidad de sus dietas, su complejidad taxonómica, amplia distribución geográfica, variedad de microhábitats frecuentados y particular comportamiento intraespecífico (D'Elía, 2003a; Pardiñas et al., 2006). Estas características favorecen la transmisión de nematodes, en especial de aquellos que presentan una limitada habilidad de dispersión y ciclos de vida directos (Krasnov et al., 2006), como los nematodes Syphaciini Raillet, 1916 (Syphaciinae-Oxyuridae).
Estudios realizados sobre nematodes Oxyuridae han mostrado una estrecha asociación con sus hospedadores (Hugot, 1988; 2002). En este contexto surge el interés de estudiar y analizar las relaciones Syphaciini-Muroidea con un sentido ecológico-sistemático-evolutivo.
En este trabajo se analiza la especificidad hospedatoria de los nematodes Syphaciini parásitos de roedores Muroidea americanos, y en particular de roedores Akodontini (Cricetidae-Sigmodontinae) de Argentina. Asimismo, a partir de la integración de los conocimientos taxonómicos, ecológicos y de especificidad hospedatoria registrados en la asociación Syphaciini-Akodontini, se discuten los posibles eventos evolutivos que intervienen en la distribución de las especies de estos nematodes entre sus especies hospedadoras.
MATERIALES Y MÉTODOS
Se calcularon los índices de especificidad STD (Poulin y Mouillot, 2003) y STD* (Poulin y Mouillot, 2005). El índice STD mide la distancia taxonómica promedio entre cada par de especies hospedadoras que albergan una misma especie parásita, mientras que el índice STD* considera además el valor de la prevalencia de esa especie parásita en cada especie hospedadora.
Debido a que estos índices no pueden ser computados para especies que parasitan a una única especie hospedadora se asigna un valor de STD y STD* = 0 (cero) a las especies que reflejan una estricta especificidad (especie parásita-especie hospedadora), ya que por definición las especies presentes en especies hospedadoras congéneres alcanzan un valor STD y STD* =1 (Poulin y Mouillot, 2003, 2004, 2005). Así, el valor de estos índices es inversamente proporcional a la especificidad, siendo el valor más alto igual a la cantidad total de niveles taxonómicos de los hospedadores considerados.
Para la aplicación del índice de especificidad STD se utilizaron los registros de hospedadores publicados para las especies de Syphaciini halladas en roedores muroideos americanos. Se estudió la distribución de los nematodes entre los hospedadores y se consideraron cuatro niveles taxonómicos de la clasificación Linneana para los roedores muroideos (Familia, Subfamilia, Género y Especie). Estos hospedadores se dispusieron en una estructura jerárquica considerando la clasificación taxonómica de Wilson y Reeder (2005).
El índice de especificidad STD*se aplicó para los nematodes Syphaciini hallados mediante el estudio de roedores akodontinos capturados previamente por diferentes equipos de trabajo en el este y noreste de Argentina (1996-2007). Los ejemplares obtenidos fueron sacrificados bajo procedimientos de manejo animal incruento aprobado por pautas internacionales y procesados según protocolo estándar. Las vísceras fueron extraídas en el campo y fijadas en formol al 10% o en alcohol al 96% para realizar luego la prospección helmintológica en el laboratorio. Los roedores fueron identificados por especialistas del Centro Nacional Patagónico (CENPAT), Puerto Madryn, del Centro de Estudios Parasitológicos y de Vectores (CEPAVE), La Plata y del Museo de La Plata, La Plata.
Se prospectaron un total de 825 roedores akodontinos, pertenecientes a 12 especies: Akodon azarae (Fischer, 1829) (N= 206), Akodon montensis Thomas, 1913 (N=126), Akodon philipmyersi Pardiñas et al., 2005 (N=2), "Akodon" serrensis Thomas, 1902 (N=1), Bibimys chacoensis (Shamel, 1913) (N=1), Brucepattersonius sp. (N=9), Deltamys kempi Thomas, 1917 (N=14), Necromys lasiurus (Lund, 1841) (N=86), Oxymycterus misionalis Sanborn, 1931 (N=8), Oxymycterus rufus (Fischer, 1814) (N=201), Scapteromys aquaticus Thomas, 1920 (N=151) y Thaptomys nigrita (Lichtenstein, 1829) (N=20). Los especímenes procedieron de 41 localidades de siete provincias del este y noreste de la Argentina en donde la tribu Akodontini se encuentra bien representada: Buenos Aires, Chaco, Corrientes, Entre Ríos, Formosa, Misiones y Santa Fe (Apéndice 1).
Los nematodes fueron colectados del ciego e intestino grueso y conservados en alcohol 70%. Para su identificación, fueron aclarados en alcohol glicerinado y observados al microscopio óptico. Se realizaron dibujos con cámara clara, sobre los cuales fueron tomadas las medidas. Algunos ejemplares fueron deshidratados y tratados con la técnica de punto crítico para su estudio al microscopio electrónico de barrido (Jeol JSMT 100® y Jeol JSMT 6360 LV®). Se contabilizó el número de hospedadores parasitados por cada especie de Syphaciini para obtener los valores de prevalencia (Bush et al., 1997).
Los hospedadores estudiados se encuentran depositados en la Colección de Mastozoología del Museo de La Plata (MLP) y Colección de Mamíferos del CENPAT (CNP). Los nematodes Syphaciini hallados fueron depositados en la Colección Helmintológica del Museo de La Plata, La Plata (CHMLP).
Se mapeó la distribución de los nematodes Syphaciini sobre la filogenia de los roedores Akodontini obtenida por D'Elía (2003b). Además, se tuvieron en cuenta estudios taxonómicos y relaciones filogenéticas propuestas por Pardiñas et al. (2005), D'Elía et al. (2008) y Jayat et al. (2008) para los géneros Akodon, Necromys y Oxymycterus, respectivamente. Algunas de las especies presentes en la filogenia disponible de los Akodontini no fueron contempladas (i.e. Blarinomys breviceps [Winge, 1887], Kunsia spp.), otras estuvieron muy poco representadas en la muestra (i.e. Deltamys kempi, "Akodon" serrensis, Bibimys chacoensis, Bruceppatersonius spp.) y otras no tienen distribución en la Argentina (i.e. Juscelinomys spp., Lenoxus apicalis [J. A. Allen, 1900], Thalpomys spp.).
Considerando la correspondencia taxonómica obtenida (nematodes Syphaciini en roedores akodontinos), la especificidad hospedatoria y la información del contexto ecológico, se distinguieron las relaciones parásito-hospedador que podrían ser producidas por diferentes procesos evolutivos (Brooks y Mac Lennan, 1993; Page, 2003).
RESULTADOS
Dieciocho especies del género Syphacia Seurat, 1916 y una especie del género Caroloxyuris Jiménez Ruiz y Gardner, 2003 parasitan a roedores muroideos americanos (Apéndice 2). De estas 19 especies, 17 fueron incluidas en el análisis de especificidad mediante el índice STD. Syphacia obvelata y S. nigeriana no fueron consideradas en este análisis por registrarse en gran cantidad de especies hospedadoras y tener una amplia distribución geográfica, siendo alta la probabilidad de encontrar especies hospedatorias accidentales incluidas en ese rango. Entre los roedores se excluyeron del análisis Melanomys caliginosus Tomes, 1860 (mencionada como Oryzomys caliginosus por Quentin, 1969) especie hospedadora de Syphacia venteli y Oligoryzomys nigripes Olfers, 1818 (citado como Oryzomys nigripes por Quentin, 1969, 1971) y Sigmodontomys alfari Allen, 1897 (citado como Nectomys alfari por Quentin, 1969) especies hospedadoras de S. alata, debido a que en las publicaciones se mencionan muy pocos especímenes estudiados, tanto parásitos como hospedadores, generando dudas respecto de su correcta identificación.
La distribución de frecuencias indica que de las 17 especies analizadas, una (S. muris) se encontró en cuatro especies hospedadoras, dos (S. carlitosi y C. boliviensis) parasitaron a tres especies hospedadoras, cuatro (S. alata, S. criceti, S. megadeiros y S. peromysci) se hallaron en dos especies hospedadoras cada una y las restantes 10 especies del género Syphacia parasitaron a una sola especie hospedadora (Fig. 1). La alta frecuencia de STD=0 - 1 observada, indica que los nematodes Syphaciini son específicos a nivel de especie-género (Fig. 2), ya que la mayoría de las especies se hallaron en una única especie hospedadora (STD=0).

Fig. 1. Distribución de frecuencias de infección con Syphaciini de las 17 especies de roedores muroideos analizados.
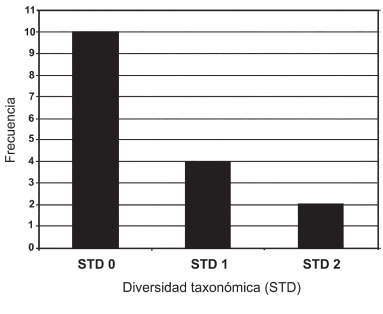
Fig 2. Distribución de frecuencias de los valores de STD.
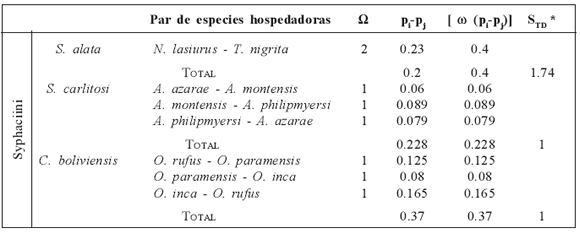
Siete de las 12 especies de roedores akodontinos examinados procedentes de 23 de las 41 localidades relevadas resultaron parasitadas con más de 2700 nematodes Syphaciini identificados como Syphacia carlitosi, S. alata, y Caroloxyuris boliviensis. La Tabla 1 muestra un resumen de los valores calculados para obtener el índice de especificidad hospedatoria STD* de estas tres especies de Syphaciini. Los valores obtenidos fueron de STD* =1 y 1.74, indicando que estas especies parasitan principalmente hospedadores del mismo género. En la Fig. 3 se observa la distribución de las tres especies de nematodes halladas sobre la filogenia de los hospedadores (D'Elía, 2003b), considerando además, información taxonómica y filogenética de otros estudios (Pardiñas et al., 2005; D'Elía et al., 2008; Jayat et al., 2008). Syphacia carlitosi se encuentra en A. montensis, A. azarae y A. philipmyersi, reflejando su especificidad a nivel genérico. Syphacia alata se encontró en dos especies pertenecientes a géneros distintos, N. lasiurus (= N. benefactus y N. temchuki) y T. nigrita, sin embargo puede observarse que ambos géneros se encuentran en el mismo clado. De esta forma, las dos especies de Syphacia mencionadas encuentran una correspondencia con cada uno de los clados más inclusivos dentro de la división Akodon (D'Elía, 2003b). Caroloxyuris boliviensis parasita a O. rufus, O. paramensis Thomas, 1902 y O. inca Thomas, 1900 los cuales se encuentran en el clado que se corresponde con la división Oxymycterus. A partir de los especímenes revisados de Brucepattersonius y Scapteromys se sugiere que los nematodes Syphaciini estarían ausentes en las divisiones Blarinomys y Scapteromys.
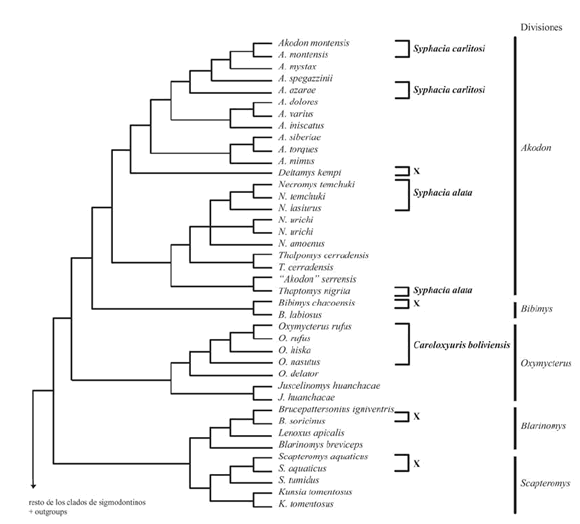
Fig. 3. Distribución de los Syphaciini sobre una hipótesis filogenética para los roedores Akodontini (esta última, extraída y levemente modificada de D'Elía, 2003b:fig.1).
Tabla 1 Índice STD * calculado para cada especie parásita hallada en roedores akodontinos de la Argentina
DISCUSIÓN
Los valores de STD obtenidos para la mayoría de las especies fueron menores a los valores de STD* registrados para las tres especies parásitas halladas en diferentes especies de akodontinos procedentes de una amplia área de distribución en el este-noreste argentino (STD=0 y STD*=1-1.74). Probablemente esto se deba a que la mayoría de las especies de Syphaciini registradas para roedores muroideos americanos fueron descriptas como resultado de estudios realizados en áreas acotadas y sobre pocas especies hospedadoras. En contraste, en esta investigación se estudió un gran número de especies de roedores sigmodontinos presentes en un área extensa, lo cual permitió observar la real distribución de las especies parásitas y confirmar con mayor precisión las asociaciones con los hospedadores presentes. La comparación de los resultados de ambos índices demuestra que si bien es poco probable que el rango de hospedadores sea ampliado considerablemente, es posible que los valores de STD y STD* para cada especie parásita aumenten levemente luego que estudios más profundos incluyan la prospección de un mayor número de especies hospedadoras en un área dada. Otros sesgos en la estimación de la especificidad hospedatoria pueden ser introducidos con la posibilidad de errores en la identificación taxonómica de las especies parásitas y hospedadoras (Wisnivesky, 2003).
En este sentido, se encuentran en progreso diferentes estudios relacionados con la revisión taxonómica, incluyendo estudios moleculares, de diferentes especies de Syphaciini, así como con la revalidación y sinonimia de no pocas especies de roedores.
A partir del análisis de los resultados con relación a la correspondencia observada, la especificidad hospedatoria y su integración con los conocimientos taxonómicos y ecológicos de la asociación Syphaciini-Akodontini, se sugieren a continuación los posibles eventos evolutivos intervinientes en la distribución de las especies parásitas sobre sus hospedadores.
La correspondencia parásito-hospedador, el alto grado de especificidad hospedatoria y la alta frecuencia y abundancia de especímenes de cada especie en los roedores estudiados, muestran indicios de una posible coespeciación entre las especies de Syphaciini y el género hospedador parasitado. En esta instancia puede sugerirse un retraso en la especiación de Syphaciini con respecto a la especiación de sus hospedadores (especie parásita-género hospedador) (Brooks y Mac Lennan, 1993).
Es importante considerar que la escasa captura de ejemplares de Deltamys kempi, refleja una baja densidad de individuos en las localidades seleccionadas. De esta forma, debe contemplarse la posibilidad que el número de hospedadores disponibles en el área sea más bajo que el requerido por el parásito para establecerse en la población hospedadora (e.g. missing the boat), o bien entender que la ausencia de S. carlitosi en D. kempi se debe a un error de muestreo y que la especie está presente pero aún no ha sido detectada (x-event) (Paterson et al., 2003).
De todas las especies de muroideos consideradas en el presente estudio, el género Oxymycterus es el único que presenta una especie parásita perteneciente a un género diferente de Syphacia (Caroloxyuris boliviensis-género monotípico). Si bien la ubicación de Oxymycterus ha fluctuado a nivel tribal, su establecimiento entre los sigmodontinos no fue puesto en duda. Entonces, es factible que esta distribución responda a un cambio de hospedador (host switching) anterior a la diversificación del género Oxymycterus. En este caso, debe asumirse la posibilidad de una superioridad competitiva de Caroloxyuris respecto a Syphacia o la existencia de un nicho disponible, ya sea por una previa extinción o por otras causas.
Como resultado de la competencia interespecífica, una especie parásita puede disminuir su abundancia hasta que la dificultad de establecerse en una especie hospedadora se convierta en una barrera, traduciéndose como una extinción (Paterson et al., 2003; Ronquist, 2003). En este sentido, pudo observarse la ausencia de Syphaciini en Scapteromys y ello podría relacionarse con la presencia de otro nematode, Nematomystes spp. (Aspidoderidae-Ascaridida), que ocupa el mismo nicho. Por otra parte, también podría sugerirse que los nematodes Syphaciini se diversificaron en el resto de los linajes pero no en el de Scapteromys y Blarinomys, reflejando un posible evento de "missing the boat" (Paterson et al., 2003; Ronquist, 2003).
Si bien este estudio esta acotado a un grupo particular de roedores, los mismos se revelan como hospedadores habituales de nematodes Syphaciini, a la vez que exhiben un significativo grado de correspondencia entre género hospedador-especie parásita. Así, los roedores Akodontini mostraron que los Syphaciini acompañaron la diversificación de sus hospedadores. De este modo, aunque los resultados obtenidos están sujetos a cambios con la producción de nueva y mayor información sobre especies parásitas y hospedadoras, el presente estudio constituye un sustancial aporte al conocimiento de la especificidad de los nematodes Syphaciini, al tiempo que representa el primero realizado sobre nematodes en la Argentina, afirmándose su potencial como posibles marcadores específicos de sus hospedadores.
Finalmente, debe entenderse que lo referido previamente constituye un punto de partida para analizar los procesos co-evolutivos y en la medida que se obtengan las filogenias de los parásitos y se cuente con la de sus hospedadores, se podrán realizar aproximaciones más rigurosas sobre la temática.
Listado de las localidades de los roedores prospectados. Las mismas se brindan en orden alfabético para cada especie de roedor, indicando coordenadas geográficas, departamento o partido, provincia y colección (acrónimo entre paréntesis). Los acrónimos empleados corresponden a: CNP (Centro Nacional Patagónico), MLP (Museo de La Plata) y Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" (MACN).
Akodon azarae: 17 km O-SO de Colonia Villafañe, Dto. Pirané, Formosa, 26° 12' S, 59° 15' O (CNP); A° Caraballo, Dto. Colón, Entre Ríos, 32° 05' S, 58° 10' O (MLP); A° Feliciano, Dto. Feliciano, Entre Ríos, 30° 22' S, 58° 45' O (MLP); Balneario Bagliardi, Pdo. de Berisso, Buenos Aires, 34° 54' S, 57° 48' O (MLP); Cerro de la Gloria, Pdo. de Catelli, Buenos Aires, 36° 06' S, 57° 46' O (MLP); Estación Biológica Corrientes, Dto. Capital, Corrientes, 27°33'01"S, 58°40'42"O (CNP); Estancia San Juan Poriahú, Dto. San Miguel, Corrientes, 27° 42' S, 57° 12' O (MLP, CNP); J. B. Molina, Dto. Constitución, Santa Fe, 33° 29' S, 60° 57' O (MLP); La Balandra, Pdo. de Berisso, Buenos Aires, 34° 56' S, 57° 42' O (MLP); Maciel, Dto. San Jerónimo, Santa Fe, 32° 28' S, 60° 53' O (MLP); Margen izquierda río Bermejo, confluencia con el arroyo Correntoso, Dto. Pirané, Formosa, 26° 19' S, 59° 06' O (CNP); Máximo Paz, Dto. Constitución, Santa Fe, 33° 29' S, 60° 57' O (MLP); Oliveros, Dto. Iriondo, Santa Fe, 32° 342 S, 60° 51' O (MLP); Paraje Atalaya, Dto Santo Tomé, Corrientes, 28° 30' S, 56° 02' O (CNP); Pergamino, Pdo. de Pergamino, Buenos Aires, 33° 532 S, 60° 34' O (MLP); Punta Indio, Pdo. de Punta Piedras, Buenos Aires, 35° 16' S, 57° 15' O (MLP, CNP); Reserva Natural de Hudson, Pdo. de Berazategui, Buenos Ares, 34° 45' S, 58° 06' O (MLP); Reserva Selva Marginal de Punta Lara, Pdo. de Ensenada, Buenos Aires, 34° 47' S, 58° 01' O (MLP); Reserva Natural de Otamendi, Pdo. de Campana, Buenos Aires, 34° 09' S, 58° 57' O (MLP); Rojas, Pdo. de Rojas, Buenos Ares, 34° 11' S, 60° 44' O (MLP); San Nicolás, Pdo. de San Nicolás de los Arroyos, Buenos Ares, 33° 192 S, 60° 13' O (MLP); Selvas del Río de Oro, Dto. Libertador General San Martín, Chaco, 26° 47' S, 58° 57' O (CNP); Villa Elisa, Dto. de Colón, Entre Ríos, 32° 08' S, 58° 24' O (CNP); Zárate, Pdo. de Campana, Buenos Aires, 34° 10' S, 58° 55' O (MLP).
Akodon montensis: 2 km aguas abajo desembocadura del A° Paranay-Guazú, Caraguatay, Dto. Montecarlo, Misiones, 26° 40' S, 54° 50' O (CNP); 6 km NE A° Paraíso sobre RP 2, Dto. Guaraní, Misiones, 27° 12' S, 54° 01' O (CNP); Arroyo Salamanca, Reserva Natural Solar del Che, Caraguatay, Dto. Montecarlo, Misiones, 26° 36' S, 54° 46' O (CNP); Balneario Municipal de Aristóbulo del Valle sobre el arroyo Cuña Pirú, 10 km al NNO de Aristóbulo del Valle, Dto. Cainguás, Misiones, 27° 05' S, 54° 57' O (MLP, CNP); Club de Pesca A° Paranay-Guazu, Caraguatay, Dto. Montecarlo, Misiones, 26° 40' S, 54° 48' O (CNP); Posada "Las Malvinas", RP 2 km. 4, Dto. Guaraní, Misiones, 27° 14' S, 54° 01' O (CNP); Puerto Península, Dto Iguazú, Misiones, 25° 40' S, 54° 38' O (MLP); Salto El Paraíso, A° Paraíso, Dto. Guaraní, Misiones, 27° 13' S, 54° 02' O (CNP).
Akodon philipmyersi: Estancia Santa Inés RP 105 km 10, Dto. Capital, Misiones, 27° 31' S, 55° 52' O (CNP).
"Akodon" serrensis: 6 km NE A° Paraíso sobre RP 2, Dto. Guaraní, Misiones, 27° 12' S, 54° 01' O (CNP).
Bibimys chacoensis: Cancha Larga, Dto. Bermejo, Chaco, 27° 04' S, 58° 43' O (CNP).
Brucepattersonius sp.: 6 km NE A° Paraíso sobre RP 2, Dto. Guaraní, Misiones, 27° 12' S, 54° 01' O (CNP); Balneario Municipal de Aristóbulo del Valle sobre el arroyo Cuña Pirú, 10 km al NNO de Aristóbulo del Valle, Dto. Cainguás, Misiones, 27° 05' S, 54° 57' O (MLP, CNP); Salto El Paraíso, A° Paraíso, Dto. Guaraní, Misiones, 27° 13' S, 54° 02' O (CNP).
Deltamys kempi: Balneario Bagliardi, Pdo. de Berisso, Buenos Aires 34° 54' S, 57° 48' O (CNP); La Balandra, Pdo. de Berisso, Buenos Aires 34° 56' S, 57° 42 'O (CNP); Reserva Costanera sur, Ciudad autónoma de Buenos Aires, Buenos Aires 34° 36' S, 58° 27' O (MACN); Reserva Natural de Hudson, Pdo. de Berazategui, Buenos Ares 34° 45' S, 58° 06' O (MLP); Reserva Selva Marginal de Punta Lara, Pdo. de Ensenada, Buenos Aires 34° 47' S, 58° 01' O (MLP).
Necromys lasiurus: 17 km O-SO de Colonia Villafañe, Dto. Pirané, Formosa, 26° 12' S, 59° 15' O (CNP); Estación Biológica Corrientes, Dto. Capital, Corrientes, 27° 33' S, 58° 40' O (CNP); Estancia Santa Inés RP 105 km 10, Dto. Capital, Misiones, 27° 31' S, 55° 52' O (CNP); Finca La Adelita, Laguna Paiva, Dto. Capital, Corrientes, 27° 28' S, 58° 44' O (CNP); Maciel, Dto. San Jerónimo, Santa Fe, 32° 28' S, 60° 53' O (MLP); Oliveros, Dto. Iriondo, Santa Fe, 32° 34 2 S, 60° 51' O (MLP); Pergamino, Pdo. de Pergamino, Buenos Aires, 33° 532 S, 60° 34' O (MLP); Rojas, Pdo. de Rojas, Buenos Aires, 34° 11' S, 60° 44' O (MLP); Uranga, Dto. Rosario, Santa Fe, 33° 162 S, 60° 42' O (MLP).
Oxymycterus misionalis: Balneario Municipal de Aristóbulo del Valle sobre el arroyo Cuña Pirú, 10 km al NNO de Aristóbulo del Valle, Dto. Cainguás, Misiones, 27° 05' S, 54° 57' O (MLP, CNP).
Oxymycterus rufus: A° Caraballo, Dto. Colón, Entre Ríos, 32° 05 S, 58° 10' O (CNP); Balneario Bagliardi, Pdo. de Berisso, Buenos Aires, 34° 54' S; 57° 48' O (MLP); Costa Rio Uruguay, Dto. Colón, Entre Ríos, 32° 04' S, 58° 10' O (CNP); Finca La Adelita, Laguna Paiva, Dto. Capital, Corrientes, 27° 28' S, 58° 44' O (CNP); Estación Biológica Corrientes, Dto. Capital, Corrientes, 27° 33' S, 58° 40' O (CNP); Estancia San Juan Poriahú, Dto. San Miguel, Corrientes, 27° 42' S, 57° 12' O (MLP, CNP); La Balandra, Pdo. de Berisso, Buenos Ares, 34° 56' S; 57° 42' O (MLP); Puente Yunque, Dto. Esquina, Corrientes, 29° 09' S, 59° 15' O (CNP); Reserva Natural de Hudson, Pdo. de Berazategui, Buenos Ares, 34° 45' S; 58° 06' O (MLP); Reserva Natural de Otamendi, Pdo. de Campana, Buenos Ares, 34° 09' S; 58° 57' O (MLP); Reserva Selva Marginal de Punta Lara, Pdo. de Ensenada, Buenos Ares, 34° 47' S; 58° 01' O (MLP).
Scapteromys aquaticus: 17 km O-SO de Colonia Villafañe, Dto. Pirané, Formosa, 26° 12' S, 59° 15' O (CNP); Balneario Bagliardi, Pdo. de Berisso, Buenos Aires, 34° 54' S; 57° 48' O (MLP); Palo Blanco, Pdo. de Berisso, Buenos Aires, 34° 53' S; 57° 50' O (MLP); Reserva Natural de Hudson, Pdo. de Berazategui, Buenos Ares, 34° 45' S; 58° 06' O (MLP); Reserva Selva Marginal de Punta Lara, Pdo. de Ensenada, Buenos Aires 34° 47' S; 58° 01' O (MLP); Reserva Natural de Otamendi, Pdo. de Campana, Buenos Aires, 34° 09' S; 58° 57' O (MLP); Selvas del Río de Oro, Dto. Libertador General San Martín, Chaco, 26° 47' S, 58° 57' O (CNP).
Thaptomys nigrita: 2 km aguas abajo desembocadura del A° Paranay-Guazú, Caraguatay, Dto. Montecarlo, Misiones, 26° 40' S, 54° 50' O (CNP); Arroyo Salamanca, Reserva Natural Solar del Che, Caraguatay, Dto. Montecarlo, Misiones, 26° 36' S, 54° 46' O (CNP); Balneario Municipal de Aristóbulo del Valle sobre el arroyo Cuña Pirú, 10 km al NNO de Aristóbulo del Valle, Dto. Cainguás, Misiones, 27° 05' S, 54° 57' O (MLP, CNP); Posada "Las Malvinas", RP 2 km. 4, Dto. Guaraní, Misiones, 27° 14' S, 54° 01' O (CNP).
Listado, ordenado alfabéticamente, de las 19 especies de Syphaciini halladas en roedores muroideos americanos, indicando referencias bibliográficas entre paréntesis.
Caroloxyuris boliviensis Jiménez Ruiz y Gardner, 2003 (Jiménez Ruiz et Gardner, 2003); Syphacia alata Quentin, 1968 (Quentin, 1968; 1969; 1971); S. arctica Tiner y Rausch, 1950 (Tiner y Rausch, 1950; Quentin, 1971); S. carlitosi Robles y Navone, 2007a (Robles y Navone, 2007a); S. criceti Quentin, 1969 (Quentin, 1969; Quentin, 1971); S. evaginata Hugot y Quentin, 1985 (Hugot y Quentin, 1985); S. kinsellai Robles y Navone, 2007b (Robles y Navone, 2007b); S. megadeiros Quentin, 1969 (Quentin, 1969; Quentin, 1971); S. mesocriceti Quentin, 1971 (Quentin, 1971; Dick et al., 1973); S. muris (Yamaguti, 1935) (Vicente et al., 1997; Smales, 1997; Quentin y Kinsella, 1972; Hugot y Quentin, 1985; Pinto et al., 2001; Robles et al., 2008) ; S. nigeriana Baylis, 1928 (Baylis, 1928; Quentin, 1971; Ogden, 1971; Wiger et al., 1978; Hugot, 1988); S. obvelata (Rudolphi, 1802) (Erickson, 1938; Hussey, 1957; Quentin y Kinsella, 1972; Vicente et al., 1997; Landaeta-Aqueveque et al., 2008); S. odilbaine Hugot y Quentin, 1985 (Hugot y Quentin, 1985); S. oryzomyos Quentin y Kinsella, 1972 (Quentin, y Kinsella, 1972); S. peromysci Harkema, 1936 (Harkema, 1936; Kruidenier et al., 1961; Quentin y Kinsella, 1972) ; S. petrusewiczi Quentin, 1969 (Quentin, 1969; Quentin 1971); S. phyllotios Quentin et al., 1979 (Quentin et al., 1979); S. sigmodoni Quentin y Kinsella, 1972 (Quentin, y Kinsella, 1972); S. venteli Travassos, 1937 (Travassos, 1937; Quentin, 1969; Robles y Navone, 2010).
AGRADECIMIENTOS
Este estudio fue desarrollado en el marco del trabajo de tesis doctoral "Nematodes Oxyuridae, Trichuridae y Capillariidae en roedores Akodontini (Cricetidae, Sigmodontinae) de la Cuenca del Plata (Argentina): su importancia en la interpretación de las relaciones parásito-hospedador-ambiente" presentada en la Facultad de Ciencias Naturales y Museo, Universidad Nacional de La Plata (UNLP). Esta investigación ha podido llevarse a cabo gracias a la cooperación de numerosas personas a través de varios años. En principio agradecer a Graciela Navone y Ulyses Pardiñas quienes como mis directores guiaron y enriquecieron significativamente este trabajo; a Guillermo D'Elía y a los revisores anónimos por sus valiosas sugerencias. A todos los que contribuyeron desinteresadamente con el aporte de roedores para su prospección: U. Pardiñas, G. Navone, Marcela Lareschi, Carlos Galliari, Sebastián Cirignoli, Darío Podestá, Juliana Notarnicola, Mariano Merino, Daniel Udrizar Sauthier, Walter Udrizar Sauthier, Agustín Abba, Gladys Calderón, Pablo Teta y Olga Suarez. En especial mi profundo agradecimiento a U. Pardiñas, C. Galliari, S. Cirignoli y M. Merino por la identificación de los roedores estudiados. Este trabajo ha sido financiado por CONICET (PIP 3000, 6179), UNLP (N392, N520, JI 2007) y ANPCyT (33019).
LITERATURA CITADA
1. ADAMSON ML y JN CAIRA. 1994. Evolutionary factors influencing the nature of parasite specificity. Parasitology 109:S85-S95. [ Links ]
2. BAYLIS HA. 1928. On a collection of Nematodes from Nigerian Mammals (Chiefly Rodents). Parasitology 20:280-304. [ Links ]
3. BROOKS D y DA McLENNAN. 1993. Parascript: Parasites and the Language of Evolution. Smithsonian Institution Press, Washington and London 430 pp. [ Links ]
4. BUSH AO, KD LAFFERTY, JM LOTZ y AW SHOSTAK. 1997. Parasitology meets ecology on its own terms: Margolis et al. revisited. Journal of Parasitology 83:575-583. [ Links ]
5. CLAYTON DH, S ALTAMIMI y KP JOHNSON. 2003. The ecological basis of the coevolutionary history. Pp. 310-343, en: Tangled trees, Phylogeny, Cospeciation and Coevolution (RDM Page, ed.). The University of Chicago Press, Chicago, London. [ Links ]
6. D'ELÍA G. 2003a. Rats, mice, and relatives IV: Sigmodontinae. Pp. 263-279, en: Grzimek's animal life encyclopedia (M Hutchins, V Geist, D Kleiman y M McDade, eds.). Thomson-Gale, Farmington Hills, Michigan. [ Links ]
7. D'ELÍA G. 2003b. Phylogenetics of Sigmodontinae (Rodentia, Muroidea, Cricetidae), with special reference to the akodont group, and with additional comments on historical biogeography. Cladistics 19:307-323. [ Links ]
8. D'ELÍA G, UFJ PARDIÑAS, JP JAYAT y J SALAZAR BRAVO. 2008. Systematics of Necromys (Rodentia, Cricetidae, Sigmodontinae): species limits and groups, with comments on historical biogeography. Journal of Mammalogy 89:778-790. [ Links ]
9. DICK TA, JC QUENTIN y RS FREEMAN. 1973. Redescription of Syphacia mesocriceti (Nematoda: Oxyuroidea) parasite of golden hamster. Journal of Parasitology 59:256-259. [ Links ]
10. ERICKSON AB. 1938. Parasites of some Minesota Cricetidae and Zapodidae and host catalogue of Helminth parasites of native American mice. The American Midland Naturalist 20:575-589. [ Links ]
11. HARKEMA R. 1936. The parasite of some North Carolina rodents. Ecological Monography 6:151-232. [ Links ]
12. HOBERG EP. 1992. Congruent and synchronic patterns in biogeography and speciation among seabirds, pinnipeds, and cestodes. Journal of Parasitology 78:601-615. [ Links ]
13. HOBERG E, DR BROOKS y D SIEGEL-CAUSEY. 1997. Host-parasite cospeciation: History, principles, and prospects. Pp. 212-235, en: Host-parasite evolution: General principles and avian models (DH Clayton y J Moore, eds.). Oxford University Press, Oxford. [ Links ]
14. HUGOT JP. 1988. Les Nematodes Syphaciinae parasites de Rongeurs et de Lagomorphes. Taxonomie, Zoogeographie, Evolution. Bulletin du Muséum National d'Histoire Naturelle série A 141:1-153. [ Links ]
15. HUGOT JP. 2002. New evidence of hystricognath rodents monophyly from the phylogeny of their pinworms. Pp.144-173, en: Tangled Trees: Phylogeny, Cospeciation and Coevolution (RDM Page, ed.). The University of Chicago press, Chicago, London. [ Links ]
16. HUGOT JP. y JC. QUENTIN. 1985. Etude morphologique de six espèces nouvelles ou peu connues appartenant au genre Syphacia (Oxyuridae, Nematoda), parasites de Rongeurs Cricétidés et Muridés. Bulletin du Muséum National D'Histoire Naturelle 4 série 2:383-400. [ Links ]
17. HUSSEY KI. 1957. Syphacia muris vs. S. obvelata in laboratory rats and mice. Journal of Parasitology 43:555-559. [ Links ]
18. JAYAT JP, G D'ELÍA, UFJ PARDIÑAS, MD MIOTTI y PE ORTIZ. 2008. A new species of the genus Oxymycterus (Mammalia: Rodentia: Cricetidae) from the vanishing Yungas of Argentina. Zootaxa 1911:31-51. [ Links ]
19. JIMÉNEZ RUIZ FA y SL GARDNER. 2003. The nematode fauna of long-nosed mice Oxymycterus spp. from the Bolivian yungas. Journal of Parasitology 89:299-308. [ Links ]
20. KRUIDENIER FJ, K MEHRA y R HARKEMA. 1961. Comparative studies of Syphacia peromysci and S. samarodini (Nematoda, Oxyurida). Journal of Para-sitology 47:47-51. [ Links ]
21. KRASNOV BR, R POULIN y S MORAND. 2006. Patterns of macroparasite diversity in small mammals. Pp. 197-231, en: Micromammals and Macroparasites (S Morand, BR Krasnov y R Poulin, eds.). Springer, New York. [ Links ]
22. LANDAETA-AQUEVEQUE CA, MdR ROBLES y PE CATTAN. 2008. The community of gastrointestinal helminths in the housemouse, Mus musculus, in Santiago, Chile. Parasitologia Latinoamericana 62:165-169. [ Links ]
23. LYMBERY AJ. 1989. Host specificity, host range, and host preference. Parasitology Today 5:298. [ Links ]
24. NIEBERDING CM. y S MORAND. 2006. Comparative phylogeography: The use of parasites for insights into host history. Pp. 277-293, en: Micromammals and Macroparasites (S Morand, BR Krasnov y R Poulin, eds.). Springer, New York. [ Links ]
25. OGDEN CG. 1971. Observations in the systematics of nematodes belonging to the genus Syphacia Seurat, 1916. The Bulletin of the British Museum of Natural History 20:255-291. [ Links ]
26. PAGE RDM. 2003. Tangled trees: Phylogeny, cospeciation, and coevolution. Chicago University Press, Chicago, 350 pp. [ Links ]
27. PARDIÑAS UFJ, G D'ELÍA, S CIRIGNOLI y P SUÁREZ. 2005. A new species of Akodon (Rodentia, Cricetidae) from the Northern Campos Grasslands of Argentina. Journal of Mammalogy 86:462-474. [ Links ]
28. PARDIÑAS UFJ, G D'ELÍA, P TETA, PE ORTIZ, PJ JAYAT y S CIRIGNOLI. 2006. Subfamilia Sigmodontini, Tribu Akodontini. En: Mamíferos de Argentina, Sistemática y Distribución (RM Barquez, MM Díaz y RA Ojeda, eds.). Tucumán, Argentina, pp. 146-202. [ Links ]
29. PATERSON AM, RL PALMA y RD GRAY. 2003. Drowning on arrival, missing the boat, and x-events: how likely are sorting events? En: Tangled trees: Phylogeny, cospeciation, and coevolution. (RD Page, ed.). Chicago, EEUU, pp. 287-307. [ Links ]
30. PINTO RM, L GONÇALVES, D NORONHA y D CORREA GOMES. 2001. Worm burdens in out-bred and inbred laboratory rats with morphometric data on Syphacia muris (Yamaguti, 1935) Yamaguti, 1941 (Nematoda, Oxyuridea). Memoires do Instituto Oswaldo Cruz 96:133-136. [ Links ]
31. POULIN R. 1998. Evolutionary ecology of parasites. From individual to communities. Chapman y Hall [ciudad]. [ Links ]
32. POULIN R y D MOUILLOT. 2003. Parasite specialization from a phylogenetic perspective: A new index of host specificity. Parasitology 126:473-480. [ Links ]
33. POULIN R y D MOUILLOT. 2004. The relationship between specialization and local abundance: the case of helminth parasites of birds. Oecologia 140:372-378. [ Links ]
34. POULIN R y D MOUILLOT. 2005. Combining phylogenetic and ecological information into a new index of host specificity. Journal of Parasitology 91:511-514. [ Links ]
35. POULIN R, BR KRASNOV y S MORAND. 2006. Patterns of host specificity in parasites exploiting small mammals. Pp. 233-256, en: Micromammals and Macroparasites (S Morand, BR Krasnov y R Poulin, eds.). Springer, New York. [ Links ]
36. QUENTIN JC. 1968. Description de Syphacia (Syphacia) alata n. sp., oxyure parasite du rongeur cricetidae Zygodontomys lasiurus (Lund, 1839). Bulletin du Muséum National D'Histoire Naturelle 2 série 4:807-813. [ Links ]
37. QUENTIN JC. 1969. Etude de nématodes Syphacia parasites de Rongeurs Cricetidae sudaméricains et de leurs corrélations biogéographiques avec certaines espèces néartiques. Bulletin du Muséum National D'Histoire Naturelle 2 série 4:909-925. [ Links ]
38. QUENTIN JC. 1971. Morphologie comparée des structures céphaliques et genitales des Oxyures du genre Syphacia. Annales de Parasitologie 46:15-60. [ Links ]
39. QUENTIN JC y JM. KINSELLA. 1972. Etude de trois espèces d'Oxyures Syphacia parasites de Rongeurs Cricétidés nord-américains. Annales de Parasitologie 47:717-733. [ Links ]
40. QUENTIN JC, BB BABERO y PE CATTAN. 1979. Helminthofaune du Chili. V Syphacia (Syphacia) phyllotios n. sp., nouvel Oxyure parasite d´un Rongeur Cricétidé au Chili. Bulletin du Muséum National D'Histoire Naturelle 4 série 2:323-327. [ Links ]
41. ROBLES MdR y GT NAVONE. 2007a. A new species of Syphacia (Nematoda: Oxyuridae) from Akodon azarae (Rodentia: Cricetidae) in Argentina. Journal of Parasitology 93:383-391. [ Links ]
42. ROBLES MdR y GT NAVONE. 2007b. A new species of Syphacia (Nematoda: Oxyuridae) from Oligoryzomys nigripes (Rodentia: Cricetidae) in Argentina. Parasitology Research 101:1069-1075. [ Links ]
43. ROBLES MdR y GT NAVONE. 2010. Redescription of Syphacia venteli Travassos, 1937 (Nematoda: Oxyuridae) from Nectomys squamipes in Argentina and Brazil and description of a new species of Syphacia from Melanomys caliginosus in Colombia. Parasitology Research 106:1117-26. [ Links ]
44. ROBLES MdR, GT NAVONE y IE GÓMEZ VILLAFAÑE. 2008. New morphological details and first records of Heterakis spumosa and Syphacia muris from Argentina. Comparative Parasitology 75:145-149. [ Links ]
45. ROHDE K. 1980. Diversity gradients of marine Monogenea in the Atlantic and Pacific Oceans. Experientia 36:1368-1369. [ Links ]
46. ROHDE K. 1993. Ecology of Marine Parasites, 2nd ed. CAB International, Wallingford. [ Links ]
47. RONQUIST F. 2003. Parsimony analysis of coevolving species associations. Pp. 22-64, en: Tangled trees: Phylogeny, cospeciation, and coevolution (RDM Page, ed.). University of Chicago Press, Chicago. [ Links ]
48. SMALES LR. 1997. A Review of the Helminth Parasites of Australian Rodents. Australian Journal of Zoology 45:505-521. [ Links ]
49. TINER JD y RL RAUSCH. 1950. Two new Syphacia (Nematoda, Oxyuridae) and observations of the inner circle circumoral papillae in North American species of the genus. Natural History Miscellaneous 30:202-203. [ Links ]
50. TRAVASSOS L. 1937. Contribuçao ao conhecimiento da Phylogynia dos Oxyuridae (Nematoda). Memorias do Instituto Oswaldo Cruz 32:607-613. [ Links ]
51. VICENTE JJ, H DE OLIVEIRA RODRÍGUES, D CORREA GOMES y RM PINTO. 1997. Nematoides do Brasil. Parte V: Nematoides de mamiferos. Revista Brasileira de Zoología 14:1-452. [ Links ]
52. WIGER R, V BARUS y F TENORA. 1978. Scanning electron microscopic studies on four species of genus Syphacia (Nematoda, Oxyuridae). Zoologica Scripta 7:25-31. [ Links ]
53. WILSON DE y DM REEDER. 2005. Mammal Species of the World. A Taxonomic and Geographic Reference. 3rd Edition. The Johns Hopkins University Press, Baltimore. [ Links ]
54. WISNIVESKY C. 2003. Ecología y epidemiología de las infecciones parasitarias. Libro Universitario Regional, Costa Rica. [ Links ]














