Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Mastozoología neotropical
versão impressa ISSN 0327-9383
Mastozool. neotrop. vol.18 no.1 Mendoza jan./jun. 2011
ARTICULOS Y NOTAS
Densidad poblacional de Saguinus leucopus en remanentes de bosque con diferentes características físicas y biológicas
Néstor J. Roncancio1,3, William Rojas2 y Thomas Defler3
1 WCS, Wildlife Conservation Society - Programa Colombia, Carrera 25 número 4-39, Santiago de Cali, Valle del Cauca, Colombia [Correspondencia: Néstor Roncancio <nroncancio@wcs.org>].
2 Programa de Biología, Facultad de Ciencias Exactas, Físicas y Naturales, Universidad de Caldas, Calle 65 # 26 - 10, Manizales, Caldas, Colombia.
3 Maestría en Ciencias-Biología, Facultad de Ciencias, Universidad Nacional de Colombia, Carrera 45 # 26-85, Bogotá D.C., Colombia.
RESUMEN: Saguinus leucopus es un primate endémico de Colombia, con un área de distribución restringida, localizada en la región central de los Andes, entre los 0 y los 1500 msnm. Esta es una de las regiones en donde se ha perdido mayor cantidad de hábitat, producto de las actividades humanas. La limitada distribución de esta especie, la reducción y fragmentación de su hábitat, son los principales factores por los cuales está actualmente categorizada como una especie en peligro de extinción. Con el objetivo de entender cómo S. leucopus ha respondido a la reducción y fragmentación del hábitat, se comparó su densidad poblacional en siete remanentes de bosque sometidos a diferentes grados y tipos de alteración. Igualmente, se evaluó la relación de la densidad poblacional del primate con el tamaño, la forma, la distancia de aislamiento y la altitud sobre el nivel del mar, y se evaluó su asociación con la estructura y composición vegetal de los sitios evaluados. Empleando el método de muestreo por distancias con transectos lineales, se estimaron densidades poblacionales con valores desde 37 hasta 149 individuos por km2. Se encontraron diferencias significativas en la densidad entre algunas localidades, formando tres grupos homogéneos. Se encontró que la densidad poblacional de S. leucopus aumentó a mayor altitud sobre el nivel del mar y en los remanentes con formas más alargadas. No hubo asociación significativa de la densidad del primate con la estructura y la diversidad vegetal.
ABSTRACT: Population density of Saguinus leucopus in forest remnants with different physical and biological features. Saguinus leucopus is an endemic primate of Colombia. It has a very small distribution on the Andean region of Colombia from 0 to 1500 m asl. This is one of the regions where more habitats are lost by human activities. S. leucopus is an endangered species because of its small distribution area and habitat loss. Our first goal was to compare the population density of S. leucopus in forest patches of different alteration level. The second goal was to evaluate the relationship between population density and the size, isolation distance, shape and altitude of the patches. The final goal was to evaluate its association with plant diversity, and tree density of the forest patches. Population density was estimated using distance sampling with line transect. The population densities were 37 to 149 Individual / km2. We found differences between some patches. Population densities of S. leucopus in the seven patches were separated into three homogeneous groups. Using Poisson regression, we found that population density of S. leucopus increases at higher altitudes and when the patch is more elongated. There was not significant association between population density and plant diversity and structure.
Palabras clave. Densidad poblacional; Saguinus leucopus.
Key words. Population density; Saguinus leucopus.
INTRODUCCIÓN
Las poblaciones normalmente muestran fluctuaciones temporales y espaciales debidas a variaciones en factores relacionados básicamente con la disponibilidad de recursos o factores ambientales (Coulson et al., 2001; Rudran y Fernández-Duque, 2003). Estas variaciones se verán reflejadas en cambios en las tasas de natalidad y mortalidad. Si hay una sucesión de factores que lleven a una disminución de la población (por alta mortalidad de adultos y bajo reclutamiento), las poblaciones grandes pueden eventualmente recuperarse pero una población pequeña tiene altas probabilidades de extinguirse (Lovejoy et al., 1986; Schwarzkopf y Rylands, 1989; Estrada y Coates-Estrada, 1996; Chiarello y De Melo, 2001). Por otro lado las poblaciones pequeñas pueden verse removidas completamente por eventos estocásticos súbitos como cambios ambientales o epidemias (Rudran y Fernández-Duque, 2003).
Saguinus leucopus es un primate endémico de Colombia y en peligro de extinción (Morales-Jiménez et al., 2008). Este primate se distribuye en la región Andina por debajo de los 1500 msnm, entre el bajo río Cauca y el río Magdalena en los departamentos de Bolívar, Antioquia, Caldas y el norte del Tolima (Fig. 1). Su distribución ocupa un área aproximada de 29 000 km2, la más pequeña para todas las especies de Saguinus (Defler, 2004). La cobertura vegetal en su área de distribución, principalmente bosques húmedos tropicales, se ha disminuido en un 85%. Del bosque nativo remanente, un 80% es bosque en regeneración en diferentes estados de sucesión (Etter et al., 2005).
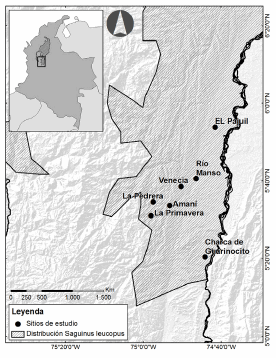
Fig. 1. Área de estudio. Sector sur de la distribución de Saguinus leucopus. Margen izquierda valle medio del Río Magdalena. Los sitios de estudio se encuentran entre los 200 - 710 msnm.
La limitada distribución de esta especie, la pérdida de hábitat y la fragmentación, son las principales razones por las cuales está amenazada (Morales-Jiménez et al., 2008). La pérdida de hábitat y la fragmentación afectan procesos ecológicos como tasas de natalidad y mortalidad, y mecanismos de dispersión (Bernstein et al., 1976; Schwarzkopf y Rylands, 1989; Jones, 1994; Estrada y Coates-Estrada, 1996; Chiarello y De Melo, 2001; Stokstad, 2004; Chapman et al., 2005; Gillespie y Chapman, 2006; Anzures-Dadda y Manson, 2007; Arroyo et al., 2007a; Arroyo et al., 2007b). Sin embargo, en el presente hay pocas generalizaciones en torno a los efectos que la alteración del hábitat tiene sobre las poblaciones de primates (Marsh, 2003) y en particular sobre esta especie (Vargas y Solano, 1996; Cuartas, 2001; Santamaría et al., 2007; Roncancio et al., 2009).
En este trabajo se comparó la densidad poblacional de S. leucopus en siete localidades sometidas a diferentes tipos de presión antrópica que difieren en características físicas y biológicas como tamaño, forma, distancia de aislamiento y estructura y composición vegetal. Se pretende demostrar que estas características físicas están relacionadas con los valores de densidad poblacional. Por otro lado, se evaluó la asociación que hay entre la densidad poblacional del primate y la estructura y diversidad vegetal.
Dado que los parámetros demográficos como la densidad poblacional son dinámicos espacial y temporalmente, su monitoreo es esencial para detectar sus tendencias y las relaciones que tienen con los factores que los modulan. Identificar los factores que influencian la distribución y la densidad poblacional es necesario para definir programas de monitoreo e implementar estrategias de conservación y manejo (Anzures-Dadda y Manson, 2007; Arroyo et al., 2007a).
MATERIALES Y MÉTODOS
Área de estudio
La zona en donde se llevó a cabo el estudio, está ubicada en la vertiente oriental de la Cordillera Central (Fig. 1). Esta región se encuentra en el distrito Nechí de la provincia biogeográfica Chocó-Magdalena (Hernández et al., 1992). La temperatura del aire presenta un régimen bimodal a lo largo del año. Los periodos de mayor temperatura media son de diciembre a marzo y de julio a septiembre; los de menores temperaturas son noviembre y abril. El régimen de precipitaciones va de los 2000 a 2500 mm al año, en el valle fluvial del río Magdalena y hasta los 6000 y 7000 mm al año, en la parte más alta (CORPOCALDAS-QUINAXI, 2004).
Entre enero de 2008 y junio de 2009, se estimaron las densidades poblacionales de S. leucopus en cinco localidades: Charca de Guarinocito, La Pedrera, El Pajuil, Rio Manso, Venecia. Adicionalmente se integraron a este análisis los estudios realizados en el año 2006 por Santamaría et al. (2007) en el área de influencia del Embalse Amaní y en el año 2005 por Roncancio et al. (2009) en la vereda La Primavera (Fig. 1). En este estudio se llevó a cabo la medición de las características físicas de todas las localidades. La estructura y la diversidad vegetal se evaluaron en cinco de las siete localidades, exceptuando Amaní y La Primavera, de las cuales se integró la información de Santamaría et al. (2007) y Rojas et al. (2008) respectivamente.
Toma de datos
Características físicas de las áreas de estudio
Como características físicas de las áreas de estudio se definieron cuatro variables: el tamaño de los remanentes, la forma, y en el caso de los fragmentos, la distancia de aislamiento. Adicionalmente, dado que las áreas de estudio se encontraron distribuidas en un rango altitudinal entre los 180 y los 1080 msnm, se agregó también la altitud sobre el nivel del mar. El tamaño de los remanentes estudiados se definió como el área de superficie plana ocupada. La forma se determinó numéricamente con el índice de diversidad de Patton: R = p/2(πA)1/2, en donde p es el perímetro, A es el área y π es 3.1416. Este índice varía entre uno (círculo perfecto) e infinito (formas no circulares) (Patton, 1975). La ventaja de este índice es que es invariante de escala, permitiendo que los valores de forma sean comparables entre áreas de diferente tamaño (Ripple et al., 1991). La distancia de aislamiento fue medida como la distancia lineal existente entre los bordes más próximos del remanente estudiado y el bosque más cercano. La altitud sobre el nivel del mar se midió sobre el punto central de cada área de estudio. Las mediciones de área y perímetro se hicieron con base en imágenes satelitales, fotografías aéreas y geo-posicionamiento de los límites de las áreas hechos en campo. Los análisis se hicieron en el programa ARC GIS versión 9.2.
Densidad poblacional de S. leucopus
La toma de datos para estimar la densidad poblacional de S. leucopus se realizó mediante el método de muestreo por distancias con transectos lineales (Peres, 1999; Buckland et al., 2001). Este método se llevó a cabo en seis de las siete localidades, exceptuando la Charca de Guarinocito. El método implica contar los animales vistos por un observador que viaja a lo largo de una línea de transecto, midiendo la distancia perpendicular desde el transecto hasta el punto donde se observó el animal o hasta el centro geográfico del grupo observado. La cantidad de transectos en cada una de los sitios de estudio dependió del tamaño del área, de su forma y de la topografía del terreno (Tabla 1).
Tabla 1
Se listan las localidades de estudio, el tamaño de la muestra y el esfuerzo de muestreo, relacionando cada uno de sus componentes.

En los muestreos sólo se incluyeron los registros visuales de la especie. Cada transecto fue recorrido silenciosamente por un solo observador a una velocidad promedio de 0.5 km/hora. Los muestreos se llevaron a cabo entre las 7:00 y las 16:00 horas.
Para estimar la densidad de S. leucopus en la Charca de Guarinocito, se realizó el conteo de todos los grupos e individuos del remanente. El conteo completo de los grupos e individuos de S. leucopus fue posible dado que este bosque solo tiene 21 ha y es alargado, sus partes más anchas miden menos de 100 m. Estas características permiten hacer un barrido completo del área de estudio.
Estructura y diversidad vegetal
La evaluación de la estructura y la diversidad vegetal se hizo a través de parcelas de vegetación. En todas las localidades, exceptuando Amaní, se levantaron seis parcelas de vegetación de 50 x 4 m (0.12 ha). En Amaní se establecieron 76 parcelas de 50 x 2 m (0.76 ha) (Santamaría et al., 2007). Se seleccionaron los árboles mayores a 10 cm de diámetro a la altura del pecho (DAP) y 1.50 m de altura. Adicionalmente se colectaron muestras de material vegetal para la determinación taxonómica. La determinación fue realizada por especialistas del Herbario de la Universidad de Caldas.
Análisis de datos
Densidad poblacional
La densidad poblacional de S. leucopus en las localidades donde se hizo uso de transectos lineales fue calculada con el programa DISTANCE 5.0 (Thomas et al., 2005). El análisis se hizo de forma independiente para cada localidad. El objetivo del análisis del muestreo por distancias es ajustar una función de detección de las distancias perpendiculares de las observaciones y usar esta función para estimar la proporción de objetos que no se detectaron en el muestreo. De esta forma, se puede obtener el valor real de la densidad y la abundancia de objetos en el área muestreada (Thomas et al., 2002).
Con el objetivo de mantener constante la probabilidad de detección a lo largo de un transecto, se debe intentar mantener constante la velocidad del recorrido. Por tal razón, una vez ubicado un grupo, el observador debe permanecer poco tiempo, hasta 15 minutos (Peres, 1999). Este corto intervalo dificulta la observación del grupo completo de tití (debido a su tamaño y a las acciones evasivas del grupo ante la presencia del observador). Razón por la cual, generalmente se subestima el tamaño de grupo (Defler y Pintor, 1985; Pruetz y Leasor, 2002). Por esta razón, fuera de los muestreos en los transectos, se realizaron seguimientos a varios grupos de la zona, hasta establecer su tamaño. La densidad se calculó introduciendo como constantes el promedio del tamaño de grupo, el error estándar y los grados de libertad.
Amaní y El Pajuil no tenían una estimación de tamaño de grupo con conteos exactos de grupos. En estas localidades, la densidad poblacional fue estimada con los conteos hechos durante los censos. Basado en las consideraciones anteriores, es posible que para estas localidades el valor de la densidad poblacional esté subestimado.
En Río Manso y en Venecia, el histograma de frecuencias de las distancias de detección mostró que algunos intervalos de la cola de la distribución tenían un mayor número de registros, afectando la tendencia de la distribución. Estos valores se consideran atípicos. Por tal razón, se truncó la función de detección a los 19 m en Río Manso y a los 24 m en Venecia, eliminando cinco y tres registros respectivamente.
Para hallar la función de detección que mejor se ajusta, se comparó la distribución de frecuencias de las distancias perpendiculares con cuatro modelos: 1. Half normal con serie de expansión Coseno, 2. Half normal con Hermite polynomial, 3. Uniforme con Coseno y 4. Uniforme con Simple polynomial. De los anteriores modelos se eligió el que presentó el menor valor en el Criterio de Información de Akaike (AIC).
La varianza muestral de la densidad poblacional fue calculada empíricamente como la suma de la varianza muestral de la tasa de encuentro, la varianza muestral del estimado de la probabilidad de detección y la varianza muestral del tamaño de grupo. La varianza de la tasa de encuentro es estimada, asumiendo que la distribución del número de grupos por kilómetro recorrido, al ser una variable de conteos discreta, tiene una distribución de Poisson (Buckland et al., 2001). Para la Charca de Guarinocito, la densidad poblacional se calculó dividiendo el número total de individuos por el área del fragmento.
El muestreo por distancia es uno de los métodos más eficientes para estimar densidades poblacionales. Es decir, uno de los métodos que produce estimados válidos y más precisos (i.e., con menor varianza muestral) para un esfuerzo de muestreo dado (Buckland et al., 2001; Harris y Burnham, 2002; Norvell et al., 2003; Kissling y Garton, 2006; Somershoe et al., 2006). Por esta razón, se asumió que los estimados de densidad poblacional obtenidos con este método y con conteos completos son comparables.
Comparación de las densidades poblacionales de S. leucopus
La comparación de las densidades poblacionales entre localidades se hizo por medio de un gráfico de intervalos de confianza. Cuando los intervalos de confianza de dos sitios se traslaparon más de un 25%, se consideró que no había evidencia en favor de que las densidades poblacionales en ambos fueran significativamente diferentes (Cumming et al., 2007).
Estructura y diversidad vegetal
Para evaluar la asociación del DAP y la altura de la vegetación en las áreas de estudio se usó la media. Se estimó también la densidad de árboles en cada localidad, dividiendo el número de árboles encontrados por el área muestreada. De igual forma, para poder integrar numéricamente la diversidad vegetal en las pruebas de correlación, se estimó el índice invertido de Simpson EstimateS (Colwell, 2006).
Relación de la densidad con las características físicas
Inicialmente se evaluó si existía asociación significativa entre cada par de variables explicativas, estimando el coeficiente de correlación de Spearman (rs ). Cuando dos variables explicativas resultaron significativamente asociadas, se eliminó una de las dos. De esta forma se evita colinealidad de las variables en el modelo (Sokal y Rohlf, 1995).
Para evaluar la relación entre las características físicas y la densidad poblacional, se llevó a cabo una regresión de Poisson. La regresión se hizo, con el método de máxima verosimilitud. La selección de variables se hizo con un proceso de selección hacia adelante y luego con un proceso de selección hacia atrás. Se eliminaron las variables explicativas que no resultaron relacionadas significativamente con la densidad poblacional de S. leucopus con un nivel de confianza del 95%.
Posteriormente se probó la significancia del modelo con una prueba de desviación. Observando la significancia del residuo en la prueba de desviación, se evaluó si este modelo era significativamente diferente de un modelo ideal que pudiera explicar la variación en la densidad poblacional. El ajuste del modelo se evaluó con el porcentaje de desviación explicado ajustado. Igualmente se evaluó el aporte de cada una de las variables explicativas en el modelo con una prueba del radio de la probabilidad (Schabenberger y Pierce, 2002).
Asociación entre la densidad poblacional y las variables de estructura y diversidad vegetal
Al DAP y a la altura, inicialmente se les probaron los supuestos de normalidad y de homogeneidad de varianzas. Ninguna de las dos variables se distribuyeron normalmente (DAP: KS = 0.14, p < 0.01; Altura: KS = 0.19, p < 0.01) y las varianzas entre localidades fueron heterogéneas (DAP: Bartlett = 276, p < 0.01; Altura: Bartlett = 179, p < 0.01). Para evaluar si había alguna asociación y su intensidad entre las variables de estructura y diversidad vegetal y la densidad poblacional, se llevaron a cabo análisis de correlación entre cada una de las variables y la densidad. Para evaluar la asociación se estimó el coeficiente de correlación de Spearman (rs ) (Sokal y Rohlf, 1995). Todos los análisis se hicieron en el programa STATGRAPHICS Plus Versión 5.0.
RESULTADOS
Características físicas
El tamaño de las localidades varió desde 21 ha para la Charca de Guarinocito hasta 1246 ha para Amaní. El resto de las localidades tenían una tamaño entre 100 y 347 ha. Río Manso y Venecia tendieron a la circunferencia mientras que Charca de Guarinocito y La Primavera presentaron formas alargadas. Tres de las localidades resultaron ser parches con algún tipo de continuidad y tres fueron fragmentos que variaban desde 30 m hasta 2.43 km en la distancia de aislamiento (Tabla 2).
Tabla 2
Se relacionan las características físicas de cada uno de los sitios de estudio, haciendo énfasis en las variables de paisaje relación perímetro/área, distancia al vecino más cercano.

Densidad poblacional
La Pedrera: Durante el muestreo se lograron 37 registros visuales de S. leucopus. El modelo Uniforme con serie de expansión Coseno arrojó el valor más bajo del Criterio de Información de Akaike (AIC) (Tabla 3). El tamaño de grupo se estimó con ocho grupos y fue de 5.25 individuos por grupo (IC95% = 4.22 - 6.28), variando entre tres y siete individuos (Tabla 4). La densidad poblacional fue de 101 individuos/km2 (IC95% = 58-177) y 19 grupos/ km2 (IC95% = 11-33), con un coeficiente de variación del 27.43% (Tabla 5). La varianza de la densidad estuvo compuesta por la probabilidad de detección en un 31.8%, por la tasa de encuentro en un 54.8% y por el tamaño de grupo en un 13.3% (Tabla 6).
Tabla 3
Modelos ajustados basados en la distribución de las frecuencias de las distancias de detección de las observaciones de Saguinus leucopus para cada localidad.
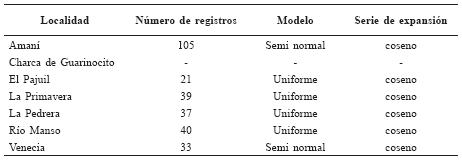
Tabla 4
Tamaño de grupo de Saguinus leucopus para cada localidad.
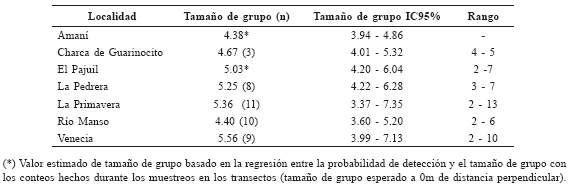
Tabla 5
Densidad poblacional de individuos y grupos de Saguinus leucopus para cada localidad. D = Densidad de individuos/km2, DS = densidad de grupos/km2, CV D=Coeficiente de variación de la densidad de individuos.
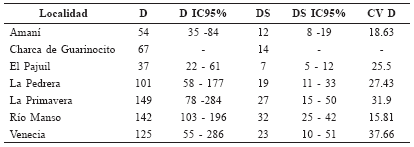
Tabla 6
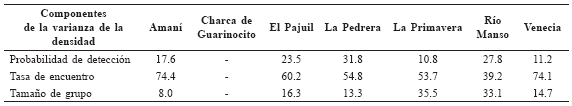
Componentes de la varianza de la densidad poblacional de Saguinus leucopus para cada localidad.
Los resultados de esta y las otras localidades están resumidos en las Tablas 3 a 7. Pueden ser leídos siguiendo el anterior formato en el mismo orden en el que están las tablas.
No se encontró diferencia significativa en el tamaño de grupo entre todas las localidades (H = 2.01, p = 0.73); varió entre 4.38 y 5.56 individuos por grupo. No obstante, en Venecia y La Primavera se encontraron grupos hasta de 10 y 13 individuos. Mientras que para las otras localidades los grupos más grandes fueron de cinco, seis y siete individuos (Tabla 4).
La mayor densidad poblacional fue encontrada en La Primavera y fue seguida por Río Manso. Las menores densidades fueron las de La Charca de Guarinocito y Amaní. En cuatro localidades se encontraron densidades por encima de 100 individuos por km2 (Tabla 5).
Para todas las localidades el componente que más aportó a la varianza de la densidad fue la variación en la tasa de encuentro entre los transectos. No obstante, ésta varió desde 39% para Río Manso hasta 74% para Amaní y Venecia. La variación en la probabilidad de detección fue el segundo componente que más aportó a la varianza de la densidad en Amaní, El Pajuil y La Pedrera. La variación en el tamaño de grupo lo fue en La Primavera, Río Manso y Venecia (Tabla 6).
La densidad poblacional de S. leucopus en el Pajuil resultó significativamente menor que todas las otras localidades. Amaní y Charca de Guarinocito no resultaron diferentes entre ellos, pero fueron significativamente menores comparadas con La Pedrera, La Primavera, Río Manso y Venecia. Entre estas últimas cuatro localidades no se presentaron diferencias significativas en la densidad poblacional de S. leucopus (Fig. 2).
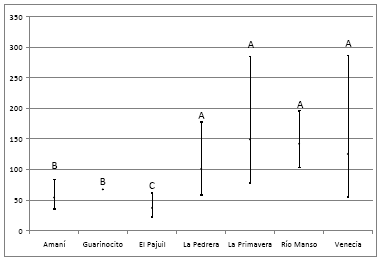
Fig. 2. Gráfico de intervalos para la densidad poblacional de individuos de Saguinus leucopus por localidad. Se ilustran tres grupos homogéneos: A, B, C. Cuando los intervalos de confianza de dos sitios se traslaparon más de 25%, se consideró que las densidades poblacionales entre ambos no fueron diferentes.
Estructura y diversidad vegetal
La Charca de Guarinocito fue la localidad con arboles más gruesos. Río Manso y Amaní fueron las localidades con árboles más altos. Amaní, Charca de Guarinocito y Río Manso presentaron la mayor dispersión en los estimadores. Los valores más bajos para DAP y altura de los árboles se encontraron en La Primavera y La Pedrera. Río Manso presentó el mayor valor en el índice de Simpson estando casi cuatro veces por encima de las otras. La Charca de Guarinocito presentó el valor más bajo. La densidad de arboles con DAP mayor a 10 cm fue mayor en la Primavera, seguida por Amaní y la Pedrera. En la Charca de Guarinocito se encontraron menos árboles por unidad de área (Tabla 7).
Tabla 7
Resultados obtenidos de las variables de estructura y diversidad vegetal en cada una de las localidades.

Relación entre la densidad poblacional de S. leucopus y las características físicas de las localidades
Entre las variables explicativas (características físicas) se encontró asociación significativa entre la distancia de aislamiento y la altitud sobre el nivel del mar (rs = -0.8, p = 0.048) y entre la distancia de aislamiento y el tamaño de los remanentes (rs = -0.95, p = 0.02). Los restantes pares de asociaciones no fueron significativos (rs = -0.3 - 0.75, p = 0.06 - 0.96). Se decidió no incluir la distancia de aislamiento en la modelación.
En la selección de variables en la regresión de Poisson se eliminó el tamaño de los remanentes, seleccionando hacia adelante y hacia atrás (p > 0.05). La modelación se llevó a cabo con la altitud sobre el nivel del mar y el índice de Patton. Se generó la siguiente ecuación: D = exp (4.02603 + 0.000571739 x Altitud sobre el nivel del mar + 0.0733881 x Índice de Patton). La relación entre la variación de la densidad poblacional de S. leucopus y variación en la altitud sobre el nivel del mar y el índice de Patton resultó positiva y significativa con un 99% de confianza (p = <0.01). No obstante, este modelo es significativamente menos ajustado que un modelo ideal que explique la variación en la densidad poblacional de S. leucopus (p del residuo < 0.01). Este modelo explica en un 15% la variación en la densidad poblacional (porcentaje ajustado = 15.55%). Por otro lado, el modelo muestra que es mayor el efecto de la forma medida con el índice de Patton, que el de la altitud sobre el nivel del mar.
Asociación entre la densidad poblacional de S. leucopus con la estructura y diversidad vegetal
La densidad poblacional de S. leucopus no resultó asociada significativamente con el índice de Simpson (rs = -0.24, p = 0.65), con el DAP (rs = -0.36, p = 0.93), con la altura del bosque (rs = 0.25, p = 0.54), ni con la densidad de los árboles (rs = 0.46, p = 0.26). No obstante, hay una tendencia a asociarse negativamente con la diversidad vegetal y con el DAP, y positivamente con la altura y con la densidad de árboles.
DISCUSIÓN
Las densidades encontradas en este estudio son altas, comparadas con los registros históricos para esta especie (Bernstein et al., 1976; Green, 1978) y con los estimados para otras especies de Saguinus, incluyendo estudios en paisajes fragmentados y continuos y en hábitats de diferente calidad. Las densidades más altas encontradas para este género están entre 20 y 30 ind/km2 (Dawson, 1976; Izawa, 1978; Eisenberg, 1979; Freese et al., 1982; Terborgh, 1983; Simmen et al., 1998; Defler, 2004; Aquino et al., 2005; Palacios y Peres, 2005).
Las altas densidades de primates en estos paisajes fragmentados han sido explicadas como un fenómeno de apiñamiento, ocasionado por la reducción y fragmentación del hábitat, en donde las poblaciones se ven obligadas a concentrase en un pequeño espacio (Defler, 1981). Esta situación puede resultar en la saturación de los fragmentos de bosque, sobreexplotación de recursos, incremento en la competencia, depredación y reducción de tasas de supervivencia y reproducción (Milner et al., 1999; Begon et al., 2006). En consecuencia, se esperaría una reducción significativa del número de individuos (Estrada y Coates-Estrada, 1996; Anzures-Dadda y Manson, 2007). Por otro lado, se ha planteado, que algunas especies del género Saguinus, aparentemente, toleran y probablemente se vean favorecidos por algunos procesos de fragmentación, aumentando sus poblaciones en donde se mantengan bosques es sucesión (Snowdon y Soini, 1988; Garber, 1997; Defler, 2004). Siendo probable que este tipo de coberturas hayan sido el escenario que permitió la evolución del género y al cual está mejor adaptado (Rylands, 1996). Este planteamiento coincide con las tendencias encontradas en este estudio, en el que la densidad de S. leucopus aumenta en los bosques con menos diversidad de árboles, árboles más delgados y con mayor número por área. Condiciones características de bosques en regeneración o bajo presiones como entresaca selectiva de madera.
Al quedar confinada a un fragmento, la probabilidad de una especie de persistir depende del tamaño y la dinámica de la población (Kattan y Álvarez-López, 1996; Harcourt y Doherty, 2005). En este estudio, de los cuatro primates diurnos que se distribuían originalmente en la región, se encontró solo a S. leucopus en La Charca de Guarinocito, La Pedrera y Venecia. En Río Manso y la Pedrera, se detectó también, durante el muestreo a Alouatta seniculus, pero solo cuatro y dos veces respectivamente. Alouatta seniculus también está registrado para Amaní, pero no fue detectado durante el muestreo hecho en esa localidad (Santamaría et al., 2007). Por otro lado en El Pajuil fueron registrados además de S. leucopus, A. seniculus y Ateles hybridus. Alouatta seniculus con densidades de 35 ind/km2 y A. hybridus con 39 ind/km2 (Acosta y García, 2009). Cebus albifrons no fue registrado en ninguna de las localidades.
Las altas densidades de S. leucopus en casi todas las localidades y la baja densidad en el Pajuil, puede ser el reflejo de un fenómeno de "compensación de densidad" (MacArthur et al., 1972). Es probable que la desaparición o disminución poblacional de los otros primates y otras especies menos tolerantes a los procesos de pérdida de hábitat, fragmentación y factores asociados como la presión de cacería (Jonsson et al., 2006; Arroyo et al., 2007b), hayan disminuido la competencia en algunas dimensiones del nicho en las que se traslapaban con S. leucopus (Hutchinson, 1957). De esta forma, las poblaciones de S. leucopus pudieron aumentar su capacidad de carga. Este fenómeno se encontró en primates, al comparar 56 localidades con y sin presión de cacería en la Amazonia y el escudo Guayana, en donde la disminución de densidades de primates grandes cazados (Atelinos), permitió, el aumento significativo de la densidad de primates medianos no cazados (Peres y Dolman, 2000; González-Solis. et al., 2001). Someter a prueba esta hipótesis para esta región demanda estudiar más sitios en donde estén presentes varias especies para poder evaluar la asociación entre sus densidades y la relación de éstas con los potenciales factores que las determinan.
Por otro lado, la diferencia en la densidad estimada en Amaní podría estar relacionada con presiones como la cacería con fines de tráfico ilegal, asociada a la cercanía a centros urbanos, a los efectos de las obras de infraestructura y carreteras que presenta esta localidad (Santamaría et al., 2007). La población de tití gris en La Charca de Guarinocito está completamente aislada hace más de 40 años y tiene solo 14 individuos. S. leucopus quizá tenga la plasticidad ecológica para tolerar cierto grado en distancia de aislamiento. No obstante esta tolerancia puede presentar umbrales. Es posible que la baja densidad en la Charca de Guarinocito sea consecuencia de la distancia y el tiempo de aislamiento, que ha impedido la dispersión de individuos desde y hacia este fragmento (Jones, 1994; Estrada y Coates-Estrada, 1996; Chiarello y De Melo, 2001; Stokstad, 2004; Chapman et al., 2005; Gillespie y Chapman, 2006).
La densidad poblacional de S. leucopus entre La Primavera, La Pedrera, Río Manso y Venecia no fue significativamente diferente. Este resultado puede deberse a que los coeficientes de variación de la densidad poblacional para todas las localidades fue amplio (> 10%). Esta imprecisión en la estimación de la densidad está influenciada en mayor proporción, por la variación en la tasa de encuentro (Tabla 6). Este resultado sugiere que existe un uso diferencial de hábitat dentro de algunas localidades.
Esta investigación se llevó a cabo bajo el supuesto de que cada una de las "poblaciones" estudiadas era independiente. S. leucopus es una especie con capacidad de desplazarse por vegetación arbustiva e incluso por estructuras artificiales. Adicionalmente, puede alimentarse de una amplia variedad de frutos que incluyen los producidos en bosques secundarios en estados tempranos de sucesión, bosques de galería y también por plantas introducidas (Poveda y Sánchez-Palomino, 2004; Santamaría et al., 2007). Estas características pueden reducir los efectos del aislamiento para esta especie. Es probable que a pesar de que algunas áreas estén fragmentadas, haya un flujo relativamente continuo de S. leucopus y sea la misma población distribuida entre hábitats de diferente calidad.
Es probable que la distribución de la población en el espacio sea anidada. A escala regional existe una aparente distribución homogénea, pero a escala más pequeña hay preferencias de hábitat o es posible que se estén presentando fenómenos de fuente-sumidero (Pulliam, 1988; Novaro et al., 2000). Demostrar esta hipótesis implicaría comparar parámetros poblacionales más finos como tasas de fecundidad y mortalidad en los diferentes hábitats. Otra alternativa sería incluir covariables en los estudios de densidad poblacional relacionadas con los requerimientos específicos para S. leucopus, como la oferta de frutos blandos e insectos (Buckland y Elston, 1993; Fewster et al., 2000; Royle et al., 2004).
La asociación encontrada entre el aumento de la altitud sobre el nivel de mar y la disminución en la distancia de aislamiento, se deriva de la historia del uso del suelo en estos paisajes, en donde las áreas más accesibles y de topografía poco accidentada, como los valles interandinos, son las primeras en ser alteradas para actividades agrícolas, asentamientos humanos o extracción forestal (Kattan y Álvarez-López, 1996). De igual forma, las zonas altas con mayores pendientes, presentarán remanentes de bosques más grandes y menos aislados. Haber encontrado mayores densidades de S. leucopus a mayor altitud sugiere que esta especie prefiere zonas más altas, hasta los 1100 msnm, en donde se presenta mayor proporción de bosques maduros y en regeneración.
La presencia del borde origina cambios en las condiciones bióticas y abióticas de los bosques remanentes. Los bordes de bosque pueden ser usados por algunas especies, mientras que para otros pueden ser completas barreras. Algunos primates (como se ha observado con muchas especies de Saguinus), capaces de usar elementos como bosques en regeneración o plantaciones, pueden verse favorecidos (Anderson et al., 2007). La relación encontrada entre las densidades más altas y los bosques más alargados sugiere preferencias de esta especie por áreas más intervenidas. No obstante, esta relación puede se un fenómeno indirecto producto del aumento de la densidad de S. leucopus ante la desaparición o disminución de las poblaciones de otras especies menos tolerantes a los efectos de borde.
La diferencia significativa entre este modelo y un modelo ideal que explique la variación de la densidad poblacional, sugiere que hay otros factores no evaluados en este estudio que pueden explicar mejor la variación de este parámetro. Es necesario integrar otros atributos medidos con más precisión, como la proporción de coberturas vegetales que generen información sobre la microheterogeneidad del paisaje (Forman y Godron, 1986).
AGRADECIMIENTOS
Los autores agradecemos a Margot Marsh Biodiversity Foundation, Woolly Monkey Foundation, a la dirección de investigaciones de la sede Bogotá de la Universidad Nacional de Colombia, a CORPOCALDAS y a Idea Wild por la financiación de esta Investigación. Al posgrado en Ciencias - Biología de la Universidad Nacional de Colombia, especialmente a la Línea en Manejo y Conservación de Vida Silvestre, por el apoyo académico. Agradecemos igualmente a los propietarios de los fincas, por su hospitalidad y colaboración, y a los auxiliares y asistentes de campo. Finalmente, agradecemos a los revisores anónimos por sus constructivas críticas para hacer de este un documento de mejor calidad.
LITERATURA CITADA
1. ACOSTA A y L GARCIA. 2009. Densidad poblacional y estructura de grupo de Ateles hybridus (Primates: Atelidae) en un fragmento de bosque aislado en el suroriente de Antioquia, Colombia. Trabajo de grado para optar al título de Bióloga. WCS - Universidad de Caldas. [ Links ]
2. AQUINO R, C IQUE y H GÁLVEZ. 2005. Reconocimiento preliminar de la densidad y estructura poblacional de Saguinus tripartitus Milne-Eduards en la Amazonía peruana. Revista Peruana de Biología 12(3):435-440. [ Links ]
3. ANDERSON J, M ROWCLIFFE y G COWLISHAW. 2007. Does the matrix matter? A forest primate complex agricultural landscape. Biological conservation 135:212-222. [ Links ]
4. ARROYO-R V, S MANDUJANO y J BENÍTEZ-M. 2007. Landscape attributes affecting patch occupancy by howler monkeys (Alouatta palliata mexicana) at Los Tuxtlas, Mexico. American Journal of Primatology 69:1-12. [ Links ]
5. ARROYO-R V, S MANDUJANO, J BENÍTEZ-M y C CUENDE-F. 2007. The Influence of large tree density on howler monkey (Alouatta palliata mexicana) presence in very small rain forest fragments. Biotropica 39(6):760-766. [ Links ]
6. ANZURES-D A y R MANSON. 2007. Patch- and landscape-scale effects on howler monkey distribution and abundance in rainforest fragments. Animal Conservation 10:69-76. [ Links ]
7. BEGON M, C TOWNSEND y J HARPER. 2006. Ecology-From Individuals to Ecosystems. Blackwell Publishing. Oxford UK. [ Links ]
8. BERNSTEIN I, P BALCAEN, L DRESDALE, H GOUZOULES, M KAVANAGH, T PATTERSON y P NEWMAN-WARNER. 1976. Differential effects of forest degradation on primate population. Primates 17:401-411. [ Links ]
9. BUCKLAND S, D ANDERSON, K BURNHAM, J LAAKE, D BORCHERS y L THOMAS. 2001. Introduction to distance sampling: estimating abundance of biological populations. Oxford University Press, Oxford. [ Links ]
10. BUCKLAND S y D ELSTON. 1993. Empirical models for the spatial distribution on Wildlife. Journal of Applied Ecology 30:478-495. [ Links ]
11. CHAPMAN C, T GILLESPIE y T GOLDBERG. 2005. Primates and the ecology of their infectious diseases: how will anthropogenic change affect host-parasite interactions? Evolutionary Anthropology 14:134-144. [ Links ]
12. CHIARELLO A y F DE MELO. 2001. Primate populations densities and size in Atlantic forest remnants of northern Espirito Santo, Brazil. International Journal Primatology 22(3):379-396. [ Links ]
13. COLWELL R. 2006. Estimates: Statistical estimation of species richness and shared species from samples. Version 8. Persistent URL <purl.oclc.org/estimates> [ Links ].
14. CORPOCALDAS-QUINAXI. 2004. Convenio C043-2004 CORPOCALDAS-QUINAXI para la construcción participativa de los escenarios prospectivos del plan de ordenamiento ambiental de la cuenca hidrográfica del río la Miel. Informe Técnico. Manizales, Colombia. Pp 9-17. [ Links ]
15. COULSON T, E CATCHPOLE, S ALBON, B MORGAN, J PEMBERTON, T CLUTTON-BROCK, M CRAWLEY y B GRENFELL. 2001. Age, sex, density, winter weather and population crashes in Soay Sheep. Science 292:1528-1531. [ Links ]
16. CUARTAS C. 2001. Distribución Parcial del tití gris (Saguinus leucopus, Callitrichidae) en el Departamento de Antioquia, Colombia. Neotropical Primates 9(3):107-110. [ Links ]
17. CUMMING G, F FIONA y D VAUX. 2007. Error bars in experimental biology. The journal of Cell Biology 177(1):7-11. [ Links ]
18. DAWSON G. 1976. Behavioral ecology of the Panamanian tamarin, Saguinus oedipus (Callithrichidae, Primates). Ph.D. Dissertation Abstracts International 37:645-645. [ Links ]
19. DEFLER T. 1981. The density of Alouatta seniculus in the Eastern Llanos of Colombia. Primates 22(4):564-569. [ Links ]
20. DEFLER T y D PINTOR. 1985. Censuring primates by transect in a forest of known primate density. International Journal Primatology 6(3):243-259. [ Links ]
21. DEFLER T. 2004. Primates of Colombia. Serie de Guías Tropicales de Colombia 4. Conservación Internacional, Bogotá [ Links ].
22. EISENBERG J. 1979. Habitat, economy and society: some correlation and hypotheses for the Neotropical primates. Pp. 215-262, en: Primate Ecology and Human Origins (IS Bernstein y EO Smith, eds.). Garland Press. New York. [ Links ]
23. ESTRADA A y R COATES-ESTRADA. 1996. Tropical rain forest fragmentation and wild populations of primates at Los Tuxtlas, Mexico. International Journal Primatology 17(5):759-781. [ Links ]
24. ETTER A, C MCALPINE, D PULLAR y H POSSINGHAM. 2005. Modeling the age of tropical moist forest fragments in heavily-cleared lowland landscapes of Colombia. Forest Ecology and Management 208:249-260. [ Links ]
25. FEWSTER R, S BUCKLAND, M SIRIWARDENA, S BAILLIE y D JEREMY. 2000. Analysis of population trends for farmland birds using generalized additive models. Ecology 81(7):1970-1984. [ Links ]
26. FORMAN R y M GODRON. 1986. Landscape ecology. John Wiley & Sons. Nueva York. [ Links ]
27. FREESE C, P HELTNE, R CASTRO y H WHITESIDES. 1982. Patterns and determinations of monkeys densities in Perú and Bolivia, whit notes and distribution. International Journal of Primatology 3:53-90. [ Links ]
28. GARBER P. 1997. One for all and breeding for one: Cooperation and competition as a tamarin reproductive strategy. Evolutionary Anthropology: 187-199. [ Links ]
29. GILLESPIE T y C CHAPMAN. 2006. Prediction of parasite infection dynamics in primate metapopulations based on attributes of forest fragmentation. Conservation Biology 20(2):441-448. [ Links ]
30. GONZÁLEZ-SOLÍS J, J GUIX, E MATEOS y L LLORENS. 2001. Population density of primates in a large fragment of the Brazilian Atlantic rainforest. Biodiversity and Conservation 10:1267-1282. [ Links ]
31. GREEN K. 1978. Primate censuring in northern Colombia: a comparison of two techniques. Primates 19:537-550. [ Links ]
32. HARCOURT A y D DOHERTY. 2005. Species-area relationships of primates in tropical forest fragments: a global analysis. Journal of Applied Ecology 42:630-637. [ Links ]
33. HARRIS R y K BURNHAM. 2002. On estimating wildlife densities from line transect data. Acta Zoological Sinica 48:812-818. [ Links ]
34. HERNÁNDEZ J, A GUERRA, R QUIJANO y T WALSCHBURGER. 1992. Unidades biogeográficas de Colombia. En: La diversidad biológica de iberoamérica I. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, Instituto de Ecología. Primera Edición (G Halffter, ed. [ Links ]).
35. HUTCHINSON G. 1957. Concluding Remarks. Cold Spring Harbor Symposia on Quantitative Biology 22(2):415-427. [ Links ]
36. ISAWA K. 1978. A field study of ecology and behavior of black-mantle tamarin (Saguinus nigricollis). Primates 19:241-274. [ Links ]
37. JONES C. 1994. Injury and disease of the mantled howler monkey in fragmented habitats. Neotropical Primates 2(4):4-5. [ Links ]
38. JONSSON T, K PATRIK y A JONSSON. 2006. Food web structure affects the extinction risk of species in ecological communities. Ecological modelling 19(9):93-106. [ Links ]
39. KATTAN G y H ÁLVAREZ-LÓPEZ. 1996. Preservation and management of biodiversity in fragmented landscapes in Colombia Andes. Pp. 3-18, en: Forest patches in tropical landscapes (J Schelhas y R Greenberg, eds.). Island Press, Washington, D. C. [ Links ]
40. KISSLING M y E GARTON. 2006. Estimating detection probability and density from point-count surveys: a combination of distance and double-observer sampling. The Auk 123(3):735-752. [ Links ]
41. LOVEJOY T, R BIERREGAARD Jr, A RYLANDS, J MALCOLM, C QUINTELA, L HARPER, K BROWN Jr, A POWELL, G POWELL, H SCHUBART y M HAYS. 1986. Edge and other effects of isolation on Amazon forest fragments. Pp. 257-285, en: Conservation Biology: The science of scarcity and diversity (ME Soulé, ed.). Sinauer, Suderland, M. A. [ Links ]
42. MacARTHUR R, J DIAMOND y J KARR. 1972. Density Compensation in Island Faunas. Ecology 53(2):330-342. [ Links ]
43. MARSH L. 2003. The Nature of fragmentation. Pp. 1-10, en: Primates in Fragments. Ecology in Conservation (LK Marsh, ed.). Kluwer Academia Plenum Publishers. New York. [ Links ]
44. MILNER J, D ELSTON y S ALBON. 1999. Estimating the contributions of population density and climatic fluctuations to interannual variation in survival of Soay sheep. Journal of Animal Ecology 68:1235-1247. [ Links ]
45. MORALES-JIMÉNEZ A, A LINK y P STEVENSON. 2008. Saguinus leucopus. En: IUCN 2008. 2008 IUCN Red List of Threatened Species. <www.iucnredlist.org>. Consultado el 5 de diciembre de 2008. [ Links ]
46. NORVELL R, F HOWE y J PARRISH. 2003. A seven-year comparison of relative-abundance and distance-sampling methods. The Auk 120(4):1013-1028. [ Links ]
47. NOVARO A, K REDFORD y R BODMER. 2000. Effect of hunting in source. Sink Systems in the Neotropics. Conservation Biology 14(3):713-721. [ Links ]
48. PALACIOS E y C PERES. 2005. Primate population densities in three nutrient-poor amazonian terra firme forests of south-eastern Colombia. Folia Primatologica 862:1-11. [ Links ]
49. PATTON D. 1975. A diversity index for quantifying habitat edge. Wildlife Society Bulletin 394:171-173. [ Links ]
50. PERES C. 1999. General guidelines for standardizing line-transect surveys of tropical forest primates. Neotropical Primates 7:1-16. [ Links ]
51. PERES C y P DOLMAN. 2000. Density compensation in Neotropical primate communities: evidence from 56 hunted and nonhunted Amazonian forests of varying productivity. Oecologia 122:175-189. [ Links ]
52. POVEDA K y P SÁNCHEZ- PALOMINO. 2004. Habitat use by the white-footed tamarin, Saguinus leucopus: a comparison between a Forest-dwelling group and an urban group in Mariquita, Colombia. Neotropical Primates 12(1):6-9. [ Links ]
53. PRUETZ L y J LEASOR. 2002. Survey of three primate species in forest fragments at La Suerte Biological Field Station, Costa Rica. Neotropical Primates 10(1):4-8. [ Links ]
54. PULLIAM H. 1988. Sources, sinks, and population regulation. American Naturalist 132:652-661. [ Links ]
55. RIPPLE W, G BRADSHAW y T SPIES. 1991. Measuring forest landscape patterns in the Cascade Range of Oregon, USA. Biological Conservation 57:73-88. [ Links ]
56. ROYLE J, D DAWSON y S BATES. 2004. Modeling abundance effects in distance sampling. Ecology 85(6):1591-1597. [ Links ]
57. ROJAS W, J ESTÉVEZ-V y N RONCANCIO. 2008. Estructura y composición florística de remanentes de bosque húmedo tropical en el oriente de caldas, Colombia. Boletín científico Universidad de Caldas 12:24-37. [ Links ]
58. RONCANCIO N, W ROJAS y J ESTÉVEZ-V. 2009. Densidad poblacional y tamaño de grupo de Saguinus leucopus en parches de bosque en el departamento de Caldas, Colombia. Neotropical Primates 15(2):63-67. [ Links ]
59. RUDRAN R y E FERNÁNDEZ-DUQUE. 2003. Demographic changes over thirty years in a red howler population in Venezuela. International Journal of Primatology 24:925-947. [ Links ]
60. RYLANDS A. 1996. Habitat and the evolution of social and reproductive behavior in Callitrichidae. American Journal Primatology 38:5-18. [ Links ]
61. SANTAMARÍA M, C DEVENÍS, A FRANCO, J SÁNCHEZ, H MENDOZA, C PEDRAZA, F FORERO y S MEDINA. 2007. Densidad y ecología básica del tití gris Saguinus leucopus en el área de influencia del Embalse Amaní, Norcasia-Caldas. Manuscrito no publicado, Instituto Alexander Von Humboldt - ISAGEN, Bogotá [ Links ].
62. SCHWARZKOPF L y A RYLANDS. 1989. Primate species richness in relation to habitat structure in Amazonian rainforest fragments. Biological Conservation 48:1-12. [ Links ]
63. SCHABENBERGER O y F PIERCE. 2002. Contemporary statistical models for the plant and soil sciences. Boca Raton: CRC Press. [ Links ]
64. SIMMEN B, C JULLIOT, F BAYART y E PAGES. 1998. Densités de primates en forêt guyanaise. Test d'une méthode d'estimation par transect. Comptes Rendus de l'Académie des sciences 321:699-704. [ Links ]
65. SNOWDON C y P SOINI. 1988. The tamarins, genus Saguinus. Pp: 223-298, en: Ecology and behavior of neotropical primates, vol. 2 (RA Mittermeier, AB Rylands, A Coimbra-Filho y GAB. Fonseca, eds.). WWF-US, Washington, D.C. [ Links ]
66. SOKAL R y F ROHLF. 1995. Biometry. The principles and practice of statistics in biological research. State University of New York at Stony Brook. Nueva York. [ Links ]
67. SOMERSHOE S, J TWEDT y B REID. 2006. Combining breeding bird survey and distance sampling to estimate density of migrant and breeding birds. The Condor 108:691-699. [ Links ]
68. STOKSTAD E. 2004. Forest loss makes monkeys sick. Science 305(5688):1230-1231. [ Links ]
69. TERBORGH J. 1983. Five New Word Primates: A study in comparative ecology. Princeton University Press. Princeton. [ Links ]
70. THOMAS L, S BUCKLAND, K BURNHAM, D ANDERSON, J LAAKE, D BORCHERS y S STRINDBERG. 2002. Distance sampling. Pp: 544-552, en: Encyclopedia of environmetrics. Vol. 1. (A El-Shaarawi y W Piegorsch, eds.). John Wiley & Sons, Ltd, Chichester. [ Links ]
71. THOMAS L, JL LAAKE, E REXSTAD, S STRINDBERG, FFC MARQUES, ST BUCKLAND, DL BORCHERS, DR ANDERSON, KP BURNHAM, ML BURT, SL HEDLEY, JH POLLARD, JRB BISHOP y TA MARQUES. 2009. Distance 6.0. Release "2", Research Unit for Wildlife Population Assessment, University of St. Andrews, UK. http://www.ruwpa.st-and.ac.uk/distance/ [ Links ]
72. VARGAS T y C SOLANO. 1996. Evaluación del estado de dos poblaciones de Saguinus leucopus para determinar áreas potenciales de conservación en un sector del Valle del Magdalena Medio, Colombia. Neotropical Primates 4(1):13-15. [ Links ]
Recibido 5 mayo 2010.
Aceptado 4 octubre 2010.
Editor asociado: G Zunino