Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.19 no.1 Mendoza jun. 2012
ARTÍCULOS Y NOTAS
El uso de modelos predictivos de distribución para el diseño de muestreos de especies poco conocidas
Guillermo E. Gil1 y Jorge M. Lobo2
1 Delegación Regional NEA, Administración de Parques Nacionales, Tres Fronteras 183, 3370 Iguazú, Misiones, Argentina [correspondencia: Guillermo Gil <gilycarbo@yahoo.com.ar>].
2 Dpto. de Biodiversidad y Biología Evolutiva, Museo Nacional de Ciencias Naturales, (CSIC), c/José Gutiérrez Abascal, 2 - 28006, Madrid, España.
Recibido 7 febrero 2011.
Aceptado 27 octubre 2011.
Editor asociado: E Cuéllar
RESUMEN: La utilidad de los modelos predictivos de distribución a la hora de ofrecer representaciones fiables está seriamente cuestionada cuando se trata de especies con pocas localidades conocidas. En este trabajo proponemos que, sin embargo, técnicas como estas pueden servir de ayuda para el diseño de futuros muestreos destinados a colectar nuevas observaciones de este tipo de especies y, con limitaciones, para evaluar el posible grado de disminución en el área de distribución original debido a los cambios en el uso del suelo. Utilizando tres técnicas de modelación distintas que únicamente utilizan datos de presencia fiables, este trabajo busca identificar áreas favorables con capacidad para albergar poblaciones no detectadas de las especies menos conocidas de mamíferos no voladores de la provincia de Misiones, República Argentina. También se analiza el grado de retracción que han podido sufrir las áreas potenciales de distribución con los cambios en el uso del suelo.
ABSTRACT: The use of predictive distribution models for planning surveys of little known species. The usefulness of predictive distribution models to provide a reliable representation is seriously questioned in the case of species with few well known localities. However, we propose in this paper that these techniques may be valuable for the design of future samplings devoted to collect new observations of little known species and, with limitations, to evaluate the possible extent of decrease in the original distribution area due to land use changes. With three different modelling techniques that use only reliable presence data, this study identified favourable areas with the capacity to support undetected populations of the lesser known species of no-flying mammals in the province of Misiones, Argentina. The probable degree of contraction in potential distribution area due to land use changes is also estimated.
Palabras clave: Argentina; Bosque atlántico; Deforestación; Misiones; Sigmodontidae.
Key words: Argentina; Atlantic forest; Deforestation; Misiones; Sigmodontidae.
INTRODUCCIÓN
Obtener información fiable sobre la distribución de las especies es una cuestión biológica central, tanto desde el punto de vista básico como aplicado (Brown y Lomolino, 1998). En la actualidad, el incremento en la potencia de computación, la existencia de redes mundiales de comunicación interconectadas y el desarrollo de los Sistemas de Información Geográfica, han permitido el surgimiento de diferentes iniciativas destinadas a compilar y visualizar datos masivos de información sobre la distribución de las especies (Guralnick et al., 2007), cuyo ejemplo más destacable puede ser la iniciativa Global Biodiversity Information Facility (http://www.gbif.org/). Esta información es la fuente básica utilizada para generar mapas de distribución pero, desafortunadamente, los datos de los puntos de colecta u observación conocidos, además de ser escasos, suelen poseer evidentes sesgos geográficos y ambientales (Dennis et al., 1999; Hortal et al., 2001; Martín Piera y Lobo, 2003; Reutter et al., 2003; Graham et al., 2004; Kadmon et al., 2004; Martínez- Meyer, 2005; Hortal et al., 2008). Para superar estas limitaciones, en la actualidad han adquirido un gran auge diversas técnicas que buscan interpolar e incluso extrapolar la información cartográfica parcial existente sobre los organismos, a fin de obtener simulaciones fiables capaces de representar su distribución a partir de datos incompletos (Guisan y Zimmermann, 2000). Se trata, en esencia, de utilizar información georreferenciada sobre la distribución de las especies, conjuntamente con diversos datos ambientales que actúan como predictores, a fin de elaborar funciones estadísticas con capacidad predictiva. Aunque existe un gran conjunto de técnicas disponibles para este propósito (Elith et al., 2006) los resultados de las mismas difieren según se busque estimar la distribución "potencial" o la "real" de las especies (Soberón y Peterson, 2004, 2005; Peterson, 2006; Soberón, 2007; Jiménez-Valverde et al., 2008). Para obtener representaciones que se acerquen a la distribución real de los organismos se necesitan datos de ausencia fiables que incorporen al análisis aquellas localidades con condiciones ambientales favorables pero deshabitadas, predictores capaces de dar cuenta del efecto generado por aquellos factores que impiden la presencia de una especie en estos territorios favorables, así como técnicas de parametrización complejas (Lobo, 2008). Si, por el contrario, lo que se desea es obtener una simulación cercana a la distribución potencial de una especie (el conjunto de localidades con condiciones ambientales favorables, estén estas habitadas o no), entonces no es necesario utilizar la información sobre las ausencias o, en todo caso, se puede incluir únicamente la proveniente de aquellas localidades con condiciones claramente desfavorables (Chefaoui y Lobo, 2008; Jiménez-Valverde et al., 2008). La distribución potencial, por su propia naturaleza, no es validable mediante datos de distribución (siempre es posible encontrar una localidad favorable en la que no esté presente la especie) y constituye una hipótesis parcialmente verificable mediante datos fisiológicos, estimando por ejemplo, los límites de tolerancia térmica en laboratorio (Calosi et al., 2008) y discriminando cuáles pueden ser las variables ambientales con mayor capacidad para representar el papel ejercido por dichos limitantes en condiciones naturales (Aragón et al., 2010).
Desafortunadamente, las posibilidades de estas técnicas para modelizar se ven seriamente mermadas cuando el número de observaciones disponibles es escaso. En el caso de regresiones logísticas se considera apropiado que el tamaño muestral sea, al menos, diez veces superior al número de variables explicativas (Peduzzi et al., 1996) y, en el caso específico de modelos predictivos de distribución, algunos estudios sugieren que es necesario disponer de más de 100 observaciones para alcanzar valores de predicción fiables (Kadmon et al., 2003; Dixon et al., 2005) que, además, deben de estar distribuidos lo más homogénea y extensamente posible dentro del espectro de condiciones ambientales del área geográfica conocida (Kadmon et al., 2004). Entonces ¿qué utilidad tienen los resultados de estos modelos de distribución cuando la información de partida sobre la distribución de las especies es escasa? Aunque no sea posible ofrecer una estimación fidedigna de la distribución de las especies en estas circunstancias, al igual que Pearson et al. (2007) consideramos que los resultados de estos modelos pueden servir de ayuda para el diseño de futuros muestreos destinados a colectar nuevas observaciones de estas especies poco conocidas a fin de mejorar el conocimiento sobre su distribución geográfica. Tras considerar la distribución actual de los diferentes usos del suelo, las representaciones geográficas obtenidas pueden utilizarse para sugerir localidades de colecta especialmente favorables porque se encuentran en áreas protegidas o, alternativamente, para desechar otras debido a su situación claramente antropizadas o inadecuadas. En este trabajo utilizamos tres técnicas distintas para modelizar las distribuciones que únicamente utilizan datos de presencia fiables, pero que pueden ofrecer representaciones diferentes dentro del gradiente distribución potencial/distribución realizada (Jiménez-Valverde et al., 2008), junto a cartografía de los usos actuales del suelo y de los espacios protegidos, a fin de discriminar las áreas con condiciones ambientales favorables para diferentes especies de mamíferos en la provincia de Misiones (Argentina) donde realizar futuros esfuerzos de colecta.
MATERIALES Y MÉTODOS
Área de estudio
Este trabajo tiene como referencia político-administrativa la provincia de Misiones, en el extremo noreste de la República Argentina, aunque para la modelación de las distribuciones se utilizaron datos de presencia procedentes del área de distribución completa de las especies tratadas, a fin de estimar el mayor conjunto de condiciones ambientales en las que existen condiciones favorables para la presencia de cada especie (Sánchez-Fernández et al., 2011). Esta provincia está ubicada entre los 25° 30' y 28° 10' latitud sur y los 53° 38' y 56° 05' longitud oeste, posee una superficie de 29 801 km2 y limita con Paraguay, Brasil y la provincia argentina de Corrientes (Dirección General de Estadísticas y Censos, 1978; Fig. 1A). Misiones contiene dos eco-regiones: la selva paranaense (o bosque atlántico del alto Paraná), que originalmente cubría el 86% de su superficie y es exclusiva de esta provincia en Argentina y los campos y malezales (o pampas en Brasil) existentes en el sur (Burkart et al., 1999; Ministerio do Meio Ambiente, sin fecha). El primero de estos biomas forma parte de un complejo de eco-regiones denominado bosque atlántico (mata atlántica en Brasil), que comparten varias características y a veces son tratadas conjuntamente (Di Bitetti et al., 2003; Ministerio do Meio Ambiente, sin fecha). La situación del bosque atlántico se ha clasificado como crítica, situando este ecosistema dentro de las 200 ecoregiones más amenazadas del planeta y al igual que a escala nacional en Argentina (World Wide Fund For Nature, 2002; Placi y Di Bitetti, 2005).

Fig. 1. Ubicación geográfica de la provincia de Misiones (A) y distribución potencial de Brucepattersonius sp. (usada como ejemplo en todas las figuras) realizada con Biomapper (B), MaxEnt (C) y Bioclim (D), así como resultado de la superposición de los tres métodos (E) o distribución potencial original en donde la línea continua representa el área de coincidencia de las tres técnicas. La distribución potencial original se convierte en la distribución potencial actual tras eliminar los territorios con usos del suelo inadecuados (F). Las líneas continuas en los resultados de los tres modelos representan el punto de corte para transformar los valores de favorabilidad continuos en binarios (presencia-ausencia)
Especies tratadas
El conocimiento geográfico de la fauna de mamíferos del bosque atlántico en la provincia de Misiones es limitado; en un análisis realizado en el que se dividió esta provincia en celdas de 0.25º, el 35.5% de las mismas poseían inventarios de mamíferos extremamente pobres (Gil y Carbó, 2004). Teniendo en cuenta que las políticas de investigación, de uso del suelo y de conservación de especies en Argentina, son potestad de los gobiernos provinciales y pensando en realizar recomendaciones que sean aplicables a la provincia de Misiones, fueron consideradas en este trabajo sólo aquellas especies de mamíferos pertenecientes a la fauna de esta provincia según Barquez et al. (2006) y Pardiñas et al. (2009). La otra condición de selección de las especies tratadas fue que sean poco conocidas, para ello se consideraron solo aquellas que, teniendo en cuenta toda su área de distribución, poseían un máximo de 21 localidades con citas concretas, excluyendo sin embargo tres especies de las cuales solo existe una localidad conocida (Brucepattersonius guarani, B. misionensis y B. paradisus).
Datos de presencia
Para la recopilación de los registros se realizó una revisión de la bibliografía existente y un examen de las bases de datos de colecciones disponibles en internet. La lista confeccionada con base en Massoia (1963); Massoia y Fornes (1969); Reig y Kirsch (1988); Massoia et al. (1991); Massoia (1993); Hershkovitz (1994; 1998); Christoff et al. (2000); Mares y Braun (2000); Tavares da Fonseca (2001); Geise et al. (2004); Neri-Bastos et al. (2004); Pardiñas et al. (2005); Pereira et al. (2005); Massoia et al. (2006); D´Elía et al. (2008); Pardiñas et al. (2008); Pardiñas et al. (2009); GBIF (http://data.gbif.org/) y Species Link (http://splink. cria.org.br/) incluye las siguientes especies que, sin pretenderlo, pertenecen todas ellas al orden Rodentia: Abrawayaomys chebezi Pardiñas, Teta y D´Elía, 2009; Akodon serrensis Thomas, 1902; Akodon philipmyersi Pardiñas, D´Elía, Cirignoli y Suarez, 2005; Brucepattersonius sp. (especie indeterminada, Pardiñas et al., 2006) y Juliomys pictipes (Osgood, 1933). Para la exclusión de datos dudosos se contó con la colaboración del Dr. U.F.J. Pardiñas.
Todos los datos compilados que lo requerían se georreferenciaron con base en las localidades de colecta, las descripciones originales de las áreas de estudio, mapas físicos, políticos y, especialmente, el mapa de la provincia de Misiones (Departamento de Geografía, Instituto Superior del Profesorado "Antonio Ruiz de Montoya", 1985) y se buscaron las coordenadas mediante el programa Google Earth (http://earth.google.com/). Se unificaron los datos en el sistema geográfico con datum WGS84 y con una precisión mínima de dos decimales.
Modelos de distribución
Como el resultado de las diferentes técnicas para modelizar que utilizan únicamente la información sobre las presencias conocidas pueden proporcionar distintas representaciones dentro del gradiente distribución potencial/distribución realizada (Jiménez- Valverde et al., 2008), se utilizaron tres diferentes técnicas: MaxEnt (Phillips et al., 2006), Biomapper 4.0 (Hirzel, 1998-2008) y Bioclim (Diva-Gis 5.2). MaxEnt emplea inteligencia artificial combinada con el principio de máxima entropía buscando una distribución lo más cercana posible a la uniformidad, pero teniendo en cuenta las restricciones de los valores proporcionados por los predictores utilizados. El algoritmo utilizado traslada la ecuación al espacio geográfico generando una capa raster cuyos valores representan, en una escala relativa de cero a uno, la favorabilidad ambiental de cada especie, de modo que los valores altos representan aquellas localidades con mejores condiciones ambientales para la presencia de la especie (Phillips et al., 2006; http:// www.cs.princeton.edu/~schapire/maxent/). MaxEnt generalmente tiende a restringir las distribuciones que genera, siendo de las tres técnicas utilizadas la que produce distribuciones más cercanas a la distribución realizada (Elith et al., 2006).
Biomapper utiliza el denominado análisis de factores de nicho ecológico (ENFA), similar en procedimiento al clásico Análisis de Componentes Principales. El primer factor maximiza la marginalidad de la especie, que es la distancia ecológica entre el óptimo de sus localidades conocidas y la media del área geográfica analizada. Los otros factores maximizan la especialización de la especie, que es la razón entre la variabilidad ambiental de la región y la variabilidad ambiental representada por las localidades de presencia observadas. Los valores de estos ejes son utilizados para generar mapas de favorabilidad (para una descripción más detallada de la técnica ver Hirzel et al., 2002 y http://www2.unil.ch/biomapper/). Ni MaxEnt ni ENFA utilizan datos de ausencia reales, generando mapas de favorabilidad mediante la comparación de las condiciones ambientales de los datos de presencia (uso) respecto a un conjunto aleatorio de datos que representa el conjunto de condiciones del territorio (disponibilidad). Sin embargo, la tercera técnica utilizada, Bioclim, se basa en el simple procedimiento de "envolventes bioclimáticas". La idea básica consiste en identificar el rango de valores ambientales entre los que se encuentran las localidades conocidas de una especie, para construir un mapa binario que discrimina el conjunto de localidades con valores ambientales similares a los de los puntos de presencia conocidos del conjunto de localidades desfavorables. Se trata de un procedimiento que suele generar distribuciones amplias alejadas, generalmente, de la distribución realizada (Elith et al., 2006) y que podrían considerarse una representación de la distribución potencial de las especies (Jiménez-Valverde et al., 2008): el conjunto de localidades, habitadas o no, que poseen condiciones ambientales similares a las localidades conocidas. Se usó el programa Diva-Gis 5.2 (http://www.diva-gis.org/) para realizar estos últimos modelos. Como los resultados generados mediante Bioclim dependen notablemente de la cantidad de variables incorporadas (Beaumont et al., 2005), se seleccionaron las más relevantes para cada especie como aquellas que poseían una mayor contribución a los primeros factores del ENFA realizado con Biomapper (correlaciones = 0.30 en valor absoluto; Tabla 1, Fig. 1D ). En el caso de A. philipmyersi, que sólo contaba con dos localidades conocidas, no se realizaron predicciones utilizando MaxEnt ni Biomapper. En este caso, asumiendo que los predictores son similares para especies del mismo género y subfamilia (Anderson et al., 2003), la estimación se realizó eligiendo como variables explicativas aquellas que reiteradamente aparecieron como relevantes para el resto de las especies, incrementando un 5% los valores de favorabilidad obtenidos a fin obtener una representación geográfica de la distribución.
Tabla 1 Punto de corte para transformar los valores de favorabilidad continuos, procedentes de los modelos realizados con MaxEnt y Biomapper, en datos de presencia-ausencia potencial para cada una de las especies y variables explicativas seleccionadas para cada una de las especies con las que se ha ejecutado el modelo de Bioclim. 1: temperatura media anual, 2: rango de temperatura diaria media, 3: isotermalidad, 4: estacionalidad de la temperatura, 5: temperatura máxima del mes más cálido, 6: temperatura mínima del mes más frío, 7: rango de temperatura anual, 8: temperatura media del trimestre más húmedo, 9: temperatura media del trimestre más seco, 10: temperatura media del trimestre más cálido, 11: temperatura media del trimestre más frío, 12: precipitación media anual, 13: precipitación del mes más húmedo, 14: precipitación del mes más seco, 15: estacionalidad de la precipitación, 16: precipitación del trimestre más húmedo, 17: precipitación del trimestre más seco, 18: precipitación del trimestre más cálido, 19: precipitación del trimestre más frío, 20: altitud sobre el nivel del mar.

Como los modelos realizados con Biomapper y MaxEnt generan valores de favorabilidad continuos, estos se convirtieron en binarios (presencia-ausencia). Para elegir el límite o umbral de corte existen criterios variables (Jiménez-Valverde et al., 2007; Lobo et al., 2008). En nuestro caso, elegimos como umbral de corte para cada especie el menor valor de favorabilidad registrado para cualquiera de los puntos de presencia conocidos (Tabla 1, Figs. 1B y 1C) de modo que todas las localidades con observaciones conocidas para cada una de las especies fueron inevitablemente predichas como favorables.
Cuando solo se utiliza la información disponible sobre las presencias de las especies y no existe información fiable sobre las ausencias, los métodos para modelizar como los utilizados en este trabajo generan representaciones geográficas ubicadas en una situación desconocida entre la distribución realizada y la potencial (ver Jiménez-Valverde et al., 2008). Por ello, se consideró como la hipótesis más parsimoniosa y verosímil de distribución el área coincidente de las tres técnicas utilizadas (Fig. 1E). Esta área trata de representar el conjunto de localidades con condiciones climáticas favorables, similares a las existentes en sus localidades de colecta. Las distribuciones obtenidas para cada una de las especies se refirieron a un marco geográfico de referencia de unos 3 000 000 km2 (entre los 17º y los 32º de latitud sur y 40º y 59º de longitud oeste). Como predictores se utilizaron las 19 variables bioclimáticas y la altitud procedentes de la base de datos Worldclim 1.4 (http://www. worldclim.org/ y Hijmans et al., 2005), las cuales poseen una resolución de 150 segundos geográficos de lado por píxel (aproximadamente 19 km2 para la latitud analizada). El uso actual del suelo fue utilizado para eliminar de las representaciones geográficas resultantes, en una primera etapa, hábitats inadecuados para las especies obteniendo la que se ha denominado "distribución potencial original" (DPO) y luego eliminando los hábitats transformados por la actividad humana, obteniendo así la "distribución potencial actual" (DPA). Dichos hábitats se obtuvieron a partir de la cartografía digital proporcionada por el proyecto Global Land Cover 2000 database (European Commission, Joint Research Centre, 2003), con base en imágenes del año 2000 y una resolución de 30 segundos geográficos de lado por píxel (aproximadamente 0.90 km2 para la latitud analizada). La DPA es una representación geográfica que pretende ofrecer una imagen del área potencial de cada especie que actualmente posee condiciones climáticas y de hábitat favorables. La diferencia DPO-DPA podría considerarse una estimación del posible grado de retracción del área de distribución original de cada especie debido a transformaciones de los usos del suelo. Se consideraron como hábitats inadecuados para la presencia de las especies los siguientes: área estéril o suelo desnudo; desierto; bosque inundado por agua dulce; manglar; páramo o mantillo; bosque de pantano permanente; nieve o hielo permanente; salinas; estepa desértica abierta de arbustos o pastos y, como transformados, a estos tipos de usos del suelo: agricultura -uso intensivo; mosaico de agricultura o bosques degradados; mosaico de agricultura o vegetación degradada; suelo urbano y cuerpos de agua. Para cada especie y cada situación considerada, se calcularon diversos parámetros que permitieran cuantificar la distribución de cada especie: superficie total del área de distribución, superficie del núcleo o parche mayor y distancias mínima y máximas de este núcleo al resto de los parches También se examinó la presencia potencial de las distintas especies en las áreas naturales protegidas de la provincia de Misiones teniendo en cuenta la cartografía proporcionada por el Ministerio de Ecología RNRyT de Misiones (Dirección de Procesamiento de Información Satelital y Cómputos - Dirección de Áreas Naturales Protegidas, 2005-2007, Fig. 2). Con base en estos análisis y obviando las localidades ya conocidas, se determinaron los mejores sitios para detectar actualmente nuevas poblaciones de las especies consideradas.
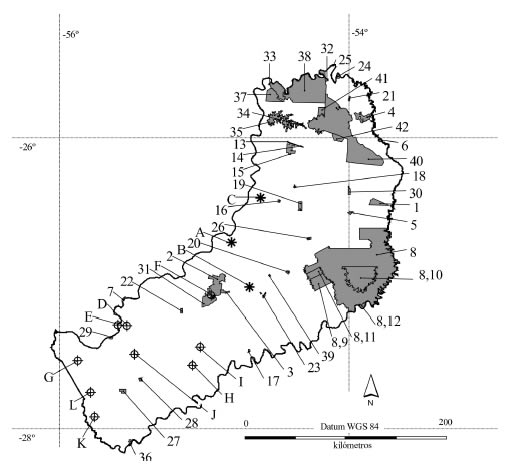
Fig. 2. Áreas protegidas de la provincia de Misiones: 1: Parque Provincial (PP) Piñalito, 2: PP V.A. Cuña Pirú, 3: PP Salto Encantado, 4: PP G.H. Foerster, 5: PP Cruce Caballero, 6: Reserva Natural Estricta San Antonio, 7: Reserva Ictica Corpus, 8: Reserva de Biosfera Yabotí, 9: Reserva Natural Cultural Papel Misionero,10: PP Esmeralda, 11: Área Experimental Guaraní, 12: PP Moconá, 13: Parque Natural Municipal Lote C, 14: PP Esperanza, 15: Reserva Privada (RP) Aguaraí-mi, 16: RP Itacuarahy, 17: RP Chancay, 18: RP Lapacho Cué, 19: RP Tomo, 20: Reserva de Uso Múltiple (RUM) EEA Cuartel Victoria, 21: RUM F. Basaldúa, 22: RP El Paraíso, 23: RUM A. Orloff Saltitos, 24: RP Yacutinga, 25: PP I.A.R. Cametti, 26: RP Yaguarundí, 27: PP de la Sierra, 28: RUM EEA Cerro Azul, 29: RP Puerto San Juan, 30: RP J. Freaza, 31: RP UNLP Cuña Pirú, 32: PP Yacuy, 33: Paisaje Protegido (PPr) A. Giai, 34: Monumento Natural Isla Palacio, 35: PPr Lago Urugua-í, 36: RP Santa Rosa, 37: PP Puerto Península, 38: Parque Nacional Iguazú, 39: RP La Ponderosa, 40: PP Urugua-í, 41: PP Uruzú, 42: RP Urugua-í,. Localidades cercanas a las zonas de mayor riqueza: A: El Alcazar, B: Dos de Mayo, C: Eldorado. Localidades mejor prospectadas: D: Aº Yabebiry y RN 12, E: Teyú Cuaré, F: RP UNLP Cuña Pirú, G: Ea. Santa Inés, H: Los Helechos, I: Campo Ramón, J: Bonpland, K: Apóstoles, L: Los Limonales.
Todo el trabajo cartográfico se realizó mediante el sistema de información geográfica Idrisi Kilimanjaro (Clark Labs, 2003).
RESULTADOS
Abrawayaomys chebezi: su distribución potencial se extiende entre los 25.6° y 27.7° de latitud sur en tres manchones principales dentro de la provincia de Misiones, excepto por una pequeña ingresión en el este de Paraguay (departamento Itapuá). La distribución de esta especie estaría incluida totalmente dentro de la ecorregión de bosque atlántico. Según la distribución potencial actual, tras eliminar las áreas deforestadas y teniendo en cuenta la presencia de áreas protegidas que garantizan un menor grado de perturbación humana, las zonas más recomendables para encontrar nuevas localidades de esta especie serían el centro-sur del Parque Nacional (PN) Iguazú, el oeste del Parque Provincial (PP) Urugua-í y las Reservas Privadas (RP) Tomo, Itacuarahy y Lapacho Cue (Figs. 2 y 3A).

Fig. 3. Distribución potencial actual de las especies consideradas en Misiones (en gris), distribuciones de las especies según Patterson et al. (2007; líneas oblicuas), localidades con presencia conocida (puntos negros) y localización de las áreas protegidas (polígonos). A: Abrawayaomys chebezi. B: Akodon philipmyersi. C: Akodon serrensis.
Akodon philipmyersi: su distribución potencial original se extiende entre los 24.5° y 29.8° de latitud sur y en una angosta franja entre los 55.2° y 56.3° de longitud oeste, principalmente al este de Paraguay (Itapuá, Caazapá y Alto Paraná), el sur de Misiones, el noreste de Corrientes (Argentina) y el oeste de Río Grande do Sul (Brasil). Ocupa básicamente ambientes de campos y malezales, aunque hay algunos parches en bosque atlántico. Los mejores sitios actuales para detectar nuevas poblaciones de esta especie serían: el PP de la Sierra y el sur de Misiones al oeste del meridiano de 55.6° longitud oeste (Figs. 2 y 3B).
Akodon serrensis: Su distribución potencial original se extiende entre los 17.9° y 29.7° de latitud sur, desde la costa brasilera hasta el NE de la provincia de Misiones. Esta área está casi totalmente incluida en el ambiente de bosque atlántico, con algunas extensiones en el sur del cerrado. Teniendo en cuenta la situación ambiental actual, los sitios donde habría que prospectar en busca de poblaciones no detectadas son: el centro-norte del PN Iguazú, el centro-este del PP Urugua-í, los PP Uruzú, G.H. Foerster, Piñalito, la Reserva Natural Estricta San Antonio y la RP J. Freaza (Figs. 2 y 3C).
Brucepattersonius sp.: su distribución potencial original se extiende entre los 24.5° y 28.1° de latitud sur con su centro en la provincia de Misiones, pero ingresando brevemente en el sudoeste del estado de Paraná, noroeste de Río Grande do Sul (Brasil) y en los departamentos de Alto Paraná e Itapuá (Paraguay). Ocupa áreas de bosque atlántico, casi en su totalidad, aunque abarca un pequeño sector de campos y malezales en el sur de Misiones. Actualmente habría que buscar nuevas poblaciones de esta especie principalmente en: el PN Iguazú (excepto en el noreste), los PP Pto. Península, Uruzú, G.H. Foerster, Esperanza, Cruce Caballero, Salto Encantado, Cuña Pirú (excepto el oeste), de la Sierra, el Paisaje Protegido A. Giai, la Reserva de Uso Múltiple (RUM) F. Basaldúa, la Reserva de la Biósfera Yabotí y la RP UNLP Cuña Pirú (esta última confirmada a posteriori por Cirignoli et al., 2011; Figs. 2 y 4A).
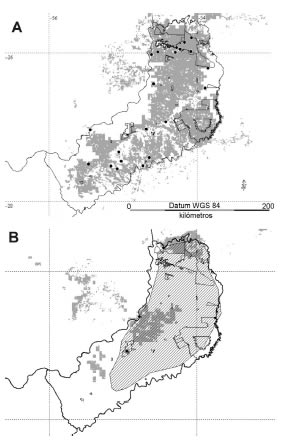
Fig. 4. Distribución potencial actual de las especies consideradas en Misiones (en gris), distribuciones de las especies según Patterson et al. (2007; líneas oblicuas), localidades con presencia conocida (puntos negros) y localización de las áreas protegidas (polígonos). A: Brucepattersonius sp. B: Juliomys pictipes.
Juliomys pictipes: Su distribución potencial original se extiende entre los 22.2° y 27.5° de latitud sur, en una franja que va desde la costa del estado de Río de Janeiro (Brasil) hasta el extremo este de Paraguay, incluyendo la provincia argentina de Misiones. Esta distribución se localiza, principalmente, dentro de los límites del bosque atlántico con una pequeña ingresión en el extremo sur del cerrado. La probabilidad más alta de hallar nuevas localidades para esta especie se encuentra en el este de PN Iguazú, los PP Yacuy, Urugua-í (norte), I.A.R. Cametti, la RUM F. Basaldúa y la RP Yacutinga (Figs. 2 y 4B).
La suma de las áreas potenciales originales resultantes para estas especies produjo un mapa potencial de variación del número de especies en el que se puede observar un valor máximo (tres especies) en el centro y el norte de Misiones. Como ninguna de estas localidades posee presencia confirmada de alguno de estos roedores, podrían considerarse localidades adecuadas para la realización de nuevos muestreos. Los sitios del centro de la provincia se encuentran fuera de áreas protegidas entre las localidades de Eldorado y Dos de Mayo (Figs. 2 y 5). En cambio las localidades del norte de la provincia, donde ocurrirían tres especies de estos roedores poco comunes, están mayormente en áreas protegidas, PN Iguazú (centro y sur), PP Urugua-í (norte) y Colonia Andresito (Figs. 2 y 5).

Fig. 5. Variación en el número de especies según la superposición de la distribución potencial actual de cada una de las especies en Misiones (en tonos de gris), localidades de presencia conocidas (puntos negros) y localización de las áreas protegidas (polígonos)
En cuanto a la disminución y fragmentación del área de distribución, en líneas generales, los cambios en el uso del suelo parecen haber supuesto una reducción de las áreas potenciales de distribución que oscilarían, según la especie, entre el 23% y el 73% del total, y entre el 18% y el 95% en el parche de mayor tamaño. Las especies más afectadas serían A. serrensis y J. pictipes, aunque la primera mantiene la mayor superficie en valores absolutos, mientras que la menos afectada sería A. chebezi. El aumento, por subdivisión, del número de parches con condiciones climáticas favorables es siempre muy elevado, oscilando este incremento entre un 1000% y un 5300% en el caso de A. philipmyersi. La distancia mínima entre el parche de mayor tamaño y el fragmento más cercano de las distribuciones potenciales no se vio aumentada más que en 100 metros como mucho, pero la distancia máxima al parche más alejado aumentó unos 9 km en el caso de A. serrensis (Tabla 2).
Tabla 2 Número de localidades con datos reales de presencia incluidas dentro de la distribución potencial estimada para cada una de las especies (PO) y la distribución potencial actual (PA), superficie en km2 de estas distribuciones tras eliminar los usos del suelo desfavorables, superficie de la zona núcleo o parche principal de la distribución, número de parches de la distribución. Los porcentajes representan la superficie de la distribución potencial actual sobre la estimada, mientras que? representa el aumento en el número de parches y su fragmentación tras eliminar los usos del suelo desfavorable.

DISCUSIÓN
Utilidad de estos modelos en el caso de especies con datos insuficientes
Cuando el número de observaciones es escaso, como ocurre generalmente para una gran parte de las especies, las representaciones geográficas generadas mediante estas técnicas deben considerarse hipótesis provisionales cuya fiabilidad sólo podrá evaluarse a medida que se obtengan nuevas colectas. Asumiendo que los factores climáticos usados como predictores son adecuados para representar la heterogeneidad ambiental capaz de describir la distribución de estas especies a la escala espacial considerada, los ejemplos que se proporcionan en este trabajo nos permiten obtener una indicación sobre la localización de futuros sitios de colecta. En nuestra opinión, esta es la principal utilidad de los resultados de este tipo de modelos cuando estos son realizados sobre especies con datos insuficientes. Básicamente, este procedimiento es similar al realizado intuitivamente por cualquier taxónomo cuando este se propone colectar nuevos ejemplares y sólo dispone de información parcial sobre las condiciones ambientales que delimitan la presencia de las especies. La diferencia básica, en este caso, consiste en que, tanto los métodos de modelación como la utilización de un conjunto estandarizado de predictores i) minimiza la subjetividad en la elección de las nuevas localidades a prospectar, ii) garantiza la obtención de resultados sobre una extensa región, y iii) permite priorizar las localidades de colecta según su favorabilidad, estado actual de antropización y accesibilidad.
Tres especies de las cinco analizadas contaban anteriormente con mapas de distribución publicados realizados a mano alzada (Patterson et al., 2007; aunque A. chebezi como A. ruschii). Estas distribuciones están compuestas por unos pocos polígonos que contienen los puntos considerados siendo, en general, mayores que las áreas predichas por los modelos realizados por nosotros (Fig. 3A, 3C y 4B).
Fiabilidad de las predicciones
En todos los casos que se realizaron los modelos de distribución con los tres métodos para su posterior superposición, las áreas resultantes con Biomapper, a grandes rasgos, fueron incluyentes de las de MaxEnt y estas a su vez de las de Bioclim (ver ejemplo en Fig. 1). Por lo tanto, las superficies coincidentes entre los tres, no variaron mucho del resultado de este último método. Como ya se comentó anteriormente, los modelos realizados buscan ofrecer una imagen de la distribución potencial de las especies. Los modelos de este tipo basados únicamente en datos de presencias no pueden validarse con precisión utilizando datos de campo, ya que la especie siempre puede no aparecer en localidades a priori climáticamente favorables. Sin embargo, pueden ponerse a prueba con el objeto de obtener una medida que permita conocer su capacidad predictiva y si sus errores son aceptables (Lobo et al., 2008). Según algunos autores (Hernández et al., 2006, Pearson et al. 2007), MaxEnt es capaz de proporcionar buenas predicciones incluso cuando el numero de presencias es escaso. En nuestro caso, podrá realizarse una comprobación de la fiabilidad de estas predicciones a medida que avancen las prospecciones de micromamíferos en la provincia de Misiones. Sin embargo, cabría preguntarse si existen localidades con inventarios fiables en las que no se haya observado la especie, pero en las que nuestros modelos predigan su presencia. El esfuerzo de colecta para micromamíferos varía ostensiblemente entre las distintas localidades de la provincia estudiada. Las localidades mejor prospectadas han sido (de mayor a menor número de individuos colectados -1853 a 24-): el cruce del arroyo Yabebiry con la ruta nacional 12 (punto D en Fig. 2, Massoia et al., 1989c, combinable con Teyú Cuaré, E en Fig. 2, Massoia et al., 1988); el balneario de la RP UNLP Cuña Pirú (punto F en Fig. 2, Pardiñas et al., 2008); la estancia Santa Inés (punto G en Fig. 2, Pardiñas in litt., 2009), además de Los Helechos, Campo Ramón, Bonpland, Apóstoles, Los Limonales (El Cruce) (Massoia, 1983; Massoia,1988; Massoia et al., 1989a, 1989b, 1989d; Pardiñas in litt., 2009) (puntos H, I, J, K y L en Fig. 2). Aunque para Los Helechos se predice la presencia de Brucepattersonius sp. y para Apóstoles y Los Limonales la de A. philipmyersi, en ninguno de estos dos casos fueron detectadas estas especies. La presencia potencial de Brucepattersonius sp. para la RP UNLP Cuña Pirú se confirmó a posteriori de este análisis (Cirignoli et al., 2011). En nuestra opinión, aunque estas localidades están entre las que poseen mayores colectas, sus inventarios de micromamíferos no pueden considerarse exhaustivos y completamente fiables. Diferencias en el método y esfuerzo de colecta han impedido, muy probablemente, detectar las especies de micromamíferos existentes en estas localidades. Por ejemplo, en la RP UNLP Cuña Pirú y en la Ea. Santa Inés los ejemplares se obtuvieron con trampas Sherman y Víctor colocadas en el suelo, mientras que en resto de las localidades se obtuvieron cráneos o partes óseas a partir del análisis de egagrópilas de la lechuza de campanario (Tyto alba). La selectividad hacia especies de ambientes abiertos por parte de esta lechuza y la parcialidad del muestreo realizado mediante trampas, sumado a que en ningún sitio se combinaron ambos métodos de colecta, serían las razones más probables que explicarían la ausencia de estas especies.
Resolución de la información utilizada
Es común que las distintas variables utilizadas en estos modelos de distribución posean distintas resoluciones, buscándose en ese caso homogeneizar el conjunto de los datos al tamaño de pixel mayor (Brotons et al., 2004, Engler et al., 2004, Sánchez-Cordero et al., 2005, Ríos-Muñoz y Navarro-Sigüenza, 2009). En nuestro caso, la distribución potencial original fue estimada utilizando información climática a una resolución (19 km2) diferente de la que poseían las variables de uso del suelo utilizadas para estimar la distribución potencial actual (0.90 km2). La resolución de los datos climáticos debe ser aquella acorde con los datos biológicos de partida. En nuestro caso decidimos utilizar esta resolución para los datos climáticos ya que el lado del píxel de los modelos de distribución (4.3 km) es aproximadamente la mitad de la distancia entre los dos puntos de presencia conocidos más cercanos (9.5 km para A. philpmyersi). A posteriori, la mayor resolución de la cartografía sobre usos del suelo proporciona representaciones espaciales con un grado mayor de fragmentación, ya que dentro de cada celda de 19 km2 considerada apta por sus valores climáticos promedio, pueden existir muchos pixeles de 0.9 km2 con usos inadecuados. Por ello, hemos preferido aprovechar la diferente resolución de ambos tipos de datos, asumiendo que las variaciones microclimáticas dentro de cada pixel son irrelevantes, mientras que un uso del suelo inadecuado limitaría efectivamente la distribución de cada especie.
Ubicación de nuevas localidades a prospectar
En el caso concreto de los micromamíferos considerados para la provincia de Misiones, nuestros resultados aconsejan realizar nuevas colectas principalmente en el centro del PN Iguazú, norte del PP Urugua-í, norte del PP G.H. Foerster, RUM F. Basaldúa y entre las localidades de Eldorado y Dos de Mayo, al este de El Alcázar (4, 21, 38, 40, A, B y C en Fig. 2).
Disminución del área potencial por efectos antrópicos
Los modelos de distribución que usan solamente presencias e información climática como predictores ofrecen, básicamente, estimaciones sobre las regiones cuya climatología es similar a la existente en las localidades de presencia conocidas. De este modo, la eliminación ulterior de los usos del suelo a priori inapropiados para la especie, asume que las localidades con estas condiciones son incapaces de albergar poblaciones con crecimientos netos demográficos positivos; los individuos podrían hallarse en estos hábitats antropizados o inapropiados pero su presencia se debería a la cercanía de otras poblaciones localizadas sobre hábitats favorables. Este supuesto debería demostrarse aunque resulta razonable. En última instancia, la eliminación de aquellas áreas cuyo hábitat original ha sido transformado ofrece la posibilidad de estimar la posible influencia que los cambios en el uso del suelo han podido tener sobre la disminución del área de distribución de cada especie y su fragmentación.
Si bien existen ejemplos de este tipo de análisis con especies amenazadas, en general han sido realizados con un número mucho mayor de localidades que el presente (Engler et al., 2004; Sánchez-Cordero et al,. 2005; Peterson et al., 2006; Ríos-Muñoz y Navarro- Sigüenza, 2009). Sólo Brotons et al. (2004) utilizaron especies con 15 ocurrencias o más. Por ello, una cuestión más delicada y atrevida es la utilización de las representaciones geográficas de estos modelos para examinar la posible disminución en el área de distribución de las especies debida a cambios en el uso del suelo. Teniendo en cuenta estas consideraciones, nuestros resultados sugieren que las diferentes especies muestran patrones de retracción distintos en su área de distribución. El área potencial actual de A. serrensis y J. pictipes podría haberse reducido básicamente en Brasil y las distribuciones potenciales con menor retracción (Brucepattersonius sp. y A. chebezi), se encuentran principalmente dentro de la Argentina. Estos patrones están relacionados con la proporción del bosque atlántico que ha desaparecido en los distintos países (Di Bitetti et al., 2003). Si se analizan los posibles cambios en la distribución, tanto J. pictipes como A. serrensis serían las especies que habrían experimentado una reducción mayor en su área de distribución potencial original (73% en ambos casos). El tamaño del núcleo principal del área de distribución habría disminuido, en promedio, un 68% y el número de parches se habría multiplicado por 280 aproximadamente. El efecto real de estos importantes cambios sobre las poblaciones de estas especies dependerá de su capacidad para persistir en pequeños parches degradados, como ocurre en el caso de J. pictipes (Pardiñas et al., 2008). Para el resto de las especies, sería necesario obtener más información sobre su demografía, tanto en hábitats degradados, como en pequeñas manchas de vegetación natural. No obstante, nuestros resultados apuntan a que las poblaciones de estas especies poco conocidas de micromamíferos podrían encontrarse gravemente amenazadas, como en el caso de A. chebezi, la cual posee el área de distribución potencial de menor tamaño (actual: 2230 km2).
En estas circunstancias, cualquier modificación ulterior dentro de las áreas de distribución de las especies aparentemente exclusivas de la provincia de Misiones (A. philpmyersi, Brucepattersonius sp. y A. chebezi), podría significar una fragmentación o aislamiento excesivos de las poblaciones, poniendo en peligro la persistencia de algunas de ellas.
AGRADECIMIENTOS
Agradecemos a la Lic. Paula Cichero (DRNEA-APN) y al Dr. Manuel Morales Prieto (Dpto. Ecol.-UAM) por el apoyo brindado a uno de los autores (GEG) en la ejecución del presente trabajo. También a los Sres. Juan C. Chebez, Andrés Bosso y al Dr. Ulyses Pardiñas por brindar generosamente datos aún no publicados y, en el último caso, asesorar sobre datos dudosos. A Karen DeMatteo y Lyn Branch por la revisión del inglés. Al personal de la DRNEA-APN ya que su esfuerzo permitió la dedicación de GEG a este trabajo. Este estudio se realizó con el apoyo del Programa Alban de Alto Nivel de la Unión Europea para América Latina, beca Nº E07D400298AR (GEG). In memoriam de Juan C. Chebez.
LITERATURA CITADA
1. ANDERSON RP, D LEW y A TOWNSEND PETERSON. 2003. Evaluating predictive models of species' distributions: criteria for selecting optimal models. Ecological Modelling 162: 211-232. [ Links ]
2. ARAGÓN P, A BASELGA y JM LOBO. 2010. Global estimation of invasion risk zones for the western corn rootworm Diabrotica virgifera virgifera: integrating distribution models and physiological thresholds to assess climatic favourability. Journal of Applied Ecology 47:1026-1035. [ Links ]
3. BARQUEZ RM, MM DÍAZ y RA OJEDA (eds.). 2006. Mamíferos de Argentina. Sistemática y distribución. SAREM, Tucumán, 356 pp. [ Links ]
4. BEAUMONT LJ, L HUGHES y M POULSEN. 2005. Predicting species distributions: use of climatic parameters in BIOCLIM and its impact on predictions of species' current and future distributions. Ecological Modelling 186:251-270. [ Links ]
5. BROTONS L, W THUILLER, MB ARAÚJO y AH HIRZEL. 2004. Presence-absence versus presence-only modelling methods for predicting bird habitat suitability. Ecography 27:437-448. [ Links ]
6. BROWN J y M LOMOLINO. 1998. Biogeography. Second edition. Sinauer Associates Inc., Sunderland, 691 pp. [ Links ]
7. BURKART R, NO BÁRBARO, RO SÁNCHEZ y DA GÓMEZ. 1999. Ecoregiones de la Argentina PRODIA, Administración de Parques Nacionales, Buenos Aires, 43 pp. [ Links ]
8. CALOSI P, DT BILTON, JI SPICER y A ATFIELD. 2008. Thermal tolerance and geographical range size in the Agabus brunneus Group of European diving beetles (Coleoptera: Dytiscidae). Journal of Biogeography 35:295-305. [ Links ]
9. CLARK LABS. 2003. Idrisi Kilimanjaro. GIS software package. Clark Labs, Worcester, MA. [ Links ]
10. CHEFAOUI R y JM LOBO. 2008. Assessing the effects of pseudo-absences on predictive distribution model performance. Ecological Modelling 210:478-486. [ Links ]
11. CHRISTOFF AU, V FAGUNDES, IJ SBALQUEIRO, MS MATTEVI y Y YONENAGA-YASSUDA. 2000. Description of a new species of Akodon (Rodentia: Sigmodontinae) from southern Brazil. Journal of Mammalogy 81:838-851. [ Links ]
12. CIRIGNOLI S, CA GALLIARI, UFJ PARDIÑAS, DH PODESTÁ y R ABRAMSON. 2011. Mamíferos de la Reserva Valle del Cuña Pirú, Misiones, Argentina. Mastozoología Neotropical 18:25-43. [ Links ]
13. D´ELÍA G, I MORA, P MYERS y RD OWEN. 2008. New and noteworthy records of Rodentia (Erethizontidae, Sciuridae and Cricetidae) from Paraguay. Zootaxa 1784:39-57. [ Links ]
14. DENNIS RLH, TH SPARKS y PB HARDY. 1999. Bias in butterfly distribution maps: the effects of sampling effort. Journal of Insect Conservation 3:33-42. [ Links ]
15. DEPARTAMENTO DE GEOGRAFÍA, INSTITUTO SUPERIOR DEL PROFESORADO "ANTONIO RUIZ DE MONTOYA". 1985. Mapa de la Provincia de Misiones. Físico y Político. Escala 1:250.000. Posadas. [ Links ]
16. DI BITETTI MS, G PLACCI y LA DIETZ. 2003. Una Visión de Biodiversidad para la Ecorregión del Bosque Atlántico del Alto Paraná: Diseño de un Paisaje para la Conservación de la Biodiversidad y prioridades para las acciones de conservación. World Wildlife Fund, Washington D.C., 156 pp. http://assets.wwf.org.br/downloads/altoparana_version_completa.pdf [ Links ]
17. DIRECCIÓN DE PROCESAMIENTO DE INFORMACIÓN SATELITAL Y CÓMPUTOS - DIRECCIÓN DE AREAS NATURALES PROTEGIDAS. 2005- 2007. Provincia de Misiones, Áreas Naturales Protegidas y Corredor Verde. Ministerio de Ecología, Recursos Naturales Renovables y Turismo, Provincia de Misiones. Mapa en archivo .jpg. 1:300.000. Junio de 2007. Coberturas de áreas naturales protegidas, polígonos en archivos .shp, .shx, .dbf. Noviembre 2005. [ Links ]
18. DIRECCIÓN GENERAL DE ESTADÍSTICAS Y CENSOS. 1978. Atlas general de la provincia de Misiones. Provincia de Misiones, Secretaría de Planificación y Control, DGEyC, Posadas, 152 pp. [ Links ]
19. DIVA-GIS 5.2. HIJMANS RJ, L GUARINO, A JARVIS, R O'BRIEN, P MATHUR, E ROJAS, M CRUZ e I BARRANTES. International Plant Genetic Resources Institute (IPGRI), International Potato Center (CIP), UC Berkeley Museum of Vertebrate Zoology, The Secretariat of the Pacific Community and others including SINGER/SGRP, FAO, USDA, SENASA, and BMZ. http://www.diva-gis.org/. [ Links ]
20. DIXON PM, AM ELLISON y J GOTELLI. 2005. Improving the precision of estimates of the frequency or rare events. Ecology 86:1114-1123. [ Links ]
21. ELITH J, CH GRAHAM, RP ANDERSON, M DUDÍK, S FERRIER, A GUISAN, RJ HIJMANS, F HUETTMANN, JR LEATHWICK, A LEHMANN, J LI, LG LOHMANN, BA LOISELLE, G MANION, C MORITZ, M NAKAMURA, Y NAKAZAWA, J MCC OVERTON, AT PETERSON, SJ PHILLIPS, KS RICHARDSON, R SCACHETTI-PEREIRA, RE SCHAPIRE, J SOBERÓN, S WILLIAMS, MS WISZ y NE ZIMMERMANN. 2006. Novel methods improve prediction of species' distributions from occurrence data. Ecography 29:129-151. [ Links ]
22. ENGLER R, A GUISAN y L RECHSTEINER. 2004. An improved approach for predicting the distribution of rare and endangered species from occurrence and pseudo-absence data. Journal of Applied Ecology 41:263-274. [ Links ]
23. EUROPEAN COMMISSION, JOINT RESEARCH CENTRE. 2003. Global land cover 2000 database. http://gem.jrc.ec.europa.eu/products/glc2000/glc2000.php. The Land Cover Map for South America in the Year 2000. H. D. Eva, E. E. de Miranda, C. M. Di Bella, V. Gond, O. Huber, M. Sgrenzaroli, S. Jones, A. Coutinho, A. Dorado, M. Guimarães, C. Elvidge, F. Achard, A. S. Belward, E. Bartholomé, A. Baraldi, G. De Grandi, P. Vogt, S. Fritz, A. Hartley. http://bioval.jrc.ec.europa.eu/products/glc2000/products.php [ Links ]
24. GEISE L, LG PEREIRA, DEP BOSSI y HG BERGALLO. 2004. Pattern of elevational distribution and richness of non volant mammals in Itatiaia National Park and its surroundings, in Southeastern Brazil. Brazilian Journal of Biology 64:599-612. [ Links ]
25. GIL Y CARBÓ GE. 2004. La Complementariedad de Áreas Protegidas con Base en la Diversidad de Mamíferos. Tesis de Maestría, Maestría en Recursos Bióticos, Área Académica de Biología, Instituto de Ciencias Básicas e Ingeniería, Universidad Autónoma del Estado de Hidalgo, Pachuca de Soto, Hidalgo, México, 170 pp. [ Links ]
26. GRAHAM CH, S FERRIER, F HUETTMAN, C MORITZ y AT PETERSON. 2004. New developments in museum-based informatics and applications in biodiversity analysis. Trends in Ecology & Evolution 19:497-503. [ Links ]
27. GUISAN A y NE ZIMMERMANN. 2000. Predictive habitat distribution models in ecology. Ecological Modelling 135:147-186. [ Links ]
28. GURALNICK RP, AW HILL y M LANE. 2007. Towards a collaborative, global infrastructure for biodiversity assessment. Ecological Letters 10:663-672. [ Links ]
29. HERNÁNDEZ PA, CH GRAHAM, LL MASTER y DL ALBERT. 2006. The effect of sample size and species characteristics on performance of different species distribution modeling methods Ecography 29: 773-785. [ Links ]
30. HERSHKOVITZ P. 1994. The Description of a New Species of South American Hocicudo, or Long Nosed Mouse, Genus Oxymycterus (Sigmodontinae, Muroidea), with a Critical Review of the Generic Context. Fieldiana, Zoology, new series 79:1-43. [ Links ]
31. HERSHKOVITZ P. 1998. Report on some sigmodontine rodents collected in southeastern Brazil with descritions of a new genus and six new species. Bonner Zoologische BeitrÄge 47:193-256. [ Links ]
32. HIJMANS RJ, SE CAMERON, JI PARRA, PG JONES y A JARVIS. 2005. Very high resolution interpolated climate surfaces for global land areas. International Journal of Climatology 25:1965-1978. [ Links ]
33. HIRZEL AH. 1998-2008. Biomapper 4.0 Version 4.0.6.370. http://www.unil.ch/biomapper. [ Links ]
34. HIRZEL AH, J HAUSSER, D CHESSEL y N PERRIN. 2002. Ecological-niche factor analysis: How to compute habitat-suitability maps without absence data? Ecology 83:2027-2036. [ Links ]
35. HORTAL J, JM LOBO y F MARTÍN-PIERA. 2001. Forecasting insect species richness scores in poorly surveyed territories: the case of the Portuguese dung beetles (Col. Scarabaeinae). Biodiversity and Conservation 10:1343-1367. [ Links ]
36. HORTAL J, A JIMÉNEZ-VALVERDE, JF GÓMEZ, JM LOBO y A BASELGA. 2008. Historical bias in biodiversity inventories affects the observed environmental niche of the species. Oikos 117:847-858. [ Links ]
37. JIMÉNEZ-VALVERDE A, VM ORTUÑO y JM LOBO. 2007. Exploring the distribution of Sterocorax Ortuño, 1990 (Coleoptera, Carabidae) species in the Iberian Peninsula. Journal of Biogeography 34:1426-1438. [ Links ]
38. JIMÉNEZ-VALVERDE A, JM LOBO y J HORTAL. 2008. Not as good as they seem: the importance of concepts in species distribution modelling. Diversity and Distributions 14:885-1032. [ Links ]
39. KADMON R, O FARBER y A DANIN. 2003. A systematic analysis of factors affecting the performance of climatic envelope models. Ecological Applications 13:853-867. [ Links ]
40. KADMON R, O FARBER y A DANIN. 2004. Effect of roadside bias on the accuracy of predictive maps produced by bioclimatic models. Ecological Applications 14:401-413. [ Links ]
41. LOBO JM. 2008. More complex distribution models or more representative data? Biodiversity Informatics 5:14-19. [ Links ]
42. LOBO JM, A JIMÉNEZ-VALVERDE y R REAL. 2008. AUC: a misleading measure of the performance of predictice distribution models. Global Ecology and Biogeography 17:145-151. [ Links ]
43. MARES MA y JK BRAUN. 2000. Three New Species of Brucepattersonius (Rodentia: Sigmodontinae) from Misiones Province, Argentina. Occasional Papers Sam Noble Oklahoma Museum of Natural History 9:1-13. [ Links ]
44. MARTÍNEZ-MEYER E. 2005. Climate change and biodiversity: some considerations in forecasting shifts in species potential distributions. Biodiversity Informatics 2:42-55. [ Links ]
45. MARTÍN-PIERA F y JM LOBO. 2003. Database records as a sampling effort surrogate to predict spatial distribution of insects in either poorly or unevenly surveyed areas. Acta Entomológica Ibérica e Macaronésica 1:23-35. [ Links ] 46. MASSOIA E. 1963. Oxymycterus iheringi (Rodentia- Cricetidae), nueva especie para la Argentina. Physis XIV:129-136 [ Links ]
47. MASSOIA E y A FORNES. 1969. Caracteres comunes y distintivos de Oxymycterus nasutus (Waterhouse) y O. iheringi Thomas (Rodentia, Cricetidae). Physis XXVIII:315-321. [ Links ]
48. MASSOIA E. 1983. La alimentación de algunas aves del orden Strigiformes en la Argentina. El Hornero, Número Extraordinario:125-148. [ Links ] 49. MASSOIA E. 1988. Presas de Tyto alba en Campo Ramón, departamento Oberá, provincia de Misiones - 1. APRONA Boletín Científico 7:4-16. [ Links ]
50. MASSOIA E. 1993. Los roedores misioneros - 1 - Lista sistemática comentada y geonemia provincial conocida. APRONA Boletín Científico 25:42-51. [ Links ]
51. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1991. Nuevos o poco conocidos cráneos de mamíferos vivientes - 3 - Abrawayaomys ruschii de la provincia de Misiones, República Argentina. APRONA Boletín Científico 19:39-40. [ Links ]
52. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1988. Depredación de mamíferos por Tyto alba tuidara en Teyú Cuaré, departamento San Ignacio, provincia de Misiones. APRONA Boletín Científico 8:7-13. [ Links ]
53. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1989a. Segundo análisis comparado de Tyto alba tuidara en el departamento Apóstoles, provincia de Misiones. APRONA Boletín Científico 13:3-8. [ Links ]
54. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1989b. Análisis de regurgitados de Tyto alba tuidara de Los Helechos, Deparatamento Oberá, provincia de Misiones. APRONA Boletín Científico 14:16-22. [ Links ]
55. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1989c. Mamíferos y aves depredados por Tyto alba tuidara en el arroyo Yabebyri, Deparatamento Candelaria, provincia de Misiones. APRONA Boletín Científico 15:8-13. [ Links ]
56. MASSOIA E, JC CHEBEZ y S HEINONEN FORTABAT. 1989d. Mamíferos y aves depredados por Tyto alba tuidara en Bonpland, Deparatamento Candelaria, provincia de Misiones. APRONA Boletín Científico 15:19-24. [ Links ]
57. MASSOIA E, JC CHEBEZ y A BOSSO. 2006. Los mamíferos silvestres de la provincia de Misiones, Argentina. CD. Ed. de los autores, Buenos Aires, Argentina, 512 pp. [ Links ]
58. MINISTERIO DO MEIO AMBIENTE. Sin fecha. Portal Brasileiro de Biodiversidade. Mapas de Cobertura Vegetal dos Biomas Brasileiros. http://mapas.mma.gov.br/mapas/aplic/probio/datadownload.htm. Consultado el 6/5/08. [ Links ]
59. NERI-BASTOS FA, DM BARROS-BATTESTI, PM LINARDI, M AMAKU, A MARCILI, SE FAVORITO y R PINTO-DA-ROCHA. 2004. Ectoparasites of wild rodents from Parque Estadual da Cantareira (Pedra Grande Nuclei), São Paulo, Brazil. Revista Brasileira de Parasitologia Veterinária 13:29-35. [ Links ]
60. PARDIÑAS UFJ, G D´ELÍA, S CIRIGNOLI y P SUAREZ. 2005. A new species of Akodon (Rodentia, Cricetidae) from the northern campos grasslands of Argentina. Journal of Mammalogy 86:462-474. [ Links ]
61. PARDIÑAS UFJ, G D´ELIA, P TETA, PE ORTIZ, PJ JAYAT y S CIRIGNOLI. 2006. Tribu Akodontini Vorontsov, 1959 (sensu D´Elía, 2003). Pp. 146-166, en: Mamíferos de Argentina. Sistemática y distribución (RM Barquez, MM Díaz y RA Ojeda, eds.). SAREM, Tucumán, Argentina. [ Links ]
62. PARDIÑAS UFJ, P TETA, G D´ELIA y C GALLIARI. 2008. Rediscovery of Juliomys pictipes (Rodentia: Cricetidae) in Argentina: emended diagnosis, geographic distribution, and insights on genetic structure. Zootaxa 1758:29-44. [ Links ]
63. PARDIÑAS UFJ, P TETA y G D´ELIA. 2009. Taxonomy and distribution of Abrawayaomys (Rodentia: Cricetidae), an Atlantic Forest endemic with the description of a new species. Zootaxa 2128:39-60. [ Links ]
64. PATTERSON BD, G CEBALLOS, W SECHREST, MF TOGNELLI, T BROOKS, L LUNA, P ORTEGA, I SALAZAR y BE YOUNG. 2007. Digital Distribution Maps of the Mammals of the Western Hemisphere, version 3.0. NatureServe, Arlington, Virginia, USA, en: INFONATURA Animals and Ecosystems of Latin America [web application]. Version 5.0. Arlington, Virginia (USA): NatureServe. Disponible en: http://www.natureserve.org/infonatura. (Consultado el 29/7/09). [ Links ]
65. PEARSON RG, CJ RAXWORTHY, M NAKAMURA y AT PETERSON. 2007. Predicting species distribution from small numbers of occurrence records: a test case using cryptic geckos in Madagascar. Journal of Biogeography 34:102-117. [ Links ]
66. PEDUZZI P, J CONCATO, R KEMPER, TR HOLFORD y AR FEINSTEIN. 1996. A simulation study of the number of events per variable in logistic regression analysis. Journal of Clinical Epidemiology 49:1373- 1379. [ Links ]
67. PEREIRA J, P TETA, N FRACASSI, A JOHNSON y P MOREYRA. 2005. Sigmodontinos (Rodentia, Cricetidae) de la Reserva de Vida Silvestre Urugua-í (Provincia de Misiones, Argentina), con la confirmación de la presencia de "Akodon" serrensis en la Argentina. Mastozoología Neotropical 12:83-89. [ Links ]
68. PETERSON AT. 2006. Uses and requirements of ecological niche models and related distributional models. Biodiversity Informatics 3:59-72. [ Links ]
69. PETERSON AT, V SÁNCHEZ-CORDERO, E MARTÍNEZ-MEYER y AG NAVARRO-SIGüENZA. 2006. Tracking population extirpations via melding ecological niche modeling with land-cover information. Ecological Modelling 195: 229-236. [ Links ]
70. PHILLIPS SJ, RP ANDERSON y RE SCHAPIRE. 2006. Maximun entropy modeling of species geographic distributions. Ecological modelling 190:231-259. www.cs.princeton.edu/schapire/maxent/. [ Links ]
71. PLACI G y M DI BITETTI. 2005. Situación ambiental en la ecorregión del bosque Atlántico del alto Paraná (selva paranaense). Pp. 197-225, en: La situación ambiental argentina (A Brown, U Martinez Ortiz, M Acerbi y J Corcuera, eds.). FVSA. http://www.vidasilvestre.org.ar/descargables/libro_imperdible/selva%20paranaense.pdf . [ Links ]
72. REIG OA y JA KIRSCH. 1988. Descubrimiento del segundo ejemplar conocido y de la presencia en Argentina del peculiar sigmodontino (Rodentia: Cricetidae) Abrawayaomys ruschii Souza Cuña et Cruz. 4as Jornadas Argentinas de Mastozoología, Resúmenes: 80 [ Links ]
73. REUTTER BA, V HELFER, A HIRZEL y P VOGEL. 2003. Modelling habitat-suitability using museum collections: an example with three sympatric Apodemus species from the Alps. Journal of Biogeography 30:581-590. [ Links ]
74. RÍOS-MUÑOZ CA y A NAVARRO-SIGüENZA. 2009. Efectos del cambio de uso de suelo en la disponibilidad hipotética de hábitat para los psitácidos de México. Ornitología Neotropical 20:491-509. [ Links ]
75. SÁNCHEZ-CORDERO V, P ILLOLDI-RANGEL, MA LINAJE, S SARKAR y AT PETERSON. 2005. Deforestation and extant distributions of Mexican endemic mammals. Biological Conservation 126:465-473. [ Links ]
76. SÁNCHEZ-FERNÁNDEZ D, JM LOBO y OL HERNÁNDEZ-MANRIQUE 2011. Species distribution models that do not incorporate global data misrepresent potential distributions: a case study using Iberian diving beetles. Diversity and Distributions 17:163-171. [ Links ]
77. SOBERÓN J y AT PETERSON. 2004. Biodiversity informatics: Managing and applying primary biodiversity data. Philosophical Transactions of The Royal Society of London B 359:689-698. [ Links ]
78. SOBERÓN J y AT PETERSON. 2005. Interpretation of models of fundamental ecological niches and species' distributional areas. Biodiversity Informatics 2:1-10. [ Links ]
79. SOBERÓN J. 2007. Grinnellian and Eltonian niches and geographic distributions of species. Ecology Letters 10:1115-1123. [ Links ]
80. TAVARES DA FONSECA M. 2001. Considerações sobre a mastofauna do Parque Estadual do Rio Doce. CRB 13089/4, 23 pp. http://www.ief.mg.gov.br/images/stories/plano_manejo_perd/an2.zip, en: Plano de Manejo - P.E. do Rio Doce, IEF (Instituto Estadual Forestal de Minas Gerais). http://www.ief.mg.gov.br/index.php?option=com_contentytask=viewyid=306yI temid=72. (Consultado el 23/4/08). [ Links ]
81. WORLD WIDE FUND FOR NATURE. 2002. Global 200. Blueprint for a living planet. www.panda.org. (Consultado el 13/8/03). [ Links ]














