Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.20 no.1 Mendoza jun. 2013
ARTÍCULO
Descripción morfológica del esqueñeto axial de filotinos (Rodentia: Sigmodontinae): Aspectos morfofuncionales y filogenéticos
Luz. V. Carrizo1 y M. Mónica Díaz2, 3, 4
1 Cátedra de Biología General, Facultad de Ciencias Naturales, Universidad Nacional de Tucumán, Miguel Lillo 205, 4000 San Miguel de Tucumán, Tucumán, Argentina [Correspondencia: <luzvaleria.carrizo@gmail.com>].
2 PIDBA, Facultad de Ciencias Naturales, Universidad Nacional de Tucumán, Miguel Lillo 205, 4000 San Miguel de
Tucumán, Tucumán, Argentina.
3 Fundación Miguel Lillo, Miguel Lillo 211, 4000 San Miguel de Tucumán, Tucumán, Argentina.
4 CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas), Argentina.
Recibido 2 agosto 2012.
Aceptado 28 enero 2013.
Editor asociado: F Prevosti
RESUMEN. Los estudios de taxonomía y filogenia en roedores filotinos en particular, y en sigmodontinos en general, se han enfocado en el análisis de las características externas, craneales y dentarias, otorgándole menor importancia al esqueleto postcraneal. Es por esto que se planteó un estudio descriptivo y comparativo de los elementos óseos del esqueleto axial de los representantes de la tribu Phyllotini sobre la base de 140 ejemplares pertenecientes a 10 géneros y 26 especies. Los objetivos del estudio fueron contribuir al conocimiento de la anatomía postcraneal de los filotinos, determinar los morfotipos de las estructuras vertebrales e identificar patrones morfológicos con un probable significado funcional y filogenético. Nuestros resultados indican que el esqueleto axial está formado por 7 vértebras cervicales, 12 ó 13 torácicas, 6 ó 7 lumbares, 4 sacras y 25 a 35 caudales. Cada región presenta distintos patrones morfológicos entre las especies, que podrían vincularse con aspectos tales como la postura, el tipo de locomoción, el uso del hábitat, el tamaño corporal o la historia evolutiva del grupo. El análisis realizado demuestra que el postcráneo en roedores filotinos constituye una valiosa fuente de evidencia para estudios taxonómicos, morfofuncionales y filogenéticos; como en otros grupos de mamíferos, presenta patrones morfológicos que revelan ciertos aspectos de las capacidades locomotoras y permite indicar relaciones entre géneros y especies en concordancia con hipótesis previas sobre la base de otros datos.
ABSTRACT. Morphological description of the axial skeleton of phyllotines (Rodentia: Sigmodontinae): morphofunctional and phylogenetics aspects. Taxonomic and phylogenetic studies in phyllotine rodents in particular, and in sigmodontines in general, have been mainly focused on external, cranial and dental characteristics, being the postcranial anatomy less important. Based on the examination of 140 specimens belonging to 24 species and 10 genera, we described and compared the elements of the axial skeleton of the members of the Phyllotini Tribe. The aims of this study are to contribute to the knowledge of the postcranial anatomy of phyllotines, to determine the morphotypes of the vertebral structures, and to identify morphological paterns with a probable functional and phylogenetic significance. The axial skeleton consists of seven cervical, 12 or 13 thoracic, six or seven lumbar, four sacral, and 25 to 35 caudal vertebrae. Each region presents different morphological paterns, which could be linked to aspects as posture, locomotion type, habitat use, body size, or even evolutionary history of the group. The analysis demonstrates that postcranium would constitute a valuable source of evidence in taxonomic, morphofunctional and phylogenetic studies, since, as in other mammals, it shows morphological paterns that reveal some aspects of the locomotor capabilities and it allows to find relationships between genera and species according to previous hypotheses based on different evidence.
Palabras claves: Anatomía; Filogenia; Morfología funcional; Phyllotini; Vértebras
Key words: Anatomy; Functional morphology; Phyllotini; Phylogeny; Vertebrae.
INTRODUCCIÓN
Los roedores filotinos se distribuyen principalmente en América del Sur ocupando diversos ambientes como pastizales, desiertos y semidesiertos a lo largo de los Andes y tierras bajas del Cono Sur sudamericano (Reig, 1986). Estos roedores presentan una radiación adaptativa que incluye principalmente formas terrestres y algunas especies con adaptaciones relacionadas con hábitos semiarboricolas y saltadores (Hershkovitz, 1962; Braun, 1993). Dentro de filotinos se reconocen aproximadamente 52 especies vivientes agrupadas en 13 géneros (ver Musser y Carleton, 2005; Jayat et al., 2007; Mares et al., 2008; Bonvicino et al., 2010; Ferro et al., 2010). Los estudios taxonómicos y filogenéticos han estado enfocados en el análisis de los caracteres craneales, dentarios y moleculares (Pearson, 1958; Hershkovitz, 1962; Pearson y Patton, 1976; Williams y Mares, 1978; Simonetti y Spotorno, 1980; Olds y Anderson, 1989; Braun, 1993; Steppan, 1993, 1995; Jayat et al., 2007; Steppan et al, 2007; Mares et al., 2008; Ferro y Martínez, 2009; Ferro et al., 2010), bajo el supuesto de que este tipo de evidencia refleja mejor las diferencias y relaciones entre los grupos. Es por esto que la morfología del esqueleto postcraneal ha sido poco estudiada y los datos disponibles son fragmentarios y están restringidos a unas pocas especies. Carleton (1980) incluye algunos caracteres postcraneales en su análisis de las relaciones de neotominos-peromyscinos, considerando al menos dos especies de filotinos (Calomys callosus y Graomys griseoflavus). Así un sustancial aporte es realizado por Steppan (1995), quien describió 14 caracteres postcraneales que fueron utilizados junto con otros caracteres morfológicos para estudiar la estructura filogenética de Phyllotini. La falta de información postcraneal también ocurre a nivel general dentro de los sigmodontinos, y existen pocos trabajos que han considerado al postcráneo como fuente de evidencia en análisis taxonómicos y filogenéticos (Voss, 1988; Steppan, 1995; Pacheco, 2003; Weksler, 2006; Pardiñas et al., 2009; Machado et al., 2011). Por otro lado, la falta de información descriptiva básica del esqueleto postcraneal lleva a que los diversos aspectos morfofuncionales de los roedores filotinos, tales como locomoción, postura y patrones de comportamiento, estén pobremente explorados. Más aún, resta conocer si existe alguna asociación entre la morfología del postcráneo y los distintos modos locomotores. Algunos de estos aspectos han sido explorados en filotinos por Hershkovitz (1962), pero en base a los rasgos morfológicos externos. Por el contrario, en otros grupos de mamíferos la morfología postcraneal está ampliamente estudiada y ha sido utilizada intensamente con fines taxonómicos y morfofuncionales (Howell, 1926; Hatt, 1932; Robert, 1974; Taylor, 1974, 1976; Evans, 1993; Gebo y Sargis, 1994; Argot, 2001, 2002, 2003; Sargis, 2001, 2002a,b; Morgan y Verzi, 2006; Candela y Picasso, 2008; Flores y Díaz, 2009; Morgan, 2009; Abello y Candela, 2010; Morgan y Verzi, 2011; entre otros) y más limitadamente en estudios filogenéticos (Horovitz y Sánchez-Villagra, 2003; Giannini y Simmons, 2005; Flores, 2009).
Considerando que existe poca información descriptiva de postcráneo de estos roedores, en este trabajo se describen y comparan los elementos óseos de cada región del esqueleto axial. Se examinaron 10 géneros y 26 especies de filotinos con los propósitos de reconocer los distintos morfotipos que presentan las estructuras vertebrales e identificar patrones morfológicos con un probable significado funcional y filogenético. En este contexto, se pretende contribuir al conocimiento de la anatomía postcraneal de los filotinos, proporcionar caracteres potencialmente útiles para estudios taxonómicos y filogenéticos y aportar información acerca de las capacidades específicas de movimiento de la columna vertebral en estos roedores.
MATERIALES Y MÉTODOS
En total se examinaron 140 ejemplares correspondientes a 26 especies incluidas en los siguientes géneros, en orden alfabético: Andalgalomys, Auliscomys, Calomys, Chinchillula, Eligmodontia, Graomys, Loxodontomys, Phyllotis, Salinomys y Tapecomys (Apéndice).
Para la nomenclatura taxonómica se siguió a Musser y Carleton (2005), con la excepción de Andinomysedax, considerado filotino por estos autores y tratado aquí como sigmodontino incertae sedis (D'Elía et al., 2005, 2006) y Paralomys gerbillus, tratado aquí como especie de Phyllotis (Steppan et al., 2007; Zeballos, 2009). Se compararon y describieron en detalle cada parte de la columna vertebral, considerando la forma, superficie, tamaño y orientación de las estructuras vertebrales y la variación en número de las vértebras. Todos los especímenes examinados fueron adultos y, en aquellas especies con material suficiente, se revisaron 10 individuos, 5 hembras y 5 machos, a fin de balancear las variaciones de edad y sexo. Las especies con escaso material postcraneal depositado en las colecciones (e.g., Auliscomys sublimis, A. pictus, Andalgalomys olrogi, A. roigi, Salinomysdelicatus y Tapecomys primus) están representadas por 1 ó 2 ejemplares. En algunas especies (A. roigi, Eligmodontia puerulus, Phyllotis amicus y P. gerbillus) la información de ciertas estructuras óseas no pudo describirse debido a que el material estaba dañado o incompleto. En Resultados se describe la morfología general de las estructuras óseas y se resaltan solo aquellas que presentaron diferencias entre las especies.
Para la nomenclatura anatómica y criterios de posición de los huesos del esqueleto axial se siguieron varios trabajos previos, principalmente para roedores (Hatt, 1932; Evans, 1993; Sargis, 2001; Argot, 2003; Bezuidenhout y Evans, 2005; Flores y Díaz, 2009; entre otros). Las estructuras homólogas fueron establecidas en base a la literatura (Evans, 1993; Argot, 2003; Bezuidenhout y Evans, 2005) y a través de la comparación de los ejemplares estudiados. Para las interpretaciones funcionales se utilizaron -como base comparativa- estudios realizados en roedores y en otros grupos de mamíferos (p.e., Hatt, 1932; Hildebrand, 1988; Sargis, 2001; Argot, 2003; Muizon y Argot, 2003; Youlatos, 2003; Flores y Díaz, 2009; Abello y Candela, 2010).
RESULTADOS
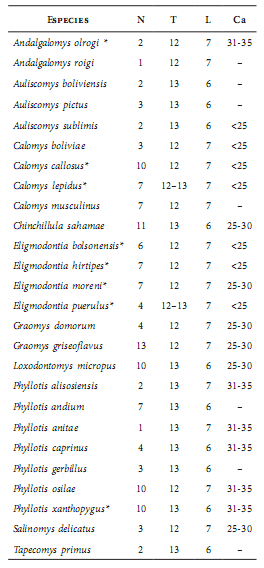
La columna vertebral de los filotinos posee 7 vértebras cervicales, 12 ó 13 torácicas, 6 ó 7 lumbares, 4 sacras y 25 a 35 caudales (Tabla 1). Además de su variación en el número, las vértebras presentan una marcada variación en la forma, tamaño y orientación de sus estructuras (procesos espinosos, procesos transversos, procesos accesorios y facetas de articulación), lo que permite identificar morfotipos particulares.
Tabla 1
Número de vértebras en roedores de la tribu Phyllotini. Referencias: Ca = caudales, L = lumbares, N = número de ejemplares, T = torácicas; * = presencia de costillas supernumerarias.
Atlas
En general es redondeado (Fig. 1A) aunque en A. boliviensis, A. pictus, A. sublimis, C. boliviae, C. sahamae, P. anitae, P. alisosiensis y P. xanthopygus es subtriangular (Fig. 1B). El arco neural, en la mayoría de las especies, es similar en longitud a la extensión craneocaudal de lo procesos transversos (Fig. 1B) comparado con aquellos de A. sublimis, C. lepidus y C. musculinus donde es más corto (Fig. 1 A); siendo esta última condición más marcada en las especies examinadas de Eligmodontia. El borde craneal del arco es casi recto y el caudal es cóncavo (Fig. 1A), excepto en A. roigi, E. hirtipes, E. puerulus, P. anitae, P. alisosiensis, P. osilae, P. xanthopygus y T. primus, con ambos bordes rectos (Fig. 1B) y en A. olrogi, P. andium y S. delicatus con los bordes cóncavos en la parte medial. Los procesos transversos son subcuadrangulares y poco desarrollados, comparados con otros sigmodontinos como orizominos (L. Carrizo, observación personal), roedores equímidos como Eumysops (Olivares, 2009) y marsupiales didélfidos como Caluromys (Argot, 2003; Flores y Díaz, 2009) en los cuales los procesos están muy extendidos lateralmente. En filotinos, los procesos transversos se extienden apenas lateral-caudalmente hasta casi al mismo nivel de la faceta caudal en A. olrogi, A. roigi, A. boliviensis, C. sahamae, G. domorum, G. griseoflavus, P. anitae, P. caprinus, P. osilae, P. xanthopygus, L. micropus y S. delicatus (Fig. 1B); mientras que están muy reducidos en A. pictus, A. sublimis, P. alisosiensis, P. andium, T. primus y en todas las especies de Calomys y Eligmodontia (Fig. 1A). En vista caudal, los procesos transversos forman un lóbulo más notable en A. boliviensis, C. boliviae, C. callosus y P. caprinus. El foramen alar, en general, es ovalado, pero se ha observado variación individual, ya que en algunos ejemplares de G. griseoflavus y P. andium es redondo; su ubicación también es variable entre los ejemplares, pudiendo registrarse sobre los procesos transversos o sobre el arco neural. El tubérculo dorsal, en la mayoría de las especies, es una protuberancia evidente (Fig. 1B), aunque ausente en A. boliviensis, A. pictus, C. lepidus, C. musculinus, E. bolsonensis, P. andium, P. caprinus y T. primus (Fig. 1A). En C. sahamae el tubérculo dorsal puede estar apenas desarrollado o ausente. Las facetas craneales están orientadas anteriormente, excepto en P. caprinus, P. osilae y P. xanthopygus que son anteromediales (Fig. 1B). Estas son relativamente cóncavas y más profundas cráneo-caudalmente en A. olrogi, A. roigi, en las especies de Auliscomys y Calomys, G. griseoflavus y P. alisosiensis (Fig. 1A). El borde dorsal de la faceta está curvado en A. sublimis, C. boliviae, C. callosus, en todas las especies del género Eligmodontia (más notable en E. bolsonensis), G. griseoflavus, P. anitae, S. delicatus y T. primus. Las facetas caudales son ovaladas, excepto en A. olrogi, A. pictus, G. domorum, G. griseoflavus, L. micropus y T. primus donde son redondas. En general, están orientadas caudo-medialmente, excepto en L. micropus de orientación caudal y en las especies de Phyllotis de orientación medial. Los forámenes transversos son redondos. El tubérculo ventral está bien desarrollado, es corto y ancho con el borde caudal comprimido a modo de quilla, muy evidente en A. boliviensis, C. sahamae, las especies de Eligmodontia y en T. primus; se orienta ventralmente, excepto en algunos ejemplares de C. musculinus y G. domorum donde es posteroventral.

Fig. 1. Vista craneal, caudal y dorsal del atlas: A) Calomys musculinus (CML 3597); B) Phyllotis xanthopygus (CML 7984). Vista craneal y cráneolateral del axis: C) Chinchillula sahamae (CBF 3264); D) Graomys griseoflavus (CML 3493); E) Salinomys delicatus (CML 3171); F) Andalgalomys olrogi (CML 8441); G) Calomys callosus (CML 7175) y H) Auliscomys sublimis (CML 8476); an, arco neural; bca, borde caudal; bcr, borde craneal; d, dens; fal, foramen alar; fca, faceta de articulación caudal; fcr, faceta de articulación craneal; fr, foramen transverso; lo, lóbulo; pe, proceso espinoso; ptr, proceso transverso; td, tubérculo dorsal; tv, tubérculo ventral. Escala 5 mm.
Axis
De forma redondeada o subtriangular; en el primer caso, el arco neural se encuentra levemente arqueado, aspecto observado en la mayoría de las especies analizadas (Fig. 1E); mientras que en el segundo el arco converge dorsalmente en forma recta, condición presente en A. roigi, A. sublimis, C. boliviae, C. callosus, C. sahamae, G. griseoflavus, L. micropus y P. xanthopygus (Figs. 1C y 1D). El arco neural es largo y el proceso espinoso es un tubérculo alto, ancho en su base con el extremo distal ligeramente comprimido y truncado (Fig. 1D). En vista lateral (Figs. 2A y 2B), los bordes craneal, dorsal y caudal del proceso espinoso son rectos; en particular el borde dorsal forma una superficie triangular notable en vista dorsal (Figs. 2A y 2B). En C. sahamae el proceso espinoso es muy alto, ancho y con el borde craneal muy comprimido formando una quilla (Fig. 1C); en Andalgalomys, A. sublimis, C. lepidus, C. musculinus, Eligmodontia y S. delicatus es proporcionalmente más bajo y ancho desde la base hasta el extremo (Fig. 1E). En G. domorum dicho proceso es más comprimido que en G. griseoflavus; además, se diferencia del de L. micropus porque la superficie triangular del borde dorsal es mayor, y de las especies de Phyllotis porque es más alto y comprimido. Dentro del género Phyllotis, P. alisosiensis presenta un proceso más ancho en comparación con las restantes especies estudiadas del género.

Fig. 2. Vista dorsal, lateral y ventral de las vértebras cervicales posteriores: A) Eligmodontia moreni (CML 8397); B y C) Graomys griseoflavus (CML 3493). Vista lateral de las vértebras torácicas: D) Chinchillula sahamae (CBF 3264); E y F) Graomys griseoflavus (CML 3927); an, arco neural; ax, axis; Co1, primera costilla; Co, costilla; d, dens; eiv, espacio intervertebral; fcr, faceta de articulación craneal; lv, lámina ventral; pac, proceso accesorio; pe, proceso espinoso; pm, proceso mamilar; ptr, proceso transverso; pv, proceso ventral; sd, superficie dorsal; T2-T11, vértebras torácicas; va, vértebra anticlinal; vd, vértebra diafragmática. Escala 5 mm.
Las facetas craneales presentan varios morfotipos; son ovaladas en C. boliviae, C. callosus, E. bolsonensis, E. hirtipes, E. puerulus, E. moreni, P. anitae, P. alisosiensis, P. osilae, P. xanthopygus y S. delicatus (Fig. 1G); redondeadas en A. olrogi, A. roigi, G. domorum, G. griseoflavus, P. caprinus y T. primus (Fig. 1F) y ventralmente expandidas con el borde ventrolateral angular en A. boliviensis, A. pictus, A. sublimis, C. lepidus, C. musculinus, C. sahamae, L. micropus y P. andium (Fig. 1H). En todos estos casos, estas facetas tienen un diámetro dorsoventral mayor, de superficie plana y se orientan cráneo-lateralmente; sin embargo, en algunas especies la orientación es craneal (A. sublimis, C. sahamae, G. domorum, P. andium, P. caprinus y en algunos ejemplares de E. puerulus), o más lateral (L. micropus). El proceso odontoides (dens) se orienta anterodorsalmente y en la mayoría de las especies no se continúa con la faceta de articulación craneal; dicho contacto se observó en C. boliviae, P. caprinus, P. osilae, P. xanthopygus, E. bolsonensis, E. hirtipes, E. puerulus, L. micropus, S. delicatus y T. primus. Los procesos transversos se orientan caudalmente y se extienden, en general, hasta el extremo caudal de la postcigapófisis; en C. sahamae el proceso es corto y no alcanza la postcigapófisis y en S. delicatus y algunos ejemplares de E. puerulus, la sobrepasa ligeramente. Los forámenes transversos son redondos, y en A. pictus, C. lepidus, C. musculinus, C. sahamae, E. bolsonensis, E. hirtipes, E. puerulus, E. moreni, P. caprinus, P. osilae, P. xanthopygus y T. primus son proporcionalmente más grandes que en el resto de los taxones examinados. Ventralmente, la vértebra es plana, ancha y se extiende posteriormente y termina en un proceso que articula con la siguiente vértebra (Fig. 2C); dicho proceso es largo y estrecho en todas las especies examinadas, excepto en E. bolsonensis, E. hirtipes, E. puerulus, E. moreni, P. anitae, P. caprinus, P. gerbillus, P. xanthopygus y S. delicatus donde es corto y ancho. En A. pictus, C. lepidus, C. musculinus, P. alisosiensis y P. osilae ambos tipos de procesos están presentes. En la superficie ventral del axis no se observó ningún foramen.
Vértebras cervicales posteriores (C3-7)
La forma y el tamaño de las vértebras cervicales se mantienen constantes a lo largo de toda la serie (Fig. 2). Son bajas y anchas con cuerpos vertebrales deprimidos, de forma elíptica y con la extremidad craneal cóncava y la caudal ligeramente convexa. Los arcos neurales son proporcionalmente cortos en todas las cervicales de A. olrogi, A. roigi, A. boliviensis, A. pictus, A. sublimis, C. lepidus, C. musculinus, E. bolsonensis, E. hirtipes, E. puerulus, E. moreni, P. andium, P. gerbillus y S. delicatus (Fig. 2A), y largos en C. boliviae, C. callosus, C. sahamae, G. domorum, G. griseoflavus, P. anitae, P. alisosiensis, P. caprinus, P. osilae, P. xanthopygus, L. micropus y T. primus (Fig. 2B). Los bordes anteriores y posteriores son en general rectos, aunque en algunas especies (A. boliviensis, A. pictus, C. boliviae, C callosus, G. domorum, G. griseoflavus, P. andium, P. caprinus, P. osilae y P. xanthopygus) presentan una concavidad medial. Los espacios intervertebrales son moderadamente amplios; sin embargo, pueden reducirse entre el axis y la C3 o estar ausentes como en A. olrogi, A. sublimis, C. callosus y L. micropus. Los procesos espinosos, en la mayoría de los taxones examinados, están reducidos a pequeños tubérculos (Fig. 2B), pero en C. sahamae tienen forma de espinas (Fig. 2D) y en A. pictus, A. sublimis, C. lepidus, C. musculinus, Eligmodontia spp., P. andium, P. gerbillus y S. delicatus están ausentes (Fig. 2A). Los procesos transversos son alargados, se dirigen caudalmente en las primeras cervicales (C3 a C5) y son subperpendiculares o perpendiculares al eje anteroposterior del cuerpo en C6 y C7 (Figs. 2A, 2B y 2C). Los forámenes transversos son ovalados y se encuentran en todas las vértebras cervicales, excepto en la C7. La lámina ventral, presente en C6, tiene forma de yunque con el extremo distal extendido anteroposteriormente (proceso posterior más extendido que el anterior) y orientada caudalmente. En vista ventral, los cuerpos vertebrales son planos y se extienden apenas posteriormente para articular entre sí. Las precigapófisis se orientan dorsomedialmente, y la postcigapófísis, ventromedialmente; ambas articulaciones se unen oblicuamente al plano sagital.
Vértebras torácicas (T1-12 ó 13)
El número es variable, 12 en A. olrogi, A. roigi, C. boliviae, C. callosus, C. musculinus, E. bolsonensis, E. hirtipes, E. moreni, G. domorum, G. griseoflavus, P. osilae y S. delicatus y 13 en A. boliviensis, A. pictus, A. sublimis, C. sahamae, P. alisosiensis, P. andium, P. anitae, P. caprinus, P. gerbillus, P. xanthopygus, L. micropus y T. primus. En E. puerulus y C. lepidus se registran tanto individuos con 12 como con 13 (Tabla 1). Son altas y comprimidas comparadas con las vértebras cervicales y los cuerpos vertebrales son pequeños y subrectangulares. La longitud de los arcos neurales aumenta posteriormente, son cortos de T1 a T5, con espacios intervertebrales amplios, y son largos con espacios reducidos a partir de la T6. Este patrón morfológico se observa sólo en filotinos a diferencia de otros grupos de sigmodontinos (akodontinos, abrotriquinos y orizominos) en los cuales los arcos neurales tienen longitudes similares a lo largo de toda la serie torácica (L. Carrizo, observación personal). En todos los taxones examinados el proceso espinoso más alto y vertical se ubica en la T2 (Fig. 2F), excepto en A. boliviensis y algunos ejemplares de S. delicatus que se ubica en la T3 mientras que en C. sahamae, en las T2 y T3 (Fig. 2D). A partir de la T3 (T4 de A. boliviensis, C. sahamae y S. delicatus) los procesos son ligeramente altos, pero inclinados posteriormente hasta la T7; desde la T8 a T12 o T13, son bajos y largos con una morfología más similar a la de las vértebras lumbares. La vértebra anticlinal (vértebra con un proceso espinoso casi perpendicular a la longitud del eje el cuerpo) y la vértebra diafragmática (vértebra donde las facetas de articulación pasan de ser paralelas a oblicuas con respeto al plano ventral) corresponden a la T10 (Fig. 2E); excepto en A. boliviensis y C. sahamae donde la diafragmática corresponde a la T11 y en E. puerulus, P. andium y S. delicatus donde la anticlinal corresponde a la T11. En uno de dos ejemplares de A. boliviensis la anticlinal se observó en la T9. Los procesos transversos son cortos, orientados dorsalmente y poseen facetas para la articulación con los tubérculos de las costillas. Los procesos accesorios, bien desarrollados y extendidos posteriormente, se separan completamente de los procesos transversos en la mayoría de las especies en la T12 (Fig. 2E). En A. sublimis y C. sahamae en la T13, en P. gerbillus en la T10 y en S. delicatus en la T11. Los procesos mamilares son pequeñas protuberancias proyectadas dorsalmente (Fig. 2E) y se observan desde la T4 a T10. En vista ventral, la superficie de los cuerpos vertebrales es plana y puede tener uno o dos forámenes cada uno.
Costillas
Se observan 12 ó 13 pares de costillas en coincidencia con el mismo número de vértebras torácicas. La primera costilla es corta y delgada, con el borde medial levemente cóncavo y el borde lateral recto; como excepción, en G. griseoflavus, P. gerbillus y L. micropus es proporcionalmente más larga y delgada y con ambos bordes rectos. Las costillas restantes están comprimidas anteroposteriormente (Fig. 2F) excepto en C. sahamae, donde están notablemente expandidas (Fig. 2D). En P. caprinus y P. xanthopygus las costillas están más expandidas que en las otras especies examinadas del género, mientras que en E. moreni y C. musculinus las costillas son más comprimidas. En algunos ejemplares de A. olrogi, G. griseoflavus, C. callosus, C. lepidus, E. bolsonensis, E. hirtipes, E. moreni, E. puerulus y P. xanthopygus se observaron costillas supernumerarias; estas se distinguen porque no articulan con la vértebra precedente como las costillas completas y frecuentemente presentan cabezas deformes y alargadas.
Vértebras lumbares (L1-6 ó 7)
El número es variable, 6 en A. boliviensis, A. pictus, A. sublimis, C. sahamae, L. micropus, P. andium, P. caprinus, P. gerbillus, P. xanthopygus y T. primus; 6 ó 7 en E. puerulus y C. lepidus y 7 en el resto de los taxones examinados (Tabla 1). En comparación con las torácicas, son robustas y relativamente más largas. Los cuerpos vertebrales son subcuadrangulares, más altos que anchos y su longitud crece gradualmente a lo largo de toda la serie. Los márgenes anteriores y posteriores de los arcos neurales son cóncavos y separados por un amplio espacio (Fig. 3E). Los procesos espinosos, en general, son altos y anchos (Fig. 3B); sin embargo, en A. olrogi, A. roigi, E. moreni y S. delicatus son proporcionalmente muy altos y estrechos (Fig. 3A); mientras que en A. pictus, A. sublimis, C. sahamae, P. anitae, P. alisosiensis y L. micropus son bajos y anchos (esta condición es más marcada en L. micropus, Fig. 3C). Estos procesos se inclinan anteriormente hasta la articulación vertebral, aunque en S. delicatus y en algunos ejemplares de G. griseoflavus la inclinación es mayor y sobrepasa dicha articulación. Los procesos transversos se orientan antero-ventralmente, son alargados (Fig. 3F) en A. olrogi, A. roigi, E. bolsonensis, E. moreni, G. domorum, G. griseoflavus, P. anitae, P. alisosiensis, P. caprinus, P. gerbillus, P. osilae, P. xanthopygus y S. delicatus; anchos en su porción proximal y alargados distalmente (Fig. 3D) en A. pictus, A. sublimis, E. puerulus, E. hirtipes, L. micropus y T. primus; y anchos en toda su extensión (Fig. 3E) en A. boliviensis, las especies de Calomys, C. sahamae y P. andium. Los procesos accesorios (Fig. 3C) están bien desarrollados en general, excepto en S. delicatus que faltan (Fig. 3A). Sin embargo, en las vértebras L4 y/o L5 de A. olrogi, A. roigi, E. hirtipes, E. moreni dichos procesos pueden estar menos desarrollados. Los procesos mamilares (Fig. 3D), presentes en todas las lumbares, son dorsales y sobrepasan ligeramente el nivel de articulación con la vértebra anterior. En vista ventral, la superficie de los cuerpos vertebrales presenta una cresta medial poco desarrollada que en A. olrogi, A. roigi y en algunos ejemplares de G. griseoflavus es más prominente y delimita dos fosas profundas. Los forámenes ventrales varían en número, y se encuentran 1, 2 ó 3 por vértebra. Las articulaciones entre las pre y la postcigapófisis son oblicuas con respecto al plano sagital.

Fig. 3. Vista lateral y dorsal de las vértebras lumbares: A) Salinomys delicatus (CML 3171); B) Phyllotis caprinus (CML 7954); C) Loxodontomys micropus (CNP 1449); D) Loxodontomys micropus (PNG 618); E) Auliscomys boliviensis (CBF 7901); F) Graomys griseoflavus (CML 3934); av, articulación vertebral; eiv, espacio intervertebral; L3-7, tercera a séptima vértebra lumbar; pac, proceso accesorio; pe, proceso espinoso; pm, proceso mamilar; ptr, proceso transverso; S1-3, primera a tercera vértebra sacra. Escala 5 mm.
Vértebras sacras (S1-4)
Todos los filotinos presentan cuatro vértebras sacras (Figs. 4A y 4B). La S1 está fusionada por completo al ilión y la S2 solo parcialmente. Los procesos transversos de las tres primeras sacras están expandidos y en la S4 son alargados, delgados y orientados anteriormente (Fig. 4B). El proceso espinoso de la S1 es más alto comparado con el resto de las sacras. Este proceso presenta formas variadas, proporcionalmente más alto y corto (Fig. 3A) en E. bolsonensis, E. moreni y S. delicatus; bajo y largo (Fig. 3C) en A. olrogi, P. anitae, P. alisosiensis, L. micropus y T. primus; y alto y largo (Fig. 3B) en el resto de las especies analizadas. La cresta intermedia está ausente, excepto en A. olrogi, A. pictus, C. sahamae, P. andium y algunos ejemplares de G. griseoflavus donde es apenas evidente. Los dos primeros forámenes sacrales dorsales son redondos y de menor tamaño que los posteriores que son ovalados (Fig. 3B). En vista ventral, el promontorio y las líneas transversas están bien desarrollados en todas las especies examinadas (Fig. 4A).

Fig. 4. Vista lateral y dorsal del sacro: A, B) Phyllotis xanthopygus (CML 7963). Vista dorsal de las vértebras caudales: C) Tapecomys primus (CML 7556); av, articulación vertebral; acv, articulación a través del cuerpo vertebral; Ca1, primera vértebra caudal; fsd, foramen dorsal sacral; L6, sexta vértebra lumbar; lt, línea transversa; pe, proceso espinoso, pm, proceso mamilar; ptr, proceso transverso; S1-4 primera a cuarta vértebra sacra.
Vértebras caudales (Ca1-35)
El número es variable (Tabla 1); en especies con colas cortas el número es < 25 (A. sublimis, C. boliviae, C. callosus, C. lepidus, E. bolsonensis, E. hirtipes y E. puerulus); en aquellas con colas moderadamente largas varía entre 25-30 (C. sahamae, E. moreni, G. domorum, G. griseoflavus, L. micropus y S. delicatus); especies con colas largas muestran un rango entre 31-35 (A. olrogi, P. anitae, P. alisosiensis, P. caprinus, P. osilae y P. xanthopygus). Las primeras 4 ó 5 vértebras caudales muestran una morfología similar a las vértebras lumbares y sacras (Fig. 4C). Las restantes, se alargan, estrechan y reducen los elementos vertebrales típicos. La articulación entre las vértebras caudales en la porción anterior de la región caudal es a través de las pre y la postcigapófisis, y en la porción posterior es por medio de los cuerpos vertebrales y los discos intervertebrales, cambio que ocurre entre las Ca3 y Ca5. Los procesos espinosos son bajos y anchos y se desarrollan hasta un cierto número de vértebras; en A. boliviensis, A. sublimis, C. boliviae, C. callosus, C. lepidus, C. musculinus, E. bolsonensis, E. hirtipes, E. moreni, P. andium, P. gerbillus y S. delicatus se observan en las dos primeras caudales; en A. olrogi, E. puerulus, G. domorum, G. griseoflavus, L. micropus y P. caprinus en las tres primeras, en A. pictus, P. alisosiensis, P. anitae, P. osilae, P. xanthopygus y T. primus en las cuatro primeras; y en C. sahamae persisten hasta la quinta. Algunos ejemplares de A. sublimis, C. callosus, C. musculinus y E. hirtipes no presentaron procesos espinosos. Los procesos transversos son alargados y delgados, orientados lateralmente con respecto al cuerpo vertebral, y se reducen a partir de la Ca4 hasta desaparecer entre las Ca7 y Ca10. En A. pictus estos se reducen a partir de la Ca6. Los procesos mamilares persisten en la serie hasta que los procesos articulares desaparecen, situación que sucede entre las Ca11 y Ca13. En vista ventral, no se observan arcos hemales y solo se encuentra un foramen ventral por vértebra.
DISCUSIÓN
Los patrones morfológicos de la columna vertebral observados entre los diferentes taxones de filotinos (Tabla 2) podrían ser interpretados como resultados de procesos de adaptaciones funcionales (postura, tipo de locomoción o uso de hábitat), tamaño corporal o historia evolutiva de estas especies (Hershkovitz, 1962; Braun, 1993; Steppan, 1993,1995).
Tabla 2 (Primera parte: región cervical)
Distribución de los estados de caracteres del esqueleto axial encontrados entre las especies de roedores de la tribu Phyllotini. Referencias: + = presente, - = ausente, * = patrones morfológicos puntuales relacionados con el tipo locomotor trepador, • = patrones morfológicos puntuales relacionados con una locomoción a salto. Para la asignación del tipo locomotor se siguió a Hershkovitz (1962) y también observaciones de campo.
Tabla 2 (Segunda parte: regiones torácica, lumbar y caudal)
Morfología funcional de los caracteres vertebrales
La presencia de 13 vértebras torácicas y 6 vértebras lumbares es la combinación más frecuente entre las distintas tribus de roedores sigmodontinos (Carleton, 1980; Voss, 1988; Steppan, 1993, 1995; Pacheco, 2003; Weksler, 2006), considerada también la condición primitiva (Carleton, 1980). En los filotinos, el número de vértebras toracolumbares es variable a nivel inter e intraespecífico (Tabla 1), y se registran combinaciones 13+6 y 12+7, resultado que coincide con las observaciones de Steppan (1993, 1995), quien destacó que el número de vértebras es una condición más inestable dentro Phyllotini que en otros grupos de sigmodontinos.
En el atlas de los filotinos, los procesos transversos y el tubérculo dorsal están poco desarrollados. En dichas estructuras se originan e insertan importantes músculos (Mm. obliquus capitis inferior y rectus capitis dorsalis minor) involucrados en el movimiento de rotación de la cabeza (Hatt, 1932; Argot, 2003; Flores y Díaz, 2009). Un menor desarrollo de estas estructuras podría implicar un menor desarrollo de los músculos, limitando la fuerza para realizar movimientos de rotación (Bekele, 1983; Flores y Díaz, 2009). Por otro lado, un buen desarrollo del tubérculo ventral estaría indicando un incremento en la flexión de la cabeza en el plano sagital, ya que los músculos asociados a este movimiento (Mm. longus colli y longus capitis) se insertan en estas estructuras (Bekele, 1983; Evans, 1993; Argot, 2003; Flores y Díaz, 2009). A diferencia del resto de los filotinos, en A. sublimis, C. lepidus, C. musculinus y en las especies de Eligmodontia se observó en el atlas un arco neural corto, lo que sugiere que en estas especies habría una mejor capacidad de movimiento en esta región del cuello; esta característica se observa en algunos marsupiales y escandentios (Sargis, 2001; Flores y Díaz, 2009). Este rasgo no está vinculado con un menor tamaño corporal ya que especies de tamaño similar a las antes mencionadas, tales como A. olrogi y S. delicatus, presentan un arco neural más largo, sugiriendo una menor movilidad (Sargis, 2001). La morfología cóncava de las facetas craneales indica una buena articulación con los cóndilos occipitales durante la flexión o extensión de la cabeza en un plano sagital (Oliver, 1964; Manfreda, 2006). Por lo tanto, estos movimientos serían más marcados en las especies con facetas curvadas dorsalmente (A. sublimis, C. boliviae, C. callosus, Eligmodontia spp., G. griseoflavus, P. anitae, S. delicatus y T. primus); este patrón morfológico resulta similar al observado en algunos escandentios y marsupiales didélfidos (Sargis, 2001; Flores y Díaz, 2009).
En el axis el proceso espinoso de la mayoría de las especies es alto y ancho en su base; esta condición observada también por Steppan (1995) es considerada como un morfotipo común entre los filotinos. Este proceso es proporcionalmente más bajo y ancho en las especies de menor tamaño (Andalgalomys spp., A. sublimis, C. lepidus, C. musculinus, Eligmodontia spp. y S. delicatus) y notablemente alto, robusto y quillado en la especie de mayor tamaño (C. sahamae), lo que podría estar correlacionado con el tamaño corporal. La falta de extensión anterior y posterior de dicho proceso es otro rasgo que sugiere que la cabeza tiene una buena extensión (Sargis, 2001; Argot, 2003; Flores y Díaz, 2009). Las facetas de articulación craneal del axis en filotinos, como en otros mamíferos, muestran variación morfológica que puede ser relacionada con el sustrato y el tipo de dieta (Argot, 2003; Flores y Díaz, 2009). Según Argot (2003), las facetas con mayor diámetro dorsoventral incrementan el rango de movimiento de la cabeza y tienden a estar relacionadas a formas terrestres con dietas más carnívoras. A su vez, este autor también indica que la relación entre la morfología de las facetas con la dieta y el tipo de sustrato no es fácil de establecer, ya que en Trichosurus, una especie herbívora, las facetas también están dorsoventralmente desarrolladas. En este sentido la amplia superficie dorsoventral presente en las distintas morfologías de las facetas en filotinos podría indicar que estos roedores tienen la capacidad de realizar movimientos de la cabeza, posiblemente asociada con la captura de insectos y al procesamiento de los alimentos. Cabe destacar que si bien estos roedores son principalmente granívoros y herbívoros, incorporan también con frecuencia insectos en su dieta (Ojeda et al., 2000; Giannoni et al., 2005; Silva, 2005).
En la región cervical posterior (C3-C7), los procesos espinosos proveen el área de inserción de los músculos profundos del cuello tales como semispinalis cervicis y multifdus cervicis, que permiten los movimientos laterales y de extensión de esta región (Evans, 1993; Flores y Díaz, 2009). El escaso desarrollo de dichos procesos en los filotinos (con excepción de C. sahamae) restringiría el área de inserción de estos músculos y limitaría los movimientos en dicha región. La menor movilidad fue relacionada con la dieta en marsupiales, primates y roedores ricochetales que usan sus manos para llevar el alimento a la boca (Hatt, 1932; Lessertisseur y Saban, 1967; Argot, 2003). Se podría inferir, entonces, que los filotinos utilizan de forma activa sus manos para la captura y para llevar el alimento a la boca durante el forrajeo (ver Hershkovitz, 1962). Por otro lado, la falta de procesos espinosos del área cervical de A. pictus, A. sublimis, C. lepidus, C. musculinus, Eligmodontia spp., P. andium, P. gerbillus y S. delicatus podría estar relacionada con una postura semierguida como se observó en roedores ricochetales (Hatt, 1932). En este sentido es interesante señalar que para los géneros Eligmodontia y Salinomys se indicó una postura semierguida vinculada a una locomoción a saltos (ver Mann, 1978; Mares, 1983; Braun y Mares, 1995; Taraborelli et al., 2003). La leve orientación caudal de los procesos transversos, observada en todos los filotinos, indicaría una acción restringida de los músculos que se insertan en esta estructura (Mm longissimus cervicis, scalenus, iliocostalis y levator scapulae dorsalis) y que participan en la extensión y flexión del cuello (Argot, 2003).
En la región torácica de la mayoría de los filotinos el proceso espinoso más alto y vertical se encuentra en la T2, sitio de inserción del ligamento nucal (Rinker, 1954; Voss, 1988; Steppan, 1995). Este carácter es considerado una condición común en sigmodontinos (Carleton, 1980; Steppan, 1995) con excepción de las especies de la tribu Ichthyomyini en las cuales el proceso espinoso más alto está en la T3 (Voss, 1988), condición también aquí registrada para A. boliviensis y algunos ejemplares de S. delicatus. En C. sahamae, los procesos más altos se encuentran en las T2 y T3. Este rasgo osteológico ha sido asociado al desarrollo de músculos nucales como el splenius cervicis, multifdus dorsi y semispinalis cervicis, comprometidos con la postura de la cabeza y en mantener fija la región torácica (Hatt, 1932; Hildebrand, 1988). Es importante destacar que procesos espinosos altos en las T2 y T3 también se registraron en géneros de sigmodontinos arborícolas como Rhipidomys, Irenomys y Juliomys (Carrizo y Díaz, 2011; L. Carrizo observación personal), en otros roedores no sigmodontinos, en marsupiales y escandentios de hábitos trepadores y saltadores (Sargis, 2001; Argot 2003; Flores y Díaz, 2009; Olivares, 2009). El patrón morfológico de C. sahamae posiblemente indique una mayor rigidez torácica que, asociada al uso del hábitat, podría sugerir un hábito trepador saxícola (especies que se desplazan sobre superficies rocosas). De hecho, C. sahamae es una especie de ambientesáridos del altiplano andino que vive asociada a las laderas rocosas, donde tiene sus madrigueras (Hershkovitz, 1962; Mann Fischer, 1978), lo que apoya la hipótesis de una locomoción de tipo trepador saxícola.
La variación observada en la posición de las vértebras anticlinal y diafragmática produce cambios relacionados con el movimiento lateral y sagital de la columna vertebral. Varios autores han asociado la posición de estas dos vértebras con los hábitos locomotores (Hildebrand, 1988; Evans, 1993; Argot, 2003; Muizon y Argot, 2003; Kurz, 2005; Flores y Díaz, 2009). Así, en la mayoría de las especies adaptadas a una locomoción terrestre-saltatorial (e.g., Canis, Metachirus, Dasyurus y Perameles), estas vértebras se ubican anteriormente en T11-12 incrementando la flexibilidad de la columna; en las formas arborícolas (e.g., Caluromys, Glironia y Phalanger) son más posteriores y se ubican generalmente en el área lumbar, proporcionando mayor rigidez a la columna. En los filotinos la posición anterior de estas vértebras (T10-11) implicaría que poseen hábitos terrestres y reflejaría la capacidad para el salto sugerida para algunos representantes de la tribu (Hershkovitz, 1962; Taraborelli et al., 2003; Carrizo, 2012).
El número de costillas varía entre géneros y especies, pero la condición más común en filotinos es 13 costillas (Steppan, 1995). Hemos registrado 12 costillas en C. callosus y G. griseoflavus; sin embargo, esta condición puede ser variable como lo sugieren los datos de literatura para estas especies (13 costillas reportadas por Carleton, 1980; Olds y Anderson 1989; 12 ó 13 costillas reportadas por Steppan, 1995). Además, a diferencia de Steppan (1995) no se encontraron costillas supernumerarias en C. musculinus y P. gerbillus. Esta disparidad indicaría variación individual de estos dos caracteres, al menos para algunas especies. Las costillas de los filotinos son estrechas, lo que genera un mayor espacio para los músculos intercostales (Mm. pectoralis, scalenus y serratus ventralis thoracis) que proveen una mayor flexibilidad en la locomoción terrestre (Sargis, 2001; Argot, 2003; Flores y Díaz, 2009). En C. sahamae las costillas están notablemente expandidas, lo que permitiría un incremento en la estabilidad del tórax y toda la columna vertebral (Jenkins, 1970), como ocurre en otros mamíferos de hábitos arborícolas y trepadores (Jenkins, 1970; Sargis, 2001; Argot, 2003; Flores y Díaz, 2009). En este sentido, la morfología de las costillas de C. sahamae probablemente esté relacionado con su hábito trepador saxícola (Hershkovitz, 1962; Mann Fischer, 1978).
En la región lumbar, en la mayoría de los filotinos los procesos espinosos son altos, anchos e inclinados anteriormente incrementando la ventaja mecánica de la musculatura epaxial y la fuerza de extensión de la columna vertebral, importante en la locomoción cuadrupedal (Slijper, 1946; Shapiro, 2005). En otros casos, los procesos espinosos son notablemente más altos y estrechos (p.e., A. olrogi, A. roigi, E. moreni y S. delicatus), incrementando el espacio intervertebral y otorgando mayor flexibilidad a la columna (Shapiro, 1995; Sargis, 2001; Argot, 2003). Procesos espinosos altos y estrechos fueron también relacionados con los movimientos sincrónicos de los miembros posteriores durante la locomoción a saltos, característica de roedores ricochetales (Hatt, 1932) y de grupos con locomoción terrestre-saltatorial como Perameles, Chinchilla y Microcavia (Argot, 2003; Olivares, 2009). En filotinos el salto se ha reportado como un mecanismo de escape ante predadores o como una adaptación para un desplazamiento rápido en ambientes abiertos (Hershkovitz, 1962; Williams y Mares, 1978; Mares, 1983; Braun y Mares, 1995; Mares y Braun, 1996; Straccia y De Santis, 2000; Taraborelli et al., 2003). Andalgalomys olrogi, A. roigi, E. moreni y S. delicatus son típicas de ambientes abiertos, por lo que el patrón morfológico apoyaría la hipótesis que vincula el modo de locomoción a saltos con este tipo de ambiente. Por otro lado, los procesos espinosos bajos y anchos (p.e., A. pictus, A. sublimis, C. sahamae, P. anitae, P. alisosiensis y L. micropus) limitarían la movilidad de la columna por la disminución del espacio intervertebral (Sargis, 2001; Argot, 2003; Shapiro, 2005) sugiriendo que estas especies tienen una mayor estabilidad lumbar asociada quizás a un hábito trepador (Jenkins, 1970; Flower, 1876; Shapiro, 1995, 2005; Argot, 2003; Sargis, 2003). En casi todas las especies de filotinos los procesos transversos lumbares son elongados y orientados ventralmente. Esto incrementa la ventaja mecánica del músculo quadratus lomborum y sugiere una buena flexión y extensión en un plano sagital de la región lumbar. Este tipo de morfología es característico de animales cuadrúpedos saltadores (Hatt, 1932; Argot, 2003; Muizon y Argot, 2003; Flores y Díaz, 2009). En algunas especies (A. boliviensis, C. sahamae, P. andium y Calomys spp.) los procesos transversos son cortos y anchos, lo que disminiye el espacio disponible para los ligamentos y las fibras musculares. Esta morfología ha sido relacionada funcionalmente con la importancia de la rigidez y extensión de la columna, y consistentemente registrada en especies arborícolas y trepadoras (Cartmill y Milton, 1977; Shapiro, 1995; Argot, 2003). Los procesos accesorios de las lumbares de todos los filotinos están bien desarrollados, situación que restringe la flexibilidad lateral de la columna y limita los movimientos a un plano sagital (Evans, 1993; Argot, 2003; Muizon y Argot, 2003). Weksler (2006) observó que la presencia de un proceso accesorio en la vértebra toracolumbar (TL) 17 es una condición taxonómicamente variable en los sigmodontinos. Sin embargo, en los filotinos está siempre presente sobre la TL 17, excepto en S. delicatus. En esta especie la ausencia de dichos procesos permitiría que la columna pueda realizar movimientos laterales.
En filotinos, la mayoría de las especies tienen colas moderadamente largas (25 a 30 ó 31 a 35 vértebras), a diferencia de colas muy largas registradas en algunos sigmodontinos arborícolas como Rhipidomys, Irenomys y Juliomys (38 a 40; Carrizo y Díaz, 2011; L. Carrizo observación personal). Las colas son funcionalmente importantes y versátiles, ya que participan en la locomoción, equilibrio, postura, protección y exhibición sexual (Hatt, 1932; Gillis et al., 2009). En la cola de los filotinos, el cambio morfológico de las vértebras caudales ocurre entre las Ca3 y Ca5; esto incrementaría la flexibilidad de la parte anterior de la cola y sugiere una buena capacidad de movimientos laterales (Flores y Díaz, 2009). Los procesos espinosos de las vértebras caudales anteriores de prácticamente todas las especies se desarrollan entre la Ca3 o Ca4, esto implica un buen desarrollo anterior del músculo extensor multifidus caudae y, en consecuencia, de los movimientos verticales de la cola (Argot, 2003). En C. sahamae los procesos persisten hasta la Ca5, lo cual indica un desarrollo más posterior de dicho músculo y, posiblemente, una mayor capacidad de movimientos verticales. Por otra parte, la ausencia de procesos espinosos (e.g., algunos ejemplares de A. sublimis, C. callosus, C. musculinus y E. hirtipes) indicaría una capacidad más limitada de los movimientos verticales de la cola (Flores y Díaz, 2009). En todas las especies analizadas los procesos transversos son alargados y delgados y están presentes hasta la Ca7 o Ca10, lo cual sugiere un buen desarrollo de la musculatura basal de la cola (Mm. ischio-caudalis y abductor caudae dorsalis) que contribuye en el movimiento de flexión lateral (Argot, 2003; Flores y Díaz, 2009). Los roedores filotinos evidencian buena movilidad de la cola en un plano vertical y lateral, movimientos que podrían tener un papel importante en el equilibrio estabilizando al animal cuando camina o trota (Argot, 2003).
Implicancia sistemática de los caracteres del esqueleto axial
Los taxones analizados presentan afinidad basada en la similitud morfológica de la columna vertebral y comparten varios rasgos osteológicos. Algunas de estas afinidades son congruentes con aquellas obtenidas en estudios taxonómicos y filogenéticos sobre la base de otro tipo de evidencia (morfología externa, craneana y molecular). Al mismo tiempo se registraron caracteres exclusivos que permiten identificar y diferenciar taxones (e.g., Chinchillula, Loxodontomys, Salinomys). Se observó una fuerte similitud morfológica entre la columna vertebral de las especies del género Eligmodontia con aquellas del género Calomys (en especial con las de C. lepidus y C. musculinus) y S. delicatus. Estas especies comparten caracteres a nivel de la región cervical y lumbar, como por ejemplo proceso espinoso del atlas bajo, facetas craneales del atlas curvadas dorsalmente y procesos espinosos lumbares altos y estrechos. Datos basados en morfología externa, craneana y molecular documentan también una cercana asociación entre estos taxones (ver Hershkovitz, 1962; Braun, 1993; Braun y Mares 1995; Spotorno et al., 2001; Salazar-Bravo, 2001; D'Elía et al., 2005; Almeida et al., 2007; Mares et al., 2008). En el género Phyllotis se registró mayor similitud morfológica entre P. alisosiensis, P. anitae, P. caprinus, P. osilae y P. xanthopygus por un lado, y entre P. andium y P. gerbillus por otro. Esta marcada diferenciación en dos grupos concuerda con lo observado por otros autores en base a evidencia morfológica y molecular (Braun, 1993; Steppan, 1995; Spotorno et al., 2001; Steppan et al., 2007; Zeballos, 2009). Algunos autores (Hershkovitz, 1962; Braun, 1993; Steppan, 1995; Steppan y Sullivan, 2000) señalan incluso que P. andium y P. gerbillus son morfológicamente distintos del resto de las especies del género y que posiblemente estos no sean miembros estrictos del clado Phyllotis. En este trabajo, el primer grupo de Phyllotis comparte características con los géneros Graomys y Tapecomys, mientras que el segundo se relaciona más estrechamente con Eligmodontia. Esto coincide con los análisis fenéticos de Braun (1993), en los cuales observa una relación entre Graomys y Phyllotis y con los análisis filogenéticos de Steppan (1995) en los cuales P. amicus, P. andium y P. gerbillus (denominado por Steppan et al., 2007 como grupo andium) se reconocen como miembros basales de un clado que contiene a Eligmodontia, Graomys y Andalgalomys.
Las dos especies de Graomys presentan gran similitud entre sí, con algunas diferencias que se limitan a nivel del atlas y axis; además, tienen semejanzas con P. caprinus, P. osilae, P. xanthopygus y Andalgalomys spp. Esto coincide parcialmente con los análisis de Braun (1993), Braun y Mares (1995) y Steppan (1993, 1995), quienes mencionan una relación entre Graomys y Andalgalomys. Braun (1993) considera a Andalgalomys como un género válido, mientras que Steppan (1995) lo incluye en Graomys. En Calomys, los patrones morfológicos del esqueleto axial de las especies de tamaño grande (C. boliviae y C. callosus) son similares entre sí y se diferencian de las especies de tamaño pequeño (C. lepidus y C. musculinus). Estas diferencias se expresan en los patrones filogenéticos descriptos por Salazar-Bravo (2001) y Almeida et al. (2007), en los cuales se identifican dos clados dentro de Calomys, uno compuesto por especies asociados a biomas de tierras bajas (C. tener, C. laucha, C. callosus, C. venustus, C. fecundus), y otro conformado por especies de pequeño tamaño asociado a biomas de tierras altas (C. sorellus, C. lepidus y C. musculinus). Andalgalomys olrogi y A. roigi solo muestran características diferentes en algunas estructuras del atlas, axis y de la primera vértebra sacra. La diferenciación y relaciones filogenéticas de las especies de este género es incierta; por un lado Mares y Braun (1996) en base a caracteres morfológicos consideran estas dos especies válidas, mientras que García (2003) en base a datos moleculares las considera sinónimos.
Auliscomys sublimis y A. pictus comparten más características de la columna vertebral entre sí que con A. boliviensis. Esto concuerda con lo observado por varios autores (Hershkovitz, 1962; Pearson y Patton, 1976; Braun, 1993; Steppan, 1993, 1995; Steppan y Sullivan, 2000; Spotorno el al., 2001), quienes basados en datos morfológicos y moleculares han mencionado una cercana relación entre las dos primeras especies. Es destacable que A. boliviensis es incluida por algunos autores en un género monotípico (Maresomys; Braun, 1993). Estas especies, particularmente A. boliviensis, muestran una consistente asociación con C. sahamae y comparten numerosos caracteres (faceta craneal del axis expandida, vértebra diafragmática en la T11, proceso transverso y accesorio separado en la T13 y procesos transversos lumbares cortos). Una relación cercana entre estos dos géneros fue mencionada por Steppan (1995) en sus análisis basados en morfología externa y cráneodentaria, indicando a Chinchillula como un taxón basal del clado Auliscomys.
Loxodontomys micropus fue considerada una especie del género Auliscomys por Simonetti y Spotorno (1980) y Musser y Carleton (1993), mientras que Braun (1993), Steppan (1993, 1995) y Spotorno et al. (2001) la consideran como un género monotípico válido. La columna vertebral de esta especie es semejante a la de A. pictus y A. sublimis. Loxodontomys presenta algunas características exclusivas que la diferencian del resto de los filotinos, tales como faceta caudal del atlas orientada caudalmente, faceta craneal del axis orientada lateralmente y procesos espinosos lumbares muy bajos y anchos.
Tapecomys comparte más patrones morfológicos de su columna con las especies mayores de Phyllotis y, en menor medida, con Loxodontomys. Steppan et al. (2007) y Zeballos (2009) relacionan a Tapecomys con Phyllotis wolfsohni, Auliscomys spp y L. micropus. Asimismo, una relación con Loxodontomys es también propuesta por D'Elía et al. (2005).
Salinomys delicatus presenta similitud con las especies de Eligmodontia y comparte características, pero en menor afinidad, con Andalgalomys; este último caso coincide con algunos análisis moleculares que han demostrado una relación cercana entre Salinomys y Andalgalomys (Anderson y Yates, 2000; García, 2003; Zeballos, 2009). Sin embargo, la presencia de procesos accesorios y transversos separados completamente a partir de la T11 y ausencia de procesos accesorios en la región lumbar son características que lo diferencian del resto de filotinos.
La columna vertebral de C. sahamae muestra varias particularidades que la diferencian claramente del resto de los filotinos (proceso espinoso del axis muy robusto, vértebras cervicales con procesos espinosos bien desarrollados, costillas expandidas, proceso espinoso en T2 y T3 altos, proceso espinoso presente hasta la Ca5) y su posición dentro de la tribu Phyllotini es incierta. Recientes estudios basados en análisis moleculares sustentan ampliamente que Chinchillula no es un filotino, considerándolo dentro de la tribu Reithrodontini (Zeballos, 2009) o como parte de un nuevo clado formado por sigmodontinos andinos (Salazar-Bravo et al., 2013). Estos trabajos discrepan con los de otros autores (Hershkovitz, 1962; Gardner y Patton, 1976; Pearson y Patton, 1976; Steppan, 1993, 1995) quienes en base a análisis morfológicos consideran a Chinchillula como un filotino.
CONCLUSIONES
El esqueleto axial de los filotinos presenta un patrón morfológico general vinculado principalmente con el incremento de la flexibilidad y con los movimientos verticales y laterales del cuerpo. Este patrón presenta variaciones entre las especies, que están relacionadas con las habilidades para trepar y saltar, confirmando que estas capacidades son comunes dentro de la tribu. Específicamente, C. sahamae posee un conjunto de caracteres (costillas expandidas, proceso espinoso más alto en T2 y T3, procesos transversos lumbares cortos, procesos espinosos lumbares bajo y corto) que han sido consistentemente descriptos en otros mamíferos con capacidad para la locomoción arbórea. Este aspecto nos permite suponer que los movimientos en un plano vertical, más que el tipo de sustrato (árboles, arbustos y rocas), parece estar impulsando las mismas adaptaciones morfológicas. Además, las características de la columna de C. sahamae junto con los rasgos morfológicos externos de sus miembros (pies y manos robustos, almohadillas palmares y plantares gruesas) fortalece la idea de que esta especie tiene locomoción saxícola, corroborando lo propuesto por Mann Fischer (1978) y Hershkovitz (1962). Asimismo, E. moreni y S. delicatus presentaron más caracteres (ausencia de procesos espinosos cervicales, procesos espinosos lumbares altos y estrechos) relacionados con la capacidad para la locomoción a salto, aspecto también sugerido por la combinación de sus rasgos externos como la forma de los miembros posteriores y los abundantes pelos plantares (Hershkovitz, 1962; Braun y Mares, 1995; Carrizo, 2012), rasgos considerados únicos entre sigmodontinos (Hershkovitz, 1962; Braun y Mares, 1995).
Finalmente, cabe destacar que el análisis morfológico del esqueleto axial de los filotinos señala que el postcráneo es una valiosa fuente de información que podría contribuir a la resolución de problemas taxonómicos y filogenéticos, ya que como en otros grupos de mamíferos (Sargis, 2001; Argot, 2002, 2003; Flores y Díaz, 2009; Salton y Sargis, 2009; etc.), permite establecer afinidades entre géneros y especies en concordancia con hipótesis previas basadas en otro tipo de evidencia (morfología externa y cráneo-dentario y molecular).
AGRADECIMIENTOS
Agradecemos a los siguientes curadores de las colecciones de mamíferos (para la referencia de acrónimos, véase el Apéndice) por permitir el acceso al material estudiado: Rubén Barquez (CML), David Flores (MACN), Ulyses Pardiñas (CENPAT), Ricardo Ojeda (IADIZA), Horacio Zeballos (MUSA) y Julieta Vargas (CBF). A Román Sánchez por trabajar en la ilustración y edición de las láminas. También agradecemos a Jorge Salazar-Bravo y a dos revisores anónimos por sus valiosos comentarios que mejoraron la calidad del trabajo. Al CONICET por el apoyo a este trabajo a través de una beca otorgada a Luz Carrizo.
LITERATURA CITADA
1. ABELLO MA y A CANDELA. 2010. Postcranial skeleton of the Miocene marsupial Palaeothentes (Paucituberculata, Palaeothentidae): Paleobiology and phylogeny. Journal of Vertebrate Paleontology 30:1515-1527. [ Links ]
2. ALMEIDA FC, CR BONVICINO y P CORDEIRO-ESTRELA. 2007. Phylogeny and temporal diversification of Calomys (Rodentia, Sigmodontinae): Implications for the biogeography of an endemic genus of the open/dry biomes of South America. Molecular Phylogenetics and Evolution 42:449-466. [ Links ]
3. ANDERSON S y TL YATES. 2000. A new genus and species of phyllotine rodent from Bolivia. Journal of Mammalogy 81:18-36. [ Links ]
4. ARGOT C. 2001. Functional-adaptive anatomy of the forelimb in the Didelphidae, and the paleobiology of the Paleocene marsupials Mayulestes ferox and Pucadelphys andinus. Journal of Morphology 247:51-79. [ Links ]
5. ARGOT C. 2002. Functional-adaptive analysis of the hindlimb anatomy of extant marsupials and paleobiology of the Paleocene marsupials Mayulestes ferox and Pucadelphys andinus. Journal of Morphology 253:76-108. [ Links ]
6. ARGOT C. 2003. Functional-adaptative anatomy of the axial skeleton of some extant marsupials and the paleobiology of the Paleocene marsupials Mayulestes ferox and Pucadelphys andinus. Journal of Morphology 255:279-300. [ Links ]
7. BEKELE A. 1983. The comparative functional morphology of some head muscles of the rodents Tachyoryctes splendens and Rattus rattus. II Cervical Muscle. Mammalia 47:549-572. [ Links ]
8. BEZUIDENHOUT AJ y HE EVANS. 2005. Anatomy of woodchuck (Marmota monax). Special publicación nº 13. American Society of Mammalogists 180 pp. [ Links ]
9.BONVICINO CR, JA DE OLIVEIRA y R GENTILE. 2010. A new species of Calomys (Rodentia, Sigmodontinae) from eastern Brazil. Zootaxa 2336:19-25. [ Links ]
10. BRAUN JK. 1993. Systematic relationships of the Tribe Phyllotini (Muridae: Sigmodontinae) of South America. Oklahoma Museum of Natural History, Norman 50 pp. [ Links ]
11. BRAUN JK y MA MARES. 1995. A new genus and species of phyllotine rodent (Rodentia: Muridae: Sigmodontini: Phyllotini) from South America. Journal of Mammalogy 76:504-521. [ Links ]
12. CANDELA A y MBJ PICASSO. 2008. Functional Anatomy of the Limbs of Erethizontidae (Rodentia, Caviomorpha): Indicators of Locomotor Behavior in Miocene Porcupines. Journal of Morphology 269:552-593. [ Links ]
13. CARLETON MD. 1980. Phylogenetic relationships of neotomine-peromyscine rodents (Muroidea) and a reappraisal of the dichotomy within New World Cricetinae. Miscellaneous Publications Museum of Zoology, University of Michigan 157:1-146. [ Links ]
14. CARRIZO LV. 2012. Revisión sistemática y filogenética de la tribu Phyllotini (Rodentia: Sigmodontinae). Tesis inédita presentada en la Facultad de Ciencia Naturales e Inst. Miguel Lillo. Universidad Nacional de Tucumán, Tucumán, Argentina. [ Links ]
15. CARTMILL M y K MILTON. 1977. The lorisiform wrist joint and the evolution of 'brachiating' adaptations in the Hominoidea. American Journal of Physical Anthropology 47:249-272. [ Links ]
16. D'ELÍA G, UFJ PARDIÑAS y P MYERS. 2005. An introduction to the genus Bibimys (Rodentia: Sigmodontinae): Phylogenetic position and alpha taxonomy. Pp. 211-246, en: Mammalian diversification: from chromosomes to phylogeography (E Lacey y P Myers, eds.). University of California Publication in Zoology, Berkeley 133 pp. [ Links ]
17. D'ELÍA G, P TETA y UFJ PARDIÑAS. 2006. Incertae Sedis. Pp. 197-202, en: Mamíferos de Argentina: sistemática y distribución (RM Barquez, MM Díaz y RA Ojeda, eds.). SAREM (Sociedad Argentina para el Estudio de los Mamíferos), Mendoza, 359 pp. [ Links ]
18. EVANS HE. 1993. Miller's Anatomy of the dog. 3rd ed. Philadelphia: W.B. Saunders. [ Links ]
19. FERRO LI y JJ MARTÍNEZ. 2009. Molecular and morphometrics evidence validates a Chacoan species of the gray leaf-eared mice genus Graomys (Rodentia: Cricetidae: Sigmodontinae). Mammalia 73:265-271. [ Links ]
20. FERRO LI, JJ MARTÍNEZ y RM BARQUEZ. 2010. A new species of Phyllotis (Rodentia, Cricetidae, Sigmodontinae) from Tucumán Province, Argentina. Mammalian Biology 75:523-537. [ Links ]
21. FLORES DA. 2009. Phylogenetic analyses of postcranial skeletal morphology in didelphid marsupials. Bulletin of the American Museum of Natural History 320:1-81. [ Links ]
22. FLORES DA y MM Díaz 2009. Postcranial skeleton of Glironia venusta (Didelphimorphia, Didelphidae, Caluromyinae): Description and functional morphology. Zoosystematics and Evolution 85:311-339. [ Links ]
23. FLOWER WR. 1876. An introduction to the osteology of the mammalia. 2th ed. London: Macmillan. [ Links ]
24. GARCÍA AA. 2003. Reevaluación de los niveles de género y especie asignado al filotino Andalgalomys (Muridae: Sigmodontinae): evidencias citogenéticas y moleculares. Tesis Doctoral, Universidad Nacional de San Luis. [ Links ]
25. GARDNER AL y JL PATTON. 1976. Karyotypic variation in oryzomyine rodents (Cricetinae) with comments on chromosomal evolution in the Neotropical cricetine complex. Occasional Papers of the Museum of Zoology 49:1-47. [ Links ]
26. GEBO DL y EJ SARGIS. 1994. Terrestrial adaptations in the postcranial skeletons of guenons. American Journal of Physical Anthropology 93:341-371. [ Links ]
27. GILLIS GB, LA BONVINI y DJ IRSCHICK. 2009. Losing stability: tail loss and jumping in the arboreal lizard Anolis carolinensis. Journal of Experimental Biology 212:604-609. [ Links ]
28. GIANNINI PN y NB SIMMONS. 2005. Conflict and congruence in a combined DNA- morphology analysis of megachiroptera bat relatioships (Mammalia: Chiroptera: Pteropodidae). Cladistics 21:411-437. [ Links ]
29. GIANNONI SM, CE BORGHI, M DACAR y CM CAMPOS. 2005. Main food categories in diets of sigmodontine rodents in the Monte (Argentina). Mastozoología Neotropical 12:181-187. [ Links ]
30. HATT TR. 1932. The vertebral columns of ricochetal rodents. Bulletin of the American Museum of Natural History 63:599-738. [ Links ]
31. HERSHKOVITZ P. 1962. Evolution of Neotropical cricetine rodents (Muridae) with special reference to the Phyllotine group. Fieldiana: Zoology 46:1-524. [ Links ]
32. HILDEBRAND M. 1988. Analysis of vertebrate structure. 3ra edición, Wiley y Sons, New York.701 pp. [ Links ]
33. HOROVITZ I y MR SÁNCHEZ-VILLAGRA. 2003. A morphological analysis of marsupial mammal higherlevel phylogenetic relationships. Cladistics 19:181-212. [ Links ]
34. HOWELL AB. 1926. Anatomy of the wood rat. Monographs of the American Society of Mammalogists. Baltimore the Williams & Wilkins Company. 225 pp. [ Links ]
35. JAYAT JP, G D'ELIA, UFJ PARDIÑAS y JG NAMEN. 2007. A new species of Phyllotis (Rodentia, Cricetidae, Sigmodontinae) from the upper montane forest of the yungas of north western Argentina. Pp. 775-798, en: the quintessential naturalist: Honoring the life and legacy of Oliver P. Pearson (DA Kelt, E Lessa, JA Salazar-Bravo, JL Patton, eds.). Vol. 134. University California Publications Zoology. [ Links ]
36. JENKINS FA Jr. 1970. Anatomy and function of expanded ribs in certain edentates and primates. Journal of Mammalogy 51:288-301. [ Links ]
37. KURZ C. 2005. Ecomorphology of opossum-like marsupials from the Tertiary of Europe and a comparison with selected taxa-Kaupia, Darmstdter Beitrge zur Naturgeschichte 14:21-26. [ Links ]
38. LESSERTISSEUR J y R SABAN. 1967. Squelette appendiculaire. Pp. 584-1123, en: Traité de Zoologie (PP Grasse, ed.). XVI (1). Paris: Masson y Cie. [ Links ]
39. MACHADO LF, R PARESQUE y AU CHRISTOFF. 2011. Anatomia comparada e morfometria de Oligoryzomys nigripes e O. favescens (Rodentia, Sigmodontinae) no Rio Grande do Sul, Brasil. Papéis Avulsos de Zoología 51:29-47. [ Links ]
40. MANN FISCHER G. 1978. Los pequeños mamíferos de Chile (marsupiales, quirópteros, edentados y roedores). Gayana, Zoología, 40:1-342. [ Links ]
41. MARES MA. 1983. Desert rodent adaptation and community structure. Pp. 30-73, en: Biology of desert rodents (OJ Reichman y JH Brown, eds.). Vol. 7. Great Basin Naturalist Memoirs, Brigham Young University, Provo, Utah. [ Links ]
42. MARES MA y JK BRAUN. 1996. A new species of phyllotine rodent, genus Andalgalomys (Muridae: Sigmodontinae) from Argentina. Journal of Mammalogy 77:928-941. [ Links ]
43. MARES MA, JK BRAUN, BS COYNER y RA VAN DEN BUSSCHE. 2008. Phylogenetic and biogeographic relationships of gerbil mice Eligmodontia (Rodentia, Cricetidae) in South America, with a description of a new species. Zootaxa 1753:1-33. [ Links ]
44. MORGAN CC. 2009. Geometric morphometrics of the scapula of South American caviomorph rodents (Rodentia: Hystricognathi): form, function and phylogeny. Mammalian Biology 74:497-506. [ Links ]
45. MORGAN CC y DH VERZI. 2006. Morphological diversity of the humerus of the South American subterranean rodent Ctenomys (Rodentia, Ctenomyidae). Journal of Mammalogy 87:1252-1260. [ Links ]
46. MORGAN CC y DH VERZI. 2011. Carpal-metacarpal specializations for burrowing in South American octodontoid rodents. Journal of Anatomy 219:167-175. [ Links ]
47. MUIZON C y C ARGOT. 2003. Comparative anatomy of the Tiupampa didelphimorphs; an approach to locomotory habits of early marsupials. Pp. 43-62, en: Predators with pouches: The biology of carnivorous marsupials (ME Jones, CR Dickman y M. Archer, eds.). Csiro Publishing, Australia. [ Links ]
48. MUSSER GM y MD CARLETON. 1993. Family Muridae. Pp. 501-756, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Smithsonian Institution, Washington. [ Links ]
49. MUSSER GG y MD CARLETON. 2005. Superfamily Muroidea. Pp. 894-1531, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds). Johns Hopkins University Press, Baltimore, MD, 3rd edn. [ Links ]
50. OJEDA AR, PG BLENDINGER y R BRANDL. 2000. Mammals in South American drylands: Faunal similarity and trophic structure. Global Ecology y Biogeography 9:115-123. [ Links ]
51. OLDS N y S ANDERSON. 1989. A diagnosis of the Tribe Phyllotini (Rodentia, Muridae). Pp. 55-74, en: Advances in Neotropical mammalogy (KH Redford y JF Eisenberg, eds.). FL Sandhill Crane Press, Gainesville 614 pp. [ Links ]
52. OLIVARES AI. 2009. Anatomía, sistemática y evolución de los roedores caviomorfos sudamericanos del género Eumysops Ameghino (Rodentia, Echimyidae). Tesis inédita presentada Facultad de Ciencias Naturales y Museo Universidad Nacional de la Plata, Buenos Aires, Argentina. [ Links ]
53. PACHECO VR. 2003. Phylogenetic analyses of the Tomasomyini (Muroidea: Sigmodontinae) based on morphological data. Tesis doctoral inédita. The City University of New York. [ Links ]
54. PARDIÑAS UFJ, P TETA y G D'ELIA. 2009. Taxonomy and distribution of Abrawayaomys (Rodentia: Cricetidae), an Atlantic Forest endemic with the description of a new species. Zootaxa 2128:39-60 [ Links ]
55. PEARSON OP. 1958. A taxonomic revision of the rodent genus Phyllotis. University of California Publications, Zoology 56:391-496. [ Links ]
56. PEARSON OP y JL PATTON. 1976. Relationships among South American phyllotine rodents based on chromosome analysis. Journal of Mammalogy 57:339-350. [ Links ]
57. REIG OA. 1986. Diversity pattern and diferentiation of high Andean rodents. Pp. 404-439, en: High altitude tropical biogeography (F Vuillemier y M Monasterio, eds.). Oxford University Press, New York. [ Links ]
58. RINKER GC. 1954. The comparative myology of the mammalian genera Sigmodon, Oryzomys, Neotoma, and Peromyscus (Cricetinae), with remarks on their intergeneric relationships. Miscellaneous Publications Museum of Zoology, University of Michigan, 83:1-124. [ Links ]
59. ROBERT D. 1974. Structure and function of the primate scapula. Pp. 171-200, en: Primate locomotion (FA Jenkins, ed.). Academic Press, New York and London. [ Links ]
60. SALAZAR-BRAVO JJ, W DRAGOO, DS TINNIN y TL YATES. 2001. Phylogeny and evolution of the Neotropical rodent genus Calomys: Inferences from mitochondrial DNA sequence data. Molecular Phylogenetics and Evolution 20:173-184. [ Links ]
61. SALAZAR-BRAVO JJ, UF PARDIÑAS y G D'ELIA. 2013. A phylogenetic appraisal of sigmodontinae (Rodentia, Cricetidae) with emphasis on phyllotine genera: systematics and biogeography. Zoologica Scripta 42(3):250-261. [ Links ]
62. SARGIS EJ. 2001. A preliminary qualitative analysis of the axial skeleton of tupaiids (Mammalia, Scandentia): functional morphology and phylogenetic implications. Journal of Zoology 253:473-483. [ Links ]
63. SARGIS EJ. 2002a. Functional morphology of the forelimb of tupaiids (Mammalia, Scandentia) and its phylogenetic implications. Journal of Morphology 253:10-42. [ Links ]
64. SARGIS EJ. 2002b. Functional morphology of the hindlimb of tupaiids (Mammalia, Scandentia) and its phylogenetic implications. Journal of Morphology 254:149-185. [ Links ]
65. SILVA SL. 2005. Posiciones trópicas de pequeños mamíferos en Chile: una revisión. Revista Chilena de Historia Natural 78:589-599. [ Links ]
66. SIMONETTI JZ y AO SPOTORNO. 1980. Posición taxonómica de Phyllotis micropus (Rodentia: Cricetidae). Anales del Museo de Historia Natural, Valparaíso 13:285-297. [ Links ]
67. SHAPIRO LJ. 1995. Functional morphology of indrid lumbar vertebrae. American Journal of Physical Anthropology 98:323-342. [ Links ]
68. SHAPIRO LJ, CVM SEIFFERT, LR GODFREY, WL JUNGERS, EL SIMONS y GFN RANDRIAS. 2005. Morphometric analysis of lumbar vertebrae in extinct Malagasy strepsrrhines. American Journal of Physical Anthropology 128:823-839. [ Links ]
69. SLIJPER EJ. 1946. Comparative biologic-anatomical investigations on the vertebral column and spinal musculature of mammals. Koninklijke Nederlandse Akademie van Wetenschappen, Tweede Sectie 42:1-128. [ Links ]
70. SPOTORNO AO, LI WALKER, SV FLORES, M YEVENES, JC MARÍN y C ZULETA. 2001. Evolución de los filotinos (Rodentia, Muridae) en los Andes del Sur. Revista Chilena de Historia Natural 74:151-166. [ Links ]
71. STEPPAN SJ. 1993. Phylogenetic relationships among the Phyllotini (Rodentia: Sigmodontinae) using morphological characters. Journal of Mammalian Evolution 1:187-213. [ Links ]
72. STEPPAN SJ. 1995. Revision of the Tribe Phyllotini (Rodentia: Sigmodontinae), with a phylogenetic hypothesis for the Sigmodontinae. Fieldiana: Zoology 80:1-112. [ Links ]
73. STEPPAN SJ y J SULLIVAN. 2000. The emerging statistical perspective in systematics: A comment on Mares and Braun. Journal of Mammalogy 81:260-270. [ Links ]
74. STEPPAN SJ, O RAMIREZ, J BANBURY, D HUCHON, V PACHECO, LI WALKER y AE SPOTORNO. 2007. A molecular reappraisal of the systematics of the leafearedmice phyllotis and the irrelatives. Pp. 799-826, en: The quintessential naturalist: Honoring the life and legacy of Oliver P. Pearson (DA Kelt, E Lessa, JA Salazar-Bravo, JL Patton, eds.). Vol. 134. University California Publications Zoology. [ Links ]
75. STRACCIA PC y LJ DE SANTIS. 2000. Análisis morfofuncional preliminar de la locomoción de Eligmodontia (Rodentia, Sigmodontinae) de la Argentina. XV Jornadas Argentinas de Mastozoología. La Plata, Buenos Aires, Argentina. [ Links ]
76. TARABORELL P, V CORBALÁN y S GIANNONI. 2003. Locomotion and scape models in the rodents of the Monte Desert (Argentina). Ethology 109:475-485. [ Links ]
77. TAYLOR ME. 1974. The functional anatomy of the forelimbs of some African Viverridae (Carnivora). Journal of Morphology 143:307-336. [ Links ]
78. TAYLOR ME. 1976. The functional anatomy of the hindlimbs of some African Viverridae (Carnivora). Journal of Morphology 148:227-254. [ Links ]
79. VOSS RS. 1988. Systematics and ecology of ichthyomyine rodents (Muroidea): Patterns of morphological evolution in a small adaptive radiation. Bulletin of the American Museum of Natural History 188:259-493. [ Links ]
80. WEKSLER M. 2006. Phylogenetic relationships of oryzomyine rodents (Muroidea: Sigmodontinae): separate and combined analyses of morphological and molecular data. Bulletin of the American Museum of Natural History 296:1-149. [ Links ]
81. WILLIAMS DF y MA MARES. 1978. A new genus and species of phyllotine rodent (Mammalia: Muridae) from northwestern Argentina. Annals of the Carnegie Museum 47:193-221. [ Links ]
82. YOULATOS D. 2003. Osteological correlates of tail prehensility in carnivorans. Journal Zoology 259:423-430. [ Links ]
83. ZEBALLOS H. 2009. Radiación adaptativa en los roedores sigmodontinos del desierto peruano-chileno y los Andes centrales y del Sur. Tesis doctoral inédita. Pontificia Universidad Católica de Chile. [ Links ]
Las especies examinadas se encuentran ordenadas alfabéticamente; para cada una se indica, entre paréntesis, el número de ejemplares estudiados; para cada espécimen se indica país, provincia, departamento, localidad específica, coordenadas geográficas, acrónimo y número de colección, de acuerdo al siguiente detalle: Colección Boliviana de Fauna, La Paz, Bolivia (CBF); Colección de Mamíferos del Centro Nacional Patagónico, Puerto Madryn, Chubut, Argentina (CNP); Colección Mamíferos Lillo, Tucumán, Argentina (CML); Colección Nacional de Mastozoología, Museo Argentino de Ciencias Naturales "Bernardino Rivadavia", Buenos Aires, Argentina (MACN); Colección de Mamíferos, Instituto Argentino de Investigaciones de Zonas Áridas, Mendoza, Argentina, (CM-IADIZA); Museo Universidad San Agustín, Arequipa, Perú (MUSA); catálogo de campo de Horacio Zeballos Patrón (HZP).
Andalgalomys olrogi (2): ARGENTINA. CATAMARCA: Andalgalá, 13 Km W, 1.1 km S Andalgalá (In Rº Amanao), 27º 36.583' S 66º 27.364' W, (CML 8441); Pomán, 35 Km de Andalgalá, (CMI 6567).
Andalgalomys roigi (1): ARGENTINA. SAN LUIS: La Botija, Pampa de las Salinas 32º 12.17' S 66º 39.141' W, 1124 m, (MACN 20652).
Auliscomys boliviensis (2): BOLIVIA. ORURO: Challapata, Janacachi, a 20 Km de Challapata, zona Azanaque, 18º 57' S 66º 42' W, (CBF 7901); Abacoa, Challapata, Santuario de Quillacas, Ventilla, 7 km al sur, 5.4 km E cruce Ventilla, 19º 8' S 66º 7' W, (CBF 857).
Auliscomys pictus (3): BOLIVIA. LA PAZ: Franz Tamayo, Pelechuco, Ulla Ulla, Husipala, Reserva Nacional de fauna Ulla Ulla, 14º 56' S 69º 6' W, 4740 m, (CBF 6432); Murillo, Nuestra Señora de La Paz, Zongo, Laguna Viscachani, Valle de Zongo, 16º 11' S 68º 7' W, 3788 m, (CBF 3684); Jhacha Toloko, 16º 21' S 68º 2' W, 4700 m, (CBF 850).
Auliscomys sublimis (2): ARGENTINA. JUJUY: Tilcara, Sierra de Tilcara 12 km ESE de Maimará, 14 Km ESE de Tilcara, 23º 39,926' S 65º17,170' W, 4092 m, (CML 8476); 20 km al N de Villa Langostura a lo largo de ruta 243, 819.2 m, (CML 8477).
Calomys boliviae (3): ARGENTINA. JUJUY: El Carmen, Along Highway 9 at border with Salta Province, 24° 29' S 65° 18' W 4600 f, (CML 3600, 3601); Ledesma, 12 km al W de Fraile Pintado, 23° 58' S 64° 55' W sobre Río Ledesma, (CML 8307).
Calomys callosus (10): ARGENTINA. FORMOSA: Ruta provincial 3 entre Tres Lagunas y Laguna Gallo, aproximadamente a 12 km al O de Tres Lagunas 25º 11' S 58º 38' W, (CML 8376, 8377). SALTA: Metán, 15 km al N de Metán por ruta 9 y 5 km al W, 25º 23.886' S 64º59.252' W, 986m, (CML 8338, 8381); Rosario de la Frontera, Bonete Punco, 13 km al S de los Baños por ruta provincial 13 25° 53'S 64° 53' W, (CML 8382). TUCUMÁN: La Cocha, Dique San Ignacio 27º 44' S 65º 40' W, 580 ± 37 m, (CML 7174, 7175); Siambón, Río Grande 5 km al S de El Siambón, 26º 46.1' S 65º 28.1' W, 920 m, (CML 8378, 8383); Tafí Viejo, 5 km al SW Siambón, 26º 46,306' S 65º 27.922' W, 3100 f., (CML 8440).
Calomys lepidus (7): ARGENTINA. JUJUY: Rinconada, Mina Pan de Azúcar, 8 km al N y 5 km al W camino a Herrera 22º 34' S 66º 06' W, 3820 m, (CML 8324); Humahuaca, Sierra de Zenta, Ruta provincial 13, entre Chaupe Rodeo e Iruya, 12 km al N de Chaupe Rodeo 22º 53' S 65º 15' S, 3876 m, (CML 8324); Tilcara, Sierra de Tilcara. El Hueco 21 km SE de Tilcara, 23º 42.447'S 65º 14.709' W, 3100 m, (CML 8452); TUCUMÁN: Tafí Viejo Laguna de Huaca Huasi (Cumbres Calchaquíes) 26º 39' S 65º 43' W, (CML 8447, 8448, 8450, 8481).
Calomys musculinus (7): ARGENTINA. CATAMARCA: Andalgalá, Choya, 13 km NNW Andalgalá, 27° 31' S 66° 22'59 W, 4000 f, (CML 3598). SAN LUIS: Capital, 6 Km W Hualtaran Parque Provincial Sierras de las Quijadas, 32° 29.78' S 67° 00.15' W, 2800 f, (CML 3579); Salinas del Bebedero, 33° 37.45' S 66° 35.79' W, 1000 f, (CML 3582, 3583); Salinas del Bebedero, 15 km E, 1350f, (CML 3585). TUCUMÁN: Trancas, Las Juntas, 22 km W of Choromoro on Hwy 312, 26° 33' S 65° 30' W, 3500 f, (CML 3597); Tafí del Valle, La Quebradita, km 69 along Hwy 307, 26° 49' S 65° 43' W, 7500 f, (CML 3596).
Chinchillula sahamae (11): BOLIVIA. LA PAZ: Franz Tamayo, Pelechuco, Ulla Ulla, 14º 52' S 69º 16' W, 4360 m, (CBF 3265, 3266, 890, 891); Reserva Nacional de Fauna Ulla Ulla, Cabaña IBTA, 14º 52' S 69º 16' W, 4410 m, (CBF 6417, 6424, 6428, 6425); Oruro: Sajama, Curahuara de Carangas, Parque Nacional Sajama, Quebrada Kohuiri, 18º 08' S 68º 57' W, 4500 m, (CBF 2413). PERÚ. AREQUIPA: Caylloma, Puquio Lacca, Tocra, 4.390 m, (MUSA 874), AREQUIPA: AREQUIPA, Sumbay, R.N. Salinas y Aguada Blanca 16º 05' S 71º 14' W, (MUSA 1116).
Eligmodontia bolsonensis (6): ARGENTINA. CATAMARCA: Pomán, Establecimiento Río Blanco 28 km S 13.3 km W Andalgalá. 27º 51' S 66º 18' W, (CML 8395); Santa María, 7.9 km W jct Hwy 47 and 40, 26º 59' S 66º 15' W alt 2255 m, (CML 8389, 8391, 8393, 8398, 8399).
Eligmodontia hirtipes (7): ARGENTINA. JUJUY: Tumbaya, ruta 40 29 km al N del empalme rutas 40 y 52, 23° 23' S 65° 47' W, 3480 m, 7 (CML 8315, 8316, 8318, 8320, 8321, 8322, 8323).
Eligmodontia moreni (7): ARGENTINA. LA RIOJA: Vinchina, 12.4 km N Va San José de Vinchina, 28º 43' S 68º 17' W, 1681m, (CML, 8388, 8390, 8392, 8394, 8396,); 14 km N Va San José de Vinchina, 28º 43' S 68º 17' W, (CML 8397); Famatina, 12.8 km N Chilecito, 1km E Chilecito 29º 02' S 67º 27' W, 1087 m, (CML 8387).
Eligmodontia puerulus (4): ARGENTINA. JUJUY: Tumbaya, ruta 40 29 km al N del empalme rutas 40 y 52, 23° 36' S, 65° 48' W, (CML 8313, 8314, 8319); Susques, Salar de Cauchari 31 km al N de Cauchari, sobre ruta provincial n° 70, 23° 50' S 66° 47' W 3840 m, (CML 8317).
Graomys domorum (4): ARGENTINA. JUJUY: Santa Bárbara, Laguna La Brea, 23° 51' S 64° 26' W, (CML 5985); Laguna La Brea, sobre ruta 1, 3 km SW del camino a Las Siete Aguas, 23° 56' S 64° 28' W, (CML 8306). SALTA: Guachitas, 25 km SE La Viña, 25º 38.868' S 65º 28.928' W, 1579 m, (CML 8442, 8443).
Graomys griseoflavus (13): ARGENTINA. CHUBUT: 8 km by road, E SE Puerto Madryn, 19.2 m, (CML 3927). FORMOSA: Bermejo, 35 km S, 5 km E Ingeniero Guillermo Juárez, Puesto Divisadero, 24° 11.66' S 61° 53.29' W, (CML 3934). MENDOZA: San Rafael, 2 km S Puesto Punta del Agua, 35º 34.23' S 68º 03.59' W, 2700 f, (CML 3557, 3558). SALTA: Rivadavia, 31 km SSW Dragones along Río Bermejo, 23° 29.62' S 63° 25.72' W, 308.16 m, (CML 3570, 3571). SAN JUAN: Quebrada de las Flores, 4 km E and 5 km N Guayamas 31° 40' S 68° 8' W, (CML 3568). SAN LUIS: Ayacucho, 8 km W La Botija, Pampa de Las Salinas, 36° 12.45' S 66° 39.58' W, 1400 f, (CML 3562); Belgrano, 6 km al W de Hualtarán, Parque Provincial Sierra de Las Quijadas, 32º 29.78' S 67º 0.15' W, 2800 f, (CML 3563, 3564); La capital, 12 km N Varela (by road), alt. 2200 f, 1 (CML 3503); La Capital, 15 km SE Salinas del Bebedero 33° 37.45' S 66° 35.79' W, 1000 f, (CML 3566); 15 km E Salinas del Bebedero, 33° 38' S 66° 25' W, 1350 f, (CML 3508).
Loxodontomys micropus (10): ARGENTINA. CHUBUT: Ea. Leleque, 42° 22' S 71° 3' W,(CNP 1449); Lago Blanco, 45° 56' S 71° 16' W, (CNP 317). NEUQUÉN: Los Lagos, 20 km al N de Villa Langostura, along Hwy 234, 40° 36' S 71° 41' W, 819.2 f., (CML 3949); 11 km al NW jct Hwys 63 y 40 along Hwy 63, 40° 39' S 71° 8' W, 832 f, (CML 3948). SANTA CRUZ: Ea. La Ensenada, 48º 16' S 72 º 09' W, 616 m, (CNP 618, 619, 650, 659, 668, 726).
Phyllotis anitae (1): ARGENTINA. TUCUMÁN. Trancas, app. 10 km al S de Hualinchay sobre camino a Lara, 2316 m, 26º 19' S 65º 36' W. (CML 6379).
Phyllotis alisosiensis (2): ARGENTINA. TUCUMÁN. Chicligasta, El Papal, 2175 m, 7º 11 'S 65º 57', (CML 7542, 7543).
Phyllotis andium (7): PERÚ. ANCASH: Tinco, al NO de Huaraz 9° 16' S77° 40' W, 3692 m, (HZP 3300), (MUSA 4806, 4809, 4810, 4811, 4822, 4855).
Phyllotis caprinus (4): ARGENTINA. JUJUY: Tumbaya, Chilcayoc, 23° 56' S 65° 28' W 2300 m, (CML 7952, 7954); 9 km NW Bárcena, 23° 57' S 65° 30' W, 2655 m, (CML 8039, 8041).
Phyllotis gerbillus (3): PERÚ. LAMBAYEQUE: 5.4 km al sur de Morrope, 6° 35' S 79° 59' W, 22 m, (MUSA 4725, 4726, 4729).
Phyllotis osilae (10): ARGENTINA. JUJUY: Rinconada, 6 km N de Rinconada camino a Timón Cruz, 22° 23' S 66° 9' W, (CML 8069). TUCUMÁN: Chicligasta, Parque Nacional Campo de los Alisos Pto Los Nacimientos (Las Cascadas) 27º 10.598' S 65º 58.296' W, 2700 m, (CML 8337); Parque Nacional Campo de los Alisos, El Kerqueo, 27º 10.355' S 65º 58.750' W, (CML 8465, 8446); Tafí Viejo, Pie de la Cuesta a Chasquivil, 5 km río arriba de La Hoyada sobre río Hoyada, 26º 39' S 65º 33' W, 1700 m, (CML 8458, 8459); Ciénaga Grande San José de Chasquivil, 26º 28' S 65º 40' W, 2800 m, (CML 8460, 8461).
Phyllotis xanthopygus (10): ARGENTINA. CATAMARCA: Belén, 5.2 km S El Bolsón 27° 2' S 66° 47' W, (CML 8018,8017). JUJUY: Rinconada: Mina Pan de Azúcar, 8 km al N y 5 Km al W camino a Herrara 22° 33' S 66° 7' W, (CML 7962, 8011, 7963); Santa Catalina, Cuesta del Hurón 29 km W de Cieneguillas sobre ruta 64 22º 06' S 66º 03' W, (CML 7969); Yavi, 17 km W de La Quiaca sobre rutas 5 y 3 km S, sobre ruta provincial 5 22° 09' S 65° 44' W, 3711 m, (CML 8006, 8007); Susques, Curques, 24 km al N de Susques sobre ruta 74, 23° 14' S 66° 23' W, 4100 m, (CML 7984). NEUQUÉN: 2 km S Lonco Luan, along Hwy 23, 38º 58' S 71º 02' W, 235, 2 m, (CML 3635).
Salinomys delicatus (3): ARGENTINA. SAN JUAN: 25 de Mayo, 6 km al N km 514 of Hwy 20, 31º 54.84' S 68º 04.42' W, 1963 f, (CML 3556, CMI 5400). SAN LUIS: La Capital, 15 km al E de Salinas de Bebedero, 33° 38' S 66° 25' W, (CML 3171).
Tapecomys primus (2): ARGENTINA. JUJUY: Manuel Belgrano, 7 km al N de Las Capillas sobre ruta provincial 20, 24º 04' S 65º 08' W, 1998 m, (CML 7080); Valle Grande, Ruta 83 Camino Valle Grande, 9 km N San Francisco 23º 35' S 64º 58' W, 1200 m, (CML 7556).














