Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.20 no.1 Mendoza jun. 2013
ARTÍCULO
Parámetros poblacionales y estado sanitario de Carpinchos (Hydrochoerus hydrochaeris) en lagunas artificiales de los Esteros del Iberá
María J. Corriale1,2,*, María M. Orozco2,3,* e Ignacio Jiménez Perez4
1 Grupo de Estudios sobre Biodiversidad en Agroecosistemas, Departamento de Biodiversidad y Biología Experimental, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Int. Güiraldes 2620, Pabellón II, 4to Piso, Lab. 14 Ciudad Universitaria, C1428EHA Ciudad Autónoma de Buenos Aires, Argentina [correspondencia: <mjcorriale@ege.fcen.uba.ar>].
2 IEGEBA- Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET).
3 Laboratorio de Eco-Epidemiología, Departamento de Ecología, Genética y Evolución, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina.
4 The Conservation Land Trust Argentina S.A.
* Autores que han contribuido igualmente en este estudio
Recibido 10 junio 2012.
Aceptado 18 febrero 2013.
Editor asociado: M Busch
RESUMEN. En las poblaciones de carpinchos de los Esteros del Iberá se registran anualmente altas tasas de morbilidad/mortalidad durante las temporadas invernales, especialmente en ambientes artificiales. En este trabajo se estudiaron los parámetros poblacionales invernales de carpinchos en ambientes artificiales del área mencionada, y se analizó su estado sanitario. Se estimó la abundancia, tamaño de grupo, proporción de sexos, condición física y estructura etaria, y se evaluaron sanitariamente 25 carpinchos seleccionados al azar. Se realizaron estudios hematológicos y serológicos (brucelosis, tripanosomiasis y leptospirosis) y se identificaron los ectoparásitos y endoparásitos intestinales. Se observó una elevada abundancia poblacional (141.7 ± 55.9 individuos/km) y un tamaño de grupo de adultos de 13.9 ± 1.9 individuos. El índice de condición obtenido fue bajo (2.96). Se observó una alta prevalencia de ectoparásitos (Sarcoptes scabiei 90% y Amblyomma dubitatum 95%) y endoparásitos (100%). No se detectó la presencia de brucelosis y tripanosomiasis, mientras que el 45.5% de los sueros estudiados para leptospirosis fueron seropositivos al menos para un serovar. Las hembras presentaron mayores valores de hemoglobina y concentración de hemoglobina corpuscular media. Las características físicas y biológicas de los tajamares y la alta densidad poblacional, parecerían afectar los parámetros poblacionales asociados (proporción de sexo y tamaño de grupo) y las condiciones sanitarias de sus poblaciones. Así, las altas cargas parasitarias y la mortalidad asociada a posibles infecciones secundarias, podrían actuar como moduladores de las poblaciones de carpinchos, especialmente en áreas protegidas y en ausencia de grandes depredadores.
ABSTRACT. Population parameters and sanitary status of capybaras (Hydrochoerus hydrochaeris) in cutwaters of Ibera Wetlands. High rates of morbidity/mortality have been recorded in capybaras populations of Iberá Wetlands during the winter seasons, especially in artificial habitats. In this study we estimated population parameters of capybaras that inhabit the cutwaters within this region and analyzed their health status. We estimated the abundance, group size, sex ratio, physical condition and age structure, and we evaluated the sanitary status of 25 randomly selected capybaras. We carried out haematological, serological (brucellosis, trypanosomiasis and leptospirosis), ectoparasite and endoparasite studies. Local density of capybaras was high (141.7 ± 55.9 individuals/km) and group size for adults was 13.9 ± 1.9 individuals. The health condition index of sampled capybaras was low (2.96). A high prevalence of ectoparasites (Sarcoptes scabiei 90%; Amblyomma dubitatum 95%) and endoparasites (100%) was found. Serological tests for brucellosis and trypanosomiasis were negative, while 45.5 % of sera samples studied for leptospirosis were seropositive for at least one serovar. Females had higher values of hemoglobin and mean cell hemoglobin concentration. Physical and biological characteristics of artificial environments, combined with high population density of capybaras could have a significant impact on population structure and its sanitary conditions. High parasitic loads and mortality associated with possible secondary infections could modulate populations of capybaras, especially in protected areas without hunting or large predators.
Palabras clave: Carpincho; Esteros del Iberá; Lagunas artificiales; Parámetros poblacionales; Parásitos.
Key words: Capybara. Cutwaters; Esteros del Iberá; Parasites; Population parameteres.
INTRODUCCIÓN
El impacto de enfermedades parasitarias sobre poblaciones animales en estado silvestre ha sido reconocido como un factor importante que influye en la distribución y densidad de las especies (Anderson, 1979). Asimismo, las parasitosis están condicionadas por factores biológicos y ambientales que actúan como presiones de selección natural (Darwin, 1859) y han sido identificadas como componentes críticos a considerar en la biología de la conservación (Scott, 1988). El impacto de los parásitos no solo tiene implicancias en la supervivencia y reproducción de los individuos de la población hospedadora, sino también en la estructura de edades, la dispersión, la diversidad genética y en la abundancia relativa y estructura de la comunidad ecológica que habitan (Scott, 1988). A su vez, las condiciones ambientales y las características poblacionales de los hospedadores (e.g. estado nutricional y densidad) juegan un papel determinante en la distribución de sus infecciones parasitarias (Scott, 1988).
Las actividades humanas generan cambios físicos y biológicos en el ambiente. La fragmentación de los hábitats altera la composición de las especies en un ambiente (Patz et al., 2004), muchas de ellas hospedadoras de patógenos, incrementando el riesgo de transmisión de agentes infecciosos (Holmes, 1996). Esta situación expone a los organismos a un amplio rango de nuevas condiciones, donde su respuesta depende tanto de las características intrínsecas de la especie como del tipo e intensidad del cambio producido (Balcom y Yahner, 1996). En algunos casos se favorecen extinciones locales y en otros casos se crean nuevos nichos que muchas veces favorecen la proliferación de alguna especie o bien de enfermedades, afectando negativamente la diversidad biológica (Wisnivesky, 2003).
La ecorregión Esteros del Iberá constituye uno de los humedales más diversos del Cono Sur y una de las reservas de agua dulce más importante de Argentina (Neif, 2004). Sin embargo este sistema de humedales también es afectado por las actividades productivas, fundamentalmente arroceras, forestaciones y ganadería (Cózar et al., 2005), siendo frecuente encontrar humedales artificiales, como los denominados tajamares (pozos o represamiento de aguas superficiales) que fueron construidos para el abastecimiento de agua al ganado y/o drenaje de los campos.
El carpincho (Hydrochoerus hydrochaeris) es una de las especies de fauna silvestre mas utilizadas por los pobladores rurales y una de las más abundantes de Iberá (Alvarez, 2003; Corriale, 2010). Estos roedores semiacuáticos, territoriales y gregarios (Herrera y MacDonald, 1987, 1989), realizan la mayor parte de sus actividades en la cercanía de varios tipos de cuerpos de agua como ríos, bañados, esteros, arroyos, lagunas y manglares (Herrera y MacDonald, 1989; Corriale, 2010; Ojasti, 2011). Se distribuye exclusivamente en la región tropical de América del Sur (Mones y Ojasti, 1986). En Argentina, la provincia de Corriente presenta las poblaciones más grandes del país (Bolkovic et al., 2006).
Se conoce que algunas enfermedades como la tripanosomiasis, la brucelosis y la sarna pueden causar importantes descensos poblacionales en estos roedores, la tripanosomiasis y la brucelosis han causado alta morbilidad y mortalidad en diferentes poblaciones de carpinchos (Gutiérrez, 1958; Plata, 1972; Godoy, 1973; Bello et al., 1974). La sarna provocada por Sarcoptes scabiei es considerada como la limitante más importante para la cría en cautiverio de esta especie (Sosa Burgos, 1981), debido a que su incidencia es muy elevada, tanto en cautividad como en vida silvestre, causando graves descensos poblacionales, especialmente cuando grandes grupos se concentran en los cuerpos de agua (Campo Assen et al., 1981; Riviera, 1983; Zurbringen et al., 1984). Cabe mencionar también diferentes especies de garrapatas que, además de provocar un daño mecánico al hospedador, pueden provocar graves problemas sanitarios por ser vectores de diversos agentes como Rickettsia rickettsii (Wolbach 1919) (Guglielmone et al., 2004).
Si bien existen estudios acerca del estado parasitológico de poblaciones de carpinchos (Mayaudon, 1980; Campo Assen et al., 1985; Draghi, 1993; Fagonde y Batista, 1994; Casas et al., 1995; Allekotte, 2003; Salas y Herrera, 2004; Corriale et al., 2011), poco se conoce para las poblaciones silvestres de Argentina.
Los objetivos de este trabajo fueron, en primer lugar, estimar parámetros poblacionales invernales tales como abundancia, tamaño de grupo, proporción de sexos, condición física y estructura de edades de los carpinchos que habitan en pequeños humedales artificiales (tajamares) dentro de Iberá, y en segundo lugar, evaluar su estado sanitario durante la estación de mayor mortalidad (invierno), a fin de discutir las relaciones entre el estado sanitario y los parámetros poblacionales hallados en la población estudiada. Con este trabajo se intenta generar información de base que contribuya al manejo y conservación de esta especie.
METODOLOGÍA
Área de estudio
El trabajo se llevó a cabo en el Parque "Rincón del Socorro" (28º 39' S 57º 25' W) ubicado al sur del Macrosistema Iberá (Corrientes, Argentina). Esta ecorregión comprende un complejo de ecosistemas con predominio de ambientes palustres (esteros y bañados) separados por cordones arenosos que interconectan lagunas poco profundas (Carnevali, 2003). El clima es subtropical húmedo, con una estacionalidad hídrica y térmica (primaveras y veranos cálidos y lluviosos, inviernos y otoños fríos con menores precipitaciones). Rincón del Socorro es una antigua estancia ganadera reconvertida en reserva privada de conservación estricta de 13 000 ha. Todo el ganado fue extraído al menos cinco años antes de la realización del estudio. En esta área, los carpinchos no presentan predadores naturales. El yaguareté (Panthera onca) se encuentra extinto en toda la ecorregión y el puma (Puma concolor) es extremadamente escaso (Jiménez, datos sin publicar; Ojasti, 2011). El estudio se realizó en dos tajamares seleccionados por su representatividad, cuyos tamaños fueron de 2.6 ha y de 2.8 ha y sus perímetros de 838.4 m y 759.2 m, respectivamente. En comparación con la mayoría de las lagunas naturales del Iberá, los tajamares de nuestro estudio tienen una menor superficie y una mayor profundidad, lo que minimiza las distancias entre animales ubicados en la costa de estas lagunas artificiales y favorece el estancamiento del agua a lo largo el año. Ambos tajamares presentaron una cobertura vegetal de entre el 40 y el 60% de su superficie con distintas especies palatables para el carpincho entre las que se destacan Juncus sp., Luziola peruviana, Eichorniacrassipes, E. azurea y Salvinia biloba.
Parámetros poblacionales
Durante el invierno de 2008 se relevaron los dos tajamares a fin de determinar el número y tamaño de grupo de carpinchos. Los relevamientos de los individuos se realizaron en las primeras horas de la mañana y al atardecer (conforme a las horas de mayor actividad de la especie; Corriale, 2010) durante 4 días consecutivos efectuando el conteo directo de individuos a través de recorridas a pie entre 5-15 m de la línea de costa de ambos tajamares. Cada grupo social presente fue identificado por la posición geográfica, el tamaño, la relación de sexos y la categoría de edad de los individuos mediante observación directa. Se estimó una densidad por km de línea de costa. Las categorías etarias se establecieron mediante el tamaño de cada individuo, siguiendo los intervalos de edad y peso descritos por Ojasti (2011): adultos (A: más de 18 meses; más de 35 kg); sub-adulto (SA: 12 a 18 meses; 22 a 35 kg); juveniles (J: entre cuatro y 12 meses; 7 a 22 kg) y crías (C: menores de cuatro meses; menos de 7 kg).
Captura e inmovilización de individuos
Se capturó un total de 25 individuos seleccionados al azar procedentes de ambos tajamares. Los animales fueron capturados con un lazo y redes especialmente diseñadas. Para la inmovilización química se utilizaron alternativamente dos protocolos anestésicos parenterales: A) Tiletamina-Zolazepam (Zelazol®, Fort Dodge), 3-5 mg/ kg, y B) Ketamina 2-6 mg/ kg-Midazolam 0.1-0.3 mg/kg. En los casos necesarios, se suplementó con anestesia inhalatoria usando Isofurano. Los carpinchos fueron colocados sobre mantas acolchadas, sus ojos fueron protegidos con soluciones lubricantes ofálmicas y se acondicionó el lugar de trabajo para mantener la temperatura corporal de los carpinchos dentro de los parámetros normales. Los animales fueron monitoreados permanentemente registrando sus parámetros vitales en planillas anestésicas a intervalos de cinco minutos, utilizándose monitoreo cardíaco y oximetría de pulso.
Condición corporal, colecta de parásitos y toma de muestras biológicas
La condición corporal fue analizada mediante un examen físico visual general (EFV) y a través del índice de condición física (IK). Para el EFV se determinaron tres categorías (G, L, S) conforme al estado general aparente (pelaje, presencia de ectoparásitos, heridas cutáneas). La categoría G correspondió a animales enfermos con lesiones graves, con hiperqueratosis grave y alopecia en más del 50% de la superficie corporal, o bien hiperqueratosis y alopecia en menos del 50% del cuerpo pero con presencia de grieta en la piel y heridas sangrantes (distinguibles de las producidas en luchas intraespecíficas). La categoría L correspondió a animales enfermos con lesiones leves e incluyó animales con alopecia en menos del 50% de la superficie corporal, sin presentar grietas en la piel ni heridas sangrantes. Por último la categoría S correspondió a animales aparentemente sanos que no presentaban alopecia ni lesiones en la piel. El índice de condición física (IK) propuesto por Bailey (1968) y utilizado por Willner et al. (1979) se basa en la relación del peso y la longitud corporal mediante la siguiente formula: K = (W/ LC3) x 105, donde W es el peso (en kg) y LC es el largo del cuerpo (en cm). Los valores de dicho índice varían entre 1 y 10. El peso fue registrado a través de una balanza portátil y el largo del cuerpo fue medido con una cinta métrica desde el hocico a la base de la cola. Se recolectaron ectoparásitos de los individuos capturados y se tomaron muestras de lesiones de piel mediante raspajes e improntas. Luego de la toma de muestras fueron colocadas soluciones "curabicheras" alrededor de las lesiones para la prevención de miasis. Las muestras de ectoparásitos se colocaron en alcohol al 70%. Se agrupó a los animales según su carga parasitaria de garrapatas estableciendo tres grados de infestación: Grado 0 = sin carga parasitaria evidente, 1 = carga baja (menos de 20 garrapatas ubicadas en forma aislada en la superficie corporal del animal), 2 = carga elevada (más de 20 garrapatas ubicadas en forma aislada o agrupada en uno o más sitios en la superficie corporal del animal). Asimismo, los animales se agruparon en otros tres grados de infestación por sarna, establecidos por observación de los raspajes mediante microscopíaóptica y conteo de los ácaros por campo: Grado 0 = sin carga parasitaria evidente, 1 = carga baja (menos de 5 ácaros por campo); 2 = carga elevada (más de 5 ácaros por campo). La identificación de los ejemplares adultos y ninfas de garrapatas se llevó a cabo según las claves de Boero (1957); Guglielmone y Viñabal (1994) y Estrada-Peña et al. (2002). Para la identificación de los ácaros se utilizó bibliografía específica (Fain, 1968; Pence et al., 1975; Krantz, 1978). Para el estudio cualitativo de endoparásitos se tomó un total de 51 muestras de materia fecal procedentes de diferentes individuos capturados, 30 en fresco y 21 conservadas en formol al 5%. Las mismas fueron analizadas mediante la técnica de Willis para la detección de huevos de nematodes, cestodes y coccidios, y mediante la técnica de Denis para la detección de huevos de trematodes utilizando bibliografía específica para la identificación taxonómica (Soulsby, 1987). A cada animal capturado se le extrajo sangre con y sin anticoagulante para realizar los exámenes serológicos y estimar los parámetros hematológicos. Los frotis destinados a la detección de hemoparásitos fueron fijados y teñidos con Dif Quick®. Se realizaron cuatro tubos de hematocrito por animal. La sangre obtenida con anticoagulante se destinó a la realización de pruebas de hematología general. La sangre obtenida sin anticoagulante fue centrifugada y el suero obtenido se utilizó para realizar pruebas serológicas (brucelosis, tripanosomiasis y leptospirosis). En el caso de Brucella sp., se empleó la técnica de Seroaglutinación lenta en tubo (SAT) y la técnica de Polarización Fluorescente (FPA). En el caso de FPA se consideró como umbral 90-100 mP (Manual de la OIE sobre animales terrestres, 2004). Para determinar la infección por Leptospira interrogans (Stimson 1907) se utilizó la técnica diagnóstica indirecta de microaglutinación (MAT), analizando nueve serovares: canicola, ballum, icterohaemorrhagiae, pomona, grippotyphosa, wolf, pyogenes, tarasovi y hardjo. El título de corte utilizado fue 200. Para el diagnóstico de tripanosomiasis se colectaron muestras de sangre en capilares de microhematocrito, se realizaron frotis sanguíneos y se inocularon ratones de laboratorio con sangre entera obtenida de los carpinchos. Las muestras fueron enviadas al Centro de Diagnósticos e Investigación Veterinaria Formosa donde se realizó la búsqueda de tripanosomas mediante microscopía óptica y se monitoreó la eventual aparición de infección en los ratones de laboratorio.
Análisis de datos: para analizar las proporciones de sexos y las proporciones de individuos pertenecientes a diferentes categorías se utilizaron pruebas de homogeneidad con el estadístico χ2 (Zar, 1996). Las diferencias en los IK y en los parámetros hematológicos entre sexos y diferentes categorías o grados de infestación fueron puestas a prueba mediante análisis de varianza no paramétricos de Kruskal Wallis (Zar, 1996). Para analizar la relación entre el peso, sexo, IK y EFV de los individuos con la presencia de ectoparásitos y endoparásitos, se realizó un Análisis de Correspondencia Canónica (CCA) (ter Braak, 1987a), el cual se llevó a cabo utilizando el programa CANOCO (ter Braak, 1987b).
RESULTADOS
Parámetros poblacionales
La abundancia de carpinchos en los tajamares fue de 141.7 ± 55.9 individuos/km y se contabilizó un total de 222 carpinchos en ambos tajamares; el tamaño de grupo medio de adultos fue de 13.9 ± 1.9 individuos y el tamaño de grupo total fue de 24.67 ± 3.06. La estructura etaria mostró una mayor proporción de individuos adultos (56%) y un bajo porcentaje de crías (Tabla 1). La proporción de sexos de los individuos adultos difirió de la relación 1:1 (p < 0.05) siendo de 1 macho: 2.1 hembras.
Tabla 1
Estructura poblacional de carpinchos presentes en dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina. N: número de individuos; M: machos adultos; H: hembras adultas; SA: subadultos; J: juveniles; C: crías; NN: individuos no identificados; T: tajamar; Po: proporción observada; EE: error estándar.

Condición corporal
No se encontraron diferencias en la proporción de individuos pertenecientes a las categorías G, L y S (χ2 = 0.286; g.l. 2; p = 0.867), ni en el número de individuos de las categorías G, L y S entre machos y hembras (χ2 = 1.333; g.l.= 2; p = 0.513). Cabe destacar que no se encontraron individuos adultos pertenecientes a la categoría G y que no se pudo analizar estadísticamente la relación existente entre las categorías etarias y el EFV dado que el bajo número de animales examinado no lo permitió. Sin embargo, se observó que los individuos juveniles presentaron más frecuentemente categorías G y L, que los adultos. Teniendo en cuenta que el índice de condición oscila entre 1 y 10, el IK de los carpinchos capturados fue relativamente bajo: 2.96 (2.69-3.32) y no se encontraron diferencias significativas en el IK entre sexos (H (1, N= 25) = 0.074; p = 0.786), ni entre los grupos de edades (H (2, N= 24) = 1.214; p = 0.55). Tampoco se encontraron diferencias en los IK entre las categorías obtenidas por la EFV (H (2, N= 24) = 1.396; p = 0.498).
Estado sanitario
En los ejemplares examinados se hallaron los ectoparásitos y endoparásitos que se detallan a continuación. Asimismo, se registraron los valores hematológicos sanguíneos y los resultados de exposición a un conjunto de agentes infecciosos de conocida susceptibilidad.
Sarna. Uno de los agentes hallados en las lesiones presentes en la piel de los carpinchos afectados fue Sarcoptes scabiei (Linnaeus, 1758). La prevalencia fue del 90%. Los hallazgos de hiperqueratosis asociada a lesiones purulentas sugieren la contaminación bacteriana de las lesiones. Una alta proporción de individuos (43%) presentó una elevada infestación (Grado 2), los cuales correspondieron mayoritariamente a subadultos, mientras que los ejemplares juveniles (24%) presentaron un grado más leve de infestación (Grado 1; Fig. 1). No se encontraron diferencias entre los IK de los individuos con distinta categoría de infestación (H (2, N=25) =0.37; p=0.832) pero sí se encontraron diferencias significativas en las categorías de infestación al comparar entre machos y hembras (χ2 = 17.0; g.l.= 2; p < 0.0002), hallándose una mayor proporción de hembras pertenecientes a la categoría 2 y una mayor proporción de machos en la categoría 1 (p < 0.05).

Fig. 1. Estructura etaria y proporción de individuos (PI) pertenecientes a los diferentes grados de infestación por Sarcoptes scabiei detectados en carpinchos en dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina. A: adultos; SA: subadultos; J: juveniles; 0: sin carga parasitaria evidente; 1: baja carga 2: carga elevada.
Garrapatas. Fueron identificadas como Amblyomma dubitatum Neumann, 1899. La prevalencia fue del 95%. El mayor número de individuos presentó una baja carga parasitaria (Grado 1) representados principalmente por carpinchos adultos y juveniles (Fig. 2). No se encontraron diferencias entre el IK de los individuos con grado de infestación 1 y 2 por A. dubitatum (H(1, N=24)=0.02; p=0.896). Cabe destacar que no se consideró en el análisis el grado de infestación 0 dado que solo un individuo perteneció a dicha categoría. Tampoco se encontró una relación entre el sexo y el nivel de infestación con garrapatas (χ2= 1.625; g.l.= 2; p< 0.444). No se encontró asociación entre el peso, el sexo, el IK y el EFV de los carpinchos muestreados y la presencia de S. scabiei y A. dubitatum (Test de Monte Carlo para el primer eje: Autovalor: 0.015, F = 2.285, p = 0.288; Test de Monte Carlo para todos los ejes en su conjunto: Traza: 0.026, F = 1.412, p = 0.160).
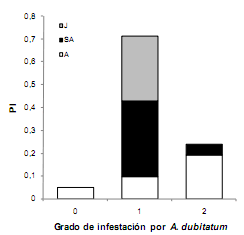
Fig. 2. Estructura etaria y proporción de individuos pertenecientes a los diferentes grados de infestación por Amblyomma dubitatum detectados en carpinchos en dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina. Referencias como en Fig. 1.
Endoparásitos. A partir de las heces frescas se obtuvieron los siguientes resultados mediante la técnica de Willis: (1) huevos de nemátodos: tricostrongilideo compatible con Viannella hydrochoeri Travassos, 1914, con una prevalencia del 100%; (2) huevos de cestodes: anoplocefalideo compatible con Monoecocestus spp. y Moniezia sp., con una prevalencia del 13 %; (3) Huevos de coccidios: Eimeria spp., con una prevalencia del 53%. Mediante la técnica de Denis los tremátodos detectados fueron parafistomideos compatibles con Taxorchis schistocotyle Beddard, 1914, con una prevalencia del 13%. A partir de las heces formolizadas, mediante la técnica de Willis se detectó la presencia de V. hydrochoeri con una prevalencia del 62% y Eimeria spp. con una prevalencia del 10%. La prevalencia total fue de 62%. Mediante la técnica de Denis se detectó solamente T. schistocotyle con una prevalencia del 19%.
Serología y diagnóstico
Los resultados del diagnóstico de Brucella sp., fueron negativos por ambas técnicas. Trypanosoma sp. fue negativo en los frotis sanguíneos y en los capilares de microhematocrito. Las muestras de sangre obtenidas de la cola de los ratones de laboratorio inoculados tampoco evidenció la presencia del parásito durante todo el período de observación. De los 22 sueros de carpinchos estudiados para leptospirosis, 10 (45.5%) fueron seropositivos al menos para un serovar. Los carpinchos estudiados presentaron evidencia de exposición a los serovares ballum (n = 6), pomona (n = 4), grippotyphosa (n = 3), e icterohaemorrhagiae (n = 1). No se detectó exposición a ninguno de los restantes serovares analizados.
Parámetros hematológicos
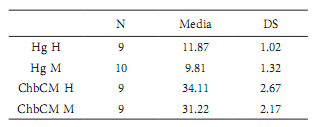
Hemograma. En la Tabla 2 se presentan los valores promedio de los hemogramas realizados a los carpinchos evaluados. Las hembras presentaron mayores valores de hemoglobina y concentración de hemoglobina corpuscular media (ChbCM) (H(1, N= 19) = 9.627, p = 0.002; H(1, N= 18) = 4.180, p = 0.041, respectivamente; Tabla 3). El resto de los parámetros hematológicos estudiados no presentaron diferencias significativas entre sexos: eritrocitos (H(1, N=18) = 3.612, p = 0.057) leucocitos (H(1, N= 21) = 1.138, p = 0.286); hematocrito (H(1, N= 18) = 3.056, p = 0.08); volumen corpuscular medio -VCM- (H(1, N= 13) = 0.421, p = 0.516) y hemoglobina corpuscular media -HCM- (H(1, N= 13) = 3.546, p = 0.06). En cuanto a la comparación de dichos parámetros entre las diferentes categorías etarias de los individuos capturados no se obtuvieron diferencias significativas en ningún caso: eritrocitos (H(2, N= 18) = 2.63, p = 0.269); leucocitos (H(2, N= 19) = 4.490, p = 0.106); hematocrito (H(2, N= 18) = 1.932, p = 0.381); hemoglobina (H(2, N= 19) = 4.288, p = 0.117); ChbCM H(2, N= 18) = 2.071, p = 0.355); VCM (H(2, N= 15) = 4.078, p = 0.130) y HCM (H(2, N= 15) = 1.748, p = 0.417). Cabe destacar que en el caso del hematocrito sólo se comparó entre adultos y subadultos por el bajo número de muestras de juveniles analizado.
Tabla 2
Valores sanguíneos medios y desviación estándar de los carpinchos en dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina. ChbCM: concentración de hemoglobina corpuscular media; VCM: volumen corpuscular medio; HCM: hemoglobina corpuscular media; ** Distribución no normal, se utilizó la mediana y cuartiles.

Tabla 3
Promedio de valores de hemoglobina (Hb) y concentración de hemoglobina corpuscular media (ChbCM) de machos (M) y hembras (H) con su desviación estándar (DS) en carpinchos de dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina.
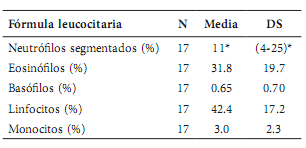
Fórmula leucocitaria. La Tabla 4 muestra los valores medios obtenidos de los parámetros leucocitarios realizados a los carpinchos capturados. Ninguno de los parámetros estudiados mostró diferencias significativas entre machos y hembras ni entre categorías etarias: neutrófilos (H(1, N= 17) = 0.009, p=0.923; H(2, N= 16) = 1.485, p=0.476); eosinófilos (H(1, N= 17) = 0.754, p= 0.385; H(2, N= 16) = 0.515, p=0.772); basófilos (H(1, N= 17) = 2.040, p=0.153; H(2, N= 16) = 1.620, p=0.445); linfocitos (H(1, N= 17) = 0.231, p=0.630; H(2, N= 16) = 1.110, p=0.574 y monocitos (H(1, N=17) = 0.881, p=0.348; H(2, N= 16) = 3.281, p=0.194).
Tabla 4
Promedio de valores sanguíneos normales con su desviación estándar en carpinchos en dos humedales artificiales (tajamares) de los Esteros del Iberá, Corrientes, Argentina; * = distribución no normal, se utilizó la mediana y cuartiles.
DISCUSIÓN
Parámetros poblacionales
La densidad encontrada en estas lagunas artificiales (141.7 ind/km) fue mayor que la estimada para lagunas naturales en otra área de los Esteros del Iberá, con las mismas condiciones de ausencia de predadores y cacería (102.8 ind/km) (Corriale, 2010; Corriale et al., 2011). Esta diferencia podría deberse principalmente a la mayor disponibilidad de recursos a lo largo del año por la existencia de un sistema de regado y segado de la vegetación en los alrededores de los tajamares que brindaría una mayor disponibilidad de alimento principalmente en la estación seca. Los tamaños de grupo de los ambientes artificiales son similares a los de ambientes naturales para la misma estación, considerando tanto el tamaño de grupo total como solamente el de individuos adultos (27.3 ± 1.3 individuos y 13.3 ± 0.7 individuos, respectivamente; Corriale, 2010) pero los tamaños de grupo de los ambientes artificiales presentaron un rango de variación mayor. Estos valores son superiores a los encontrados en los llanos venezolanos (9.6 individuos; Herrera y Macdonald, 1987) y en el Pantanal de Brasil (10.6 individuos; Alho y Rondon, 1987) mientras que en bosque aluvial amazónico y en el Chaco paraguayo los tamaños de grupo reportados fueron muy inferiores a los obtenidos en este trabajo (4.8 ± 2.4 individuos y 2-6 individuos, respectivamente) (Soini, 1993; Campos Krauer, 2009). Nuestros resultados apoyan la tendencia observada por Herrera et al. (2011) y Corriale et al. (2013) quienes sugieren una relación positiva entre el tamaño medio de grupo de carpinchos y su densidad poblacional, la cual parecería estar asociada a la productividad de los diferentes ecosistemas. Teniendo en cuenta la ausencia de grandes depredadores y de caza, unida a la gran disponibilidad de recursos a lo largo de todo el año, estos ambientes artificiales brindarían condiciones propicias para una alta abundancia poblacional.
La estructura de edades en poblaciones de lagunas naturales (A: 51.5%; SA: 16.7; J: 17.9% y C: 14.3) para la misma estación (Corriale et al., en prep.) presentó un menor porcentaje de adultos y un mayor porcentaje de crías que lo observado en este estudio. Es probable que en los ambientes artificiales la alta prevalencia parasitaria y la alta mortalidad de individuos jóvenes pudiera estar afectando la estructura de edades. En cuanto a la proporción de hembras respecto al número de machos observada en los tajamares, resultó menor a la encontrada en lagunas naturales (relación de sexos: 1M: 2.77H; Corriale et al., en prep.). El mayor porcentaje de machos presentes en los tajamares podría deberse a la alta disponibilidad de recursos, lo que reduciría la ocurrencia de interacciones agresivas por competencia (Ebensperger, 2003; Soto Gamboa, 2003).
Estado sanitario
El estado general de los carpinchos capturados en los tajamares artificiales de Rincón del Socorro fue regular o malo, presentando una mala condición corporal cerca del 62% de los individuos examinados (pertenecientes a las categorías G y L), lo que asociado a las altas densidades halladas en los tajamares, permite inferir que la transmisión de ciertas enfermedades como la sarna puede verse favorecida en estos ambientes por una alta tasa de contacto entre individuos. Si bien los individuos enfermos suelen ser más susceptibles a las capturas por la metodología empleada, el relevamiento visual previo a las capturas avaló dichos resultados.
El valor medio de los IK fue de 2.96; considerando que dicho índice oscila en un rango de 0-10, los resultados obtenidos indicarían que los carpinchos presentaron un estado deficiente. Si bien no existen hasta el momento valores de referencia para la especie, dicho índice fue usado para otra especie de hábitos similares como el coipo (Myocastor coypus) (Corriale, 2004) en la que el IK fue de 5.18 (4.69-6.63). Dicho trabajo se realizó en lagunas artificiales y bajo condiciones antrópicas similares a las encontradas en los tajamares de Iberá, y se encontraron diferencias en el IK de los coipos pertenecientes a distintas lagunas, probablemente debido a las diferencias en la aptitud de hábitat (Corriale et al., 2006) y a la mayor densidad de coipos hallados (Corriale et al., 2008). En nuestro trabajo, a pesar de capturar individuos en dos tajamares de características y parámetros poblacionales diferentes, los IK de los carpinchos capturados presentaron un bajo coeficiente de variación.
Una elevada prevalencia ectoparasitaria fue hallada tanto para S. scabiei (90%) como para A. dubitatum (95%). El hallazgo de estos ectoparásitos es consistente con hallazgos previos para la especie (Campo Assen et al., 1981; Zurbringen et al., 1984; Draghi, 1993) y justifica las lesiones halladas sobre la piel de los ejemplares examinados, registradas en más del 50% de los individuos capturados. Las posibles infecciones bacterianas asociadas se corresponden con los cuadros clínicos hallados.
La alta densidad poblacional y el consecuente estrecho contacto que ocurre entre los carpinchos en los tajamares, sumado a que los resultados fueron obtenidos en la época más seca del año, favorecerían una alta incidencia de la sarna, tal como lo describen Campo Assen et al. (1981) en poblaciones de Venezuela y Zurbringen et al. (1984) para ambientes similares a los del presente trabajo. Zurbringen et al. (1984) observaron un desmejoramiento progresivo a lo largo del tiempo, anorexia, enfaquecimiento, caquexia y muerte causada por S. scabiei. La incidencia de sarna aumenta e incluso produce grandes mortalidades durante la sequía, cuando se concentran los animales en los pocos arroyos con agua que persisten (Zurbringen et al., 1984). Incluso en condiciones de cautiverio con alto confinamiento, a pesar de implementar medidas de control, se han encontrado altas prevalencias de sarna (e.g. 64%) (Riviera, 1983). Si bien la sarna en cautiverio se presenta tanto en juveniles como en adultos (Sosa Burgos, 1981; Riviera, 1983) en nuestro trabajo los individuos subadultos y las hembras estuvieron afectados en mayor medida. Dado que la patogénesis y la sintomatología clínica de la sarna están asociadas al estado inmunitario del hospedador (Pence y Ueckermann, 2002), los individuos juveniles podrían ser mas susceptibles por el incompleto desarrollo de su sistema inmune, mientras que el hecho de que hembras de distintas categorías etarias participen en el cuidado parental, aumentaría el contacto con los juveniles. Así, S. scabiei podría estar jugando un papel importante en las diferencias observadas en la estructura de edades de estas poblaciones de carpinchos.
Cabe destacar que además del proceso patológico que genera la presencia de los ácaros en los carpinchos, la ocurrencia de esta parasitosis disminuye considerablemente e incluso anula el valor comercial de su piel (Campo Assen et al., 1981). Si bien este trabajo se desarrolló en un área protegida en la que los animales no son explotados comercialmente, los resultados obtenidos constituyen un antecedente respecto a los daños que la sarna puede ocasionar en la piel de los individuos afectados.
Sarcoptes scabiei, como la mayoría de losácaros, se encuentra adaptado a hospedadores específicos por lo que no se transmitiría a otras especies, y por lo tanto no representaría una amenaza para las especies domésticas ni para el hombre (Zurbringen et al., 1984; Draghi, 1993).
Los endoparásitos diagnosticados en el área de estudio son similares a los citados para otras poblaciones de la laguna Iberá y zonas aledañas (Ortiz y Rizzello, 2004, Corriale et al., 2011) aunque se hallaron variaciones en las prevalencias de los distintos parásitos. En nuestro estudio la prevalencia total de endoparásitos fue del 100%, en correspondencia con prevalencias de similar magnitud halladas por Costa y Catto (1994), Sinkoc et al. (1995, 2009) Salas y Herrera (2004) y Ojasti (2011), en condiciones naturales.
Todos los individuos capturados presentaron V. hydrochoeri, un nematodo frecuente en la especie hospedadora estudiada (Casas et al., 1995; Allekotte, 2003; Ortiz y Rizello, 2004; Sinkoc et al., 1995, 2009; Salas y Herrera, 2004). En las cercanías del área de estudio, en la laguna Iberá, Ortiz y Rizzello (2004) hallaron V. hydrochoeri, aunque con una frecuencia menor (14%).
La prevalencia de cestodes de la familia Anoplocephalidae (Monoecocestus spp. y Moniezia sp.) encontrados en este trabajo (13%) fue similar a la encontrada en poblaciones naturales (Casas et al., 1995; Moreno et al., 1999) incluso de zonas aledañas (Corriale et al., 2011) y en condiciones de cautiverio (Ribeiro, 2002). Sin embargo, para Monoecocestus spp. se han reportado prevalencias superiores al 50% (Costa y Catto, 1994; Salas y Herrera, 2004; Sinkoc et al., 2009). La baja prevalencia de Anoplocephalidae hallada en la población de carpinchos estudiada puede corresponderse con una baja circulación del parásito en elárea.
En cuanto a los coccidios, la prevalencia de Eimeria spp. (53%) fue superior a la hallada en distintos ambientes naturales cercanos a nuestra área de estudio (prevalencia de 1-13%; Ortiz y Rizzello, 2004; Corriale et al., 2011). Mientras que en Venezuela, Moreno et al. (1999) encontraron una prevalencia similar a la hallada en este trabajo (41.7%). La alta prevalencia encontrada podría estar asociada a la alta densidad poblacional, el agua estancada, falta de higiene y condiciones climáticas de alta humedad (Allekotte, 2003). Cabe destacar que dicha parasitosis perjudica principalmente a individuos jóvenes, y las bajas cargas parasitarias permiten el desarrollo de ciertos niveles de inmunidad (Allekotte, 2003).
La prevalencia de T. schistocotyle hallada en este trabajo (13-19%) fue similar a la encontrada por Sinkoc et al. (2009) en Río Grande (Brasil) y por Casas et al. (1995) en Bolivia. Por otro lado, las prevalencias en poblaciones de San Pablo (Sinkoc et al., 2004) y en el Pantanal (Casas et al., 1995) fueron superiores al 40% y en Venezuela la prevalencia fue del 83% (Salas y Herrera, 2004).
La brucelosis es una enfermedad ampliamente distribuida en países en desarrollo y se ha demostrado que numerosas especies de animales silvestres son susceptibles a la infección por diferentes especies del género Brucella (Bell et al., 1977). Diversos autores reportan una alta incidencia de esta enfermedad en carpinchos (Plata, 1972; Godoy, 1973, Bello et al., 1974; Lord y Flores, 1983; Draghi, 1993), por lo cual es de notable importancia la ausencia de seroprevalencia para esta enfermedad en los individuos capturados. Este fenómeno, poco usual en poblaciones naturales, puede atribuirse a la escasa o nula interacción con ganado doméstico en esta área de reserva. Tampoco se han encontrado casos positivos de tripano-somiasis, mientras que casos agudos de esta enfermedad en carpinchos se han detectado en nuestro país (Gutiérrez, 1958) así como en Brasil (Núñez et al., 1993) y en Paraguay (Elmasian y Mignone, 1904).
Una alta proporción de individuos presentaron anticuerpos contra Leptospira sp. (45%). Esta proporción es levemente superior a la descripta en otras poblaciones naturales de Brasil que presentaron porcentajes del 33.3% (Ito et al., 1998), 30.2% (Nogueira et al., 1997) y 35.3% (Shimabukuro, 2006) y en criaderos del mismo país 27% (Silva et al., 2009). Sin embargo, la proporción observada fue inferior a la encontrada en condiciones de cautiverio en Perú donde se registraron porcentajes del 97.2% al 100% (Cueva et al., 2010) y a la observada en ríos de áreas metropolitanas con alto grado de contaminación (60%) (Shimabukuro, 2006). En estos casos, la transmisión de leptospirosis (a través de la orina de los animales infectados) pudo estar favorecida por la combinación de factores tales como el tipo y el tamaño de los ambientes acuáticos, el estancamiento de sus aguas (especialmente durante la época seca), la concentración de materia orgánica por descargas cloacales, las altas temperaturas y la alta congregación de individuos (McDonough, 2001; Odriozola, 2003).
Las variantes serológicas más frecuentes reportadas en carpinchos son icterohaemorrhagiae y copenhageni (Shimabukuro, 2006) las cuales además poseen como principal reservorio a Rattus norvergicus (Leighton y Kuiken, 2001). En nuestro trabajo, la mayor frecuencia fue observada para el serovar ballum (60%). Cordeiro et al. (1981) describieron a varios roedores y marsupiales silvestres como reservorios de las variantes serológicas grippotyphosa, pomona y ballum, tres de las cuatro variantes encontradas en este estudio. Por otro lado, la variante serológica pomona suele hallarse con alta frecuencia en ovinos y búfalos (Girio et al., 2004), estos últimos presentes en el área. Sobre la base de estos resultados se considera que una considerable fracción de carpinchos podría estar actuando como reservorio de leptospiras patógenas enfatizando los riesgos asociados tanto para la salud humana como para otras especies.
Parámetros hematológicos
Teniendo en cuenta el estado sanitario de los individuos capturados, los valores hematológicos pueden ser utilizados como referencia para evaluar el estado de salud de estos y para realizar comparaciones con valores reportados por otras investigaciones. Los parámetros hematológicos analizados se encontraron dentro del rango obtenido para otras poblaciones previamente estudiadas aunque con algunas variantes. Los valores medios de eritrocitos fueron semejantes a los reportados por otros autores para la especie (Lopes et al., 1988; Dragui, 1993; Arouca et al., 2000), pero inferiores a los encontrados por Etzel (1931) y FAO (2007). Los valores de hemoglobina hallados resultaron inferiores a los encontrados por Arouca et al. (2000) y FAO (2007). El valor medio de hematocrito también resultó inferior al hallado por Arouca et al. (2000), FAO (2007) y Wendt et al. (2007), aunque similar al encontrado por Dragui (1993). Según diversos autores, los niveles de infestación parasitaria por estrongilos digestivos se correlacionan negativamente con los valores de eritrocitos, hematocrito y hemoglobina (Mandonnet, 1995; Morales et al., 2001), constituyendo estos parámetros, buenos indicadores de la presencia de parásitos hematófagos. En nuestro caso, la prevalencia obtenida de 100% para V. hydrochoeri podría estar relacionada con los valores hematológicos hallados. Infestaciones parasitarias similares fueron citadas para otras poblaciones que mantuvieron valores de eritrocitos y hemoglobina cercanos a los normales, lo que podría reflejar una menor adaptabilidad de las poblaciones de nuestro estudio al medio ambiente (FAO, 2007) donde se hallan sometidos a las descriptas condiciones de estrés.
Las cargas parasitarias altas (tanto externas como internas) asociadas a las infecciones bacterianas secundarias halladas en este trabajo se relacionan con los altos recuentos leucocitarios obtenidos. Si bien los valores medios de neutrófilos fueron inferiores a los reportados por Arouca et al. (2000) y Wendt et al. (2007), los porcentajes de eosinófilos fueron similares a los de FAO (2007) y Wendt et al. (2007) y superiores a los de Arouca et al. (2000). Los valores elevados de eosinófilos se relacionan con la prevalencia del 100% de infecciones parasitarias (Cohen y Warren, 1982), asociado a infecciones dérmicas secundarias. Los valores medios de linfocitos, basófilos y monocitos fueron similares a los de Wendt et al. (2007) y a los de Arouca et al. (2000). La monocitosis podría estar reflejando infecciones generales e incluso podría asociarse a infecciones por cestodos (Gretillat, 1976). Teniendo en cuenta la importancia del papel de los linfocitos cuando se desarrolla una infección, los valores obtenidos se corresponderían con la alta prevalencia de endoparásitos intestinales encontrada en este trabajo.
A modo de síntesis, la condición corporal y los resultados parasitológicos indicarían que estas altas densidades tendrían un costo importante en el estado sanitario de la población, favoreciendo las transmisiones parasitarias, aumentando la prevalencia y regulando de esta forma la estructura de edades, siendo los jóvenes los más vulnerables. Las altas cargas de ectoparásitos halladas durante este estudio y la mortalidad asociada a posibles infecciones secundarias podrían convertir a las enfermedades en importantes moduladores de las poblaciones de carpinchos, especialmente enáreas protegidas.
Estos ambientes acuáticos artificiales relacionados a las actividades productivas de la zona estarían creando nuevos nichos para la especie en sectores donde normalmente sería poco abundante o no estaría presente. En base a los resultados de este trabajo, se podría inferir, además, que al igual que sucede con otras especies de hábitos similares como el M. coypus, el tipo de cuerpo de agua podría ser determinante en la abundancia, distribución y estructura social de la especie (Guichón et al., 2003) como así también en su estado sanitario.
AGRADECIMIENTOS
A las autoridades de la Reserva Iberá. A los guardareservas de CLT Pascual Pérez y Ariel Ocampo, y a Sebastián Cirignoli como responsable del personal del Socorro. A los veterinarios Javier Fernández y Virginia Rago, y a la coordinadora del Proyecto de Conservación en los Esteros del Iberá de CLT Lic. Sofia Heinonen.
LITERATURA CITADA
1. ALHO CJR y NL RONDON. 1987. Habitats, population densities, and social structure of capybaras (Hydrochaeris hydrochaeris, Rodentia) in the Pantanal, Brazil. Revista Brasileira de Zoologia 4:139-149. [ Links ]
2. ALLEKOTTE R. 2003. La cría del carpincho. Ediciones INTA, Buenos Aires. [ Links ]
3. ALVAREZ BB. 2003. Fauna del Iberá. Editorial de la Universidad Nacional del Nordeste, Talleres Gráficos Volpe/Fox, Buenos Aires, Argentina. [ Links ]
4. ANDERSON RM. 1979. Parasite pathogenicity and the depression of host population equilibria. Nature 279:150-152. [ Links ]
5. AROUCA ME, LB MIRANDA, RS LOPES, RK TAKAHIRA, A KOHAYAGAWA, PC CIARLINI y E OBA. 2000. Valores hematológicos de capivaras (Hydrochoerus hydrochaeris) criadas em cativeiro no município de Botucatu SP. Ciência Rural 30:813-817. [ Links ]
6. BAILEY JA. 1968. A weight-length relationship for evaluating physical condition of cottontails. Journal of Wildlife Management 32:835-841. [ Links ]
7. BALCOM BJ y RH YAHNER. 1996. Microhabitat and landscape characteristics associated with the threatened allegheny woodrat. Conservation Biology 10:515-525. [ Links ]
8. BELL LM, LB HAYLES y AB CHANDA. 1977. Serological evidence of Brucella melitensis infection in goats and eland in Zambia. Veterinary Record 101(15):305. [ Links ]
9. BELLO A, P MOGOLLON, PM VILLEGAS, R LASERNA y G GOMEZ. 1974. La brucelosis en animales salvajes: el chigüire (H.h.) Veterinaria Tropical 1:117-128. [ Links ]
10. BOERO JJ. 1957. Las garrapatas de la República Argentina (Acarina: Ixodoidea). Eudeba, Buenos Aires, Argentina. [ Links ]
11. BOLKOVIC ML, RD QUINTANA, D RAMADORI, M ELISETCH y J RABINOVICH. 2006. Proyecto Carpincho. Pp 105-119, en: Manejo de fauna silvestre en la Argentina. Programas de uso sustentable. (ML Bolkovic y D Ramadori, eds.). Dirección de Fauna Silvestre, Secretaría de Ambiente y Desarrollo Sustentable. Buenos Aires, Argentina. [ Links ]
12. CAMPO ASSEN Y, G PLANAS-GIRON y E YEPEZ. 1981. Patología dermoepidérmica producida por la presencia de acarinos en la piel del chigüire en Venezuela. Acta Científica Venezolana 32:448-450. [ Links ]
13. CAMPO ASSEN Y, ML EBERHARD y TC ORIHEL. 1985. Survey for filariasis in Venezuelan capybaras. Archivos del Hospital Vargas XXVII:61-67. [ Links ]
14. CAMPOS KRAUER JM. 2009. Landscape ecology of the capybara (Hydrochoerus hydrochaeris) in the Chaco Region of Paraguay. PhD Tesis, Kansas State University, USA. [ Links ]
15. CARNEVALI R. 2003. El Iberá y su entorno fitogeográfico. Ed. EUDENE-UNNE, Corrientes, Argentina. [ Links ]
16. CASAS MC, LM ZALLES, MJ PATRICKy M DAILEY. 1995. Intestinal helminths of capybara (Hydrochaeris hydrochaeris) from Bolivia. Journal of the Helminthological Society of Washington 62:87-88. [ Links ]
17. COHEN S y KS WARREN. 1982. Immunology of parasitic infections. Blackwell Scientific, Oxford, UK. [ Links ]
18. CORDEIRO F, CR SULZER y AA RAMOS. 1981. Leptospira interrogans in several wildlife species in Southeast Brazil. Pesquisa Veterinária Brasileira 1:19-29. [ Links ]
19. CORRIALE MJ. 2004. Evaluación del estado poblacional y patrón de uso de hábitat del coipo (Myocastor coypus) en humedales urbanos. Tesis de Licenciatura, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina. [ Links ]
20. CORRIALE MJ, SM ARIAS, RF BÓ y G PORINI. 2006. Habitat-use patterns of the coypu Myocastor coypus in an urban wetland of its original distribution. Acta Teriologica 51:295-302. [ Links ]
21. CORRIALE MJ, SM ARIAS, RF BÓ y G PORINI. 2008 A methodology for indirect estimation of the Myocastor coypus abundance at an urban wetland in Argentina. Current Zoology 54:164-168 [ Links ]
22. CORRIALE MJ. 2010. Uso de hábitat de Hydrochoerus hydrochaeris en los Esteros del Iberá (Corrientes, Argentina). Tesis de doctorado, Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina. [ Links ]
23. CORRIALE MJ, AM MILANO, MA GÓMEZ-MUÑOZ y EA HERRERA. 2011. Prevalence of gastrointestinal parasites in a natural population of capybaras, Hydrochoerus hydrochaeris, in Esteros del Iberá (Argentina). Revista Ibero-Latinoamericana de Parasitología 70:189-196. [ Links ]
24. CORRIALE MJ, E MUSCHETTO y EA HERRERA. 2013. Influence of group sizes and food resources on seasonal variation in home range sizes of capybaras (Hydrochoerus hydrochaeris) from Esteros del Iberá, Argentina. Journal of Mammalogy 94:19-28. [ Links ]
25. COSTA CAF y JB CATTO. 1994. Helmintos parasitos de capivaras (Hydrochaeris hydrochaeris) na sub-região da Nhecolândia, Pantanal-sul-matogrossense. Revista Brasileira de Biologia 51:39-48. [ Links ]
26. CÓZAR A, C GARCÍA, JA GÁLVEZ, S LOISELLE, L BRACCHINI y A COGNETTA. 2005. Remote sensing imagery analysis of the lacustrine system of Ibera wetland (Argentina). Ecological Modelling 186:29-41. [ Links ]
27. CUEVA EA, HG RIVERA, PN SÁNCHEZ y MV RAMÍREZ. 2010. Incidencia de infección por Leptospira sp. en ronsocos (Hydrochoerus hydrochaeris) en cautiverio en un zoocriadero de Iquitos. Revista de Investigaciones Veterinarias del Perú 21:106-112. [ Links ]
28. DARWIN C. 1859. On the origin of species by means of natural selection. John Murray, London, UK. [ Links ]
29. DRAGHI MG. 1993. Importancia del carpincho (Hydrochoerus hydrochaeris) como reservorio de enfermedades de interés económico y zoonóticas. Série Técnica Nº 27. INTA. Estación Experimental Agropecuaria Mercedes, Corrientes, Argentina. [ Links ]
30. EBENSPERGER LA. 2003. Restricciones fisiológicas y evolución de la sociabilidad en roedores. Pp. 463-480, en: Fisiología Ecológica & Evolutiva (F Bozinovic, ed.). Ediciones Universidad Católica de Chile, Santiago, Chile. [ Links ]
31. ELMASIAN M y E MIGNONE. 1904. Mal de caderas chez les animaux domestiques et sauvages (Epidemies Paralleles). Annales de l'Institut Pasteur 18:587-589. [ Links ]
32. ESTRADA PEÑA A, JM VENZAL y AA GUGLIELMONE. 2002. Amblyomma dubitatum Neumann: description of nymph and redescription of adults, together with the description of the immature stages of A. triste Koch. Acarologia 42:323-333. [ Links ]
33. ETZEL E. 1931. Morfologia dos elementos do sangue circulante dos cavídeos silvestres. Tesis de doctorado, inédita, Faculdade de Medicina, São Paulo, Brazil. [ Links ]
34. FAGONDE CA y J BATISTA. 1994. Helmintos parasitos de capivaras (Hydrochaeris hydrochaeris) na sub-região da Nhecolândia, Pantanal Sul-Mato-Grossense. Revista Brasileira de Biologia 54:39-48. [ Links ]
35. FAIN A. 1968. Étude de la variabilit é de Sarcoptes scabiei avec une revision des Sarcoptidae. Acta zoologica et pathologica antverpiensia 47:1-196. [ Links ]
36. FAO. 2007. El capibara o carpincho (Hydrochoerus hydrochaeris), estado actual de su producción. FAO, Sitio de Producción Animal. Departamento de Agricultura. www.produccion-animal.com.ar. [ Links ]
37. GIRIO RJS, FLG PEREIRA, M MARCHIORI FILHO, LA MATHIAS, RCP HERREIRA, AC ALESSI y TMS GIRIO. 2004. Pesquisa de anticorpos contra Leptospiras spp. em animais silvestres e em estado feral da região de Nhecolândia, Mato Grosso do Sul, Brasil. Utilização da técnica de imuno-histoquímica para detecção do agente. Ciência Rural 34:165-169. [ Links ]
38. GODOY M. 1973. El chigüire. Posible reservorio de la brucelosis. Trabajo de ascenso, inédito, Facultad de Ciencias Veterinarias. Universidad del Zulia, Maracaibo, Venezuela. [ Links ]
39. GRETILLAT S. 1976. Variation in the blood picture of the red Maradi goat as anfunction of its gastrointestinal parasitism. Acta Tropica 33:240-245. [ Links ]
40. GUGLIELMONE AA y AE VIÑABAL. 1994. Claves morfológicas dicotómicas e información ecológica para la identificación de garrapatas del genero Amblyomma Koch 1844 de la Argentina. Revista de Investigaciones Agropecuarias 25:39-67. [ Links ]
41. GUGLIELMONE AA, A ESTRADAPEÑA, JE KEIRANS y RG ROBBINS. 2004. Las garrapatas (Acari. Ixodida) de la región zoogeográfica neotropical. Instituto Nacional de Tecnología Agropecuaria (INTA), Buenos Aires, Argentina. [ Links ]
42. GUICHÓN ML, CP DONCASTER y MH CASSINI. 2003. Population structure of coypus (Myocastor coypus) in their region of origin and comparison with introduced populations. Journal of Zoology 261:265-272. [ Links ]
43. GUTIERREZ RO. 1958. El mal de caderas de los equinos. Revista de Investigaciones ganaderas 4:177. [ Links ]
44. HERRERA EA y DW MACDONALD. 1987. Group stability and the structure of a capybara population. Symposia of the Zoological Society of London 58:115-130. [ Links ]
45. HERRERA EA y DW MACDONALD. 1989. Resource utilization and territoriality in group living capybaras. Journal of Animal Ecology 58:667-679. [ Links ]
46. HERRERA EA, V SALAS, ER CONGDON, MJ CORRIALE y Z TANG-MARTINEZ. 2011. Capybara social structure and dispersal patterns: Variations on a theme. Journal of Mammalogy 92:12-20. [ Links ]
47. HOLMES JC. 1996. Parasites as threats to biodiversity in shrinking ecosystems. Biodiversity Conservation 5:975-983. [ Links ]
48. ITO FH, SA VASCONCELLOS, F BERNARDI, AA NASCIMENTO, MB LABRUNA y IG ARANTES. 1998. Evidência sorológica de brucelose e leptospirose e parasitismo por ixodídeos em animais silvestres do pantanal sul-mato-grossense. ARS Veterinária 14:302-310. [ Links ]
49. KRANTZ GW. 1978. A manual of Acarology. Book Stores Inc. Oregon State University. Oregon, USA. [ Links ]
50. LEIGHTON FA y T KUIKEN. 2001. Leptospirosis. Pp. 498-502, en: Infectious diseases of wild mammals. (ES Williams y IK Barker, eds.). Iowa State Press. Iowa State, USA. [ Links ]
51. LOPES RS, JM SILVEIRA, KG CASTRO y GS ABDO. 1988. Valores sangüíneos de capivaras (Hydrochoerus hydrochaeris) criadas em semi-cativeiro no Mato Grosso do Sul. Revista Brasileira de Medicina Veterinária 10:6-8. [ Links ]
52. LORD VR y RC FLORES. 1983. Brucella spp. From the capybara (Hydrochaeris hydrochaeris) in Venezuela: Serologic studies and metabolic characterization of isolates. Journal of Wildlife Disease 19:308-314. [ Links ]
53. MANDONNET N. 1995. Analyse de la variabilité génétique de la résistance aux strongles gastrointestinaux chez les petits ruminants. Elements pour la définition d'objetifs et de critéres de sélection en milieu tempere ou tropical. Tesis de Doctorado en Ciencias. Universidad de Paris XI . Orsay, France. [ Links ]
54. MAYAUDON H. 1980. Sobre una colección de helmintos del chigüire. Revista de la Facultad de Ciencias Veterinarias, UCV 28:19-47. [ Links ]
55. MCDONOUGH L. 2001. Leptospirosis en caninos: estado actual. Department of Population Medicine and Diagnostic Science, Diagnostic Laboratory, College of Veterinary Medicine, Cornell University, Ithaca, New York, USA. http://www.ivis.org/advances/Infect_Dis_Carmichael/mcdonough_es/chapter_frm.asp?LA=2. [ Links ]
56. MONES A y J OJASTI. 1986. Hydrochoerus hydrochaeris. Mammalian Species 264:1-7. [ Links ]
57. MORALES G, L PINO, E SANDOVAL y L MORENO. 2001. Gastrointestinal nematode infection in ewes raised in an arid zone of Venezuela. Parasitología al Día 25:36-39 [ Links ]
58. MORENO LG, R LORD, G MORALES, LA PINO y C BALESTRINI. 1999. Parasitismo gastrointestinal de Hydrochoerus hydrochaeris en un hato del Estado de Apure, Venezuela. Veterinaria Tropical 24:85-91. [ Links ]
59. NEIFF JJ. 2004. El Iberá...¿en peligro? Fundación Vida Silvestre Argentina. 1ra Edición, Buenos Aires, Argentina. [ Links ]
60. NOGUEIRA MF, H LANGONI, A LAVORENTI, SM GIMENES y SLG NOGUEIRA FILHO. 1997. Detecção de anticorpos anti-Leptospira spp. e anti Brucella abortus em capivaras (Hydrochaeris hydrochaeris), en: Libro de resúmenes, Anais do XIX Congresso Brasileiro de Microbiologia, Rio de Janeiro, Brazil. [ Links ]
61. NUÑEZ VLB, ET OSHIRO, MEC DORVAL, LAM GARCIA, AAP SILVA y AR BOGLIOLO. 1993. Investigação epidemiológica sobre Trypanosoma (Trypanozoon) evansi no pantanal sul-mato-grossense. Estudo de reservatórios. Revista Brasileira de Parasitología Veterinaria 2:41-44. [ Links ]
62. ODRIOZOLA E. 2003. Leptospirosis y su relación con el anegamiento. Carta Agropecuaria, San Isidro, Bs.As. 39:7. www.produccion-animal.com.ar [ Links ]
63. OJASTI J. 2011. Estudio biológico del chigüire o capibara. Equinoccio, Universidad Simón Bolívar-Academia de Ciencias físicas Matemáticas y Naturales, Caracas, Venezuela. [ Links ]
64. ORTIZ MI y AD RIZZELLO. 2004. Prevalencia de parásitos intestinales en poblaciones de Hydrochaeris hydrochaeris (Linneaeus, 1766) de la laguna Ibera, provincia de Corrientes. Estado de Avance Universidad del Nordeste. Comunicaciones Científicas y Tecnológicas, http://www.unne.edu.ar/Web/cyt/com2004/4-Veterinaria/V-036.pdf. [ Links ]
65. PATZ JA, P DASZAK, GM TABOR, AA AGUIRRE, M PEARL, J EPSTEIN, ND WOLFE, AM KILPATRICK, J FOUFOPOULOS, D MOLYNEUX y DJ BRADLEY. 2004. Unhealthy landscapes: Policy recommendations on land use change and infectious disease emergence. Environmental health perspectives 112:1092-1098. [ Links ]
66. PENCE DB, CASTO SD y WM SAMUEL. 1975. Variation in the chaetotaxy and denticulation of Sarcoptes scabiei (Acarina: Sarcoptidae) from wild canids. Acarologia 17:160-165 [ Links ]
67. PENCE DB y E UECKERMANN. 2002. Sarcoptic mange in wildlife. Revue scientifique et technique/ Ofice international des épizooties 21:385-398. [ Links ]
68. PLATA V. 1972. Informe sobre un muestreo serológico en chigüires del hato El Frío, Informe Anual. Proyecto CONICIT DF 030-S1, Apure, Venezuela. [ Links ]
69. RIBEIRO SMB. 2002. Helmintos do sistema digestivo de Hydrochaeris hydrochaeris (Linnaeus, 1766) criadas em sistema semi intensivo no município de Santo Antônio da Patrulha, Rio Grande do Sul, Brasil. MSc Tesis, Universidade Federal do Rio Grande do Sul, Porto Alegre, Rio Grande do Sul, Brazil. [ Links ]
70. RIVIERA MA. 1983. Sarna sarcóptica en Chigüires. Revista de la Facultad de Ciencias Veterinarias U.C.V. 30:99-115. [ Links ]
71. SALAS V y EA HERRERA. 2004. Intestinal helminths of capybaras, Hydrochoerus hydrochaeris from Venezuela. Memórias do Instituto Oswaldo Cruz 99:563-566. [ Links ]
72. SCOTT ME. 1988. The impact of infection and disease on animal populations: implications for conservation biology. Conservation Biology 2:40-56. [ Links ]
73. SHIMABUKURO JS. 2006. Estudo da soroprevalência de Leptospira spp. em capivaras (Hydrochaerishydrochaeris) na bacia hidrográfica do Alto Tietê, SP. Dissertação de Mestrado em Epidemiologia Experimental Aplicada às Zoonoses, USP, São Paulo, Brazil. [ Links ]
74. SILVA EF, N SEYFFERT, SDD JOUGLARD, DA ATHANAZIO, AO DELLAGOSTIN y CS BROD. 2009. Seroprevalence of leptospiral infection in capybaras (Hydrochoerus hydrochaeris) in a slaughterhouse of Rio Grande do Sul, Brazil. Pesquisa Veterinária Brasileira 29:174-176. [ Links ]
75. SINKOC AL, G MÜLLER, JGW BRUM, A BEGROW y C DELEVATTI. 1995. Helmintos parasitos de capivaras (Hydrochoerus hydrochaeris) na Estação Ecológica do Taim, Rio Grande, en: Libro de resúmenes, 19thCongresso Brasileiro da Sociedade de Zoológicos do Brasil, Foz do Iguaçu, Brazil. [ Links ]
76. SINKOC AL, FA BRUM, G MÜLLER y JGW BRUM. 2004. Helmintos parasitos de capivara (Hydrochoerus hydrochaeris L. 1766) na região de Araçatuba, São Paulo. Arquivos do Instituto Biologico 71:329-333. [ Links ]
77. SINKOC AL, JG BRUM y G MULLER G. 2009. Gastrintestinal helminths of capybara (Hydrochoerus hydrochaeris, Linnaeus, 1766) in cattle breeding farm in the area of the Ecological Reserve of Taim, Rio Grande. Brazilian Archives of Biology and Technology 52:327-333. [ Links ]
78. SOINI P. 1993. Estudio de la dinámica poblacional del ronsoco o capibara (H. hydrochaeris) en el río Pacaya, Perú. Folia Amazónica 5:137-154. [ Links ]
79. SOSA BURGOS L. 1981. Comportamiento social del chigüire en relación con su manejo en cautiverio. Tesis de licenciatura, inédita, Facultad de Ciencias U.C.V. Venezuela. [ Links ]
80. SOTO-GAMBOA M. 2003. Endocrinología y ecología conductual: mecanismos proximales que explican patrones conductuales, Pp. 443-460, en: Fisiología ecológica y evolutiva (F Bozinovic, ed.). Ediciones Universidad Católica de Chile, Santiago, Chile. [ Links ]
81. SOULSBY E., 1987. Parasitología y enfermedades parasitarias en los animales domésticos. 7ma edición, Nueva Editorial Interamericana, México. [ Links ]
82. TER BRAAK CJF. 1987a. The analysis of vegetation-environment relationship by canonical correspondence analysis. Vegetation 69:69-77. [ Links ]
83. TER BRAAK CJF. 1987b. CANOCO- a for-TRAN program for canonical community ordination by (partial) (detrended) (canonical) correspondence analysis, principal components analysis, and redundancy analysis (version 2.1). ITI-TNO, Wageningen, The Netherlands. [ Links ]
84. WENDT LW, E KRAUSE, K PAUL, JL RUAS, MS PINHEIRO, T GALLINA y NAR FARIAS. 2007.Valores hematológicos encontrados em capivaras (Hydrochaeris hydrochaeris, Linnaeu, 1766) criadas em sistema semiintensivo na região sul do Rio Grande do Sul, en: Libro de resúmenes, XVI Congresso de Iniciação científica da Universidade Federal de Pelotas, Brazil. [ Links ]
85. WILLNER GR, JA CHAPMAN y D PURSLEY. 1979. Reproduction, physiological responses, food habitats, and abundance of nutria on Maryland marshes. Wildlife Monographs 65:1-43. [ Links ]
86. WISNIVESKY C. 2003. Ecología y epidemiología de las infecciones parasitarias. Editorial Libro Universitario Regional, Costa Rica. [ Links ]
87. ZAR JH. 1996. Biostatistical analysis. Tird edition, Upper Saddle River, Prentice-Hall, Inc., New Jersey, USA. [ Links ]
88. ZURBRINGEN MA, A HONSA, D ROCHINOTTI y MG DRAGHI. 1984. Sarna sarcóptica en carpinchos. Veterinaria Argentina 1:245-248. [ Links ]














