Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.21 no.2 Mendoza dic. 2014
ARTÍCULO
Variación estacional de la tasa metabólica de reposo en Ctenomys talarum (Rodentia, Ctenomyidae): ausencia de efectos ambientales
Facundo R. Meroi A.1, 2, Facundo Luna3 y Daniel Antenucci3
1 CICTERRA-CONICET, Universidad Nacional de Córdoba, Av. Vélez Sarsfield 1611, Ciudad Universitaria, 5016 Córdoba, Argentina [correspondencia: <facundomeroi@hotmail.com>].
2 Centro de Investigaciones Paleobiológicas (CIPAL), FCEFyN-UNC, Universidad Nacional de Córdoba, Av. Vélez Sarfield 299, 5000 Córdoba, Argentina.
3 Laboratorio de Ecología Fisiológica y del Comportamiento, Instituto de Investigaciones Marinas y Costeras (IIMyC-CONICET), Universidad Nacional de Mar del Plata, Funes 3250, 7600 Mar del Plata, Buenos Aires, Argentina.
Recibido 3 abril 2014.
Aceptado 25 julio 2014.
Editor asociado: F Bozinovic
RESUMEN.
El género Ctenomys, roedores subterráneos endémicos de América del Sur, es un excelente modelo para evaluar la influencia de diversos factores sobre el metabolismo energético, en particular sobre la tasa metabólica de reposo (TMR). El hábitat subterráneo se caracteriza por poseer un ambiente térmico estable, que minimiza el gasto en termorregulación en estaciones frías, pero, por otra parte, presenta vías limitadas para la disipación de calor durante estaciones cálidas, debido a la alta humedad y baja convección que presenta. Además, el ambiente subterráneo es hipercápnico e hipóxico. Ctenomys talarum ocupa dunas costeras vegetadas en el sudeste de la provincia de Buenos Aires, es herbívoro y presenta la particularidad de forrajear en superficie, en las cercanías de las bocas de los sistemas de túneles, por lo cual los individuos no se encuentran completamente aislados de las variaciones térmicas presentes en superficie. El principal objetivo de este trabajo consistió en evaluar si la TMR en C. talarum presenta variaciones a corto, mediano y largo plazo en un período anual, en función de factores abióticos (precipitación, temperatura ambiente, cautiverio) y disponibilidad de alimento. No se observaron variaciones a corto, mediano y largo plazo en la TMR. La estabilidad microambiental de las cuevas, la respuesta a cambios estacionales con modificaciones en la conductancia térmica y las estrategias comportamentales destinadas a la conservación de calor podrían ser responsables de la estabilidad observada en la TMR.
ABSTRACT.
Seasonal variation of resting metabolic rate in Ctenomys talarum (Rodentia, Ctenomyidae): Absence of environmental effects.
Ctenomys is an endemic subterranean rodent from South America, and it represents an excellent model to evaluate the effect of different factors on energy metabolism, particularly, resting metabolic rate (RMR). Its subterranean micro-environment is characterized as thermically stable, but not convective, humid, hipercapnic and hypoxic. So the capacity to dissipate heat during the hot season is further reduced. Ctenomys talarum occupies coastal grasslands dunes in the southeast of Buenos Aires province; feeds on plants located near the borrow system entrances. Therefore, they are exposed to thermal variations on the surface. This study aims to determine how RMR varies during short, medium, and long term time periods during an annual cycle in relation to abiotic (rainfall, ambient temperature, captivity) and food availability. RMR did not vary between seasons or in a year cycle. The micro-environmental stability inside burrows, the seasonal changes in the thermal conductance and behavioural strategies destined to face thermal challenges, could be signalled as responsible for RMR stability.
Palabras clave: Ctenomys; Energética; Tasa metabólica.
Key words: Ctenomys; Energetics; Metabolic rate.
INTRODUCCIÓN
El gasto y las transformaciones de energía juegan un papel central en la conducta, fisiología y ecología de los organismos (McNab, 2002). Por ello, diferentes estudios han tratado de comprender cuáles son los factores intrínsecos y extrínsecos que limitan el presupuesto energético de un individuo (véase Cruz-Neto et al., 2003). En endotermos, una de las variables más utilizadas y representativas del gasto energético mínimo para sostener la homeostasis es la tasa metabólica basal (TMB). La TMB representa una medida estandarizada y comparativa de las demandas energéticas de los individuos (McNab, 2002), siendo la masa corporal uno de los principales factores, a nivel interespecífico, que influyen sobre la misma (Kleiber, 1932). Sin embargo, no toda la variación en la TMB puede ser explicada por cambios en la masa corporal.
La variación residual de la TMB se ha atribuido a diversos factores, entre otros, la dieta (McNab, 1986), el clima (Lovegrove, 2003; Rezende et al., 2004; Withers et al., 2006), latitud (Lovegrove, 2003), filiaciones taxonómicas (Elgar y Harvey, 1987), patrones zoogeográficos (Lovegrove, 2000), así como a los límites entre sopor e hibernación (Geiser y Ruf, 1995). En ambientes que sufren variaciones estacionales, la habilidad de cambiar o modificar el fenotipo en respuesta a factores externos es crucial (Piersma y van Gils, 2011). Si bien no es una respuesta universal, se reconoce que es beneficioso para un organismo, en términos energéticos, poseer la capacidad de disminuir la TMB en períodos de elevadas temperaturas, ya que permite evitar el sobrecalentamiento y la pérdida de agua, sobre todo en especies que no consumen agua libre (Rezende et al., 2003); del mismo modo, en períodos donde la disponibilidad o calidad del alimento disminuye (Cruz-Neto y Bozinovic, 2004; Perissinotti et al., 2009). Por el contrario, se observa un aumento en la TMB ante valores bajos de temperatura ambiente (Ta), lo cual puede interpretarse como una respuesta plástica de algunos órganos, por mayor demanda energética debido al aumento del gasto en termorregulación (Rezende et al., 2003). Por ello, en mamíferos que permanecen activos durante el invierno, la supervivencia depende de la capacidad para tolerar bajas temperaturas mediante un incremento en el aislamiento térmico o de la TMB (Corp et al., 1997).
Por otro lado, la TMB no solo presenta variaciones estacionales asociadas a mecanismos de aclimatización (Speakman, 2000), sino que puede ser variable dentro de un período de tiempo corto. La presencia de ritmos endógenos diarios les permite a los organismos mantener la homeostasis, ante eventos circadianos del ambiente (Marques et al., 1997). En tal sentido, en roedores de superficie se ha observado que las variaciones diarias en la TMB o la temperatura corporal (Tc) están relacionadas con las variaciones diarias de Ta (McNab, 2002). Por otro lado, animales mantenidos en laboratorio, como roedores expuestos a fotoperíodos cortos y a Ta constante, han evidenciado un mayor grado de tolerancia a bajas temperaturas (Haim y Levi, 1990; Haim et al., 1994, 1995); este mismo resultado se observa en roedores expuestos a aclimatización previa a temperaturas ambiente bajas (Wunder et al., 1977).
Un grupo de mamíferos que resulta un modelo único para el estudio de las variaciones en los parámetros energéticos son los roedores subterráneos. Se ha propuesto que en respuesta a este ambiente tan particular en el que habitan, los roedores subterráneos presentan una convergencia fisiológica adaptativa, que consiste en una baja TMB, una baja Tc y altos valores de conductancia térmica, comparados con representantes del mismo orden que habitan en superficie (McNab, 1966; Vleck, 1979).
Ctenomys es un género de roedores subterráneos endémicos de América del Sur (Woods 1984; Reig et al., 1990). A diferencia de algunas formas estrictamente subterráneas (Nevo, 1999), las especies de Ctenomys presentan un uso extensivo de la superficie, ya que salen de sus cuevas para colectar partes aéreas de plantas en su cercanía, exponiéndose a variaciones climáticas externas. En particular, se ha observado que la exposición en superficie es importante en C. knighti, con permanencia fuera de la cueva un tiempo considerable para recolectar alimento o remover el sustrato de los túneles, manteniendo este tipo de actividad en condiciones de laboratorio (Tomotani et al., 2012).
Ctenomys talarum Thomas, 1898 es un representante del género de pequeño tamaño que habita en sistemas de galerías cerradas y paralelas a la superficie del suelo, en dunas costeras vegetadas de la provincia de Buenos Aires (Antinuchi y Busch, 1992). Los individuos de esta especie son herbívoros, consumen preferentemente partes aéreas de plantas que recolectan en las cercanías de la boca de la cueva (Comparatore et al., 1995), pero acceden a nuevos parches de vegetación a través de la construcción de nuevos túneles (Luna et al., 2002; Luna y Antinuchi, 2007a; Schleich y Zenuto, 2007). Se han llevado a cabo numerosos estudios sobre la energética de C. talarum (véase Antinuchi et al., 2007), en particular, evaluando el efecto de la aclimatación a dietas de baja calidad (Perissinotti et al., 2009) o de la temperatura ambiente (Luna et al., 2012) sobre la TMB. Estos estudios mostraron que la TMB puede ser afectada de manera diferencial de acuerdo al factor de aclimatación utilizado. En cautiverio, la TMB es afectada por dietas de baja calidad, pero no por la temperatura (Perissinotti et al., 2009; Luna et al., 2012). En tal sentido, la combinación de estos factores en condiciones naturales puede tener implicancias en el metabolismo energético de la especie, no solo directamente sobre la TMB, sino a través de características ambientales correlacionadas, como la calidad y disponibilidad de alimento (véase Bozinovic y Sabat, 2010).
El objetivo de este trabajo fue evaluar la variación estacional del metabolismo energético mínimo en C. talarum. Asimismo, determinar su variación diaria y luego de su aclimatación a condiciones estables de laboratorio en cautiverio. En tal sentido, se espera que existan variaciones estacionales en el metabolismo mínimo, como respuesta compensatoria a variaciones en factores climáticos y ambientales, como son la temperatura ambiental, la composición del sustrato y la disponibilidad de alimento. Por otro lado, dado que los individuos de C. talarum no presentan patrones rítmicos de actividad (Luna et al., 2000), se espera que la tasa metabólica de reposo, que se utilizará como estimador de la TMB, no presente variaciones circadianas vinculada a ritmos endógenos y, además, que tampoco varíe luego del período de aclimatación.
MATERIALES Y MÉTODOS
Captura y mantenimiento de los animales
Se capturaron 48 individuos adultos, 6 machos y 6 hembras para cada una de las 4 estaciones del año, en la localidad de Mar de Cobo (37º 45' S, 57º 56' O, provincia de Buenos Aires, Argentina), mediante trampas de captura viva. Los animales fueron trasladados al bioterio y dispuestos en cajas (0.3 x 0.4 x 0.25 m) individuales con cama de viruta. Se les suministró alimento ad libitum que consistió en zanahoria, batata, alfalfa y semillas de girasol. Debido a que C. talarum no ingiere agua libre, la misma fue provista a través del suministro de lechuga fresca (Zenuto et al., 2001). El bioterio se mantuvo bajo condiciones controladas de fotoperíodo (12:12 L:O) y Ta (entre 19 y 25 ºC).
Estimación del consumo de oxígeno
Todas las estimaciones de consumo de oxígeno (O2) fueron realizadas utilizando un respirómetro de circuito abierto de presión positiva (Sable System, Las Vegas). Brevemente, la cámara de medición constó de una doble pared de aluminio, con poliuretano entre ambas, con cierre mediante una tapa de acrílico transparente de 20 mm de espesor, con la finalidad de observar regularmente a los individuos. El intercambio de calor con el exterior de la cámara se realizó de manera automática, mediante 2 intercambiadores (Melcor, modelo CP-1.4-127- 06l). La cámara de medición fue conectada a un ordenador personal y controlada vía software. La Ta dentro de la cámara fue mantenida a 25 ºC, con una precisión de 0.1 °C (zona de termoneutralidad de esta especie; Busch, 1989). La cámara de un volumen de ~5 L recibió un flujo de aire a una tasa de 1.5 L min-1 de un controlador de flujo de masa (Sierra Instruments, Monterrey); esta tasa resultó suficiente para equilibrar la cámara de medición en un 95% en ~10 min (Lasiewski et al., 1966). El aire circuló a través de absorbente de CO2 (IQB®) y de agua (Silica Gel) antes y después de pasar por la cámara. El aire excurrente fue muestreado a una tasa de 150 ± 10 ml min-1 y el consumo del O2 se calculó con un analizador (FC-1B), cada 1 segundo, mediante el programa Datacan V (Sable System, Las Vegas). La línea de base del analizador se estableció en 20.95% de O2 al comienzo de cada medición. Una vez finalizado el registro de consumo, se estimó la Tc mediante una sonda YSI, insertada 2 centímetros en el recto del individuo y conectada a un termómetro digital (Cole-Parmer modelo 8402-10). En todos los casos, el consumo de O2 fue calculado mediante la ecuación 4a de Withers (1977). Para evitar la posible variación de la medición de O2 por efecto del agua eliminada mediante la orina, cuando se analizaron los consumos de O2 diarios, se colocó dentro de la cámara un recipiente plástico con vaselina líquida en su interior y una malla metálica revestido de forma tal que el animal no entrara en contacto con la vaselina y que la fase acuosa de la orina quedara debajo de la misma.
Se realizaron 2 experimentos para determinar si existe un patrón de variación estacional o diaria en el consumo de O2 mínimo. En todos los casos el consumo de O2 mínimo fue considerado como la tasa metabólica de reposo (TMR). Para C. talarum esta estimación es considerada una aproximación fiable de la TMB (Perissinotti et al., 2009). Además, se realizó un estudio complementario para determinar el efecto del tiempo de cautiverio sobre la TMR, con el siguiente protocolo: (1), se estimó el consumo de O2 en un período continuo de 24 h; (2), se determinó la TMR en diferentes estaciones del año; (3), se estableció la variación de la TMR en diferentes días de cautiverio en cada una de las estaciones.
Para (1) se establecieron los valores de consumo de O2 en un período de 24 h; durante este intervalo de tiempo se registraron valores promedios de períodos de 5 min, con el fin de evaluar la existencia de patrones circadianos de consumo de O2 entre los individuos. Para evitar cualquier posible alteración de la TMR debida al cautiverio, el análisis de consumo de O2 diario se realizó entre las 24 h y 48 h posteriores a la captura. Para (2) y (3), el consumo de O2 de cada uno de los individuos se estimó como el promedio de 5 min donde el consumo de oxigeno fue mínimo y estable dentro de un período de 2 h. En estudios previos, se ha observado que el tiempo total de experimentación (2 h) es suficiente para obtener mediciones mínimas y estables de consumo de O2 en C. talarum (véase Antinuchi et al., 2007). En todos los casos, los períodos de estabilización de la cámara (~ 10 min) fueron descartados del análisis.
Para el segundo experimento (2), se capturaron individuos en diferentes estaciones de año. En primavera, solo se realizaron mediciones en 6 machos, con el fin de evitar el costo energético por preñez, ya que durante dicha estación la mayoría de las hembras están grávidas. La estimación de la TMR también se llevó a cabo entre las 24 h y 48 h luego de la captura. Finalmente, con los mismos individuos y metodologías para la obtención de datos utilizados en el experimento previo (2), se midió el consumo de O2 a los 10 y 20 días luego de la captura. Este experimento (3) permitió determinar si las capturas y el tiempo de cautiverio tienen efectos sobre la TMR.
Obtención de muestras de sustrato y vegetación
Se tomaron muestras de vegetación y de sustrato en las cercanías de las bocas de los túneles habitados por los animales capturados, para determinar la granulometría, humedad del sustrato y cantidad de alimentos disponible (partes aéreas y subterráneas de plantas). Se obtuvieron 12 muestras de vegetación y 12 de sustrato; las muestras de vegetación fueron colectadas de un círculo de 0.03 m2 y 30 cm de profundidad, en tanto que para el sustrato el círculo fue de 0.002 m2, de igual profundidad, siempre con la boca del túnel como centro del círculo. Las muestras de vegetación fueron separadas en parte aérea (correspondiente al tallo y hojas) y subterránea (correspondiente a las raíces) y pesadas. Posteriormente, se determinó el peso seco colocando las muestras en estufa a 60 °C y pesándolas diariamente hasta alcanzar un valor constante. Para las muestras de suelo, el peso húmedo y peso seco fue determinado siguiendo la metodología previamente descrita. Con el fin de caracterizar la composición del suelo, las muestras -una vez secas- fueron tamizadas con mallas de 2, 1, 0.5 y 0.25 μm en un tamizador automático.
Obtención de datos climáticos
Los datos climáticos para la localidad de colecta de los ejemplares de C. talarum fueron obtenidos del Servicio Meteorológico Nacional de la República Argentina (www.smn.gov.ar). Los parámetros climáticos cuantificados corresponden a cada mes del año en el cual fue realizado este estudio y fueron volumen de precipitaciones, temperatura promedio máxima (Tmax), y temperatura promedio mínima (Tmin).
Estadística
Para determinar si el consumo de O2 mínimo varió durante el día, se evaluó la hipótesis nula de ausencia de diferencias en el consumo de O2 entre períodos de 5 min dentro de un período de 24 h mediante un análisis de ANOVA de medidas repetidas por rangos. Así, si los individuos presentaban patrones circadianos de consumo de O2, se esperaba que los valores mínimos de los períodos de 5 min se encontraran agrupados en un período de tiempo acotado en el día. Para evaluar los valores de TMR dentro de las 24 h de captura (día 1), para cada estación, se realizó un análisis de ANOVA de una vía. Se evaluó la hipótesis nula de la inexistencia de diferencias en la TMR entre estaciones, mediante ANCOVA, al día 1 de captura para cada estación, utilizando como covariante la masa corporal. Para determinar los efectos directos e indirectos de las variables ambientales (temperatura ambiental máxima, temperatura ambiental mínima, precipitación y disponibilidad de alimento) y de la masa corporal sobre la TMR (mLO2 h-1), se realizó un análisis de ecuaciones estructurales. Este tipo de análisis permite la descomposición de la variación encontrada de acuerdo a una hipótesis particular (análisis de vías). Se calcularon los coeficientes estandarizados y sus respectivos errores estándar, de las relaciones entre las variables medidas mediante la estimación de la máxima verosimilitud. Debido al tamaño muestral, realizamos simulación Monte Carlo para evaluar el comportamiento de la muestra y el procedimiento de iteración en diferentes tamaños de la muestra utilizada. Los datos de temperatura corporal fueron evaluados mediante ANOVA, poniendo a prueba la hipótesis nula de la inexistencia de diferencias en la Tc entre el día 1 de cada estación. Dentro de cada estación, los datos de consumo de O2 fueron evaluados mediante análisis de ANCOVA de medidas repetidas, poniendo a prueba la hipótesis nula de la inexistencia de diferencias en la TMR entre los días 1, 10 y 20, usando como covariante la masa corporal. Para evaluar la existencia de variaciones edáficas entre las estaciones se realizó ANOVA de 2 vías, tomando como factores a las estaciones del año y las diferentes categorías de granos obtenidos luego de tamizar la muestra (2, 1, 0.5 y 0,25 μm). Además, en cada estación se estimó el contenido de agua del sustrato y se lo comparó mediante análisis de ANOVA de una vía. La variación de la abundancia de plantas, tanto para la porción aérea como para la subterránea en el área de captura, fue analizada mediante ANOVA de una vía. Los datos de vegetación se transformaron a logaritmo en base diez, previo al análisis estadístico. Para los análisis a posteriori se utilizó el test de Tukey. En todos los análisis se verificaron los supuestos de normalidad y homocedasticidad y se utilizaron pruebas no paramétricas cuando no se cumplieron. Los datos son expresados como la media ± desvío estándar.
RESULTADOS
Consumo de O2 diario
No se observaron diferencias en los promedios de 5 min de consumo de O2 instantáneos, para cada individuo en un periodo de 24 h. (ANOVA de medidas repetidas por rangos, c2 = 266.60, g.l. = 287, P = 0.80). Es decir, no se encuentran patrones circadianos de consumo de O2. Los valores mínimos para los periodos de 5 min encontrados para cada individuo difieren en el horario en el cual fueron obtenidos.
Consumo de O2 mensual y estacional
Se detectaron diferencias en la masa corporal, entre el día 1 de cada estación (ANOVA, F3, 46=3.516, P = 0.025; Tabla 1). El test de Tukey mostró diferencias significativas entre verano y otoño (P = 0.045), así como entre verano y primavera (P = 0.038). No se observaron diferencias en la TMR entre estaciones (ANCOVA, F3, 34 = 0.48; P = 0.70; Fig. 1; Tabla 1). Basado en el valor de probabilidad del test de Chi-cuadrado (c2 = 0.64, g.l. = 1, P = 0.42), el modelo presenta diferencias no significativas con lo esperado en base a la matriz de covarianza. Se observa efecto directo de la precipitación sobre la masa corporal (β = -0.001 ± 0.001, P< 0.001) y de la masa corporal sobre la TMR (β = 0.85 ± 0.15, P < 0.001), sin que hubiera efecto directo (β = 0.001 ± 0.001, P = 0.53) o indirecto -a través de la masa corporal- (β = -0.001 ± 0.001) de la precipitación sobre la TMR. Las demás variables exógenas (Tmax, Tmin, disponibilidad de alimento) no presentan efectos directos o indirectos sobre la TMR (todos, P < 0.11).
Tabla 1. Masa corporal (en gramos), tasa metabólica de reposo (TMR) y temperatura corporal (Tc) en individuos de Ctenomys talarum del sudeste de la provincia de Buenos Aires (Argentina) en diferentes estaciones del año. Los valores corresponden al día 1 luego de la captura. Letras diferentes en superíndices indican diferencias estadísticamente significativas entre columnas con un P < 0.05


Fig. 1. Variación de la tasa metabólica de reposo (TMR) en las diferentes estaciones del año en el tuco-tuco Ctenomys talarum del sudeste de la provincia de Buenos Aires (Argentina). Los valores corresponden al día 1 para cada estación.
No se observaron diferencias entre los días 1, 10 y 20 luego de la captura para cada una de las estaciones (otoño, ANCOVA de medidas repetidas, F2, 14 = 0.01; P = 0.99; invierno, F2, 12 = 1.67; P = 0.23; primavera, F2, 4 = 4.76; P = 0.09; verano, F2,12 = 0.89, P = 0.44; Fig. 2). La temperatura corporal en individuos de C. talarum varió entre estaciones (Tabla 1). Se observaron diferencias en la Tc entre invierno y verano (ANOVA, F3, 46 = 9.92, P < 0.001, Tukey, P = 0.006). Los datos para otoño y primavera, no presentaron diferencias (Tukey, P > 0.05).
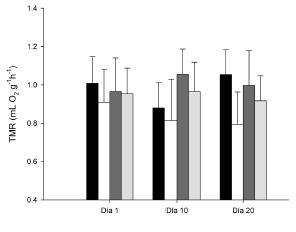
Fig. 2. Variación de la tasa metabólica de reposo (TMR) en los días 1, 10 y 20 luego de la captura, en el tuco-tuco Ctenomys talarum del sudeste de la provincia de Buenos Aires (Argentina). Las diferentes barras en cada día corresponden a las diferentes estaciones del año (negro: invierno; blanco: primavera; gris oscuro: verano; gris claro: otoño).
Suelo y vegetación
No se observaron diferencias entre los sitios de muestreo en la composición del suelo (ANOVA de dos vías, F3, 220 = 0.307, P = 0.82; Tabla 2). Como se ha señalado en otras contribuciones (Massarini et al., 2002; Luna et al., 2002), el tipo de sustrato en el que habita C. talarum corresponde a un suelo arenoso, compuesto principalmente por fracciones de granos de tamaño medio (< 0.5 a > 0.25 micrones, 44.59 ± 8.54%) y finos (< 0.25 micrones, 33.74 ± 8.03%). Este tipo de suelo, que incluye fracciones mínimas de arcillas, determina una baja capacidad de retención de agua. En tal sentido, el contenido de agua del suelo fue relativamente bajo y resultó diferente entre verano y primavera (ANOVA de una vía, F3, 44 = 3.88, P = 0.02, Tukey, P = 0.01; Tabla 2). Los valores de invierno y otoño no fueron diferente a los de verano y primavera (todos, P > 0.05).
Tabla 2. Variables climáticas (Tmax = temperatura ambiente máxima; Tmin = temperatura ambiente mínima; precipitación), disponibilidad de alimento (partes aéreas y subterráneas de plantas) y características edáficas (granulometría y humedad del suelo) del sitio de captura de los individuos de Ctenomys talarum del sudeste de la provincia de Buenos Aires en las diferentes estaciones del año. Letras diferentes en superíndices indican diferencias estadísticamente significativas entre columnas con un P < 0.05. 1No se observaron diferencias en la composición del suelo (en sus diferentes fracciones) entre estaciones.
El peso de la fracción aérea de vegetación fue diferente entre estaciones (ANOVA, F3, 44 = 11.97, P < 0.001; Tabla 2). Se observaron diferencias entre primavera y otoño (Tukey, P = 0.004) y entre primavera e invierno (P < 0.001). De la misma manera, el peso de la porción aérea en verano fue mayor que en otoño (P = 0.008) e invierno (P = 0.001). No se observaron diferencias significativas entre primavera y verano (P = 0.99) y entre otoño e invierno (P = 0.92). Se debe destacar que los valores obtenidos son relativamente altos comparados con otras localidades donde C. talarum habita (Massarini et al., 2002). El patrón observado con respecto al peso de la porción subterránea de vegetación es similar al observado en la porción aérea (ANOVA, F3,44 = 7.75, P = 0.002; Tabla 2). El peso de las partes subterráneas es menor en invierno que en las demás estaciones (Tukey, todos P > 0.028).
DISCUSION
En ambientes que sufren variaciones estacionales marcadas, los individuos afrontan dificultades para poder mantener un presupuesto energético balanceado (McNab, 2002). En especies de superficie, la flexibilidad de los caracteres fisiológicos, en particular los energéticos, son importantes para tolerar estas variaciones estacionales (Piersma y van Gils, 2011). Sin embargo, en base a los resultados obtenidos en este estudio es importante mencionar que, contra lo que se hubiera esperado, no se observaron variaciones en la TMR entre estaciones en C. talarum. Puede concluirse que la variación de los factores ambientales registrados, como la cobertura vegetal -como estimador de la oferta de alimento (Comparatore et al., 1995)- y las características edáficas y climáticas no son determinantes en la variación intraespecífica de la TMR.
Por un lado, aunque significativa (Tabla 2), la variación en la cantidad de material vegetal disponible para su consumo entre estaciones del año, no parece tener influencia sobre la TMR. A diferencia de lo observado en experimentos de laboratorio, donde los individuos fueron forzados a consumir dietas de baja calidad, las cuales determinaron una disminución en la TMR (Perissinotti et al., 2009), la disponibilidad en el campo parece suficiente como para que, ante una baja calidad de alimento en períodos invernales, no se vea afectada la TMR. Este factor es condicionante para especies, como Ctenomys porteousi, que habitan regiones con una disponibilidad de vegetación en invierno extremadamente baja (D. Antenucci, obs. pers.).
Ctenomys talarum se alimenta de partes aéreas de la vegetación, por lo que permanece parte de su tiempo forrajeando en superficie (Comparatore et al., 1995; Luna et al., 2000; Luna et al., 2002; Luna y Antinuchi, 2007b). Esto indica que los individuos de esta especie no se encuentran totalmente aislados de las condiciones climáticas externas. A pesar de que los individuos afrontan variaciones climáticas, no ve afectada su TMR entre estaciones, ni tampoco se observan variaciones diarias en el consumo de O2. Aunque no existen estudios en tuco-tucos donde se analice estacionalmente el tiempo total de permanencia en superficie, se ha observado una disminución en la actividad de superficie en las horas de mayor Ta durante el verano y de menor Ta en invierno (D. Antenucci, obs. pers.). Es posible que los tuco-tucos en condiciones naturales eviten forrajear en superficie en períodos del día con mayor Ta en verano y menor en invierno, almacenando alimento dentro de sus cuevas y limitando la actividad en superficie a períodos en los cuales la Ta tiene un efecto menor sobre el costo termorregulatorio. Por otro lado, la precipitación tiene efecto sobre el peso de los individuos de manera directa, no así sobre la TMR. El resultado obtenido, podría ser un artefacto de la cantidad de individuos estudiados, especialmente en primavera. Los efectos de su variación en el campo sobre la TMR deben ser evaluados a futuro.
Si bien no se observaron efectos de la Ta sobre la TMR, se detectaron diferencias en la Tc entre invierno y verano. En relación a esto se ha observado que los tuco-tucos presentan diferencias en el largo y densidad de su pelaje ventral entre invierno y verano. Estas variaciones morfológicas tendrían implicancias sobre la regulación de la Tc (Cutrera y Antinuchi, 2004) con correlatos en variaciones en la conductancia térmica. Dicha respuesta morfofisiológica permitiría tolerar eficientemente los cambios estacionales en la Ta, sin la correspondiente variación en la producción de calor mínima.
En roedores subterráneos las estrategias comportamentales pueden ser relevantes. En las cuevas de C. talarum los sistemas de galerías se distribuyen desde unos pocos centímetros de profundidad hasta por debajo del medio metro (Antinuchi y Busch, 1992). Resulta esperable que a mayor profundidad, la temperatura y las condiciones atmosféricas de las cuevas sean más estables (Burda et al., 2007), por lo que si existe una presión ambiental sobre la TMR, puede que los individuos construyan túneles más profundos permitiendo una disminución de los costos que se afrontan en el control de la pérdida o ganancia de calor. Otra estrategia comportamental es la disminución o aumento de la superficie del organismo que se encuentra en contacto con el sustrato, para regular la Tc. Luna y Antinuchi (2007a) observaron que los individuos de C. talarum que estaban expuestos a altas temperaturas durante la excavación, presentaban períodos donde comprimían el vientre en el sustrato aumentando la pérdida de calor por conductancia.
Finalmente, el hecho de no encontrar diferencias significativas en la TMR entre días de cautiverio (día 1, 10, 20), indica que el alimento ad libitum provisto a los animales, las mayores presiones parciales de O2 y menores de CO2 presentes en la superficie, la reducción de la actividad excavatoria y la ausencia del sustrato natural, no producen alteración en la TMR. La información obtenida es de importancia a la hora de diseñar metodologías de investigación en el laboratorio que involucren la estimación de la TMR en tuco-tucos y valida los datos obtenidos en trabajos previos.
En conclusión, es ampliamente difundido que el modo de vida subterráneo requiere de adaptaciones fisiológicas particulares que permiten enfrentar condiciones microclimáticas especiales. Aunque la masa corporal explica en gran medida la TMR, las diferentes estrategias morfológicas y comportamentales, de disipación y mantenimiento del calor corporal serían efectivas y suficientes ante variaciones ambientales entre las estaciones.
AGRADECIMIENTOS
Agradecemos a todos los miembros del Laboratorio de Ecología Fisiológica y del Comportamiento. Este estudio fue financiado por la Universidad Nacional de Mar del Plata, la Agencia Nacional de Promoción Científica y Tecnológica (PICT 2102) y el Consejo de Investigaciones Científicas y Técnicas (PIP 2787).
LITERATURA CITADA
1. ANTINUCHI CD y C BUSCH. 1992. Burrow structure in the subterranean rodent Ctenomys talarum. Zeitschrift für Säugetierkunde 57:163-168. [ Links ]
2. ANTINUCHI CD, RR ZENUTO, F LUNA, AP CUTRERA, P PERISINOTI y C BUSCH. 2007. Energy budget in subterranean rodents: Insights from the tuco-tuco Ctenomys talarum (RODENTIA: CTENOMYIDAE). Pp. 111-140, en: The quintessential naturalist: Honoring the life and legacy of Oliver P. Pearson (DA Kelt, E Lessa, JA Salazar-Bravo y JL Patton, eds.). University of California Publications in Zoology. [ Links ]
3. BOZINOVIC F y P SABAT. 2010. On the intraspecific variability in basal metabolism and the food habits hypothesis in birds. Current Zoology 56:759-766. [ Links ]
4. BURDA H, R SUMBERA y S BEGALL. 2007. Microclimate in Burrows of Subterranean Rodents. Pp. 21-33, en: Subterranean rodents: News from underground (S Begall, H Burda y C Schleich, eds.). Springer, Alemania. [ Links ]
5. COMPARATORE VM, MS CID y C BUSCH. 1995. Dietery preferences of two sympatric subterranean rodent populations in Argentina. Revista Chilena de Historia Natural 68:197-206. [ Links ]
6. CORP N, ML GORMAN y JR SPEAKMAN. 1997. Seasonal variation in the resting metabolic rate of male wood mice Apodemus sylvaticus from two contrasting habitats 15 Km apart. Comparative Physiology 167:229-239. [ Links ]
7. CRUZ-NETO AP y F BOZINOVIC. 2004. The relationship between diet quality and basal metabolic rate in endotherms: Insights from intraspecific analysis. Physiological and Biochemical Zoology 77:877-889. [ Links ]
8. CRUZ-NETO AP, DC BRIANI y F BOZINOVIC. 2003. La tasa metabólica basal: ¿una variable unificadora en energética animal? Pp. 379-395, en: Fisiología Ecológica y Evolutiva (F Bozinovic, ed.). Ediciones Universidad Católica de Chile, Santiago de Chile. [ Links ]
9. CUTRERA AP y CD ANTINUCHI. 2004. Cambios en el pelaje del roedor subterráneo Ctenomys talarum: posible mecanismo térmico compensatorio. Revista Chilena de Historia Natural 77:235-242. [ Links ]
10. CUTRERA AP, CD ANTINUCHI, MS MORA y AI VASSALLO. 2006. Home range and activity patterns of the South America subterranean rodent Ctenomys talarum. Journal of Mammalogy 87:1183-1191. [ Links ]
11. ELGAR M y P HARVEY. 1987. Basal metabolic rates in mammals: Allometry, phylogeny and ecology. Functional Ecology 1:25-36. [ Links ]
12. GEISER F y T RUF. 1995. Hibernation versus daily torpor in mammals and birds: Physiological variables and classification of torpor patterns. Physiological Zoology 68:935-966. [ Links ]
13. HAIM A y G LEVI. 1990. Role of body temperature in seasonal acclimatization: Photoperiod-induced rhythms and heat production in Merriones crassus. Journal Experimental Zoology 256:237-241. [ Links ]
14. HAIM A, RM McDEVIT y JR SPEAKMAN. 1994. Non-shivering thermogenesis in the common wood mouse Apodemus sylvaticus: The role of photoperiodicity and time of the day. Israel Journal Zoology 40:99. [ Links ]
15. HAIM A, RM McDEVIT y JR SPEAKMAN. 1995. Daily variations in the response of wood mice Apodemus sylvaticus to noradrenaline. Journal Experimental Biology 198:561-565. [ Links ]
16. KLEIBER M. 1932. Body size and animal metabolism. Hilgardia 6:315-353. [ Links ]
17. LOVEGROVE BG. 2000. The zoogeography of mammalian basal metabolic rate. The American Naturalist 156:201-219. [ Links ]
18. LOVEGROVE BG. 2003. The influence of climate on the basal metabolic rate of small mammals: A slow-fast metabolic continuum. Journal of Comparative Physiology B 173:87-112. [ Links ]
19. LUNA F y CD ANTINUCHI. 2007a. Energetics and thermoregulation during digging in the rodent tuco-tuco (Ctenomys talarum). Comparative Biochemistry and Physiology 146:559-564. [ Links ]
20. LUNA F y CD ANTINUCHI. 2007b. Energy and distribution in subterranean rodents: Sympatry between two species of the genus Ctenomys. Comparative Biochemistry and Physiology 147:948-954. [ Links ]
21. LUNA F, CD ANTINUCHI y C BUSCH. 2000. Ritmos de actividad locomotora y uso de las cuevas en condiciones seminaturales en Ctenomys talarum (Rodentia, Octodontidae). Revista Chilena de Historia Natural 73:39-46. [ Links ]
22. LUNA F, CD ANTINUCHI y C BUSCH. 2002. Digging energetics in the South American rodent, Ctenomys talarum (Rodentia, Octodontidae). Canadian Journal Zoology 80:2144-2149. [ Links ]
23. LUNA F, P ROCA, J OLIVER y CD ANTENUCCI. 2012. Maximal thermogenic capacity and non shivering thermogenesis in the South American subterranean rodent Ctenomys talarum. Journal of Comparative Physiology B 182:971-983. [ Links ]
24. MARQUES MD, DA GOLOMBEK y C MORENO. 1997. Sincronización con un ciclo ambiental. Pp. 57-98, en: Cronobiología, principios y aplicaciones (N Marques, L Menna-Barreto y DA Golombek, eds.). Editorial Eudeba, Buenos Aires. [ Links ]
25. MASSARINI A, D MIZRAHI, S TIRANTI, A TOLOZA, F LUNA y CE SCHLEICH. 2002. Extensive chromosomal variation in Ctenomys talarum from the atlantic coast of Buenos Aires, Argentina (Rodentia: Octodontidae). Mastozoología Neotropical 9:199-207. [ Links ]
26. McNAB BK. 1966. The metabolism of fossorial rodents: A study of convergence. Ecology 47:712-733. [ Links ]
27. McNAB BK. 1986. The influence of food habits on the energetic of eutherian mammals. Ecological Monographs 56:1-19. [ Links ]
28. McNAB BK. 2002. The physiological ecology of vertebrates: A view from energetics. Cornell University Press, Ithaca. [ Links ]
29. PERISSINOTTI P, CD ANTENUCCI, RR ZENUTO y F LUNA. 2009. Effect of diet quality and soil hardness on metabolic rate in the subterranean rodent Ctenomys talarum. Comparative Biochemistry and Physiology 154:298-307. [ Links ]
30. PIERSMA T y JA VAN GILS. 2011. The flexible phenotype: A body-centred integration of ecology, physiology, and behavior. Oxford University Press, Oxford. [ Links ]
31. REIG O, C BUSCH, M ORTELLS y J CONTRERAS. 1990. An overview of evolution, systematics, population biology, cytogenetics, molecular biology and speciation in Ctenomys. Pp.71-96, en: Evolution of subterranean mammals at the organismal and molecular levels (E Nevo y O Reig, eds.). Liss-Wiley, New York. [ Links ]
32. REZENDE EL, A CORTES, LD BACIGALUPE, RF NESPOLO y F BOZINOVIC. 2003. Ambient temperature limits above-ground activity of the subterranean rodent Spalacopus cyanus. Journal of Arid Environments 55:63-74. [ Links ]
33. REZENDE EL, F BOZINOVIC y T GARLAND. 2004. Climatic adaptation and the evolution of basal and maximum rates of metabolism in Rodents. Evolution 58:1361-1374. [ Links ]
34. SCHLECH CE y RR ZENUTO. 2007. Use of vegetation chemical signals for digging orientation. Ethology 573-578. [ Links ]
35. SPEAKMAN J. 2000. The cost of living: Field metabolic rates of small mammals. Advance in Ecological Research 30:178-297. [ Links ]
36. SPEAKMAN JR, E KROL y SM JOHNSONS. 2004. The functional significance of individual variation in basal metabolic rate. Physiological and Biochemical Zoology 77:900-915. [ Links ]
37. TOMOTANI BM, DEFL FLORES, P TACHINARDI, JD PALIZA, GA ODA y VS VALENTINUZZI. 2012. Field and laboratory studies provide insights into the meaning of day-time activity in a subterranean rodent (Ctenomys aff. knighti), the Tuco-tuco. PLoS ONE 7: e37918. doi:10.1371/journal.pone.0037918. [ Links ]
38. VLECK D. 1979. The energy cost of burrowing by the pocket gopher Thomomys bottae. Physiological Zoology 52:122-135. [ Links ]
39. WITHERS PC, CE COOPER y AL LARCOMBE. 2006. Environmental correlates of physiological variables in marsupials. Physiological and Biochemistry Zoology 79:437-453. [ Links ]
40. WITHERS PC. 1977. Measurements of VO2, VCO2, and evaporative water loss with a flow through a mask. Journal Applied Physiology 42:120-123. [ Links ]
41. WOODS CA. 1984. Histricognath rodents. Pp. 389- 446, en: Orders and families of recent mammals of the world (S Anderson y JK Jones, eds.). John Wiley, New York. [ Links ]
42. WUNDER BA, DS DOBKIN y RD GETTINGER. 1977. Shifts in thermogenesis in the praire vole (Microtus ochrogaster). Oecologia 29:11-26. [ Links ]
43. ZENUTO RR, AI VASALLO y C BUSCH. 2001. A method for studying social and reproductive behaviour of subterranean rodents in captivity. Acta Theriologica 46:161-170. [ Links ]














