Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.21 no.2 Mendoza dic. 2014
ARTÍCULO
Actualización de la lista de especies de mamíferos vivientes de Costa Rica
Bernal Rodríguez-Herrera1, 2, José D. Ramírez-Fernández1, 2, David Villalobos-Chaves1, 2 y Ragde Sánchez2
1 Escuela de Biología, Universidad de Costa Rica, 2060 San José, Costa Rica [Correspondencia: Bernal Rodríguez- Herrera <bernal.rodriguez@ucr.ac.cr>].
2 Asociación Theria para la Conservación e Investigación, Desamparados, San José, Costa Rica.
Recibido 12 mayo 2014.
Aceptado 26 junio 2014.
Editor asociado: U Pardiñas
RESUMEN.
Aunque Costa Rica es un país pequeño contiene una alta diversidad de mamíferos. El estudio de la mastozoología en el país se remonta a inicios del siglo XIX con la presencia de naturalistas europeos y los primeros costarricenses como Alfaro y Zeledón. A pesar de los amplios estudios realizados en Costa Rica aún quedan muchas especies de mamíferos por registrar. Prueba de lo anterior es la adición aquí de 11 especies de mamíferos a la lista nacional, totalizando 249. Los órdenes con mayor número de especies son Chiroptera con 114, Rodentia con 47, Cetacea con 31 y Carnivora con 24. De las 11 especies agregadas a esta lista, el 50% corresponden a especies descritas con nuevos reportes para Costa Rica y 3 son producto de la elevación de subespecie a nivel específico. El endemismo de mamíferos en Costa Rica se presenta principalmente en las tierras altas con 23 especies. Hace falta más trabajo de campo para completar el registro de especies presentes en el territorio nacional; sin embargo, es importante resaltar que no conocemos la ecología de un gran número de especies. Completar esa información, es uno de los retos más importantes para las generaciones presentes y futuras de mastozoólogos, no sólo en Costa Rica sino en el Neotrópico.
ABSTRACT.
List of extant species of mammals of Costa Rica.
Although Costa Rica is a small country, it has a high diversity of mammals. The study of mammalogy in the country dates back to the early nineteenth century with the presence of the first European and Costa Rican naturalists as Alfaro and Zeledon. Despite extensive studies in Costa Rica there are still many species of mammals to be recorded. Proof of this is the addition here of 11 species of mammals to the national list, with a total of 249 species. The orders with more species are Chiroptera with 114, Rodentia with 47, Cetacea with 31, and Carnivora with 24. Out of the 11 species added to previous list of mammals for the country, 50% correspond to already describe species with new records for Costa Rica, and 3 are the result of the elevation of subspecies to specific level. The endemic mammals in Costa Rica occur mainly in the highlands with 23 species. We point on the need of more field work to complete the documentation of species for the country; however, we do not know much about the ecology of many species. To complete the information on the ecology of mammalian species is one of the most important challenges for present and future generations of mammalogists, not only in Costa Rica but in the Neotropics.
Palabras clave: Costa Rica; Endemismo; Promops centralis; Taxonomía.
Key words: Costa Rica; Endemism; Promops centralis; Taxonomy.
INTRODUCCIÓN
A pesar de tener una extensión geográfica de apenas 50 900 km², el 3% del territorio mundial, Costa Rica cuenta con una alta diversidad de mamíferos en comparación con países de mayor extensión como México (1 972 550 km²) o Estados Unidos (9 826 675 km²). Esta elevada riqueza se asocia principalmente a su posición geográfica. Costa Rica ha servido como puente y barrera para diversos grupos de mamíferos provenientes del norte y del sur del continente, dando lugar a un ensamble con mezcla de especies con origen en ambos hemisferios (Cody et al., 2010; Wilson et al., 2014). También representa el límite de distribución de algunas especies; por ejemplo, el ratón bolsero de Salvin (Liomys salvini), nativo del bosque seco y cuyo límite sur de distribución se encuentra en el noroeste del país (Reid, 2009).
La gran diversidad de mamíferos de Costa Rica empezó a ser documentada por los naturalistas europeos llegados al país a mediados del siglo XIX. Los primeros naturalistas costarricenses Alfaro y Zeledón también hicieron grandes aportes (Rodríguez-Herrera et al., 2005). Los trabajos más representativos son los de Frantzius (1869), Alfaro (1897) y Goodwin (1946), entre otros, quienes crearon las primeras colecciones y listas de especies (Rodríguez- Herrera et al., 2005). En los últimos años se ha generado nueva información de mamíferos para el país, con las publicaciones de listas de especies (Janzen, 1983; Wilson, 1983; Rodríguez y Chinchilla, 1996; Carrillo et al., 2000; Mora, 2000; Wilson et al., 2002), nuevos registros (Pineda et al., 2008; Montero- Cordero et al., 2010; Rodríguez-Herrera et al., 2011), ampliaciones de áreas de distribución (Rodríguez-Herrera, 2004) y descripción de nuevas especies (Anderson y Timm, 2006; Gardner y Carleton, 2009).
El presente trabajo brinda la más reciente lista de mamíferos vivientes terrestres y marinos de Costa Rica. De esta forma incluye los últimos cambios en la sistemática y filogenia del grupo, la mención de especies nuevas, los registros novedosos para el país y las ampliaciones de rango geográfico.
MATERIALES Y MÉTODOS
Para elaborar esta lista actualizada de especies de mamíferos de Costa Rica se tomó como base a aquella de Rodríguez-Herrera et al. (2002), la cual fue enriquecida mediante una revisión bibliográfica de las publicaciones anteriores sobre nuevos registros y modificaciones taxonómicas. Además, revisamos e incluimos, en los casos necesarios, los especímenes depositados en el Museo de Zoología de la Universidad de Costa Rica (MZUCR) producto de colecciones de los últimos 12 años. La nomenclatura empleada está basada en la propuesta de Wilson y Reeder (2005) con cambios acordes a las publicaciones más recientes.
RESULTADOS
En el presente trabajo incrementamos en 11 especies la lista elaborada por Rodríguez-Herrera et al. (2002). En total registramos 249 especies de mamíferos (Apéndice 1), de los cuales 214 son terrestres. Los órdenes con mayor número de especies son Chiroptera con 114 (más del 45% del total del país), seguido por Rodentia con 47, Cetacea con 31 y Carnivora con 24 (Fig. 1).
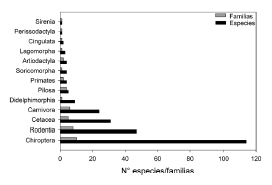
Fig. 1. Número de especies y familias por orden de mamíferos de Costa Rica.
Al analizar los datos derivados de la revisión bibliográfica efectuada sobre las especies de mamíferos reportados a lo largo de la historia para Costa Rica, 2 periodos se destacan por el aumento en especies. El primero se ubica entre 1900-1950 (94 especies) y el segundo, entre 1980-2000 (37 especies; Fig. 2).

Fig. 2. Número de especies registradas según el año de publicación de diferentes listas de mamíferos de Costa Rica.
Dentro de los límites políticos de Costa Rica se han documentado 6 especies de mamíferos endémicos, todos roedores: Orthogeomys heterodus, O. cherriei, Heteromys oresterus, H. nubicolens, Reithrodontomys rodriguezi y R. musseri. Sin embargo, si se considera la región geográfica compuesta por las tierras altas de la cordillera de Talamanca en Costa Rica y la zona de Chiriquí en el oeste de Panamá, este número aumenta a 21 especies. En el extremo norte del país se comparten otras 2 especies más con Nicaragua, Reithrodontomys brevirostris y R. paradoxus, totalizando en 23 el número de especies endémicas regionales (Tabla 1).
Tabla 1. Cambios en la composición de los órdenes de mamíferos presentes en Costa Rica entre los años 2002 (año de publicación de la lista de Rodríguez-Herrera) y 2014.

Cambios taxonómicos
Órdenes
Cingulata. Actualmente los miembros de la familia Dasypodidae (armadillos) están clasificados dentro del orden Cingulata (Gardner, 2005a, 2007). Antes se agrupaban en el orden Xenarthra junto con los miembros del actual orden Pilosa (Rodríguez-Herrera et al., 2002).
Pilosa. Los miembros de las familias Bradypodidae, Megalonychidae, Myrmecophagidae y Cyclopedidae -antiguos integrantes de Xenarthra- ahora se clasifican en el orden Pilosa (Gardner, 2005b, 2008).
Soricomorpha. Las musarañas de Costa Rica (Soricidae: Cryptotis) ya no forman parte del desaparecido orden Insectivora, sino del orden Soricomorpha (Hutterer, 2005).
Familias
Cyclopedidae. El serafín de platanar o ceibita, Cyclopes didactylus, se incluye en su propia familia -con base en diferencias morfológicas y moleculares- dentro del orden Pilosa. Anteriormente la especie estaba incluida en Myrmecophagidae (Delsuc et al., 2002; Gardner, 2005b; Delsuc y Douzery, 2009).
Cricetidae. De acuerdo con Fabre et al. (2012), la familia Cricetidae representa un grupo monofilético, así como cada una de las subfamilias que la componen (i.e. Sigmodontinae, Cricetinae, Arvicolinae, Tylomyinae y Neotominae).
Géneros
Dermanura. Con base en el análisis de ADN nuclear y mitocondrial, Hoofer et al. (2008) y Redondo et al. (2008) elevan el subgénero Dermanura a nivel de género; todas las especies pequeñas de Artibeus de Costa Rica se incluyen en el mismo.
Especies
Marmosa alstoni. Según Voss y Jansa (2009), el género Micoureus es un subgénero de Marmosa.
Marmosa mexicana. Rossi et al. (2010) separa esta especie en 2: M. mexicana y M. zeledoni. En Costa Rica, la distribución de M. mexicana está restringida a la costa pacífica del noroeste del país.
Marmosa zeledoni. Antes considerada como M. mexicana (véase Rossi et al., 2010); M. zeledoni se encuentra en todo el país, excepto en la costa pacífica del noroeste, en la provincia de Guanacaste.
Cebus imitator. De acuerdo con Doubli et al. (2012) esta especie es diferente de C. capucinus. Su distribución incluye desde el noreste de Honduras hasta el sur de Costa Rica.
Handleyomys alfaroi. Tratado previamente como Oryzomys alfaroi; se sigue aquí el cambio provisional de Weksler et al. (2006; véase también Weksler y Percequillo, 2011), hasta que se describa un género nuevo para el "grupo alfaroi".
Nephelomys devius. Antes incluida en Oryzomys. N. devius fue separado de la especie andina N. albigularis (Weksler, 2006) y se constituye como una especie endémica de las tierras altas de Costa Rica y Panamá.
Sigmodon hirsutus. especie válida fuera del complejo S. hispidus, siguiendo a Carroll et al. (2005) y Bradley et al. (2008).
Tanyuromys aphrastus. Antes Sigmodontomys aphrastus, fue reasignada por Pine et al. (2012) al género novedoso Tanyuromys, debido a que no integra un grupo monofilético con Sigmodontomys alfari.
Transandinomys bolivaris. Previamente Oryzomys bolivaris (véase Weksler et al., 2006).
Transandinomys talamancae. previamente Oryzomys talamancae (véase Weksler et al., 2006).
Sphiggurus mexicanus. Con base en datos cromósomicos y moleculares (Bonvicino et al., 2002; Woods y Kilpatrick, 2005) se considera a Sphiggurus como un género distinto de Coendou.
Sylvilagus gabbi. Se eleva a rango específico la subespecie centroamericana S. brasiliensis gabbi, con base en datos morfológicos y moleculares (Ruedas y Salazar-Bravo, 2007).
Cryptotis orophila. Previamente como C. parva (Woodman, 2002; Hutterer, 2005).
Artibeus lituratus. Aunque algunos autores consideran a A. intermedius una especie distinta (Davis, 1984), se sigue a Simmons (2005) quien la ubica como una subespecie de A. lituratus.
Dermanura azteca. El epíteto específico cambia para estar en concordancia con el genitivo femenino (Hoofer et al., 2008; Solari et al., 2009); ver género Dermanura (arriba).
Dermanura phaeotis. Previamente como Artibeus phaeotis.
Dermanura tolteca. El nombre de la especie cambia de Artibeus toltecus a D. tolteca.
Dermanura watsoni. Previamente como Artibeus watsoni.
Eptesicus chiriquinus. Siguiendo a Simmons y Voss (1998) se reconoce a E. chiriquinus como especie distinta de E. brasiliensis, ambas presentes en Costa Rica.
Lophostoma silvicolum. El epíteto específico cambia de silvicola a silvicolum según lo propuesto por Lee et al. (2002).
Lonchophylla concava. Previamente tratada como subespecie de L. mordax, considerada como una especie distinta por Woodman y Timm (2006).
Mesophylla macconnelli. Previamente tratada como Ectophylla macconnelli. Porter y Baker (2004) y Hoofer y Baker (2006) la ubican en el género Mesophylla.
Mimon cozumelae. Previamente tratada como M. bennettii; McCarthy (1987), McCarthy et al. (1993) y Simmons y Voss (1998) la reconocen como una especie distinta. De esta forma M. bennettii queda restringida al sudeste de Brasil y Guayanas, mientras que M. cozumelae se distribuye desde México, a través de América Central, hasta Colombia.
Molossus coibensis. Siguiendo a Simmons (2005) se acepta a M. coibensis como una especie diferente de M. molossus, ambas presentes en Costa Rica.
Natalus mexicanus. Siguiendo a Tejedor (2005, 2011; pero veáse Clare et al., 2011; López-Wilchis et al., 2012) corresponde a las poblaciones continentales previamente tratadas como N. stramineus, que se distribuye en las Antillas.
Pteronotus mesoamericanus. Siguiendo a Clare et al. (2013), se acepta el rango específico de P. parnellii mesoamericanus con base en diferencias genéticas, morfológicas y acústicas documentadas para este taxón.
Rhogeessa bickhami. Con base en información genética y morfológica, Baird et al. (2012) reconocen a R. bickhami para Costa Rica. Rhogessa tumida queda restringida a la vertiente atlántica de México.
Sturnira hondurensis. Previamente tratada como S. ludovici; las diferencias reportadas para las poblaciones del sudeste de México y de América Central con respecto a aquellas de América del Sur (Iúdica, 2000; Gardner, 2008; Velazco y Patterson, 2013), indican que la especie centroamericana es S. hondurensis.
Sturnira parvidens. Descrita como especie distinta de S. lilium por Iúdica (2000; véase además Jarrín-V. y Kunz, 2011; Jarrín-V. y Clare, 2013; Velazco y Patterson, 2013).
Vampyressa thyone. Previamente tratada como V. pusilla; Lim et al. (2003) la reconocen como especie distinta a la de América del Sur.
Vampyriscus nymphaea. Previamente tratada como Vampyressa nymphaea (véase Hoofer y Baker, 2006).
Vampyrodes major. De acuerdo a Velazco y Simmons (2011), se acepta a V. major como especie diferente de V. caraccioli, estando sólo la primera presente en Costa Rica.
Puma yagouaroundi. Anteriormente en el género Herpailurus. Según estudios de ADN mitocondrial, al igual que datos cromosómicos, los jaguarundis y los pumas son congenéricos y deben ser tratados como P. yagouaroundi y P. concolor (Wozencraft, 2005; Sunquist y Sunquist, 2009).
Spilogale angustifrons. Se acepta la elevación a rango específico de la subespecie de S. putorius angustifrons, con base en datos cromosómicos, quedando S. putorius restringida a América del Norte (Wozencraft, 2005; Dragoo, 2009).
Pecari tajacu. De acuerdo con Grubb (2005) y Taber et al. (2011), "Tayassu" tajacu pertenece a un linaje distinto de las otras especies vivientes de la familia Tayassuidae, por lo que es más apropiado incluirlo en el género monotípico Pecari.
Mazama temama. Siguiendo a Geist (1998) y Merino y Rossi (2010), M. temama es una especie diferente del complejo M. americana. La primera se distribuye desde el sur de México, por América Central, hasta el norte de Colombia; la segunda queda restringida a América del Sur.
Balaenoptera brydei. De acuerdo con Rice (1998) y Kato (2002), B. brydei es distinta de B. edeni con base en evidencias moleculares y morfológicas (Wada et al., 2003; Sasaki et al., 2006; pero véase Kanda et al., 2007; Smultea et al., 2012).
Sotalia guianensis. De acuerdo a análisis morfométricos y moleculares, se considera con rango específico pleno la subespecie S. fluviatilis guianensis (Caballero et al., 2007). De esta forma S. guianensis se distribuye en las costas Caribe y Atlántico, desde Nicaragua hasta el sur de Brasil; S. fluviatilis se restringe al río Amazonas y sus afluentes.
Registros recientes
Heteromys nubicolens. Roedor de la familia Heteromyidae que habita a elevaciones intermedias en las cordilleras de Tilarán y de Guanacaste (Monteverde, volcán Rincón de la Vieja, volcán Santa María y el cerro Cacao; Anderson y Timm, 2006).
Reithrodontomys musseri. Esta especie, recientemente descrita, presenta poblaciones en el cerro La Asunción, provincia de Cartago (Gardner y Carleton, 2009).
Eumops nanus. Capturada en el río Enmedio, parque nacional Diriá, Santa Cruz, provincia de Guanacaste (Pineda et al., 2008); para el tratamiento de E. bonariensis nanus como especie plena se sigue a Eger (2007).
Natalus lanatus. Registrada en las siguientes localidades de Toma 1, Río Savegre, provincia de San José; Río Guacimal, Monteverde, provincia de Puntarenas y Navarro de Socorro, Orosí, provincia de Cartago (Rodríguez-Herrera et al., 2011).
Sturnira burtonlimi. Registrada en Colima Tapantí, provincia de Cartago de acuerdo a Velazco y Patterson (2014), quienes la consideran distinta de S. ludovici y de S. hondurensis.
Arctocephalus galapagoensis. Registrada al sur del país, en la desembocadura del río Sierpe y en Playa Dominicalito, Osa, provincia de Puntarenas (Montero-Cordero et al., 2010).
Indopacetus pacificus. Se agrega esta especie de zifio siguiendo a MacLeod et al. (2006) y a Palacios-Alfaro et al. (2012), quienes la observaron en el Pacífico Sur de Costa Rica.
Mesoplodon ginkgodens. Se agrega esta especie de acuerdo con Culik (2004), con base en un modelaje realizado por Carwardine (1995), el cual predice su presencia en toda la costa pacífica de Costa Rica.
Ampliaciones de distribución
Nyctomys sumichrasti. Esta especie se distribuye desde el sur de Jalisco y Veracruz en México, continuando por América Central hasta el este de Panamá, excluyendo la Península de Yucatán (Hunt et al., 2004; Pérez-Lustre y Santos-Moreno, 2010). Altitudinalmente, se ha reportado desde el nivel del mar hasta los 1800 m (Reid, 2009). El 16 de diciembre de 2012 uno de los autores (JDRF) colectó un macho de N. sumichrasti en el parque nacional Volcán Barva, Heredia (10°7'54.10" N, 84°7'25.30" O, 2660 m), el cual fue depositado en el Museo de Zoología de la Universidad de Costa Rica (UCR-4276). Este registro representa una ampliación del rango altitudinal superior de ca. 800 m para la especie.
Rheomys raptor. Sigmodontino representado en Costa Rica por escasos ejemplares de localidades en la vertiente Pacífico al oeste del país (Voss 1988; Durden y Timm, 2001). El 16 de julio del 2011 se recolectó un individuo (UCR- 4292) en Veragua Rainforest, Limón (9°55'29.6" N, 83°11'29.1" O, 390 m). Este registro amplia tanto el rango latitudinal como altitudinal, este último en casi 800 m, conocidos para la especie (Wilson y Reeder, 2005; Reid, 2009).
Tanyuromys aphrastus. Especie representada en colecciones por 8 ejemplares, de los cuales 3 son de Costa Rica, 2 de Panamá y 3 de Ecuador (Pine et al., 2012). En Costa Rica se ha registrado en 2 localidades: la cordillera de Talamanca a 1220 m, que corresponde a su terra typica (Harris, 1932; McCain et al., 2007) y el bosque nuboso de Monteverde, lugar de obtención de 2 individuos. El 11 de mayo del 2012 uno de los autores (DVC) capturó una hembra (UCR-1921) a 1570 m en el Parque Internacional La Amistad, Sector Pittier, Puntarenas (9°01'25.7" N, 82°57'29.3" O).
Mesophylla macconnelli. Reportada en Costa Rica para unas pocas localidades de tierras bajas y medias en la vertiente Caribe (Rodríguez y Wilson, 1999; LaVal y Rodríguez, 2002), hasta una altitud máxima de 1100 m (Starrett y Casebeer, 1968; Reid, 2009). El 24 de abril se capturó una hembra (UCR-3299) a 1300 m en el parque nacional Tapantí, Cartago (Echeverría-Tello, 2013).
Nuevo registro
Promops centralis. El 8 de abril de 2011, el primer autor (BRH) y sus estudiantes colocaron 4 redes de niebla (2 x 9 m) a través del río Enmedio en el parque nacional Diriá (10°10'24"N, 85°35'39" O; 128 m ) a 11 km al suroeste de Santa Cruz, Provincia de Guanacaste. A las 19:00 se capturó un macho escrotal asignable a esta especie (Fig. 3), con las siguientes medidas corporales (en mm): largo del cuerpo = 83; cola = 57; pata trasera derecha = 12; oreja = 16; trago = 1.3; antebrazo = 55; y peso 29 g. El individuo fue preservado en alcohol y depositado con el número UCR-4093.
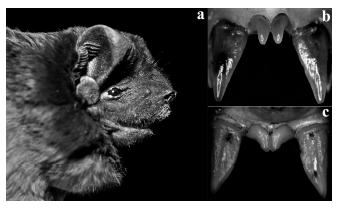
Fig. 3. Promops centralis (Molossidae), nuevo mamífero para Costa Rica, sobre la base de un ejemplar (UCR-4093) capturado en el parque nacional Diriá, Guanacaste: a) detalle del rostro; b) incisivos superiores; C) incisivos superiores de Molossus rufus (UCR-4048), con fines comparativos.
P. centralis se diferencia externamente de Molossus por las siguientes características diagnósticas: pelos largos entre las orejas; sin pelos largos en la base del dorso como los presenta Molossus (Reid, 2009); la quilla del rostro es elevada, no recta y la cola del ejemplar capturado es de 57 mm, mientras que en M. rufus, con el que se podría confundir por el tamaño de antebrazo, la cola es de 38-54 mm (Reid, 2009); además los incisivos superiores forman un triángulo, de diferente forma que en Molossus (López-González, 2004); Promops presenta cuatro incisivos inferiores, mientras que Molossus dos (Díaz et al., 2011). Del género Eumops, se diferencia fácilmente por la forma del antetrago (en Eumops es más bajo y ancho) y presenta orejas mucho más cortas (en Eumops las orejas sobrepasan el hocico) (Hall, 1981; Reid, 2009). El ejemplar capturado presenta el paladar en forma de domo, claramente distinto a los géneros mencionados (Molossus y Eumops), y esta es una característica diagnóstica del género Promops (Hall, 1981).
Esta especie es conocida desde Jalisco y Yucatán en México, hasta Ecuador, Perú, oeste de Brasil, Bolivia, Paraguay, norte de Argentina y Guyana y Trinidad (Simmons, 2005). Sin embargo no se ha documentado en Belice, El Salvador y Costa Rica (Reid, 2009). Por su amplia distribución y por haberse registrado tanto en el norte como en el sur del país, no es de extrañar que esta especie esté presente en Costa Rica. Este ejemplar representa el primer registro de Promops centralis para el país, sumando un género más de mamíferos, e incluyendo al país en la distribución de la especie.
DISCUSIÓN
Debido al gran número de especies que contienen los órdenes Cetacea, Chiroptera y Rodentia y a lo arduo de su estudio y taxonomía, en Costa Rica se continuan registrando especies nuevas pertenecientes a los mismos. Por el contrario, el resto de los órdenes de mamíferos parecen bien conocidos. En estos, la adición de nuevos representantes en la lista nacional se ha debido principalmente a revisiones de especies ya conocidas, tal como es el caso de M. zeledoni.
Entre las especies documentadas recientemente para Costa Rica se verifican 5 especies de murciélagos, tres de mamíferos marinos, 2 de roedores y una de marsupiales. Además se eliminó una especie de murciélago, Artibeus intermedius. De las 11 especies nuevas incluidas en esta lista, el 50% ya estaban descritas y fueron reportadas recientemente para el país; otras 3 son resultado de cambios de nivel subespecífico a específico. Cabe destacar que los roedores Heteromys nubicolens y Reithrodontomys musseri fueron descritos recientemente a partir de ejemplares colectados en el país, siendo ambas especies de tierras altas donde la abundancia y el endemismo de este grupo de mamíferos parece ser elevado. El género Reithrodontomys en particular es muy diverso y la identificación taxonómica confiable de individuos vivos sigue siendo complicada en algunas de sus especies.
En el caso particular de Sturnira burtonlimi, esta especie fue descrita a partir de un individuo colectado en Panamá que resultó concidente con otro ejemplar previamente indeterminado disponible para Costa Rica, el cual representa la única localidad conocida en dicho territorio (Velazco y Patterson, 2014).
El registro aquí presentado para P. centralis en Costa Rica es prueba de que aún resta mucho trabajo en campo para describir la diversidad de mamíferos del país. Resulta curioso que en la misma localidad donde se capturó P. centralis se han registrado otras especies relevantes, entre otros, 5 ejemplares del poco conocido murciélago de Sanborn, Eumops hansae, el segundo ejemplar para Costa Rica de Eumops underwoodi y ejemplares de Cynomops mexicanus, Eumops glaucinus, Molossus coibensis (= M. molossus) y Molossus pretiosus (Pineda et al., 2008).
El endemismo de mamíferos en Costa Rica se presenta principalmente en las tierras altas. De las 23 especies endémicas del país (Tabla 1), 14 se distribuyen en elevaciones > 1500 m y principalmente en la cordillera de Talamanca. Esta cordillera abarca territorio costarricense y panameño en la provincia de Chiriquí, alcanza su máxima elevación a los 3819 m en el cerro Chirripó y representa el límite norte de los ecosistemas de páramo (Kappelle, 2005). Esta región, además, cuenta con la mayor cobertura boscosa del país, con el mayor número de zonas de vida y con el parque nacional de mayor superficie (~ 404 500 ha; parque nacional La Amistad), características que la convierten en un área de interés para su estudio (Rodríguez- Herrera et al., 2005).
A pesar de que algunos investigadores consideran a Costa Rica un país bien conocido con respecto a su diversidad de mamíferos, todos los registros y descripciones nuevas demuestran que aún espera un importante trabajo a futuro para alcanzar un inventario exhaustivo de su patrimonio natural. Las contribuciones en sistemática siguen siendo necesarias, ya que con el uso y aplicación de las colecciones de museo se siguen descubriendo especies, en particular en grupos diversos y de compleja taxonomía como los roedores y los murciélagos. Por esta razón, la recolecta científica de especímenes y sus datos asociados resulta una herramienta indispensable no solo en la documentación de la diversidad biológica, sino también en estudios de morfología, evolución, distribución, variación fenotípica a través del tiempo, manejo y conservación, entre otros (Rocha et al., 2014). La tarea en el campo de la ecología aún es mayor, ya que un gran número de las especies cuenta tan solo con la descripción original y se desconoce todo aspecto de su historia natural. Aquí se incluye a la mayoría de las especies endémicas y especies de pequeños mamíferos que pertenecen a géneros como Reithrodontomys, Cryptotis, Eumops, por mencionar sólo algunos. Este es uno de los retos más importantes para las generaciones presentes y futuras de mastozoólogos, no solo en Costa Rica sino en el Neotrópico.
AGRADECIMIENTOS
Agradecemos a todas las personas que aportaron información para la elaboración de este trabajo: J. L. Echevería- Tello, A. Cerdas-Cedeño, A. Gómez-Lépiz, al Grupo de Mastozoología de la Universidad Nacional, a los colegas y estudiantes de la Universidad de Costa Rica que han aportado de distintas formas tanto en el campo como en la revisión del manuscrito.
LITERATURA CITADA
1. ALFARO A. 1897. Mamíferos de Costa Rica. Tipografía Nacional, San José, Costa Rica. 51 pp. [ Links ]
2. ANDERSON RP y RM TIMM. 2006. A new montane species of spiny pocket mouse (Rodentia: Heteromyidae: Heteromys) from northwestern Costa Rica. American Museum Novitates 3509:1-38. [ Links ]
3. BAIRD AM, MR MARCHÁN-RIVADENEIRA, SG PÉREZ y RJ BAKER. 2012. Morphological analysis and description of two new species of Rhogeessa (Chiroptera: Vespertilionidae) from the Neotropics. Occasional Papers, Museum of Texas Tech University 307:1-25. [ Links ]
4. BONVICINO CR, V PENNA-FIRME y E BRAGGIO. 2002. Molecular and karyologic evidence of the taxonomic status of Coendou and Sphiggurus (Rodentia: Hystricognathi). Journal of Mammalogy 83:1071-1076. [ Links ]
5. BRADLEY RD, DD HENSON y ND DURISH. 2008. Re-evaluation of the geographic distribution and phylogeography of the Sigmodon hispidus complex based on the mitochondrial DNA sequences. Southwest Naturalist 53:301-310. [ Links ]
6. CABALLERO S et al. 2007. Taxonomic status of the genus Sotalia: species level ranking for "tucuxi" (Sotalia fluviatilis) and "costero" (Sotalia guianensis) dolphins. Marine Mammal Science 23:358-386. [ Links ]
7. CARRILLO E, G WONG y J SÁENZ. 2000. Mamíferos de Costa Rica. INBIO, Heredia, Costa Rica. [ Links ]
8. CARROLL DS, LL PEPPERS y RD BRADLEY. 2005. Molecular systematics and phylogeography of the Sigmodon hispidus species group. Pp. 87-100, en: Contribuciones mastozoológicas en homenaje a Bernardo Villa (VS Sánchez-Cordero y RA Medellín, eds.). Instituto de Biología e Instituto de Ecología, Universidad Nacional Autónoma de México y Comisión Nacional del Conocimiento y Uso de la Biodiversidad, México. [ Links ]
9. CARWARDINE M. 1995. Whales, dolphins and porpoises. Dorling Kindersley, London, UK. [ Links ]
10. CLARE EL, AM ADAMS, AZ MAYA-SIMOES, JL EGER, PDN HEBERT y MB FENTON. 2013. Diversification and reproductive isolation: Cryptic species in the only New World high-duty cycle bat, Pteronotus parnellii. BMC Evolutionary Biology 13:1-18. [ Links ]
11. CLARE EL, BK LIM, MB FENTON y PDN HEBERT. 2011. Neotropical bats: Estimating species diversity with DNA barcodes. PloS ONE 6:e22648. [ Links ]
12. CODY S, JE RICHARDSON, V RULL, C ELLIS y RT PENNINGTON. 2010. The Great American Biotic Interchange revisited. Ecography 33:326-332. [ Links ]
13. CULIK BM. 2004. Review of small cetaceans: Distribution, behaviour, migration and threats. Marine Mammal Action Plan/Regional Seas Reports and Studies no. 177. UNEP/CMS Secretariat, Bonn, Germany. [ Links ]
14. DAVIS WB. 1984. Review of the large fruit-eating bats of the Artibeus "lituratus" complex (Chiroptera: Phyllostomidae) in Middle America. Occasional Papers, Museum of Texas Tech University 93:1-16. [ Links ]
15. DELSUC F y EJP DOUZERY. 2009. Armadillos, anteaters, and sloths (Xenarthra). Pp. 475-478, en: The timetree of life (SB Hedges y S Kumar, eds.). Oxford University Press. [ Links ]
16. DELSUC F, M SCALLY, O MADSEN, MJ STANHOPE, WW DE JONG, FM CATZEFLIS, MS SPRINGER y EJP DOUZERY. 2002. Molecular phylogeny of living xenarthrans and the impact of character and taxon sampling on the placental tree rooting. Molecular Biology and Evolution 19:1656-1671. [ Links ]
17. DÍAZ MM, LF AGUIRRE y RM BARQUEZ. 2011. Clave de identificación de los murciélagos del cono sur de Sudamérica. Centro de Estudios en Biología Teórica y Aplicada, Bolivia. [ Links ]
18. DOUBLI JP, AB RYLANDS, IP FARIAS, ME ALFARO y JW LYNCH ALFARO. 2012. Cebus phylogenetic relationships: A preliminary reassessment of the diversity of the untufted capuchin monkeys. American Journal of Primatology 74:381-393. [ Links ]
19. DRAGOO JW. 2009. Family Mephitidae (Skunks). Pp. 532-563, en: Handbook of the mammals of the world. Vol. 1. Carnivores (DE Wilson y RA Mittermeier, eds.). Lynx Edicions, Barcelona. [ Links ]
20. DURDEN LA y RM TIMM. 2001. Hoplopleura janzeni n. sp. (Phthiraptera: Anoplura), a new sucking louse from a Central American swimming mouse. Journal of Parasitology 87:1409-1413. [ Links ]
21. ECHEVERRÍA-TELLO JL. 2013. Ensambles de murciélagos frugívoros y nectarívoros en un gradiente altitudinal de Costa Rica y su potencial distribución bajo escenarios de cambio climático. Tesis de maestría en ciencias, CATIE, Turrialba, Costa Rica. [ Links ]
22. EGER JL. 2007. Family Molossidae P. Gervais, 1856. Pp. 399-439, en: Mammals of South America: Marsupials (Didelphimorphia, Microbiotheria, and Paucituberculata), xenarthrans (Cingulata, Pilosa), shrews (Soricomorpha), and bats (Chiroptera) (AL Gardner, ed.). University of Chicago Press, Chicago. [ Links ]
23. FABRE PH, L HAUTIER, D DIMITROV y EJP DOUZERY. 2012. A glimpse on the pattern of rodent diversification: A phylogenetic approach. BMC Evolutionary Biology 12:88. [ Links ]
24. FRANTZIUS AV. 1869. Los mamíferos de Costa Rica. Traducido por D. R. Cortéz. 1963. Revista de los Archivos Nacionales de Costa Rica 27:237-281. [ Links ]
25. GADNER AL. 2005a. Order Cingulata. Pp. 94-99, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
26. GADNER AL. 2005b. Order Pilosa. Pp. 100-103, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
27. GARDNER AL. 2008. Mammals of South America: Marsupials (Didelphimorphia, Microbiotheria, and Paucituberculata), xenarthrans (Cingulata, Pilosa), shrews (Soricomorpha), and bats (Chiroptera). University of Chicago Press, Chicago. [ Links ]
28. GARDNER AL y MD CARLETON. 2009. A new species of Reithrodontomys, subgenus Aporodon (Cricetidae: Neotominae), from the highlands of Costa Rica, with comments on Costa Rican and Panamanian Reithrodontomys. Bulletin of the American Museum of Natural History 331:157-182. [ Links ]
29. GEIST V. 1998. Deer of the world, their evolution, behaviour, and ecology. Stackpole Books, Mechanicsburg. [ Links ]
30. GOODWIN GG. 1946. Mammals of Costa Rica. Bulletin of the American Museum of Natural History 87:271-473. [ Links ]
31. GRUBB P. 2005. Order Artiodactyla. Pp. 637-722, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
32. HALL ER. 1981. The mammals of North America. John Wiley & Sons, New York. [ Links ]
33. HARRIS WP JR. 1932. Four new mammals from Costa Rica. Occasional Papers of the Museum of Zoology, University of Michigan 248:1-6. [ Links ]
34. HOOFER SR y RJ BAKER. 2006. Molecular systematics of Vampyressine bats (Phyllostomidae: Stenodermatinae) with comparison of direct and indirect surveys of mitochondrial DNA variation. Molecular Phylogenetics and Evolution 39:424-438. [ Links ]
35. HOOFER SR, S SOLARI, PA LARSEN, RD BRADLEY y RJ BAKER. 2008. Phylogenetics of the fruit-eating bats (Phyllostomidae: Artibeina) inferred from mitochondrial DNA sequences. Occasional Papers, Museum of Texas Tech University 277:1-15. [ Links ]
36. HUNT JL, JE MORRIS y TL BEST. 2004. Nyctomys sumichrasti. Mammalian Species 754:1-6. [ Links ]
37. HUTTERER R. 2005. Order Soricomorpha. Pp. 220-311, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
38. IÚDICA CA. 2000. Systematic revision of the Neotropical fruit bats of the genus Sturnira: A molecular and morphological approach. Tesis de doctorado en ciencias, Universidad de Florida, Gainesville, USA. [ Links ]
39. JANZEN DH. 1983. Costa Rican Natural History. University of Chicago Press, Chicago. [ Links ]
40. JARRÍN-V P y EL CLARE. 2013. Systematics of Sturnira (Chiroptera: Phyllostomidae) in Ecuador, with comments on species boundaries. Zootaxa 3630:165- 183. [ Links ]
41. JARRÍN-V P y TH KUNZ. 2011. A new species of Sturnira (Chiroptera: Phyllostomidae) from the Choco forest of Ecuador. Zootaxa 2755:1-35. [ Links ]
42. KANDA N, M GOTO, H KATO, MV MCPHEE y LA PASTENE. 2007. Population genetic structure of Bryde´s whales (Balaenoptera brydei) at the inter-oceanic and trans-equatorial levels. Conservation Genetics 8:853-864. [ Links ]
43. KAPPELLE M. 2005. Hacia una breve descripción del concepto "páramo". Pp. 29-36, en: Páramos de Costa Rica (M Kappelle y SP Horn, eds.). INBio, Heredia, Costa Rica. [ Links ]
44. KATO H. 2002. Bryde´s whales Balaenoptera edeni and B. brydei. Pp. 171-177, en: Encyclopedia of marine mammals (Perin et al., eds.). Academic Press, San Diego. [ Links ]
45. LAVAL RK y B RODRÍGUEZ-H. 2002. Murciélagos de Costa Rica. INBio, Heredia, Costa Rica. [ Links ]
46. LEE TE, SR HOOFER Jr y RA VAN DEN BUSCHE. 2002. Molecular phylogenetics and systematic revision of the genus Tonatia (Chiroptera: Phyllostomidae). Journal of Mammalogy 83:49-57. [ Links ]
47. LIM BK, WA PEDRO y FC PASSOS. 2003. Differentiation and species status of the Neotropical yellow-eared bats Vampyressa pusilla and V. thyone (Phyllostomidae) with molecular phylogeny and review of the genus. Acta Chiropterologica 5:15-29. [ Links ]
48. LÓPEZ-GONZÁLEZ C. 2004. Murciélagos del Paraguay. Publicaciones del Comité Español del Programa MaB. [ Links ]
49. LÓPEZ-WILCHIS R, LM GUEVARA-CHUMACERO, NA PÉREZ, J JUSTE, C IBÁÑEZ e IDLA BARRIGA-SOSA. 2012. Taxonomic status assessment of the Mexican populations of funnel-eared bats, genus Natalus (Chiroptera: Natalidae). Acta Chiropterologica 14:305-316. [ Links ]
50. MACLEOD CD, WF PERRIN, R PITMAN, J BARLOW, L BALLANCE, A D' AMICO, T GERRODETTE, G JOYCE, KD MULLIN, DL PALKA y GT WARING. 2006. Known and inferred distributions of beaked whale species (Cetacea: Ziphiidae). Journal of Cetacean Research and Management 7:271-286. [ Links ]
51. MCCAIN CM, RM TIMM y M WEKSLER. 2007. Redescription of the enigmatic long-tailed rat Sigmodontomys aphrastus (Cricetidae: Sigmodontinae) with comments on taxonomy and natural history. Proceedings of the Biological Society of Washington 120:117-136. [ Links ]
52. MCCARTHY TJ. 1987. Distributional records of bats from the Caribbean lowlands of Belize and adjacent Guatemala and Mexico. Fieldiana Zoology 39:137-162. [ Links ]
53. MCCARTHY TJ, WB DAVIS, JE HILL, JK JONES JR y GA CRUZ. 1993. Bat (Mammalia: Chiroptera) records, early collectors, and faunal lists for northern Central America. Annals Carnegie Museum 62:191-228. [ Links ]
54. MERINO ML y RV ROSSI. 2010. Origin, systematics and morphological radiation. Pp. 2-11, en: Neotropical cervidology: Biology and medicine of Latin America deer (JMB Duarte y S González, eds.). FUNEP, Jabotical, Brasil & Gland, Switzerland: IUCN. [ Links ]
55. MONTERO-CORDERO A, D MARTÍNEZ FERNÁNDEZ y G HERNÁNDEZ-MORA. 2010. Mammalia, Carnivora, Otariidae, Arctocephalus galapagoensis Heller, 1904: First continental record for Costa Rica. Check List 6(4). [ Links ]
56. MORA JM 2000. Los mamíferos silvestres de Costa Rica. EUNED, San José, Costa Rica. [ Links ]
57. PALACIOS-ALFARO JD, J RODRÍGUEZ-FONSECA, F GARITA-ALPÍZAR, G HERNÁNDEZ-MORA y E ARGUEDAS-MONTEZUMA. 2012. Costa Rica progress report on Cetacean research January 1999 to February 2012. SC-64-ProgRepCostaRica. International Whale Commission (IWC)'s Scientific Committee Documents. [ Links ]
58. PÉREZ-LUSTRE M y A SANTOS-MORENO. 2010. Movements and capture-recapture data analysis of the vesper rat (Nyctomys sumichrasti: Rodentia, Muridae) in a tropical forest in northeastern Oaxaca, Mexico. Acta Zoológica Mexicana 26:627-638. [ Links ]
59. PINE RH, RM TIMM y M WEKSLER. 2012. A newly recognized clade of trans-Andean Oryzomyini (Rodentia: Cricetidae), with description of a new genus. Journal of Mammalogy 93:851-870. [ Links ]
60. PINEDA W, B RODRÍGUEZ-HERRERA y RM TIMM. 2008. Rediscovery, ecology, and identification of rare free-tailed bats (Chiroptera: Molossidae) in Costa Rica. Acta Chiropterologica 10:97-102. [ Links ]
61. PORTER CA y RJ BAKER. 2004. Systematics of Vampyressa and related genera of phyllostomid bats as determined by cytochrome-B sequences. Journal of Mammalogy 85:126-132. [ Links ]
62. REDONDO RAF, LPS BRINA, RF SILVA, AD DITCH-FIELD y FR SANTOS. 2008. Molecular systematics of the genus Artibeus (Chiroptera: Phyllostomidae). Molecular Phylogenetics and Evolution 49:44-58. [ Links ]
63. REID F. 2009. Mammals of Central America and Southeast Mexico. 2da ed. Oxford University Press, New York. [ Links ]
64. RICE DW. 1998. Marine mammals of the world: Systematic and distribution. Marine Mammals Science 4 (Special Publication):67-78. [ Links ]
65. ROCHA LA et al. 2014. Specimen collection: An essential tool. Science 344:814-816. [ Links ]
66. RODRÍGUEZ J y FA CHINCHILLA. 1996. Lista de mamíferos de Costa Rica. Revista Biología Tropical 44:877-890. [ Links ]
67. RODRÍGUEZ-HERRERA B. 2004. Ampliaciones de ámbito y registro de nuevas localidades de especies de mamíferos en Costa Rica. Brenesia 61:125-126. [ Links ]
68. RODRÍGUEZ-HERRERA B y DE WILSON. 1999. Lista de distribución de las especies de murciélagos de Costa Rica. Occasional Papers in Conservation Biology 5:1-34. [ Links ]
69. RODR ÍGUEZ-HERRERA B, DE WILSON , M FERNÁNDEZ y W PINEDA. 2005. La mastozoología en Costa Rica: historia, recolecta, localidades y composición de especies. Brenesia 63-64:89-112. [ Links ]
70. RODRÍGUEZ-HERRERA B, FA CHINCHILLA y L MAY-COLLADO. 2002. Lista de especies, endemismo y conservación de los mamíferos de Costa Rica. Revista Mexicana de Mastozoología 6:21-57. [ Links ]
71. RODRÍGUEZ-HERRERA B, R SÁNCHEZ y W PINEDA. 2011. First record of Natalus lanatus (Chiroptera: Natalidae) in Costa Rica, and current distribution of Natalus in the country. Ecotropica 17:113-117. [ Links ]
72. ROSSI RV, RS VOSS y DP LUNDE. 2010. A revision of the didelphid marsupial genus Marmosa. Part 1. The opecies in Tate's ‘Mexicana' and ‘Mitis' sections and other closely related forms. Bulletin of the American Museum of Natural History 334:1-83.
73. RUEDAS LA y J SALAZAR-BRAVO. 2007. Morphological and chromosomal taxonomic assessment of Sylvilagus brasiliensis gabbi (Leporidae). Mammalia 71:63-69. [ Links ]
74. SASAKI T, M NIKAIDO, S WADA, TK YAMADA, Y CAO, M HASEGAWA y N OKADA. 2006. Balaenoptera omurai is a newly discovered baleen whale that represents an ancient evolutionary lineage. Molecular Phylogenetics and Evolution 41:40-52. [ Links ]
75. SIMMONS NB. 2005. Order Chiroptera. Pp. 94-99, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
76. SIMMONS NB y RS VOSS. 1998. The mammals of Paracou, French Guiana: A Neotropical lowland rainforest fauna. Part 1. Bats. Bulletin of the American Museum of Natural History 237:1-219. [ Links ]
77. SMULTEA MA, AB DOUGLAS, CA BACON, TA JEFFERSON y L MAZZUCA. 2012. Bryde´s whale (Balaenoptera brydei/edeni) sightings in the Southern California Bight. Aquatic Mammals 38:92-97. [ Links ]
78. SOLARI S, SR HOOFER, PA LARSEN, AD BROWN, RJ BULL, JA GUERRERO, J ORTEGA, JP CARRERA, RD BRADLEY y RJ BAKER. 2009. Operational criteria for genetically defined species: Analysis of the diversification of the small fruit-eating bats, Dermanura (Phyllostomidae: Stenodermatinae). Acta Chiropterologica 11: 279-288. [ Links ]
79. STARRETT A y RS CASEBEER. 1968. Records of bats from Costa Rica. Contributions in Science 148:1-23. [ Links ]
80. SUNQUIST ME y FC SUNQUIST. 2009. Family Felidae (Cats). Pp. 54-169, en: Handbook of the mammals of the world. Vol. 1. Carnivores (DE Wilson y RA Mittermeier, eds.). Lynx Edicions, Barcelona. [ Links ]
81. TABER AB, M ALTRICHTER, H BECK y J GONGORA. 2011. Family Tayassuidae (Peccaries). Pp. 292-307, en: Handbook of the mammals of the world. Vol. 2. Hoofed Mammals (DE Wilson y RA Mittermeier, eds.). Lynx Edicions, Barcelona. [ Links ]
82. TEJEDOR A. 2005. A new funnel-eared bat (Natalidae: Natalus) from Mexico. Journal of Mammalogy 86:1109-1120. [ Links ]
83. TEJEDOR A. 2011. Systematics of funnel-eared bats (Chiroptera: Natalidae). Bulletin of the American Museum of Natural History 353:1-140. [ Links ]
84. VELAZCO PM y BD PATTERSON. 2013. Diversification of the yellow-shouldered bats, genus Sturnira (Chiroptera, Phyllostomidae), in the New World tropics. Molecular Phylogenetics and Evolution 68:683-698 [ Links ]
85. VELAZCO PM y BD PATTERSON. 2014. Two new species of yellow-shouldered bats, genus Sturnira Gray, 1842 (Chiroptera, Phyllostomidae) from Costa Rica, Panama and western Ecuador. ZooKeys 402:43-66. [ Links ]
86. VELAZCO PM y NB SIMMONS. 2011. Systematics and taxonomy of great striped-faced bats of the genus Vampyrodes Thomas, 1900 (Chiroptera: Phyllostomidae). American Museum Novitates 3710:1-35. [ Links ]
87. VOSS RS. 1988. Systematics and ecology of ichthyomyine rodents (Muroidea): Patterns of morphological evolution in a small adaptive radiation. Bulletin of the American Museum of Natural History 188: 259-493. [ Links ]
88. VOSS RS y SA JANSA. 2009. Phylogenetic relationships and classification of didelphid marsupials, an extant radiation of new world metatherian mammals. Bulletin of the American Museum of Natural History 322:1-117. [ Links ]
89. WADA S, M OISHI y TK YAMADA. 2003. A newly discovered species of living baleen whale. Nature 426:278-281. [ Links ]
90. WEKSLER M. 2006. Phylogenetic relationships of oryzomyine rodents (Muroidea: Sigmodontinae): Separate and combined analyses of morphological and molecular data. Bulletin of the American Museum of Natural History 296:1-149. [ Links ]
91. WEKSLER M y AR PERCEQUILLO. 2011. Key to the genera of the tribe Oryzomyini (Rodentia: Cricetidae: Sigmodontinae). Mastozoología Neotropical 18: 281-292. [ Links ]
92. WEKSLER M, AR PERCEQUILLO y RS VOSS. 2006. Ten new genera of oryzomyine rodents (Cricetidae: Sigmodontinae). Bulletin of the American Museum of Natural History 3537:1-29. [ Links ]
93. WILSON DE. 1983. Lista de Mamíferos de Costa Rica. Pp. 457-514, en: Historia natural de Costa Rica (DH Janzen, ed.). Editorial de la Universidad de Costa Rica, San José, Costa Rica. [ Links ]
94. WILSON DE, RM TIMM y FA CHINCHILLA. 2002. Mamíferos de Costa Rica. Pp. 227-254, en: Diversidad y conservación de los mamíferos neotropicales (G Ceballos y JA Simonetti, eds.). CONABIO, México. [ Links ]
95. WILSON DE y DM REEDER (eds.). 2005. Mammal species of the world: A taxonomic and geographic reference. Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
96. WILSON JS, OM CARRIL y SD SIPES. 2014. Revisiting the Great American Biotic Interchange through analyses of amphitropical bees. Ecography 37:001-006. [ Links ]
97. WOODMAN N. 2002. A new species of small-eared shrew from Colombia and Venezuela (Mammalia: Soricomorpha: Soricidae: Genus Cryptotis). Proceedings of the Biological Society of Washington 115:249-272. [ Links ]
98. WOODMAN N y RM TIMM. 2006. Characters and phylogenetic relationships of nectar-feeding bats, with descriptions of new Lonchophylla from western South America (Mammalia: Chiroptera: Phyllostomidae: Lonchophyllini). Proceedings of the Biological Society of Washington 119:437-476. [ Links ]
99. WOODS CA y CW KILPATRICK. 2005. Infraorder Hystricognathi. Pp. 1538-1600, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
100. WOZENCRAFT WC. 2005. Order Carnivora. Pp. 532- 628, en: Mammal species of the world: A taxonomic and geographic reference (DE Wilson y DM Reeder, eds.). Johns Hopkins University Press, Baltimore, Maryland. [ Links ]
Lista actualizada de las especies de mamíferos vivientes de Costa Rica; * = especie presente únicamente en las tierras altas de Costa Rica y Panamá; ** = especie exclusiva de Costa Rica; *** = especie con distribución restringida al norte de Costa Rica y Nicaragua.
ORDEN DIDELPHIMORPHIA
FAMILIA DIDELPHIDAE
SUBFAMILIA CALUROMYINAE
Caluromys derbianus (Waterhouse, 1841)
SUBFAMILIA DIDELPHINAE
TRIBU MARMOSINI
Marmosa alstoni (J. A. Allen, 1900)
Marmosa mexicana Merriam, 1897
Marmosa zeledoni Goldman, 1911
TRIBU METACHIRINI
Metachirus nudicaudatus (Desmarest, 1871)
TRIBU DIDELPHINI
Chironectes minimus (Zimmermann, 1780)
Didelphis marsupialis Linnaeus, 1758
Didelphis virginiana Kerr, 1792
Philander opossum (Linnaeus, 1758)
ORDEN PILOSA
SUBORDEN VERMILINGUA
FAMILIA MYRMECOPHAGIDAE
Myrmecophaga tridactyla Linnaeus, 1758
Tamandua mexicana (Saussure, 1860)
FAMILIA CYCLOPEDIDAE
Cyclopes didactylus (Linnaeus, 1758)
SUBORDEN FOLIVORA
FAMILIA MEGALONYCHIDAE
Choloepus hoffmanni Peters, 1858
FAMILIA BRADYPODIDAE
Bradypus variegatus Schinz, 1825
ORDEN CINGULATA
FAMILIA DASYPODIDAE
Cabassous centralis (Miller, 1899)
Dasypus novemcinctus Linnaeus, 1758
ORDEN SORICOMORPHA
FAMILIA SORICIDAE
Cryptotis gracilis Miller, 1911*
Cryptotis merriami (Choate, 1970)
Cryptotis nigrescens (J. A. Allen, 1895)*
Cryptotis orophila (J. A. Allen, 1895)
ORDEN CHIROPTERA
FAMILIA EMBALLONURIDAE
Balantiopteryx plicata Peters, 1867
Centronycteris centralis Thomas, 1912
Cormura brevirostris (Wagner, 1843)
Cyttarops alecto Thomas, 1913
Diclidurus albus Wied-Neuwied, 1820
Peropteryx kappleri Peters, 1867
Peropteryx macrotis (Wagner, 1843)
Rhynchonycteris naso (Wied-Neuwied, 1820)
Saccopteryx bilineata (Temminck, 1838)
Saccopteryx leptura (Schreber, 1774)
FAMILIA NOCTILIONIDAE
Noctilio albiventris Desmarest, 1818
Noctilio leporinus (Linnaeus, 1758)
FAMILIA MORMOOPIDAE
Pteronotus davyi Gray, 1838
Pteronotus gymnonotus Natterer, 1843
Pteronotus mesoamericanus Smith, 1972
Pteronotus personatus (Wagner, 1843)
FAMILIA PHYLLOSTOMIDAE
SUBFAMILIA PHYLLOSTOMINAE
TRIBU LONCHORHININI
Lonchorhina aurita Tomes, 1863
Macrophyllum macrophyllum (Schinz, 1821)
Mimon cozumelae Goldman, 1914
Mimon crenulatum (E. Geoffroy, 1810)
TRIBU MICRONYCTERINI
Glyphonycteris daviesi (Hill, 1964)
Glyphonycteris sylvestris Thomas, 1896
Lampronycteris brachyotis (Dobson, 1879)
Micronycteris hirsuta (Peters, 1869)
Micronycteris microtis Miller, 1898
Micronycteris minuta (Gervais, 1856)
Micronycteris schmidtorum Sanborn, 1935
Trinycteris nicefori (Sanborn, 1949)
TRIBU PHYLLOSTOMINI
Phylloderma stenops Peters, 1865
Phyllostomus discolor (Wagner, 1843)
Phyllostomus hastatus (Pallas, 1767)
TRIBU VAMPYRINI
Chrotopterus auritus (Peters, 1865)
Lophostoma brasiliense Peters, 1867
Lophostoma silvicolum d'Orbigny, 1836
Tonatia saurophila Koopman y Williams, 1951
Trachops cirrhosus (Spix, 1823)
Vampyrum spectrum (Linnaeus, 1758)
SUBFAMILIA GLOSSOPHAGINAE
TRIBU GLOSSOPHAGINI
Anoura cultrata Handley, 1960
Anoura geoffroyi Gray, 1838
Choeroniscus godmani (Thomas, 1903)
Glossophaga commissarisi Gardner, 1962
Glossophaga leachii (Gray, 1844)
Glossophaga soricina (Pallas, 1766)
Hylonycteris underwoodi Thomas, 1903
Lichonycteris obscura Thomas, 1895
TRIBU LONCHOPHYLLINI
Lonchophylla concava Goldman, 1914
Lonchophylla robusta Miller, 1912
SUBFAMILIA CAROLLINAE
Carollia castanea H. Allen, 1890
Carollia perspicillata (Linnaeus, 1758)
Carollia sowelli Baker et al., 2002
Carollia subrufa (Hahn, 1905)
SUBFAMILIA STENODERMATINAE
TRIBU STENODERMATINI
Artibeus jamaicensis Leach, 1821
Artibeus lituratus (Olfers, 1818)
Centurio senex Gray, 1842
Chiroderma salvini Dobson, 1878
Chiroderma trinitatum Goodwin, 1958
Chiroderma villosum Peters, 1860
Dermanura azteca K. Andersen, 1906
Dermanura phaeotis Miller, 1902
Dermanura tolteca (Saussure, 1860)
Dermanura watsoni (Thomas, 1901)
Ectophylla alba H. Allen, 1892
Enchisthenes hartii (Thomas, 1892)
Mesophylla macconnelli Thomas, 1901
Platyrrhinus helleri (Peters, 1866)
Platyrrhinus vittatus (Peters, 1860)
Uroderma bilobatum Peters, 1866
Vampyressa thyone Thomas, 1909
Vampyriscus nymphaea (Thomas, 1909)
Vampyrodes major G. Allen, 1908
TRIBU STURNIRINI
Sturnira burtonlimi Velazco y Patterson, 2014*
Sturnira hondurensis Goodwin, 1940
Sturnira luisi Davis, 1980
Sturnira mordax (Goodwin, 1938)*
Sturnira parvidens Goldman, 1917
SUBFAMILIA DESMODONTINAE
Desmodus rotundus (E. Geoffroy, 1810)
Diaemus youngi (Jentink, 1893)
Diphylla ecaudata Spix, 1823
FAMILIA NATALIDAE
Natalus lanatus Tejedor, 2005
Natalus mexicanus Miller, 1902
FAMILIA FURIPTERIDAE
Furipterus horrens (F. Cuvier, 1828)
FAMILIA THYROPTERIDAE
Thyroptera discifera (Lichtenstein y Peters,1855)
Thyroptera tricolor Spix, 1823
FAMILIA VESPERTILIONIDAE
SUBFAMILIA VESPERTILIONINAE
TRIBU EPTESICINI
Eptesicus brasiliensis (Desmarest, 1819)
Eptesicus chiriquinus Simmons y Voss, 1998
Eptesicus furinalis (d'Orbigny y Gervais, 1847)
Eptesicus fuscus (Palisot de Beauvois, 1796)
TRIBU LASIURINI
Lasiurus blossevillii (Lesson, 1826)
Lasiurus castaneus Handley, 1960*
Lasiurus ega (Gervais, 1856)
Lasiurus intermedius H. Allen, 1862
TRIBU NYCTICEIINI
Rhogeessa bickhami Baird et al., 2012
Rhogeessa io Thomas, 1903
SUBFAMILIA MYOTINAE
Myotis albescens (E. Geoffoy, 1806)
Myotis elegans Hall, 1962
Myotis keaysi J. A. Allen, 1914
Myotis nigricans (Schinz, 1821)
Myotis oxyotus (Peters, 1866)
Myotis riparius Handley, 1960
SUBFAMILIA ANTROZOINAE
Bauerus dubiaquercus (Van Gelder, 1959)
FAMILIA MOLOSSIDAE
SUBFAMILIA MOLOSSINAE
Cynomops mexicanus (Jones y Genoways, 1967)
Eumops auripendulus (G. Shaw, 1800)
Eumops glaucinus (Wagner, 1843)
Eumops hansae Sanborn, 1932
Eumops nanus (Miller, 1900)
Eumops underwoodi Goodwin, 1940
Molossus bondae J. A. Allen, 1904
Molossus coibensis J. A. Allen, 1904
Molossus molossus (Pallas, 1766)
Molossus pretiosus Miller, 1902
Molossus rufus E. Geoffroy, 1805
Molossus sinaloae J. A. Allen, 1906
Promops centralis Thomas, 1915
Tadarida brasiliensis (I. Geoffroy, 1824)
ORDEN PRIMATES
FAMILIA CEBIDAE
SUBFAMILIA CEBINAE
Cebus imitator Thomas, 1903
SUBFAMILIA SAIMIRIINAE
Saimiri oerstedii (Voigt, 1831)*
FAMILIA ATELIDAE
SUBFAMILIA ATELINAE
Ateles geoffroyi Kuhl, 1820
SUBFAMILIA ALOUATTINAE
Alouatta palliata (Gray, 1849)
ORDEN RODENTIA
SUBORDEN SCIUROMORPHA
FAMILIA SCIURIDAE
SUBFAMILIA SCIURINAE
Microsciurus alfari (J. A. Allen, 1895)
Sciurus deppei Peters, 1863
Sciurus granatensis Humboldt, 1811
Sciurus variegatoides Ogilby, 1839
Syntheosciurus brochus Bangs, 1902*
SUBORDEN CASTORIMORPHA
FAMILIA GEOMYIDAE
Orthogeomys cavator (Bangs, 1902)*
Orthogeomys cherriei (J. A. Allen, 1893)**
Orthogeomys heterodus (Peters, 1865)**
Orthogeomys underwoodi (Osgood, 1931)*
FAMILIA HETEROMYIDAE
SUBFAMILIA HETEROMYINAE
Heteromys desmarestianus Gray, 1868
Heteromys nubicolens Anderson y Timm, 2006**
Heteromys oresterus Harris, 1932**
Liomys salvini (Thomas, 1893)
SUBORDEN MYOMORPHA
FAMILIA CRICETIDAE
SUBFAMILIA SIGMODONTINAE
TRIBU ICHTHYOMYINI
Rheomys raptor Goldman, 1912
Rheomys underwoodi Thomas, 1906*
TRIBU SIGMODONTINI
Sigmodon hirsutus (Burmeister, 1854)
TRIBU ORYZOMYINI
Handleyomys alfaroi (J. A. Allen, 1891)
Melanomys caliginosus (Tomes, 1860)
Nephelomys devius (Bangs, 1902)*
Oecomys trinitatis (J. A. Allen y Chapman, 1893)
Oligoryzomys fulvescens (Saussure, 1860)
Oligoryzomys vegetus (Bangs, 1902)*
Oryzomys couesi (Alston, 1877)
Sigmodontomys alfari J. A. Allen, 1897
Tanyuromys aphrastus (Harris, 1932)
Transandinomys bolivaris (J. A. Allen, 1901)
Transandinomys talamancae (J. A. Allen, 1891)
Zygodontomys brevicauda (J. A. Allen y Chapman, 1893)
SUBFAMILIA TYLOMYINAE
Nyctomys sumichrasti Saussure, 1860
Ototylomys phyllotis Merriam, 1901
Tylomys watsoni Thomas, 1899
SUBFAMILIA NEOTOMINAE
TRIBU BAIOMYINI
Scotinomys teguina (Alston, 1877)
Scotinomys xerampelinus (Bangs, 1902)*
TRIBU REITHRODONTOMYINI
Peromyscus mexicanus (J. A. Allen, 1891)
Reithrodontomys brevirostris Goodwin, 1943***
Reithrodontomys creper Bangs, 1902*
Reithrodontomys gracilis J. A. Allen y Chapman, 1897
Reithrodontomys mexicanus (Saussure, 1860)
Reithrodontomys musseri Gardner y Carleton, 2009**
Reithrodontomys paradoxus Jones y Genoways, 1970***
Reithrodontomys rodriguezi Goodwin, 1943*
Reithrodontomys sumichrasti (Saussure, 1861)
SUBORDEN HYSTRICOMORPHA
FAMILIA ERETHIZONTIDAE
Sphiggurus mexicanus (Kerr, 1792)
FAMILIA DASYPROCTIDAE
Dasyprocta punctata Gray, 1842
FAMILIA CUNICULIDAE
Cuniculus paca (Linnaeus, 1766)
FAMILIA ECHIMYIDAE
Hoplomys gymnurus (Thomas, 1897)
Proechimys semispinosus (Tomes, 1860)
ORDEN LAGOMORPHA
FAMILIA LEPORIDAE
SUBFAMILIA LEPORINAE
Sylvilagus dicei Harris, 1932*
Sylvilagus floridanus (J. A. Allen, 1890)
Sylvilagus gabbii (J. A. Allen, 1877)
ORDEN CARNIVORA
SUBORDEN FELIFORMIA
FAMILIA FELIDAE
SUBFAMILIA PANTHERINAE
Panthera onca (Linnaeus, 1758)
SUBFAMILIA FELINAE
Leopardus pardalis (Linnaeus, 1758)
Leopardus tigrinus (Schreber, 1775)
Leopardus wiedii (Schinz, 1821)
Puma concolor (Linnaeus, 1771)
Puma yagouaroundi (E. Geoffroy, 1803)
SUBORDEN CANIFORMIA
FAMILIA CANIDAE
Canis latrans Say, 1823
Urocyon cinereoargenteus (Schreber, 1775)
FAMILIA PROCYONIDAE
Bassaricyon gabbii J. A. Allen, 1876
Bassariscus sumichrasti (Saussure, 1860)
Nasua narica (Linnaeus, 1766)
Potos flavus (Schreber, 1774)
Procyon cancrivorus (G. Cuvier, 1798)
Procyon lotor (Linnaeus, 1758)
FAMILIA MEPHITIDAE
SUBFAMILIA MEPHITINAE
Conepatus semistriatus (Boddaert, 1785)
Mephitis macroura Lichtenstein, 1832
Spilogale angustifrons Howell, 1902
FAMILIA MUSTELIDAE
SUBFAMILIA MARTINAE
Eira barbara (Linnaeus, 1758)
SUBFAMILIA GALICTIDINAE
Galictis vittata (Schreber, 1776)
SUBFAMILIA LUTRINAE
Lontra longicaudis (Olfers, 1818)
SUBFAMILIA MUSTELINAE
Mustela frenata Lichtenstein, 1831
FAMILIA OTTARIDAE
Arctocephalus galapagoensis Heller, 1904
Zalophus californianus Lesson, 1828
Zalophus wollebaeki Sivertsen, 1953
ORDEN SIRENIA
FAMILIA TRICHECHIDAE
Trichechus manatus Linnaeus, 1758
ORDEN PERISSODACTYLA
FAMILIA TAPIRIDAE
Tapirus bairdii (Gill, 1865)
ORDEN ARTIODACTYLA
FAMILIA TAYASSUIDAE
Pecari tajacu (Linnaeus, 1758)
Tayassu pecari (Link, 1795)
FAMILIA CERVIDAE
SUBFAMILIA CAPREOLINAE
TRIBU ODOCOILEINI
Mazama temama (Kerr, 1792)
Odocoileus virginianus (Zimmermann, 1780)
ORDEN CETACEA
SUBORDEN ODONTOCETI
FAMILIA DELPHINIDAE
Delphinus delphis Linnaeus, 1758
Feresa attenuata Gray, 1874
Globicephala macrorhynchus Gray, 1846
Grampus griseus Cuvier, 1812
Lagenodelphis hosei Fraser, 1956
Orcinus orca Linnaeus, 1758
Peponocephala electra Gray, 1846
Pseudorca crassidens Owen, 1846
Sotalia guianensis (van Bénéden, 1864)
Stenella attenuata Gray, 1846
Stenella clymene Gray, 1850
Stenella coeruleoalba Meyen, 1833
Stenella frontalis Cuvier, 1829
Stenella longirostris Gray, 1828
Steno bredanensis Lesson, 1828
Tursiops truncatus Montagu, 1821
FAMILIA PHYSETERIDAE
Physeter macrocephalus Linnaeus, 1758
FAMILIA KOGIIDAE
Kogia breviceps de Blainville, 1838
Kogia simus Owen, 1866
FAMILIA ZIPHIIDAE
Indopacetus pacificus (Longman, 1926)
Mesoplodon densirostris de Blainville, 1817
Mesoplodon europaeus Gervais, 1855
Mesoplodon ginkgodens (Nishiwaki y Kamiya, 1958)
Mesoplodon peruvianus Reyes et al., 1991
Ziphius cavirostris Cuvier, 1823
SUBORDEN MYSTICETI
FAMILIA BALAENOPTERIDAE
Balaenoptera acutorostrata Lacépède, 1804
Balaenoptera borealis Lesson, 1828
Balaenoptera brydei Olsen, 1913
Balaenoptera musculus Linnaeus, 1758
Balaenoptera physalus Linnaeus, 1758
Megaptera novaeangliae Borowski, 1781














