Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383
Mastozool. neotrop. vol.21 no.2 Mendoza dic. 2014
ARTÍCULO
Variación morfológica cualitativa y cuantitativa en Abrothrix longipilis (Cricetidae, Sigmodontinae)
Pablo Teta y Ulyses F. J. Pardiñas
Unidad de Investigación Diversidad, Sistemática y Evolución, Centro Nacional Patagónico, CP 9120 Puerto Madryn, Chubut, Argentina [correspondencia: Pablo Teta <antheca@yahoo.com.ar>].
Recibido 28 febrero 2014.
Aceptado 30 junio 2014.
Editor asociado: E Lessa
RESUMEN.
Se estudió la taxonomía alfa de Abrothrix longipilis (Waterhouse, 1837), uno de los abrotriquinos más ampliamente distribuidos y abundantes en las porciones australes de Argentina y Chile. Se realizó un análisis morfológico cualitativo (6 caracteres discretos) y cuantitativo (18 medidas cráneo-dentarias) de 477 especímenes adultos, agrupados primero según un criterio geográfico y luego según su pertenencia a los clados definidos por un estudio filogeográfico previo basado en 2 marcadores moleculares. Los análisis multivariados (análisis de componentes principales y análisis discriminantes "libres de tamaño") indican que A. longipilis es un complejo que incluye por lo menos 2 especies, A. longipilis stricto sensu, aquí restringida al centro de Chile, y A. hirta (Thomas, 1895), distribuida en el sur de Chile y sudoeste de Argentina. Las poblaciones de A. hirta mostraron una correspondencia moderada entre los patrones filogeográficos y de variación fenotípica. Preliminarmente, puede considerarse que el tamaño en A. hirta se vincula más estrechamente con las características del ambiente (con los individuos más grandes en áreas boscosas, de mayor productividad primaria y los más pequeños en ambientes áridos, de menor productividad) antes que con su pertenencia a los distintos clados. En este escenario, la divergencia morfológica podría estar mayormente determinada por la selección diferencial a lo largo de un gradiente ambiental extremo, aun en presencia de flujo génico (modelo de divergencia con flujo génico).
ABSTRACT.
Qualitative and quantitative morphological variation in Abrothrix longipilis (Cricetidae, Sigmodontinae).
We studied the alpha taxonomy of Abrothrix longipilis (Waterhouse, 1837), one of the most widely distributed and abundant Abrotrichini along the southern portion of Argentina and Chile. We conducted a qualitative (6 discrete characters) and quantitative (18 skull and dental measurements) morphological analysis of 477 adult specimens, grouped first by geographical criteria and later by membership to the clades defined in a previous phylogeographical study based on 2 molecular markers. Multivariate analyses (principal component analysis, discriminant analyses) suggested that in its current conception A. longipilis is a species-complex that includes at least two nominal taxa, A. longipilis stricto sensu, here restricted to Central Chile, and A. hirta (Thomas, 1895), distributed in southern Chile and southwestern Argentina. Populations of A. hirta showed a moderate correspondence between phylogeographic and phenotypic patterns. Tentatively, we considered that general size in A. hirta is mostly linked to environmental conditions (with larger individuals in forested areas, under high primary productivity conditions and the smaller ones in arid environments of low productivity) rather than to their inclusion in different clades. Under this scenario, morphological differentiation was probably driven by differential selection across a sharp ecological gradient, in spite of gene flow (divergence-with-gene-flow model).
Palabras clave: Abrotrichini; Argentina; Chile; Cráneo; Morfometría; Muroidea; Rodentia; Taxonomía.
Key words: Abrotrichini; Argentina; Chile; Morphometrics; Muroidea; Rodentia; Skull; Taxonomy.
INTRODUCCIÓN
Durante la última década los análisis filogeográficos basados en marcadores moleculares, principalmente ADN mitocondrial, han demostrado que muchas especies están geográficamente estructuradas en linajes génicos (Avise, 2000). En algunos casos, estos linajes coinciden con los arreglos taxonómicos propuestos previamente sobre la base de otras evidencias (e.g., subespecies en Oligoryzomys longicaudatus; Palma et al., 2012), pero en muchos otros se presentan situaciones conflictivas, donde la clasificación vigente no concuerda con las genealogías moleculares (véase Baker y Bradley, 2006). Los avances realizados en el campo de la sistemática molecular, ocurridos a gran velocidad en los últimos años, han dejado rezagado el estudio de los patrones de variación morfológica, que no siempre han sido adecuadamente caracterizados o abordados desde una perspectiva contemporánea (e.g., sobre series extensas de ejemplares y a través de técnicas estadísticas multivariadas). Muchos de los taxones propuestos hacia finales del siglo XIX y principios del XX fueron erigidos bajo un paradigma taxonómico tipológico, sobre la base de colecciones limitadas, tanto en número de individuos como de cobertura geográfica (e.g., Philippi, 1900; Thomas, 1927; Osgood, 1943) y no han sido formalmente revisados desde entonces. Hacia mediados del siglo XX, ya bajo el consenso generalizado del concepto biológico de especie, algunas entidades fueron revisadas total o parcialmente, redundando en el agrupamiento de distintas formas nominales bajo un mismo taxón (e.g., Cabrera, 1961). El caso del ratón peludo Abrothrix longipilis (Waterhouse, 1837) ejemplifica claramente este derrotero. Esta especie se distribuye desde el centro-norte de Chile (29° S) y el centro-oeste de Argentina (35° S), por la cordillera de los Andes y la Patagonia hasta la isla de Tierra del Fuego (Osgood, 1943; Mann Fischer, 1978; Pardiñas et al., 2003; Palma et al., 2010). Este ratón es ecológicamente uno de los representantes más ubicuos del género, con registros en matorrales, bosques, roquedales, pastizales y estepas arbustivas y herbáceas desde el nivel del mar hasta los 2000 metros de altura (Mann Fischer, 1978; Pearson, 1995; Teta et al., 2006; Patterson et al., en prensa). Distintos aspectos de su autoecología han sido bien estudiados en el centro y sur de Chile y el noroeste de la Patagonia Argentina (Pearson, 1983, 1992; Meserve et al., 1988, 1991a, 1991b; Patterson et al., 1989, 1990).
Abrothrix longipilis, cuyo ejemplar tipo fue colectado por Charles Darwin en su paso por Chile (Waterhouse, 1837), incluye en su sinonimia una profusa lista de formas nominales, algunas muy mal conocidas (e.g., porcinus, fusco-ater, brachytarsus), establecidas a lo largo de los más de 170 años transcurridos desde su descripción (para una lista completa de sinónimos y sus localidades tipo, véase el Apéndice 1). Thomas (1927), sobre la base del tamaño principalmente, distinguió a las poblaciones del centro-norte de Chile como correspondientes a A. longipilis y las de Argentina, al este de los Andes, como A. hirta (Thomas, 1895) (incluyendo como subespecies a moerens, nubila y suffusa). Para este autor, la forma nominal francei, con localidad tipo en Tierra del Fuego, merecía reconocimiento específico. Osgood (1943) consideró a A. longipilis como una especie politípica, con al menos 8 subespecies. De estas, 4 estaban limitadas a Chile (de norte a sur: longipilis, apta, castanea y francei) y otras 4 habitaban principalmente, aunque no exclusivamente, en la Argentina (de norte a sur: hirta, moerens, suffusa y nubila). La impronta de este esquema taxonómico se ha mantenido hasta la actualidad y ha signado la literatura del último medio siglo (e.g., Cabrera, 1961; Mann Fischer, 1978; Contreras y Rosi, 1981; Justo et al., 1987).
Palma et al. (2010), en un análisis de los patrones de variación de los genes para el citocromo b y del intrón 7 para el β-fibrinógeno de ejemplares chilenos, recuperaron una genealogía para A. longipilis conformada por 7 clados principales, que según esos autores se correspondían a grandes rasgos con el arreglo subespecífico de Osgood (1943) para las poblaciones al oeste de la cordillera de los Andes. Lessa et al. (2010), sobre la base de ejemplares coleccionados mayormente del lado argentino, obtuvieron una topología con 3 clados, 2 patagónicos (uno al norte y otro al sur) y un tercero restringido al centro-oeste de Argentina. Sierra-Cisternas (2010), en un análisis que consideró especímenes de todo el rango de distribución de la especie, incluyendo genealogías mitocondriales y de un locus no ligado al ADN mitocondrial (β-fibrinógeno), recobró 8 clados fuertemente apoyados, estructurados geográficamente y con una significativa diferenciación genética. Tanto Palma et al. (2010) como Sierra-Cisternas (2010) coincidieron en destacar que el clado más divergente es aquel que incluye a las poblaciones del centro-norte de Chile y que contiene individuos topotípicos de la forma nominal. Para Sierra-Cisternas (2010), A. longipilis merecería reconocimiento específico pleno, una hipótesis también avanzada por Palma et al. (2010). Más en general, los resultados de Sierra-Cisternas (2010) muestran una notable falta de congruencia con la clasificación clásica, contradiciendo a la postura de Palma et al. (2010).
En este trabajo se presenta un análisis de los patrones de variación geográfica de la morfología cualitativa y cuantitativa de A. longipilis lato sensu y su contrastación con los grupos geográficos detectados mediante marcadores moleculares. Esta aproximación permitirá poner a prueba el arreglo taxonómico intraespecífico existente y delinear los procesos que subyacen a esta diversificación. Este trabajo tiene 3 objetivos principales: 1) estudiar los patrones geográficos de variación morfológica cualitativa-cuantitativa en A. longipilis lato sensu; 2) evaluar la congruencia entre las evidencias morfológicas y los linajes filogenéticos recobrados mediante análisis moleculares por Sierra-Cisternas (2010); 3) discutir los alcances de los resultados obtenidos a la luz del esquema taxonómico vigente (i.e., aquel propuesto por Osgood, 1943).
MATERIALES Y MÉTODOS
Se estudiaron 477 especímenes de A. longipilis lato sensu, incluyendo pieles y esqueletos, cubriendo la mayor parte del rango de distribución de la especie (Fig. 1). El listado completo de materiales examinados se anota en el Apéndice 2. Las muestras fueron agrupadas en 16 conjuntos (Fig. 1): CC: centro-oeste de Chubut (Argentina), LS: centro-norte de Chile, MA: Malleco (Chile), ME: Mendoza (Argentina), ML: Maule (Chile), NC: noroeste de Chubut (Argentina), NN: norte de Neuquén (Argentina), ÑU: Ñuble (Chile), OS: Osorno (Chile), QT: Quetropillán (Chile), RN: Río Negro (Argentina), SC: sudoeste de Chubut (Argentina), SN: sur de Neuquén (Argentina), SO: Altiplanicie de Somuncurá (Argentina), ST: Santa Cruz (Argentina), VA: Valdivia (Chile). Para realizar estos agrupamientos se siguió mayormente un criterio de cercanía espacial, pero también se tuvo en cuenta la continuidad de ambientes o la existencia de barreras geográficas entre localidades (e.g., cordillera de los Andes, grandes ríos). Posteriormente, los materiales fueron clasificados dentro de alguno de los 8 clados reconocidos por Sierra-Cisternas (2010; se eligió este estudio por tratarse del muestreo más denso y con mayor cobertura espacial) mediante el estudio de marcadores moleculares, según un criterio geográfico y disponibilidad de evidencias genéticas (Fig. 1): AL: Araucanía-Los Lagos; AU: austral; CE: centro; CN: centro-norte; ME: Mendoza; NO: Neuquén-Octava; SE: Séptima; TC: Tomé-Concepción. La correspondencia entre conjuntos geográficos y clados moleculares es parcial, ya que en algunos sectores del centro-oeste de Argentina y centro de Chile se ha registrado, incluso para una misma localidad, la simpatría entre 2 o más clados (Tabla 1). Para minimizar las posibilidades de confusión, en este estudio sólo se utilizaron aquellos individuos que procedían de localidades con registros para un único clado o ejemplares secuenciados para aquellas áreas con evidencias de simpatría. Esta situación obligó a dejar fuera del análisis algunas localidades con presencia comprobada de dos o más clados y para las que no se disponía de animales con secuencias. Idealmente, para las regiones con ocurrencia de 2 o más clados se requiere de un mayor número de especímenes secuenciados para ser incorporados en los análisis morfométricos.
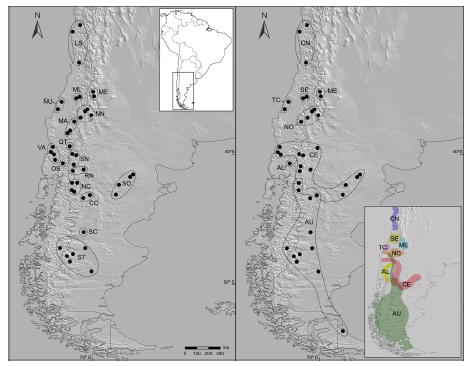
Fig. 1. Localidades de procedencia de las muestras de Abrothrix longipilis l. s. estudiadas en este trabajo. En el mapa de la izquierda se muestran las localidades agrupadas según un criterio geográfico; en el de la derecha, según su pertenencia a los clados moleculares definidos por Sierra-Cisternas (2010), tal como se indica en el mapa inserto en colores (tomado de Sierra-Cisternas, 2010).
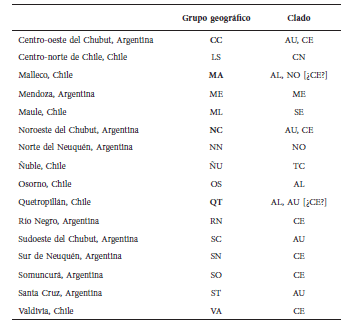
Tabla 1. Correspondencia entre grupos geográficos tal como fueron definidos en este estudio y los clados moleculares propuestos por Sierra-Cisternas (2010). En negrita se destacan aquellos grupos en los que se ha detectado o se supone la simpatría de 2 o más clados.
Para cada ejemplar se tomaron las siguientes medidas craneanas siguiendo las definiciones indicadas por Patterson (1992; véase también Feijoo et al., 2010; Fig. 2): longitud total del cráneo (LTC); longitud cóndilobasal (LCB); longitud basal (LB); ancho cigomático (AZ); ancho de la caja craneana (ACC); longitud de los forámenes incisivos (LFI); ancho de los forámenes incisivos (AFI); longitud de la diastema (LD); longitud de la serie molar superior (SMS); ancho de la placa cigomática (APZ); ancho de los nasales (AN); ancho del rostro (AR); ancho de los senos frontales (ASF); ancho interorbitario (AI); longitud de la mandíbula (LM); longitud condilar (LC); altura de los procesos mandibulares (APM); profundidad del ramus (PR). Las medidas individuales se encuentran disponibles por solicitud al autor. Todas las medidas fueron tomadas usando un calibre digital y registradas con una precisión de 0.01 mm.
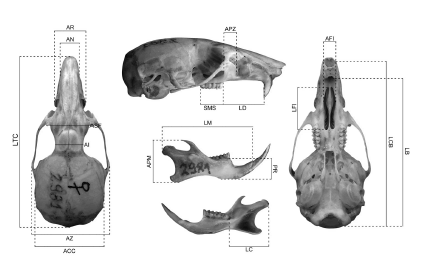
Fig. 2. Medidas craneanas usadas en este estudio representadas sobre un cráneo de A. longipilis. Para los acrónimos de las mismas, véase Materiales y Métodos.
Adicionalmente, para cada ejemplar revisado se consignó el estado de los siguientes caracteres cualitativos (Fig. 3):

Fig. 3. Caracteres anatómicos considerados en este estudio: a, e: morfología del borde posterior de los nasales (a: acuminado, e: recto; la flecha blanca señala el borde posterior de los nasales) y profundidad de las muescas cigomáticas (a: profundas, e: poco marcadas); b, f: robustez del proceso hamular del escamoso (b: angosto, f: grueso); c, g: proceso medio del palatino (c: presente, g: ausente) y excrecencias óseas en el borde posterior del paladar (c: ausentes, e: presentes); d, h: foramen lacerado (d: parcialmente, h: abierto todo a lo largo). Abreviaturas: bt = bulla timpánica; f = frontal; fi = forámenes incisivos; fl = foramen lacerado; fp = foramen postglenoideo; h = proceso hamular del escamoso; mz = muescas cigomáticas; n = nasales; pm = proceso medio del palatino; pp = placa parapterigoidea; rp = excrecencias óseas.
1) forma del margen posterior de los nasales: a) acuminado; o b) recto o cerrándose abruptamente por detrás de la sutura premaxilo-frontal;
2) profundidad de las muescas cigomáticas (en vista dorsal): a) superficiales, más anchas en sentido transverso que extendidas antero-posteriormente; o b) profundas, con la longitud antero-posterior mayor que el ancho;
3) robustez del proceso hamular del escamoso: a) hamular angosto, proyectado anteriormente no cubre el foramen postglenoideo; o b) hamular grueso, proyectado anteriormente es igual o mayor que el foramen postglenoideo;
4) presencia de excrecencias óseas sobre el sector posterior del paladar (posiblemente homólogas a un torus postpalatino): a) sin excrecencias; o b) con 2 o más excrecencias en forma de barras transversales angostas que pueden unirse o no en la línea media;
5) proceso medio del palatino (= espina nasal): a) ausente; o b) presente.
6) osificación del foramen lacerado (= fenestra piriforme): a) foramen lacerado abierto todo a lo largo; o b) foramen lacerado parcialmente osificado, poniendo en contacto el borde anterior de la bulla timpánica y la parte posterior del alisfenoides.
Para los caracteres 2 y 3 se presentaron estados intermedios, que fueron codificados como tales (Tabla 2).
Tabla 2. Frecuencia de ocurrencia para los distintos estados en 6 caracteres anatómicos en Abrothrix longipilis l. s.: 1) margen posterior de los nasales: ac = acuminada; ro = recta o cerrándose abruptamente por detrás de la sutura premaxilo-frontal; 2) profundidad de las muescas cigomáticas: l = poco marcadas; p = profundas; l-p = situación intermedia; 3) robustez del proceso hamular del escamoso: f = angosto; g = grueso; f-g = situación intermedia; 4) presencia de excrecencias óseas sobre el sector posterior del paladar: no = sin excrecencias; si = 2 o más excrecencias óseas en forma de barras transversales angostas que pueden unirse o no en la línea media; 5) proceso medio del palatino: no = ausente; si = presente; 6) osificación del foramen lacerado: ab = abierto todo a lo largo; ce = parcialmente osificado.

Los ejemplares estudiados fueron categorizados en 6 clases de edad según erupción y desgaste dentario, siguiendo a Patterson (1992). Para los análisis morfométricos, únicamente se incluyeron individuos adultos (clases 3 a 6). Machos y hembras fueron analizados por separado; un análisis multivariado de la varianza de las 2 muestras con más especímenes (correspondientes a las localidades de La Picada [Osorno, Chile] y Estancia La Ensenada [Santa Cruz, Argentina]) indicó diferencias significativas entre ambos sexos (P < 0.01; los resultados no se muestran). La existencia de dimorfismo sexual en A. longipilis fue destacada por Gallardo et al. (1988), quienes en un estudio morfométrico realizado sobre poblaciones chilenas trataron a machos y hembras en forma independiente.
Para evaluar las causas de variación en el conjunto de datos y ordenarlas por importancia se aplicó un análisis de componentes principales (ACP). Las similitudes morfométricas de forma fueron evaluadas a través de un análisis discriminante (AD) "libre de tamaño", verificando previamente que la distribución de los datos fuese normal. Esta metodología corrige los sesgos que pudieran presentarse por influencia del crecimiento ontogénico en la discriminación intergrupal de patrones (Reis et al., 1990). Brevemente, este procedimiento implica realizar los AD a partir de los residuos de la regresión de las 18 variables métricas consideradas en relación con el primer componente principal (Reis et al., 1990). La contribución de los caracteres en cada función discriminante "libre de tamaño" fue evaluada a través del coeficiente de correlación producto-momento de Pearson entre los caracteres transformados a logaritmo y las puntuaciones discriminantes (Strauss, 1985). Finalmente, se realizó un análisis de conglomerados a partir de las distancias de Mahalanobis al cuadrado (D2); posteriormente, estas distancias fueron empleadas en la construcción de dendrogramas basados en el método del encadenamiento promedio (Sneath y Sokal, 1973). Para un mayor detalle sobre los alcances y limitaciones de los métodos utilizados véase Strauss (2010).
Para los análisis estadísticos se utilizó el software InfoStat (Di Rienzo et al., 2008). Todos los análisis fueron realizados sobre las medidas transformadas a logaritmos naturales y en 2 etapas: primero con las muestras agrupadas por procedencia geográfica y luego según su pertenencia a los clados moleculares definidos por Sierra-Cisternas (2010).
La correlación entre distancias geográficas (medidas en kilómetros lineales) y morfológicas (distancia de Mahalanobis al cuadrado) se evaluó a través de un test no paramétrico de Mantel (Mantel, 1967), poniendo a prueba el ajuste de los datos con un modelo de aislamiento por distancia. Este análisis se realizó mediante el programa Mantel 2.0 (Liedloff, 1999), llevando a cabo 1000 aleatorizaciones.
RESULTADOS
Variación morfológica cuantitativa
Con las muestras agrupadas por procedencia geográfica, los primeros 2 componentes principales explicaron el 77% de la variación craneométrica en los machos y el 80% en las hembras (Figs. 4 y 6, Tablas 3 y 14 [material suplementario]). Todas las variables tuvieron un peso positivo sobre el PC 1, con correlaciones moderadas a altas, aspecto que sugiere que este componente es un vector de tamaño (Tablas 3 y 14 [material suplementario]). La superposición entre polígonos fue entre moderada y alta, excepto en el caso de LS. Este grupo se diferenció claramente en el análisis realizado sobre machos y se solapó moderadamente con ÑU y VA en hembras. En líneas generales y a pesar de la superposición entre polígonos, las muestras de poblaciones de Chile tendieron a agruparse hacia valores positivos del PC 1 (e.g., OS, LS, ÑU, VA) y aquellas de Argentina, hacia los valores negativos del mismo eje (e.g., CC, NC, SC). Esta situación revela un gradiente de tamaño moderado, con los individuos más grandes al oeste de la cordillera de los Andes y los más pequeños, hacia el este. El AD "libre de tamaño" muestra, tanto para machos como para hembras, la existencia de 2 conjuntos mayores dispuestos a lo largo de la primera y segunda funciones discriminantes, que acumularon el 64% de la varianza ajustada por tamaño (Tablas 4, 5, 6, 15, 16 y 17 [material suplementario]). El primer grupo está constituido por los ejemplares de LS, mientras que el segundo incluye al resto de las poblaciones de Argentina y Chile, con una amplia superposición entre individuos en el espacio multivariado. En este último, tanto para machos como hembras, el porcentaje de especímenes incorrectamente clasificados por la función discriminante fue mayor al 30%. El aporte de cada carácter morfométrico a las funciones discriminantes se indica en las Tablas 13 y 24 (material suplementario). La relación dicotómica entre LS y el resto de los grupos también se corroboró en los análisis de conglomerados (Fig. 8, Tablas 7 y 18 [material suplementario]). En el caso de los machos, el resto de las muestras se repartió en 2 conjuntos mayores, uno incluyendo todas las localidades argentinas más MA y el otro exclusivamente integrado por muestras chilenas. Esta estructura se repitió en las hembras, aunque en ese caso las muestras de ML se distinguieron como un tercer conjunto.

Fig. 4. Polígonos correspondientes a las puntuaciones (= "scores") individuales de los 2 primeros componentes principales (izquierda) y de los ejes canónicos 1 y 2 del análisis discriminante "libre de tamaño" (derecha) para 15 grupos geográficos de machos adultos (clases de edad 3-6) de Abrothrix longipilis l. s. (N = 212). La cruz indica el centroide de cada grupo. El polígono de línea negra corresponde al grupo LS (= A. longipilis s.s.). Para otros acrónimos, véase el texto.

Fig. 6. Polígonos correspondientes a las puntuaciones (= "scores") individuales de los 2 primeros componentes principales (izquierda) y de los ejes canónicos 1 y 2 del análisis discriminante "libre de tamaño" (derecha) para 16 grupos geográficos de hembras adultas (clases de edad 3-6) de Abrothrix longipilis l. s. (N = 203). La cruz indica el centroide de cada grupo. El polígono de línea negra corresponde al grupo LS (= A. longipilis s.s.). Para otros acrónimos, véase el texto.
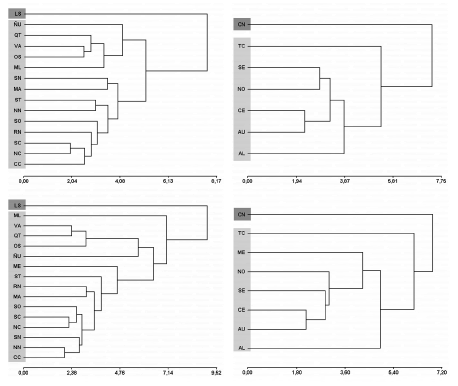
Fig. 8. Dendrograma basado en las distancias Mahalanobis y graficados a través del método del encadenamiento promedio entre grupos geográficos (columna izquierda; machos arriba, hembras abajo) y clados identificados en función de los análisis moleculares de Sierra-Cisternas (2010) (columna derecha; machos arriba, hembras abajo) de Abrothrix longipilis l. s. El color gris oscuro corresponde a las poblaciones de Abrothrix longipilis s.s. (LS, CN); el gris claro a aquellas que en este trabajo se refieren como A. hirta.
El ACP realizado con las muestras agrupadas por clados indicó una superposición entre moderada y alta de individuos de distintos clados, excepto para CN (Figs. 5 y 7). En este caso, los primeros 2 componentes explicaron ~80% de la variación craneométrica tanto en machos como en hembras (Tablas 8 y 19 [material suplementario]). En el AD "libre de tamaño" la superposición entre clados fue moderada, excepto en el caso de CN que no se superpuso (hembras) o lo hizo mínimamente (machos) con otros polígonos. La varianza ajustada por tamaño, acumulada por los 2 primeros ejes, fue de 76% (machos) y 81% (hembras) (Tablas 9, 10, 11, 19, 21 y 22 [material suplementario]). El porcentaje de especímenes incorrectamente clasificados por la función discriminante fue >20%, tanto en machos como en hembras. El aporte de cada carácter morfométrico a las funciones discriminantes se anota en las Tablas 13 y 24 (material suplementario). El análisis de conglomerados reveló una dicotomía mayor entre CN y el resto de los clados (Tablas 12 y 23 [material suplementario]). Las relaciones entre los clados fueron mayormente similares entre machos y hembras, con mínimas diferencias para aquellos clados más pobremente representados (n < 5).

Fig. 5. Polígonos correspondientes a las puntuaciones (= "scores") individuales de los 2 primeros componentes principales (izquierda) y de los ejes canónicos 1 y 2 del análisis discriminante "libre de tamaño" (derecha) para 7 clados de machos adultos (clases de edad 3-6) de Abrothrix longipilis l. s. (N = 155), identificados en función del análisis de marcadores moleculares de Sierra-Cisternas (2010). La cruz indica el centroide de cada grupo. El polígono de línea negra corresponde al clado CN (= A. longipilis s.s.). Para otros acrónimos, véase el texto.

Fig. 7. Polígonos correspondientes a las puntuaciones (= "scores") individuales de los 2 primeros componentes principales (izquierda) y de los ejes canónicos 1 y 2 del análisis discriminante "libre de tamaño" (derecha) para 8 clados de hembras adultas (clases de edad 3-6) de Abrothrix longipilis l. s. (N = 150), identificados en función del análisis de marcadores moleculares de Sierra-Cisternas (2010). La cruz indica el centroide de cada grupo. El polígono de línea negra corresponde al clado CN (= A. longipilis s.s.). Para otros acrónimos, véase el texto.
El test de Mantel entre distancias geográficas y morfológicas para 4 poblaciones del clado centro (RN, SN, SO, VA) mostró un coeficiente de correlación bajo y no significativo (r = 0.3663, P > 0.05). La correlación también fue baja y no significativa (r = 0.2683, P >0.05) cuando se compararon poblaciones de Argentina (CC, NC, NN, RN, SC, SN, SO, ST) y Chile (ÑU, OS, QT, VA), extendidas a todo lo largo de la distribución de la especie. Sin embargo, se obtuvieron correlaciones significativas cuando las poblaciones de cada país se consideraron por separado (Argentina: r = 0.5471, P <0.01; Chile: r = 0.9391; P <0.01).
Variación morfológica cualitativa
Externamente, los especímenes del centro-norte de Chile se distinguieron por poseer un pelaje más largo y laxo y una coloración general más agutí, careciendo de la típica banda dorsal castaña que caracteriza a otras poblaciones y que en estos animales es reemplazada por una franja amarillenta de bordes difusos. El cráneo de estos ejemplares se caracteriza por su mayor tamaño y robustez, los nasales acuminados con el borde posterior cerrándose abruptamente por detrás de la sutura premaxilo-frontal, la placa cigomática más ancha y con el borde libre mas extendido y el borde posterior del paladar frecuentemente hendido a la altura de la sutura entre los palatinos (Figs. 9 y 10).
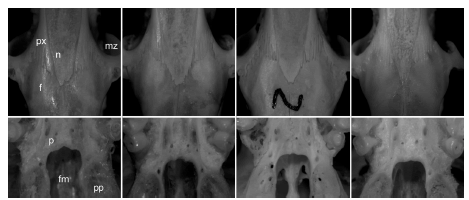
Fig. 9. Variación en la morfología del extremo posterior de los nasales (arriba) y borde anterior de la fosa mesopterigoidea (abajo) en A. longipilis del centro-norte de Chile (de izquierda a derecha, UACH 2675, 2678, 2667, 2668). En estas poblaciones los nasales (n) son posteriormente rectos o se cierran abruptamente por detrás de la sutura premaxilo-frontal y el borde anterior de la fosa mesopterigoidea (fm) presenta una indentación sobre la línea de unión entre los palatinos (p). En el ejemplar UACH 2668 los nasales son acuminados, una condición que es más frecuente en A. hirta. Para otras abreviaturas, véase la Fig. 3.
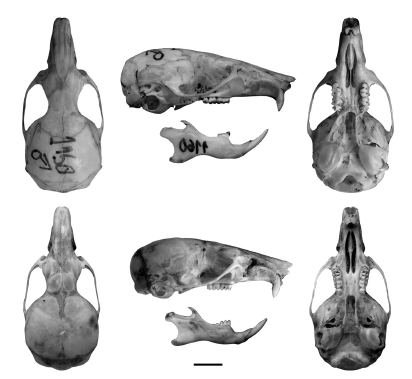
Fig. 10. Vista dorsal, lateral y ventral del cráneo y vista labial de la mandíbula (rotada) de Abrothrix longipilis (UACH 1160, arriba) y A. hirta (CNP 2339, abajo). Escala = 5 mm.
Ninguno de los 6 caracteres discretos revisados aportó información para la identificación inequívoca de los clados moleculares definidos por Sierra-Cisternas (2010). Sin embargo, la frecuencia de ocurrencia de algunos estados fue diferente entre clados. Por ejemplo, la presencia de una barra ósea sobre el margen posterior del paladar fue más frecuente en los individuos de AU (62.9% de los especímenes revisados [N = 97]) que en otros clados (<20%). Del mismo modo, la presencia de un foramen lacerado parcialmente osificado fue típica de los animales de SE, donde este estado se presentó en el 65.4% de los animales (vs. <10% en otros clados). En la Tabla 2 se resume la información correspondiente a este tópico.
DISCUSIÓN
Tanto los análisis basados en marcadores moleculares (Lessa et al., 2010; Palma et al., 2010, Sierra-Cisternas, 2010) como los resultados alcanzados en este trabajo sugieren que, en su actual concepción, A. longipilis es un complejo que incluye más de una especie. Esta situación se hace evidente en el caso de los ejemplares del centro-norte de Chile, cuya divergencia genética con respecto al resto de las poblaciones se ve también sustentada por diferencias morfológicas cualitativas y cuantitativas. El nombre longipilis quedaría restringido para este taxón, que tiene localidad tipo en Coquimbo, Chile. Además, la morfología de los ejemplares revisados coincide con la diagnosis propuesta por Osgood (1943) para A. l. longipilis, basada parcialmente en ejemplares topotípicos. El resto de las poblaciones, cuya geonemia se extiende ampliamente por el sur de Argentina y Chile, pueden ser referidas, siguiendo un criterio de prioridad, a la forma nominal A. hirta, con localidad tipo en Fuerte San Rafael, Argentina (sobre la ubicación de esta localidad tipo, véase la discusión en el Apéndice 1).
Para los grupos geográficos y clados incluidos bajo el concepto de A. hirta, la diferenciación morfológica registrada en este trabajo fue baja a moderada, una situación que en principio coincide con reportes previos. Por ejemplo, Gallardo et al. (1988) tampoco encontraron diferencias morfológicas cuantitativas entre poblaciones referidas como A. l. apta y A. l. suffusa. Sin embargo, la población referida por estos autores como suffusa (de Bariloche, Argentina) pertenecería, en el esquema de Sierra-Cisternas (2010), al mismo clado que aquellas de Valdivia incluidas en apta. Además, otras 2 poblaciones identificadas como apta (de Concepción y Osorno, Chile) corresponderían a los clados TC y AL de Sierra-Cisternas (2010). Una situación similar se plantea con respecto a los resultados de Yáñez et al. (1978), quienes también siguen el esquema de subespecies de Osgood (1943) y encuentran diferencias significativas en medidas corporales y craneanas entre poblaciones referidas como longipilis (sobre ejemplares de Coquimbo, Santiago y Valparaíso), castanea (Isla Mocha), apta (parque nacional Nahuelbuta, Puyehue y Valdivia), francei (Río Torcido, Tierra del Fuego), nubila (parque nacional Torres del Paine, Puerto Natales y Punta Arenas) y suffusa (Puerto Ibáñez). En el arreglo de estos autores, hay subespecies que incluyen a representantes de más de un clado (e.g., apta) o se aceptan como válidas subespecies que filogeográficamente corresponden a un mismo clado (e.g., francei, nubila, suffusa). Por todo esto, resulta difícil comparar los resultados de autores previos con los alcanzados en este trabajo, ya que el esquema subespecífico propuesto por Osgood (1943) y seguido mayormente por estos investigadores, no se ajusta al esquema de clados propuesto por Sierra-Cisternas (2010).
Yáñez et al. (1978) estudiaron ejemplares de A. longipilis y A. hirta entre los 29º y 54º 30' S. Estos autores encontraron una disminución en la longitud de varias medidas craneanas y corporales en un gradiente de norte a sur. Aunque en la presente investigación no se incluyeron ejemplares para el extremo austral de Chile como para poner a prueba la validez de dicha hipótesis, nuestros resultados sugieren que, por lo menos el tamaño general del cráneo disminuye de este a oeste. El caso del clado CE es elocuente en este sentido; con las muestras agrupadas por cercanía geográfica, los 4 grupos reconocidos dentro de este clado (SO, RN, SN y VA) se ordenaron por tamaño creciente de este a oeste (Figs. 4 y 6). Yáñez et al. (1978) vincularon la disminución en el tamaño corporal con la menor productividad primaria que se verifica hacia altas latitudes, argumentando que sería un mecanismo adaptativo para sobrevivir en regiones productivamente pobres o climáticamente impredecibles. Esta hipótesis también se aplica en nuestro caso, ya que las condiciones ambientales en el segmento longitudinal que ocupa el CE (67º-73.7º O) varían fuertemente de este a oeste, con mayor productividad primaria en los ambientes boscosos de Chile y Argentina que en aquellos semiáridos y ecotonales de la Patagonia extra-andina (Paruelo et al., 1998). En apoyo de esta presunción, se observó que los individuos de áreas boscosas tienen tractos digestivos más largos que aquellos de la estepa (al menos en los clados AU y CE), tal como se esperaría si sus dietas variasen en función de la productividad de los ambientes (Naya et al., en prensa). La relación entre la distribución espacial de distintos fenotipos y el ambiente ha sido estudiada a nivel intraespecífico en diversos grupos de organismos, destacándose reiteradamente la vinculación entre productividad (medida usualmente a través de las precipitaciones) y el tamaño corporal (e.g., Marchán-Rivadeneira et al., 2012; Cordero y Epps, 2013). El caso de A. hirta, cuya distribución incluye ambientes tan contrastantes como bosques bajo regímenes de lluvias de 2600 mm anuales (Valdivia, Chile) hasta estepas herbáceas con ~200 mm al año (Altiplanicie de Somuncurá, Río Negro, Argentina) seguramente merece un estudio más detallado, con énfasis en la vinculación entre fenotipo y ambiente, que escapa a los objetivos de este trabajo.
La falta de correlación entre distancias geográficas y morfológicas entre 12 poblaciones que corresponden por lo menos a 6 clados de A. hirta es consistente con la señal de expansión demográfica que exhibe esta especie cuando se considera la tendencia general para todos sus clados. En efecto, los análisis demográficos y las pruebas de apartamiento de la neutralidad realizados por Sierra-Cisternas (2010) sugieren que la mayoría de los clados están en equilibrio, excepto AU y CE, este último por lo menos en el sector argentino de su distribución. Para esos casos, se puede argumentar que la falta de correlación entre distancias se debe a que aún no se ha llegado a un equilibrio entre flujo génico y deriva génica que se manifieste en un patrón de aislamiento por distancia. En este contexto, tanto AU como CE se distribuyen ampliamente en el sur de Argentina y Chile y su representación en las muestras analizadas es mayoritaria (7 de 12), una situación que seguramente influye en el resultado de los análisis. Por el contrario, las correlaciones entre distancias morfológicas y geográficas fueron significativas cuando se consideraron las muestras de Argentina y Chile por separado. Al menos en el caso de Chile, estos resultados son consistentes con la señal genética de equilibrio demográfico reportada para los clados involucrados (AL, CE, SE, NO). En este contexto, la divergencia entre poblaciones ocurriría cuando reducciones severas del tamaño poblacional se conjugan con un aislamiento relativo entre las poblaciones, como resultado de factores tales como distancias de dispersión cortas, áreas de acción pequeñas y barreras fisiogeográficas o reproductivas (Le Boulengé et al., 1996; Macholán, 2001). En ambos casos, la correlación positiva y significativa entre distancias geográficas y morfológicas es consistente con la idea de que A. hirta representa una unidad morfológicamente continua (cf. Moreira y Oliveira, 2011).
El patrón filogeográfico detectado para A. hirta es único entre los roedores sigmodontinos que habitan Patagonia (cf. Lessa et al., 2010; Sierra-Cisternas, 2010; Pardiñas et al., 2011). En el caso de A. olivacea, Smith et al. (2001) plantearon un modelo de diversificación consistente con la colonización postglacial de la región patagónico-fueguina a partir de un único refugio, a lo que se puede agregar una diferenciación importante entre las poblaciones continentales y aquellas de Tierra del Fuego (Lessa et al., 2010). Para hirta, por el contrario, se ha propuesto que la colonización postglacial habría ocurrido a partir de múltiples refugios y que no existen diferencias entre los haplotipos de Tierra del Fuego y del sector austral continental (Palma et al., 2010; Sierra- Cisternas, 2010). Además, las poblaciones del sur de Mendoza (Argentina) forman un clado separado de aquellas del norte del Neuquén, mientras que en otros sigmodontinos (e.g., Loxodontomys micropus [Cañón Valenzuela et al., 2010], Chelemys macronyx [Alarcón et al., 2011]) las poblaciones de esos 2 sectores geográficos suelen estar emparentadas en forma estrecha. Desde un punto de vista morfológico, el patrón reportado en este trabajo para A. hirta indica cierta similitud con el de A. olivacea. Para esta última especie, Smith et al. (2001; véase también Pearson y Smith, 1999) reportaron diferencias morfológicas significativas, principalmente externas (de tamaño y coloración), entre las poblaciones de estepa y bosque, contrastando con su homogeneidad a nivel genético. Estos autores hipotetizaron que el caso de A. olivacea podría ser explicado por un modelo de divergencia con flujo génico (Rice y Hostert, 1993; Orr y Smith, 1998; Schneider et al., 1999). Bajo estas circunstancias, la divergencia morfológica estaría mayormente determinada por la selección diferencial a lo largo de un gradiente ambiental extremo y sería independiente de la cantidad de flujo génico (Orr y Smith, 1998).
Sierra-Cisternas (2010) reconoció que A. hirta incluye por lo menos 7 clados fuertemente apoyados, estructurados geográficamente de norte a sur y con una diferenciación genética importante (en la genealogía por citocromo b, las diferencias genéticas fluctúan entre 2.9 y 5.9%). En su esquema, la cordillera de los Andes habría restringido el contacto entre las poblaciones de esta especie al norte de los 36° S, pero no por debajo de esa latitud, en coherencia con las mayores y menores elevaciones que corresponden a la cadena andina en esos segmentos. Sierra-Cisternas (2010) propuso que cada uno de los clados de A. hirta identificados en su estudio podía ser reconocido con rango subespecífico, pero advirtiendo que el esquema taxonómico tradicionalmente aceptado no coincidía con los resultados obtenidos por los marcadores moleculares. Para dicha autora, las formas subespecíficas válidas serían suffusa (identificada con el clado AU, incluyendo en su sinonimia a los epítetos apta, nubila y francei), moerens (= CE) e hirta (= ME), mientras que otros 4 clados permanecerían innominados (AL, NO, SE, TC).
Los resultados presentados en este trabajo muestran que existe una elevada superposición entre especímenes correspondientes a distinto origen geográfico en el espacio multivariado. Sin embargo, cuando las muestras son agrupadas por clados se hace evidente una moderada correspondencia entre los patrones de variación detectados a partir del estudio de marcadores moleculares y aquellos de variación fenotípica. Por otro lado, aunque ninguno de los caracteres discretos estudiados permitió una identificación inequívoca de los individuos de distintos clados, la frecuencia de ocurrencia de los distintos estados o su combinatoria aportó elementos para la identificación de los mismos. Por ejemplo, los individuos del clado austral se caracterizaron mayormente por presentar los nasales posteriormente rectos, una excrescencia ósea sobre el paladar y un proceso hamular del escamoso grueso. En principio, no es nuestra intención proponer cambios taxonómicos dentro del esquema subespecífico de A. hirta, en tanto no se revise el estatus de todas las formas nominales involucradas (e.g., castanea, con localidad tipo en Isla Mocha no ha sido incluido en este trabajo ni tampoco estudiada por Sierra-Cisternas [2010]) o se realicen nuevas aproximaciones morfológicas a través de otras metodologías. En cualquier caso, parece necesario incluir nuevas muestras en los análisis, especialmente para aquellos sectores geográficos (e.g., sur de la Patagonia, Tierra del Fuego) y clados más pobremente representados (e.g., MA, ML), con el objetivo de resolver con mayor detalle los patrones de estructuración morfológica en A. hirta. Un esfuerzo adicional debería ponerse en aquellas áreas potenciales de simpatría, incluyendo el estudio de ejemplares previamente secuenciados. No es trivial, por ejemplo, que cada uno de los clados de A. hirta identificados en su estudio podía ser reconocido con rango subespecífico, pero advirtiendo que el esquema taxonómico tradicionalmente aceptado no coincidía con los resultados obtenidos por los marcadores moleculares. Para dicha autora, las formas subespecíficas válidas serían suffusa (identificada con el clado AU, incluyendo en su sinonimia a los epítetos apta, nubila y francei), moerens (= CE) e hirta (= ME), mientras que otros 4 clados permanecerían innominados (AL, NO, SE, TC).
Los resultados presentados en este trabajo muestran que existe una elevada superposición entre especímenes correspondientes a distinto origen geográfico en el espacio multivariado. Sin embargo, cuando las muestras son agrupadas por clados se hace evidente una moderada correspondencia entre los patrones de variación detectados a partir del estudio de marcadores moleculares y aquellos de variación fenotípica. Por otro lado, aunque ninguno de los caracteres discretos estudiados permitió una identificación inequívoca de los individuos de distintos clados, la frecuencia de ocurrencia de los distintos estados o su combinatoria aportó elementos para la identificación de los mismos. Por ejemplo, los individuos del clado austral se caracterizaron mayormente por presentar los nasales posteriormente rectos, una excrescencia ósea sobre el paladar y un proceso hamular del escamoso grueso. En principio, no es nuestra intención proponer cambios taxonómicos dentro del esquema subespecífico de A. hirta, en tanto no se revise el estatus de todas las formas nominales involucradas (e.g., castanea, con localidad tipo en Isla Mocha no ha sido incluido en este trabajo ni tampoco estudiada por Sierra-Cisternas [2010]) o se realicen nuevas aproximaciones morfológicas a través de otras metodologías. En cualquier caso, parece necesario incluir nuevas muestras en los análisis, especialmente para aquellos sectores geográficos (e.g., sur de la Patagonia, Tierra del Fuego) y clados más pobremente representados (e.g., MA, ML), con el objetivo de resolver con mayor detalle los patrones de estructuración morfológica en A. hirta. Un esfuerzo adicional debería ponerse en aquellas áreas potenciales de simpatría, incluyendo el estudio de ejemplares previamente secuenciados. No es trivial, por ejemplo, que en el centro-sur de Chile, donde se registran al menos 4 clados (AL, AU, CC, NO), se haya documentado además una elevada diversidad morfológica (cf. Osgood, 1943:188-189). Otro aspecto que merece una evaluación objetiva es el de la coloración externa, dado que ha sido uno de los principales parámetros para delimitar subespecies (e.g., Osgood, 1943). Es esperable que como resultado de esos estudios puedan comprenderse mejor los patrones de diversificación, relaciones filéticas, distribución e historia natural de este sigmodontino. Al mismo tiempo, sería conveniente extender este tipo de estudio a otras especies, en orden de evaluar similitudes y diferencias en los modelos de diversificación de la biota patagónica.
AGRADECIMIENTOS
Este trabajo fue realizado en el marco de la tesis doctoral de uno de los autores (PT), que fue financiada con fondos de la Agencia Nacional de Promoción Científica y Tecnológica (PICT 2008-0547 a UFJP). Guillermo D'Elía y Fredy Mondaca (UACH), David Flores y Sergio Lucero (MACN) y Diego Verzi e Itatí Olivares (MLP) facilitaron el ingreso a las colecciones biológicas consultadas y el préstamo de materiales. Este trabajo se ha visto beneficiado por la lectura crítica de Enrique Lessa, Norberto Giannini y Cecilia Morgan -que actuaron como árbitros de la tesis doctoral- y Francisco J. Prevosti -como co-director de la misma- y del intercambio de ideas sostenido con G. D'Elía. Ya durante el proceso editorial, el manuscrito se vio favorecido con las observaciones realizadas por J. Pablo Jayat y E. Lessa. Distintos aspectos estadísticos multivariados fueron discutidos con Gerardo Cueto, quien también aportó sus sugerencias sobre una versión previa. Daniela de Tommaso colaboró con la medición de especímenes y la confección del Apéndice 2. A todas las personas e instituciones mencionadas, el profundo agradecimiento de los autores. Se trata de la contribución número 9 del Grupo de Estudio de Mamíferos Australes (GEMA).
LITERATURA CITADA
1. ALARCÓN O, G D'ELÍA, E LESSA y UFJ PARDIÑAS. 2011. Phylogeographic structure of the fossorial long-clawed mouse Chelemys macronyx (Cricetidae: Sigmodontinae). Zoological Studies 50:682-682. [ Links ]
2. AVISE JC. 2000. Phylogeography: The history and formation of species. Harvard University Press, Cambridge. [ Links ]
3. BAKER RJ y RD BRADLEY. 2006. Speciation in mammals and the Genetic Species Concept. Journal of Mammalogy 87:643-662. [ Links ]
4. CABRERA A. 1961. Catálogo de los mamíferos de América del Sur. Parte II. Revista del Museo Argentino de Ciencias Naturales "Bernardino Rivadavia" Ciencias Zoológicas 4:309-732. [ Links ]
5. CAÑÓN VALENZUELA C, G D'ELÍA, UFJ PARDIÑAS y EP LESSA. 2010. Phylogeography of Loxodontomys micropus with comments on the alpha taxonomy of Loxodontomys (Cricetidae: Sigmodontinae). Journal of Mammalogy 91:1449-1458. [ Links ]
6. CONTRERAS JR y MI ROSI. 1981. Notas sobre los Akodontini argentinos (Rodentia, Cricetidae). I. Abrothrix longipilis moerens Thomas, 1919 en el Parque Nacional Nahuel Huapi. Historia Natural 1:209-212. [ Links ]
7. CORDERO GA y CW EPPS. 2012. From desert to rainforest: Phenotypic variation in functionally important traits of bushy-tailed Woodrats (Neotoma cinerea) across two climatic extremes. Journal of Mammalian Evolution 19:135-153. [ Links ]
8. DI RIENZO JA, F CASANOVES, MG BALZARINI, L GONZALEZ, M TABLADA y CW ROBLEDO. 2008. InfoStat, versión 2008, Grupo InfoStat, FCA, Universidad Nacional de Córdoba, Argentina. [ Links ]
9. FEIJOO M, G D'ELÍA, UFJ PARDIÑAS y EP LESSA. 2010. Systematics of the southern Patagonian-Fueguian endemic Abrothrix lanosus (Rodentia: Sigmodontinae): phylogenetic position, karyotypic and morphological data. Mammalian Biology 75:122-137. [ Links ]
10. GALLARDO MH, G AGUILAR y O GOICOECHEA. 1988. Systematics [sic] of sympatric cricetid Akodon (Abrothrix) rodents and their taxonomic implications. Medio Ambiente 9:65-74. [ Links ]
11. JUSTO ER, CI MONTALVO y LJM DE SANTIS. 1987. Contribución al conocimiento de Akodon longipilis suffusus Thomas, 1903 (Cricetidae, Sigmodontinae) en la Argentina. Neotrópica 33:83-88. [ Links ]
12. LE BOULENGÉ E, P LEGENDRE, C DE LE COURT, P LE BOULENGÉ-NGUYEN y M LANGUY, 1996. Microgeographic morphological differentiation in muskrats. Journal of Mammalogy 77:684-701. [ Links ]
13. LESSA EP, G D'ELÍA y UFJ PARDIÑAS. 2010. Genetic footprints of late Quaternary climate change in the diversity of Patagonian-Fueguian rodents. Molecular Ecology 19:3031-3037. [ Links ]
14. LIEDLOFF AC. 1999. Mantel Nonparametric Test Calculator. Version 2.0. School of Natural Resource Sciences, Queensland University of Technology, Australia. [ Links ]
15. MACHOLAN M. 2001. Multivariate analysis of morphometric variation in Asian Mus and Sub- Saharan Nannomys (Rodentia: Muridae). Zoologischer Anzeiger, 240:7-14. [ Links ]
16. MANN FISCHER G. 1978. Los pequeños mamíferos de Chile. Gayana: Zoología 40:1-342. [ Links ]
17. MANTEL N. 1967. The detection of disease clustering and a generalized regression approach. Cancer Research 27:209-220. [ Links ]
18. MARCHÁN-RIVADENEIRA MR, PA LARSEN, CJ PHILLIPS, RE STRAUSS y RJ BAKER. 2012. On the association between environmental gradients and skull size variation in the great fruit-eating bat, Artibeus lituratus (Chiroptera: Phyllostomidae). Biological Journal of the Linnean Society 105:623-634. [ Links ]
19. MESERVE PL, DA KELT y DR MARTÍNEZ. 1991a. Geographical ecology of small mammals in continental Chile Chico, South America. Journal of Biogeography 18:179-187. [ Links ]
20. MESERVE PL, BK LANG, R MURÚA, A MUÑOZ PEDEROS y LA GONZÁLEZ. 1991b. Characteristics of a terrestrial small mammal assemblage in a temperate rainforest in Chile. Revista Chilena de Historia Natural 64:157-169. [ Links ]
21. MESERVE PL, BK LANG y BD PATTERSON. 1988. Trophic relationships of small mammals in a Chilean temperate rainforest. Journal of Mammalogy 69:721- 730. [ Links ]
22. MOREIRA J y JA DE OLIVEIRA. 2011. Evaluating diversification hypotheses in the South American cricetid Thaptomys nigrita (Lichtenstein, 1829) (Rodentia: Sigmodontinae): An appraisal of geographical variation based on different character systems. Journal of Mammalian Evolution 18:201-214. [ Links ]
23. NAYA D, M FEIJOO, EP LESSA, UFJ PARDIÑAS, P TETA, IH TOMASCO, L VALDEZ y G D'ELÍA. En prensa. Digestive morphology of two species of Abrothrix (Rodentia, Cricetidae): comparison of populations from contrasting environments. Journal of Mammalogy. [ Links ]
24. ORR MR y TB SMITH. 1998. Ecology and speciation. Trends in Ecology and Evolution 13:502-506. [ Links ]
25. OSGOOD WH. 1943. The mammals of Chile. Field Museum of Natural History, Zoological Series 30:1-268. [ Links ]
26. PALMA RE, D BORIC-BARGETT, F TORRES-PÉREZ, CE HERNÁNDEZ y TL YATES. 2012. Glaciation effects on the phylogeographic structure of Oligoryzomys longicaudatus (Rodentia: Sigmodontinae) in the Southern Andes. PLoS ONE 7: e32206. doi:10.1371/ journal.pone.0032206. [ Links ]
27. PALMA RE, RA CANCINO y E RODRÍGUEZ-SERRANO. 2010. Molecular systematics of Abrothrix longipilis (Rodentia: Cricetidae: Sigmodontinae) in Chile. Journal of Mammalogy 91:1102-1111. [ Links ]
28. PARDIÑAS UFJ, P TETA, S CIRIGNOLI y DH POSDESTÁ. 2003. Micromamíferos (Didelphimorphia y Rodentia) de norpatagonia extra-andina, Argentina: taxonomía alfa y biogeografía. Mastozoolología Neotropical 10:69-113. [ Links ]
29. PARDIÑAS UFJ, P TETA, G D'ELIA, S CIRIGNOLI y PE ORTÍZ. 2007. Missing type localities of sigmodontine (Cricetidae, Sigmodontine) rodents: Some solutions. Pp. 391-416, in: The Quintessential naturalist: Honoring the life and legacy of Oliver P. Pearson (DA Kelt, E Lessa, JA Salazar-Bravo y JL Patton, eds.), University of California Publications in Zoology. [ Links ]
30. PARDIÑAS UFJ, P TETA, G D'ELIA y EP LESSA. 2011. The evolutionary history of sigmodontine rodents in Patagonia and Tierra del Fuego. Biological Journal of the Linnean Society 103:495-513. [ Links ]
31. PARUELO JM, AB BELTRÁN, OE SALA, EG JOBBÁGY y RA GOLLUSCIO. 1998. The climate of Patagonia: General patterns and controls on biotic processes. Ecología Austral 8:85-104. [ Links ]
32. PATTERSON BD. 1992. A new genus and species of long-clawed mouse (Rodentia: Muridae) from temperate rainforests of Chile. Zoological Journal of the Linnean Society 106:127-145. [ Links ]
33. PATTERSON BD, PL MESERVE y BK LANG. 1989. Distribution and abundance of small mammals along an elevational transect in temperate rainforests of Chile. Journal of Mammalogy 70:67-78. [ Links ]
34. PATTERSON BD, PL MESERVE y BK LANG. 1990. Quantitative habitat associations of small mammals along an elevational transect in temperate rainforests of Chile. Journal of Mammalogy 71:620-633. [ Links ]
35. PATTERSON BD, M SMITH y P TETA. En prensa. Genus Abrothrix Waterhouse, 1837. En: Mammals of South America. Volume 2 - Rodentia (J Patton, UFJ Pardiñas y G D'Elía, eds.). University of Chicago Press. [ Links ]
36. PEARSON OP. 1983. Characteristics of a mammalian fauna from forests in Patagonia, southern Argentina. Journal of Mammalogy 64:476-492. [ Links ]
37. PEARSON OP. 1984. Taxonomy and natural history of some fossorial rodents of Patagonia, southern Argentina. Journal of Zoology (London) 202:225-237. [ Links ]
38. PEARSON OP. 1992. Reproduction in a South American mouse, Abrothrix longipilis. The Anatomical Record 234:73-88. [ Links ]
39. PEARSON OP. 1995. Annotated keys for identifying small mammals living in or near Nahuel Huapi National Park or Lanin National Park, southern Argentina. Mastozoología Neotropical 2:99-148. [ Links ]
40. PEARSON OP y HA LAGIGLIA. 1992. "Fuerte de San Rafael": una localidad tipo ilusoria. Revista del Museo de Historia Natural de San Rafael (Mendoza, Argentina) 12:35-43. [ Links ]
41. PEARSON OP y MF SMITH. 1999. Genetic similarity between Akodon olivaceus and Akodon xanthorhinus (Rodentia: Muridae) in Argentina. Journal of Zoology 247: 43-52. [ Links ]
42. PHILIPPI RA. 1900. Figuras i descripciones de los murideos de Chile. Analales del Museo Nacional de Chile 14:9-64. [ Links ]
43. REIS SF, LM PESSOA y RE STRAUSS. 1990. Application of size-free canonical discriminant analysis to studies of geographic differentiation. Revista Brasileira de Genética 13:509-520. [ Links ]
44. REISE D y MH GALLARDO. 1990. A taxonomic study of the South American genus Euneomys (Cricetidae, Rodentia). Revista Chilena de Historia Natural 63:73-82. [ Links ]
45. RICE WR y EE HOSTERT. 1993. Laboratory experiments on speciation: What have we learned in 40 years? Evolution 47:1637-1653. [ Links ]
46. SCHNEIDER CJ, TB SMITH, B LARISON y C MORITZ C. 1999. A test of alternative models of diversification in tropical rainforests: ecological gradients vs. rainforest refugia. Proceedings of the National Academy of Sciences 96:13 869-13 873. [ Links ]
47. SIERRA-CISTERNAS CX. 2010. Filogeografía de Abrothrix longipilis (Rodentia: Sigmodontinae). Tesis de licenciatura no publicada. Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción, Concepción, Chile. [ Links ]
48. SMITH MF, DA KELT y JL PATTON. 2001. Testing models of diversification in mice in the Abrothrix olivaceus/ xanthorhinus complex in Chile and Argentina. Molecular Ecology 10:397-405. [ Links ]
49. SNEATH PHA y RR SOKAL. 1973. Numerical taxonomy: The principles and practice of numerical classification. W. H. Freeman and Company, San Francisco, USA. [ Links ]
50. STRAUSS RE. 1985. Evolutionary allometry and variation in body form in the South American catfish genus Corydoras (Callichthyidae). Systematic Zoology 34:381-396. [ Links ]
51. STRAUSS RE. 2010. Discriminating groups of organisms. Pp. 73-91 en: Morphometrics for nonmorphometricians (E Ashraf, ed.). Lecture Notes in Earth Sciences 124, Springer-Verlag. [ Links ]
52. TETA P, UFJ PARDIÑAS y G D'ELÍA. 2006. "Abrotrichinos". Pp. 192-197, en: Mamíferos de Argentina: sistemática y distribución (RM Barquez, MD Díaz y RA Ojeda, eds.). Sociedad Argentina para el Estudio de los Mamíferos, Tucumán, Argentina. [ Links ]
53. THOMAS, O. 1895. Descriptions of four small mammals from South America, including one belonging to the peculiar marsupial genus "Hyracodon". Tomes. Annals and Magazine of Natural History, series 10 16:367-370. [ Links ]
54. THOMAS O. 1927. On a further collection of mammals made by Sr. E. Budin in Neuquen, Patagonia. Annals and Magazine of Natural History, series 9 19:650-658. [ Links ]
55. WATERHOUSE GR. 1837. Numerous species of Mus, forming part of the collection presented by Charles Darwin, Esq. from the southern coast of South America. Proceedings of the Zoological Society of London 1837:15-21. [ Links ]
56. YÁÑEZ J, W. SIELFELD, J. VALENCIA y F. JAKSÍC. 1978. Relaciones entre la sistematica y la morfometria del subgenero Abrothrix (Rodentia: Cricetidae) en Chile. Anales del Instituto de la Patagonia 9:185-197. [ Links ]
MATERIAL SUPLEMENTARIO (ON-LINE)
Tablas 3 a 24, correspondientes a los análisis de componentes principales, discriminantes "libres de tamaño" y de conglomerados para Abrothrix longipilis l. s.
http://www.sarem.org.ar/wp-content/uploads/2014/12/SAREM_MastNeotrop_21-2_Teta-sup1.doc
Sinonimia, diagnosis enmendada y distribución de Abrothrix longipilis y A. hirta.
Abrothrix longipilis (Waterhouse, 1837)
Mus longipilis Waterhouse, 1837:16; localidad tipo "Coquimbo", Coquimbo, Chile.
Mus porcinus Philippi, 1858:78; localidad tipo "in planitie prov. Santiago prope locum Angostura", Santiago, Chile.
Mus brachytarsus Philippi, 1900:37, lámina XV, Fig. 2; localidad tipo "Prope
Santiago loco dicto Quinta Normal", Quinta Normal, Santiago, Chile.
Mus fuscoater Philippi, 1900:45, plate XIX, Fig. 1; localidad tipo no especificada.
Mus melampus Philippi, 1900: 49, plate XX, Fig. 4; localidad tipo "Ad vicum Cartajena ad austrum urbis Valparaiso", cercanías de Cartagena, Valparaiso, Chile.
Diagnosis enmendada: un sigmodontino de la tribu Abrotrichini, género Abrothrix, caracterizado por la siguiente combinación de caracteres: tamaño mediano (LCC ~129 mm, LC ~91 mm, LTC ~31.4 mm); pelaje largo, abundante y laxo; coloración general con "agutí" más marcado que en A. hirta y sin banda media dorsal castaña (en su lugar, hay una franja difusa y más amarillenta); en el dorso se entremezclan pelos que de la base a la punta presentan los siguientes colores: gris oscuro, pardo grisáceo, gris oscuro y pardo amarillento; pelos de guarda muy largos (~24 mm), sobresaliendo especialmente en la línea media; flancos grisáceos, apenas contrastados con el gris del vientre; cola bicolor, marrón por encima y gris blanquecina por debajo; uñas de las patas delanteras largas (2.5 mm); cráneo robusto; nasales posteriormente acuminados, con el borde posterior cerrándose abruptamente por detrás de la sutura premaxilo-frontal; región interorbitaria estrecha; paladar largo, con una muesca en relación a la unión de los palatinos y sobre el borde anterior de la fosa mesopterigoidea.
Distribución actual: centro-norte de Chile, entre 30º y 34º S; mayormente restringido a la franja costera de matorrales mediterráneos (Osgood, 1943).
Abrothrix hirta (Thomas, 1895)
Acodon hirtus Thomas, 1895:370; localidad tipo "Fort San Rafael, Mendoza", Argentina; Pearson y Lagiglia (1992; véase también Reise y Gallardo, 1990) consideran que, en realidad, el material no proviene del Fuerte de San Rafael sino el algún lugar cercano al volcán Peteroa, en la frontera entre Argentina y Chile.
Akodon suffusus Thomas, 1903:241; localidad tipo "Valle del Lago Blanco, Southern Chubut (Cordillera Region)", Argentina; Pardiñas et al. (2007) restringieron esta localidad a la estancia Valle Huemules, Chubut, Argentina.
Akodon francei Thomas, 1908:496; localidad tipo "[estancia] Santa Maria, Tierra del Fuego", Magallanes, Chile.
Abrothrix suffusus modestior Thomas, 1919:202; localidad tipo "Maiten [= El Maitén]", Chubut, Argentina.
Abrothrix suffusus moerens Thomas, 1919:203; localidad tipo "Beatriz, Nahuel Huapi. 800 m", Península Quetrihue, Neuquén, Argentina.
Chelemys angustus Thomas, 1927:654; localidad tipo "Bariloche, E. of Lake Nahuel Huapi. Alt. 800 m", Río Negro, Argentina (véase Pearson 1984).
Abrothrix hirta nubila Thomas, 1929:40; localidad tipo "Estancia, Alta Vista, Lago Argentino, 600m", estancia Alta Vista, Santa Cruz, Argentina.
Akodon (Abrothrix) longipilis apta Osgood, 1943b:188; localidad tipo "Piedra de Aguilas, Sierra Nahuelbuta, Malleco, Chile. Altitude about 4,000 feet."
Akodon (Abrothrix) longipilis castaneus Osgood, 1943b:189; localidad tipo "Mocha Island, coast of southern Chile, Province of Arauco."
Diagnosis enmendada: un sigmodontino de la tribu Abrotrichini, género Abrothrix, caracterizado por la siguiente combinación de caracteres: tamaño general menor que en A. longipilis (LCC <120 mm, LC ~85 mm, LTC ~29 mm); coloración variable, pero usualmente grisácea y levemente "agutí", con una banda media dorsal, más o menos marcada, de pelos castaños; pelos de guarda <15 mm; separación entre la coloración dorsal y ventral bien definida; vientre blanquecino o grisáceo, con la base de los pelos individuales de color gris oscuro; cráneo similar al de A. longipilis, pero menor en la mayoría de sus dimensiones, especialmente en los ejemplares de Argentina; nasales posteriormente acuminados; placa cigomática usualmente más estrecha y con el borde libre menos extendido; paladar largo, con el borde anterior de la fosa mesopterigoidea redondeado o cuadrado, con o sin proceso medio del palatino.
Distribución actual: centro-oeste y sudoeste de Argentina y centro-sur y sur de Chile desde los 35° hasta el norte de Tierra del Fuego (Osgood, 1943; Patterson et al., en prensa), desde el nivel del mar hasta los 2000 m de altura.
APÉNDICE 2
Especímenes de Abrothrix examinados en este estudio; los acrónimos para las instituciones son los que siguen: Argentina, Buenos Aires: Colección Elio Massoia (CEM); La Plata: Museo de La Plata (MLP); Chubut, Puerto Madryn: Colección de mamíferos del Centro Nacional Patagónico (CNP); Chile, Valdivia: Universidad Austral de Chile (UACH). La sigla GD corresponde al catálogo de campo de Guillermo D'Elía.
Abrothrix longipilis (n = 35): CHILE, Coquimbo, La Serena, Comuna de Elqui, Fundo El Salitre (h [hembras]: UACH 2667; m [machos]: UACH 2668, 2669), Parque Nacional Fray Jorge (h: UACH 1159, 1161, 1162, 1166, 1167, 1169, 1170, 1173, 1174, 1177, 2676, 2677, 2678, 2680, 2682; m: UACH 1160, 1163, 1165, 1168, 1171, 1172, 1175, 1176, 2474, 2675, 2679), Quebrada de Las Vacas (h: UACH 2671; m: UACH 2670, 2672); Valparaíso, Parque Nacional La Campana (h: UACH 5619, 5620; m: UACH 5618).
Abrothrix hirta (n = 442): ARGENTINA: Chubut, 1 km E Lago Blanco (m: CNP 1286, 1314, 1365), El Maitén (h: CNP 67, 2699, 2792, 2793, 2795, 2839, 2876, 2877, 2878; m: CNP 355, 499, 2700, 2752, 2794, 2879), Establecimiento La Maroma (h: CNP 3913), Estancia Leleque, La Potrada (h: CNP 1110, 1131, 1327, 1561, 1573; m: CNP 997, 1337), Estancia Quichaura (h: CNP 961, 1139; m: CNP 936, 1015, 1106), Laguna Larga (h: CNP 909, 925, 926, 966, 1006, 1008, 1041, 1151, 1157, 1168, 1209; m: CNP 192, 480, 502, 920, 924, 1181, 1087, 1124, 1162, 1167, 1223, 1317, 2743), Parque Nacional Lago Puelo (h: CNP 1180; m: CNP 981), Sierra de Tepuel, Cañadón de La Madera (h: CNP 2685, 2833, 2835, 2857, 2860, 2865; m: CNP 2690, 2802, 2838, 2861, 2862, 2376, 2797), Extremo W-SW Lago Blanco (h: CNP 358, 379, 502, 1257, 1274; m: CNP 374, 378, 1197, 1208, 1363); Mendoza, Cerro Colorado (CNP 2339, 4040, 4041); Neuquén, Área Natural Protegida Domuyo, Aguas Calientes (h: CNP 3907, 3914; m: CNP 3735, 3905, 3915), Área Natural Protegida Domuyo, Arroyo Las Ramadillas (m: CNP 3904, 3909), Estancia Las Breñas, veranada (m: CNP 2743), Lago Curruhué Chico (h: MLP-1-IV-96-5, MLP-1-IV-96-45, MLP-1-IV-96-54; m: MLP-20-IV-96-7 MLP-18-VIII-97-11), entre Lago Curruhué Chico y Grande (h: MLP-1-IV-96-15, MLP-10-V-96-24, MLP-18-VIII-97-8, MLP-18-VIII-97-9; m: MLP-18-VIII-97-12), Península Quetrihue, sendero km 2 (h: CNP 2689, 2709; m: CNP 2697, 2711, 2791, 2827), Parque Provincial Volcán Tromen (h: CNP 2726, 2843, 2846, 2847; m: CNP 2842, 2844); Río Negro, Estación Perito Moreno (h: UACH 1180, 1181, 1183; m: UACH 1179, 1182, 1184, 1185, 1186, 1187, 1188), Meseta de Somuncurá, Cerro Corona (h: CNP 2737; m: CNP 2555, 2694, 2800, 2829), Meseta de Somuncurá, Laguna Blanca (h: CNP 2796, 2851, 2853, 2854, 2855; m: CNP 2832, 2850, 2852), Meseta de Somuncurá, Puesto Buñuelo (m: CNP 2830), Meseta de Somuncurá, Puesto Quiñielaf (h: CNP 2840;), Meseta de Somuncurá, subida del Naciente (h: CNP 2740, 2749; m: CNP 514, 2741), Parque Nacional Nahuel Huapi (h: UACH 1189); Santa Cruz, Estancia Cerro Ventana (m: CNP 2789), Estancia La Ensenada (h: 2686, 2688, 2698, 2707, 2717, 2720, 2738, 2745, 2746, 2759, 2761, 2764, 2766, 1769, 2778, 2788, 2801, 2804, 2811, 2813, 2814, 2819, 2820, 2826, 2845; m: CNP 2706, 2712, 2719, 2723, 2727, 2728, 2736, 2742, 2747, 2757, 2769, 2763, 2770, 2775, 2784, 2799, 2807, 2808, 2809, 2810, 2822, 2823, 2825, 2867, 2870, 2869), extremo E Lago Burmeister (m: CNP 2762), Río Ecker, 500 m aguas abajo casco Estancia Casa de Piedra, Santa Cruz (m: CNP 2691), Valle del río Oro (h: CNP 3894; m: CNP 3899, 3900, 3903, 3911, 3930). CHILE: Araucanía, Villarrica, Cautín, Quetropillán (h: UACH 2343, 2344, 2345, 2348, 2352, 2371, 2373, 4212, 4220; m: UACH 2334, 2301, 2308, 2335, 2339, 2342, 2357, 2359, 2362, 2368, 2370, 3753, 4211, 4215, 4216, 4218), Cautín, Palguín (h: UACH 2319; m: UACH 2318); Malleco, Collipulli, Parque Nacional Tolhuaca (h: UACH 2530; m: 2529), Lonquimay, Paso de Pino Hachado (h: UACH 3749, m: 3748), Malalcahuello (h: UACH 2320, 2333; m: 2322, 2323, 2325, 2326, 2328, 2329, 2330, 2331, 2332), Curacautín, Río Colorado (h: UACH 2298, 2299; m: UACH 2301, 2308); Aysen, Comuna de Cochrane, Sector La Colonia (h: GD 969, 1010; m: 1027); Biobío, Comuna de Coelemu, Burca, Fundo La Madera (h: UACH 971, 1152, 1155, 2660, 2661, 2981, 2982, 2984, 2987, 2992; m: UACH 972, 1138, 1149, 1150, 1153, 1154, 1158, 2658, 2659, 2664, 2666, 2978, 2979, 2980, 2985, 2986), Quirihue, Las Eras (m: UACH 3744, 3745), Petronquines, Laguna Laja (h: UACH 2384, 2386; m: UACH 2387); Los Lagos, Osorno, Puyehue, Pampa Frutilla (h: UACH 3731, 3732; m: UACH 3734), Valle La Picada (h: UACH 1091, 1097, 1853, 1858, 1859, 1860, 1861, 1862, 1867, 1869, 1871, 1872, 1873, 1877, 1879, 1881, 1883, 1885, 1886, 1889, 1891, 1893, 1899, 1912, 1930, 1959, 4070, 4075, 4086, 4089, 4093, 4097, 5615; m: UACH 69, 1857, 1864, 1866, 1868, 1870, 1876, 1878, 1880, 1882, 1884, 1890, 1892, 1896, 1940, 1943, 4069, 4078, 4079, 4081, 4082, 4084, 4085, 4092, 4094, 4095, 5616); Los Ríos, Valdivia, Choshuenco (h: UACH 2293, 2294), Fundo Buenaventura (m: UACH 67), Fundo Huape (h: UACH 4985, 4986, 4992, 4993; m: 4990), Fundo La Dehesa (h: UACH 977, 980, 985, 987, 989, 1114, 1115, 2532, 2544, 2952; m: UACH 981, 982, 990, 1116, 2531, 2536), Fundo San Martín (h: UACH 39, 40, 1124, 1126, 1128, 2919, 2922, 2940, 2942, 2944, 4223, 4224, 4982, 5612; m: UACH 37, 42, 43, 44, 48, 52, 53, 54, 55, 56, 68, 1122, 2927, 2934, 2943, 4978, 4980, 5611), Fundo Santa Rosa (h: UACH 1093, 1096, 1098, 1104, 1105, 1106, 1110, 2538, 2966, 2968; m: UACH 61, 1085, 1087, 1088, 1097, 1099, 1109, 1109, 1112, 1113, 2957, 2969, 2970), Mehuín (h: UACH 57, 2291), Rupanco, Piedras Negras (h: UACH 1139, 1140, 1142; m: 1131, 1135, 1139), Universidad Austral de Chile, Instituto de Ecologia (h: UACH 976); Maule, Lircay (h: GD 1307, 1308, 1311, 1313; m: 1306, 1309, 1310, 1312), San Clemente, Laguna del Maule (m: UACH 58).














