Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. vol.22 no.1 Mendoza jun. 2015
ARTÍCULO
Consumo de plantas pioneras por murciélagos frugívoros en una localidad de la orinoquía colombiana
Andrés F. Suárez-Castro1, 2 y Olga L. Montenegro1, 3
1 Grupo Conservación y Manejo de Vida Silvestre, Instituto de Ciencias Naturales Universidad Nacional de Colombia, Carrera 45 #26-85, Sede Bogotá D.C., Colombia, Código Postal. 11001. Teléfono (57) (1) 3165000 ext. 11505. [Correspondencia: Andrés F. Suárez-Castro <asuarezca@unal.edu.co>].
2 School of Geography, Planning and Environmental Management, University of Queensland, Brisbane, Australia.
3 Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá D.C.
Recibido 24 abril 2014.
Aceptado 3 diciembre 2014.
Editor asociado: M Sandoval
RESUMEN.
El comportamiento alimentario cumple un papel principal en la estrategia de partición de recursos dentro de los ensambles de murciélagos frugívoros. A pesar de que Colombia es uno de los países con mayor riqueza de este grupo de fauna, la influencia de la fenología de los recursos consumidos sobre las dietas de las especies en los ensambles locales aún está pobremente estudiada. En este trabajo analizamos la estructura trófica de un ensamble de murciélagos frugívoros en una localidad de la Orinoquía colombiana y evaluamos su relación con los patrones de fructificación de cuatro especies de árboles (Cecropia peltata, C. sciadophylla, Ficus schultesii y F. gomelleira) y dos especies de arbustos (Piper arboreum y P. obliquum), los cuales constituyen elementos dietarios focales en la dieta de murciélagos frugívoros neotropicales. El análisis de 191 registros dietarios de 20 especies muestra que la estratificación vertical constituye el principal mecanismo en la estrategia de partición de recursos del ensamble de murciélagos frugívoros estudiado. Este mecanismo es independiente de los patrones de fructificación de las plantas evaluadas. Los murciélagos centraron su dieta en plantas con patrones de fructificación continuos y distribuciones espacialmente homogéneas. Por lo tanto, el uso de categorías de forrajeo basadas en la preferencia de plantas con diferentes estrategias de fructificación no explica los patrones de consumo encontrados en el ensamble estudiado.
ABSTRACT.
Pioneer plants consumption by bats in one locality from Colombian Orinoco.
Feeding behavior plays a major role as a resource partitioning strategy within assemblages of fruit bats. Although Colombia is one of the most diverse countries in terms of bat diversity, the influence of phenology of consumed resources on bat diets in local ensembles is still poorly known. In this study, we analyze trophic structure of a fruit bat assemblage in a locality of Colombian Orinoco, and we evaluate its relationship with fruiting patterns of four tree species (Cecropia peltata, C. sciadophylla, Ficus schultesii, and F. gomelleira) and two shrub species (Piper arboreum and P. obliquum), all of them representing focal dietary resources of Neotropical fruit bats. The analysis of 191 dietary records of 20 species shows that vertical stratification constitutes the main mechanism for resource partitioning among the studied bat ensemble. This mechanism is independent of the fructification patterns of the evaluated plants. Bats fed mainly on plants with continuous fructification patterns and spatially homogenous distributions. Therefore, categories based on the preference of plants with different fructification strategies do not explain the consumption patterns of the studied ensemble.
Palabras clave: Chiroptera; Dieta; Estrategias de forrajeo; Estructura trófica; Fenología.
Key words: Chiroptera; Diet; Foraging strategies; Phenology; Trophic structure.
INTRODUCCIÓN
El comportamiento alimentario constituye uno de los principales mecanismos asociados a la estrategia de partición de recursos dentro de los ensamblajes de murciélagos, lo que ha favorecido la gran diversificación de este grupo de fauna en varias regiones del Neotrópico (Fleming, 1986; Patterson et al., 2003; Giannini y Kalko, 2004). Factores como la distribución espaciotemporal de los recursos consumidos (Marinho-Filho, 1991; Soriano, 2000), las propiedades físicas y nutricionales del fruto (Kalko et al., 1996; Aguirre et al., 2003), la forma de procesamiento del alimento (Dumont, 2003; Nogueira y Peracchi, 2003) y los patrones de forrajeo (Bonaccorso, 1979; Kalko et al., 1996; Soriano, 2000), influyen en la capacidad de los murciélagos para seleccionar y consumir ciertas especies de plantas (Dumont, 2003; Andrade et al., 2013 Saldaña-Vázquez et al., 2013). De esta manera, los murciélagos frugívoros de la familia Phyllostomidae se pueden categorizar como frugívoros de sotobosque y como frugívoros de dosel (Dumont, 2003). Los frugívoros de sotobosque (género Sturnira y Subfamilia Carolliinae) consumen de manera rápida (aproximadamente 2 minutos) frutos pequeños y no fibrosos, para luego defecar las semillas en tiempos relativamente cortos, cercanos a los treinta minutos (Bonaccorso y Gush, 1987; Dumont, 2003). Por otro lado, los frugívoros de dosel (Subfamilia Stenodermatinae, excepto Sturnira), consumen frutos fibrosos que mastican lentamente mientras absorben la parte líquida, por lo que forman masas que son escupidas sin tragar la mayor parte del contenido (Bonaccorso y Gush, 1987; Dumont, 2003).
Los patrones de consumo descritos pueden tener una relación estrecha con las estrategias reproductivas de las plantas (Snow, 1965; Soriano, 2000; Thies y Kalko, 2004). Respecto a este criterio, algunos autores han planteado dos patrones de forrajeo básicos: frugívoros nómadas y frugívoros sedentarios (Rivas-Pava et al., 1996; Soriano, 2000). Las especies de dosel son consideradas nómadas, debido a que migran localmente para buscar plantas cuyos individuos se encuentran relativamente alejados unos de otros dentro de los bosques y presentan picos de fructificación asincrónicos en periodos cortos de tiempo (e.g. Ficus spp.; estrategia “big bang”). En contraste, los murciélagos de sotobosque centran su consumo en especies que fructifican de manera continua durante un periodo extendido del año (Piper spp., Cecropia spp., Solanum spp.), lo que provee un volumen pequeño pero constante de recursos para la fauna (estrategia “steady state”). Por lo tanto, las rutas de forrajeo de estas especies son generalmente las mismas ya que sus recursos son más predecibles espacio-temporalmente (Soriano, 2000; Dumont, 2003).
La diferenciación entre murciélagos nómadas y sedentarios ha sido utilizada para describir patrones de estructura y composición de especies en diferentes ensambles (Rivas-Pava et al., 1996; Estrada Villegas et al., 2010), así como posibles respuestas de los murciélagos a la fragmentación y a la pérdida de hábitat (Cosson et al., 1999). Estas categorías guardan además una relación estrecha con la hipótesis de Fleming (1986), quien propuso que la evolución de los hábitos de consumo en frugívoros filostómidos involucra la especialización en grupos núcleo de plantas. Con base en una gran cantidad de datos de un ensamble de filostómidos en la Isla de Barro Colorado en Panamá, Giannini y Kalko (2004) confirmaron esta hipótesis y demostraron que existe una fuerte asociación filogenética dentro de la estructura trófica del ensamble de murciélagos frugívoros. Sin embargo, aunque diferentes estudios han encontrado patrones similares a los descritos por Fleming (1986) (e.g. Gonçalves Da Silva et al., 2008; Estrada Villegas et al., 2010; Silveira et al., 2011; Sánchez et al., 2012a), la proporción de consumo de los diferentes ítems alimenticios puede depender de la abundancia relativa de los recursos y por lo tanto es variable temporal y geográficamente (Gonçalves Da Silva et al., 2008; Saldaña-Vázquez et al., 2013).
En este sentido, aún falta mucho por conocer sobre la incidencia de la época y la diversidad florística sobre los mecanismos que influyen en los patrones de consumo de recursos en los ensambles locales. La evidencia sobre la importancia de los patrones de fructificación como mecanismo de partición de recursos dentro de diferentes comunidades es contradictoria (Thies y Kalko, 2004; Burns, 2005). Además, se desconoce la fenología de fructificación para la mayoría de las especies de plantas consumidas por murciélagos a escalas locales, y los análisis que relacionan esta información con las estrategias de forrajeo de los consumidores son escasos (Thies y Kalko, 2004; Bonaccorso et al., 2007; Ramos Pereira et al., 2010).
En este trabajo analizamos la dieta de un ensamble de murciélagos frugívoros en una localidad de la Orinoquía colombiana y evaluamos su relación con los patrones de fructificación de algunas especies de plantas centrales en la dieta de los murciélagos frugívoros neotropicales, según la hipótesis de Fleming (1986). En particular, abordamos las siguientes preguntas: 1) ¿cuál es la estructura trófica del ensamble de murciélagos frugívoros de la localidad estudiada?; 2) ¿cómo varían los patrones de fructificación de seis especies de plantas pioneras consumidas por murciélagos?; y 3) ¿cuál es la relación entre estos patrones y el comportamiento alimentario de especies clasificadas por poseer diferentes estrategias de forrajeo? De esta manera, evaluamos si la variación temporal en la disponibilidad de frutos afecta la proporción de consumo de plantas con diferentes estrategias de fructificación y si esta proporción de consumo se relaciona con los patrones de forrajeo descritos para los murciélagos de dosel y de sotobosque.
MATERIALES Y MÉTODOS
Área de estudio
El estudio se realizó dentro de los predios de la Finca Los Moriches (02°43'41.7”N y 73°45'2.5”W), vereda La Reforma, en el municipio de Vista Hermosa, al suroccidente del departamento de Meta, Colombia (Fig. 1). Trabajamos en un intervalo altitudinal que varía entre 230 y 280 m. El clima es húmedo, con precipitaciones promedio mensuales de 196.2 mm y temperatura promedio de 25 °C. El régimen de distribución de las lluvias es unimodal, con un periodo de muy baja precipitación (<5 mm diarios en promedio), comprendido entre diciembre y marzo, y una temporada de mayores precipitaciones (10-20 mm diarios en promedio) que se presenta entre abril y noviembre (IDEAM, 2010).

Fig. 1. Localización del área de estudio. El punto negro indica la zona de muestreo.
El área forma parte de la región suroriental del piedemonte y las zonas bajas de la serranía de La Macarena, área transicional con características de los ecosistemas andino, amazónico y orinocense, y que incluye un sistema montañoso perteneciente al escudo guayanés. La finca abarca una extensión aproximada de 250 hectáreas y corresponde a una matriz de bosques con diferentes grados de intervención, en donde aparecen inmersas zonas de pastizales dedicadas principalmente a la ganadería y algunos cultivos de subsistencia. Entre los tipos de vegetación natural se encuentran bosques de origen amazónico y otros ambientes orinocenses, como bosques de galería y morichales, típicos de la zona de transición existente entre la Orinoquía y la Amazonía (Contreras-Herrera, 2011).
Captura de murciélagos y obtención de semillas
Con el fin de obtener datos acerca de las especies de plantas consumidas por los murciélagos, realizamos capturas con redes de niebla entre agosto de 2011 y febrero de 2012. Durante cada mes, seleccionamos tres sitios de muestreo donde ubicamos diariamente entre seis y ocho redes independientes instaladas entre los cero y los ocho metros desde el suelo. Calculamos el esfuerzo de muestreo como el producto del número de horas de muestreo por noche, el número de noches y el área de la red para obtener m2.hora (Straube y Bianconi, 2002). Las redes fueron ubicadas teniendo en cuenta los siguientes criterios: 1) presencia de zonas de transición (ecotono y borde), 2) sitios potenciales de paso para los murciélagos entre diferentes fragmentos de bosque, y 3) presencia de plantas en periodo de fructificación y floración. Los murciélagos capturados fueron depositados en bolsas de tela con el fin de obtener sus heces y recolectar las semillas consumidas. Obtuvimos información sobre el sexo, el estado reproductivo y la categoría de edad de todos los individuos capturados (Kunz y Parsons, 2009) y recolectamos al menos un espécimen de referencia por cada morfotipo capturado con el fin de confirmar en el laboratorio las identificaciones realizadas en el campo. Los ejemplares fueron depositados en la colección del Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN, números de colector FSC 243 – FSC 307).
Para la identificación de las especies de murciélagos seguimos a Davis (1968) para el género Uroderma, a Hollis (2005) para el género Artibeus, a Velazco et al. (2010) para el género Platyrrhinus, a Zurc y Velazco (2010) para el género Carollia y a Rodríguez-Posada y Sánchez-Palomino (2009) para el género Phyllostomus. Para la identificación de los demás géneros seguimos la clasificación de Gardner (2008). Las semillas fueron identificadas mediante comparaciones con una colección de referencia y con ejemplares del Herbario Nacional Colombiano (COL).
Patrones de fructificación
Especies examinadas
Para evaluar las diferencias en los patrones de fructificación de las plantas consumidas por los murciélagos escogimos las siguientes especies: Cecropia peltata, C. sciadophylla, Piper arboreum, P. obliquum, Ficus schultesii y F. gomelleira. Estas especies poseen diferentes estrategias de fructificación y constituyen una parte central de la dieta de los filostómidos frugívoros (Fleming, 1986; Giannini y Kalko, 2004; Muscarella y Fleming, 2007). Para la selección de estas especies, realizamos seis transectos aleatorios de 200 m cada uno y contamos todos los individuos de los géneros Cecropia, Piper y Ficus, con el fin de seleccionar aquellas especies más abundantes en la zona.
Las plantas del género Piper producen pocos amentos en tiempos predecibles durante periodos de varias semanas o meses, una estrategia conocida como “steady state”. P. arboreum y P. obliquum son arbustos o árboles pequeños de 2-8 m de alto, los cuales viven principalmente en el interior del bosque. En P. arboreum, los amentos son erectos y en P. obliquum son péndulos. Por su parte, las plantas de Cecropia son árboles dioicos que se caracterizan por presentar infrutescencias múltiples estrobiliformes, axilares, péndulas, digitadas, carnosas, con cientos de frutiolos libres entre sí (Linares y Moreno-Mosquera, 2010). C. peltata y C. sciadophylla son árboles pioneros que pueden alcanzar 30 m de altura y son comúnmente encontrados en bosques secundarios, desde el nivel del mar hasta los 1300 m (Berg y Franco-Roselli, 2005). Finalmente, F. schultesii y F. gomelleira son árboles que pueden alcanzar los 30 m de altura y que producen una gran cantidad de frutos en periodos cortos de tiempo (estrategia “big bang”). Ambas especies presentan siconos axilares, de 1 a 2.5 cm de diámetro y de color verdusco al madurar.
Seguimiento fenológico
Seguimos las recomendaciones para la realización de estudios fenológicos de Fournier y Charpantier (1975) para la selección del número de individuos muestreados por especie. Marcamos quince individuos para C. sciadophylla y quince para C. peltata. Sin embargo para los análisis posteriores, única mente tomamos en cuenta los individuos hembra que fueron confirmados mediante el seguimiento fenológico: seis para C. sciadophylla y cuatro para C. peltata. Para cada una de las especies de Piper spp. marcamos 15 individuos, mientras que para F. schultesii y F. gomelleira, encontramos cinco individuos por especie. En total registramos los datos de fructificación cada mes para 50 individuos de las seis especies. Los individuos marcados se distribuyeron en un área correspondiente a 4.5 km2, la cual abarca una gran proporción del área de acción de la mayoría de las especies de murciélagos estudiadas (Galindo- González, 1998; Trevelin et al., 2013).
Para estimar el porcentaje de fructificación, contamos el número total de frutos maduros e inmaduros en los individuos de Piper spp. y Cecropia spp. Para los individuos de Ficus spp. realizamos una estimación del porcentaje de fructificación dividiendo la copa del árbol en cuadrantes y estimando el número de frutos en cada cuadrante. Clasificamos el porcentaje de fructificación en “ninguno” (0 %), “bajo” (25 %), “medio” (25-50 %), “medio alto” (50-75 %) o “alto” (75-100 %).
Análisis de datos
Representatividad del muestreo
Calculamos la representatividad del muestreo tanto para la captura de murciélagos como para los registros dietarios mediante curvas de acumulación de especies con el programa EstimateS 9.1 (Colwell 2013). La unidad de muestreo consistió en grupos de máximo 20 registros provenientes de la misma fecha y localidad (Villarreal et al., 2006). Utilizamos los estimadores no paramétricos Jacknife 1 y Chao 2, los cuales no asumen homogeneidad ambiental en el muestreo, son menos sesgados cuando existen pocas especies representadas en una sola muestra (Gotelli y Colwell, 2011) y no necesitan que exista una distribución estadística conocida (Villarreal et al., 2004). Con base en los valores de riqueza estimada por los índices y asumiendo este valor como el 100 %, determinamos el porcentaje de representatividad de especies registradas durante la fase de campo.
Estructura trófica
Usamos un análisis de correspondencia para describir la estructura de los patrones de dieta entre los murciélagos frugívoros. De esta manera, producimos una representación gráfica de las filas y las columnas de una matriz, en nuestro caso especies de murciélagos y especies de plantas, lo que permite la interpretación conjunta de sus co-ocurrencias (Giannini y Kalko, 2004). Calculamos la concordancia de las especies de murciélagos con los ítems alimenticios como la fracción de variación de murciélagos e ítems, explicada por los ejes examinados. En un principio incluimos todas las especies para las cuales existía al menos un registro dietario. Posteriormente revisamos los resultados para evaluar la influencia de las especies de murciélagos o los registros dietarios con los tamaños de muestra más pequeños. Estos registros fueron eliminados del análisis si se comportaban como valores extremos en los diagramas de ordenación, o retenidos si no existía tal efecto. Para los análisis, juntamos los datos de todas las especies de plantas por género, con el fin de identificar los patrones de consumo generales dentro del ensamble de murciélagos frugívoros. Estos análisis fueron realizados en el programa Past v.2.17 (Hammer et al., 2001).
Patrones fenológicos
Definimos la fenología de la fructificación como los cambios temporales en la disponibilidad de frutos de cada especie de planta (Fleming y Williams, 1990; Milton, 1991; Thies y Kalko, 2004; Burns, 2005). Para cada especie, calculamos la proporción de individuos con presencia de frutos durante cada mes (número de individuos por especie con frutos / número de individuos por especie). Adicionalmente, asignamos una categoría para los porcentajes de fructificación en cada individuo. De esta manera, los porcentajes obtenidos en la fase de campo (ninguno, bajo, medio, medio-alto y alto) fueron transformados en 0, 1, 2, 3 y 4, respectivamente. Para determinar si existían diferencias significativas en la actividad de fructificación para las especies monitoreadas durante la época de lluvias (agosto – noviembre) y la época seca (diciembre – febrero), utilizamos una prueba de intervalos de Wilcoxon. Debido a la cantidad reducida de individuos por especie para los géneros Cecropia y Ficus, juntamos los datos de las dos especies evaluadas para cada uno de los géneros. Escogimos p < 0.05 como el nivel de significancia para todas las pruebas.
Los patrones temporales en la disponibilidad de frutos de las seis especies de plantas fueron evaluados a partir de un modelo nulo. Este modelo puede ser utilizado para evaluar si los tiempos de fructificación de las especies estudiadas se encuentran segregados en el tiempo. Para ello, utilizamos un índice basado en la varianza entre los tiempos de fructificación promedio de dos especies de plantas con picos de fructificación adyacentes. La superposición media de estas combinaciones fue comparada con 99 valores de un test de aleatorización como describen Gotelli y Entsminger (2006). Consideramos que había una tendencia a la agregación en los tiempos de fructificación cuando el índice observado fue mayor en más del 95 % de los 99 valores simulados. En caso contrario, consideramos que el patrón era escalonado. Todos los cálculos fueron desarrollados en el programa EcoSim v.7.0 (Gotelli y Entsminger, 2006). Aunque los patrones de fructificación de las especies de plantas evaluadas se encuentran clasificados en estrategias distintas (“big-bang” para Ficus spp. y “steady state” para Cecropia spp. y Piper spp.), aplicar este modelo resulta apropiado para evidenciar patrones de oferta de los recursos consumidos por los murciélagos frugívoros durante las dos épocas estudiadas.
Variación temporal en los patrones de consumo
Con el fin de identificar cómo las variaciones en la producción de frutos afectaban los patrones de consumo de murciélagos clasificados por poseer distintos patrones de forrajeo, escogimos a C. perspicillata y A. lituratus, las especies con la mayor cantidad de registros dietarios en el muestreo. Para cada época, calculamos el índice normalizado de Levins (BA) como una estadística descriptiva de la amplitud de nicho en cada época (Krebs, 1999): BA = (B-1)/ (n-1), donde n es el número de ítems dietarios disponibles y B = 1/Σpi2, donde pi es la proporción del recurso i en la dieta. BA varía entre 0 (solo un recurso utilizado) y 1 (todos los recursos disponibles usados equitativamente).
RESULTADOS
Representatividad del muestreo
Muestreamos un total de 48 noches distribuidas durante todo el periodo de muestreo, para un total de 22500 m2.h (12 000 m2.h entre los 0 y los 4 m, y 10 500 m2.h entre los 4 y los 8 m). Capturamos un total de 544 murciélagos pertenecientes a 34 especies, de las cuales 20 incluyeron en su dieta el consumo de frutos (Tabla 1), y representaron el 93 % (513) de los individuos capturados. La representatividad del muestreo para los estimadores utilizados fue del 86.3 % (Fig. 2a). Carollia y Artibeus fueron los géneros que aportaron la mayor cantidad de individuos con el 37 % y el 43.6 % de las capturas respectivamente. La abundancia de las especies dominantes varió dependiendo de la época (Tabla 1). Para la época de lluvias, C. perspicillata aportó la mayor cantidad de individuos y representó el 50.5 % de las capturas, mientras que para la época seca, A. lituratus fue la especie dominante con el 46 % de las capturas.
Tabla 1 Especies de murciélagos frugívoros registradas por época, número de encuentros de semillas y proporción de consumo de los frutos encontrados en las muestras para cada especie.
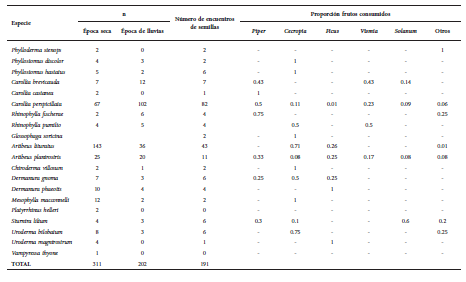
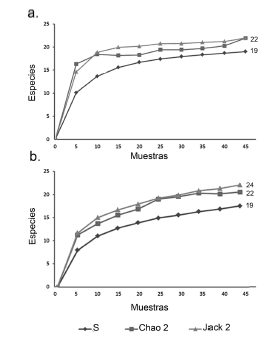
Fig. 2. Curva de acumulación de especies para (a) el ensamble de murciélagos frugívoros; (b): los registros dietarios en las heces. Los números en el extremo de las curvas representan los valores estimados de riqueza para cada estimador empleado. S: riqueza observada.
En cuanto a los registros de dietas, revisamos un total de 206 heces, de las cuales 165 contenían semillas pertenecientes a 19 especies de plantas (Tabla 2). El número de heces examinadas por cada especie de murciélago se presenta en la Tabla 1. La representatividad del muestreo varió entre el 79.5 % y el 86.3 % dependiendo del estimador utilizado (Fig. 2b). El 92.1 % (152) de las heces solo contenían una especie de semilla, mientras que el 7.9 % (13) contenían dos o más morfotipos, por lo que obtuvimos un total de 191 encuentros (Tabla 2). El número de registros dietarios fue mayor en la época seca que en la época de lluvias (114 vs. 77 respectivamente). Para la época de lluvias, encontramos 12 especies y dos morfotipos de semillas, mientras que para la época seca encontramos 15 especies y un morfotipo. La cantidad de muestras de heces con semillas varió entre las especies registradas (Tabla 1) y la mayoría provinieron de C. perspicillata (49.7 %) y A. lituratus (27.8 %).
Tabla 2 Especies de plantas a las que corresponden las semillas encontradas en las heces de los murciélagos capturados, indicando el número de registros por época y la/s especie/s de murciélago en la que fueron registradas. Al: A. lituratus, Ap: A. planirostris, Cb: C. brevicauda, Cc: C. castanea, Cp: C. perspicillata, Dg: D. gnoma, Dp: D. phaeotis, Gs: G. soricina, Mm: M. macconnelli, Pd: P. discolor, Ph: P. hastatus, Ps: P. stenops, Rf: R. fischerae, Rp: R. pumilio, Sl: S. lilium, Ub: U. bilobatum.

Estructura trófica
Las especies de plantas consumidas por los murciélagos de la zona se detallan en la Tabla 2. En total, cinco especies de plantas fueron encontradas solo en un registro dietario, mientras que Piper spp. (29.3 %), C. peltata (19.9 %), Vismia baccifera (12.6 %), C. sciadophylla (10.9 %), Ficus spp. (9.9 %) y Solanum jamaicense (6.8 %), constituyeron los taxones que aportaron la mayor cantidad de registros. Los dos primeros ejes del análisis de correspondencia acumularon el 80.28 % de la variación en la dieta de las especies evaluadas (Fig. 3). El eje 1 muestra un gradiente de separación donde los murciélagos de los géneros Carollia, Sturnira y Rhinophylla se asocian al consumo de frutos de arbustos de sotobosque como Piper spp. Vismia spp. y S. jamaicense, mientras que especies como Phyllostomus hastatus, A. lituratus y Uroderma bilobatum complementan su dieta en mayor medida con frutos de árboles del género Cecropia. Dentro del género Artibeus, A. planirostris presenta una posición intermedia e incluye en su dieta frutos de especies de los géneros Piper, Cecropia, Solanum, Vismia y Ficus (Fig. 3, Tabla 1).

Fig. 3. Diagrama de ordenamiento del análisis de correspondencia, donde se muestra la asociación de las especies de murciélagos y los principales ítems alimenticios. Al: A. lituratus, Ap: A. planirostris, Cb: C. brevicauda, Cc: C. castanea, Cp: C. perspicillata, Dg: D. gnoma, Dp: D. phaeotis, Mm: M. macconnelli, Pd: P. discolor, Ph: P. hastatus, Sl: S. lilium, Ub: U. bilobatum.
Fenología de la fructificación
La fenología de las plantas estudiadas refleja distintos tipos de patrones de fructificación. P. arboreum y C. sciadophylla constituyeron un recurso continuo, disponible durante todo el periodo de estudio, mientras que las plantas del género Ficus presentaron dos picos claros de fructificación al inicio y al final del muestreo (Fig. 4). La producción de frutos de P. obliquum se presentó de manera continua principalmente durante la época de lluvias (Fig. 4).
Fig. 4. Proporción de individuos con frutos para las seis especies de plantas evaluadas mensualmente entre agosto de 2011 y febrero de 2012.
Tanto C. peltata como C. sciadophylla tuvieron su pico de fructificación en la época de lluvias, aunque para C. peltata solo encontramos individuos con frutos hasta noviembre, mientras que el periodo de fructificación de C. sciadophylla se extendió hasta la época seca (Fig. 4). Finalmente, las especies de Ficus mostraron un patrón de fructificación discontinuo, con dos periodos únicos de producción de frutos, uno en septiembre, durante la época de lluvias y otro en febrero durante la época seca (Fig. 4). Los patrones descritos también se mantienen cuando analizamos las categorías de fructificación (Tabla 3).
Tabla 3 Categorías de fructificación máximas registradas por mes para las especies de plantas evaluadas en este estudio. 0: ninguno, 1: bajo, 2: medio, 3: medio alto, 4: alto.

Encontramos una diferencia significativa entre la cantidad de frutos producidos en las dos épocas evaluadas tanto para P. obliquum (n = 15, z = 2.236, p = 0.025) como para las especies de Cecropia (n = 9, z = 2.121, p = 0,033). En contraste, no encontramos diferencias estadísticamente significativas en los patrones de fructificación de las dos épocas para P. arboreum (n = 15, z = 1.857, p = 0.067) ni para las especies de Ficus (n = 10, z = 0.137, p = 0.891). Al evaluar los resultados del modelo nulo, el índice observado (0.200) fue menor que los valores obtenidos en 88 simulaciones, aunque estos valores no fueron significativamente diferentes (p = 0.09). Lo anterior indica que aunque no todas las especies tienen los picos de fructificación en el mismo periodo, existe una tendencia hacia la agregación en la producción de frutos durante una época del periodo estudiado.
Variación de patrones de consumo con la época
Sin importar la época estudiada, los murciélagos centraron su dieta en el mismo tipo de plantas (Tabla 1; Fig. 5) y esto fue independiente de los picos de fructificación de las especies focales estudiadas. Aunque la proporción de consumo de Piper spp. disminuyó en la época seca, este fue el ítem alimenticio con la mayor representatividad en la dieta de Carollia spp. durante todo el periodo de muestreo. El consumo de Cecropia spp. fue constante durante todo el periodo estudiado. Sin embargo, obtuvimos una mayor cantidad de registros de este ítem alimenticio en la época seca, cuando C. sciadophylla contribuyó en mayor medida dentro de la dieta de especies como A. lituratus, P. hastatus y C. perspicillata (Tabla 2). Al comparar las especies con la mayor cantidad de registros, encontramos que C. perspicillata incluyó una mayor variedad de plantas a lo largo del período de estudio y modificó la proporción de consumo de Cecropia y Piper en la época seca, periodo en el que incorporó frutos de especies diferentes a los de la época de lluvias (Fig. 5a). Por su parte, A. lituratus centró su dieta en menos especies y consumió consistentemente una mayor proporción de plantas del género Cecropia (Tabla 1; Fig. 5b). La amplitud de nicho para C. perspicillata fue muy similar en las dos épocas evaluadas (época de lluvias: 0.091; época seca 0.095), mientras que para A. lituratus, fue mayor durante la época seca (época de lluvias: 0.097; época seca 0.105).
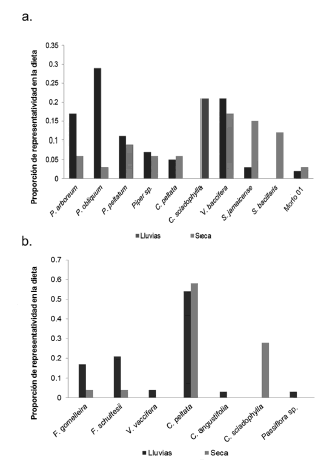
Fig. 5. Proporción de consumo, para las dos épocas estudiadas, de las plantas encontradas en las heces de (a) Carollia perspicillata; (b) Artibeus lituratus.
DISCUSIÓN
Nuestros resultados muestran que los murciélagos frugívoros tienden a consumir plantas con periodos de fructificación continuos y predecibles a nivel espacio-temporal, como es el caso de C. peltata, C. sciadophylla y P. obliquum. En este sentido, la estratificación vertical, uno de los principales mecanismos en la estrategia de partición de recursos a nivel de ensamble (e.g. Stenodermatinae excepto Sturnira en árboles pioneros y Carolliinae y Sturnira spp. en arbustos), es independiente de las estrategias de fructificación de las plantas evaluadas. Por lo tanto, consideramos que el uso de la clasificación de murciélagos sedentarios y nómadas no explica los patrones de consumo encontrados en la dieta del ensamble estudiado.
La dominancia de Cecropia en la dieta de las especies de Stenodermatinae ha sido reportada para varias localidades del Neotrópico, las cuales presentan ecosistemas y condiciones locales muy heterogéneas (Fleming y Williams, 1990; Gonçalves Da Silva et al., 2008; Lobova et al., 2003; Estrada-Villegas, et al., 2010). Debido a que las especies de Ficus y Cecropia presentan contenidos nutricionales similares (Saldaña- Vázquez et al., 2013), autores como Gonçalves Da Silva et al. (2008) han postulado que Artibeus spp. utiliza facultativamente las especies de estos géneros dependiendo de los regímenes de disturbio. En nuestra área de estudio, la diversidad florística es relativamente alta y presenta bosques con un buen estado de conservación a nivel estructural (Contreras-Herrera, 2011). Sin embargo, las prácticas ganaderas han generado fragmentos y áreas abiertas de diferentes tamaños, los cuales son adecuados para el establecimiento de especies de borde como los árboles de Cecropia (Berg y Franco-Roselli, 2005; Lobova et al., 2003). Diferentes estudios han demostrado que los murciélagos son flexibles y responden positivamente a cambios en la distribución y abundancia de frutos (Ramos-Pereira et al., 2010; Sánchez et al., 2012b). Si la oferta es constante y suficiente para mantener la población, resultaría más efectivo para los murciélagos consumir aquellos recursos con una distribución más predecible. En este sentido, la heterogeneidad espacial en la distribución de los recursos jugaría un papel más importante que las estrategias de fructificación en el proceso de selección de recursos a nivel de ensamble.
Aunque existió una tendencia a la agregación de los picos de fructificación en la época de lluvias, no todas las plantas fructificaron con proporciones similares en el mismo momento, tendencia que ha sido evidenciada en otros estudios (Thies y Kalko, 2004; Burns, 2005). Por lo tanto, el consumo de plantas con periodos de fructificación prolongados, no implica una representación similar a nivel de especie en la dieta de los murciélagos durante diferentes épocas climáticas (Gonçalves Da Silva, 2008; Sánchez et al., 2012b). Un ejemplo de ello lo constituye C. peltata, especie consumida en mayor medida y por más especies de murciélagos durante la época seca (Tabla 2). La producción de frutos en diferentes proporciones durante periodos distintos del año, permitiría a las especies de plantas evadir la superposición en los periodos de maduración de los frutos, lo que se traduce en una menor competencia por los dispersores disponibles (Thies y Kalko, 2004). Por lo tanto, aunque los picos de fructificación no determinaran los patrones de estratificación vertical a nivel de ensamble, este mecanismo sí estaría ligado con las estrategias de exclusión competitiva que permiten la coexistencia para grupos cercanos de especies (Thies y Kalko, 2004; Bonaccorso et al., 2007).
Nuestros resultados muestran que algunas especies simpátricas con tamaños y requerimientos de hábitat similares tienden a consumir especies distintas del mismo género, o plantas con diferentes distribuciones espaciales a nivel vertical, no obstante el componente histórico que limita el tipo de recursos al que los murciélagos pueden acceder (Dumont, 2003; Giannini y Kalko, 2004; Sánchez et al., 2012a). Observamos que A. planirostris es más flexible que A. lituratus y consume en proporciones similares frutos de los géneros Piper, Cecropia, Solanum y Vismia (Tabla 2). La cantidad reducida de datos no nos permite aportar evidencia robusta para parejas de especies como D. phaeotis-D. gnoma, U. bilobatum-U. magnirostrum y R. pumilio- R. fischerae. Sin embargo, encontramos que siempre existía un consumo diferencial de recursos al comparar los registros dietarios (Tabla 1). Estos patrones han sido encontrados en otras localidades del Neotrópico (Sánchez et al., 2012a; Andrade et al., 2013), y constituyen una base para generar hipótesis sobre las estrategias que moldean la estructura de los ensambles a diferentes niveles filogenéticos.
Nuestro análisis provee además información relevante sobre las relaciones tróficas de algunas especies con pocos registros dietarios. Ejemplo de ello lo constituyen Carollia brevicauda y U. bilobatum, cuya dieta es conocida únicamente por seis muestras cada una, pero que se ajustan claramente entre los grupos de consumidores de Piper spp. y Cecropia spp., respectivamente. Para establecer conclusiones robustas acerca de los hábitos alimenticios de especies como Phylloderma stenops, Chiroderma villosum, Vampyressa thyone y Mesophylla macconnelli, se requieren otras aproximaciones que permitan obtener una mayor cantidad de muestras. Varias de estas especies se limitan a absorber la parte líquida del fruto y no tragan las semillas (Dumont, 2003; Nogueira y Peracchi, 2003), por lo que el examen de las heces resulta inadecuado para evaluar sus patrones de dieta. Por ejemplo, si bien revisamos seis heces de M. macconnelli, dos contenían semillas y cuatro solo pulpa de fruta. En este sentido, es necesario incrementar los esfuerzos para realizar experimentos controlados de selección de recursos (Nogueira y Peracchi, 2003; Andrade et al., 2013), así como el uso de isotopos estables para la descripción de dietas (Rex et al., 2011), con el fin de obtener un panorama más completo sobre los patrones de consumo a nivel de ensamble.
A pesar del número relativamente bajo de muestras, considerando que realizamos el estudio en dos épocas climáticas contrastantes y que la representatividad del muestreo fue alta para los estimadores utilizados (Fig. 2), nuestros resultados permiten explicar los patrones generales sobre los mecanismos de partición de recursos en el ensamble estudiado, ya que las especies evaluadas centraron su dieta en plantas con periodos de fructificación continuos. Son muchos los esfuerzos para generar información sobre las dietas de los murciélagos en el Neotrópico (Giannini y Kalko, 2004; Gonçalves Da Silva, 2008; Lobova et al., 2009; Estrada- Villegas, 2010; Andrade et al., 2013; Saldaña et al., 2013). Sin embargo, es evidente la escasez de conocimiento de la influencia de la filogenia sobre los patrones de fructificación y su relación con los mecanismos de exclusión competitiva para grupos hermanos de especies (Bonaccorso et al., 2007; Andrade et al., 2013), así como la influencia de los regímenes de disturbio sobre la selección de recursos por parte de las especies de murciélagos frugívoros. Aunque la asociación de las plantas del género Ficus y las especies de la familia Stenodermatinae ha sido ampliamente documentada (Dumont et al., 2004; Andrade et al., 2013; Saldaña et al., 2013), falta evidencia empírica sobre la importancia relativa de los factores que influyen en la selección de recursos de los murciélagos como respuesta a cambios temporales y espaciales a diferentes escalas (e.g. Sánchez et al., 2012b).
Diferentes autores han utilizado las categorías de nómadas y sedentarios para analizar patrones de consumo o inferir los efectos de la fragmentación sobre este grupo de fauna (Cosson et al., 1999; Bernard y Fenton, 2003; Estrada-Villegas et al., 2010). Con base en nuestros resultados y los patrones encontrados en otras localidades (Gonçalves Da Silva, 2008; Estrada-Villegas, 2010; Sánchez et al., 2012b), resaltamos la necesidad de reevaluar esta clasificación con el fin de entender la relación de los murciélagos con procesos clave como la dispersión de semillas (Trevelin et al., 2013) y las respuestas de las especies a la fragmentación (Cosson et al., 1999; Bernard y Fenton, 2003). La realización de estudios que evalúen la relación entre los patrones de movimiento de los murciélagos, la fenología de las plantas y la distribución espacial de los recursos en áreas continuas y fragmentadas, permitirá explicar de mejor manera los mecanismos que favorecen la coexistencia de este grupo de fauna a nivel de paisaje.
AGRADECIMIENTOS
Los autores agradecemos a Colciencias y al programa Jóvenes Investigadores e innovadores “Virginia Gutiérrez de Pineda”, el cual financió la pasantía de investigación de Andrés F. Suárez-Castro. Además, agradecemos el apoyo económico otorgado por la Dirección de Investigación de la Universidad Nacional de Colombia sede Bogotá (DIB) (Proyecto 14341) y la Dirección de Investigación de la Universidad Nacional de Colombia sede Orinoquía (Proyecto 13782). La fundación IDEA WILD y el biólogo Miguel Rodríguez-Posada aportaron equipos que permitieron el desarrollo de la fase de campo. Jorge Enrique Contreras, Amparo de Contreras, Jorge Luis Contreras Herrera nos ofrecieron su hospitalidad en el área de estudio. Darwin Manuel Morales Martínez, Diana Sofía López y Gonzalo Pinilla-Buitrago Cubillos colaboraron con el trabajo de campo y laboratorio, mientras que Diego Mauricio Cabrera apoyó el componente botánico del proyecto. Héctor Ramírez-Chaves, César Bracamonte y un revisor anónimo realizaron valiosos comentarios en una fase preliminar del manuscrito. Finalmente agradecemos a los grupos de “Mastozoología” y de “Conservación y Manejo de Vida Silvestre” de la Universidad Nacional de Colombia por apoyar el desarrollo de todo el proceso.
LITERATURA CITADA
1. AGUIRRE LF, A HERREL, R VAN DAMME y EM THYSEN 2003. The implications of food hardness for diet in bats. Functional Ecology 17:201-212. [ Links ]
2. ANDRADE TY, W THIES, PK ROGERI, EKV KALKO y MAR MELLO. 2013. Hierarchical fruit selection by Neotropical leaf-nosed bats (Chiroptera: Phyllostomidae). Journal of Mammalogy 94:1094-1101. [ Links ]
3. BERG CC y P FRANCO-ROSELLI. 2005. Cecropia. Flora Neotropica Monograph 94. The New York Botanical Garden, New York. [ Links ]
4. BERNARD E y B FENTON. 2003. Bat mobility and roosts in a fragmented landscape in Central Amazonia, Brazil. Biotropica 35:262-277. [ Links ]
5. BONACCORSO FJ. 1979. Foraging and reproductive ecology in a Panamanian bat community. Bulletin of the Florida State Museum, Biological Sciences 24:359-408. [ Links ]
6. BONACCORSO FJ y TJ GUSH. 1987. Feeding behaviour and foraging strategies of captive phyllostomid fruit bats: An experimental study. The Journal of Animal Ecology 56:907-920. [ Links ]
7. BONACCORSO FJ, JR WINKELMANN, D SHIN, CI AGRAWAL, N ASLAMI, A HSU, PE JEKIELEK, AK KNOX, SJ KOPACH, TD JENNINGS, JR LASKY, SA MENESALE, JH RICHARDS, JA RUTLAND, AK SESSA, L ZHAUROVA y TH KUNZ. 2007. Evidence for exploitative competition: Comparative foraging behavior and roosting ecology of short-tailed fruit bats (Phyllostomidae). Biotropica 39:249-256. [ Links ]
8. BURNS KC. 2005. Is there limiting similarity in the phenology of fleshy fruits? Journal of Vegetation Science 16:617-624. [ Links ]
9. COLWELL RK. 2013. ESTIMATES, Version 9.1: statistical estimation of species richness and shared species from samples. <URL: purl.oclc.org/estimates> [ Links ].
10. CONTRERAS-HERRERA JL. 2011. Caracterización florístico estructural de un bosque en el suroriente de la Serranía de la Macarena (Meta, Colombia). Trabajo de Grado. Departamento de Biología, Facultad de Ciencias, Universidad Nacional de Colombia. 33 pp. [ Links ]
11. COSSON JF, JM PONS y D MASSON. 1999. Effects of forest fragmentation on frugivorous and nectarivorous bats in French Guiana. Journal of Tropical Ecology 15:515-534. [ Links ]
12. DAVIS WB.1968. Review of the genus Uroderma (Chiroptera). Journal of Mammalogy 49:676-698. [ Links ]
13. DUMONT ER. 2003. Bats and fruit: An ecomorphological approach. Pp. 308-428, en: Bat ecology (T. Kunz y HR Fenton, eds.). The University of Chicago Press, Chicago. [ Links ]
14. ESTRADA-VILLEGAS S, J PÉREZ-TORRES y PR STEVENSON. 2010. Ensamblaje de murciélagos en un bosque subandino colombiano y análisis sobre la diera de algunas esepcies. Mastozoología Neotropical 17:31-41. [ Links ]
15. FLEMING TH. 1986. Opportunism versus specialization: The evolution of feeding strategies in frugivorous bats. Pp. 105-116, en: Frugivores and seed dispersal (A Estrada y TH Fleming, eds.). Dr. W. Junk Publishers, Dordrecht. [ Links ]
16. FLEMING TH y CF WILLIAMS. 1990. Phenology, seed dispersal, and recruitment in Cecropia peltata (Moraceae) in Costa Rican tropical dry forest. Journal of Tropical Ecology 6:163-178. [ Links ]
17. FOURNIER L y C CHARPANTIER. 1975. El tamaño de la muestra y la frecuencia de las observaciones en el estudio de las características fenológicas de los árboles tropicales. Turrialba 25:45-48. [ Links ]
18. GALINDO-GONZÁLEZ J. 1998. Dispersión de semillas por murciélagos: su importancia en la conservación y regeneración del bosque tropical. Acta Zoológica Mexicana. 73:57-74. [ Links ]
19. GARDNER AL. 2008. Mammals of South America, volume 1, Marsupials, xenarthrans, shrews and bats. University of Chicago Press, Chicago. [ Links ]
20. GIANNINI NP y EKV KALKO.2004. Trophic structure in a large assemblage of phyllostomid bats in Panama. Oikos 105:209-222. [ Links ]
21. GONÇALVES DA SILVA A, O GAONA y RA MEDELLÍN. 2008. Diet and trophic structure in a community of fruit-eating bats in Lacandon Forest, México. Journal of Mammalogy 89:43-49. [ Links ]
22. GOTELLI NJ y GL ENTSMINGER. 2006. EcoSim: null models software for ecology, Version 7.72. Acquired Intelligence and Kesey-Bear, Jericho, VT05465. Disponible en línea: <http://garyentsminger.com/ecosim/index.htm> [ Links ].
23. GOTELLI NJ y RK COLWELL. 2011. Estimating species richness. Pp. 39-54, en: Frontiers in measuring biodiversity (AE Magurran y BJ McGill, eds). Oxford University Press, New York. [ Links ]
24. HAMMER Ø, DAT HARPER y PD RYAN. 2001. PAST: paleontological statistics software package for education and data analysis. Palaeontología Electrónica 4(1):9pp. http://palaeo-electronica.org/2001_1/past/ issue1_01.htm. [ Links ]
25. HOLLIS L. 2005. Artibeus planirostris. American Society of Mammalogists 775:1-6. [ Links ]
26. IDEAM 2010. Instituto de Hidrología, Meteorología y Estudios Ambientales. <http://institucional.ideam.gov.co> [ Links ].
27. KALKO E, C HANDLEY y D HANDLEY. 1996. Organization, diversity, and long-term dynamics of a Neotropical bat community. Pp. 503-553, en: Long-term studies in vertebrate communities. Academic Press, Los Angeles. [ Links ]
28. KREBS CJ. 1999. Ecological methodology. Addison Wesley Longman, Menlo Park, California. [ Links ]
29. KUNZ TH y PARSONS (Eds.). 2009. Ecological and behavioral methods for the study of bats. Smithsonian Institution Press, Washington, D.C. [ Links ]
30. LINARES EL y ED MORENO-MOSQUERA. 2010. Morfología de los frutiolos de Cecropia (Cecropiaceae) del Pacífico colombiano y su valor taxonómico en el estudio de dietas de murciélagos. Caldasia 32:275-287. [ Links ]
31. LOBOVA TA, SA MORI, F BLANCHARD, H PECKHAM y P CHARLES-DOMINIQUE. 2003. Cecropia as a food resource for bats in French Guiana and the significance of fruit structure in seed dispersal and longevity. American Journal of Botany 90:388-403. [ Links ]
32. LOBOVA TA, CK GEISELMAN y SA MORI. 2009. Seed dispersal by bats in the Neotropics. New York Botanical Garden Press, New York. [ Links ]
33. MARINHO-FILHO J. 1991. The coexistence of two frugivorous bat species and the phenology of their food plants in Brazil. Journal of Tropical Ecology 7:59-67. [ Links ]
34. MILTON K. 1991. Leaf change and fruit production in six Neotropical Moraceae species. Journal of Ecology 79:1-26. [ Links ]
35. MUSCARELLA R y TH FLEMING. 2007. The role of frugivorous bats in tropical forest succession. Biological Reviews 82:573-E590. [ Links ]
36. NOGUEIRA MR y AL PERACCHI. 2003. Fig-seed predation by 2 species of Chiroderma: Discovery of a new feeding strategy in bats. Journal of Mammalogy 84:225-233. [ Links ]
37. PATTERSON BD, MR WILLIG y R STEVENS. 2003. Trophic strategies, niche partitioning, and patterns of ecology organization. Pp. 536-579, en: Bat ecology (TH Kunz y MB Fenton, eds.). University of Chicago Press, Chicago. [ Links ]
38. RAMOS PEREIRA MJ, JT MARQUEZ y JM PALMEIRIM. 2010. Ecological responses of frugivorous bats to seasonal fluctuation in fruit availability in Amazonian Forest. Biotropica 42:680–687.
39. REX K, R MICHENER, TH KUNZ y CC VOIGT. 2011 Vertical stratification of Neotropical leaf-nosed bats (Chiroptera: Phyllostomidae) revealed by stable carbon isotopes. Journal of Tropical Ecology 27:211-222. [ Links ]
40. RIVAS-PAVA P, P SÁNCHEZ-PALOMINO y A CADENA. 1996. Estructura trófica de la comunidad de quirópteros en bosques de galería de la serranía de La Macarena (Meta-Colombia). Pp. 237-248, en: Contributions in Mammalogy: A memorial volume Honoring Dr. J. Knox Jones, Jr. (HH Genoways y RJ Baker, eds.). Texas Press Tech, Lubbock. [ Links ]
41. RODRÍGUEZ-POSADA M y P SÁNCHEZ-PALOMINO. 2009 Taxonomía del género Phyllostomus (Chirotepra: Phyllostomidae) en Colombia. Mastozoología Neotropical 16:153-168. [ Links ]
42. SALDAÑA-VÁZQUEZ RA, VJ SOSA, IÑIGUEZ-DÁVALOS y JE SCHONDUBE. 2013. The role of extrinsic and intrinsic factors in Neotropical fruit bat-plant interactions. Journal of Mammalogy 94:632-639. [ Links ]
43. SÁNCHEZ MS, NP GIANNINI y RM BARQUEZ. 2012a. Bat frugivory in two subtropical rain forests of northern Argentina: Testing hypotheses of fruit selection in the Neotropics. Mammalian Biology 77:22-31. [ Links ]
44. SÁNCHEZ MS, LV CARRIZO, NP GIANNINI y RM BARQUEZ. 2012b. Seasonal patterns in the diet of frugivorous bats in the subtropical rainforests of Argentina. Mammalia 76:269-275. [ Links ]
45. SILVEIRA M, L TREVELIN, M PORT-CARVALHO, S GODOI, E MANDETTA y A CRUZ-NETO. 2011. Frugivory by phyllostomid bats (Mammalia: Chiroptera) in a restored area in Southeast Brazil. Acta Oecologica-International Journal of Ecology 37:31-36. [ Links ]
46. SNOW DW. 1965. A possible selective factor in the evolution of fruiting seasons in tropical forest. Oikos 15:274-281. [ Links ]
47. SORIANO J. 2000. Functional structure of bat communities in tropical rainforest and Andean cloud forest. Ecotropicos 13:1-20. [ Links ]
48. STRAUBE FC y GV BIANCONI. 2002. Sobre a grandeza e a unidade utilizada para estimar esforço de captura com utilização de redes-de-neblina. Chiroptera Neotropical 8:150-152. [ Links ]
49. THIES W y EKV KALKO. 2004. Phenology of Neotropical pepper plants (Piperaceae) and their association with their main dispersers, two short-tailed fruit bats, Carollia perspicillata and C. castanea (Phyllostomidae). Oikos 104:362-376. [ Links ]
50. TREVELIN LC, M SILVEIRA, M PORT-CARVALHO, DH HOMEM y AP CRUZ-NETO. 2013. Use of space by frugivorous bats (Chiroptera: Phyllostomidae) in a restored Atlantic forest fragment in Brazil. Forest Ecology and Management 29:136-143. [ Links ]
51. VELAZCO PM, AL GARDNER y BD PATTERSON. 2010. Systematics of the Platyrrhinus helleri species complex (Chiroptera: Phyllostomidae), with descriptions of two new species. Zoological Journal of the Linnean Society 159:785-812. [ Links ]
52. VILLAREAL H, M ÁLVAREZ, S CÓRDOBA, F ESCOBAR, G FAGUA, F GAST, H MENDOZA, M OSPINA y AM UMAÑA.2004. Manual de métodos para el desarrollo de inventarios de biodiversidad. Segunda edición. Programa de Inventarios de Biodiversidad. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá [ Links ].
53. ZURC D y P VELAZCO. 2010. Análisis morfológico y morfométrico de Carollia colombiana Cuartas et al. 2001 y C. monohernandezi Muñoz et al. 2004 (Phyllostomidae: Carollinae) en Colombia. Chiroptera Neotropical 16:549-567. [ Links ]














