Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.22 no.2 Mendoza Dec. 2015
ARTÍCULO
Variación espacial en la depredación por puma (Puma concolor) sobre guanacos (Lama guanicoe) en la Payunia, Mendoza, Argentina
María J. Bolgeri1 y Andrés J. Novaro1, 2
1 Programa Estepa Patagónica y Andina, Wildlife Conservation Society, Argentina. Curruhué 395, 8371 Junín de los Andes, Neuquén, Argentina. [correspondencia: Andrés J. Novaro <anovaro@wcs.org>].
2 INIBIOMA-CONICET-Universidad Nacional del Comahue, Centro de Ecología Aplicada del Neuquén, 8371 Junín de los Andes, Neuquén, Argentina.
RESUMEN.
Estudiamos los patrones de depredación por puma sobre guanacos en dos sitios con diferente topografía en La Payunia, Mendoza, Argentina, analizando selección por sexo, edad y estado nutricional. La depredación fue la causa más frecuente de muerte (73%, n = 118 carcasas). En el sitio Este (más escarpado) los guanacos fueron depredados con mayor frecuencia que lo esperado en base a su densidad. No encontramos selección por parte de pumas por edades ni condición nutricional de guanacos, pero sí de machos por encima de hembras, a diferencia de otros estudios. En invierno, cuando se reduce el forraje, aumentó la frecuencia de carcasas en condición nutricional pobre.
ABSTRACT.
Spatial variation in predation by pumas (Puma concolor) on guanacos (Lama guanicoe) in Payunia, Mendoza, Argentina.
We studied patterns of puma predation on guanacos in two sites with different topography in La Payunia, Mendoza, Argentina, analyzing selection of prey by sex, age and nutritional condition. Predation was the most frequent mortality cause (73%, n = 118 carcasses) and was more frequent than expected according to guanaco density in the more rugged eastern site. We did not find prey selection by age nor nutritional condition, but pumas selected guanaco males over females, in contrast with other studies. In winter, when forage availability declines, the frequency of carcasses in poor nutritional condition increased.
Palabras clave: Depredador-presa; Migración estacional; Selección de presas.
Key words: Predator-prey; Prey selection; Seasonal migration.
Recibido 29 junio 2015.
Aceptado 13 agosto 2015.
Editor asociado: J Pereira
INTRODUCCIÓN
Conocer los patrones de depredación de un depredador sobre su presa nos ayuda a entender los impactos de esta interacción sobre el comportamiento y la dinámica poblacional del depredador y de la presa, y sobre otros componentes del ecosistema (Pierce et al., 2000a; Hebblewhite et al., 2005; Beyer et al., 2007; Ford et al., 2014). La intensidad de la depredación suele variar espacialmente dependiendo de factores como la disponibilidad de refugios para la presa y el depredador y la abundancia de presas alternativas (Kolowski y Holekamp, 2006; Ford et al., 2014). Por otro lado, si la presa tiene desplazamientos de tipo migratorio o importantes cambios estacionales en el uso del espacio, los mismos individuos pueden verse expuestos a distintos niveles de depredación dependiendo de dónde se encuentren (Fryxell y Sinclair, 1988; Fryxell, 1995).
El puma (Puma concolor) es el carnívoro tope por su tamaño (34 a 101 kg) (Hornocker, 1970) en la mayoría de los ambientes semiáridos de Sudamérica, y en el Cono Sur se distribuye hasta el extremo sur del área continental de Chile y Argentina (Walker y Novaro, 2010). El guanaco (Lama guanicoe) es el ungulado nativo dominante por su abundancia y tamaño (110-140 kg en adultos) en dichos ambientes en la zona central y sur de estos dos países. La interacción entre ambas especies fue afectada en partes de sus distribuciones por la extirpación del puma como consecuencia del conflicto con el ganado, la reducción de la densidad de guanacos por la acción humana directa, y el aumento de la prevalencia de especies introducidas (Novaro y Walker, 2005; Zanón et al., 2012). Donde los guanacos son abundantes constituyen la presa principal del puma (Iriarte et al., 1991; Zanón et al., 2012; Fernández y Baldi, 2014) y la depredación es una causa importante de muerte en los guanacos (Bank et al., 2002; Fernández y Baldi, 2014).
Mientras algunas de las poblaciones de guanacos estudiadas son sedentarias (Fernández y Baldi, 2014), otras tienen desplazamientos estacionales asociados con cambios en la disponibilidad de recursos (Cajal y López, 1987; Ortega y Franklin, 1995; Bank et al., 2002). Sin embargo, estos estudios no analizaron diferencias espaciales en la incidencia de la depredación. Estas diferencias espaciales pueden ser importantes para entender, por ejemplo, los factores que afectan la vulnerabilidad de distintos componentes de la población de guanacos y su comportamiento antipredatorio (Marino y Baldi, 2008) o la selección de hábitat por los pumas y guanacos (Elbroch y Wittmer, 2012; Flores et al., 2012).
Los objetivos de este estudio fueron caracterizar los patrones de depredación del puma sobre una población de guanacos parcialmente migratoria y describir variaciones espaciales en la incidencia de la depredación en relación a otras causas de mortalidad. En base al tipo de caza al acecho que realizan los pumas (Hornocker, 1970), esperamos que en sitios de relieve escarpado y con vegetación arbustiva alta, que favorecen la emboscada, la incidencia de la depredación sea mayor que en sitios menos escarpados y con vegetación más baja (Marino y Baldi, 2008; Franklin et al., 1999; Bank et al., 2002).
MATERIALES Y MÉTODOS
Área de estudio
El estudio se desarrolló entre noviembre de 2005 y noviembre de 2010 en el área natural protegida La Payunia, en el sur de la provincia de Mendoza, Argentina (Fig. 1). La población de guanacos de La Payunia, con más de 25 000 individuos, es la población protegida más grande de la especie (Puig et al., 2003; Schroeder et al., 2014). El área protegida tiene una superficie de 6641 km2, pero el 70% es propiedad privada y en la mayor parte de esta se practica ganadería extensiva, principalmente de caprinos (Candia et al., 1993). La topografía es dominada por la actividad volcánica que dejó numerosas coladas basálticas, parcialmente cubiertas por arenas eólicas, y conos volcánicos inactivos que forman picos que en el sur de la reserva llegan a 3700 m s.n.m. (Martínez Carretero, 2004). El área de estudio se ubicó entre 1250 y 2200 m s.n.m.
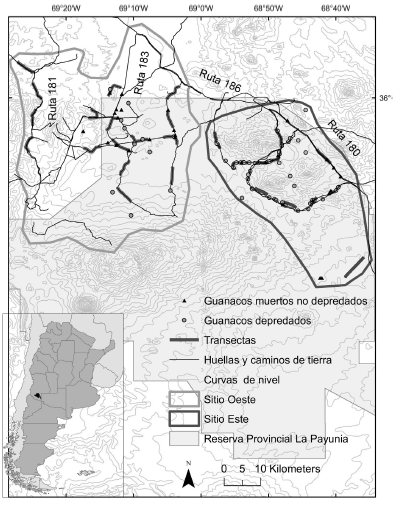
Fig. 1. Sitios de estudio en Payunia, con indicación de las transectas utilizadas para estimar densidad de guanacos en huellas y caminos y las carcasas de guanacos halladas.
La vegetación es xerofita, con 58% de cobertura promedio, y corresponde a la provincia fitogeográfica La Payunia (Martínez Carretero, 2004). En las planicies arenosas predominan las comunidades herbáceas dominadas por Panicum urvilleanum, Poa sp. y Stipa sp., y en las pendientes y coladas basálticas predominan comunidades arbustivas formando matorrales de Larrea sp., Neosparton aphyllum y Ephedra ochreata con herbáceas como P. urvilleanum (Candia et al., 1993; Puig et al., 2003). El clima es desértico continental con precipitación media anual de 255 mm y temperatura media del mes más cálido de 20 ºC y del mes más frío de 6 ºC (Puig et al., 1996).
Se estableció el área de estudio donde ocurren las mayores densidades de guanacos: la zona norte y este de la reserva (Puig et al., 2003; Schroeder et al., 2014), más un sector adyacente al noroeste (Bolgeri y Novaro, obs. pers.). Algunos sectores de intenso uso por guanacos se excluyeron debido a la falta de acceso por huellas transitables con un vehículo 4 x 4 (Fig. 1).
Dividimos el área de estudio en dos sitios de muestreo, denominados de aquí en más Oeste y Este, en base a diferencias en topografía y a información de pobladores locales sobre uso estacional por guanacos, verificada por telemetría entre 2005 y 2010 (Bolgeri y Novaro, datos no publ.). Mientras 14 de 28 guanacos adultos capturados en el Oeste y rastreados con radiocollares (por 18 a 40 meses) permanecieron todo el año en el Oeste, 14 se desplazaron al Este durante 1 y 3 inviernos y regresaron al Oeste en primavera. A través de conteos en transectas (ver abajo) y un estudio posterior de telemetría (Ruiz Blanco y Novaro, datos no publ.) confirmamos que también hay guanacos que utilizan el Este todo el año. El área relevada en el Oeste tuvo una extensión de 1907 km2 y en el Este de 1117 km2 (Fig. 1).
El sitio Oeste presenta un relieve predominantemente suave, con amplias planicies interrumpidas por colinas elevadas pero de laderas poco escarpadas y escasas coladas y afloramientos rocosos (Candia et al., 1993; Bolgeri, obs. pers.). El Este presenta un relieve más quebrado que el Oeste, predominando cerros de laderas escarpadas (ej. Zaino), afloramientos rocosos y planicies interrumpidas por abundantes coladas que formaron extensas áreas mesetiformes erosionadas e irregulares llamadas “escorias” (Candia et al., 1993). La densidad promedio de ganado vulnerable a pumas (equinos juveniles, caprinos y ovinos) durante el estudio fue 6.7 ± 1.1 ind./ km2 en el Oeste y 5.0 ind./km2 ± 2.1 en el Este (Bolgeri y Novaro, datos no publ.).
Entre mayo de 2007 y febrero de 2009 se estimó la cobertura de arbustos altos que pueden dar cobertura para acecho por pumas con transectas de punto de intersección (Diersing et al., 1992) de 50 m de largo dispuestas al azar (n Oeste = 115 transectas y n Este = 111). Se registraron las especies de más de 0.5 m de altura: Larrea sp., E. ochreata, Schinus sp., Berberis grevilleana, Prosopis alpataco, N. aphyllum y Senecio subulatus.
Análisis de carcasas de guanacos y causas de muerte
Desde noviembre de 2005 a marzo de 2010, con frecuencia semanal, se buscaron carcasas de guanacos desde caminos secundarios y huellas (Fig. 1) en vehículo o a pie o guiándonos por la presencia de aves carroñeras. Se determinó el sexo por observación de genitales o dimorfismo en la sínfisis pubiana (Raedeke, 1979) y la edad en base al desgaste y reemplazo dentario (Raedeke, 1979; Puig y Monge, 1983). Cuando fue posible, se determinó la causa de muerte y se registró la presencia de arbustos de más de 0.5 m a una distancia ≤ 25m de la carcasa (Husseman et al., 2003).
Se identificó la muerte por puma cuando se observaron signos como la carcasa semienterrada o ubicada sobre arbustos, marcas grandes de caninos en cuello, garganta o cráneo, huesos largos rotos y marcas de arrastre (Franklin et al., 1999; Shaw et al., 2007). Al igual que en otros estudios, esperamos un sesgo en el hallazgo de carcasas debido a una más rápida desaparición de carcasas de crías que de adultos (Franklin et al., 1999).
Se comparó la proporción de sexos observada en los guanacos depredados por pumas con la proporción esperada asumiendo una proporción en la población de 1:1 (Puig, 1986) por medio de una prueba X2 de bondad de ajuste. Esta comparación se realizó para cada sitio y globalmente para el área de estudio. Se utilizó el programa Statistica versión 8 (StatSoft Inc., 2013).
Evaluamos la condición nutricional de los guanacos por análisis visual de la grasa medular del fémur (Cheatum, 1949; Bank et al., 2002). Clasificamos como en buen estado a guanacos con médula de color blanco-amarillento y consistencia sólida, y como pobre estado a los de médula rosada y gelatinosa. Descartamos a las crías < 3 meses de edad ya que el color de su médula puede depender del proceso de diferenciación de células sanguíneas. Para determinar si hubo diferencias entre la proporción de estados bueno/pobre en los guanacos depredados por pumas y los guanacos muertos por otras causas comparamos estas proporciones con una prueba de independencia de X2. Debido a que en ungulados silvestres el estado nutricional es afectado por la fenología del forraje, analizamos las proporciones de estados para las distintas causas de muerte en las cuatro estaciones del año utilizando una prueba exacta de Fisher. Usamos la prueba de independencia de X2 para evaluar diferencias entre la proporción de estados bueno/pobre en guanacos depredados en el Oeste y el Este.
Disponibilidad de guanacos por sitios y por edades
Estimamos la disponibilidad de guanacos en cada sitio a través de su densidad, utilizando transectas de línea de ancho variable de 5 km de largo sobre huellas y caminos secundarios (Fig. 1). En ambos sitios se realizaron dos relevamientos en cada estación del año desde el otoño 2006 a la primavera 2010, muestreando 12 transectas permanentes en el Oeste (n = 175 muestreos) y 10 en el Este (n = 88 muestreos). Circulando en un vehículo a 20 km/ hora, con dos observadores en la caja, medimos las distancias perpendiculares al centro de cada grupo de guanacos con telémetro láser, truncando los datos a 800 m. Usamos el programa DistanceSampling versión 6.0 para diseñar la ubicación de las transectas y analizar los datos y comparamos densidades entre sitios con una prueba de “t” con corrección de Welch (Buckland et al., 1993, 2001). En base a la densidad promedio de cada sitio calculamos la frecuencia esperada de guanacos depredados, la que comparamos con la frecuencia observada con una prueba X2 de bondad de ajuste (Franklin et al., 1999; Bank et al., 2002; Fernández y Baldi, 2014).
Para estimar la disponibilidad relativa de guanacos adultos y chulengos (crías < 1 año de edad) maximizamos el tamaño de muestra realizando conteos mensuales, independientes de las transectas de línea, en 21 transectas permanentes a lo largo de un total de 251 km en todas las huellas y caminos de ambos sitios. Desde noviembre de 2005 a abril de 2010 registramos todos los adultos y chulengos hasta unos 200 m a cada lado (n = 1109 conteos). A diferencia de otros autores (Franklin et al., 1999; Fernández y Baldi, 2014) no diferenciamos adultos de juveniles (1 a 2 años de edad) para reducir errores de clasificación de juveniles cercanos a 2 años de edad y porque obtuvimos muchos de los registros a largas distancias (100-200 m).
Para evaluar la selección de edades se analizó la depredación y disponibilidad de crías agrupando los datos en dos períodos, correspondiendo uno al momento de mayor vulnerabilidad de crías (desde noviembre a mayo, es decir hasta los seis meses posteriores a su nacimiento) y otro de menor vulnerabilidad (junio a octubre) (Puig, 1986). Debido al escaso número de guanacos depredados encontrados en el Oeste (ver Resultados) y a que las proporciones entre adultos y crías depredadas y disponibles fueron similares entre sitios (Bolgeri y Novaro, datos no publ.), analizamos la selección de edades por pumas combinando los datos de ambos sitios. Descartamos del análisis 8 carcasas para las que teníamos dudas, debido a su fecha de hallazgo, sobre asignarlas a uno u otro período. Comparamos la frecuencia observada de adultos y crías depredadas en cada período con las frecuencias esperadas en base a los conteos usando una prueba X2 de bondad de ajuste.
RESULTADOS
Causas de mortalidad y disponibilidad de guanacos en cada sitio
Hallamos 334 carcasas de guanaco pero solo 118 eran suficientemente frescas para evaluar causa de muerte. La depredación por puma fue la causa de muerte más frecuente (72.9%; Fig. 2). El 59% de los guanacos depredados estaban semienterrados u ocultos entre arbustos. Para 22.9% de los guanacos no encontramos evidencias inequívocas de la causa de muerte, pero ninguno tenía evidencias de depredación y 4 tenían signos de enfermedades que podrían haber causado la muerte. Otras causas de muerte fueron atropellamiento, enganche en alambrados y caza furtiva (4.2% en total) (Fig. 2). La incidencia relativa de la depredación fue significativamente mayor en el Este, donde causó el 82.1% de las muertes frente al 50% en el Oeste (Fig. 2; X2 = 22.82, g.l. = 1, p0.05 = 0.0001).
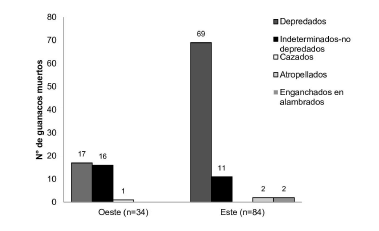
Fig. 2. Número de guanacos depredados por puma y muertos por otras causas en dos sitios de Payunia.
La densidad promedio anual en el Este (13.7 guanacos/km2 ± 1.84) fue significativamente mayor que en el Oeste (7.8 guanacos/km2 ± 1.14; t = 27.54, g.l. = 121, p0.05 < 0.0001). El número observado de guanacos muertos por puma (Fig. 2) fue significativamente mayor que el número esperado de acuerdo a su densidad en el Este (55) y menor que el esperado en el Oeste (31) (X2 = 9.88, g.l. = 1, p0.05 = 0.0016).
El 64.3% de las carcasas halladas en el Oeste y el 57.7% en el Este estuvo a ≤ 25 m de distancia de arbustos de > 0.5 m de altura, mientras que el resto estuvo rodeado por arbustos bajos o pastizales. La cobertura de arbustos de > 0.5 m de altura fue significativamente mayor en el Oeste (5.6%; SD = 7.1) que en el Este (2.0%; SD = 3.6) (F = 3.86, p = 0.0001; Prueba U Mann Whitney = 3973.5; p = 0.0001).
Depredación de guanacos según sexo, edad y estado nutricional
Los guanacos machos fueron depredados con mayor frecuencia (62.9%) que las hembras (n total = 70; X2 = 4.3, g.l. = 1,p0.05 = 0.031; Tabla 1). La mayor depredación de machos que de hembras ocurrió en ambos sitios, pero las diferencias entre sexos en cada sitio no fueron significativas (Oeste: X2 = 1.14, g.l. = 1, p0.05 = 0.285; Este: X2 = 3.5,g.l. = 1, p0.05 = 0.061; Tabla 1).
Tabla 1 Número de guanacos depredados por puma según edad, sexo y ubicación en Payunia.

El 22.1% de los guanacos hallados depredados fueron crías (Tabla 1). Entre noviembre y mayo observamos 16 crías (32.7%) y 33 adultos (67.3%) depredados, y entre junio y octubre observamos 3 crías (10.3%) y 26 adultos (89.7%) depredados.
Como se esperaba, hubo una mayor disponibilidad relativa de crías en el período que siguió a la parición. Entre noviembre y mayo registramos 29.8% de crías en las transectas, y entre junio y octubre 13.9% de crías (Fig. 3). A partir de esta disponibilidad, el número de carcasas esperadas de noviembre a mayo fue de 15 crías y 34 adultos, y de junio a octubre de 4 crías y 25 adultos. Los números de carcasas de crías y adultos observadas y esperadas no difirieron significativamente en ninguno de los dos períodos (noviembre a mayo: = 0.096, g.l. = 1, p0.05 = 0.756; junio a octubre: X2 = 0.290, g.l. = 1, p0.05 = 0.590) (Fig. 3).
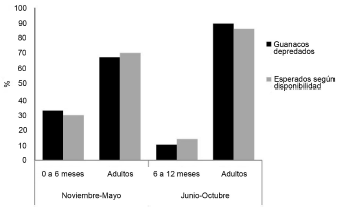
Fig. 3. Porcentajes de guanacos depredados por puma observados y esperados según su disponibilidad en dos períodos del año y para dos clases de edad en Payunia.
Entre los guanacos muertos para los que pudimos analizar la médula ósea (n = 70) el 45.7% estuvo en condición nutricional pobre. Los porcentajes de guanacos depredados en condición nutricional buena (52.6%) y pobre (47.3%) según su médula ósea (n = 38) no difirieron significativamente de los guanacos muertos por otras causas (n = 32), que tuvieron 56.2% en condición buena y 43.8% en condición pobre (X2 = 0.090, g.l. = 1, p0.05 = 0.762). Sin embargo, estas proporciones difirieron a lo largo del año (Fig. 4). En invierno y primavera hubo más guanacos depredados en condición pobre que buena, a diferencia de lo ocurrido en verano y otoño (Prueba exacta de Fisher, P = 0.024). Entre los guanacos muertos por otras causas, en invierno también hubo más guanacos en condición pobre que buena, pero esta proporción no difirió significativamente del resto de las estaciones (Prueba exacta de Fisher, P = 0.351).
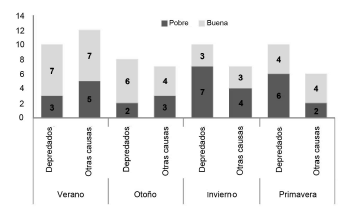
Fig. 4. Diferencias estacionales en la condición de la grasa medular en guanacos depredados y muertos por otras causas.
Las proporciones de condiciones nutricionales encontradas en machos (n = 12 buena y 9 pobre) y hembras depredadas (n = 5 buena y 6 pobre) no difirieron significativamente (X2 = 0.400, df = 1, p0.05 = 0.529). Proporcionalmente hubo peores condiciones nutricionales en guanacos depredados en el Oeste (n = 2 buena y 5 pobre) que en el Este (n = 18 buena y 13 pobre) pero estas diferencias no fueron significativas (X2 = 1.990, g.l. = 1, P = 0.158).
DISCUSIÓN
La incidencia de la depredación por pumas que documentamos para los guanacos de Payunia está entre las más altas reportadas. La depredación también fue importante en poblaciones de la costa patagónica que coexisten con poblaciones abundantes de pumas (78%, Marino, 2010; 51%, Fernández y Baldi, 2014) y en áreas con gran acumulación invernal de nieve (74%, Bank et al., 2002). La depredación por pumas también tuvo un rol importante en la mortalidad en otros ungulados (Hornocker, 1970).
El mayor número de guanacos depredados en comparación con lo esperado según su disponibilidad en el Este y menor número en el Oeste podrían deberse a la mayor vulnerabilidad provocada por la topografía más escarpada en el Este. Los afloramientos rocosos que disectan los llanos del Este, además de facilitar el acecho por pumas, pueden limitar las corridas de huida de larga distancia que son efectivas frente a ataques por pumas (Beier et al., 1995) y más factibles en los extensos llanos y laderas del Oeste. En ambos sitios hubo arbustos altos que favorecen el acecho cerca de un alto porcentaje de guanacos depredados. Sin embargo, la mayor cobertura de dichos arbustos en el Oeste indica que este factor no explica las diferencias espaciales en depredación.
Además de la topografía, otros dos factores que pueden estar asociados con la mayor depredación en el Este son la mayor densidad de guanacos, que podría resultar por ejemplo en una mayor actividad de caza de pumas, y una menor densidad de presas alternativas, como ocurre parcialmente con el ganado. La mayor frecuencia de ataques por puma sobre ganado en el Oeste durante el estudio (Bolgeri y Novaro, datos no publ.) podría estar relacionada con el último factor, aunque desconocemos la relación causal entre la depredación de guanacos y ganado. La variación espacial en la depredación de guanacos amerita estudios más detallados sobre el rol de la topografía, la vegetación y las presas alternativas, contribuyendo también al manejo del creciente conflicto entre pumas y ganado en Payunia.
Otros factores que pueden afectar la vulnerabilidad de las presas son su comportamiento y estructura social. Taraborelli et al. (2012) mostraron que en Payunia machos solitarios defienden territorios y responden a disturbios con una escasa respuesta de escape, hipotetizando que estos individuos, sin las ventajas antidepredatorias de la vida en grupo (Marino y Baldi, 2008), se exponen a un alto riesgo de depredación. Estos machos solitarios que defienden territorios ocurren durante la mayor parte del año (Bolgeri, datos no publ.). Este comportamiento podría explicar parcialmente la mayor depredación relativa de machos que documentamos y que contrasta con otros estudios que no hallaron diferencias en la depredación de ambos sexos (Cajal y López, 1987; Franklin et al., 1999; Bank et al., 2002; Marino, 2010). Sin embargo, nuestros resultados deben ser considerados preliminares debido al reducido tamaño de muestra y las numerosas carcasas en las que no pudimos determinar el sexo.
La depredación de crías y adultos de acuerdo a su disponibilidad que reportamos durante los dos períodos del año contradice estudios previos que muestran mayor depredación de crías (Franklin et al., 1999; Bank et al., 2002; Fernández y Baldi, 2014). De todas maneras, no podemos descartar el sesgo que seguramente tuvo nuestro estudio de menor detectabilidad y mayor velocidad de desaparición de carcasas de guanacos pequeños que de adultos.
La falta de selección de pumas hacia guanacos según su condición nutricional, en relación con otras causas de muerte, coincidió con los hallazgos para otros ungulados presa (Hornocker, 1970; Pierce et al., 2000b; Donadio et al., 2012). Es destacable que lacondición nutricional pobre en toda el área de estudio fue más frecuente que en la población de Torres del Paine (20%, Bank et al., 2002). Una condición pobre puede generar mayor vulnerabilidad de las presas a la depredación modificando sus comportamientos de vigilancia y selección de hábitat (Winnie y Creel, 2007; Marino y Baldi, 2008; Donadio et al., 2012). Por otro lado, el aumento invernal de la proporción de guanacos muertos en pobre condición nutricional, tanto entre los depredados como los muertos por otras causas, posiblemente refleja los cambios estacionales en la disponibilidad de forraje, como se ha reportado para vicuñas (Donadio et al., 2012). Tanto la diversidad como la cobertura de las plantas más palatables para el guanaco en Payunia se reduce en invierno y aumenta en verano (Puig et al., 1996).
Las diferencias espaciales encontradas en la incidencia de la depredación sugieren que los guanacos que se desplazan entre el Oeste y el Este de Payunia se exponen a un riesgo de depredación cambiante en su ruta migratoria. Esta incidencia parece haber sido escasa en toda la reserva hace 30 años (S. Puig, com. pers.). Coincidentemente, los pobladores de Payunia indican que los pumas comenzaron a aumentar en abundancia hace unos 20-25 años (Bolgeri, datos no publ.), tal como ocurrió en otras poblaciones de Patagonia que sufrieron extinción local asociada con la ganadería ovina durante mediados del siglo XX (Bellati y Von Thungen, 1990; Novaro y Walker, 2005; Walker y Novaro, 2010). El efecto demográfico de la intensa depredación puede ser insignificante si es de tipo compensatorio en poblaciones con abundancia de presa (McCullough, 1979; Bartmann et al., 1992). Sin embargo, dada la importancia para la conservación de la población de guanacos de Payunia y su migración masiva estacional (Bolgeri y Novaro, datos no publ.; Puig et al., 2003; Muller et al., 2011; Schroeder et al., 2014), recomendamos monitorear el efecto de la depredación en las tasas vitales tanto de su porción migratoria como sedentaria, considerando las diferencias espaciales reportadas.
AGRADECIMIENTOS
A la Dirección de Recursos Naturales de Mendoza por otorgarnos los permisos de investigación para trabajar en la reserva y facilitar el uso de la seccional y otro apoyo logístico. A todos los guardaparques de la zona sur de Mendoza (Llancanelo y Payunia) por el apoyo y colaboración brindada en los años de estudio y en particular a M. Palma, A. Soto, L. Aros, J. Baronetto y A. Bale. A A. González, M. Funes y A. Rey por la asistencia en el análisis de datos de transectas. A J. Berg, R. Perassi, L. Rivas, E. Juan y S. Walker por la colaboración en recolección y análisis de datos. A R. Baldi, E. Donadio y S. Walker que enriquecieron el trabajo con sus sugerencias. Este trabajo fue financiado parcialmente por el CONICET, un subsidio PICT-2005 de la Agencia Nacional de Promoción Científica y Tecnológica y la Wildlife Conservation Society.
LITERATURA CITADA
1. BANK MS, J SARNO, NK CAMPBELL y WL FRANKLIN. 2002. Predation of guanacos (Lama guanicoe) by southernmost mountain lions (Puma concolor) during a historically severe winter in Torres del Paine National Park, Chile. Journal of Zoology (London) 258:215-222. [ Links ]
2. BARTMANN RM, GC WHITE y LH CARPENTER. 1992. Compensatory mortality in a Colorado mule deer population.Wildlife Monographs 121:1-39. [ Links ]
3. BEIER P, D CHOATE y H BARRETT. 1995. Movement patterns of mountain lions during different behaviors. Journal of Mammalogy 76:1056-1070. [ Links ]
4. BELLATI J y J VON THUNGEN.1990. Lamb predation in Patagonian ranches. Pp 263-268, en: Proceeding of the 14th Vertebrate Pest Conference (LR Davis y RE Marsh, eds.). University of California. [ Links ]
5. BEYER HL, EH MERRILL, N VARLEY y MS BOYCE. 2007. Willow on Yellowstone’s northern range: Evidence for a trophic cascade? Ecological Applications 17:1563-1571.
6. BUCKLAND ST, DR ANDERSON, KP BURNHAM y JL LAAKE. 1993. Distance Sampling: Estimating abundance of biological populations. Chapman & Hall, London. [ Links ]
7. BUCKLAND ST, DR ANDERSON, KP BURNHAM, JL LAAKE, DL BORCHERS y L THOMAS. 2001. Introduction to Distance Sampling. Oxford University Press, London. [ Links ]
8. CAJAL JL y NE LÓPEZ. 1987. El puma como depredador de camélidos silvestres en la Reserva San Guillermo, San Juan, Argentina. Revista Chilena de Historia Natural 60:87-91. [ Links ]
9. CANDIA R, S PUIG, A DALMASSO, F VIDELA y E MARTÍNEZ CARRETERO. 1993. Diseño del plan de manejo para la Reserva Provincial La Payunia (Malargüe, Mendoza). Multequina 2:5-87. [ Links ]
10. CHEATUM EL. 1949. Bone marrow as an index of malnutrition in deer. NY State Conservationist 3:19-22. [ Links ]
11. DIERSING VE, RB SHAW y DJ TAZIK. 1992. U.S. Army Land Condition-Trend Analysis (LCTA) program. Environmental Management 16:405-414. [ Links ]
12. DONADIO E, SW BUSKIRK y AJ NOVARO. 2012. Juvenile and adult mortality patterns in a vicuña (Vicugna vicugna) population. Journal of Mammalogy 93:1536-1544. [ Links ]
13. ELBROCH LM y HU WITTMER. 2012. Puma spatial ecology in open habitats with aggregate prey. Mammalian Biology 77:377-384. [ Links ]
14. FERNÁNDEZ C y R BALDI. 2014. Hábitos alimentarios del puma (Puma concolor) e incidencia de la depredación en la mortandad de guanacos (Lama guanicoe) en el Noreste de la Patagonia. Mastozoología Neotropical 21:331-338. [ Links ]
15. FLORES CE, AM CINGOLANI, A VON MÜLLER y FR BARRI. 2012. Habitat selection by reintroduced guanacos (Lama guanicoe) in a heterogeneous mountain rangeland of central Argentina. The Rangeland Journal 34:439-445. [ Links ]
16. FORDAT, JR GOHEEN, TO OTIENO, LA ISBELL, TM PALMER, D WARD, R WOODROFFE y RM PRINGLE. 2014. Large carnivores make savanna tree communities less thorny. Science 346:346-349. [ Links ]
17. FRANKLIN WL, WE JOHNSON, RJ SARNO y JA IRIARTE. 1999. Ecology of the Patagonia puma (Felis concolor patagonica) in southern Chile. Biological Conservation 90:33-40. [ Links ]
18. FRYXELL JM y ARE SINCLAIR.1988. Causes and consequences of migration by large herbivores. Trends in Ecology & Evolution 3:237-241. [ Links ]
19. FRYXELL JM. 1995. Aggregation and migration by grazing ungulates in relation to resources and predators. Pp. 257-273, en: Serengeti II - Dynamic, Management and Conservation of an Ecosystem (ARE Sinclair y P Arcese, eds.). University of Chicago Press. [ Links ]
20. HEBBLEWHITE M, CA WHITE, CG NIETVELT, JA MCKENZIE, TE HURD, JM FRYXELL, SE BAYLEY y PC PAQUET. 2005. Human activity mediates a trophic cascade caused by wolves. Ecology 86:2135- 2144. [ Links ]
21. HORNOCKER MG. 1970. An analysis of mountain lion predation upon mule deer and elk in the Idaho Primitive Area. Wildlife Monographs 21:3-39. [ Links ]
22. HUSSEMAN JS, DL MURRAY, G POWER, C MACK, CR WENGER y H QUIGLEY. 2003. Assessing differential prey selection patterns between two sympatric large carnivores. Oikos 101:591-601. [ Links ]
23. IRIARTE JA, WE JOHNSON y WL FRANKLIN. 1991. Feeding ecology of the Patagonia puma in southernmost Chile. Revista Chilena de Historia Natural 64:145-156. [ Links ]
24. KOLOWSKI JM y KE HOLEKAMP. 2006. Spatial, temporal, and physical characteristics of livestock depredations by large carnivores along a Kenyan reserve border. Biological Conservation 128:529-541. [ Links ]
25. MARINO A y R BALDI. 2008. Vigilance patterns of territorial guanacos (Lama guanicoe): The role of reproductive interests and predation risk. Ethology 114:412-423. [ Links ]
26. MARINO A. 2010. Respuesta anti-depredatoria del guanaco: comportamiento, organización social y vulnerabilidad a la depredación. Tesis de doctorado, Universidad Nacional del Comahue, Bariloche, Río Negro, Argentina. [ Links ]
27. MARTÍNEZ CARRETERO E. 2004. La provincia fitogeográfica de La Payunia. Boletín de la Sociedad Argentina de Botánica 39:195-226. [ Links ]
28. McCULLOUGH DR. 1979. The George Reserve deer herd: Population ecology of a K-selected species. University of Michigan Press, Ann Arbor. [ Links ]
29. MUELLER T, KA OLSON, G DRESSLER, P LEIMGRUBER, TK FULLER, C NICOLSON, AJ NOVARO, MJ BOLGERI, D WATTLES, S DESTEFANO, JM CALABRESE y WF FAGAN. 2011. How landscape dynamics link individual- to population-level movement patterns: A multispecies comparison of ungulate relocation data. Global Ecology and Biogeography 20:683-694. [ Links ]
30. NOVARO AJ y RS WALKER. 2005. Human-induced changes in the effect of top carnivores on biodiversity in the Patagonian Steppe. Pp. 268-288, en: Large Carnivores and Biodiversity Conservation (JC Ray, KH Redford, RS Steneck y J Berger, eds.). Island Press, Washington. [ Links ]
31. ORTEGA I y WL FRANKLIN. 1995. Social organization, distribution, and movements of a migratory guanaco population in the Chilean Patagonia. Revista Chilena de HistoriaNatural 85:72-78. [ Links ]
32. PIERCE BM, VC BLEICH y RT BOWYER. 2000a. Social organization of mountain lions: Does a land-tenure system regulate population size? Ecology 81:1533-1543. [ Links ]
33. PIERCE BM, VC BLEICH y RT BOWYER. 2000b. Selection of mule deer by mountain lions and coyotes: Effects of hunting style, body size, and reproductive status. Journal of Mammalogy 81:462-472. [ Links ]
34. PUIG S. 1986. Ecología poblacional del guanaco (Lama guanicoe, Camelidae, Arthyodactyla) en la Reserva La Payunia (Mza). Tesis de doctorado, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de Buenos Aires, Buenos Aires, Argentina. [ Links ]
35. PUIG S y S MONGE.1983. Determinación de edad en Lama guanicoe (Müller). Deserta 7:246-270. [ Links ]
36. PUIG S, F VIDELA, SA MONGE y V ROIG. 1996. Seasonal variations in guanaco diet (Lama guanicoe Müller, 1776) and food availability in Northern Patagonia, Argentina. Journal of Arid Environments 34:215-224. [ Links ]
37. PUIG S, G FERRARIS, M SUPERINA y F VIDELA. 2003. Distribución de densidades de guanaco (Lama guanicoe) en el norte de la Reserva La Payunia y su área de influencia (Mendoza, Argentina). Multequina 12:37-48. [ Links ]
38. RAEDEKE KJ. 1979. Population dynamics and socio-ecology of the guanaco (Lama guanicoe) of Magallanes, Chile. Tesis de doctorado, University of Washington, EEUU. [ Links ]
39. SCHROEDER NM, SD MATTEUCCI, PG MORENO, P GREGORIO, R OVEJERO, P TARABORELLI y PD CARAMANCHAHI. 2014. Spatial and seasonal dynamic of abundance and distribution of guanaco and livestock: Insights from using density surface and null models. PLoS ONE 9:e85960. [ Links ]
40. SHAW HG, P BEIER, M CULVER y M GRIGIONE. 2007. Puma Field. The Cougar Network. Concord, Massachusetts. [ Links ]
41. STATSOFT INC. 2013. Electronic Statistics Textbook. Tulsa. http://www.statsoft.com/textbook/ [ Links ]
42. TARABORELLI P, P GREGORIO, P MORENO, AJ NOVARO y P CARMANCHAHI. 2012. Cooperative vigilance: The guanaco’s (Lama guanicoe) key antipredator mechanism. Behavioural Processes 91:82-89.
43. WALKER RS y AJ NOVARO. 2010. The world’s southernmost cougars in Patagonia and the southern Andes. Pp. 91-99, en: Cougar: Ecology and Conservation (M Hornocker y S Negri, eds.). University of Chicago Press, Chicago.
44. ZANÓN MARTÍNEZ JI, A TRAVAINI, S ZAPATA, D PROCOPIO y MA SANTILLÁN. 2012. The ecological role of native and introduced species in the diet of the puma Puma concolor in southern Patagonia. Oryx 46:106-111. [ Links ]
45. WINNIE J y S CREEL. 2007. Sex-specific behavioural responses of elk to spatial and temporal variation in the threat of wolf predation. Animal Behaviour 73:215-225. [ Links ]














