Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.22 no.2 Mendoza Dec. 2015
NOTA
Información demográfica de Bradypus variegatus, Choloepus hoffmanni Y Cyclopes didactylus (xenarthra: pilosa) en un bosque húmedo tropical secundario de Santander, Colombia
Nicolás Reyes-Amaya1, Diego R. Gutiérrez-Sanabria2, Yeimy Castillo-Navarro3, Raúl A. Rodríguez3 y Tinka Plese4
1 Unidad Ejecutora Lillo, Consejo Nacional de Investigaciones Científicas y Técnicas, Calle Miguel Lillo 251, 4000 San Miguel de Tucumán, Argentina. [Correspondencia: <nicolas.reyes2@gmail.com>].
2 Universidad Nacional de Costa Rica, Avenida 1 con Calle 9, 3000 Heredia, Costa Rica.
3 Universidad Industrial de Santander, Calle 9 con Carrera 27, Ciudad Universitaria, 680002 Bucaramanga, Colombia.
4 Fundación AIUNAU, Circular 1ª, No. 73 - 20, Medellín, Colombia.
RESUMEN.
Durante cinco meses (febrero-junio 2014) se rescató y reubicó fauna como parte de las labores de adecuación del vaso del embalse del Proyecto Hidroeléctrico Sogamoso (Santander-Colombia). Se realizaron 71 capturas de especies del orden Pilosa, que correspondieron a densidades de 0.4, 0.35 y 0.06 (ind/ha) para Bradypus variegatus, Choloepus hoffmanni y Cyclopes didactylus, respectivamente. La proporción de sexos fue 1♂:1♀ para B. variegatus y 1♂:2.2♀ para C. hoffmanni. El cuidado de crías se observó entre marzo y junio para B. variegatus y C. hoffmanni, mientras que la gestación solo en mayo para C. hoffmanni. Se recomienda documentar los rescates de fauna, minimizando la pérdida de datos biológicos valiosos de las especies afectadas.
ABSTRACT.
Demographic information on Bradypus variegatus, Choloepus hoffmanni, and Cyclopes didactylus (Xenarthra: Pilosa) in a secondary wet tropical forest of Santander, Colombia.
During five months (February-June 2014), wild species were rescued and relocated in preparation for the flooding of the reservoir of the Sogamoso Hydroelectric Project (Santander-Colombia). Seventy one captures of species of the order Pilosa were obtained, corresponding to the densities 0.4, 0.35 and 0.06 (ind/ha) for Bradypus variegatus, Choloepus hoffmanni and Cyclopes didactylus, respectively. The sex ratio was 1♂:1♀ for B. variegatus and 1♂:2.2♀ for C. hoffmanni. Parental care was observed from March to June for B. variegatus and C. hoffmanni, while gestation was detected only in May for C. hoffmanni. We recommend documenting wildlife rescue, minimizing the loss of valuable biological data pertaining to the affected species.
Palabras clave: Densidad poblacional; Hormigueros; Perezosos; Proporción de sexos; Rescate de fauna.
Key words: Ant-eaters; Population density; Sex ratio; Sloths; Wildlife rescue.
Recibido 14 mayo 2015.
Aceptado 22 octubre 2015.
Editor asociado: M Busch
Colombia es uno de los países con más biodiversidad del mundo (Samper, 2000); sin embargo, miles de hectáreas de sus bosques desaparecen anualmente (González et al., 2011). El bosque húmedo tropical colombiano ha perdido la tercera parte de sus coberturas y se considera como uno de los ecosistemas más vulnerables a alteraciones antrópicas (Etter et al., 2006); la ampliación de la frontera agrícola es una de las principales causas de su desaparición (Kattan, 1997).
Los integrantes del orden Pilosa constituyen uno de los grupos de mamíferos más antiguos del Nuevo Mundo, distribuyéndose en América Central y América del Sur con 31 especies vivientes (Gardner, 2007). En Colombia se registran cuatro especies de hormigueros y tres de perezosos. Los integrantes de este orden son vitales para mantener ecosistemas naturales sanos; la dieta de los perezosos de dos dedos es herbívora-omnívora y la de los perezosos de tres dedos es principalmente folívora, contribuyendo al ciclo de nutrientes y a la formación y regeneración del suelo (Montgomery y Sunquist, 1975). Los hormigueros consumen insectos, regulando la proliferación de los mismos (Montgomery, 1985). Son pocos los estudios poblacionales de estas especies en Colombia, dada su baja detección en campo (Humanez-López et al., 2014). En el presente trabajo se reporta la densidad poblacional del oso hormiguero pigmeo (Cyclopes didactylus), el perezoso de tres dedos (Bradypus variegatus) y el perezoso de dos dedos (Choloepus hoffmanni), así como la proporción de sexos e incidencia de hembras con cría de los dos últimos. Se utilizaron datos de actividades de rescate y reubicación de fauna del Proyecto Hidroeléctrico Sogamoso, como un aporte al conocimiento de la ecología de poblaciones de algunas especies del orden Pilosa.
El área de estudio se situó en la Vereda Sogamoso del Municipio de Betulia (Santander, Colombia), dentro del vaso del embalse del Proyecto Hidroeléctrico Sogamoso (7° 3’ 27” N, 73° 22’ 43.15” O), construido y operado por la empresa ISAGEN S.A. E.S.P. La precipitación promedio anual de la zona es de 2200 mm, la temperatura promedio anual de 24 °C (Duarte, 1998) y se registran alturas entre 170 y 280 m s.n.m. El área abarcada en el presente estudio comprendió 88.5 ha de vegetación secundaria de bosque húmedo tropical según las zonas de vida de Holdridge (1982), excluyendo zonas de potreros para ganadería (Fig. 1).

Fig. 1. Localización del área de estudio (Santander, Colombia) y registros por especie dentro de ésta (Bradypus variegatus, asteriscos; Choloepus hoffmanni, triángulos; Cyclopes didactylus, petágonos)
Durante cinco meses (febrero-junio 2014), 25 días al mes, se rescató y reubicó fauna como parte de las labores de adecuación del vaso del embalse. Antes, durante y después de realizar actividades reglamentarias de tala y extracción de madera (vegetación con DAP > 10 cm), se realizaron inspecciones detalladas mediante parcelas de búsqueda de fauna con área variable (1-6 ha), hasta abarcar el área total de muestreo (88.5 ha). En cada parcela, un total de 9 personas, ubicadas en formación lineal con una distancia de 5 m entre sí, realizaron durante 3-4 horas una búsqueda intensiva de sitios potenciales de refugio y alimentación de fauna (i.e. dosel, madrigueras), alcanzando un esfuerzo de muestreo total de 3937 horas/ hombre. Los individuos hallados fueron capturados manualmente, realizando una valoración médica in situ para determinar su inmediata reubicación en zonas boscosas por encima de la cota de inundación del proyecto hidroeléctrico, o el ingreso a Centros de Atención de Fauna (CAF), hasta su recuperación. Se registró el sexo, condición reproductiva y coordenadas geográficas de captura; no obstante, las crías y juveniles aferrados a las madres no fueron manipulados, con el fin de evitar posibles miopatías asociadas a la captura por estrés (Kreeger et al., 2002). No se realizó seguimiento posterior a la reubicación; sin embargo se marcaron con pintura las garras anteriores y posteriores de cada animal, para evitar el conteo de recapturas.
Se calcularon las densidades poblacionales para Bradypus variegatus, Choloepus hoffmanni y Cyclopes didactylus, dividiendo el número total de individuos capturados por especie sobre el área total muestreada. Se tomó esta relación como medida directa de la densidad ecológica; bajo la premisa de que todos los individuos en las áreas muestreadas fueron avistados y capturados, debido a la metodología empleada y a las características de dispersión de las especies estudiadas. Las crías y juveniles dependientes de sus madres fueron excluidos del cálculo de densidades, debido a que estos individuos no ocupan un rango de acción propio dentro de la población (Gardner, 2007); asimismo, fueron excluidos de las proporciones de sexos. Se reportó la proporción de sexos y la presencia de hembras con cría o preñadas para B. variegatus y C. hoffmanni. El estudio abarca estas especies debido a que fueron las que tuvieron mayor cantidad de registros.
Se obtuvieron 35 capturas para B. variegatus, 31 para C. hoffmanni y 5 para Cyclopes didactylus, correspondiendo a densidades de 0.4, 0.35 y 0.06 ind./ha, respectivamente (Tabla 1). La proporción de sexos para B. variegatus fue 1♂:1♀, mientras que la de C. hoffmanni fue 1♂:2.2♀ (Tabla 1). Se observó un número constante de hembras con cría desde marzo hasta mayo para B. variegatus, sin reporte de hembras preñadas, mientras que en C. hoffmanni la mayor cantidad de hembras con cría se observó en abril y mayo, registrándose una sola hembra preñada para el mes de mayo (Fig. 2).
Tabla 1 Número de individuos capturados y su sexo para Bradypus variegatus, Choloepus hoffmanni y Cyclopes didactylus, en un bosque húmedo tropical secundario de Santander (Colombia) durante el presente estudio.


Fig. 2. Registros de hembras preñadas y con cría para Bradypus variegatus y Choloepus hoffmanni durante el presente estudio en un bosque húmedo tropical secundario de Santander, Colombia.
Las densidades poblacionales reportadas en la literatura para las tres especies son muy disímiles, oscilando entre 8.5 y 0.09 ind./ha para B. variegatus (Montgomery y Sunquist, 1975; Cuevas-Correa, 2007), 1.5 y 0.08 ind./ ha para C. hoffmanni (Álvarez et al., 2004; Aguilar-Isaza y López-Obando, 2009), y 0.77 y 0.05 ind./ha para C. didactylus (Montgomery, 1985; Bhagratty et al., 2013). Las densidades obtenidas en el presente estudio constituyen el segundo reporte más bajo para B. variegatus y el tercero más bajo para C. hoffmanni, con valores de 0.4 y 0.35 ind./ha, respectivamente, similar a lo encontrado por Acevedo-Quintero et al. (2011) para estas especies en un bosque seco tropical fragmentado del departamento de Antioquia en Colombia (Tabla 2). En el caso de C. didactylus, la densidad reportada en el presente estudio es la segunda más baja para esta especie (0.06 ind./ha), similar a la obtenida en los manglares de la isla de Trinidad por Bhagratty et al. (2013) (Tabla 2).
Tabla 2 Densidades reportadas en la literatura y en el presente estudio para Bradypus variegatus, Choloepus hoffmanni y Cyclopes didactylus.
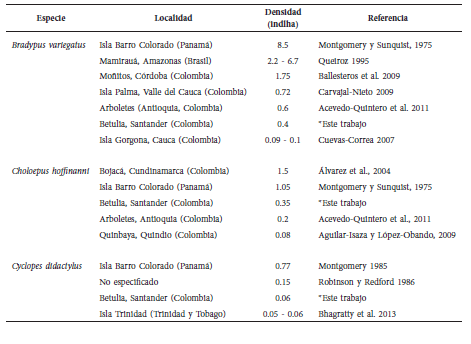
La densidad de individuos es un atributo de las poblaciones animales que varía en el tiempo (épocas del año) y el espacio (ecosistemas), influenciada por factores bióticos y abióticos tales como el clima, el hábitat, la disponibilidad y distribución de los recursos dentro del hábitat, la capacidad de dispersión y las relaciones interespecífas e intraespecíficas (Begon et al., 2006). El amplio espectro de densidades reportadas en la literatura y en el presente trabajo para las especies analizadas (Tabla 2), puede estar asociado adicionalmente con las metodologías utilizadas; el diseño del muestreo (rastros, observación directa, parcelas/transectas o búsqueda libre) y el esfuerzo de muestreo invertido, son factores que influencian las densidades finales obtenidas.
El uso de índices ecológicos en condiciones en que no se cumplen todas las premisas propuestas ha sido señalado por varios autores como una fuente común de error en estos trabajos, llevando a subestimaciones o sobreestimaciones en los cálculos (Anderson, 2001; Bart et al., 2004). Muchos de los estudios en estas especies podrían estar sobreestimando la densidad real de las mismas; Taube et al. (1999) utilizaron una metodología similar a la del presente estudio, encontrando también densidades bajas para las especies similares Choloepus didactylus (0.01- 0.05 ind./ha) y Bradypus tridactylus (0.02- 0.09 ind./ ha). Las metodologías que involucran la remoción del material vegetal brindan una mayor detección de las especies arbóreas, al acceder directamente al dosel (Vié, 1999).
La proporción de sexos es un aspecto demográfico poco abordado en comparación con otros de la biología de poblaciones silvestres de perezosos (Superina et al., 2010). En el presente estudio esta proporción fue 1♂:1♀ para B. variegatus (Tabla 1), coincidiendo con la reportada por Meritt y Meritt (1976) para el Canal de Panamá, mientras que contrasta con la obtenida por Ballesteros et al. (2009) para un bosque seco tropical fragmentado en el departamento de Córdoba en Colombia (1♂:1.7♀). Por su parte, la proporción de sexos 1♂:2.2♀ obtenida para C. hoffmanni (Tabla 1) resulta cercana a lo reportado dentro de un sistema agroforestal de cacao y bosque húmedo tropical en San José, Costa Rica (1♂:1.26♀, adultos; 1♂:1.80♀, subadultos) (Peery y Pauli, 2012). Sin embargo no coincide con lo reportado para el Canal de Panamá (1♂:11♀) (Meritt y Meritt, 1976), ni para la especie similar Choloepus didactylus en el río Sinnamary de la Guayana Francesa (0.74♂:1♀) (Taube com pers.). Aunque las proporciones de sexo reportadas para C. hoffmanni resultan bastante disímiles, en general se observa un desequilibrio hacia las hembras. Este desequilibrio podría estar actuando como una respuesta ventajosa a su largo periodo de gestación (aprox. 12 meses) (Meritt y Meritt, 1976; Eisenberg y Maliniak, 1978), teniendo en cuenta que el sistema de apareamiento de esta especie, única estudiada en este aspecto dentro de los perezosos, consta en una combinación de poliginia y promiscuidad (Peery y Pauli, 2012).
La incidencia de hembras con cría de B. variegatus entre marzo y mayo concuerda con lo reportado en cautiverio por Oliveira (1999) y en poblaciones silvestres por Ballesteros et al. (2009), quienes señalan que las hembras al cuidado de crías son observadas entre diciembre y mayo. Para el caso de C. hoffmanni la presencia de hembras con cría únicamente entre abril y junio no es concordante con el hecho de que el género Choloepus se reproduce constantemente durante el año (Henry y Dubost, 1990) (Fig. 2). Sin embargo, el tiempo abarcado en el presente estudio no es suficiente para establecer patrones en este aspecto.
En Colombia, las poblaciones silvestres de las especies del orden Pilosa enfrentan amenazas asociadas a la extracción de individuos, la introducción de especies exóticas y la transformación de sus hábitats para ganadería, agricultura y la construcción de obras de infraestructura (Moreno y Plese, 2006; Ministerio de Ambiente y Desarrollo Sostenible, 2014), que en conjunto transforman los ecosistemas a escala de paisaje (Chávez y Arango, 2004). Existen algunos estudios que aportan información sobre la demografía de poblaciones de perezosos en ecosistemas colombianos (Superina et al., 2010; Humanez-López et al., 2014), sin embargo son nulos en el caso del hormiguero pigmeo, C. didactylus (Chacón et al., 2013). El presente trabajo constituye un aporte al conocimiento sobre la ecología de poblaciones de algunas especies del orden Pilosa, poniendo a disposición nuevos datos de regiones anteriormente no estudiadas para dichas especies y haciendo uso de metodologías poco ortodoxas, como lo es la remoción de la vegetación. Según OLADE (2013), Colombia es el cuarto país latinoamericano con mayor potencial hidroeléctrico, sin embargo la mayoría de datos biológicos obtenidos durante los estudios asociados a estas obras de infraestructura no son publicados, teniendo en cuenta la oportunidad única que proveen estas actividades para registrar taxones de difícil captura (Vié, 1999).
Agradecimientos.
A Andrés Gonzáles, Ferney Ardila, Marco Ortíz, Franklin Guerrero, Alexander Lancheros, Raúl Pedroza, María José Serrano (REFOCOSTA), Raúl Cáceres, Ana Lucía Estrada (ISAGEN), Diana Caballero, Larissa Payán, Cindy Jerez y Alix Herrera (INGETEC), por facilitar el desarrollo del presente trabajo. A Vladimir Rojas y Adriana Jeréz, por sus observaciones a versiones preliminares del manuscrito. Este estudio fue financiado por ISAGEN S.A. E.S.P. y la información en campo obtenida por el equipo de rescate de fauna de REFOCOSTA S.A.S.
LITERATURA CITADA
1. ACEVEDO-QUINTERO J, D SÁNCHEZ y T PLESE. 2011. Abundancia y preferencia de hábitat de Bradypus variegatus y Choloepus hoffmanni durante la época seca en dos fragmentos de bosque seco en Arboletes, Antioquia, Colombia. Edentata 12:36-44. [ Links ]
2. AGUILAR-ISAZA N y DC LÓPEZ-OBANDO. 2009. Estado poblacional actual y hábitat del perezoso de dos dedos (Choloepus hoffmanni, Peters, 1858) en la reserva natural La Montaña del Ocaso, Quimbaya (Quindío), Colombia. Tesis de grado, Universidad del Quindío, Colombia. [ Links ]
3. ÁLVAREZ S, A CADENA y R POLANCO. 2004. Densidad y preferencia de hábitat del perezoso de dos dedos Choloepus hoffmanni en un bosque andino (Bojacá, Cundinamarca, Colombia). Acta Biológica Colombiana 9:118-119. [ Links ]
4. ANDERSON DR. 2001. The need to get the basics right in wildlife field studies. Wildlife Society Bulletin 29:1294-1297. [ Links ]
5. BALLESTEROS J, K REYES y J RACERO. 2009. Estructura poblacional y etología de Bradypus variegatus en un fragmento de bosque seco tropical, Córdoba-Colombia. Revista de Medicina Veterinaria y Zootécnia de Córdoba 14:1812-1819. [ Links ]
6. BART J, S DROEGE, P GEISSLER, B PETERJOHN y JC RALPH. 2004. Density estimation in wildlife surveys. Wildlife Society Bulletin 32:1242-1247. [ Links ]
7. BEGON M, CR TOWNSEND y JL HARPER. 2006. Ecology: From individuals to ecosystems. Blackwell Publishing, London. [ Links ]
8. BHAGRATTY H, K TAYLOR, A LAWRENCE, ES DEVENISH-NELSON y HP NELSON. 2013. Population density of silky anteaters (Cyclopes didactylus, Xenarthra: Cyclopedidae) in a protected mangrove swamp on the island of Trinidad. Mammalia 77:447-450. [ Links ]
9. CARVAJAL-NIETO P. 2009. Uso de hábitat y tamaño poblacional del perezoso de tres dedos (Bradypus variegatus) en una zona insular del Chocó biogeográfico Colombiano. Tesis de grado, Universidad del Valle, Colombia. [ Links ]
10. CHACÓN L, J RACERO-CASARRUBIA y E RODRÍGUEZ-ORTÍZ. 2013. Nuevos registros de Cyclopes didactylus Linnaeus, 1758 para Colombia. Edentata 14:78-84. [ Links ]
11. CHÁVEZ M y N ARANGO. 2004. Informe nacional sobre el estado de la biodiversidad en Colombia. 2004. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá [ Links ].
12. CUEVAS-CORREA D. 2007. Estimación de la densidad poblacional, patrón de distribución espacial y preferencia de hábitat del perezoso de tres dedos, Bradypus variegatus, y consideraciones para su conservación en el Parque Nacional Natural Gorgona. Tesis de grado, Pontificia Universidad Javeriana, Bogotá [ Links ].
13. DUARTE J. 1998. Estudio de la temperatura en el Departamento de Santander. HYPERLINK “http://koha.ideam.gov.co/”.
14. EISENBERG JF y E MALINIAK. 1978. Reproduction of the two-toed sloth Choloepus hoffmanni in captivity. American Society of Mammalogist, abstract technical paper in the 58th Annual Meeting:41-42. [ Links ]
15. ETTER A, C MCALPINE, S PHINN, K WILSON y H POSSINGHAM. 2006. Regional patterns of agricultural land use and deforestation in Colombia. Agriculture, Ecosystems and Environment 114:369- 386. [ Links ]
16. GARDNER AL. 2007. Order Pilosa. Pp. 157-165, in: Mammals of South America: Volume 1 Marsupials, Xenarthrans, Shrews, and Bats. (AL Gardner ed.). University of Chicago Press, Chicago. [ Links ]
17. GONZÁLEZ JJ, A ETTER, AH SARMIENTO, SA ORREGO, C RAMÍREZ, E CABRERA, D VARGAS, G GALINDO, MC GARCÍA y MF ORDOÑEZ. 2011. Análisis de tendencias y patrones espaciales de deforestación en Colombia. Instituto de Hidrología Meteorología y Estudios Ambientales (IDEAM), Bogotá [ Links ].
18. HENRY O y G DUBOST. 1990. Premiers resultats sur la saisonnalité de la reproduction des mammiferes Guyanais. Pp. 161-166, in: Gestion de l’Ecosystème Forestier et Aménagement de l’Espace Régional (Congrès SEPANGUY), Guyane.
19. HOLDRIDGE, L. 1982. Ecología basada en zonas de vida. 2da reimpresión en español. Instituto Interamericano de Cooperación para la Agricultura, Costa Rica. [ Links ]
20. HUMANEZ-LÓPEZ E, J CHACÓN, M SUPERINA y JF GONZÁLEZ-MAYA. 2014. Prioridades de investigación del superorden Xenarthra en Colombia, II Simposio colombiano de perezosos, armadillos y hormigueros. Edentata 15:73-76. [ Links ]
21. KATTAN G. 1997. Transformación de paisajes y transformación de hábitats. Pp. 76-87, en: Causas de pérdida de biodiversidad (MF Chavez y N Arango, eds.). Instituto de Investigaciones Biológicas Alexander Von Humboldt, Bogotá [ Links ].
22. KREEGER TJ, JM ARNEMO y JP RAATH. 2002. Handbook of Wildlife Chemical Immobilization. Wildlife Pharmaceuticals Inc., Fort Collins. [ Links ]
23. MERITT DA y GF MERITT. 1976. Sex ratios of Hoffmanns sloth Choloepus hoffmanni and three toed sloth Bradypus infuscatus in Panama. American Midland Naturalist 96:472-473. [ Links ]
24. MINISTERIO DE AMBIENTE Y DESARROLLO SOSTENIBLE. 2014. Programa nacional para la conservación y uso sostenible de las especies del Súper Orden Xenarthra presentes en Colombia, Plan de acción 2014-2023. Fundación AIUNAU, Ministerio de Ambiente y Desarrollo Sostenible, Bogotá [ Links ].
25. MONTGOMERY GG y ME SUNQUIST. 1975. Impact of sloths on neotropical energy flow and nutrient cycling. Pp. 69-98, in: Trends in Tropical Ecology; Ecological Studies IV (E Medina y F Golly, eds.). Springer Verlag, New York. [ Links ]
26. MONTGOMERY GG. 1985. Impact of vermilinguas (Cyclopes, Tamandua: Xenarthra = Edentata) on arboreal ant populations. Pp. 351-364, in: The evolution and ecology of armadillos, sloths, and vermilinguas (GG Montgomery, ed.). Smithsonian Institution Press, Washington [ Links ]
27. MORENO S y T. PLESE. 2006. The illegal traffic in sloths and threats to their survival in Colombia. Edentata 6:10-18. [ Links ]
28. OLADE. 2013. Potencial de recursos energéticos y minerales de América del Sur: coincidencias jurídicas hacia una estrategia regional. HYPERLINK “http://www.olade.org/sites/default/files/publicaciones/Potencial- Recursos-Energeticos-Minerales-AS.pdf ”
29. OLIVEIRA VL. 1999. Reabilitaçao e manutençao dos bichos-preguiça (Bradypus torquatus e B. variegatus – Mammalia, Bradypodidae) em semi cativeiro. Reserva Zoobotánica (Martinha), Brasil.
30. PEERY MZ y JN PAULI. 2012. The mating system of a ‘lazy’ mammal, Hoffmann’s two-toed sloth. Animal Behaviour 84:555-562.
31. QUEIROZ HL. 1995. Preguiças e guaribas: os mamíferos folívoros arborícolos do Mamirauá. CNPq e Sociedade Civil Mamirauá, Brasília. [ Links ]
32. ROBINSON JG y KH REDFORD. 1986. Body size, diet, and population density of Neotropical forest mammals. American Naturalist 128:665-680. [ Links ]
33. SAMPER C. 2000. Prólogo. Pp. 17-18, en: Colombia. Diversidad Biótica III (JO Rangel, ed.). Universidad Nacional de Colombia. Bogotá [ Links ].
34. SUPERINA M, T PLESE, N MORAES-BARROS y AM ABBA. 2010. The 2010 Sloth Red List assessment. Edentata 11:115-134. [ Links ]
35. TAUBE E, JC VIÉ, P FOURNIER, C GENTRY y JM DUPLANTIER. 1999. Distribution of two sympatric species of sloths (Choloepues didactylus and Bradypus tridactylus) along the Sinnamary River, French Guiana. Biotropica 31:686-691. [ Links ]
36. VIÉ JC. 1999. Wildlife rescues—the case of the Petit Saut hydroelectric dam in French Guiana. Oryx 33:115-126.














