Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. vol.23 no.2 Mendoza dic. 2016
SECCIÓN ESPECIAL
MAMÍFEROS EXÓTICOS INVASORES
Abundancia poblacional y manejo del jabalí (Sus scrofa): una revisión global para abordar su gestión en la Argentina
Javier Sanguinetti1 y Hernán Pastore2,3
1 Parque Nacional Lanín, Administración de Parques Nacionales, Perito Moreno 1008, 8371 San Martín de los Andes, Neuquén. [Correspondencia: <sanguinetti.javier@gmail.com>]
2 Delegación Regional Patagonia, Administración de Parques Nacionales, Vicealmirante E. O’Connor 1188, 8400 San Carlos de Bariloche, Río Negro.
3 Centro Regional Universitario, Universidad Nacional del Comahue, 8400 San Carlos de Bariloche, Río Negro, Argentina.
Recibido 27 julio 2015.
Aceptado 25 febrero 2016.
Editor invitado: RA Ojeda
RESUMEN.
El jabalí (Sus scrofa) es una de las especies invasoras más dañinas y cuyo manejo es prioritario a nivel mundial. Sin embargo, en la Argentina la información demográfica y las experiencias de manejo son casi nulas. En este trabajo se realiza una revisión sobre las densidades y resultados de manejo del jabalí en distintos biomas y ambientes del mundo con el objeto de alertar sobre el potencial demográfico que podría alcanzar el jabalí en cada ecorregión de Argentina y plantear las opciones de manejo más adecuadas y pertinentes en cada caso. Se revisaron 162 publicaciones sobre demografía del jabalí y 30 sobre manejo, tanto en condición nativa como exótica, dentro o fuera de áreas protegidas y en islas o en continente. El valor promedio de densidad del jabalí obtenido de la revisión bibliográfica fue de 7 (rango 0.01-115; N = 273 registros) ind/km2. La mayoría (55%) de los registros se encuentran en el rango 0-3 ind/km2 mientras que el 33 y 12% restantes están en los rangos 4-13 ind/km2 y más de 13 ind/km2, respectivamente. La especie pareciera ser más abundante en biomas tropicales y subtropicales (selvas, bosques y sabanas), en su condición exótica más que como nativa, y en islas más que en continente y dentro de áreas protegidas. La erradicación es factible únicamente en poblaciones aisladas (islas) o en aquellas recientemente instaladas, pero requiere de esquemas de control que remuevan anualmente más del 90% de los individuos. Esquemas de control basados en la combinación de métodos que remuevan anualmente el 60-70% de los individuos, resultaron eficaces. Basándose en el análisis de las densidades y de los factores de regulación del jabalí, se discute el escenario demográfico que podría alcanzarse en cada ecorregión de la Argentina y sus posibilidades de manejo para minimizar los graves impactos ambientales y socioeconómicos potenciales.
ABSTRACT.
Population density and management of wild boar (Sus scrofa): a global review to address its management in Argentina.
Wild boar (Sus scrofa) is one of the most harmful non-native species whose management is a worlwide priority. However, in Argentina demographic and management experience is practically absent. In this work we reviewed population densities and management results for wild boar in different biomes and habitats at world scale in order to alert about the demographic potential of this species in the Argentine eco-regions and to propose effective management options in each case. We reviewed 162 publications about wild boar populations and 30 about management where the species was native or exotic, inside or outside protected areas, or at islands or in mainland. The mean value of wild boar density obtained from our review was 7 (range 0.01-115; N = 273 records) ind /km2. Most density records (55%) were within 0-3 ind/km2 range, while 33 and 12% fell within 4-13 ind/km2 and more than 13 ind/km2 ranges, respectively. Wild boar is apparently more abundant in tropical and subtropical (rainforest, forest and savannas) biomes, more as an exotic species than as native, more on islands than in mainland, and more within protected areas. The eradication is possible if effective control methods are applied at isolated populations (within islands) or at those recently established, and removes annually 90% or more of the total individuals. Population control is possible if a combination of effective methods removes annually 60-70% of the individuals. Based on the analysis of published densities records and population regulation factors for wild boar, we discuss the potential demographic scenarios for each of the eco-regions in Argentina and the management options to minimize the expected environmental and socioeconomic impacts for the future.
Palabras clave: Bioma; Métodos de control; Densidad; Ecorregión; Impactos.
Key words: Biome; Control methods; Density; Eco-region; Impacts.
INTRODUCCION
El jabalí (Sus scrofa), nativo de Eurasia y norte de África, es el mamífero con más amplia distribución en el mundo (Rosell et al., 2001). Ha sido introducido en varios países de América, centro y sur de África y ampliamente en Oceanía en sus numerosas islas (Barrios-García y Ballari, 2012). Por su capacidad reproductiva y adaptabilidad a diversos ambientes, la UICN lo ha clasificado como uno de los mamíferos más invasores en el mundo con potencialidad de alcanzar altas densidades poblacionales (Lowe et al., 2000).
En Europa, el jabalí estuvo al borde de la extinción a mediados del siglo XX, y desde 1980 muestra una sostenida recuperación como consecuencia de la reducción de la presión de caza y de los depredadores naturales, por el subsidio de forraje suplementario aportado por nuevos cultivos (maíz y viñedos principalmente) y por la ocurrencia de inviernos cada vez más suaves debido al cambio climático (Rosell et al., 2001; Melis et al., 2006). Con esta tendencia, en Europa existe preocupación por los impactos económicos y sociales que se están produciendo por daños a la agricultura, por la transmisión de enfermedades al ganado y al hombre, por el incremento de colisiones en rutas y por las molestias que ocasiona el jabalí en zonas suburbanas e incluso en las grandes urbes (Geisser y Reyer, 2005).
Por otra parte, en los lugares donde fue introducido, el jabalí mostró una rápida expansión en su distribución, y en pocas décadas, en especial en las regiones con climas y ambientes más favorables, mostró la típica explosión demográfica que caracteriza a las especies exóticas invasoras (Choquenot et al., 1996). Como “ingeniero de ecosistemas” genera múltiples impactos al modificar las condiciones del suelo y de la vegetación en los ecosistemas, al transmitir decenas de enfermedades y al transformarse en un depredador o presa dominante y modificar las relaciones interespecíficas originales entre especies nativas (Choquenot et al., 1996; Seward et al., 2004; Barrios-García y Ballari, 2012). También en su condición de exótica produce graves impactos económicos y sociales, similares a los descriptos en los países europeos (Choquenot, 1996; Seward et al., 2004).
A nivel mundial, existe una amplia experiencia de manejo (erradicación, control sostenido y monitoreo poblacional) del jabalí que lleva más de 30 años y que ha ido evolucionando a medida que la ciencia y la experimentación avanzaron influidas por las presiones de la sociedad (Engeman et al., 2007; Massei et al., 2011). La especie es muy difícil de controlar; únicamente con la aplicación de múltiples métodos de control implementados secuencialmente o simultáneamente se la ha podido erradicar, principalmente en islas (Anderson y Stone, 1993; Kessler 2002; Schuyler et al., 2002; Cruz et al., 2005), aunque también en poblaciones continentales incipientes (Barrett et al., 1988; Richardson et al., 1997; Lohraff, 2008; McCann y Garcelon, 2007). Por el contrario, donde la erradicación no es viable, se ejercen controles sostenidos para mantener a sus poblaciones en densidades compatibles con las necesidades de conservación de la biodiversidad o según las demandas socioeconómicas (Choquenot et al., 1996; Peine y Farmer, 1990). Sin embargo, los casos de manejo exitosos se han basado en métodos letales de control muy eficaces (veneno o uso de lazos) pero extremos, los que son cada vez más rechazados por la sociedad por sus potenciales efectos sobre la fauna (silvestre o doméstica) local y por ser considerados inhumanos (Massei et al., 2011). Otros métodos de reconocida eficacia y utilidad, aunque de limitado alcance espacial, como el trampeo con cajas, con corrales o con redes se están usando cada vez más (Sweitzer et al., 2000; Williams et al., 2011, Gaskamp, 2012). Debido al rechazo social creciente por el uso de métodos letales, los no letales, como las diferentes opciones de disuasión o el control poblacional vía la regulación de la reproducción, están teniendo cada vez más protagonismo y desarrollo en los planes de manejo de la especie (Massei et al., 2011). Por su parte, en Europa, la caza grupal intensiva (llamadas ‘batidas’) aplicada a pequeña o gran escala por un número importante de cazadores, contribuye a mantener las densidades bajas en algunos contextos, pero no ha podido detener el aumento poblacional del jabalí en la mayoría de las regiones del continente (Melis et al., 2006; Massei et al., 2014).
En Argentina, a pesar de que la especie fue introducida hace un siglo, la información sobre su abundancia es escasa, solo hay datos para Bahía Samborombón (Merino y Carpinetti, 2003; Pérez Carusi et al., 2009) y solo se conocen distribuciones generales para el país (Novillo y Ojeda, 2009) y dentro de la áreas protegidas en jurisdicción nacional (>21% de las áreas protegidas por la Administración de Parques Nacionales tienen jabalí; Merino et al., 2009) y tendencias de ocupación poblacional en un sector de Patagonia norte (Pescador et al, 2009). En Patagonia, el jabalí selecciona los sectores ubicados a baja altitud formados por bosques de Nothofagus dombeyii con denso sotobosque de caña colihue (Schiaffini y Vila, 2012) y más al norte, bosques mixtos de Araucaria-Nothofagus spp. y matorrales densos (Pescador et al., 2009) o las plantaciones de pináceas exóticas (Lantschner et al., 2013). En regiones semiáridas de Mendoza el jabalí modifica sus preferencias de hábitat entre la estación seca y húmeda buscando ampliar el rango dietario para incorporar recursos de mayor calidad nutricional (Cuevas et al., 2013). Con respecto a los impactos, la información es limitada. En la región pampeana se determinó una tendencia inversa entre la abundancia del venado de las pampas (Ozotoceros bezoarticus) y el jabalí, por lo cual existiría competencia con este cérvido amenazado (Pérez Carusi et al., 2009). En bosques de Araucaria el jabalí puede consumir hasta el 30% de las semillas caídas al suelo, competir por este recurso con los roedores nativos y en parches de bosque pequeños afectar la regeneración de esta conífera de alto valor de conservación (Sanguinetti y Kitzberger, 2010). Con las hozadas se reduce la cobertura herbácea y arbustiva nativa en ecosistemas semiáridos de Mendoza (Cuevas et al., 2012) y en los bosques andino-patagónicos, aumenta el establecimiento y biomasa de flora exótica invasora (Barrios García y Simberloff, 2013) y facilita la invasión de pinos exóticos a partir de la dispersión en sus heces de hongos ectomicorrizas (Nuñez et al., 2013). Se desconocen sus impactos socioeconómicos a pesar de estar presente en el 30% de la superficie del país (Novillo y Ojeda, 2008). A pesar del tiempo transcurrido desde su introducción en Argentina, existen pocas experiencias de control poblacional, por ejemplo en el Parque Nacional El Palmar (APN, 2008) y en Esteros del Iberá (Ciringoli, 2010), y lo que prevalece es el uso de la especie con fines cinegéticos en las siete provincias donde se estableció. La amplia experiencia internacional demuestra que el manejo orientado a fines cinegéticos no solo no evita el aumento en distribución y en abundancia del jabalí sino que lo favorece al estimular mecanismos compensatorios (Choquenot et al., 1996, Toïgo et al., 2008, Servanty et al., 2011; Massei et al., 2014).
Frente a este escenario en la Argentina, es necesario definir las estrategias de manejo para la gestión efectiva de esta especie tan exitosa en términos biológicos, para evitar futuros escenarios de invasión que impliquen altos costos ambientales y socioeconómicos (Ballari et al., 2014). Existe una amplia aceptación de que el impacto producido por la especie aumenta con la abundancia poblacional, aunque la forma en que varía dicha relación puede diferir según el ambiente y el tipo de impacto (Choquenot el al., 1996; Seward et al., 2004). Por lo tanto, resulta crítico conocer la situación demográfica actual y la potencialidad del jabalí en distintos ecosistemas. Es importante priorizar el manejo de una especie exótica invasora según su historia y dinámica de invasión, las potencialidades de colonización y de las características del ecosistema invadido, así como los valores biológicos y económicos que estén amenazados en cada región frente al riesgo de escenarios poblacionales futuros (Sanguinetti et al., 2014).
En este trabajo se revisan las abundancias y los resultados de medidas de manejo del jabalí en los distintos biomas y ambientes del mundo, tanto en su condición nativa como exótica. Con esta información se pretende: a) analizar el patrón demográfico del jabalí en distintas regiones del mundo con clima y condiciones ecológicas similares a los biomas de Argentina y; b) proponer los biomas prioritarios del país y los métodos más adecuados para estimar abundancias y manejos poblaciones en cada uno de ellos.
MATERIALES Y METODOS
Se realizó una amplia búsqueda bibliográfica de trabajos publicados, en el período 1922-2015, en revistas científicas indexadas y, adicionalmente, en trabajos no publicados (p. ej. manuales) cuando su calidad y pertinencia justificase su inclusión en el análisis. Se buscaron trabajos enfocados en los siguientes tópicos: a) estimaciones de abundancia poblacional, área de acción y evaluación de mecanismos de regulación poblacional; b) experiencias de erradicación o control en general, y aquellos que evaluaron la efectividad del manejo de uno o más métodos de control en particular; c) revisiones bibliográficas sobre demografía y métodos de control de la especie. La búsqueda de trabajos científicos se realizó en Google académico utilizando las palabras Sus scrofa, wild boar, density, population dynamic, management, control methods. Incluimos también datos encontrados en revisiones bibliográficas (Choquenot et al., 1996; Melis et al., 2006; Mayer y Brisbin, 2009) o citados por otros trabajos publicados. Además, para la búsqueda de material inédito se utilizaron las mismas palabras, en inglés y castellano, pero en la página de Google y usando las extensiones .doc y .pdf.
Cada trabajo encontrado fue clasificado según el rango de distribución (nativo o exótico) del jabalí, el bioma donde fue realizado y los ambientes a escala local. Ante la casi ausencia de información demográfica sobre el jabalí en Argentina, los datos sobre densidad y factores de regulación clasificados fueron utilizados para realizar una primera aproximación sobre el potencial demográfico que podría alcanzar el jabalí en cada bioma y ecorregión de la Argentina asimilable a los existentes a nivel mundial. Se construyeron histogramas de frecuencias con los datos sobre densidad poblacional para cada rango de distribución. Se calculó el promedio, la mediana y los valores mínimos y máximos por bioma y según su condición nativa o exótica, continental o insular o su ubicación dentro y fuera de áreas protegidas con el objeto de describir el patrón demográfico a escala mundial. De los trabajos publicados sobre manejo poblacional del jabalí se obtuvieron datos sobre el número de animales eliminados, la unidad de esfuerzo, el esfuerzo acumulado y los costos de manejo para presentar una síntesis de la efectividad de cada experiencia de control. Los trabajos se agruparon según los siguientes métodos de eliminación empleados: cacería con armas de fuego, cacería con perros, envenenamiento, trampeo (trampa, corral o lazo) o combinación entre algunos de ellos. También se analizaron publicaciones con aspectos metodológicos para la estimación poblacional de la especie para proponer los métodos más convenientes según cada ecorregión de Argentina.
De este modo se analizaron por separado, por un lado los datos sobre densidad y factores de regulación, y por el otro los datos sobre métodos de control y nivel de efectividad según objetivos (influidos por su condición “nativa” o “exótica”) y considerando las restricciones o potencialidades que ofrece cada tipo de escenario socioeconómico, ambiental y político.
RESULTADOS
En total se accedió a 162 publicaciones que abarcan estudios en 34 países con presencia del jabalí, de las cuales 143 son referidas a los aspectos demográficos (abundancia, área de acción o factores de regulación poblacional) y 30 vinculadas con el manejo (erradicación, control o uso cinegético) del jabalí (Tabla 1). El 48 y 52% de los trabajos demográficos consultados provienen de regiones donde el jabalí es o exótico o nativo. En total se compilaron 273 registros sobre densidad, 138 en condición exótica y 135 como nativa. En condición nativa, la información obtenida proviene mayoritariamente de regiones templadas o mediterráneas, mientras que en condición exótica proviene principalmente de zonas tropicales y subtropicales (Tabla 1). Para la Argentina solo se encontraron dos estudios que estimaron densidades del jabalí, ambos en la zona de Bahía Samborombón (Buenos Aires) utilizando conteos aéreos, donde en el período 1995-1998, Merino y Carpinetti (2003) estimaron 1.65 ind./ km2 mientras que en otro sector, en el período 2002-2005, Pérez Carusi et al. (2009) estimaron 0.91-7.78 ind./km2.
Tabla 1 Resumen de la cobertura bioclimática (biomas), de ambientes y de países alcanzado con la revisión bibliográfica (número de publicaciones y de datos sobre densidad) realizada en el presente trabajo. En negritas se destacan los países en condición de exótica. (Ver Material Suplementario con el detalle de la fuente revisada).

Abundancias conocidas a nivel mundial
La densidad promedio del jabalí estimada del total de trabajos revisados fue de 7 (rango 0.01-115) ind/km2. La mayoría (55%) de las densidades publicadas se encuentran en el rango 0-3 ind/km2 mientras que el 33% y el 12% restante corresponden a datos en los rangos 4-13 ind/km2 y más de 13 ind/km2, respectivamente (Fig. 1). Este último intervalo de densidad se considera que se encuentra fuera del rango natural de variación de densidades en su condición nativa por lo cual se lo define como de hiperabundancia (Ickes, 2001). Cerca del 90% de estos valores de hiperabundancia corresponden a escenarios donde la especie es exótica (Fig. 1). Existe una cierta tendencia a una mayor densidad del jabalí en condición de exótica que como nativa, dentro que fuera de áreas protegidas y en las poblaciones ubicadas en islas oceánicas comparados con el continente (Tabla 2).

Fig. 1. Distribución de frecuencias de los datos de densidad publicados a nivel mundial para poblaciones de jabalí en su condición exótica (N = 138) y nativa (N = 135). El último intervalo corresponde a >23 ind./km2.
Tabla 2 Media, mediana y valores mínimo-máximo de la densidad recopilada del jabalí (ind./km2) según su condición (nativa o exótica), ubicación (continente o isla) y estatus de protección del territorio (fuera o dentro de areas protegidas).

Patrón de densidades entre biomas en el ámbito nativo o exótico
Por su parte, las densidades publicadas tienden a ser más altas en selvas tropicales y subtropicales comparada con las praderas templadas, los desiertos o los bosques templados (Fig. 1). A su vez, tienden a ser más altas en sabanas que en praderas templadas, y en bosques mediterráneos más que en bosques y praderas templadas (Fig. 1).
Los trabajos revisados muestran que el jabalí en su área original de distribución tendería a ser más abundante en los biomas de sabanas, de taiga (bosques fríos de coníferas) y en bosques-matorrales mediterráneos comparados con bosques y praderas templadas y desiertos. Por el contrario, en las regiones invadidas parece presentar una tendencia de más abundancia en selvas subtropicales frías o en selvas tropicales, y en menor medida en biomas mediterráneos y en selvas secas subtropicales comparados con biomas que carecen de cobertura arbustiva o arbórea (Fig. 1).
Recopilación de parámetros reproductivos y demográficos
Area de Acción: El área de acción en el jabalí varía de acuerdo a una mezcla de factores entre los que se destaca la abundancia absoluta y la disponibilidad espacial del alimento, del agua y de la cobertura vegetal como refugio-protección térmica, el tamaño corporal y la densidad local de individuos (Mayer y Brisbin, 2009). De los datos recopilados se desprende que el área de acción del jabalí puede variar en hembras y machos entre 0.3-60.0 y 0.4-135 y km2, respectivamente, y es variable dentro y entre biomas (Tabla 3).
Tabla 3 Síntesis de datos demográficos del jabalí por bioma recopilados a partir de la búsqueda bibliográfica. (Fuentes: Dzieciolowski et al., 1992; Choquenot et al., 1996; Gabor et al., 1999; Sweitzer et al., 2000; Choquenot y Ruscoe, 2003; Bieber y Ruf, 2005; Da Cunha Nogueira et al., 2007; Mayer y Brisbin, 2009; Fernández Lario, 2014; Massei et al., 2014). En Area de Acción se presentan los rangos para hembras (superior) y machos (inferior).
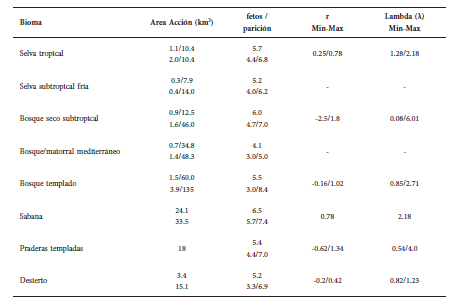
Fecundidad: El tamaño de la camada aumenta con la edad, con el peso de la madre y según la disponibilidad de alimento. Las poblaciones de jabalí tiene en promedio 0.8 a 2 camadas al año y un promedio de entre 3-8.4 fetos por camada, mientras que es de 4-5 en la variante euroasiática y de 5-6 en el jabalí asilvestrado (Mayer y Brisbin, 2009).
Mortalidad: El jabalí se caracteriza por presentar altas tasas de mortalidad antes del 1° año de vida (p. ej. 50-58%; Baber y Coblentz, 1986; Mayer y Brisbin, 2009) debido a accidentes, heridas, aplastamiento o sofocaciones en el nido, por ahogo, peleas, predación o por altas o bajas temperaturas, por enfermedades o hambrunas. Sin embargo puede ser muy variable y fluctuar entre 10-15% en épocas favorables y 90-100% en períodos duros (sequías, inundaciones e inviernos severos). En subadultos y adultos la mortalidad varía entre 10-50% (Mayer y Brisbin, 2009).
Tasa de crecimiento poblacional: La dinámica poblacional interanual del jabalí es muy fluctuante. Se han estimado promedios de tasa intrínseca poblacional (r o la diferencia entre individuos nacidos y muertos en el año) de entre –2.5 y 1.8, y promedios de tasa finita de crecimiento (λ o proporción de nuevos individuos que anualmente se incorporan a la población por cada individuo presente) de entre 0.40 y 1.35 (Choquenot et al., 1996; Choquenot et al., 2003; Uzal y Nores, 2004; Bieber y Ruf, 2005; Mayer y Brisbin, 2009). Estas tasas determinan que las poblaciones de jabalí pueden crecer 2-3 veces de un año para el otro (Pavlov, 1980; Barrett y Birmingham, 1994) y estas fluctuaciones poblacionales parecen ocurrir en todos los biomas a escala mundial (Tabla 3).
Factores de regulación
El jabalí como especie r estratega responde rápida y dinámicamente a la influencia de factores climáticos, antrópicos o epidemiológicos, que producen altas tasas de mortalidad juvenil pero que son posteriormente compensadas con una extraordinaria capacidad reproductiva asociada a la aparición de pulsos de recursos (Tabla 3; Bieber y Ruf, 2005; Mayer y Brisbin, 2009).
Varios autores coinciden en que en las regiones de clima frío y húmedo (bosques templados y taiga europea) la regulación poblacional del jabalí está controlada directamente por la severidad del invierno y secundariamente por los pulsos de alimento, en particular de semillas de gran tamaño aportadas por especies del género Quercus spp. (Andrzejewski y Jezierski, 1978; Briedermann, 1990; Melis et al., 2006). Los inviernos rigurosos, donde los suelos se congelan o se acumula nieve, o las épocas de escasez de alimento, provocan una alta mortalidad de crías y subadultos (1-2 años) y de animales viejos (>6 años) por inanición (Okarma et al., 1995; Jedrzejewska et al., 1997; Geisser y Reyer, 2005).
En climas mediterráneos (bosques y matorrales caducos en clima seco), la población de jabalí estaría controlada por la competencia intraespecífica regulada por la interacción compleja entre la variación en la oferta de alimento aportado por especies del género Quercus spp. y la frecuencia e intensidad de sequías estivales que regulan la disponibilidad de agua y la productividad primaria en primavera-verano (Fernández-Llario, 2014). Por el contrario, en regiones áridas y semiáridas, la falta de agua, de sombra y de productividad primaria son factores clave que limitan la capacidad de carga de estos ecosistemas y acotan la dispersión y la posibilidad de alcanzar altas densidades en el jabalí (Gabor et al., 1999; Saunders y Giles, 1995; Melis et al., 2006). En estos ecosistemas, la disposición espacial de la vegetación arbórea ribereña restringe la eficiencia de forrajeo del jabalí en pastizales y acota su uso dentro de un radio de 10 km a lo largo de la red hidrológica (Choquenot y Ruscoe, 2003). Por su parte, en climas tropicales, los pulsos de recursos alimenticios en las selvas aportados por un conjunto diverso de árboles productores de frutos y semillas (p. ej. de la familia Dipterocarpácea) y la frecuencia e intensidad de inundaciones en la estación húmeda serían los factores principales de regulación poblacional (Curran y Leighton, 2000; Ickes, 2001).
Debido a la elevada productividad primaria y al aporte constante de alimento que tienen las selvas y humedales, en estos ambientes el jabalí puede alcanzar muy altas densidades (hiperabundancia), donde las enfermedades, el hombre y otros depredadores tienen un rol regulador secundario (Ickes, 2001).
Métodos de control
Existe una amplia disponibilidad de métodos letales y no letales para controlar a las poblaciones de jabalí, cada una con sus ventajas y desventajas desde el punto de vista técnico, logístico y económico, y según el ambiente donde sean aplicados (Mayer y Brisbin, 2009; Massei et al., 2011). Sin embargo, el jabalí es muy difícil de controlar dado que ante altas tasas de mortalidad causadas por remociones intensivas, responde incrementando su tasa reproductiva a través del aumento de la fecundidad y de la proporción de hembras reproductoras de 8-10 meses de edad (Mayer y Brisbin, 2009). En esta revisión se sintetizó una serie de experiencias de manejo en el ámbito nativo y exótico que reflejan el abanico de posibilidades de control (Tabla 4). En Europa, el jabalí se usa como recurso cinegético, pero la caza pública aplicada incluso con intensidad, no alcanza a regular las poblaciones, salvo en los casos donde se supera anualmente la remoción del 50-60% del total de individuos (Massei et al., 2014). En Oceanía se logra reducir las poblaciones, local o regionalmente, mediante el uso de tóxico (warfarina, 1080 o CSSP) o combinándolos con otros métodos letales o no letales (cercos). Por otra parte, en países de América del Norte el control se basa en la caza intensiva combinada con el trampeo (corral o caja), mientras que las experiencias de erradicación exitosas utilizaron mayormente trampeo o tóxico al inicio, continuaron con la implementación de caza profesional intensiva con o sin perros, y finalizaron con la liberación de jabalíes con radio-collar para la detección y remoción de los últimos grupos (método del jabalí “Judas”, Massei et al., 2011). En su condición de exótica, se ha logrado la erradicación solo en islas oceánicas de hasta 584 km2 o en poblaciones continentales incipientes, donde previamente se alambró el área y por ende, por su restricción de costos el caso de mayor superficie no superó los 60 km2. Por su parte, las experiencias de control sostenido para reducir fuertemente las poblaciones, se aplicaron sobre superficies de entre 40-2210 km2. El costo económico por individuo removido es muy variable según la abundancia poblacional, la complejidad y objetivo de manejo, puede fluctuar entre US$ 50-26 000 con promedios de US$ 220-521 en experiencias de erradicación (Tabla 4). En Argentina el único caso de control sostenido y monitoreado es el del Parque Nacional El Palmar, donde en 85 km2 y en un escenario de hiperabundancia (>16 ind./km2) se logró, en 5-6 años, reducir la población en un 55% aplicando simultáneamente tres métodos de control (cacería desde apostaderos, caza con perros y caza nocturna desde vehículo; APN 2008). En base a la experiencia internacional revisada se propone una subdivisión de los esquemas de control que en nuestra opinión serían los más convenientes de aplicar en Argentina según el escenario ambiental y la situación poblacional que potencialmente podría el jabalí alcanzar en cada ecorregión (Fig. 2). Los métodos combinados o secuenciales propuestos son los que la bibliografía destaca por su efectividad y rendimiento en términos de costo-beneficio (Mayer y Brisbin, 2006; Massei et al., 2011).
Tabla 4
Comparación de métodos de control de jabalí aplicados en distintos ambientes y superficie y para diferentes objetivos. Esta lista representa una variedad representativa de entre todos los casos compilados.




Fig. 2. Esquemas de control propuestos para los distintos escenarios de invasión y ecorregiones de Argentina basado en la revisión de experiencias internacionales. Con signo positivo (+) y con flecha se indica la aplicación conjunta o consecutiva, respectivamente. Los signos de interrogación corresponden a escenario donde no está fehacientemente confirmada la especie.
Métodos de monitoreo
Si no se puede o no se tiene capacidad para monitorear la población de jabalí, no se la puede manejar (Engeman et al., 2013). Existen diversos métodos para estimar su abundancia; cada uno tiene sus ventajas y desventajas, y, en particular, los utilizados para determinar la densidad absoluta tienen más complejidad y son costosos, por lo que se recomienda utilizar índices de abundancia que sean previamente calibrados correctamente para confirmar su confiabilidad (Engeman et al., 2013). En este sentido se propone un esquema de métodos de monitoreo según el tipo de ambiente y el grado de accesibilidad del área bajo manejo, destacándose la utilidad de los métodos basados en el registro de signos (hozadas, heces o huellas) si previamente son calibrados con el conteo de animales utilizando transporte aéreo o terrestre o a partir de la aplicación de batidas con perros y un gran número de personas (p. ej. 20-50; Fig. 3).

Fig. 3. Esquema con propuestas de métodos para el monitoreo poblacional del jabalí según condiciones ambientales y grado de accesibilidad. La propuesta de método y su condición de aplicación se indican mediante la misma numeración que figura entre paréntesis. (Fuente: Anderson y Stone, 1994; Choquenot et al., 1996; Sweitzer et al., 2000; Engeman et al., 2013; Massei et al., 2014).
DISCUSION
Según nuestra revisión bibliográfica, el jabalí presenta un amplio rango de abundancias pero con una importante proporción de casos con densidades altas y muy altas, de hiperabundancia, y un promedio preocupante según los datos mundiales recopilados. Los antecedentes demográficos a escala mundial muestran que la especie tendería a ser más abundante en ambientes con mayor cobertura vegetal y alcanzaría las densidades más altas en ecosistemas con máxima productividad primaria y con limitadas regulaciones abióticas (selvas y sabanas en regiones tropicales y subtropicales). A la vez se observa un patrón de mayor abundancia en escenarios sin disturbios humanos o donde no se controlan sus poblaciones (p. ej. dentro de las áreas protegidas) y en donde la dispersión está limitada o los factores de regulación están más relajados (p. ej. en las islas oceánicas).
La regulación poblacional del jabalí es compleja y está dada principalmente por el clima (denso-independiente) y por la competencia intra-específica en épocas de escasez de recursos (denso-dependiente). Solo las estrategias de manejo basadas en la aplicación simultánea de varios métodos de control que se complementen entre sí podrán reducir significativamente las poblaciones, siempre y cuando eliminen por año el 50-70% o más de los individuos totales de la población (Choquenot et al., 1996; Bieber y Ruf, 2005; Melis et al., 2006; Mayer y Brisbin, 2009; Massei et al., 2011, 2014). Si bien el manejo de la especie debe centralizarse en reducir impactos, no en remover individuos per se, está demostrada la relación positiva y curvilínea entre la abundancia poblacional y el nivel de daño que produce el jabalí (Choquenot et al., 1996; Seward et al., 2004). En este sentido, tomando en cuenta la distribución de frecuencias de los datos recopilados sobre densidad, sobre rangos de tasa intrínseca de crecimiento y sobre el porcentaje mínimo de remoción anual de individuos que quebró la tendencia poblacional en las experiencias de manejo exitosas, para reducir los impactos del jabalí se esperaría, para muchas poblaciones que se desee controlar, que desde el inicio el manejo elimine más de 3-4 ind./km2 al año, y más aún en condiciones de hiperabundancia donde es preciso eliminar anualmente más del 70% de los individuos de la población. A su vez, los programas de control para ser exitosos deben aplicarse a una escala espacial adecuada según las áreas de acción (p. ej., un promedio de 7 y 20 km2 en hembras y machos, respectivamente, según Mayer y Brisbin, 2009) y según las diferencias en el patrón de dispersión que tiene la especie en ecosistemas húmedos (más sedentario) y áridos-semiáridos (más móvil). Estas características determinan la necesidad de un abordaje regional y de una coordinación del manejo entre tierras públicas y privadas, para lo cual se necesita de un enfoque cooperativo entre el Estado y sus distintas instituciones involucradas y los propietarios de la tierra.
Escenarios demográficos probables a futuro en Argentina
De la recopilación bibliográfica se desprende que casi no existe información sobre la demografía del jabalí en Argentina, esto limita fuertemente las posibilidades de su manejo poblacional en el país. En este contexto, si bien los datos de densidad del jabalí a nivel mundial pueden tener su sesgo dado que fueron obtenidos por distintos métodos (captura-marcaje-recaptura, telemetría, conteos directos o conteo de signos y su posterior calibración), por su cantidad y cobertura mundial se consideran útiles para ensayar una primera aproximación del potencial escenario demográfico que la especie podría alcanzar en las distintas ecorregiones de Argentina, con el objeto de contribuir con la argumentación para la priorización del manejo de esta especie, comenzando por estimar densidades y tendencias en distintos puntos de Argentina, para luego comenzar a controlar sus poblaciones. Actualmente el jabalí está bien establecido en las ecorregiones de la Pampa Húmeda, del Espinal, de los Bosques Patagónicos y de los Esteros del Iberá, y está invadiendo la Estepa Patagónica, el Monte de Llanuras-Mesetas y los Campos y Malezales (Novillo y Ojeda, 2009). Considerando que en toda invasión existen tiempos de retardo y teniendo en cuenta los tiempos de residencia del jabalí en estas ecorregiones (10-100 años), es muy probable que en ninguna de ellas haya finalizado el proceso de invasión y se hayan alcanzado las densidades máximas potenciales según la capacidad de carga de cada ambiente. En Iberá, en los bosques templados patagónicos, en particular en los más húmedos o donde hay recursos que provoquen pulsos poblacionales (p. ej. Selva Valdiviana, bosques de araucaria), y en la Llanura Pampeana la especie podría alcanzar una de las más altas densidades del país (quizás >10 ind./km2), superando los registros actuales (Pérez Carusi et al., 2009), como se observó en las sabanas y humedales subtropicales (p. ej. India o Brasil) y en las selvas subtropicales frías (Australia o Nueva Zelanda). Por el contrario, si la situación fuera como en los ambientes áridos y semiáridos de EE.UU. y Australia, en la Estepa Patagónica se esperaría una invasión dendrítica a lo largo de los cursos de agua, donde podría ser localmente abundante (1-5 ind./km2) si hay mallines y humedales, pero en general, lejos del agua (≥ 10 km), se establecería en bajas densidades (< 0.5 ind./ km2). Similar situación se esperaría en el Monte y en el Espinal, salvo que en el paisaje existan fuentes de agua naturales o artificiales asociadas a la ganadería o al uso agrícola que favorezcan la dispersión y aumento poblacional a pesar de la aridez regional (Gabor et al., 1999; Choquenot y Ruscoe, 2003). La Yunga y la Selva Paranaense, aún no invadidas, están claramente en riesgo frente a la posibilidad cierta de que el jabalí colonice estas regiones del país y que alcance altas densidades (quizás > 15-20 ind./km2), ya que aquí la especie expresaría todo su potencial por las condiciones abióticas y por las fuentes de alimento (p. ej. Dipterocarpaceas) aptas para que generen pulsos poblaciones, como fuera observado en las selvas tropicales (p. ej. Malasia, India o Sri Lanka) y subtropicales (p. ej. Australia o Brasil). El Chaco Seco y Húmedo podrían también ser colonizados por poblaciones de jabalí con densidades relativamente altas (quizás 5-10 ind./km2) si tomamos como ejemplo los datos provenientes de los bosques-matorrales mediterráneos de España, Italia o EE.UU. (California). En estas ecorregiones hay fuentes de alimento (p. ej. Prosopis) que podrían provocar pulsos poblacionales importantes en el jabalí. También en la ecorregión de los Montes de Sierras y Bolsones el jabalí podría alcanzar densidades altas a moderadas (p. ej. 1-8 ind./ km2) como las observadas en los bosques montanos de Nepal. Las ecorregiones de Altos Andes y Puna (p. ej. en La Rioja o San Juan) son quizás las regiones del país más difíciles para que el jabalí se establezca por las restricciones que imponen simultáneamente la aridez y las bajas temperaturas. En cierta medida se supone que ocurriría aquí el patrón observado en el extremo este de Rusia (Melis et al., 2006).
La invasión futura del jabalí dependerá en gran parte de la facilitación que genere el hombre, ya sea por translocación de animales, como por la creación de cotos de caza del jabalí puro o hibridado, o por los escapes de chanchos domésticos desde criaderos, como se demostrara en Australia, Estados Unidos, Nueva Zelanda o en el norte de Sudamérica (Choquenot et al., 1996; De Oliveira, 2012). Todos estos manejos que alientan la dispersión y el establecimiento de la especie deberían prohibirse o regularse, en particular en las regiones del país sin jabalí y más aun en las zonas de amortiguación de las áreas protegidas. A su vez los paisajes fragmentados conformados por vegetación nativa y cultivos agrícolas que favorezcan al jabalí (maíz, trigo, avena, cebada, viñedos, caña de azúcar, entre otros) pueden generar escenarios de hiperabundancia, en particular en regiones cálidas y húmedas (Ickes, 2001).
Regiones del país con mayores dificultades de manejo futuras
De la experiencia recabada sobre manejo del jabalí se desprende que los escenarios de mayor dificultad de control poblacional ocurrirán en aquellas regiones donde la especie pueda alcanzar moderadas-altas densidades y donde el acceso y el tipo de vegetación y el contexto socioeconómico y ambiental limiten la aplicación de los métodos letales más efectivos. En este contexto, la Yunga, la Selva Paranaense, los Montes de Sierras y Bolsones y los Bosques Patagónicos presentan fuertes restricciones al manejo por la complejidad topográfica frente al potencial demográfico que puede alcanzar la especie en dichos ambientes. En estos ecosistemas, si no se pueden usar tóxicos o lazos en combinación con una cacería intensiva con perros, pocas alternativas de manejo eficaces quedan disponibles, al menos hasta que se desarrollen los métodos de esterilización a campo y a gran escala. En paisajes fragmentados y degradados de estos ecosistemas, quizás la aplicación de un esquema de cacería intensiva con perros, combinado con el trampeo (red o corral) local sea la mejor alternativa de manejo. Por el contrario, en los ecosistemas abiertos y llanos la aplicación a gran escala de trampeo (corrales o redes) y caza intensiva terrestre o aérea quizás sea la mejor alternativa si se aplica profesionalmente y en forma sostenida. Sin embargo en este tipo de ambientes pero anegadizos, como Iberá o Samborombón, las limitaciones de acceso imponen fuertes restricciones para la aplicación de estos esquemas de control (Pérez Carusi et al., 2009). Un enfoque estratégico del control centralizado en el efecto que generan los pulsos de alimento en la demografía del jabalí es clave, ya que se demostró que para reducir la población es más efectivo direccionar el esfuerzo de control hacia hembras adultas, en años con pobres condiciones de recursos, y sobre juveniles (< 1 año de edad) en años con ocurrencia de dichos pulsos (Bieber y Ruf, 2005). Este enfoque ya fue propuesto para los bosques de araucaria en Patagonia considerando el patrón fluctuante y sincrónico de la producción de semillas en esta conífera (Sanguinetti y Kitzberger, 2010) y la respuesta espaciotemporal del jabalí a sus pulsos (Pastore y Sanguinetti, 2014).
Necesidades de información y de manejo urgentes
Varios autores demuestran y advierten sobre las tendencias alcistas en las abundancias poblaciones del jabalí en distintas regiones del mundo, independientemente de su condición de exótica o nativa (Melis et al., 2006; Massei et al., 2011, 2014). En este contexto, se considera que en Argentina es urgente conocer la distribución, abundancia y tendencia poblacional del jabalí en cada ecorregión, alentar investigaciones bien diseñadas que determinen experimentalmente el impacto de la especie sobre la biodiversidad en áreas protegidas y se impulse sostenidamente desde el Estado la aplicación de esquemas de control bien planificados (Ballari et al., 2014). A su vez, para que los tomadores de decisiones prioricen en su agenda a esta especie, es igualmente importante y urgente que se estimen las pérdidas socioeconómicas actuales y potenciales frente a futuros escenarios de invasión, expresadas en términos monetarios, que genera o generará el jabalí por daños a la ganadería (competencia, enfermedades), a la agricultura, y los asociados con la salud humana (enfermedades pero también colisiones vehiculares). Como en otros países, esta información seguramente ayudará a incentivar el necesario y justificado manejo estratégico del jabalí a escala regional dirigida desde el Estado y concertando la ineludible cooperación con los propietarios de la tierra y articulando la imprescindible participación de los distintos sectores de la sociedad que ven en el jabalí un problema o un beneficio.
AGRADECIMIENTOS
Se agradece a Guillermo Gil y Marcelo Cavicchia, de la Administración de Parques Nacionales, por la información remitida sobre el manejo del jabalí en el PN El Palmar, y a Guillermo Cirignoli sobre el manejo en los Esteros del Iberá. Se agradecen los aportes y contribuciones realizados por el revisor anónimo para mejorar el manuscrito final.
LITERATURA CITADA
1. ANDERSON SJ y CP STONE. 1993. Snaring to control feral pigs Sus scrofa in a remote Hawaiian rain forest. Biological Conservation 63:195-201 [ Links ]
2. ANDREZEJEWSKI R y W JEZIERSKI. 1978. Management of wild boar population and its effects on commercial land. Acta Theriologica 23:245-250. [ Links ]
3. APN. 2008. Monitoreo del plan de control de los mamíferos exóticos invasores en el Parque Nacional El Palmar. Informe Final, Período 2006-2007. Administración de Parques Nacionales, Argentina, 80 pp. [ Links ]
4. BABER DW y BE COBLENTZ. 1986. Density, home range, habitat use and reproduction of feral pigs on Santa Catalina Island. Journal of Mammalogy 67(3):512-525. [ Links ]
5. BALLARI SA, MF CUEVAS, S CIRIGNOLI y AEJ VALENZUELA. 2014. Invasive wild boar in Argentina: Using protected áreas as a research platform to determine distribution, impacts and management. Biological Invasions 17:1595-1602. [ Links ]
6. BARRETT R, BL GOARCHER, PF GOGAN y EL FITZHUGH. 1988. Removing feral pigs from Annadel State Park. Transactions of the western Section of the Wildlife Society 24:47-52. [ Links ]
7. BARRET RH y GH BIRMINGHAM. 1994. Wild pigs. Pp. D65-D70, en: Prevention and control of wildlife damage (SE Hygnstrom, RM Timm y GE Larson, eds.). 2 volumes. Great Plains Agricultural Council, Univ. of Nebraska, Lincoln, Nebraska. [ Links ]
8. BARRIOS-GARCIA MN y SA BALLARI. 2012. Impact of wild boar (Sus scrofa) in its introduced and native range: A review. Biological Invasions 14:2283-2300. [ Links ]
9. BARRIOS-GARCIA MN y D SIMBERLOFF. 2013. Linking the pattern to the mechanism: How an exotic mammal promotes plant invasions. Austral Ecology 38:884-890. [ Links ]
10. BIEBER C y T RUF. 2005. Population dynamics in wild boar Sus scrofa: Ecology, elasticity of growth rate and implications for the management of pulsed resource consumers. Journal Applied Ecology 42:1203-1213. [ Links ]
11. BOBEK DMB y MAJ FURTEK. 2015. The age structure and sex ratio in wild boar (Sus scrofa) populations as determined by observations of free-roaming populations and by harvests of collective hunts in southern Poland. European Wildlife Journal Research 61:167-170. [ Links ]
12. CHOQUENOT D, B KAY y B LUKINS. 1990. An Evaluation of warfarin for the control of feral pigs. Journal Wildlife Management 54:353-359 [ Links ]
13. CHOQUENOT D, J McIIROY y T KORN. 1996. Managing vertebrate pests: Feral pigs. Bureau of Resource Sciences. Australian Government Publishing Service, Canberra. [ Links ]
14. CHOQUENOT D y WA RUSCOE. 2003. Landscape complementation and food limitation of large herbivores: Habitat-related constraints on the foraging efficiency of wild pigs. Journal Applied Ecology 72:14-26 [ Links ]
15. CIRIGNOLI S. 2010. Informe sobre las actividades de control de fauna exótica en la Reserva Provincial Iberá, Corrientes, Argentina. The Conservation Land Trust. Período 2007-2010, Informe Inédito, 9 pp. [ Links ]
16. CLARK CMH y RM DZIECIOLOWSKI. 2012. Feral pigs in the northern South Island, New Zealand: I. Origin, distribution and density. Journal Royal Society New Zealand 3:237-247. [ Links ]
17. CRUZ F, CJ DONLAN, K CAMPBELL y V CARRION. 2005. Conservation action in the Galápagos: Feral pig (Sus scrofa) eradication from Santiago Island. Biological Conservation 121:473-478. [ Links ]
18. CURRAN LM y M. LEIGHTON. 2000. Vertebrate responses to spatio-temporal variability in seed production by mast-fruiting Borneon Dipterocarpaceae. Ecological Monographs 70:121-150. [ Links ]
19. CUEVAS MF, L MASTRONTONIO, RA OJEDA y FM JAKSIC. 2012. Effects of wild boar disturbance on vegetation and soil properties in the Monte Desert, Argentina. Mammalian Biology 77:299-306. [ Links ]
20. CUEVAS MF, RA OJEDA, MA DACAR y FM JAKSIC. 2013. Seasonal variation in feeding habits and diet selection by wild boars in a semi-arid environment of Argentina. Acta Theriologica 58:63-72. [ Links ]
21. DA CUNHA NOGUEIRA SS, SLG NOGUEIRA-FILHO, M BASSFORD, K SILVIUS y JM VIEIRA FRAGOSO 2007. Feral pigs in Hawaii: Using behavior and ecology to refine control techniques. Applied Animal Behavior Science 108:1-11 [ Links ]
22. DE OLIVEIRA CHS 2012. Ecologia e manejo Javali (Sus scrofa L.) na América do Sul. Tese apresentada ao programa de Pós-graduação em Ecologia da Universidade Federal do Rio de Janeiro como requisito para obtenção do Título de Doutor em Ecologia. Universidad Federal do Rio de Janeiro, Brasil. [ Links ]
23. DESBIEZ ALJ, RE BODMER y WM TOMAS. 2010. Mammalian densities in a Neotropical wetland subject to extreme climatic events. Biotropica 42:372-78. [ Links ]
24. DITCHKOFF SS, DB JOLLEY, BD SPARKLIN, LB HANSON, MS MITCHELL y JB GRAND. 2012. Reproduction in a population of wild pigs (Sus scrofa) subjected to lethal control. Journal of Wildlife Management 76:1235-1240 [ Links ]
25. DZIECIOLOWSKI RM, CMH CLARKE y CM FRAMPTON. 1992. Reproductive characteristics of feral pigs in New Zealand. Acta Theriologica 37:259-270. [ Links ]
26. ENGEMAN RM, G MASSEI, M SAGE y MN GENTLE. 2013. Monitoring wild pig populations: A review of methods. Environmental Science Pollution Research 20:8077-8091. [ Links ]
27. FERNÁNDEZ-LLARIO P. 2014. Jabalí - Sus scrofa. En: Enciclopedia virtual de los vertebrados españoles. (A Salvador y JJ Luque-Larena, eds.). Museo Nacional de Ciencias Naturales, Madrid. http://www.vertebradosibericos.org/1996 [ Links ]
28. GABOR TM, EC HELLGREN, RA VAN DEN BUSSCHE y NJ SILVY. 1999. Demography, sociospatial behavior and genetics of feral pigs (Sus scrofa) in a semi-arid environment. Journal of the Zoological Society (London) 247:311-322. [ Links ]
29. GABOR TM, EC HELLGREN y NL SILVY. 2001 Multi-scale habitat partitioning in sympatric suiforms. Journal Wildlife Management 65:99-110. [ Links ]
30. GASKAMP JA 2012. Use of drop-nets damage and disease abatement. Master of Science Thesis, Texas AyM University, 139 pp. [ Links ]
31. GEISSER H y HU REYER. 2005. The influence of food and temperature on population density of wild boar Sus scrofa in the Thurgau (Switzerland). Journal of Zoology 267:89-96. [ Links ]
32. HANSON LB, MS MITCHELL, JB GRAND, DB JOLLEY, BD SPARKLIN y SS DITCHKOFF. 2009. Effect of experimental manipulation on survival and recruitment of feral pigs. Wildlife Research 36:185-191. [ Links ]
33. HOWELLS O y G EDWARDS-JONES. 1997. A feasibility study of reintroducing wild boar Sus scrofa to Scotland: Are existing woodlands large enough to support minimum viable populations. Biological Conservation 81:77-89. [ Links ]
34. ICKES KL 2001. The effects of wild pigs (Sus scrofa) on woody understory vegetation in Lowland Rainforest of Malaysia. Phd Thesis, Louisiana State University, 93 pp. [ Links ]
35. JEDRZEJEWSKI B, W JEDRZEJESWSKI, AN BUNEVICH, L MILKOWSKI y ZA KRASINSKI. 1997. Factors shaping population densities and increase rates of ungulates in Bialowieza Primeval Forest (Poland and Belarus) in the 9th and 20th centuries. Acta Theriologica 42:399-451. [ Links ]
36. KESSLER CC. 2000. Eradication of feral goats and pigs and consequences for other biota on Sarigan Island, Commonweath of the Northern Mariana Islands. Pp. 132-140, en: Turning the tide: The eradication of invasive species (CR Veitch y MN Clout, eds.). IUCN SSC Invasive Species Specialist Group. IUCN, Gland, Switzerland and Cambridge, UK. [ Links ]
37. KEULING O, K LAUTERBACH, N STIER y M ROTH. 2010. Hunter feedback of individually marked wild boar Sus scrofa L.: Dispersal and efficiency of hunting in northeastern Germany. European Journal Wildlife Research 56:159-167. [ Links ]
38. LANTSCHNER MV, M RUSCH y HP HAYES. 2013. Do exotic pine plantations favour the spread of invasive herbivorous mammals in Patagonia? Austral Ecology 38:338-345. [ Links ]
39. LOHRAFF K 2008. Fort Leonard Wood, Missouri: A feral hog eradication success story. National Conference of Feral Hog, Paper 5. [ Links ]
40. LOWE S, M BROWNE, S BOUDJELAS y M DE POORTER. 2000. 100 of the World’s worst invasive alien species. A selection from the Global Invasive Species Database. ISSG, Auckland, New Zealand, http://www.issg.org/database/species/reference_files/100English.pdf.
41. MCCANN BE y DK GARCELON. 2007. Eradication of feral pigs from Pinnacles National Monument. Journal of Wildlife Management 72:1287-1295 [ Links ]
42. MASSEI G, S ROY y R BUNTING. 2011. Too many hogs? A review of methods to mitigate impact by wild boar and feral hogs. Human-Wildlife Interactions 5:79-99. [ Links ]
43. MASSEI G, J KINDBERG, A LICIPPE, D. GACIC, N SPERM et al. 2014. Wild boar populations up, numbers of hunters down? A review of trends and implications for Europe. Pest Management Science, DOI 10.1002/ps.3965 [ Links ]
44. MAYER JJ y IL BRISBIN. 2009. Wild pigs: Biology, damage, control techniques and management. Savannah River National Laboratory, Aiken, South Carolina. Mayer JJ y I L Brisbin editors., SRNL-RP-2009-00869, 408 pp. [ Links ]
45. MELIS C, PA SZANFRANSKA, B JEDRZEJEWSKA y K BARTON. 2006. Biogeographical variation in the population density of wild boar (Sus scrofa) in western Eurasia. Journal Biogeography 33:803.811 [ Links ]
46. MERINO ML y BN CARPINETTI. 2003. Feral pig Sus scrofa population estimates in Bahía Samborombón conservation area, Buenos Aires Province, Argentina. Mastozoología Neotropical 10:269-275. [ Links ]
47. MERINO ML, BN CARPINETTI y AM ABBA. 2009. Invasive mammals in the National Parks System of Argentina. Natural Areas Journal 29:42-49. [ Links ]
48. NOVILLO A y RA OJEDA. 2008. The exotic mammals of Argentina. Biological Invasions 10:1333-1344. [ Links ]
49. NUÑEZ MA, J HAYWARD, TR HORTON, GC AMICO, RD DIMARCO, MN BARRIOS-GARCIA y D SIMBERLOFF. 2013. Exotic mammals disperse exotic fungi that promote invasion by exotic trees. PLoS ONE 8(6): e66832. doi:10.1371/journal.pone.0066832 [ Links ]
50. OKARMA H, B JEDRZEJEWSKA, W JEDRZEJEWSI, ZA KRASINSKI y L MILKOWSKI. 1995. The roles of predation, snow cover, acorn crop, and man-related factors on ungulate mortality in Bialowieza Primeval Forest, Poland. Acta Theriologica, 40:197-210. [ Links ]
51. PARKES JP, DSL RAMSEY, N MACDONALD, K WALKER, S MCKNIGHT, BS COHEN y SA MORRISON. 2011. Rapid eradication of feral pigs (Sus scrofa) from Santa Cruz Island, California. Biological Conservation 143:634-641. [ Links ]
52. PASTORE H y J SANGUINETTI. 2014. Selección de bosques de araucaria por el jabalí (Sus scrofa Linnaeus, 1758) y efecto de la oferta de semillas en el PN Lanín (Patagonia, Argentina). XXVII Jornadas Argentinas de Mastozoología, Esquel, noviembre de 2014. [ Links ]
53. PAVLOV PM 1980. The diet and general ecology of the feral pig (Sus scrofa) at Girilambone, N. S. W. M.S. Thesis, Monash University, Melbourne, Australia. [ Links ]
54. PEINE JD y JA FARMER. 1990. Wild Hog Management Program at Great Smoky Mountains National Park. Proc. 14th Vertebrate Pest Conference, University California, Davis, USA, 221-227pp. [ Links ]
55. PESCADOR M, J SANGUINETTI, H PASTORE y S PERIS. 2009. Expansion of the introduced wild boar (Sus scrofa) in the Andean Region, Argentinean Patagonia. Galemys 21:121-32. [ Links ]
56. PEREZ CARUSI LC, MS BEADE, F MIÑARRO, AR VILA, M GIMENEZ DIXON y DN BILENCA. 2009. Relaciones espaciales y numéricas entre venados de las pampas (Ozotoceros bezoarticus celer) y chanchos cimarrones (Sus scrofa) en el Refugio de Vida Silvestre Bahía Samborombón, Argentina. Ecología Austral 19:63-71. [ Links ]
57. RICHARDSON CD, PS GIPSON, DP JONES y JC LUCHSINGER. 1997. Extirpation of a recently established feral pig population in Kansas. Proceedings of the Eastern Wildlife Damage Mammalogy Management Conference 7:100-103 [ Links ]
58. ROSELL C, P FERNANDEZ-LLARIO y J HERRERO. 2001. El Jabalí (Sus scrofa LINNAEUS, 1758). Galemys 13:1-25. [ Links ]
59. SALINAS RA, WH STIVER, JL CORN, S LENHART y C COLLINS. 2015. An individual-based model for feral hogs in Great Smoky Mountains National Park. USDA National Wildlife Research Center - Staff Publications. Paper 1663 [ Links ]
60. SANGUINETTI J y T KITZBERGER. 2010. Factors controlling seed predation by rodents and non-native Sus scrofa in Araucaria araucana forests: Potential effects on seedling establishment. Biological Invasion 12:689-706. [ Links ]
61. SANGUINETTI J, L BURIA, L MALMIERCA, C NUÑEZ, AEJ VALENZUELA et al. 2014. Manejo de especies exóticas invasoras en Patagonia, Argentina: priorización, logros y desafíos de integración entre ciencia y gestión identificados por la Administración de Parques Nacionales. Ecología Austral 24:183-192. [ Links ]
62. SAUNDERS G y J GILES. 1995. Ecological comparison of two wild pig populations in semi-arid and sub-alpine Australia. Ibex, Journal of Mountain Ecology 3:152-155. [ Links ]
63. SEWARD NW, KC VERCAUTEREN, GW WITMER y RM ENGEMAN. 2004. Feral swine impacts on agriculture and the environment. Sheep and Goat Research Journal 19:34-40. [ Links ]
64. SCHIAFFINI MI y A VILA. 2012. Habitat use of the wild boar, Sus scrofa Linnaeus 1758, in Los Alerces National Park, Argentina. Studies on Neotropical Fauna and Environment 47:11-17. [ Links ]
65. SCHUYLER PT, DK GARCELON y S ESCOVER. 2002. Eradication of feral pigs (Sus scrofa) on Santa Catalina Island, California, USA. Pp 274-286, en: Turning the tide: The eradication of invasive species (CR Veitch y MN Clout, eds). IUCN SSC Invasive Species Specialist Group. IUCN, Gland, Switzerland and Cambridge, UK. [ Links ]
66. SERVANTY S, JM GAILLARD, F RONCHI, S FOCARDI, E BAUBET y O GIMENEZ. 2011. Influence of harvesting pressure on demographic tactics: Implications for wildlife management. Journal Applied Ecology 48:835-843. [ Links ]
67. SWEITZER RA, D VAN VUREN, WM BOYCE y JD WAITHMAN. 2000. Estimating sizes of wild pig populations in the north and central coast regions of California. Journal of Wildlife Management 64:531-543 [ Links ]
68. TOÏGO C, S SERVANTY, JM GAILLARD y E BAUBET. 2008. Disentangling natural from hunting mortality in an intensively hunted wild boar population. Journal of Wildlife Management 72:1532-1539. [ Links ]
69. TWIGG LE, T LOWE, G MARTIN y M EVERETT. 2005. Feral pigs in north-western Australia: Basic biology, bait consumption, and efficiency of 1080 baits. Wildlife Research 32:281-296. [ Links ]
70. UZAL A y C NORES. 2004 Endogenous and exogenous constraints in the population changes of wild boar (Sus scrofa). Galemys 16:83-98. [ Links ]
71. WILLIAMS BL, RW HOLTFRETER, SS DITCHKOGG y JB GRAND. 2011. Trap style influences wild pig behavior and trapping success. Journal of Wildlife Management 75:432-436. [ Links ]
MATERIAL SUPLEMENTARIO EN LÍNEA
Detalle de fuentes revisadas.
https://www.sarem.org.ar/wp-content/uploads/2016/09/SAREM_MastNeotrop_23-2_Sanguinetti-sup1.docx














