Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Mastozoología neotropical
versão impressa ISSN 0327-9383versão On-line ISSN 1666-0536
Mastozool. neotrop. vol.23 no.2 Mendoza dez. 2016
ARTÍCULO
Distribución anidada de murciélagos en fragmentos de bosque premontano de la cuenca media del río Cauca, Colombia
Diana M. Cardona1, John H. Castaño2,4 y Jorge E. Botero3
1 Asociación Colombia Endémica, Programa de Conservación de Murciélagos de Colombia. Medellín, Colombia [Correspondencia: Diana M. Cardona <dianicardoni@gmail.com>].
2 Grupo de investigación en Biología de la Conservación y Biotecnología, Corporación Universitaria Santa Rosa de Cabal UNISARC. Santa Rosa de Cabal, Colombia.
3 Centro Nacional de Investigaciones en Café-CENICAFÉ. Chinchiná, Colombia.
4 Postgrado en Ciencias Biológicas, Pontificia Universidad Javeriana. Bogotá, Colombia.
Recibido 4 febrero 2016.
Aceptado 27 mayo 2016.
Editor asociado: J Morrone
RESUMEN.
La fragmentación del hábitat cambia la estructura y distribución de los ensamblajes ecológicos, de manera que se forman subconjuntos de especies con respecto a los ensamblajes de hábitats no fragmentados. Este trabajo tiene como objetivos identificar el patrón de distribución de murciélagos en 15 fragmentos de Bosque húmedo premontano de la cuenca media del río Cauca (Colombia), y estudiar las características estructurales de los fragmentos de bosques, probablemente relacionadas con la ocurrencia de murciélagos en los mismos. Se capturaron murciélagos con redes de niebla, y se calculó la diversidad, grado de anidamiento y su relación con las características estructurales de los fragmentos de bosque, las cuales se analizaron mediante Modelos Lineales Generalizados. Con un esfuerzo de 15 750 horas-red, se registró un total de 1162 individuos pertenecientes a 32 especies de murciélagos. Lonchophylla concava se registra por primera vez para la zona de estudio. La distribución de las especies de murciélagos en los fragmentos de bosque estudiados reveló un patrón de distribución anidado, donde los bosques que contienen menor riqueza de especies son una submuestra de las especies presentes en los bosques con mayor riqueza. Dicha estructura anidada no está dada por el tamaño de bosque, sino por el promedio del área basal y el diámetro promedio de la vegetación a la altura del pecho. En este sentido, la riqueza de especies de murciélagos aumenta con el grado de recuperación de los fragmentos de bosque y es un factor relevante para predecir el patrón de distribución de los mismos.
ABSTRACT.
Nested distribution of bats in premontane forest fragments of the middle Cauca River basin, Colombia.
Habitat fragmentation changes the structure and composition of ecological assemblages, forming subsets of those species found in unfragmented habitats. The goal of this project was to identify the pattern of distribution of bats in 15 montane humid forest fragments in the middle Cauca River basin (Colombia), and to study the structural characteristics of forest fragments that may explain the occurrence of bats. Bats were captured in mist nets, diversity and nestedness were calculated, and their relationship with measures of structural features was analyzed using Generalized Linear Models. A total of 1162 individuals belonging to 32 bat species were recorded in 15 750 net-hours. Lonchophylla concava was recorded for the first time in the study area. The distribution of bat species in forest fragments revealed a nested pattern, in which forests with lower species richness represent subsamples of the species in the forests with greater species richness. Importantly, this nested structure is not related to the size of forest, but rather to the mean basal area and the mean diameter at breast height of the vegetation. In this sense, the richness of bat species increases with the degree of recovery of forest fragments, which is a relevant factor to predict the pattern of distribution of bats.
Palabras clave: Anidamiento; Ecología de paisaje; Estructura de ensamblajes; Fragmentación de bosques; Zona cafetera.
Key words: Assemblage structure; Coffee landscape; Forest fragmentation; Landscape ecology; Nestedness.
INTRODUCCIÓN
El patrón de distribución de especies es conocido como el espacio que las especies ocupan, así como la forma en que lo hacen, y se produce en función de los recursos que el ambiente les provee (Wright et al., 1998; Gaston y Blackburn, 2007). La ocurrencia de especies (presencia/ ausencia) ha sido usada para identificar los patrones de distribución de las especies entre distintos hábitats, ya que revelan diferencias en la estructura de las comunidades (Diamond, 1975; Ulrich et al., 2009). Existen varios tipos de patrones (Almeida-Neto et al., 2007), entre los más conocidos se encuentran: 1) anidado: cuando las especies se agrupan en determinadas partes del hábitat; 2) aleatorio: cada especie se distribuye en el espacio indistintamente de la ubicación de las otras especies; y 3) tablero de ajedrez: la presencia de las especies se alterna en los diferentes sitios, es decir, la presencia de una especie disminuye significativamente la probabilidad de encontrar otra en el mismo espacio (Almeida-Neto et al., 2007; Gaston y Blackburn, 2007).
El patrón anidado surgió del estudio de comunidades que residen en islas, con el fin de encontrar algún patrón en la organización, donde la distribución de las especies en un sitio no es al azar (Atmar y Patterson, 1993). En el patrón anidado, las especies que aparecen en áreas pobres en especies suelen ser una muestra de las que aparecen en las áreas más diversas (Patterson y Atmar, 1986). Esto ha sido registrado frecuentemente en murciélagos que residen en islas o fragmentos de bosque (Frick et al., 2009; Loayza y Loiselle, 2009; Presley y Willig, 2010; Varzinczak y Passos, 2015).
Una gran variedad de hipótesis han sido planteadas para explicar los patrones de distribución anidada: (1) secuencias ordenadas de extinción y de inmigración de las especies (Patterson y Atmar, 2000; Presley y Willig, 2010); (2) diferencias de abundancia regional entre especies (Cutler, 1991); (3) facilitación (Guégan y Hugueny, 1994); (4) hábitats anidados (Cutler, 1991; Wright et al., 1998); (5) tolerancia selectiva del medio ambiente (Ulrich et al., 2009; López-González et al., 2012); (6) diversidad de hábitats (Simberloff y Martin, 1991); y (7) aislamiento (Meyer y Kalko, 2008). Por otra parte, se ha reportado que la estructura de la vegetación (altura de los árboles, diámetro a la altura del pecho, área basal, cobertura arbórea, densidad de sotobosque y dosel; Estrada y Coates-Estrada, 2002; Yates y Muzika, 2006; Zipkin et al., 2010; Jung et al., 2013), la relación área-perímetro, forma y complejidad estructural de los fragmentos de bosques (Hu et al., 2011), así como diferencias taxonómicas y características específicas de las especies del ensamble (tamaño corporal, vagilidad, rango geográfico, especificidad de hábitat y requerimientos de área) (Wright et al., 1998; Wang et al., 2010), pueden influir diferencialmente sobre la riqueza de especies y el patrón de anidamiento.
A pesar de que la fragmentación del hábitat no es una causa directa de los patrones de anidamiento (Ulrich et al., 2009), los cambios en el uso del suelo y la explotación de los recursos naturales crean mosaicos heterogéneos de diferente tamaño y aislamiento, donde el bosque original queda embebido entre áreas dedicadas principalmente a la ganadería extensiva y la agricultura (Collins et al., 2010; Melo et al., 2013). Esto puede provocar anidamiento, causado principalmente por las secuencias ordenadas de extinción, donde las especies con baja abundancia y especialistas de hábitat se pierden en los fragmentos más pequeños y persisten solo en los fragmentos más grandes (Patterson y Atmar, 2000; Ulrich et al., 2009).
Otra explicación para los patrones anidados en fragmentos de bosque se relaciona con la alteración del hábitat, donde las secuencias ordenadas de ausencias se producen debido a las susceptibilidad de las especies a diferentes grados de perturbación o calidad del hábitat (Fernández-Juricic, 2002a; Bloch et al., 2007; Ulrich et al., 2009). La estructura de la vegetación ha sido estudiada para medir el grado de regeneración y de recuperación de los bosques (Denslow, 2000; Guariguata y Ostertag, 2002; Chazdon et al., 2009; Morales-Salazar et al., 2012). Un cambio en dicha estructura disminuye la capacidad del bosque de proporcionar servicios y productos ecosistémicos, reflejo del estado de perturbación de los mismos (Fao, 2011).
En ese contexto, este trabajo plantea las siguientes preguntas: (1) ¿Presentan los ensamblajes de murciélagos una distribución anidada en 15 fragmentos de bosque de la cuenca media del río Cauca? (2) ¿Existe relación entre el tamaño de los fragmentos de bosque y la ocurrencia de especies dentro de los mismos? (3) ¿El grado de recuperación de los bosques impulsa la ocurrencia y riqueza de especies dentro de los fragmentos de bosque?
MATERIALES Y MÉTODOS
Área de estudio
Este estudio se realizó en 15 fragmentos de bosque húmedo premontano (bh-PM) (Holdridge, 1964; Dinerstein et al., 1995), ubicados entre 930 y 2000 m de altitud en la cuenca media del río Cauca, en la vertiente oriental de la Cordillera Occidental y vertiente occidental de la Cordillera Central, departamentos de Caldas, Quindío, Risaralda y Antioquia, Colombia (4°35’y 5°49’ N y 75°34’ y 75°59’ W) (Tabla 1, Fig. 1). La zona muestreada forma parte del orobioma Subandino (Rodríguez et al., 2006), en el que predomina un régimen bimodal de lluvias, desde marzo hasta junio, y desde septiembre hasta diciembre. Los períodos menos lluviosos son enero-febrero y julio-agosto. Los promedios anuales de precipitación varían desde 2300 a 3000 mm anuales (Eslavar et al., 1986; Cenicafé, 2011).
Tabla 1 Variables estructurales de los fragmentos de bosque y características del ensamblaje de murciélagos de la cuenca media del río Cauca. *Valores promedio del área basal, abundancia, altura y DAP de individuos arbóreos y arbustivos con un DAP > 2.5 cm, tomado de Orrego et al. (2004). N° ind: número de individuos capturados, Sobs: riqueza de especies observada, Sesp: riqueza de especies esperada, basada en el estimador Chao 1 y la desviación estándar (SD), eH’: índice de exponencial de Shanon.
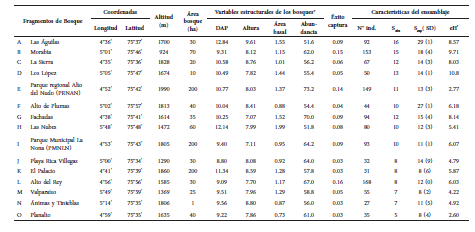

Fig. 1. Localización geográfica de los fragmentos de bosque estudiados en los departamentos de Antioquia, Caldas, Quindío y Risaralda de la cuenca media del río Cauca (Colombia).
Se seleccionaron fragmentos de bosque donde no hubiese problemas de orden público, existiera un interés por su conservación y protección y que estuvieran separados por al menos 3 km entre sí. Los fragmentos seleccionados presentaron tamaños entre 1 y 200 ha (Tabla 1). La región presenta un paisaje conformado por un mosaico de agroecosistemas, donde predomina el cultivo de café al sol y pastos, y en menor grado cultivos anuales, frutales, guaduales y cañadas arborizadas.
Caracterización del ensamblaje de murciélagos
El estudio se realizó en el período comprendido entre noviembre del 2003 y abril del 2004. Para caracterizar el ensamblaje de murciélagos en cada uno de los fragmentos, se capturaron individuos utilizando redes de niebla. En cada fragmento de bosque se instalaron 42 m de red, durante cinco noches consecutivas. Las redes permanecieron abiertas generalmente entre las 18:00 y 24:00 horas, desde el suelo hasta una altura de 2.6 m. La posición de las redes fue determinada por las características del terreno y la fisonomía de la vegetación. En cada fragmento, las redes fueron movidas de lugar en dos ocasiones, en el período de cinco días, buscando abarcar diversos microambientes y evitar que los murciélagos se acostumbraran a ellas. Adicionalmente se realizó captura manual en refugios de especies de Molossidae y Noctilionidae.
Los murciélagos capturados fueron introducidos en bolsas de tela para ser transportados hasta el sitio de procesamiento. A cada individuo capturado se le tomaron medidas externas como longitud del antebrazo y longitud total (las convencionales) en milímetros, con un calibrador de precisión de 0.05 mm. El peso de cada ejemplar se determinó con una gramera de 1 g de precisión. La identificación taxonómica en campo se realizó usando claves dicotómicas para murciélagos como la propuesta por Gardner (2007). Se siguieron cambios nomenclaturales considerados por Gardner (2007) con modificaciones de Solari et al. (2009, 2013), Velazco y Gardner (2009), Larsen et al. (2010), Mantilla- Meluk y Baker (2010), Mantilla-Meluk (2014), y Velazco y Patterson (2014) para algunos géneros. Los murciélagos fueron marcados en la espalda con barniz de uñas, para identificar recapturas en la misma sesión de muestreo. Los ejemplares de difícil identificación fueron prepararon mediante el método de piel-cráneo (Díaz et al., 1998) y se depositaron en la colección teriológica del Museo de Historia Natural de la Universidad de Caldas (MHN-UC 381-728).
Caracterización de la vegetación
Para evaluar la estructura de la vegetación se usaron los datos recopilados por Orrego et al. (2004), los cuales fueron tomados simultáneamente durante el presente estudio. Como variables de la estructura de la vegetación en cada uno de los fragmentos de bosque, se tuvieron en cuenta los cálculos de altura, área basal y abundancia promedio de individuos arbóreos y arbustivos con un diámetro a la altura del pecho (DAP) mayor o igual a 2.5 cm.
Análisis de datos
Para todos los análisis se excluyeron las especies que no fueron capturadas mediante los muestreos nocturnos con redes de niebla. El éxito de captura se calculó como el número de individuos dividido por el esfuerzo de captura (Moreno y Halffter, 2000). La abundancia relativa de murciélagos en cada fragmento se calculó dividiendo el número de individuos de la especie i (ni), entre el número total de individuos (N) (AR= ni /N). Para evaluar la representatividad del muestreo en la zona de estudio se elaboraron curvas de acumulación de especies teniendo en cuenta la abundancia de murciélagos y utilizando el número de noches de muestreo como unidad de esfuerzo. Adicionalmente, se estimó la riqueza de murciélagos esperada (Sesp) para cada fragmento de bosque, usando el paquete Vegan 2.3-5 de R (Oksanen et al., 2016), mediante el estimador no paramétrico Chao 1. Este estimador emplea datos cuantitativos y produce estimaciones de gran precisión con baja sensibilidad al tamaño de la muestra en comparación con otros estimadores (Colwell y Coddington, 1994; Walther y Moore, 2005).
La diversidad de murciélagos en cada fragmento de bosque (diversidad verdadera), se estimó utilizando el paquete Vegan 2.3-5 de R (Oksanen et al., 2016). Se calculó el exponencial del índice de entropía de Shannon (eH’), transformación propuesta por Jost (2006, 2007), que permite determinar el número de especies efectivas, sin sobrevalorar a las especies raras o las comunes (Jost, 2006, 2007). Adicionalmente, se graficaron curvas de rango-abundancia relativa, para comparar la estructura de los ensamblajes y la jerarquía de murciélagos de los 15 fragmentos de bosque muestreados. Los análisis estadísticos se realizaron en el programa R 3.2.4 (R Core Team, 2016).
Análisis del patrón de distribución de especies
Para evaluar si los patrones de ocurrencia de los murciélagos crean una distribución anidada de especies entre los 15 fragmentos de bosque, se utilizó el programa Nestedness Temperature Calculator (NTC) (Atmar y Patterson, 1993). El NTC calcula el grado de anidamiento en base a la temperatura (T°) de la matriz, la cual varía entre 0° (anidamiento perfecto) y 100 °C (ausencia de anidamiento) (Patterson y Atmar, 2000). Para ello se generó una matriz de doble entrada con las especies en las columnas y los fragmentos de bosque en las filas, las presencias se codificaron con “1” y las ausencias con “0”. Por último, las columnas y las filas se ordenaron de forma decreciente de presencia, obteniendo una ordenación triangular de las presencias en la parte superior izquierda de la matriz. El programa genera una línea hipotética que divide el área ocupada (presencias) de la no ocupada (ausencias) y se define como el límite de extinción u ocurrencia (Atmar y Patterson, 1993).
Se analizó el ruido que pueden producir las especies sobre la temperatura general de la matriz. El ruido puede ser: (1) “aleatorio” generado por la estocasticidad ambiental, demográfica y genética, o (2) “coherente” generado por eventos biogeográficos específicos o por la ecología de las especies. El ruido aleatorio genera una interrupción de la suavidad de la línea límite de la matriz y el ruido coherente crea “picos” de idiosincrasias que corresponden a las especies o sitios que contribuyen mucho más al ruido de la matriz que el resto (Patterson y Atmar, 2000).
Para medir la significancia del anidamiento para la métrica T° y determinar la probabilidad de que el ensamblaje observado aparezca por azar, se generaron 1000 ensamblajes ficticios (aleatorizaciones) fijando el número de fragmentos (15) y especies de murciélagos (34) y luego se comparó con el valor observado. Estos valores fueron proporcionados por el modelo nulo generado por la simulación de Monte Carlo (Atmar y Patterson, 1993).
Se realizaron modelos lineales generalizados (MLG) en el programa R 3.2.4 (R Core Team, 2016), para determinar cuáles variables de la estructura de la vegetación (área basal, abundancia, DAP, altura), el área del fragmento (ha) y la altitud (Tabla 1), influyen sobre la ocurrencia de murciélagos dentro de los bosques (Sobs y Sesp). Las variables se transformaron a logaritmo natural (ln) para cumplir con el supuesto de normalidad, y mediante análisis de correlaciones de Pearson fueron probadas antes de iniciar la modelación, para identificar las variables que presentan colinealidad y separar el efecto de estas variables sobre el modelo final.
Con el paquete glmulti de R 1.0.7 (Calcagno, 2015), se generaron todas las posibles combinaciones de variables explicativas, organizando los modelos basados en el criterio de información de Akaike corregido para muestras pequeñas (AICc), el ΔAICc (diferencias entre cada modelo y el mejor modelo) y Wi (peso normalizado AICc) (Burnham y Anderson, 2002; Johnson y Omland, 2004). Se consideraron los modelos que presentaran la puntuación mínima de AIC; ΔAICc ≤ 2 siguiendo lo propuesto por Burnham y Anderson (2002) para la selección de modelos con mejor soporte, y el peso (Wi) más cercano a 1. Dentro del conjunto de modelos candidatos, estos tres criterios permiten escoger el modelo que se ajusta mejor a los datos observados (Burnham y Anderson, 2002; Johnson y Omland, 2004) y corresponde a las variables que tienen un efecto importante en la riqueza de especies de murciélagos en los diferentes fragmentos de bosque.
RESULTADOS
Se capturó un total de 1162 individuos de murciélagos pertenecientes a 32 especies, 19 géneros y tres familias (Apéndice 1), con un esfuerzo de muestreo de 1050 horas-red por fragmento y un total general de 15750 horas-red. Por medio de otras metodologías (captura manual, búsqueda de refugios diurnos), se registraron tres especies (Noctilio albiventris, Molossus molossus y M. pretiosus), que se suman al conteo general de la riqueza de murciélagos de la cuenca media del río Cauca (Apéndice 1).
El éxito de captura de murciélagos para todo el estudio, representado en el número de individuos capturados por una hora-red, fue de 0.074. El fragmento de bosque Alto del Rey obtuvo el mayor éxito de captura (0.16), seguido por Morabia (0.15) y el Parque regional Alto del Nudo (PRNAN) (0.14). El menor éxito de captura se presentó en los fragmentos de Playa Rica, El Palacio, Planalto y Ánimas y Tinieblas (Tabla 1).
Aunque la curva de acumulación de especies de murciélagos no llegó a su asíntota, el estimador Chao 1 indicó una riqueza esperada de 34 especies de murciélagos (Fig. 2). Por lo tanto, durante las 75 noches de muestreo se alcanzó una representatividad del 95%. No obstante, la riqueza esperada varió entre fragmentos de bosque. Para nueve fragmentos se obtuvo una representación entre el 80 y 100%, cinco entre 55 y 67% y para el Alto de Plumas el 37% (Tabla 1).
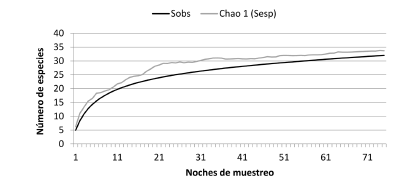
Fig. 2. Curva de acumulación de especies de murciélagos y curva del estimador no paramétrico de riqueza Chao 1, para el muestreo realizado en fragmentos de bosque de la cuenca media del río Cauca (Colombia). Sobs: riqueza observada, Sesp: riqueza esperada.
Diversidad de especies y estructura del ensamblaje
El cálculo del índice Exponencial de Shannon (eH’) indicó que Los López (10.8), Morabia (9.7) y Las Águilas (8.6) son los fragmentos de bosque con mayor diversidad de especies; en contraste se encuentran el Parque regional Alto del Nudo (PRNAN) (2.8) y Planalto (2.6), que albergaron la menor diversidad de murciélagos (Tabla 1, Fig. 3). Las curvas de rango-abundancia relativa mostraron diferencias en la estructura de los ensamblajes de murciélagos en los 15 fragmentos de bosque muestreados (Fig. 3). Las especies más abundantes fueron A. lituratus (4 fragmentos), Carollia perspicillara (4 fragmentos) y C. brevicauda (2 fragmentos). Sturnira sp., S. ludovici, Dermanura rava, C. castanea y Glossophaga soricina dominaron en La Sierra, Las Águilas, Morabia, Las Nubes y Planalto, respectivamente. En cada uno de los fragmentos de bosques, las especies más abundantes representaron entre el 20% y el 30% de todos los murciélagos capturados, mientras que A. lituratus, C. perspicillata y G. soricina abarcaron entre el 34% y el 75% de las capturas por fragmento (Fig. 3, Apéndice 1).

Fig. 3. Curvas de rango-abundancia relativa de los ensamblajes de murciélagos de la cuenca media del río Cauca y los valores de diversidad (eH’) para todos los fragmentos de bosque. Anoura caudifer: A.cau, Artibeus lituratus: A.lit, Carollia brevicauda: C.bre, C. castanea: C.cas, C. perspicillata: C.per, Chiroderma salvini: C.sal, Dermanura bogotensis: D.bog, D. rava: D.rav, Desmodus rotundus: D.rot, Eptesicus fuscus: E.fus, Enchisthenes hartii: E.har, Eptesicus sp.: Ep.sp, Glossophaga soricina: G.sor, Lasiurus blossevillii: L.blo, Lonchophylla concava: L.con, Myotis albescens: M.alb, M. keaysi: M.kea, M. nigricans: M.nig, M. oxyotus: M.oxy, M. riparius: M.rip; Mesophylla macconnelli: M.mac, Platyrrhinus albericoi: P.alb, P. brachycephalus: P.bra, P. dorsalis: P.dor. P. angustirostris: P.ang, Phyllostomus hastatus: P.has, Sturnira sp.: S.sp, S. erythromos: S.ery, S. ludovici: S.lud. Thyroptera tricolor: T.tri, Uroderma convexum: U.con y Vampyressa thyone: V.thy. AR: abundancia relativa.
Se registraron 13 especies raras (< 10 individuos) (Apéndice 1). La mayor parte de las especies corresponde a las familias Phyllostomidae y Vespetilionidae, con seis especies cada una. Se obtuvo el primer registro de Lonchophylla concava en la cuenca media del río Cauca (Ortegón-Martínez y Pérez-Torres, 2004; Numa et al., 2005; Castaño, 2011; Aguilar-Garavito et al., 2015). El fragmento Las Águilas obtuvo el mayor número de especies raras (4), seguido por Morabia (3) (Apéndice 1).
Anidamiento de los ensamblajes de especies
El ensamblaje de murciélagos en fragmentos de bosque de la cuenca media del río Cauca presentó un patrón de distribución significativamente anidado (P < 0.0001, T° = 33.83°), con respecto a lo esperado por azar (T°: 57.28° ± 5.54°) (Fig. 4). Cinco de las 32 especies de murciélagos (C. perspicillata, G. soricina, C.castanea, Myotis nigricans y S. lilium) mostraron presencias o ausencias inesperadas aumentando la temperatura de la matriz y aportando inestabilidad al modelo (Fig. 4). Al ser excluidas estas especies del análisis, el patrón de distribución anidado aumentó (P < 0.0001, T° = 21.06°).
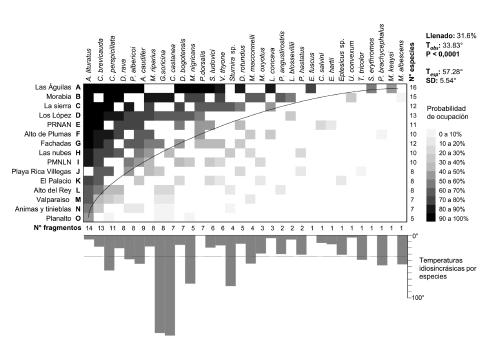
Fig. 4. Resultados del análisis de anidamiento para el ensamblaje de murciélagos capturados en 15 fragmentos de bosque de la cuenca media del río Cauca. Probabilidad de ocupación y especies de murciélagos con temperaturas idiosincrásicas. Línea límite de la matriz: divide el área ocupada (presencias) de la no ocupada (ausencias). Tobs: temperatura observada, Tesp: temperatura esperada por el azar, así como las probabilidades derivadas de las aleatorizaciones de Monte Carlo y su desviación estándar (SD).
Seis especies de murciélagos fueron consideradas las más ubicuas, las cuales presentaron una mayor probabilidad de ocupación (90- 100%) y se ubican en el margen superior izquierdo de la matriz (Fig. 4). Del mismo modo, las especies con menor probabilidad (0-30%) se encuentran en la parte inferior de la línea divisoria (e.g. Chiroderma salvini, Enchisthenes hartii, Eptesicus sp., Uroderma convexum, Thyroptera tricolor y Myotis albescens), y las ausencias o presencias inesperadas comienzan a aparecer, extendiéndose a través de la matriz (Fig. 4).
Las correlaciones de Pearson entre riqueza de especies observada (Sobs) con las variables explicativas sugirieron que el promedio del área basal (ABP) (r = 0.45, P < 0.05) y el promedio del diámetro a la altura del pecho (DAP) (r = 0.50, P < 0.05) podrían ser determinantes de la ocurrencia de especies en los fragmentos de bosque. Por el contrario, la riqueza de especies esperada (Sesp), estuvo relacionada con la altura promedio de los árboles (AAP) (r = 0.53, P < 0.01) y el DAP promedio (r = 0.46, P < 0.05) (Tabla 2).
Tabla 2 Matriz de correlación de Pearson entre la riqueza de especies (Sobs, Sesp) y las variables de los fragmentos de bosque de la cuenca media del Río Cauca. (Sobs: riqueza observada, Sesp: riqueza esperada, AFB: área fragmento de bosques, ABP: área basal promedio, AbdP: abundancia promedio, AAP: altura de los árboles promedio, DAP: promedio del diámetro a la altura del pecho, ALT: Altitud bosque. Los valores de probabilidad resaltados indican resultados significativos. * P<0.05, ** P<0.01, ***P<0.001).

Entre las variables de la estructura de la vegetación estudiadas, se encontró que el DAP promedio estuvo relacionado con el área basal promedio (r = 0.73 < 0.0001). La altura promedio estuvo relacionada negativamente con la abundancia promedio (r = -0.66 p<0.01), lo que indica que los bosques con mayor número de individuos presentaron la altura promedio más baja. La altura promedio estuvo relacionada positivamente con el DAP promedio (0.52 p < 0.01) (Tabla 2).
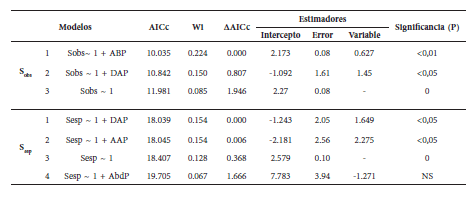
Se generaron 64 modelos, de los cuales se consideraron solo los que presentaran un ΔAICc ≤ 2 (Tabla 3). El modelo que explicó mejor la ocurrencia de especies observadas (Sobs) dentro de los fragmentos de bosques incluyó el área basal promedio. Para la riqueza de especies esperadas (Sesp), el modelo incluyó el DAP promedio (Tabla 3). Considerando los Wi, la oportunidad de que estos modelos sean los mejores entre los modelos candidatos fue de 22.4% para la riqueza de especies observada y 15.4% para la esperada. En ninguno de los casos, el mejor modelo tuvo un alto nivel de soporte (es decir, Wi ≥ 0.9) (Tabla 3), y las variables área y elevación de los fragmentos de bosque resultaron poco explicativas en los modelos y en el análisis de correlación (Tablas 2 y 3).
Tabla 3 Modelos con ΔAICc < 2 propuestos para explicar la ocurrencia de especies de murciélagos en fragmentos de bosque de la cuenca media del Río Cauca. Sobs: riqueza observada, Resp: riqueza esperada, ~ 1: notación matricial (=intercepto + variable), ABP: área basal promedio, DAP: promedio del diámetro a la altura del pecho, AbdP: abundancia promedio, AAP: altura de los árboles promedio, AICc: criterios de información de Akaike corregido para muestras pequeñas, Wi: peso normalizado, ΔAICc: diferencias entre cada modelo y el mejor modelo, NS: no significativo.
DISCUSIÓN
Los ensamblajes de murciélagos en fragmentos de bosque de la cuenca media del río Cauca presentaron un patrón de distribución significativamente anidado. Las especies en cada fragmento son una submuestra de los bosques de mayor riqueza (Patterson y Atmar, 2000). El patrón anidado se ha presentado en otros ensamblajes de murciélagos que habitan islas o hábitats fragmentados (Meyer y Kalko, 2008; Frick et al., 2009; Loayza y Loiselle, 2009; Presley y Willig, 2010) y en otros taxones como aves, mamíferos terrestres, anfibios y reptiles (Fischer y Lindenmayer, 2005; Watling et al., 2009; Wang et al., 2010).
La principal variable relacionada con la ocurrencia de especies y el patrón de anidamiento fue el área de los fragmentos de bosques o islas, producto de las secuencias ordenadas de extinción y de inmigración de las especies (Patterson y Atmar, 2000; Fernández-Juricic, 2002b; Lindenmayer et al., 2002; Frick et al., 2008), así como el aislamiento, donde las especies con mayor capacidad de movilidad son capaces de colonizar más sitios, que las menos vágiles (Meyer y Kalko, 2008; Watling et al., 2009). No obstante, en este estudio no se encontró relacionada la riqueza de especies de murciélagos con el tamaño de los bosques; el resultado puede estar influenciado por la estructura de la vegetación de los fragmentos más grandes, como es el caso del Parque Municipal La Nona (PMNLN) y el Parque regional Alto del Nudo (PRNAN), los cuales presentan un alto número de individuos de árboles con tallos delgados, lo que corresponde a estados iniciales en la sucesión del bosque secundario (Denslow, 1995). Por el contrario, los resultados sugieren que el patrón de ocurrencia de los ensamblajes de murciélagos en fragmentos de bosque de la cuenca media del río Cauca puede estar relacionado directamente con el promedio del área basal y el promedio del diámetro a la altura del pecho de la vegetación. Es conocido que las características estructurales de los bosques influyen en la ocurrencia y distribución de especies de murciélagos en paisajes fragmentados (Estrada y Coates-Estrada, 2002; Yates y Muzika, 2006; Zipkin et al., 2010). Zipkin et al., (2010) y Yates y Muzica (2006) encontraron una relación inversa del área basal con la ocurrencia de aves y murciélagos del género Pipistrellus, pero para este último caso, cuando el modelo incluía también la densidad del sotobosque, se relacionaba directamente. Jung et al. (2013) encontraron que la presencia de especies del género Myotis estaba relacionada positivamente con el área basal y la altura de los árboles, características importantes para la disponibilidad de sitios potenciales de percha de esos murciélagos.
El área basal y el promedio del diámetro a la altura del pecho son indicadores para medir el grado de recuperación de los bosques, debido a que estos aumentan conforme hay un incremento en la sucesión de los mismos y tienden a tener una estructura similar a los bosques primarios (Finegan, 1997; Denslow, 2000; Guariguata y Ostertag, 2002; Morales- Salazar et al., 2012). En este sentido, la riqueza de especies de murciélagos parece aumentar con el grado de recuperación de los fragmentos de bosque y puede ser un factor relevante para predecir el patrón de distribución de los mismos y estar fuertemente asociados con las características del hábitat localmente (Zipkin et al., 2010).
La presencia o ausencia inesperada de cinco especies de murciélagos aumentaron la temperatura de la matriz, disminuyendo el anidamiento en los ensamblajes de murciégalos en fragmentos de bosque de la cuenca media del río Cauca. Esto puede estar influenciado por sesgos en el muestreo de insectívoros aéreos (e.g., M. molossus), o diferencias de composición de especies asociadas a la distribución altitudinal que favorecen o limitan la presencia de algunas especies (Patterson y Atmar, 2000), como es el caso de C. castanea que habita principalmente por debajo de los 1600 m de elevación (Castaño, 2011). Otras causas pueden ser insuficiencias del muestreo (Cutler, 1991; Wright et al., 1998), que no permitieron percibir la presencia de especies comunes (e.g., G. soricina, S. lilium) en los bosques con mayor riqueza de especies, o baja representatividad de las especies esperadas para los fragmentos de bosque, entre los que se encuentran Las Águilas (55%), Alto de Plumas (37%) y Playa Rica Villegas (57%).
Se ha planteado que en patrones perfectamente anidados, el bosque más grande debe ser seleccionado para conservar la mayor riqueza de especies, incluyendo las especies raras o sensibles a la fragmentación (Patterson y Atmar, 2000). Sin embargo, los resultados mostraron que solo el 47% de la riqueza y el 9% de las especies raras se encuentran incluidas en los fragmentos más grandes. En consecuencia, las recomendaciones de conservación basadas en el tamaño de los bosques pueden ser insuficientes, por lo que incluir criterios adicionales permitirá generar la mejor estrategia de conservación (Fischer y Lindenmayer, 2005).
La conversión de bosques a tierras agrícolas y pastos en la región andina de Colombia, se está produciendo a un ritmo cada vez más acelerado (Rodríguez et al., 2006; Rudas et al., 2007). Por lo tanto, la información presentada sobre los patrones de distribución, la estructura de los ensamblajes y las probabilidades de ocurrencia de las especies de murciélagos en la cuenca media del río Cauca puede ser tomada en cuenta para implementar un programa de áreas locales protegidas, seleccionando fragmentos de bosque que se adapten a diferentes objetos y objetivos de conservación (Lomolino, 1994).
AGRADECIMIENTOS
El presente estudio forma parte del proyecto “Efecto de la fragmentación de los bosques de la zona cafetera sobre la diversidad de flora y fauna silvestre”, financiado por el Ministerio de Ambiente Vivienda y Desarrollo de Colombia, y desarrollado por el Programa de Biología de la Conservación de Cenicafé-FEDERECAFE. Agradecemos a los propietarios de los bosques por permitirnos realizar el estudio en sus predios. A Carlos Ortiz por sus aportes en los análisis estadísticos; y a Camilo Medina, Mauricio Pinilla, Víctor Amaya, Gabriel Garro, Isabel López, Alejandro López, Fabiola Arroyave, Marinella Alzate, Henry Alzate, Martha Medina y Adrián Vanegas por su entusiasmo y compañía durante las noches de muestreo.
LITERATURA CITADA
1. AGUILAR-GARAVITO M, LM RENJIFO y J PÉREZ-TORRES. 2015. Seed dispersal by bats across four successional stages of a subandean landscape. Biota Colombiana 15:87-101. [ Links ]
2. ALMEIDA-NETO M, PR GUIMARAES y TM LEWINSOHN. 2007. On nestedness analyses: Rethinking matrix temperature and anti-nestedness. Oikos 116:716-722. [ Links ]
3. ATMAR W y BD PATTERSON. 1993a. The measure of order and disorder in the distribution of species in fragmental habitat. Oecologia 96:373-382. [ Links ]
4. BLOCH CP, CL HIGGINS y MR WILLIG. 2007. Effects of large-scale disturbance on metacommunity structure of terrestrial gastropods: Temporal trends in nestedness. Oikos 116:395-406. [ Links ]
5. BURNHAM KP y DR ANDERSON. 2002. Model selection and multimodel inference: A practical information-theoretic approach (Second Edition). Springer, New York. [ Links ]
6. CALCAGNO V. 2015. Package glmulti 1.0.7, Title Model selection and multimodel inference made easy. Community Ecology Package. https://cran.rproject.org/web/packages/glmulti/index.html. [ Links ]
7. CASTAÑO JH. 2011. Mamíferos de Caldas: un análisis de vacíos de información 1. Boletín CIentífico centro de Museos 16:101-119. [ Links ]
8. CENICAFÉ. 2011. Anuario Meteorológico Cafetero 2010. Chinchiná, Colombia. [ Links ]
9. CHAZDON RL, CA PERES, D DENT, D SHEIL, AE LUGO, D LAMB, et al. 2009. The potential for species conservation in tropical secondary forests. Conservation Biology 23:1406-1417. [ Links ]
10. COLLINS SL, SR CARPENTER, SM SWINTON, DE ORENSTEIN, DL CHILDERS, TL GRAGSON, et al. 2010. An integrated conceptual framework for long-term social–ecological research. Frontiers in Ecology and the Environment 9:351-357.
11. COLWELL RK y JA CODDINGTON. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactions: Biological Sciences 345:101-118. [ Links ]
12. CUTLER A. 1991. Nested faunas and extinction in fragmented habitats. Conservation Biology 5:496-504. [ Links ]
13. DENSLOW J. 1995. Disturbance and diversity in tropical rain forests: The density effect. Ecological Applications 5:962-968. [ Links ]
14. DENSLOW JS. 2000. Patterns of structure and diversity across a tropical moist forest chronosequence. Pp. 237-241, en: Vegetation science in retrospect and perspective (PS White, L Mucina, J Leps y E Van der Maarel, eds.). Opulus Press, Uppsala. [ Links ]
15. DIAMOND JM. 1975. Assembly of species communities. Ecology and Evolution of Communities 342:444. [ Links ]
16. DÍAZ M, D FLORES y RM BARQUEZ. 1998. Instrucciones para preparación y conservación de mamíferos. Publicaciones Especiales PIDBA 1:1-44. [ Links ]
17. DINERSTEIN E, D OLSON, D GRAHAM, A WEBSTER, S PRIMM, M BOOKBINDER y G LEDEC. 1995. Una evaluación del estado de conservación de las eco regiones terrestres de América Latina y el Caribe. WWF/ Banco Mundial, Washington, D.C. [ Links ]
18. ESLAVAR J, VA LÓPEZ y G OLAYA. 1986. Contribución al conocimiento del régimen térmico y pluviométrico de Colombia. Colombia Geográfica 12:53-118. IGAC. [ Links ]
19. ESTRADA A y R COATES-ESTRADA. 2002. Dung beetles in continous forest, forest fragments and in an agricultural mosiac habitat island at Los Tuxtlas, Mexico. Biodiversity and Conservation 11:1903-1918. [ Links ]
20. FAO. 2011. Medir la degradacion del bosque. Unasylva 62:72. [ Links ]
21. FERNÁNDEZ-JURICIC E. 2002a. Can human disturbance promote nestedness? A case study with breeding birds in urban habitat fragments. Oecologia 131:269-278. [ Links ]
22. FERNÁNDEZ-JURICIC E. 2002b. Nested patterns of species distribution and winter flock occurrence of insectivorous birds in a fragmented landscape. Ecoscience 9:450-485. Taylor y Francis. [ Links ]
23. FINEGAN B. 1997. Bases ecológicas para el manejo de bosques secundarios de las zonas húmedas del trópico americano, recuperación de la biodiversidad y producción sostenible de madera. Pucallpa. [ Links ] [ Links ]
24. FISCHER J y DB LINDENMAYER. 2005. Perfectly nested or significantly nested - An important difference for conservation management. Oikos 109:485-494. [ Links ]
25. FRICK WF, JP HAYES y PA HEADY III. 2008. Island biogeography of bats in Baja California, Mexico: Patterns of bat species richness in a near-shore archipelago. Journal of Biogeography 35:353-364. [ Links ]
26. FRICK WF, JP HAYES y PA HEADY III. 2009. Nestedness of desert bat assemblages: Species composition patterns in insular and terrestrial landscapes. Oecologia 158:687-697. [ Links ]
27. GARDNER AL. 2007. Mammals of South America, Volume 1: Marsupials, xenarthrans, shrews, and bats. University of Chicago Press, Chicago and London. [ Links ]
28. GASTON KJ y TM BLACKBURN. 2000. Range size, en: Pattern and Process in Macroecology. Blackwell Publishing, United Kingdom. [ Links ]
29. GUARIGUATA RM y R OSTERTAG. 2002. Sucesión secundaria. Pp. 591-624, en: Biología y conservación de bosques neotropicales (RM Guariguata y GH Kattan, eds.). Libro Universitario Regional, San José, Costa Rica. [ Links ]
30. GUÉGAN JF y B HUGUENY. 1994. A nested parasite species subset pattern in tropical fish: Host as major determinant of parasite infracommunity structure. Oecologia 100:184-189. [ Links ]
31. HOLDRIDGE LR. 1964. Life zone ecology. Tropical Science Center, San José, Costa Rica. [ Links ]
32. HU G, KJ FEELEY, J WU, G XU y M YU. 2011. Determinants of plant species richness and patterns of nestedness in fragmented landscapes: Evidence from land-bridge islands. Landscape Ecology 26:1405-1417. [ Links ]
33. JOHNSON JB y KS OMLAND. 2004. Model selection in ecology and evolution. Trends in Ecology and Evolution 19:101-108. [ Links ]
34. JOST L. 2006. Entropy and diversity. Oikos 113:363-375. [ Links ]
35. JOST L. 2007. Partitioning diversity into independent alpha and beta components. Ecology 88:2427-2439. [ Links ]
36. JUNG TS, ID THOMPSON, RD TITMAN y AP APPLEJOHN. 2013. Habitat by forest bats in relation to selection mixed-wood stand types and structure in Central Ontario. The Journal of Wildlife Management 63:1306-1319. [ Links ]
37. LARSEN PA, MR MARCHÁN-RIVADENEIRA y RJ BAKER. 2010. Taxonomic status of Andersen’s fruit-eating bat (Artibeus jamaicensis aequatorialis) and revised classification of Artibeus (Chiroptera: Phyllostomidae). Zootaxa 2648:45-60.
38. LINDENMAYER DB, RB CUNNINGHAM, CF DONNELLY, H NIX y BD LINDENMAYER. 2002. Effects of forest fragmentation on bird assemblages in a novel landscape context. Ecological Monographs 72:1-18. [ Links ]
39. LOAYZA AP y B a LOISELLE. 2009. Composition and Distribution of a bat assemblage during the dry season in a naturally fragmented landscape in Bolivia. Journal of Mammalogy 90:732-742. [ Links ]
40. LOMOLINO MV. 1994. An evaluation of alternative strategies for building networks of nature reserves. Biological Conservation 69:243-249. [ Links ]
41. LÓPEZ-GONZÁLEZ C, SJ PRESLEY, A LOZANO, RD STEVENS y CL HIGGINS. 2012. Metacommunity analysis of Mexican bats: Environmentally mediated structure in an area of high geographic and environmental complexity. Journal of Biogeography 39:177-192. [ Links ]
42. MANTILLA-MELUK H y RJ BAKER. 2010. New species of Anoura (Chiroptera: Phyllostomidae) from Colombia, with Systematic remarks and notes on the distribution of the A. geoffroyi Complex. Occasional Papers Museum of Texas Tech University 292:1-19. [ Links ]
43. MANTILLA-MELUK H. 2014. Defining species and species boundaries in Uroderma (Chiroptera: Phyllostomidae) with a description of a new species. Occasional Papers Museum of Texas Tech University 325:1-25. [ Links ]
44. MELO FPL, V ARROYO-RODRÍGUEZ, L FAHRIG, M MARTÍNEZ-RAMOS y M TABARELLI. 2013. On the hope for biodiversity-friendly tropical landscapes. Trends in Ecology and Evolution 28:462-8. [ Links ]
45. MEYER CFJ y EK V KALKO. 2008. Bat assemblages on Neotropical land-bridge islands: Nested subsets and null model analyses of species co-occurrence patterns. Diversity and Distributions 14:644-654. [ Links ]
46. MORALES-SALAZAR M, B VÍLCHEZ-ALVARADO, RI CHAZDON, M ORTEGA-GUTIÉRREZ, E ORTIZ-MALAVASSI y M GUEVARA-BONILLA. 2012. Diversidad y estructura horizontal en los bosques tropicales del Corredor Biológico de Osa, Costa Rica. Revista Forestal Mesoamericana Kurú 9:19-28. [ Links ]
47. MORENO CE y G HALFFTER. 2000. Assessing the completeness of bat biodiversity inventories using species accumulation curves. Journal of Applied Ecology 37:149-158. [ Links ]
48. NUMA C, JR VERDÚ y P SÁNCHEZ-PALOMINO. 2005. Phyllostomid bat diversity in a variegated coffee landscape. Biological Conservation 122:151-158. [ Links ]
49. OKSANEN AJ, FG BLANCHET, R KINDT, PR MINCHIN, RBO HARA, GL SIMPSON, et al. 2016. Package vegan 2.3-5. Community Ecology Package. https://cran.r-project.org. https://github.com/vegandevs/vegan:285. [ Links ]
50. ORREGO O, JH CASTAÑO y AM LÓPEZ. 2004. Efecto de la fragmentación de los bosques en la zona cafetera sobre la diversidad genética de poblaciones de flora y fauna silvestre. Informe técnico. Chinchiná, Colombia. [ Links ]
51. ORTEGÓN-MARTÍNEZ D y J PÉREZ-TORRES. 2004. Estructura y composicion del ensamblaje de murcielagos (Chiroptera) presente en un cafetal con sombrío (Santander, Colombia). Actualidades Biológicas 29:221-234. [ Links ]
52. PATTERSON BD y W ATMAR. 1986. Nested subsets and the structure of insular mammalian faunas and archipelagos. Biological Journal of Linnean Society 28:65-82. [ Links ]
53. PATTERSON BD y W ATMAR. 2000. Analyzing species composition in fragments. Bonner Zoologische Monographien 46:9-24. [ Links ]
54. PRESLEY SJ y MR WILLIG. 2010. Bat metacommunity structure on Caribbean islands and the role of endemics. Global Ecology and Biogeography 19:185- 199. [ Links ]
55. R CORE TEAM. 2016. A language and environment for statistical computing. R Foundation for Statistical Computing, Viena, Austria. [ Links ]
56. RODRÍGUEZ N, D ARMENTERAS, M MORALES y M ROMERO. 2006. Ecosistemas de los Andes colombianos. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá, D.C., Colombia. [ Links ]
57. RUDAS G, D MARCELO, D ARMENTERAS, N RODRÍGUEZ, M MORALES, L. DELGADO, et al. 2007. Biodiversidad y actividad humana: relaciones en ecosistemas de bosque subandino en Colombia. Instituto de Investigación de Recursos Biológicos Alexander von Humboldt, Bogotá D.C., Colombia. [ Links ]
58. SIMBERLOFF D y J-L MARTIN. 1991. Nestedness of insular avifauna: Simple summary statistics masking complex species patterns. Ornis Fennica 68:178-192. [ Links ]
59. SOLARI S, SR HOOFER, PA LARSEN, AD BROWN, RJ BULL, JA GUERRERO, et al. 2009. Operational criteria for genetically defined species: Analysis of the diversification of the small fruit-eating bats, Dermanura (Phyllostomidae: Stenodermatinae). Acta Chiropterologica 11:279-288. [ Links ]
60. SOLARI S, Y MUÑOZ-SABA, J V RODRÍGUEZ-MAHECHA, TR DEFLER, HE RAMÍREZ-CHAVES y F TRUJILLO. 2013. Riqueza, endemismo y conservación de los mamíferos de Colombia. Mastozoología Neotropical 20:301-365. [ Links ]
61. ULRICH W, M ALMEIDA-NETO y NJ GOTELLI. 2009. A consumer’s guide to nestedness analysis. Oikos 118:3-17.
62. VARZINCZAK LH y FC PASSOS. 2015. Null model analysis on bat species co-occurrence and nestedness patterns in a region of the Atlantic Rainforest, Brazil. [ Links ]
63. VELAZCO PM y AL GARDNER. 2009. A new species of Platyrrhinus (Chiroptera: Phyllostomidae) from western Colombia and Ecuador, with emended diagnoses of P. aquilus, P. dorsalis, and P. umbratus. Proceedings of the Biological Society of Washington 122:249-281. [ Links ]
64. VELAZCO PM y BD PATTERSON. 2014. Two new species of yellow-shouldered bats, genus Sturnira Gray, 1842 (Chiroptera, Phyllostomidae) from Costa Rica, Panama and western Ecuador. ZooKeys:43-66. [ Links ]
65. WALTHER BA y JL MOORE. 2005. The concepts of bias, precision and accuracy, and their use in testing the performance of species richness estimators, with a literature review of estimator performance. Ecography 28:815-829. [ Links ]
66. WANG Y, Y BAO, M YU, G XU y P DING. 2010. Nestedness for different reasons: The distributions of birds, lizards and small mammals on islands of an inundated lake. Diversity and Distributions 16:862-873. [ Links ]
67. WATLING JI, K GEROW y MA DONNELLY. 2009. Nested species subsets of amphibians and reptiles on neotropical forest islands. Animal Conservation 12:467-476. [ Links ]
68. WRIGHT DH, BD PATTERSON, GM MIKKELSON, A CUTLER y W ATMAR. 1998. A comparative analysis of nested subset patterns of species composition. Oecologia 113:1-20. [ Links ]
69. YATES MD y RM MUZIKA. 2006. Effect of forest structure and fragmentation on site occupancy of bat species in Missouri ozark forests. Journal of Wildlife Management 70:1238-1248. [ Links ]
70. ZIPKIN EF, J ANDREW ROYLE, DK DAWSON y S BATES. 2010. Multi-species occurrence models to evaluate the effects of conservation and management actions. Biological Conservation 143:479-484. [ Links ]
Ensamblaje de murciélagos registrados en la cuenca media del río Cauca. Total: número individuos capturados por especie, A.R.: abundancia relativa. *Capturados por técnicas diferentes a los muestreos con redes de niebla. 1Nuevo registro para la cuenca media del río Cauca. Nomenclatura según Gardner (2007) con modificaciones de Solari et al. (2009, 2013), Velazco y Gardner (2009), Larsen et al. (2010), Mantilla-Meluk y Baker (2010), Mantilla-Meluk (2014), y Velazco y Patterson (2014).

















