Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Mastozoología neotropical
versión impresa ISSN 0327-9383versión On-line ISSN 1666-0536
Mastozool. neotrop. vol.23 no.2 Mendoza dic. 2016
ARTÍCULO
Las especies del género Myotis (Chiroptera: Vespertilionidae) en el Bajo Delta del Paraná y la Pampa Ondulada, Argentina
M. Ayelen Lutz1, M. Mónica Díaz2, Mariano L. Merino3 y Roberto F. Jensen4
1 CONICET (Consejo Nacional de Investigaciones Científicas y Técnicas). Laboratorio BioGeA, Universidad Nacional de Avellaneda, Mario Bravo 1460, 1870 Avellaneda, Buenos Aires, Argentina. [Correspondencia: M. AyelenLutz <ayelenlutz@gmail.com>].
2 CONICET. PCMA (Programa de Conservación de los Murciélagos de Argentina). PIBDA (Programa de Investigaciones de Biodiversidad Argentina), Facultad de Ciencias Naturales e Instituto Miguel Lillo, Universidad Nacional de Tucumán, Fundación Miguel Lillo, Miguel Lillo 205, 4000 San Miguel de Tucumán, Tucumán, Argentina.
3 CIC (Comisión de Investigaciones Científicas de la provincia de Buenos Aires). Centro de Bioinvestigaciones, CIT NOBA (CONICET - Universidad Nacional del Noroeste de la Provincia de Buenos Aires), Ruta Provincial 32 Km 3.5, 2700 Pergamino, Buenos Aires, Argentina.
4 Instituto de Limnología “Dr. Raúl A. Ringuelet” (CONICET - Universidad Nacional de La Plata), Boulevard 120 y 62, 1900 La Plata, Buenos Aires, Argentina.
Recibido 25 enero 2016.
Aceptado 1 julio 2016.
Editor asociado: L Guichón
RESUMEN.
El género Myotis se distribuye en todo el mundo, excepto en los polos, e incluye más de 100 especies, de las cuales 12 se presentan en Argentina. El conocimiento sobre los murciélagos de este género es escaso en amplias áreas de Argentina, como por ejemplo en la Pampa Ondulada y el Bajo Delta del Paraná. En este trabajo se estudian las especies de Myotis colectadas en tres localidades del área mencionada: dos en el departamento Islas del Ibicuy (provincia de Entre Ríos), y una en el Parque Costero Sur (provincia de Buenos Aires). Se presentan datos morfométricos y características de los ejemplares colectados, aportando información sobre la variabilidad intraespecífica de cada especie colectada en el área. En total se colectaron 51 ejemplares pertenecientes a 5 especies: M. albescens, M. dinellii, M. levis, M. ruber y M. riparius. Esta última especie es registrada por primera vez para las provincias de Entre Ríos y Buenos Aires.
ABSTRACT.
Species of the genus Myotis (Chiroptera: Vespertilionidae) from the Lower Delta of the Parana River and the Rolling Pampa, Argentina.
The genus Myotis is distributed worldwide, except at the poles. It includes more than 100 species, 12 of which are present in Argentina. Knowledge about the bats of this genus is sparse in large areas of Argentina, including the Rolling Pampa and Lower Delta of the Parana River. Here, we present a study about the species of Myotis collected in three locations: two at Islas del Ibicuy department (Entre Ríos province), and one at Parque Costero del Sur (Buenos Aires province). Morphometric data and characteristics of the collected specimens are described, providing information on intraspecific variability of each species collected in the area. We collected 51 specimens belonging to 5 species of this genus: M. albescens, M. dinellii, M. levis, M. ruber and M. riparius. The latter is recorded for first time in the provinces of Entre Ríos and Buenos Aires.
Palabras claves: Buenos Aires; Entre Ríos; M. riparius; Murciélagos.
Key words: Bats; Buenos Aires; Entre Ríos; M. riparius.
INTRODUCCIÓN
El género Myotis Kaup, 1829 se distribuye en todo el mundo excepto en los polos (Wilson, 2007). Son murciélagos insectívoros, de tamaño pequeño y vuelo maniobrable, con lo cual pueden moverse en el interior de densos sotobosques (Bianconi y Pedro, 2007; Wilson, 2007). Las especies de este género se diferencian claramente de otros géneros de la familia Vespertilionidae por la retención de los tres premolares en cada hilera de dientes y por la diferencia de tamaño entre los dos primeros premolares y el último, por lo que a simple vista parece haber un espacio entre el canino y el tercer premolar (Barquez et al., 1999; Wilson, 2007). Es el género más diverso de murciélagos, incluyendo más de 100 especies, de las cuales 20 habitan América del Sur (Wilson, 2007; Moratelli y Wilson, 2011, 2014; Moratelli et al., 2011, 2013; Díaz et al., 2016). Barquez et al. (1999) mencionan la presencia de nueve especies de este género en Argentina, considerando dos subespecies para M. levis, M. l. levis y M. l. dinellii. Posteriormente, Barquez (2006) eleva ambas subespecies a la categoría de especie en base a diferencias morfológicas externas (coloración del pelaje) y al hecho de que se encontraban en simpatría, lo cual ha sido validado por Miranda et al. (2013) mediante estudios morfométricos. Por lo tanto, considerando a M. levis y M. dinellii, son 12 las especies del género que habitan en el país (Díaz et al., 2016).
En Argentina, la información existente sobre los murciélagos es asimétrica, dado que se conocen relativamente bien los ensambles del noroeste del país, pero es incompleto el conocimiento que se tiene sobre estos mamíferos en otras áreas (Barquez et al., 1999; Barquez y Díaz, 2009). Entre estas últimas se encuentra el área que abarca la Pampa Ondulada y el Bajo Delta del Paraná, que incluye el límite ecotonal subtropical pampásico, lo que le otorga importancia biogeográfica y ecológica, y que además está sujeta a una fuerte alteración antrópica (Ringuelet, 1978; Bó, 2006; Viglizzo et al., 2006).
En este trabajo se analizan las especies de Myotis colectadas en tres localidades del área mencionada: dos en el departamento Islas del Ibicuy (provincia de Entre Ríos), y una en el Parque Costero Sur (provincia de Buenos Aires). En total se colectaron cinco especies del género Myotis, registrándose por primera vez M. riparius en las provincias de Entre Ríos y Buenos Aires.
MATERIALES Y MÉTODOS
Área de estudio
El Delta Inferior del río Paraná o Bajo Delta es un conjunto de islas que ocupa, geográficamente, los extremos sudeste de la provincia de Entre Ríos y noreste de la provincia de Buenos Aires (Fig. 1), y abarca una superficie aproximada de 2000 km2 (Bó, 2006; Matteucci, 2012a). El clima es templado subhúmedo, con temperaturas medias anuales que rondan los 17 °C y precipitaciones de alrededor de 1000 mm anuales. La acción moderadora de las grandes masas de agua circundantes genera amplitudes térmicas diarias y temperaturas máximas relativamente bajas y pocos días con heladas (Bó y Quintana, 1999). En esta región se seleccionaron dos tipos de ambientes para los muestreos, el monte blanco y una plantación de salicáceas (Salix spp. y Populus spp.). El monte blanco o selva en galería es uno de los paisajes nativos del Bajo Delta, compuesto por especies arbóreas como Inga uraguensis, Eugenia uruguayensis, Blepharocalyx salicifolius, Ocotea acutifolia, Pouteria salicifolia, Salix humboldtiana, Erythrina crista-galli, Syagrus romanzoffiana, entre otros (Bó y Quintana, 1999; Kalesnik y Sirolli, 2011). Actualmente solo han quedado relictos de monte blanco debido a la importante extensión de la producción forestal de salicáceas en esta región. Las plantaciones forestales muestreadas pertenecían a la quinta “Arco Iris” (33º47’ S; 58º32’ O), y los relictos de monte blanco a la quinta “La Chilena” (33º46’ S; 58º32’ O) (Fig. 1). Ambas quintas se ubican en el departamento Islas del Ibicuy, ubicado en el extremo sudeste de la provincia de Entre Ríos.
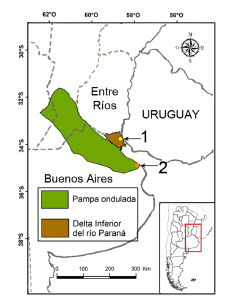
Fig.1. Área de estudio. 1: Quintas “Arco Iris” y “La Chilena”, departamento Islas del Ibicuy, provincia de Entre Ríos, Argentina; 2: Reserva “El Destino” (Parque Costero del Sur), partido de Magdalena, provincia de Buenos Aires, Argentina.
La Pampa Ondulada es una planicie con suaves lomadas que ocupa el sur de Santa Fe, el sudeste de Córdoba y el noreste de Buenos Aires (Fig. 1), abarcando 76 720 km2 (Viglizzo et al., 2006; Matteucci, 2012b). El clima es templado, con temperaturas medias que varían entre 10 y 12 °C en invierno, y entre 23 y 25 °C en verano; las precipitaciones se distribuyen a lo largo de todo el año, sumando alrededor de 1000 mm (Silva, 2003). También se caracteriza por una humedad relativa ambiental superior al 70% y una baja frecuencia de heladas (Matteucci, 2012b). El paisaje nativo correspondía a un extenso pastizal dominado por especies de gramíneas de los géneros Stipa, Poa, Piptochaetiumy aristida (Viglizzo et al., 2006), existiendo originalmente montes asociados a las márgenes de ríos y arroyos, llamados bosques ribereños, y sobre las barrancas y albardones de conchillas se disponían los talares, montes dominados por talas (Celtis ehrenbergiana) y coronillos (Scutia buxifolia) (Athor, 2006). En la actualidad, la Pampa Ondulada es un complejo mosaico compuesto de campos productivos, áreas rurales y centros urbano-industriales. En esta región se trabajó en ambientes de talares, los muestreos se llevaron a cabo en la Reserva “El Destino” (35º08’ S; 57º23’ O), que conserva importantes bosques dominados por grandes ejemplares de tala (Arturi et al., 2009). Dicha reserva se ubica al este de la provincia de Buenos Aires, en el partido de Magdalena, y se encuentra incluida en el Parque Costero del Sur, declarado por la UNESCO como Reserva de Biosfera.
Metodología
Para la captura de murciélagos se utilizaron ocho redes de niebla, una red de 12 m de largo, dos de 9 m y cinco de 6 m, colocadas a 1 m de distancia del suelo. Se seleccionaron dos sitios por tipo de ambiente, separados por una distancia mínima de 500 m como recomiendan Medellín et al. (2000). En total se trabajó en seis sitios (dos por cada localidad): dos en plantaciones de salicáceas, dos en monte blanco y dos en talares. Los muestreos se realizaron durante dos noches consecutivas en cada sitio; excepto en caso de lluvias, vientos muy fuertes o, en el área del delta, por inundaciones, casos en los que el muestreo se realizaba la noche posterior. Se trabajó en las estaciones de primavera, verano y otoño, entre octubre de 2009 y marzo de 2012; en cada sitio se trabajó en cada una de estas estaciones en dos años diferentes. Las redes permanecían abiertas durante seis horas desde la puesta del sol, excepto el verano del 2011 que permanecieron abiertas hasta el amanecer (ocho horas) en todos los sitios. En total se completaron 92 noches de muestreo, siendo el esfuerzo total de muestreo 33 840 h*m red (Medellín, 1993).
Para la identificación de las especies en el campo se utilizó la clave de murciélagos de Argentina de Barquez y Díaz (2009). De cada ejemplar colectado se tomaron las siguientes medidas externas de acuerdo a Barquez et al. (1999): longitud del antebrazo (Ab), largo total (LT), longitud de cola (LC), longitud de la pata (P) y longitud de oreja (O). El Ab se midió con un calibre mecánico de precisión 0.02 mm, y el resto de las medidas con una regla metálica milimetrada. También se obtuvo el peso de cada individuo mediante una balanza digital. Se determinó el sexo y se evaluó la edad relativa de cada individuo de acuerdo al grado de osificación de las articulaciones entre metacarpales y falanges (Anthony, 1988). Se prepararon la piel y el esqueleto de cada ejemplar colectado siguiendo a Díaz et al. (1998). Dicho material fue depositado en la Colección de Mastozoología del Museo de La Plata (MLP), La Plata, provincia de Buenos Aires, Argentina.
Se registraron las siguientes medidas craneales, de acuerdo a Barquez et al. (1999): longitud cóndilobasal (LCB), ancho menor interorbital (AMI), ancho zigomático (AZ), longitud máxima del cráneo (LMC), constricción postorbital (CP), ancho de la caja craneana (ACC), longitud del paladar (LP), ancho mastoideo (AM), longitud de la hilera superior de dientes (HSD), distancia entre caninos superiores (DCS), distancia entre los segundos molares superiores (DMS), longitud de la mandíbula (LM), longitud de la hilera inferior de dientes (HID). Las medidas craneales se tomaron con un calibre digital de precisión 0,01 mm.
RESULTADOS
En total se colectaron 51 ejemplares pertenecientes a 5 especies del género Myotis: M. albescens (1), M. dinellii (16), M. levis (16), M. riparius (16) y M. ruber (2). En la Tabla 1 se presentan las medidas morfológicas de los ejemplares, y en la Fig. 2 se exhiben fotos de un ejemplar de cada especie. A continuación se detallan los especímenes colectados por especie y se comentan diferentes aspectos de los mismos.
Tabla 1 Medidas (en mm) de los ejemplares de Myotis colectados en el presente estudio. Para M. albescens, medidas del único ejemplar capturado, para el resto de las especies: Media, DS (desvío estándar), Max (máximo) y Min (mínimo). N = número de ejemplares medidos. Ab: longitud del antebrazo; LT: largo total; LC: longitud de cola; P: longitud de la pata; O: longitud de oreja; LCB: longitud cóndilobasal; AMI: ancho menor interorbital; AZ: ancho zigomático; LMC: longitud máxima del cráneo; CP: constricción postorbital; ACC: ancho de la caja craneana; LP: longitud del paladar; AM: ancho mastoideo; HSD: longitud de la hilera superior de dientes; DCS: distancia entre caninos superiores; DMS: distancia entre los segundos molares superiores; LM: longitud de la mandíbula; HID: longitud de la hilera inferior de dientes.


Fig. 2. Vista dorsal (izquierda) y ventral (derecha) de ejemplares de Myotis colectados en el área de estudio: M. albescens A y B; M. dinellii C y D; M. levis E y F; M. riparius G y H; M. ruber I y J.
Myotis albescens (É. Geoffroy, 1806) se distribuye desde el sur de México hasta el centro de Argentina, conociéndose ejemplares de todos los países de América del Sur, excepto para la Guayana Francesa y Chile (Wilson, 2007). En Argentina, esta especie se registra en las provincias del norte y este del país: Jujuy, Salta, Tucumán, Formosa, Chaco, Santiago del Estero, Misiones, Corrientes, Santa Fe, Entre Ríos y Buenos Aires (Barquez y Díaz, 2009). Especímenes colectados (1♀): Quinta “Arco Iris”, Islas del Ibicuy, Entre Ríos (n = 1; MLP 2067). El único ejemplar capturado en el área durante este estudio corresponde a una hembra subadulta, colectada el 9 de febrero de 2011. El ejemplar presenta pelos dorsales y ventrales de bases marrones y puntas blancuzcas, y en la región perianal los pelos son completamente blancos. El borde del uropatagio es claro con un fleco de pelos, el cual puede observarse a simple vista a contraluz (La Val, 1973; Barquez et al., 1999). El cráneo del individuo colectado presenta la curvatura frontal pronunciada, característica que permite diferenciar a la especie de otras del género (La Val, 1973).
Myotis dinellii Thomas, 1902 se distribuye en Argentina, Bolivia y sudeste de Brasil (Díaz et al., 2011, 2016; Paglia et al., 2012). Barquez et al. (1999) circunscriben la distribución de la subespecie M. l. dinellii en Argentina desde los 62° O hacia el oeste, ubicando su límite sur en los 38°58’ S en la provincia de Neuquén; y reportan a la ciudad de Bahía Blanca (38°44’ S; 62°16’ O), provincia de Buenos Aires, como el único lugar donde se hallaban las dos subespecies de M. levis consideradas hasta ese momento. Barquez et al. (2011) extienden la distribución de M. dinellii hacia el este del país, confirmando su presencia en la estancia La Cuyana (33°08’38” S; 59°08’23” O), departamento Gualeguay, provincia de Entre Ríos. Por otro lado, Merino et al. (2003) mencionan la presencia de la especie M. levis en Rancho San José, partido de Patagones (40°57’51’’ S; 62°47’58’’ O), extremo sur de la provincia de Buenos Aires; sin asignar subespecie a los ejemplares. La revisión del material analizado en el trabajo de Merino et al. (2003) permitió asignar cuatro ejemplares (MLP 3.X.00.21, 3.X.00.22, 3.X.00.23, 3.X.00.24) a la especie M. dinellii, basados en la coloración del pelaje. Dicha localidad sería, hasta el momento, el punto de distribución más austral conocido para la especie. Especímenes colectados (16; 8♀, 8♂): Reserva “El Destino”, Magdalena, Buenos Aires (n = 8; MLP: 2058, 2060, 2062, 2077, 2078, 2079, 2083, 2095); Quinta “Arco Iris”, Islas del Ibicuy, Entre Ríos (n = 6; MLP: 2039, 2041, 2049, 2052, 2089, 2094); Quinta “La Chilena”, Islas del Ibicuy, Entre Ríos (n = 2; MLP: 2076, 2092). Los individuos de esta especie capturados en el área de estudio presentan un fuerte contraste en el pelaje dorsal, con las puntas amarillentas y el rostro oscuro, sobresaliendo respecto de la coloración del pelaje. El borde del uropatagio es claro con un fleco de pelos, y se encuentra plegado entre la punta de la cola y el comienzo del calcar (La Val, 1973). En el material taxidermizado puede ser difícil de observar los pliegues del borde del uropatagio, pero es fácilmente visible en los individuos vivos.
Myotis levis (I. Geoffroy, 1824) se distribuye en el sur de Brasil, sudeste de Paraguay, Uruguay y noreste de Argentina (Wilson, 2007). En Argentina, Barquez (2006) menciona la presencia de la especie M. levis en las provincias de Misiones, Corrientes, Santa Fe, Entre Ríos y Buenos Aires. Hasta el momento el registro más austral conocido para M. levis es Rancho San José, partido de Patagones (40°57’51’’ S; 62°47’58’’ O), provincia de Buenos Aires (Merino et al., 2003). Especímenes colectados (16; 3♀, 13♂): Reserva “El Destino”, Magdalena, Buenos Aires (n = 7; MLP: 2069, 2070, 2071, 2081, 2082, 2084, 2086); Quinta “Arco Iris”, Islas del Ibicuy, Entre Ríos (n = 8; MLP: 2053, 2063, 2066, 2072, 2073, 2087, 2088, 2093); Quinta “La Chilena”, Islas del Ibicuy, Entre Ríos (n = 1; MLP 2064). Los individuos de M. levis capturados en el área de estudio presentan el pelaje dorsal pardo, sin contraste evidente entre bases y puntas, y también presenta el borde del uropatagio claro y plegado, con un fleco de pelos, por lo que coincide con la descripción de La Val (1973).
Myotis riparius Handley, 1960 es una especie ampliamente distribuida en tierras bajas desde Honduras hacia el sur hasta Uruguay y norte de Argentina (La Val, 1973; Barquez et al., 1999; González y Martínez Lanfranco, 2010), en América del Sur solo ausente en Chile y Suriname (Díaz et al., 2016). El registro más austral en Uruguay se ubica en el sur del departamento de Colonia (González y Martínez Lanfranco, 2010). En Argentina, hay registros de la especie en diferentes provincias del norte del país: Jujuy, Salta, Tucumán, Catamarca, Formosa, Chaco, Santiago del Estero, Misiones y Corrientes (Barquez, 2006; Barquez et al., 2011). Barquez et al. (2011) extienden el rango latitudinal de la especie en Argentina, con un registro en Estancia La Blanca (28°29’01” S; 55°59’02” O) sobre la margen del río Uruguay, localidad de Santo Tomé, provincia de Corrientes. Con la realización de este estudio se agregan registros para las provincias de Entre Ríos y Buenos Aires, extendiendo su distribución sur alrededor de 750 km. Asimismo la reserva “El Destino” (Magdalena, Buenos Aires) se convierte en el registro más austral de la especie, extendiendo su distribución aproximadamente 90 km. Especímenes colectados (16; 6♀, 10♂): Reserva “El Destino”, Magdalena, Buenos Aires (n = 5; MLP: 2057, 2059, 2061, 2080, 2085); Quinta “Arco Iris”, Islas del Ibicuy, Entre Ríos (n = 6; MLP: 2040, 2047, 2048, 2051, 2065, 2068,); Quinta “La Chilena”, Islas del Ibicuy, Entre Ríos (n = 5; MLP: 2044, 2045, 2074, 2075, 2091). A diferencia de las otras especies mencionadas, M. riparius presenta el borde del uropatagio oscuro, sin pliegues ni fleco de pelos (La Val, 1973). En el área de estudio los individuos presentan variación en la coloración dorsal; se han capturado ejemplares con coloración uniforme pardo-negruzca y otros con pelos de bases oscuras y puntas marrones o grises. El ejemplar MLP 2048 presentó un pelaje dorsal pardo, con las bases anchas marrón oscuro y las puntas apenas más claras, además sobre el uropatagio se observó una estrecha franja de pelos rojizos unicoloreados. Ventralmente los adultos presentan pelos de bases anchas, negras o pardo oscuro, con las puntas marrón claro o crema; a excepción del ejemplar MLP 2045 que presenta pelos de base marrón y punta anaranjada, excepto en algunas zonas del vientre y de la garganta donde los pelos tienen base marrón y punta marrón claro o crema. Considerando las características de la especie según la morfología craneal, cabe mencionar que todos los ejemplares colectados durante este trabajo presentaron cresta sagital (característica que lo diferencia de M. nigricans), aunque con diferentes grados de desarrollo, y crestas lambdoideas marcadas.
Myotis ruber (É. Geoffroy, 1806) es una especie endémica de América del Sur (Wilson, 2007). Su distribución abarca el este y sur de Brasil, sudeste de Paraguay, nordeste de Argentina (Barquez et al., 1999; Bianconi y Pedro, 2007; Wilson, 2007) y Uruguay (López González et al., 2001). La frecuencia de captura de M. ruber es baja, siendo por consiguiente escasos sus registros. En Argentina, se ha registrado en las provincias de Buenos Aires, Corrientes, Entre Ríos, Formosa, Misiones y Santa Fe (Barquez et al., 1999; Fabri et al., 2003; Chebez et al., 2005; Pautasso y Arnaudo, 2009; Lutz et al., 2012). El espécimen de Buenos Aires (MLP 14.XI.08.13) fue colectado en la Reserva Natural Punta Lara (34° 47’ 26’’ S, 57° 59’ 56’’ O), y representa hasta el momento, el registro más austral para la especie (Lutz et al., 2012). Especímenes examinados (2 ♀): Quinta “La Chilena”, Islas del Ibicuy, Entre Ríos (n = 2; MLP: 1924, 2090). Los dos ejemplares capturados presentan el pelaje característico descripto para la especie, un pelaje rojo unicoloreado en el dorso, y pelos con bases de color castaño oscuro que cambian gradualmente a naranja amarillento en las puntas del lado ventral. Dicho patrón de coloración es un carácter diagnóstico para la especie (La Val, 1973). El color del pelaje contrasta fuertemente con las membranas negruzcas; el borde del uropatagio también es oscuro, sin pliegues ni fleco de pelos (La Val, 1973).
DISCUSIÓN
La fauna de quirópteros del Bajo Delta del río Paraná y la Pampa Ondulada de Argentina ha sido poco explorada; este trabajo aporta nueva información sobre la diversidad de los murciélagos del género Myotis que habitan en el área. Hasta el momento, se consideraba solo la presencia de dos especies, M. albescens y M. levis, las que eran consideradas comunes (Barquez et al., 1999; Merino et al., 2003). Uno de los aportes más destacables de este estudio es el registro de M. riparius por primera vez para las provincias de Buenos Aires y Entre Ríos. En total se colectaron 16 ejemplares, lo que representa un 31% del total de ejemplares colectados, por lo que se puede considerar una especie común para el área de estudio. La falta de muestreos sistemáticos en la zona puede ser la principal causa por la cual esta especie no se registró con anterioridad (Lutz et al., 2012). Igual porcentaje se obtuvo para M. dinellii y M. levis, y las tres especies se capturaron en los tres ambientes muestreados.
En cuanto a las características cráneo-dentarias de M. riparius, es necesario indicar que Barquez et al. (1999) proponen como carácter para esta especie que el segundo premolar (P2) se encuentra desplazado hacia el lado lingual. Sin embargo, La Val (1973) señala que los ejemplares de Paraguay y Uruguay tienden a tener el P2 menos desplazado hacia el lado lingual, y López-González (2005) confirma que no todos los M. riparius de Paraguay tienen el P2 desplazado. En los ejemplares adultos colectados en el área de estudio observamos que la mitad presentan el P2 desplazado hacia el lado lingual, mientras que la otra mitad conserva el P2 en línea. Por lo tanto, este es un carácter variable dentro de la especie. En cambio, a nivel de la morfología craneal, esta especie presenta cresta sagital y crestas lambdoideas marcadas, características que podrían ayudar a la identificación de ejemplares de M. riparius respecto a M. nigricans.
Solo un individuo de M. albescens se colectó durante este estudio, lo que llama la atención ya que en la literatura se citan diferentes localidades de colecta en el área de estudio y en los alrededores (Barquez et al., 1999). Cabe mencionar que Barquez et al. (1999) y Barquez y Díaz (2009) indican que el pelaje dorsal de M. albescens es escarchado. Sin embargo, el ejemplar capturado durante este trabajo no tiene una apariencia escarchada. Esto podría deberse a una variación geográfica, dado que esa apariencia escarchada es muy evidente en ejemplares colectados en el noroeste de Argentina, por lo que al menos para ejemplares de la región pampeana y del delta del Paraná no debería considerarse este carácter como primordial al momento de la identificación. En cambio, sí debería considerarse como carácter diagnóstico el pelaje blanco en la región perianal (Barquez et al., 1999).
Es necesario destacar que algunas especies de este género, aun aquellas que se consideran comunes, presentan dificultades para su identificación. Algunos individuos de M. levis capturados en el área de estudio podrían confundirse con M. albescens, pero M. levis ventralmente no presenta el pelaje blanco en la región perianal, el borde del uropatagio es plegado y el cráneo no presenta una marcada curvatura frontal.
Asimismo, M. levis y M. dinellii tienen una historia sistemática compleja ya que fueron descriptas como especies plenas, luego consideradas subespecies y posteriormente elevadas de nuevo a la categoría de especie (Barquez, 2006; Miranda et al., 2013). En lo que respecta a la distribución de ambas como subespecies, La Val (1973) menciona que la provincia de Entre Ríos podría ser una zona de intergradación entre las dos subespecies; mientras Barquez et al. (1999) reportan a la ciudad de Bahía Blanca (provincia de Buenos Aires) como un punto de contacto temporal entre áreas marginales de ambas subespecies. Barquez (2006) menciona como áreas de simpatría de ambas especies a las provincias de Entre Ríos y Buenos Aires, lo que confirmamos en este estudio para Islas del Ibicuy (Entre Ríos), Magdalena y Patagones (Buenos Aires).
En lo que se refiere a las diferencias morfométricas entre M. levis y M. dinellii, Barquez y Díaz (2009) señalan que en la última el ancho zigomático (AZ) es menor a 9 mm y en M. levis es mayor a 9 mm. Sin embargo, ejemplares de M. dinellii capturados en el área de estudio presentan un AZ mayor a 9 mm, aunque no superan los 9.6 mm, e individuos de M. levis presentan un AZ menor a 9 mm, siendo el mínimo registrado 8.14 mm. Por su parte, Miranda et al. (2013) no consideran esta medida, pero indican que en los ejemplares de su estudio (los cuales proceden de diferentes estados del Brasil y algunos de la provincia de Tucumán, Argentina), la longitud del antebrazo (Ab) y la longitud máxima del cráneo (LMC) son mayores en M. levis respecto a M. dinellii. Sin embargo, estas diferencias morfométricas entre M. dinellii y M. levis tampoco fueron encontradas en los ejemplares del área de estudio, ya que todas las medidas tomadas presentan algún punto de solapamiento entre ambas especies (ver Tabla 1). Es por ello que es necesaria una revisión exhaustiva de los materiales de estas especies, con la finalidad de establecer claramente los límites de sus distribuciones, así como de las diferencias morfológicas entre ellas y la variabilidad intraespecífica de cada especie. También es importante continuar indagando en los requerimientos ecológicos de cada una.
Respecto a M. ruber, los dos ejemplares colectados en Islas del Ibicuy, así como el ejemplar de Buenos Aires registrado por Lutz et al. (2012), presentan medidas de Ab, LMC y LCB (longitud cóndilo basal) levemente menores respecto a aquellas reportadas por Barquez et al. (1999) y López-González et al. (2001). Esto podría explicarse por el pequeño tamaño de las muestras, o bien podría deberse a una variación geográfica, aunque por el momento es difícil argumentar a favor de esta última explicación porque, en general, hay pocos especímenes en colecciones. La Selva Atlántica alberga la mayor cantidad de registros para M. ruber, mientras que aquellos registros no incluidos en esta unidad florística se encuentran asociados a bosques o selvas aledaños a cuerpos de agua que tienen continuidad con dicha unidad (Weber et al., 2010). Durante este trabajo se capturaron dos ejemplares en monte blanco en Islas del Ibicuy, lo que respalda la hipótesis de que en el extremo austral de su distribución M. ruber se encuentra asociado a selvas en galería (Lutz et al., 2012). Debido a que el estado de conservación de esta especie es “Casi amenazada”, tanto a nivel nacional como internacional (Díaz, 2012), deberían desarrollarse acciones para la conservación de los ambientes que habitan en esta área.
Aunque el número de individuos de cada especie capturados en este trabajo no es elevado, los datos obtenidos contribuyen al conocimiento sobre la variabilidad intraespecífica de cada una de las especies, principalmente porque en otros trabajos no se han incluido ejemplares del área de estudio, la que para algunas de estas especies constituye el límite austral de su distribución. Asimismo es importante considerar a futuro la relación entre estas poblaciones y las del norte de Argentina y aquellas de Uruguay, incluyendo el rol que juegan los ambientes ribereños del río Uruguay y del Río de La Plata en su distribución.
La incorporación de nuevas especies de murciélagos a la fauna del sur de Entre Ríos y noreste de Buenos Aires en áreas de humedales destaca el valor de estos ambientes como sitios de alta diversidad biológica (Bó, 2006; Lutz et al., 2012). Los estudios de la biodiversidad de estas áreas requieren la incorporación de grupos taxonómicos, como los quirópteros, que tradicionalmente no se han tenido en cuenta. Asimismo, es fundamental incluir este grupo en monitoreos a largo plazo para evaluar cambios, lo cual es especialmente importante para preservar los humedales en áreas afectadas por diferentes actividades humanas.
AGRADECIMIENTOS
A Sofía Quiroga, Gastón “Tati” Schargorodsky, Santiago Gamboa Alurralde y Natalin Vicente por su colaboración en el trabajo de campo. A la gente de los sitios donde se realizaron las colectas. A Patrick Gado por su ayuda con la figura. A Agustín Abba y Daniel Udrizar Sauthier por los valiosos comentarios sobre el texto que da origen a este trabajo.
LITERATURA CITADA
1. ANTHONY ELP. 1988. Age determination in bats. Pp. 47-58, en: Ecological and behavioral methods for the study of bats (TH Kunz, ed.). Smithsonian Institution Press, Washington. [ Links ]
2. ARTURI M, M PÉREZ MERONI, C PALEO y R HERRERA. 2009. Lineamientos para una zonificación del Parque Costero del Sur basada en la relación del paisaje con la cultura. Pp. 18-36, en: Parque Costero del Sur: Magdalena y Punta Indio (J Athor, ed.). Fundación de Historia Natural Félix de Azara, Buenos Aires. [ Links ]
3. ATHOR J. 2006. Referencias bibliográficas históricas que delatan la presencia del talar en la ciudad de Buenos Aires. Pp. 218-222, en: Talares bonaerenses y su conservación (E Mérida y J Athor, eds.). Fundación de Historia Natural Félix de Azara, Buenos Aires. [ Links ]
4. BARQUEZ RM, MA MARES y JK BRAUN. 1999. The bats of Argentina. Special Publications of the Museum of Texas Tech University 42:1-275. [ Links ]
5. BARQUEZ RM. 2006. Orden Chiroptera. Pp. 56-86, en: Mamíferos de Argentina. Sistemática y distribución (RM Barquez, MM Díaz y RA Ojeda, eds.). SAREM (Sociedad Argentina para el Estudio de los Mamíferos), Mendoza. [ Links ]
6. BARQUEZ RM y MM DÍAZ. 2009. Los murciélagos de Argentina. Clave de identificación. Publicación Especial N°1 PCMA (Programa de Conservación de los Murciélagos de Argentina), Tucumán. [ Links ]
7. BARQUEZ RM, MS SÁNCHEZ y ML SANDOVAL. 2011. Nuevos registros de murciélagos (Chiroptera) en el norte de Argentina. Mastozoología Neotropical 18:11-24. [ Links ]
8. BIANCONI GV y WA PEDRO. 2007. Família Vespertilionidae. Pp. 167-196, en: Morcegos do Brasil (NR dos Reis, AL Peracchi, WA Pedro e IP de Lima, eds.). Universidade Estadual de Londrina, Londrina. [ Links ]
9. BÓ RF. 2006. Situación ambiental en la ecorregión Delta e islas del Paraná. Pp. 130-174, en: La Situación Ambiental Argentina 2005 (A Brown, U Martínez Ortiz, M Acerbi y J Corcuera, eds.). Fundación Vida Silvestre Argentina, Buenos Aires. [ Links ]
10. BÓ RF y RD QUINTANA. 1999. Actividades humanas y biodiversidad en humedales: el caso del Bajo Delta del Río Paraná. Pp. 291-315, en: Biodiversidad y uso de la tierra. Conceptos y ejemplos de Latinoamérica (SD Matteucci, OT Solbrig, J Morello y G Halffter, eds.). Eudeba, Buenos Aires. [ Links ]
11. CHEBEZ JC, J PEREIRA, E MASSOIA, AG DI GIACOMO y S HEINONEN FORTABAT. 2005. Mamíferos de la Reserva El Bagual. Pp. 467-499, en: Historia natural y paisaje de la Reserva El Bagual, Formosa, Argentina. Inventario de la fauna de vertebrados y de la flora vascular de un área del Chaco Húmedo. Temas de Naturaleza y Conservación (AG Di Giacomo y SF Krapovickas, eds.). Aves Argentinas/ Asociación Ornitológica del Plata, Buenos Aires. [ Links ]
12. DÍAZ MM, DA FLORES y RM BARQUEZ. 1998. Instrucciones para la preparación y conservación de mamíferos. Publicación Especial N°1 PIDBA (Programa de Investigaciones de la Biodiversidad Argentina), Tucumán. [ Links ]
13. DÍAZ MM. 2012. Myotis ruber. Pp. 76, en: Libro rojo de los mamíferos amenazados de la Argentina (GB Díaz y RA Ojeda, eds.). Sociedad Argentina para el Estudio de los Mamíferos, Argentina. [ Links ]
14. DÍAZ MM, LF AGUIRRE y RM BARQUEZ. 2011. Clave de identificación de los murciélagos del cono sur de Sudamérica. Publicación especial PCMA (Programa de Conservación de los Murciélagos de Argentina)-PCMB (Programa para la Conservación de los Murciélagos de Bolivia), Cochabamba. [ Links ]
15. DÍAZ MM, S SOLARI, LF AGUIRRE, L AGUIAR y RM BARQUEZ. 2016. Clave de identificación de los murciélagos de Sudamérica/Chave de indentifição dos morcegos da América do Sul. Publicación Especial PCMA Nro 2. Editorial Magna Publicaciones, San Miguel de Tucumán. [ Links ]
16. FABRI S, S HEINONEN FORTABAT, A SORIA y UFJ PARDIÑAS. 2003. Los mamíferos de la Reserva Provincial Iberá, Provincia de Corrientes, Argentina. Pp. 305-342, en: Fauna del Iberá (BB Alvarez, ed.). Editorial Universitaria de la Universidad Nacional del Nordeste, Corrientes. [ Links ]
17. GONZÁLEZ EM y JA MARTÍNEZ LANFRANCO. 2010. Mamíferos de Uruguay. Guía de campo e introducción a su estudio y conservación. Banda Oriental, Vida Silvestre y MNHN, Montevideo. [ Links ]
18. KALESNIK FA y H SIROLLI. 2011. La vegetación del Bajo Delta Insular del Paraná: Diversidad, situación y uso. Pp. 89-99, en: El patrimonio natural y cultural del Bajo Delta Insular del Río de La Plata: bases para su conservación y uso sostenible (R Quintana, MV Villar, E Astrada, P Saccone y S Malzof, eds.). Aprendelta, Buenos Aires. [ Links ]
19. LA VAL RK. 1973. A revision of the Neotropical bats of the genus Myotis. Science Bulletin Los Angeles County Natural History Museum 15:1-54. [ Links ]
20. LÓPEZ-GONZÁLEZ C. 2005. Murciélagos del Paraguay. Publicaciones del Comité Español del Programa Mab y de la red IberoMab de la UNESCO, Sevilla. [ Links ]
21. LÓPEZ-GONZÁLEZ C, SJ PRESLEY, RD OWEN y MR WILLIG. 2001. Taxonomic status of Myotis in Paraguay. Journal of Mammalogy 82:138-160. [ Links ]
22. LUTZ MA, ML MERINO, MM DÍAZ y RF JENSEN. 2012. Primeros registros de Myotis ruber (Chiroptera: Vespertilionidae) en las provincias de Entre Ríos y Buenos Aires, Argentina. Mastozoología Neotropical 19:333-338. [ Links ]
23. MATTEUCCI SD. 2012a. Ecorregión Delta e Islas de los ríos Paraná y Uruguay. Pp. 447-488, en: Ecorregiones y complejos ecosistémicos argentinos (J Morello, SD Matteucci, AF Rodríguez y ME Silva, eds.). Orientación Gráfica Editora, Buenos Aires. [ Links ]
24. MATTEUCCI SD. 2012b. Ecorregión Pampa. Pp. 391-445, en: Ecorregiones y complejos ecosistémicos argentinos (J Morello, SD Matteucci, AF Rodríguez y ME Silva, eds.). Orientación Gráfica Editora, Buenos Aires. [ Links ]
25. MEDELLÍN RA. 1993. Estructura y diversidad de una comunidad de murciélagos en el trópico húmedo mexicano. Pp. 333-354, en: Avances en el estudio de los mamíferos de México (RA Medellín y G Ceballos, eds.). Publicaciones Especiales de la Asociación Mexicana de Mastozoología, México D.F. [ Links ]
26. MEDELLÍN RA, M EQUIHUA y MA AMIN. 2000. Bat diversity and abundance as indicators of disturbance in neotropical rainforests. Conservation Biology 14:1666-1675. [ Links ]
27. MERINO ML, DE UDRIZAR SAUTHIER y AM ABBA. 2003. New distributional records of bats species in the provinces of Buenos Aires y Entre Ríos, Argentina. Biogeographica 79:85-95. [ Links ]
28. MIRANDA JMD, IP BERNARDI, J SPONCHIADO y FC PASSOS. 2013. The taxonomic status of Myotis levis levis and Myotis levis dinellii (Mammalia: Chiroptera: Vespertilionidae). Zoologia 30:513-518. [ Links ]
29. MORATELLI R, AL PERACCHI, D DIAS y JA DE OLIVEIRA. 2011. Geographic variation in South American populations of Myotis nigricans (Schinz, 1821) (Chiroptera, Vespertilionidae), with the description of two new species. Mammalian Biology 76:592-607. [ Links ]
30. MORATELLI R y DE WILSON. 2011. A new species of Myotis Kaup, 1829 (Chiroptera, Vespertilionidae) from Ecuador. Mammalian Biology 76:608-614. [ Links ]
31. MORATELLI R, AL GARDNER, JA DE OLIVEIRA y DE WILSON. 2013. Review of Myotis (Chiroptera, Vespertilionidae) from Northern South America, including description of a new species. American Museum Novitates 3780:1-36. [ Links ]
32. MORATELLI R y DE WILSON. 2014. A new species of Myotis (Chiroptera, Vespertilionidae) from Bolivia. Journal of Mammalogy 95:17-25. [ Links ]
33. PAGLIA AP, GAB DA FONSECA, AB RYLANDS, G HERRMANN, LMS AGUIAR, AG CHIARELLO, YLR LEITE, LP COSTA, S SICILIANO, MCM KIERULFF, SL MENDES, V DA C TAVARES, RA MITTERMEIER y JL PATTON. 2012. Lista Anotada dos Mamíferos do Brasil / Annotated Checklist of Brazilian Mammals. 2ª Edição/2nd Edition. Occasional Papers in Conservation Biology, No. 6. Conservation International, Arlington. [ Links ]
34. PAUTASSO AA y ME ARNAUDO. 2009. Primeros registros del murcielaguito rojo (Myotis ruber) para la provincia de Santa Fe, Argentina. Biológica 10:59-61. [ Links ]
35. RINGUELET RA. 1978. Dinamismo histórico de la fauna brasílica en la Argentina. Ameghiniana 15:255-262. [ Links ]
36. SILVA ME. 2003. Efectos ecológicos de la expansión urbana sobre las tierras agrícolas de la Pampa Ondulada, Buenos Aires, Argentina. Tesis de Maestría, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina. [ Links ]
37. VIGLIZZO EF, FC FRANK y L CARREÑO. 2006. Situación ambiental en las ecorregiones Pampa y Campos y Malezales. Pp. 261-278, en: La Situación Ambiental Argentina 2005 (A Brown, U Martínez Ortiz, M Acerbi y J Corcuera, eds.). Fundación Vida Silvestre Argentina, Buenos Aires. [ Links ]
38. WEBER MM, LC TERRIBILE y NC CÁCERES. 2010. Potential geographic distribution of Myotis ruber (Chiroptera: Vespertilionidae), a threatened Neotropical bat species. Mammalia 74:333-338. [ Links ]
39. WILSON DE. 2007. Genus Myotis. Pp. 468-481, en: Mammals of South America, Volume 1Marsupials, Xenarthrans, Shrews, and Bats (AL Gardner, ed.). The University of Chicago Press, Chicago. [ Links ]














