Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
Mastozoología neotropical
versão impressa ISSN 0327-9383versão On-line ISSN 1666-0536
Mastozool. neotrop. vol.23 no.2 Mendoza dez. 2016
ARTÍCULO
Redescripción de Eremoryzomys polius (Rodentia: Cricetidae) y descripción de una nueva especie del género Eremoryzomys
Angie C. J. Uturunco1 y Víctor R. Pacheco1, 2
1 Departamento de Mastozoología, Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, Av. Arenales 1256, Lima 14, Lima, Perú. [Correspondencia: Angie C. J. Uturunco <auturuncop@gmail.com>].
2 Instituto de Ciencias Biológicas “Antonio Raimondi”, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Av. Arenales 1256, Lima 14, Lima, Perú.
Recibido 1 febrero 2016.
Aceptado 8 agosto 2016.
Editor asociado: P Teta
RESUMEN.
Eremoryzomys polius (Osgood 1913) es un roedor orizomyino endémico de la cuenca alta del río Marañón, Perú, del que solo se conocen 15 ejemplares procedentes de 7 localidades y que no había sido registrado en los últimos 22 años. En este trabajo se reportan 4 localidades nuevas para E. polius, que expanden la distribución de este roedor. Adicionalmente, describimos una especie nueva para el género Eremoryzomys en base a la comparación de caracteres morfológicos cualitativos y cuantitativos con E. polius. La especie nueva de Eremoryzomys se diferencia de E. polius en los siguientes rasgos: cola corta ligeramente bicoloreada; almohadillas de las patas posteriores oscuras; almohadillas tenar e hipotenar casi contiguas; cráneo más pequeño, con un rostro corto y grácil; cresta nucal desarrollada; forámenes incisivos que llegan hasta el anterocono del M1, serie molar más corta y proceso coronoides triangular. La nueva especie es endémica de los bosques premontanos del Amazonas de la cuenca media del río Marañón, agregando evidencia de la importancia de esta región como centro de endemismo y de la necesidad de su conservación. Finalmente, sugerimos que E. polius, en su actual concepción, es aún un complejo de especies.
ABSTRACT.
Redescription of Eremoryzomys polius (Rodentia: Cricetidae) and description of a new species of the genus Eremoryzomys.
Eremoryzomys polius (Osgood 1913) is an oryzomyine rodent endemic to the upper basin of the Marañón River in Peru, known from only 15 specimens at 7 localities and with no new records in at least 22 years. Here we report an expansion of the geographic distribution of E. polius by confirming its presence at four new locations near the Marañón River. In addition, we describe a new species of Eremoryzomys based on comparison of its morphological and morphometric characteristics with E. polius. The new species of Eremoryzomys differs from E. polius in the following traits: slightly bicolored and short tail; dark hind leg pads; thenar and hypothenar pads nearly contiguous; small skull with a short and gracile rostrum; well-developed nuchal ridge; short incisive foramen reaching the anterocone of M1; shorter molar series and triangular coronoid process. This new species is endemic to premontane Amazon forest of the middle basin of the Marañon River, adding support for the importance of this region as a center of endemism and as a focus for habitat conservation. Finally, we suggest that E. polius, as currently understood, remains a species complex.
Palabras clave: Biogeografía; Endemismo; Oryzomyini; Río Marañón; Taxonomía.
Key words: Biogeography; Endemism; Marañón River; Oryzomyini; Taxonomy.
INTRODUCCIÓN
La subfamilia Sigmodontinae incluye once tribus (i.e., Abrotrichini, Akodontini, Andinomyini, Ichthyomyini, Oryzomyini, Phyllotini, Reithrodontini, Sigmodontini, Thomasomyini, Wiedomyini y Euneomyini) y varios linajes incertae sedis (D´Elía et al., 2007; Patton et al. 2015; Pardiñas et al., 2015). Dentro de ellas, la tribu Oryzomyini se destaca por ser la más diversa en el Neotrópico y está compuesta por 30 géneros vivientes y al menos 8 extintos (Weksler y Percequillo, 2011). En el Perú se han registrado 18 géneros de Oryzomyini, de los cuales solo dos son considerados endémicos: Amphinectomys (Malygin et al., 1994), de la Selva Baja, y Eremoryzomys (Osgood, 1913), del valle del río Marañón (Pacheco et al., 2009).
Eremoryzomys polius, el “ratón arrozalero de Osgood” (Pacheco et al., 2009) o “rata gris arrozera” (Pacheco et al., 2008) fue descrita por Osgood (1913) a partir de un ejemplar colectado en “Tambo Carrizal, al este de Balsas, departamento de Amazonas, Perú”. Weksler et al. (2006) ampliaron su descripción reconociendo a Eremoryzomys como género monotípico; previamente Weksler (2003) había colocado a E. polius como un linaje basal del clado D de Oryzomys. Actualmente, se conoce que E. polius se distribuye en los Andes Centrales al oeste de la Cordillera Central del Perú (Percequillo et al., 2011), en la cuenca alta del río Marañón (Weksler et al., 2006; Percequillo, 2005). Eremoryzomys es el grupo hermano de Drymoreomys albimaculatus, un taxón endémico de la Selva Atlántica del este de Brasil. E. polius es considerada una especie Vulnerable según la legislación nacional vigente del Decreto Supremo N° 004-2014-AG (Ministerio de Agricultura y Riego, 2014). Otros aspectos de su biología son desconocidos.
Recientes trabajos de campo realizados en la cuenca media del río Marañón, en Amazonas, dieron lugar a la colecta de unos especímenes cuyas características morfológicas externas y cráneo-dentarias concordaban con la descripción de Eremoryzomys (sensu Percequillo, 2015), pero que a su vez presentaban varias diferencias morfológicas con E. polius. En este trabajo se propone que esta población de Amazonas corresponde a una nueva especie, la cual es aquí nominada y descrita. Adicionalmente, se presenta una redescripción de E. polius y se plantea que, en su actual concepción, podría tratarse de un complejo de especies.
MATERIALES Y MÉTODOS
Se examinaron 61 especímenes de ambos sexos de Eremoryzomys polius, incluyendo adultos y juveniles provenientes de los departamentos de Amazonas, Cajamarca y La Libertad, circundantes a la cuenca alta del río Marañón (Fig. 1). Los individuos examinados están depositados en las colecciones de mamíferos del Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima (MUSM); The Field Museum, Chicago (FMNH); American Museum of Natural History, New York (AMNH) y Museum of Vertebrate Zoology, Berkeley (MVZ). Los especímenes pertenecientes al MUSM (n = 47) fueron material preservado en alcohol (pieles y carcasas) y en seco (pieles, cráneos y esqueletos) mientras que los especímenes de los museos FMNH, AMNH y MVZ (n = 14) fueron examinados en base a material fotográfico. Las medidas cráneo-dentales de los ejemplares del MUSM fueron tomadas por el primer autor, mientras que para los ejemplares del FMNH, AMNH y MVZ fueron registradas por Natali Hurtado, Paul Velazco y Edgar Rengifo, respectivamente. Se siguió a Carleton y Musser (1989), Voss (1991), Voss y Carleton (1993), Steppan (1995), Pacheco (2003), Weksler (2006) y Weksler et al. (2006) para la definición de caracteres morfológicos externos, craneanos y dentarios. La coloración del pelaje se definió siguiendo a Smithe (1975). Para la comparación se usaron 19 especímenes de Aegialomys xanthaeolus, 18 de Euryoryzomys macconnelli y 20 de Nephelomys albigularis, de la colección del departamento de Mastozoología del Museo de Historia Natural (MUSM). Los especímenes examinados, las localidades registradas y sus coordenadas geográficas están detalladas en el Apéndice 1. La descripción de los hábitats se basó en Linares-Palomino (2004b) y el asesoramiento de botánicos del Museo de Historia Natural, a través de material fotográfico obtenido por los colectores de los especímenes.

Fig. 1. Noroeste de Perú, con indicación de la distribución de las especies de Eremoryzomys en la cuenca alta y media del río Marañón: E. polius (triángulos blancos) y E. mesocaudis sp. nov. (triángulos negros). Localidades tipo (estrellas): Tambo Carrizal (7) y Copallín (13). La flecha indica la Depresión de Huancabamba. Véase el Apéndice 1 para la referencia numérica de las localidades y en “Comentarios” para E. polius una explicación para los signos de interrogación (?).
El criterio de edades siguió a Prado y Percequillo (2011) y Musser et al. (1998), con algunas modificaciones: edad 0 (juvenil): M3 no erupcionado o con desarrollo incompleto; edad 1 (juvenil): cúspides de los molares elevadas, con poca exposición de la dentina; flexos linguales del M1 y M2 muy abiertos y conspicuos; M3 con paracono prominente e hipoflexo notorio; edad 2 (subadulto): molares con mayor desgaste, pero las cúspides aún se ven elevadas con una exposición moderada de la dentina; flexos linguales del M1 y M2 muy abiertos y conspicuos; M3 con paracono aún pronunciado pero no tanto como en la edad 1; paraflexo generalmente sin formar una foseta e hipoflexo ligeramente notorio; edad 3 (adulto): cúspides de los molares bajas o aplanadas, con una mayor exposición de dentina pero el anterolofo del M2 y M3 aún conspicuos; paracono del M3 no diferenciado; hipoflexo ausente y paraflexo formando o no una foseta; edad 4 (adulto): cúspides de los molares muy gastadas (forma de vasija), con una masiva exposición de la dentina; flexos labiales y linguales en M1 y M2 visibles, pero ya no en M3; lofos de M1 aún visibles; M3 de contorno triangular; edad 5 (adulto-viejo): cúspides completamente gastadas con una total exposición de la dentina; los lofos y flexos inobservables; M3 de contorno triangular. Para la descripción dentaria también se incluyeron las edades 1 y 2, que presentaban un desgaste menor.
Para el análisis morfométrico se tomaron 20 medidas cráneo-dentarias. Las medidas corporales estandar —longitud total (LT), longitud de la cola (LC), longitud de la pata (LP) y longitud de la oreja (LO)— se tomaron de las etiquetas del material de colección y sólo se usaron para la comparación con otros orizomyinos (Tabla 1). Las medidas cráneo-dentarias fueron tomadas con un calibre digital Fowler Sylvac Ultra-cal IV (± 0.01 mm) y transformadas a logaritmo natural (ln) para lograr la normalidad. Se consideraron las siguientes medidas: longitud total del cráneo (LTC), longitud cóndilo-incisiva (LCI), longitud cóndilo-molar (LCM), longitud del diastema (LD), longitud de la hilera dentaria maxilar (LHDM), longitud de la fosa orbital (LFO), ancho del M1 (AM1), longitud del foramen incisivo (LFI), ancho de los forámenes incisivos (AFI), largo del hueso palatino (LHP), ancho del hueso palatino (AHP), largo postpalatino (LPP), ancho rostral (AR), ancho del nasal (AN), ancho mínimo interorbitario (AMI), ancho cigomático (ACi), ancho de la placa cigomática (APC), ancho de la bulla timpánica (AB), ancho de la caja craneana (ACC) y alto de la caja craneana (AC). Estas medidas fueron tomadas de otros trabajos realizados para orizomyinos, incluyendo aquellos de Carleton y Musser (1989), Voss (1991), Musser et al. (1998), Sánchez et al. (2001), Percequillo et al. (2008), Prado y Percequillo (2011) y Percequillo et al. (2011).
Tabla 1 Medidas externas y cráneo-dentarias de la serie tipo de Eremoryzomys polius del distrito de Balsas, provincia Chachapoyas, departamento Amazonas, Perú (FMNH). Estado etario y sexo en paréntesis (ad = adulto, juv = juvenil; h = hembra, m = macho).

El análisis multivariado de varianza (MANOVA) se realizó para evaluar la variación intrapoblacional entre sexos y edades de Eremoryzomys polius sensu stricto (n = 26) y de la especie nueva (n = 31). Previamente a los análisis estadísticos se realizó una prueba de normalidad y homocedasticidad a los individuos de E. polius a través de un prueba de Kolmogorov-Smirnov y homogeneidad de varianzas de Levene, respectivamente. Además, se realizó un análisis de componentes principales (ACP) para evaluar las causas de variación en el conjunto de datos y ordenarlas por importancia. Finalmente, se realizó la prueba t-student para determinar la significancia de las medidas morfométricas entre los dos taxones. Todos los análisis estadísticos se realizaron con el programa Statistical Package for the Social Sciences (SPSS) versión 22.0 para Windows.
RESULTADOS
Análisis morfométrico:
De las 20 medidas cráneo-dentarias registradas, solo AM1, AFI, LPP y APC no cumplieron con los supuestos de normalidad y homogeneidad de varianza (p <0.05), por lo que ellas no fueron consideradas en el MANOVA. El MANOVA con respecto al sexo no mostró diferencias significativas para E. polius ni para Eremoryzomys sp. nov. Dada la inexistencia de dimorfismo sexual a nivel del cráneo, las muestras de ambos sexos fueron combinadas en los análisis subsiguientes. Por el contrario, sí se detectaron diferencias significativas entre individuos de distintas edades (p <0.05), por lo cual se optó por incluir en el ACP solo a los ejemplares adultos de ambos sexos (edades 3, 4 y 5) (n = 13 para E. polius y n = 14 para la especie nueva).
Los primeros tres ejes del ACP representaron el 84.57 % de la varianza total (Tabla 2). Los diagramas de dispersión del primer componente principal (CP1) versus el CP2 y el CP1 versus el CP3 no mostraron solapamiento entre Eremoryzomys polius y Eremoryzomys sp. nov. (Fig. 2). El CP 1 explicó el 68.48% de la varianza, siendo las variables LTC y LCI las que obtuvieron un mayor coeficiente y por lo tanto explicaron mejor esta variación. El CP 2 explicó un 9.81 % de la variación y estuvo fuerte y positivamente correlacionado con la variable AMI. El CP 3 explicó un 6.28% de variación total, incluyendo a la variable AC como la de mayor valor positivo. En consecuencia, los especímenes más pequeños (E. mesocaudis) tuvieron puntuaciones más bajas a lo largo del eje del CP1 y los más grandes (E. polius) puntuaciones más altas. (Fig. 2).
Tabla 2 Coeficientes de las variables, autovalores, varianza explicada y varianza acumulada para los tres primeros componentes principales en base a las 20 variables morfométricas de ejemplares adultos de Eremoryzomys polius (n=13) y E. mesocaudis sp. nov. (n=14).


Fig. 2. Diagrama de dispersión para los componentes 1 y 2 extraídos del análisis de componentes principales de 16 variables morfométricas de adultos de Eremoryzomys polius sensu stricto (círculos blancos; p = paratipo) y E. mesocaudis sp. nov. (triángulos negros; h = holotipo; p = paratipo).
El análisis a través de la prueba de t-student encontró 14 medidas con diferencias significativas sobre las 16 medidas consideradas (Tabla 3).
Tabla 3 Medidas externas y craneanas (en mm) de ejemplares adultos del género Eremoryzomys y algunos orizomyinos de tamaño similar y distribución cercana. Se anota la media ± desviación estándar, rango y tamaño de la muestra. Las medidas con diferencias significantes (test-t; p ≤ 0.05) entre Eremoryzomys polius y Eremoryzomys mesocaudis se resaltaron con un asterisco.


Redescripción de Eremoryzomys polius (Osgood, 1913)
Holotipo.— FMNH 19765, hembra adulta con piel y cráneo; colectado el 18 de mayo de 1912 por W. H. Osgood (Tabla 1).
Localidad tipo.— “Tambo Carrizal, montañas al este de Balsas, 1524 m” (Osgood, 1914). (6° 47’S, 77° 52’W, 2000 m, departamento Amazonas, provincia de Chachapoyas) (localidad 7 en Fig. 1).
Paratipos.— FMNH 19762-64 ejemplares hembras y FMNH 19766-67 ejemplares machos con piel, cráneo y carcasa; colectados el 18 de mayo de 1912 por W. H. Osgood y M. P. Anderson (Tabla 1).
Distribución.— Esta especie está restringida a la cuenca alta del río Marañón, en solo siete localidades de los departamentos Amazonas y Cajamarca (Percequillo, 2015a). Nuestra revisión del material en estudio amplía dicha distribución a once localidades incluyendo también al departamento de La Libertad entre 779 y 2205 m s.n.m. (Fig. 1).
Diagnosis enmendada.— Eremoryzomys polius es un Sigmodontino de la tribu Oryzomyini (Rodentia, Cricetidae) que se caracteriza por la siguiente combinación de caracteres: tamaño grande (LT promedio = 330.63 mm); la cola es más larga que la longitud cabeza-cuerpo; las vibrisas mistaciales llegan hasta el borde posterior de la oreja pero no lo sobrepasan; el pelo de cobertura es mediano (![]() = 13 mm) y de aspecto lacio y tosco. Presenta un espacio notorio entre las almohadillas tenar e hipotenar. La coloración del pelaje dorsal es marrón-oliva (color 28) y la región ventral es superficialmente gris neutral pálido (Color 86); la cola es fuertemente bicolor; el metatarso es blanco sin manchas y la planta de las patas posteriores es de color crema rosado. El cráneo es moderadamente grande con un rostro largo y robusto (valores promedio de las longitudes: LTC = 35.53 mm y ACI = 17.99 mm); el interorbital es anteriormente convergente, con los márgenes supraorbitales muy desarrollados; el perfil del arco cigomático es subrectangular y la cresta nucal no es sobresaliente. Los forámenes incisivos son largos, llegando o sobrepasando ligeramente el protoflexo del M1 (promedio de la LFI = 8.72 mm); la hilera molar es mayor a 5 mm (promedio de la LHDM = 5.54 mm); las fosas posterolaterales del paladar son múltiples y están dispuestas en una fosa mayor y profunda; el borde anterior de la fosa mesopterigoidea es redondeado y el flexo anteromedio del M1 está ausente. En la mandíbula el proceso coronoides es falciforme, el proceso angular está al mismo nivel del proceso condilar y el proceso capsular es poco desarrollado.
= 13 mm) y de aspecto lacio y tosco. Presenta un espacio notorio entre las almohadillas tenar e hipotenar. La coloración del pelaje dorsal es marrón-oliva (color 28) y la región ventral es superficialmente gris neutral pálido (Color 86); la cola es fuertemente bicolor; el metatarso es blanco sin manchas y la planta de las patas posteriores es de color crema rosado. El cráneo es moderadamente grande con un rostro largo y robusto (valores promedio de las longitudes: LTC = 35.53 mm y ACI = 17.99 mm); el interorbital es anteriormente convergente, con los márgenes supraorbitales muy desarrollados; el perfil del arco cigomático es subrectangular y la cresta nucal no es sobresaliente. Los forámenes incisivos son largos, llegando o sobrepasando ligeramente el protoflexo del M1 (promedio de la LFI = 8.72 mm); la hilera molar es mayor a 5 mm (promedio de la LHDM = 5.54 mm); las fosas posterolaterales del paladar son múltiples y están dispuestas en una fosa mayor y profunda; el borde anterior de la fosa mesopterigoidea es redondeado y el flexo anteromedio del M1 está ausente. En la mandíbula el proceso coronoides es falciforme, el proceso angular está al mismo nivel del proceso condilar y el proceso capsular es poco desarrollado.
Descripción.— Eremoryzomys polius es un orizomyino de tamaño grande (LT promedio en la serie tipo es de 330.63 mm). El pelo de cobertura es de tamaño mediano ( ![]() = 13 mm) y de aspecto lacio tosco. Las orejas son cortas y representan un 14.25% de la longitud cabeza-cuerpo. Las vibrisas mistaciales, genales y superciliares son medianas, no sobrepasan el borde posterior de la oreja; las vibrisas interramales y submentales son cortas y blancas. Las patas posteriores tienen almohadillas interdigitales muy desarrolladas; el hipotenar es redondo y representa aproximadamente la tercera parte del tenar y es posterior a la almohadilla interdigital IV; el tenar es de forma alargada y es posterior a la almohadilla interdigital I y muy distante al hipotenar. No presentan mancha metatarsal. Las patas anteriores tienen los pelos ungueales de tamaño largo que llegan hasta la punta de las garras o las sobrepasan; en las patas posteriores son largos y abundantes y cubren las garras casi por completo. La cola es más larga que la longitud cabeza-cuerpo (125% en la serie tipo), los pelos de su base llegan hasta 1cm de largo en promedio y los pelos distales cubren 2 escamas aproximadamente. La hembra tiene cuatro pares de mamas, un par postaxial, uno pectoral, uno abdominal y otro inguinal. La coloración del pelaje dorsal es marrón-oliva (color 28) y en algunos especímenes adultos-viejos es más claro con tonos amarillentos; el pelaje ventral superficialmente es gris neutral pálido (Color 86) con bases negras o grises, la parte distal gris más larga que la base. El anillo periocular es ligeramente oscuro. La coloración dorsal y ventral de las patas anteriores es blanquecina; en las patas posteriores la coloración dorsal es blanquecina y la ventral crema rosácea. La cola es fuertemente bicoloreada siendo el dorso ocre oscuro puro (color 23) y la zona ventral crema (color 54).
= 13 mm) y de aspecto lacio tosco. Las orejas son cortas y representan un 14.25% de la longitud cabeza-cuerpo. Las vibrisas mistaciales, genales y superciliares son medianas, no sobrepasan el borde posterior de la oreja; las vibrisas interramales y submentales son cortas y blancas. Las patas posteriores tienen almohadillas interdigitales muy desarrolladas; el hipotenar es redondo y representa aproximadamente la tercera parte del tenar y es posterior a la almohadilla interdigital IV; el tenar es de forma alargada y es posterior a la almohadilla interdigital I y muy distante al hipotenar. No presentan mancha metatarsal. Las patas anteriores tienen los pelos ungueales de tamaño largo que llegan hasta la punta de las garras o las sobrepasan; en las patas posteriores son largos y abundantes y cubren las garras casi por completo. La cola es más larga que la longitud cabeza-cuerpo (125% en la serie tipo), los pelos de su base llegan hasta 1cm de largo en promedio y los pelos distales cubren 2 escamas aproximadamente. La hembra tiene cuatro pares de mamas, un par postaxial, uno pectoral, uno abdominal y otro inguinal. La coloración del pelaje dorsal es marrón-oliva (color 28) y en algunos especímenes adultos-viejos es más claro con tonos amarillentos; el pelaje ventral superficialmente es gris neutral pálido (Color 86) con bases negras o grises, la parte distal gris más larga que la base. El anillo periocular es ligeramente oscuro. La coloración dorsal y ventral de las patas anteriores es blanquecina; en las patas posteriores la coloración dorsal es blanquecina y la ventral crema rosácea. La cola es fuertemente bicoloreada siendo el dorso ocre oscuro puro (color 23) y la zona ventral crema (color 54).
El cráneo es grande (el valor promedio de la serie tipo es 35.53 mm) en comparación con otros orizomyinos, de rostro largo, robusto y caja craneal redondeada (Fig. 3). Los nasales son más anchos en su parte anterior (en especímenes adultos viejos es más notorio) y su extremo posterior llega hasta el final de los lacrimales sobrepasando la juntura maxilar-frontal-lacrimal (MFL). Los premaxilares sobrepasan la muesca cigomática y la juntura premaxilar-maxilar-frontal (PMF) pero no al MFL. La muesca cigomática es abierta y profunda con una espina pronunciada que puede ser delgada o ligeramente gruesa. La placa cigomática es vertical y ancha como la longitud del M1. El arco cigomático tiene un perfil subrectangular. La raíz escamosal del cigomático es robusta. El jugal es largo y delgado. El puente anteorbital es largo y aproximadamente igual a la cuarta parte de la profundidad del rostro. La región interorbitaria es anteriormente convergente, con bordes marcados y márgenes supraorbitales redondos; la base de los molares es visible en una vista dorsal. Los lacrimales son pequeños, no elongados y se suturan igualmente con el maxilar y frontal. La sutura fronto-parietal es ligeramente entrante al frontal y colineal con la sutura fronto-escamosa. Los parietales tienen amplias expansiones laterales. El interparietal es de forma variable: en forma de banda, pentagonal o en “V” alargado en los extremos. Las crestas temporales y la cresta nucal no son desarrolladas. El diastema es recto. Los forámenes incisivos son largos llegando hasta el protoflexo del M1 o sobrepasándolo ligeramente en algunos casos, delgados y ligeramente anchos en la parte media. El paladar es largo, ancho y de superficie rugosa extendiéndose más allá del margen posterior del M3, con el foramen posterior del palatino ubicado a la altura del protocono del M2. Las fosas posterolaterales del paladar son ovaladas y múltiples dispuestas en una fosa profunda ubicadas a los costados del borde anterior de la fosa mesopterigoidea y se extienden hasta la altura del hipocono del M3. La fosa mesopterigoidea tiene márgenes paralelos, borde anterior ovalado y no alcanza el borde posterior del M3. La fosa parapterigoidea es triangular y profunda. El foramen oval es conspicuo pero en algunos (22% de los individuos observados) es pequeño. La bula timpánica es de aspecto brillosa con un periótico delgado que se extiende posteriormente entre el ectotimpánico y el basioccipital. El tubo de Eustaquio es largo y tubular. El proceso anterior del ectotimpánico cuenta con dos espinas: una con terminación en punta y la otra ancha y sin punta. La fenestra de la capsula mastoidea es pequeña. En vista lateral, los etmoturbinales no son de aspecto inflado (sensu Pacheco 2003); los forámenes etmoides y esfeno palatino están ubicados generalmente a la altura del M2; el foramen óptico está a la altura del M3 y es más grande que este. La columna media del aliesfenoides puede estar presente o ausente. La abertura anterior del canal del aliesfenoides es de igual tamaño o más chico que el foramen oval accesorio. El foramen lacerado medio es abierto y se extiende hasta el proceso anterior del tegmen timpánico o está en continuación con la fenestra subescamosa. La circulación carotidea corresponde al patrón 3 (sensu Voss, 1988) con el foramen estapedial ausente. El tegmen timpánico no está sobrepuesto al proceso posterior del escamoso; el canal o surco timpánico es muy tenue. La fenestra subescamosa es más pequeña que el foramen postglenoides, cerrado o abierto en la parte posterior con un proceso hamular ligeramente grueso. Ambos forámenes tienen forma ovalada. El anillo ectotimpánico es cerrado; la lámina del malleus es rectangular y ligeramente profunda; el proceso brevis del yunque es largo pero no robusto y la apófisis orbicular es redonda como un espolón. Las crestas lambdoideas son muy pronunciadas. En la mandíbula, la cresta masetérica está ubicada a la altura del procíngulo del m1. El foramen mental está ubicado cerca al diastema. El proceso capsular del incisivo inferior es distinguible y con una apariencia ligeramente globosa y no en punta. La lámina sigmoidea es poco profunda. El margen ventral es ondulado. El proceso coronoides es falciforme y a la altura del proceso condilar; el proceso condilar es robusto y el proceso angular está al nivel del proceso condilar.

Fig. 3. Vista dorsal, ventral y lateral del cráneo y mandíbula de Eremoryzomys polius, topotipo (MUSM 4972). Escala = 10mm.
Los incisivos tienen una proyección ortodonte. Los molares son del tipo bunodonte y braquiodonte y no presentan crenulación. En el M1, el anterocono no se divide dentro de los cónulos labial y lingual, sin embargo presenta una foseta interna lo cual puede ser un remanente de flexo anteromedio; el anterolofo es muy desarrollado y está fusionado con el anteroestilo en el cíngulo labial; paralófulo presente; anterolófulo y protostilo ausente. En el M2 el protoflexo está presente pero es poco profundo; el mesoflexo presente y profundo; el mesolofo es pequeño con respecto a los otros molares. En el M3 se puede observar aún el hipoflexo (tendiendo a desaparecer con el desgaste). En la mandíbula el flexídeo anteromedio del m1 no está desarrollado y el anteroconido presenta fosetidos (en algunos solo un cónulido). El labiolófulido del m1 es perpendicular a la zona entre los lófidos labial y lingual llamado “murid anterior”. El anterolófido está presente en todos los molares inferiores. El mesolófido del m1 y m2 es desarrollado pero reducido o ausente en m3. El hipofléxido es muy marcado en todos los molares inferiores. Las raíces accesorias están ausentes en m1, m2 y m3. Las raíces anterior y posterior son largas.
Historia Natural.— Eremoryzomys polius habita en la cuenca alta del valle del río Marañón hacia el oeste de la cordillera Central del norte de Perú, entre 779 y 2205 m s.n.m. Esta zona se caracteriza por tener un clima cálido y seco (Cracraft 1985; Osgood 1914) y forma parte del ecosistema denominado Bosque Tropical Estacionalmente Seco (BTES) (sensu Linares-Palomino, 2004a; Sánchez et al., 2011). Este bioma se caracteriza por la presencia de diversas formaciones vegetales secas (e.g., cactáceas, fabáceas, etc.). Muchas de estas localidades están modificadas por campos de cultivos, lo que indicaría que dicho hábitat podría estar amenazado por el incremento de la población humana y la ganadería (Fig. 4). Ha sido registrada en simpatría con Aegialomys xanthaeolus, Phyllotis andium y Akodon mollis (A. Uturunco, com. pers.).

Fig. 4. Bosque premontano de Copallín, localidad tipo de Eremoryzomys mesocaudis sp. nov. (fotografiado por E. Arias el 26 de marzo del 2012).
Comentarios.— Eremoryzomys polius ha sido reportada también al norte de la Depresión de Huancabamba, en las localidades del Chaupe y San Ignacio, en el departamento de Cajamarca, por Watkins H. en 1923. Nosotros hemos examinado fotos del cráneo de dichos ejemplares (dos especímenes juveniles y un subadulto), encontrando cierta variabilidad que por la naturaleza de los ejemplares no es posible evaluar si corresponden a diferencias ontogenéticas o geográficas. Así mismo, también es necesario reexaminar la identidad del espécimen identificado como E. polius colectado en Amazonas, a 29 km sur del río Utcubamba y 38 km al este de Bagua, por Huey R. B. en 1967, incluyendo un mayor número de muestras de la zona. Nosotros solo pudimos obtener la fotografía de la piel del ejemplar en cuestión y en base a ello y por su ubicación creemos que se trataría de la especie nueva aquí descripta. Sin embargo, por el momento preferimos no innovar y mantener estas poblaciones bajo E. polius.
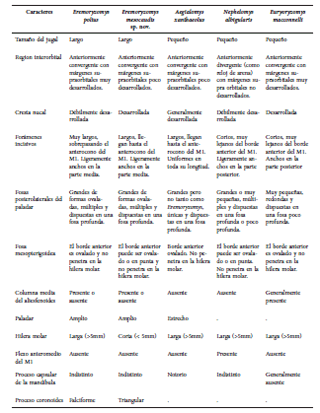
Comparaciones.— Las comparaciones entre Eremoryzomys polius, Aegialomys xanthaeolus y otros orizomyinos cercanos a su distribución se resumen en la Tabla 4.
Tabla 4 Comparaciones morfológicas entre orizomyinos adultos presentes en el valle del Marañón, Perú. x= promedio.


Eremoryzomys mesocaudis sp. nov. (Figs. 5, 6)

Fig. 5. Eremoryzomys mesocaudis sp. nov., holotipo (MUSM 41463) fotografiado en el momento de su captura (izquierda) y una vista de la planta de la pata posterior mostrando la coloración negruzca y disposición de las almohadillas tenar e hipotenar (derecha, abajo).

Fig. 6. Vista dorsal, ventral y lateral del cráneo y mandíbula de Eremoryzomys mesocaudis sp. nov., holotipo (MUSM 41463). Escala = 10 mm.
Holotipo.— MUSM 41463, hembra adulta con piel, cráneo y carcasa; colectado el 23 de enero del 2012 por Edith Arias (Fig. 6).
Localidad tipo.— Copallín, (5° 41’S, 78° 25’W, 817 m, departamento Amazonas, provincia de Bagua) (localidad 13 en Fig. 1).
Paratipos.— MUSM 41462-68, colectados por E. Arias del 23 al 25 de enero del 2012 en la localidad tipo. MUSM 41488-505, colectados por E. Arias y D. Aybar del 26 al 28 de marzo del 2012 en la localidad tipo.
Distribución.— Esta especie es conocida en los bosques premontanos de las localidades de Casual, Achaguay y Copallín (localidad tipo) de la provincia de Bagua departamento de Amazonas y Chiñuña, provincia Utcubamba, departamento de Amazonas, entre los 463 m a 859 m de elevación (Fig. 1). Estas localidades se encuentran en la parte baja del río Utcubamba, y en la cuenca media del río Marañón.
Diagnosis.— Eremoryzomys mesocaudis es un sigmodontino de la tribu Oryzomyini (Rodentia, Cricetidae) que se caracteriza por la siguiente combinación de caracteres: es de tamaño mediano (LT = 256 mm en promedio), la cola es más corta o de igual longitud cabeza-cuerpo; las vibrisas mistaciales son cortas y llegan apenas al borde anterior del pabellón de la oreja; el tamaño del pelo dorsal es corto (![]() = 9.12 mm). No presenta un espacio notorio entre las almohadillas tenar e hipotenar. La coloración del pelaje dorsal es marrón-canela (Color 33); la cola es moderadamente contrastante, con la base ventral clara y oscureciéndose hacia la punta; la planta de las patas posteriores es de color negruzco o ligeramente oscuro y en el centro de la nariz tiene una línea medial negra pronunciada. El cráneo es pequeño con un rostro corto y no robusto (LTC = 32.03 y ACI = 16.77, en promedio); el interorbital es anteriormente convergente con márgenes supraorbitales poco desarrollados; el arco cigomático tiene un perfil triangular y la cresta nucal es sobresaliente. Los forámenes incisivos llegan hasta el anterocono del M; la hilera molar es corta (LHM = 4.82 en promedio); el borde anterior de la fosa mesopterigoidea puede ser ovalado o en punta. En la mandíbula el proceso coronoides es triangular y está al mismo nivel del proceso condilar; el proceso capsular es poco desarrollado.
= 9.12 mm). No presenta un espacio notorio entre las almohadillas tenar e hipotenar. La coloración del pelaje dorsal es marrón-canela (Color 33); la cola es moderadamente contrastante, con la base ventral clara y oscureciéndose hacia la punta; la planta de las patas posteriores es de color negruzco o ligeramente oscuro y en el centro de la nariz tiene una línea medial negra pronunciada. El cráneo es pequeño con un rostro corto y no robusto (LTC = 32.03 y ACI = 16.77, en promedio); el interorbital es anteriormente convergente con márgenes supraorbitales poco desarrollados; el arco cigomático tiene un perfil triangular y la cresta nucal es sobresaliente. Los forámenes incisivos llegan hasta el anterocono del M; la hilera molar es corta (LHM = 4.82 en promedio); el borde anterior de la fosa mesopterigoidea puede ser ovalado o en punta. En la mandíbula el proceso coronoides es triangular y está al mismo nivel del proceso condilar; el proceso capsular es poco desarrollado.
Descripción.— Eremoryzomys mesocaudis es un orizomyino de tamaño mediano (LT promedio = 256 mm). El pelo de cobertura es de tamaño corto (![]() = 9.12 mm) y de aspecto lacio tosco; presenta en el centro del hocico una línea negra. Las orejas son cortas con un antitrago estrecho. Las vibrisas mistaciales son cortas y llegan hasta el borde anterior de la oreja. Las patas anteriores tienen las garras curvadas con la base cerrada. Las patas posteriores tienen las almohadillas desarrolladas; el hipotenar es redondo y notorio, ubicado debajo de la almohadilla interdigital IV; el tenar es alargado, ubicado debajo de la almohadilla interdigital I y muy cercano al hipotenar. Los pelos ungueales en las patas anteriores son largos y llegan hasta la punta de las garras o las sobrepasa ligeramente; en las patas posteriores los pelos ungueales no sobrepasan las garras. La cola es menor o casi igual que la longitud cabeza-cuerpo (97% en el holotipo y 95% en nuestros especímenes) y presenta escamas pequeñas. Los pelos de la base de la cola llegan hasta 7 mm de largo aproximadamente. La hembra tiene cuatro pares de mamas, un par axial, uno pectoral, uno abdominal y otro inguinal. La coloración del pelaje dorsal es de color marrón-canela (Color 33); el pelaje ventral está entre los colores neutral ligero (Color 85) y gris neutral pálido (Color 86) con pelos de la base negro o gris. La coloración dorsal y ventral de las patas anteriores es blanquecina mientras que en las patas posteriores la coloración dorsal es blanquecina con una mancha metatarsal marrón tenue y la coloración ventral puede ser negruzca o ligeramente oscura; los pelos ungueales de las patas posteriores son de color crema. La cola es débilmente bicoloreada con el dorso fusco (Color 21) y la parte ventral glauco (Color 79) que se va oscureciendo a medida que se acerca a la punta de la cola.
= 9.12 mm) y de aspecto lacio tosco; presenta en el centro del hocico una línea negra. Las orejas son cortas con un antitrago estrecho. Las vibrisas mistaciales son cortas y llegan hasta el borde anterior de la oreja. Las patas anteriores tienen las garras curvadas con la base cerrada. Las patas posteriores tienen las almohadillas desarrolladas; el hipotenar es redondo y notorio, ubicado debajo de la almohadilla interdigital IV; el tenar es alargado, ubicado debajo de la almohadilla interdigital I y muy cercano al hipotenar. Los pelos ungueales en las patas anteriores son largos y llegan hasta la punta de las garras o las sobrepasa ligeramente; en las patas posteriores los pelos ungueales no sobrepasan las garras. La cola es menor o casi igual que la longitud cabeza-cuerpo (97% en el holotipo y 95% en nuestros especímenes) y presenta escamas pequeñas. Los pelos de la base de la cola llegan hasta 7 mm de largo aproximadamente. La hembra tiene cuatro pares de mamas, un par axial, uno pectoral, uno abdominal y otro inguinal. La coloración del pelaje dorsal es de color marrón-canela (Color 33); el pelaje ventral está entre los colores neutral ligero (Color 85) y gris neutral pálido (Color 86) con pelos de la base negro o gris. La coloración dorsal y ventral de las patas anteriores es blanquecina mientras que en las patas posteriores la coloración dorsal es blanquecina con una mancha metatarsal marrón tenue y la coloración ventral puede ser negruzca o ligeramente oscura; los pelos ungueales de las patas posteriores son de color crema. La cola es débilmente bicoloreada con el dorso fusco (Color 21) y la parte ventral glauco (Color 79) que se va oscureciendo a medida que se acerca a la punta de la cola.
El cráneo es mediano (LTC = 32.03 mm en promedio) en comparación con otros orizomyinos, de rostro corto, no robusto y caja craneal redondeada donde resalta la cresta nucal. Los nasales tienen el borde anterior muy ensanchado y su extremo posterior sobrepasa la sutura maxilar-frontal-lacrimal (MFL). Los premaxilares sobrepasan la muesca cigomática y ligeramente los nasales; la juntura premaxilar-maxilar-frontal (PMF) es posterior a la muesca cigomática pero no sobrepasa al MFL. La muesca cigomática es abierta y profunda con una espina moderada muy pronunciada, en algunos casos puede ser pequeña (17% de los especímenes observados). El arco cigomático tiene un perfil triangular. El yugal es largo y delgado. El puente orbital anterior representa aproximadamente la cuarta parte de la profundidad del rostro. La región interorbitaria es anteriormente convergente, con bordes marcados y márgenes supraorbitales débilmente redondeados, la base de los molares visible en una vista dorsal. Los lacrimales son elongados y sujetos al maxilar y frontal. Los parietales tienen ligeras expansiones laterales. El interparietal es delgado en forma de “V” y alargado en los extremos. Las crestas temporales no son desarrolladas. El diastema es recto. Los forámenes incisivos son largos y sobrepasan el margen anterior del M1 pero nunca su protoflexo. El paladar es largo, ancho y de superficie rugosa extendiéndose más allá del margen posterior del M3, con el foramen posterior del palatino ubicado a la altura del protocono del M2. Las fosas posterolaterales del paladar son ovaladas y múltiples dispuestas en una fosa profunda y se extienden hasta la altura del hipocono del M3. La fosa mesopterigoidea es ligeramente ancha con márgenes paralelos, con el borde anterior ovalado o en punta, no penetrando a la hilera molar. La fosa parapterigoidea es triangular y profunda. La bula timpánica es de aspecto brilloso con un proceso periótico delgado que se extiende posteriormente entre el ectotimpánico y el basioccipital. El tubo de Eustaquio es largo y tubular. El proceso anterior del ectotimpánico cuenta con dos espinas: una con terminación en punta y la otra ancha y sin punta. La fenestra de la capsula mastoidea es pequeña o grande.
En una vista lateral, los etmoturbinales, forámenes etmoides y esfeno palatino son de tamaño pequeño; los forámenes etmoides y esfeno palatino están ubicados generalmente a la altura del M2; el foramen óptico está ubicado a la altura del M3 y es más grande que este. La columna media del aliesfenoides puede estar presente o ausente con igual frecuencia en ambos casos. La abertura anterior del canal del aliesfenoides puede ser de igual tamaño o más chico que el foramen oval accsesorio. La fenestra subescamosa es abierta en la parte posterior. El tegmen timpánico no está sobrepuesto al proceso posterior del escamoso; el canal o surco timpánico es notorio. La fenestra subescamosa es más pequeña que el foramen postglenoide y puede estar cerrado o abierto en su parte posterior. El anillo ectotimpánico está generalmente cerrado; la lámina del malleus es rectangular y ligeramente profunda; el proceso brevis del yunque es largo pero no robusto y la apófisis orbicular es redondeada como un espolón. Las crestas lambdoideas no son pronunciadas. En la mandíbula, la cresta masetérica está ubicada a la altura del procíngulo del m1. El foramen mental está ubicado cerca al diastema. El proceso capsular del incisivo inferior es ligeramente globoso. La lámina sigmoidea es poco profunda. El margen ventral es ondulado. El proceso coronoides es triangular. El proceso condilar es robusto y generalmente a la misma altura del proceso angular.
Los incisivos tienen una proyección ortodonte. Los molares son del tipo bunodonte y braquiodonte y no presentan crenulación. En el M1, el anteroconopresenta una foseta interna la cual puede ser un remanente de flexo anteromedio; el anterolofo es muy desarrollado y está fusionado con el anteroestilo en el cíngulo labial; el paralófulo y anterolófulo están ausentes. En el M2 el mesolofo es pequeño con respecto a los otros molares. En el M3 se puede observar aún el hipoflexo (tendiendo a desaparecer con el desgaste). En la mandíbula el flexídeo anteromedio del m1 no está desarrollado y el anterocónido no presenta fosetidos (en algunos solo un cónulido). El labiolófulido del m1 es perpendicular a la zona entre los lófidos labial y lingual llamado “murid anterior”. El anterolófido está presente en todos los molares. El mesolófido del m2 es desarrollado pero reducido o ausente en los molares m1 y m3. El hipofléxido es muy marcado en todos los molares. Las raíces accesorias están ausentes en m1, m2 y m3. Las raíces anterior y posterior son largas.
Etimología.— El nombre específico mesocaudis deriva de las palabra griega meso (medio) y caudis (cola), en referencia al tamaño de la cola (menor o igual al tamaño del cuerpo).
Historia Natural.—Los especímenes de Eremoryzomys mesocaudis fueron capturados en trampas de golpe y de captura viva (tipo Sherman) colocadas a nivel del suelo en el interior del bosque durante los meses de enero y marzo en el 2012. Eremoryzomys mesocaudis fue registrado durante las épocas seca y húmeda. Las zonas evaluadas presentan un hábitat de transición entre bosque seco y bosque montano alto, denominado bosque premontano y se caracterizan principalmente por ser áreas boscosas abiertas conformadas por árboles delgados y espaciados, con dosel de 10 m, sotobosque con arbustos de gran tamaño (2 m aprox.) y poca densidad junto con herbáceas de tamaño corto. No hay presencia de epífitos vasculares, pero sí de epífitos avasculares (líquenes). El suelo presenta escasa materia orgánica. Las plantas representativas para este hábitat son Pteridium, Adiantopsis, Salvia, Anthurium, Desmodium, algunas Bambusoideae y arbustos como Cybianthus y Clusia (N. Vega, com. pers.) (Fig. 4). Estas zonas también presentan vegetación secundaria, destacando los cultivos de cacao y arroz; además de evidenciarse la presencia de poblados cercanos, excepto en Achaguay. Otra especie de roedor capturada en esta región fue Aegialomys xanthaeolus. Ambas especies se registraron solo en la localidad de Achaguay.
Comparaciones.— Por su distribución y similitud morfológica, Eremoryzomys mesocaudis es comparado con Eremoryzomys polius y Aegialomys xanthaeolus.
Eremoryzomys mesocaudis tiene una distribución adyacente con E. polius y se distingue principalmente por ser de menor tamaño en casi todas las medidas consideradas (Tabla 3). Morfológicamente se distingue por una sumatoria de rasgos que se resumen en la Tabla 4; destacándose, además del tamaño del cuerpo y largo de la cola (Fig. 7), algunas diferencias en las longitudes de huesos craneanos (e.g., nasal, forámenes incisivos) y el desarrollo de la cresta nucal y el proceso coronoides (Fig. 8). Así mismo, la hilera molar es más corta en E. mesocaudis (LHM 4.82 mm vs. 5.54 mm en promedio) y el M1 no presenta anterolofo mientras que E. polius sí los presenta; el paralófulo está ausente; el mesolófido del m2 es más desarrollado en especímenes juveniles que en E. polius (Fig. 9).

Fig. 7. Vistas dorsal (izquierda) y ventral (derecha) de la piel de Eremoryzomys polius (MUSM 4972, A) y E. mesocaudis sp. nov. (MUSM 41463, B). Nótese la cola relativamente más grande en E. polius. Escala = 50 mm.

Fig. 8. Comparación de caracteres discretos en la anatomía craneana de Eremoryzomys mesocaudis sp. nov. (MUSM 41463) y Eremoryzomys polius (MUSM 4972) (de izquierda a derecha). Nótese que: a) el nasal es más corto y ancho en la parte anterior en E. mesocaudis sp. nov. mientras que el desarrollo de la región supraorbital es mayor en E. polius; b) la longitud de los forámenes incisivos es mayor en E. polius; c) el desarrollo de la cresta nucal es más notorio en E. mesocaudis sp. nov.; d) la forma del proceso coronoides de la mandíbula es triangular en E. mesocaudis sp. nov. y falciforme en E. polius. Escala = 5 mm.

Fig. 9. Hilera molar superior en especímenes adultos (edad 3) de Eremoryzomys mesocaudis sp. nov. (MUSM 41463, izquierda) y E. polius (MUSM 4972, derecha). a) Comparación de la longitud de las hileras molares. b) el mesolófido (flecha) del m2 está más desarrollado en especímenes juveniles (edad 1) de E. mesocaudis sp. nov. (MUSM 41496, izquierda) que en E. polius de edad comparable (MUSM 4973, derecha).
Eremoryzomys mesocaudis tiene una distribución simpátrica con Aegialomys xanthaeolus y puede ser confundido por el tamaño mediano y la bicoloración de la cola levemente marcada que presentan ambos, pero se distinguen en varios aspectos descritos en la Tabla 4, entre ellos: el pelaje dorsal más oscuro en E. mesocaudis y con tonos menos amarillentos que en A. xanthaeolus, la planta de las patas posteriores negruzca versus marrón claro o blanco de A. xanthaeolus. Eremoryzomys mesocaudis presenta una línea negra al centro de la punta de la nariz, que está ausente en A. xanthaeolus. En E. mesocaudis el arco cigomático es triangular versus subrectangular en A. xanthaeolus, el jugal es más largo en E. mesocaudis que en A. xanthaeolus, la columna media del aliesfenoides puede estar presente o ausente en E. mesocaudis mientras que en A. xanthaeolus está ausente; E. mesocaudis tiene el paladar más amplio y la hilera dental más corta que A. xanthaeolus (LHM 4.82 mm vs 5.14 mm en promedio). En la mandíbula, el proceso capsular de E. mesocaudis es indistinto versus notorio en A. xanthaeolus.
DISCUSIÓN
La historia taxonómica de Eremoryzomys polius es corta, debido a los pocos ejemplares y estudios disponibles para esta especie. La primera descripción morfológica detallada fue realizada por Weksler et al. (2006), que reconoció a Eremoryzomys como un género monotípico en base a una serie de 5 ejemplares, entre juveniles y subadultos, provenientes de unas pocas localidades de la cuenca alta del río Marañón. Más recientemente, Percequillo (2015a) describió el género también en base a 5 ejemplares (un adulto y el resto juveniles y subadultos), señalando que E. polius era conocida para solo siete localidades distribuidas entre Amazonas y Cajamarca. Sin embargo, nuestros resultados, basados en un mayor número de especímenes (n = 61), demuestran que Eremoryzomys tiene una distribución más amplia en la cuenca del río Marañón, llegando hasta La Libertad (Fig. 1) y que no corresponde a un género monotípico.
La presente redescripción de E. polius, tomada de ejemplares adultos, presenta variaciones con los caracteres descritos por Percequillo (2015a), incluyendo la longitud total y de la cola, contraste de coloración de la cola, longitud del pelaje dorsal del cuerpo, tamaño de las vibrisas, relación entre las almohadillas tenar e hipotenar y longitud de los forámenes incisivos, entre otros.
Nuestro estudio también indica que las poblaciones de Eremoryzomys polius de Chaupe y San Ignacio, registradas en Cajamarca (Weksler, 2006; Percequillo et al., 2011; Percequillo, 2015a), ameritan una inspección más amplia y profunda. Estos especímenes fueron colectados hace 93 años y al día de hoy no se conocen otros registros de E. polius en dichas localidades. Por otro lado, estas poblaciones limitan al oeste con el río Marañón y al norte con la Depresión de Huancabamba, consideradas como dos grandes barreras geográficas para especies de aves (Vuilleumier, 1969; Parker et al., 1985; Sánchez, 2003), anfibios y reptiles (Duellman, 1979; Cadle, 1991; Duellman y Wild, 1993). Esto también se observa en mamíferos grandes y pequeños, como en la distribución de Callicebus cupreus cupreus, presente solo al este del río Ucayali (Hershkovitz, 1990; Pacheco, 1991), Aotus nancymaae, distribuida al sur del río Amazonas (Hershkovitz, 1983), Cacajao calvus ucayalii, al sur del río Amazonas entre los ríos Ucayali y Yavarí (Hershkovitz, 1987), Lestoros inca, conocida solo al sur del río Urubamba (Gardner, 1993), Phyllotis definitus, presente solo al sur del río Santa (Pearson, 1982; Pacheco et al., 2014) y Cryptotys peruviensis, registrada solo al norte de la depresión de Huancabamba (Vivar et al., 1997; Pacheco et al., 2009). Sin embargo, hay casos de mamíferos en donde dichas barreras geográficas no habrían sido obstáculo para la migración de especies, tales los casos de Tapirus pinchaque (Jiménez et al., 2010), Caenolestes caniventer (Lunde y Pacheco, 2003), Sturnira erythromos (Pacheco y Patterson, 1992) y algunas especies del género Artibeus (Patterson et al., 1992). Asimismo, otra población que merece un estudio con mayor cantidad de muestras es aquella de Amazonas, a 29 km al sur del río Utcubamba y 38 km al este de Bagua. De esta población solo se conserva un ejemplar de hace 49 años, del cual solo pudimos obtener una fotografía de la piel y que creemos se trataría de Eremoryzomys mesocaudis. Sin embargo, por el momento se mantiene la referencia de esta población a E. polius, siguiendo a Percequillo et al. (2011).
La ampliación de la distribución de Eremoryzomys aquí reportada, que abarca hábitats de bosque seco y premontano de la cuenca alta y media del río Marañón, desde La Libertad hasta el norte de Amazonas, evidencia la importancia de este río como un centro de endemismo y como objeto para la conservación de sus hábitats, particularmente la cuenca alta, que comprende desde las nacientes del mismo río hasta la desembocadura del río Chamaya (Iberico y Peñaherrera del Águila, 1986). En este sector se distribuyen varias especies amenazadas y no protegidas de plantas, aves, anfibios y mamíferos (Josse et al., 2013).
El valle del río Marañón es el más largo y profundo de los valles interandinos (Weberbauer, 1945); está ubicado al noroeste del Perú y es considerado un centro de endemismo para muchos géneros de plantas (León, 2006; Marcelo-Peña, 2007, 2008), aves (Porzecanski y Cracraft, 2005; Roncal et al., 2010; García- Bravo, 2011), reptiles (Koch et al., 2006; Koch et al., 2011; Venegas et al., 2008) y mamíferos (Koopman, 1978; Patterson, 1999; Shanee et al., 2013). Teniendo en cuenta que los centros de endemismo pueden indicar áreas de alta diversificación y especiación (Pacheco, 2002; Vergara et al., 2006), es imperioso el estudio detallado de su biota para generar planes de manejo y conservación adecuados (Ippi y Flores, 2001; Brooks et al., 2006).
Finamente, queremos destacar que estudios recientes, basados en análisis morfológicos cualitativos y cuantitativos, han contribuido a aumentar el número de especies de roedores reconocidas para Perú, a partir de la descripción de nuevas especies (e.g., Akodon josemariarguedasi [Jiménez et al., 2013], Phyllotis pearsoni [Pacheco et al., 2014], Calomys chinchilico y Calomys achaku [Zevallos et al., 2014], Phyllotis occidens [Rengifo y Pacheco, 2015]). Muchas de estas especies corresponden a colectas recientes, lo que demuestra la necesidad de continuar realizando trabajos de campo, especialmente en áreas todavía poco prospectadas.
AGRADECIMIENTOS
Nuestro agradecimiento a los miembros del Departamento de Mastozoología del Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, especialmente a C. Barriga y P. Sánchez por su ayuda con el diseño del mapa y a J. Pacheco y R. Barzega con las imágenes. Así mismo a C. Jiménez, E. Vivar y N. Hurtado por sus comentarios, que fueron importantes durante el desarrollo de este estudio. Un especial agradecimiento al Dr. Bruce Patterson, por su gentileza al proporcionar fotos de Eremoryzomys polius de la colección del Field Museum; así como también al gerente del proyecto Estudio de Impacto Ambiental para la Prospección Sísmica 2D y Perforación de 02 Pozos de Exploración en el Lote 145 Zona 1, Alfonso Reynaga, de la consultora Environmental Resources Management (ERM), quien autorizó el permiso para publicar los datos de colecta. También a P. Velazco, investigador del AMNH, y C. Tello, investigador del MUSM, por haber tomado fotos y medidas craneanas de ejemplares de E.polius del American Museum of Natural History. Igualmente a E. Rengifo y N. Hurtado, investigadores del MUSM, por haber tomado fotos y medidas craneanas de ejemplares de E.polius del Museum of Vertebrate Zoology y The Field Museum respectivamente. A las biólogas E. Arias y N. Vega por brindarnos información necesaria para la descripción del hábitat de la nueva especie.
LITERATURA CITADA
1. BROOKS T, R MITTERMEIER, G DA FONSECA, J GERLACH, M HOFFMANN, J LAMOREUX, C MITTERMEIER, J PILGRIM y A RODRIGUES. 2006. Global biodiversity conservation priorities. Science 313:58-61. [ Links ]
2. CADLE JE. 1991. Systematics of the lizards of the genus Stenocercus (Iguania: Tropiduridae) from northern Peru: New species and comments on the relationships and distribution patterns. Proceedings of the Academy of Natural Sciences of Philadelphia 143:1-96. [ Links ]
3. CARLETON MD y GG MUSSER. 1989. Systematic studies of Oryzomyine rodents (Muridae, Sigmodontinae): A synopsis of Microryzomys. Bulletin of the American Museum of Natural History 191:1-83 [ Links ]
4. CRACRAFT J. 1985. Historical biogeography and patterns of differentiation within the South American avifauna: Areas of endemism. American Ornithologists Union, Ornithological Monographs 36:49-84. [ Links ]
5. D´ELÍA G, UFJ PARDIÑAS, P TETA y JL PATTON. 2007. Definition and diagnosis of a new tribe of sigmodontine rodents (Cricetidae: Sigmodontinae), and a revised classification of the subfamily. Gayana 71:187-94. [ Links ]
6. DUELLMAN WE. 1979. The herpetofauna of the Andes: Patterns of distribution, origin, differentiation, and present communities. Pp. 371-459, in: The South American herpetofauna: Its origin, evolution, and dispersal (WE Duellman, ed.). Monographs of the Museum of Natural History University of Kansas. [ Links ]
7. DUELLMAN WE y ER WILD. 1993. Anuran amphibians from the Cordillera de Huancabamba, northern Peru: Systematics, ecology, and biogeography. Occasional Papers of the Museum of Natural History of the University of Kansas, Lawrence 157:1-53. [ Links ]
8. GARCÍA-BRAVO A. 2011. Amenazas y conservación del hábitat de gorrión Jaeno (Incaspiza watkinsi) en Cajamarca y Amazonas-Perú. Boletín informativo UNOP 6:8-13. [ Links ]
9. GARDNER AL. 1993. Order Paucituberculata. Pp. 25, en: Mammals species of the world: A taxonomic and geographic reference. Second edition (DE Wilson and DM Reeder, eds. [ Links ]).
10. HERSHKOVITZ P. 1983. Two new species of night monkeys, genus Aotus (Cebidae, Platyrrhini): A preliminary report on Aotus taxonomy. American Journal of Primatology 4:209-243. [ Links ]
11. HERSHKOVITZ P. 1987. Uacaries, New World monkeys of the genus Cacajao (Cebidae, Platyrrhini): A preliminary taxonomic review with the description of a new subspecies. American Journal of Primatology 12:1-53. [ Links ]
12. HERSHKOVITZ P. 1990. Titis, New World monkeys of the genus Callicebus (Cebidae, Platyrrhini): A preliminary taxonomic review. Fieldiana Zoology 55:1-109. [ Links ]
13. IBERICO M y C PEÑAHERRERA DEL ÁGUILA. 1986. Gran geografía del Perú. Naturaleza y Hombre I. Manfer-Juan Mejía Baca, Barcelona. [ Links ]
14. IPPI S y V FLORES. 2001. Las tortugas neotropicales y sus áreas de endemismo. Acta Zoológica Mexicana 84:49-63. [ Links ]
15. JIMÉNEZ CF, V PACHECO y D VIVAS. 2013. An introduction to the systematics of Akodon orophilus Osgood, 1913 (Rodentia: Cricetidae) with the description of a new species. Zootaxa 3669:223-242. [ Links ]
16. JIMÉNEZ CF, H QUINTANA, V PACHECO, D MELTON, J TORREALVA y G TELLO. 2010. Camera trap survey of medium and large mammals in a montane rainforest of northern Peru. Revista Peruana de Biología 17:191-196. [ Links ]
17. JOSSE C, B YOUNG, R LYONS-SMYTH, T BROOKS, A FRANCES, P COMER, P PETRY, H BALSLEV, B BASSUNER, B GOETTSCH, J HAK, P JØRGENSEN, et al.. 2013. Desarrollo de insumos para la toma de decisiones de conservación en la cuenca amazónica occidental. Ecología Aplicada 12:45-65. [ Links ]
18. KOCH C, PJ VENEGAS y W BÖHME. 2006. A remarkable discovery: Description of a big-growing new gecko (Squamata: Gekkonidae: Phyllopezus) from northwestern Peru. Salamandra 42:145-150. [ Links ]
19. KOCH C, PJ VENEGAS, A GARCIA-BRAVO y W BÖHME. 2011. A new bush anole (Iguanidae: Polychrotinae: Polychrus) from the upper Marañón basin, Peru, with a redescription of Polychrus peruvianus (Noble, 1924) and additional information on P. gutturosus Berthold, 1845. Zookeys 141:79-107. [ Links ]
20. KOOPMAN KF. 1978. Zoogeography of Peruvian bats with special emphasis on the role of the Andes. American Museum Novitates 2651:1-6. [ Links ]
21. LEÓN B. 2006. Clusiaceae endémicas del Perú. Revista Peruana de Biología 13:261-264. [ Links ]
22. LINARES-PALOMINO R. 2004a. Los Bosques Tropicales Estacionalmente secos: I. El concepto de los Bosques Secos en el Perú. Arnaldoa 11:85-102. [ Links ]
23.LINARES-PALOMINO R. 2004b. Los Bosques Tropicales Estacionalmente secos: II. Fitogeografía y Composición Florística. Arnaldoa 11:119-121. [ Links ]
24. LUNDE DP y V PACHECO. 2003. Shrew opossums (Paucituberculata: Caenolestes) from the Huancabamba region of east Andean Peru. Mammal Study 28:145- 148. [ Links ]
25. MALYGIN V, V ANISKIN, S ISAEV y A MILISHNIKOV. 1994. Amphinectomys savamis Malygin gen. et sp. n., a new species and a new genus of water rat (Cricetidae, Rodentia) from Peruvian Amazonia. Zoologicheskii Zhurnal 73:195-208. [ Links ]
26. MARCELO-PEÑA JL. 2008. Vegetación leñosa, endemismos y estado de conservación en los bosques estacionalmente secos de Jaén, Perú. Revista Peruana de Biología 15:43-52. [ Links ]
27. MARCELO-PEÑA JL, C REYNEL-RODRÍGUEZ, P ZEVALLOS-POLLITO, F BULNES-SORIANO y A PÉREZ-OJEDA DEL ARCO. 2007. Diversidad, composición florística y endemismos en los bosques estacionalmente secos alterados del distrito de Jaén, Perú. Ecología Aplicada 6:9-22. [ Links ]
28. MINISTERIO DE AGRICULTURA Y RIEGO – MINAGRI. 2014. Decreto Supremo N° 004 - 2014 – MINAGRI. Lista de especies amenazadas de fauna silvestre legalmente protegidas. Lima. Perú.
29. MUSSER GG, MD CARLETON y AL GARDNER. 1998. Systematic studies of Oryzomyine Rodents (Muridae, Sigmodontinae): Diagnoses and distributions of species formerly assigned to Oryzomys ‘‘capito’’. Bulletin of The American Museum of Natural History 236:1-376.
30. OSGOOD WH. 1913. New Peruvian mammals. Field Museum of Natural History, Zoological Series 10:97-98. [ Links ]
31. OSGOOD WF. 1914. Mammals of an expedition across Northern Perú. Publications of the Field Museum of Natural History, Zoological Series 176:159-160. [ Links ]
32. PACHECO V. 1991. A new species of Scolomys (Muridae: Sigmodontinae) from Perú. Publicaciones del Museo de Historia Natural, Universidad Nacional Mayor de San Marcos (A) 37:1-3. [ Links ]
33. PACHECO V. 2002. Mamíferos del Perú. Pp. 503-550, en: Diversidad y conservación de los mamíferos neotropicales (G Ceballos y J Simonetti, eds). CONABIO-UNAM. México, D.F [ Links ]
34. PACHECO V. 2003. Phylogenetic analyses of the Thomasomyini (Muroidea: Sigmodontinae) based on morphological data. Tesis de doctorado, Facultad de Biología, Universidad de New York, New York. [ Links ]
35. PACHECO V y BD PATTERSON. 1992. Systematics and biogeographic analyses of four species of Sturnira (Chiroptera: Phyllostomidae), with emphasis on Peruvian forms. Pp. 57-81, en: Biogeografía, Ecología y conservación del bosque montano en el Perú (KR Young y N Valencia, eds.). Memorias del Museo de Historia Natural UNMSM 21. [ Links ]
36. PACHECO V, EM. RENGIFO y D VIVAS. 2014. A new species of leaf-eared mouse, genus Phyllotis Waterhouse, 1837 (Rodentia: Cricetidae) from northern Peru. Therya 5:481-508. [ Links ]
37. PACHECO V, H ZEBALLOS, E VIVAR y M WEKSLER. 2008. Eremoryzomys polius. In: IUCN 2012. IUCN Red List of Threatened Species. Version 2012.1. [ Links ]
38. PACHECO V, R CADENILLAS, E SALAS, C TELLO y H ZEBALLOS. 2009. Diversidad y endemismo de los mamíferos del Perú. Revista Peruana de Biología 16:5-32. [ Links ]
39. PARKER TA, TS SCHULENBERG, G R GRAVES y MJ BRAUN. 1985. The avifauna of the Huancabamba region, northern Peru. Ornithological Monographs 36:169-197. [ Links ]
40. PATTERSON BD. 1999. Contingency and determinism in mammalian biogeography: The role of history. Journal of Mammalogy 80:345-360. [ Links ]
41. PATTERSON BD, V PACHECO y MV ASHLEY. 1992. On the origins of the western slope region of endemism: Systematics of fig-eating bats, genus Artibeus. Pp. 189-205, en: Biogeografía, ecología y conservación del bosque montano en el Perú (KR Young y N Valencia, eds.). Memorias del museo de Historia Natural 21. [ Links ]
42. PATTON JL, UFJ PARDIÑAS y G D’ELÍA. 2015. Mammals of South America, Volume 2 - Rodents. The University of Chicago Press, Chicago, Illinois.
43. PEARSON OP. 1982. Distribución de pequeños mamíferos en el altiplano y los desiertos de Perú. Pp. 263-284, en: Zoología Neotropical (P Salinas, ed.). Actas del VIII Congreso Latinoamericano de Zoología. [ Links ]
44. PERCEQUILLO AR. 2015a. Genus Eremoryzomys. Pp. 310-312, en: Mammals of South America, Volume 2: Rodents (JL Patton, UFJ Pardiñas, G D’Elía, eds.). University of Chicago Press, Chicago.
45. PERCEQUILLO AR. 2015b. Genus Drymoreomys. Pp. 308-310, en: Mammals of South America, Volume 2: Rodents (JL Patton, UFJ Pardiñas, G D’Elía, eds.), University of Chicago Press, Chicago.
46. PERCEQUILLO AR, E HINGST-ZAHER y CR BONVICINO. 2008. Systematic review of genus Cerradomys Weksler, Percequillo and Voss, 2006 (Rodentia: Cricetidae: Sigmodontinae: Oryzomyini), with description of two new species from Eastern Brasil. American Museum Novitiates, 3622:1-46. [ Links ]
47. PERCEQUILLO AR, M WEKSLER y LP COSTA. 2011. A new genus and species of rodent from the Brazilian Atlantic Forest (Rodentia: Cricetidae: Sigmodontinae: Oryzomyini), with comments on oryzomyine biogeography. Zoological Journal of the Linnean Society 161:357–390.
48. PORZECANSKI AL y J CRACRAFT. 2005. Cladistic Analysis of Distributions and Endemism (CADE): Using raw distributions of birds to unravel the biogeography of the South American aridlands. Journal of Biogeography 32:261-275. [ Links ]
49. PRADO JR y AR PERCEQUILLO. 2011. Ontogenetic and sexual variation in cranial characters of Aegialomys xanthaeolus (Thomas, 1894) (Cricetidae: Sigmodontinae) from Ecuador and Peru. Papéis Avulsos de Zoologia 51:155-177. [ Links ]
50. RENGIFO EM y VR PACHECO. 2015. Taxonomic revision of the Andean leaf-eared mouse, Phyllotis andium Thomas 1912 (Rodentia: Cricetidae), with the description of a new species. Zootaxa 4018:349-380. [ Links ]
51. RONCAL MR, ED DÍAZ y C RONCAL. 2010. Caracterización de los componentes físico y biológico de la Reserva Ecológica Huacaybamba Cerro Cedropata, Celendín. Revista Científica de la Escuela de Postgrado de la Universidad Nacional de Cajamarca Fiat Lux 6:15-21. [ Links ]
52. SÁNCHEZ C. 2003. Taxonomy, phylogeny, and biogeography of the Andean hummingbird genera Coeligena LESSON, 1832; Pterophanes GOULD, 1849; Ensifera LESSON 1843; and Patagona GRAY, 1840 (Aves: Trochiliformes). Tesis de doctorado, Facultad de Matemáticas y Ciencias Naturales, Universidad de Bonn Rheinischen Friedrich-Wilhelms, Alemania. [ Links ]
53. SÁNCHEZ HJ, GJ OCHOA y RS VOSS. 2001. Rediscovery of Oryzomys gorgasi (Rodentia: Muridae). With notes on taxonomy and natural history. Mammalia 65:205-21. [ Links ]
54. SÁNCHEZ MR, JT CASTRO, CL DURÁN, OP GRANDA y D QUEVEDO. 2011. Características edáficas y composición florística del bosque estacionalmente seco La Menta y Timbes, Región Piura, Perú. Ecología Aplicada 10:61-74. [ Links ]
55. SHANEE S, N SHANEE y N ALLGAS-MARCHENA. 2013. Primate Surveys in the Marañón-Huallaga landscape, northern Peru with notes on conservation. Primate Conservation 27:3-11. [ Links ]
56. SMITHE FB. 1975. Naturalist’s color guide. American Museum of Natural History, New York.
57. STEPPAN S. 1995. Revision of the tribe Phyllotini (Rodentia: Sigmondontinae), with a phylogenetic hypothesis for the Sigmodontinae. Fieldiana: Zoology 1464:1-112. [ Links ]
58. VENEGAS PJ, JH TOWNSEND, C KOCH y W BÖHME. 2008. Two new sympatric species of leaf-toed geckos (Gekkonidae: Phyllodactylus) from the Balsas region of the upper Marañón Valley, Peru. Journal of Herpetology 42:386-396. [ Links ]
59. VERGARA O, V JEREZ y L PARRA. 2006. Diversidad y patrones de distribución de coleópteros en la Región del Biobío, Chile: una aproximación preliminar para la conservación de la diversidad. Revista Chilena de Historia Natural 79:369-388. [ Links ]
60. VOSS RS. 1988. Systematics and ecology of ichthyomyine rodents (Muroidea): Patterns of morphological evolution in a small adaptive radiation. Bulletin of the American Museum of Natural History 188:259-493. [ Links ]
61. VOSS RS. 1991. An introduction to the Neotropical muroid rodent genus Zygodontomys. Bulletin of the American Museum of Natural History 210:1-113. [ Links ]
62. VOSS RS y MD CARLETON. 1993. A new genus for Hesperomus molitor Winge and Holochilus magnus Hershkovitz (Mammalia, Muridae) with an Analysis of its phylogenetic relationships. American Museum Novitates 3085:1-39. [ Links ]
63. VIVAR E, V PACHECO y M VALQUI. 1997. A new species of Cryptotis (Insectivora: Soricidae) from northern Peru. American Museum Novitates 3202:1-15. [ Links ]
64. VUILLEUMIER F. 1969. Pleistocene speciation in birds living in the high Andes. Nature 223:1179-1180. [ Links ]
65. WEBERBAUER A. 1945. El mundo vegetal de los Andes peruanos, estudio fitogeográfico. Ministerio de Agricultura, Lima. [ Links ]
66. WEKSLER M. 2003. Phylogeny of Neotropical oryzomyine rodents (Muridae: Sigmodontinae) based on the nuclear IRBP exon. Molecular Phylogenetics and Evolution 29:331-349. [ Links ]
67. WEKSLER M. 2006. Phylogenetic relationships of Oryzomine Rodents (Muroidea: Sigmodontinae): Separate and combined analyses of morphological and molecular data. Bulletin of the American Museum of Natural History 296:1-149. [ Links ]
68. WEKSLER M, AR PERCEQUILLO y RS VOSS. 2006. Ten new genera of Oryzomyine rodents (Cricetidae: Sigmodontinae). American Museum Novitates 3537:1-29. [ Links ]
69. WEKSLER M y AR PERCEQUILLO. 2011. Key to the genera of the tribe Oryzomyini (Rodentia: Cricetidae: Sigmodontinae). Mastozoología Neotropical 18:281- 292. [ Links ]
70. ZEVALLOS H, RE PALMA, PA MARQUET y G ZEVALLOS. 2014. Phylogenetic relationships of Calomys sorellus Complex (Rodentia: Cricetidae), with the description of two new species. Revista Mexicana de Mastozoología Nueva época 4:1-23. [ Links ]
Los especímenes examinados pertenecen a las colecciones de mamíferos de los siguientes museos: MUSM, Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima, Perú; FMNH, The Field Museum, Chicago, United States; MVZ, Museum of Vertebrate Zoology, University of California, Berkeley, United States y AMNH, American Museum of Natural History, New York, United States. Se indica el nombre de la especie seguido del nombre del departamento, provincia y localidad. Los números corresponden a los empleados en la Fig. 1 y aquellos con asterisco en los análisis morfométricos.
Eremoryzomys polius (n=30).- AMAZONAS: Utcubamba: 1) A 29 Km. Sur del Rio Utcubamba y 38 km. E de Bagua, (5°54’29.63” S, 78° 9’44.68” W; MVZ 135657). Chachapoyas: 2) Condechaca, río Utcubamba, (6°21’27.00” S, 77°54’38.99” W; BMNH 26.5.3.16); 5) Tingo, 30 km S and 41 km E Bagua (6°22’59.88” S, 77°49’59.88” W; MVZ* 135658); 7) Tambo Carrizal, montañas al este de Balsas (6°46’60.00” S, 77°52’0.01” W; FMNH* 19762-67); 8) A 19 km del este de Balsas (6°49’40.19” S, 77°54’46.80” W; MUSM* 4972-4973; FMNH 129242-43, 129245). Luya: 3) San Lucas, (6°26’41.99” S, 78°12’39.93” W; MUSM* 38644-46); 4) Mendán, (6°33’26.28” S, 78° 7’55.24” W; MUSM* 34792); 6) Tuén (6°44’42.90” S, 78° 1’46.60”W; MUSM* 34793-95, 38647-50). LA LIBERTAD: Pataz: 9) Suyubamba (7°50’46.24” S, 77°34’20.89” W; MUSM* 42445-57). CAJAMARCA: San Ignacio: 10) San Ignacio (5°12’19.48” S, 79° 3’38.16” W; AMNH* 64055-56). Cutervo: 11) Chaupe (5°12’19.48” S, 79° 3’38.16” W; AMNH* 64054).
Eremoryzomys mesocaudis nov. sp. (*n=31). - AMAZONAS: Bagua: 17) Casual (5°35’30.35” S, 78°32’46.36” W; MUSM 41487); 18) Achaguay (5°41’5.64”S, 78°25’8.40” W; MUSM 41486); 19) Copallín (5°35’11.58” S, 78°29’42.36” W; MUSM 41461-68, 41488-96, 41498-505). Utcubamba: 20) Chiñuña (6° 4’5.57” S, 78°31’32.32” W; MUSM 34791, 38641-43).
Aegialomys xanthaeolus (*n=19).-AMAZONAS: Luya: Mendán (6°33’36.90” S, 78° 8’1.86” W; MUSM 34774, 34777, 38632- 34, 38636). Tuén (6°44’31.63” S, 78° 2’7.19” W; MUSM 34781, 38638). Bagua: Achaguay (5°35’12.73” S, 78°30’2.38” W; MUSM 41460, 41481). Casual (5°34’55.54” S, 78°32’30.67” W; MUSM 41482). CAJAMARCA: Celendín: Yaguén-El Mango (6°28’23.30” S, 78°10’32.52” W; MUSM 34784-88). Catangue (7° 1’59.99” S, 78° 4’0.01” W; MUSM 36994, 36997). Chota: Sangana (6°21’36.38” S, 79°26’25.42” W; MUSM 40248).
Euryoryzomys macconnelli (*n= 18). - AMAZONAS: Condorcanqui: Condorcanqui, Nieva, Pto. Tunduza (4°46’54.52” S, 77°52’32.09” W; MUSM 16225). Camp. 2, margen derecha de la Quebrada Wee, aprox 1.5 km del PV 12 de Enero (3°38’31.88” S, 78°18’36.50” W; MUSM 27055). LORETO: Maynas: Quebrada Agua Negra (10°15’0.00” S, 75°10’58.80” W; MUSM 24436-38). PASCO: Oxapampa: Cerro Chontiya, 5Km Oeste Shiringamazu, carretera a Iscosazin (12°27’43.38” S, 73° 3’21.85” W; MUSM 10454, 10457). CUSCO: La Convención: Alto Manugali (12°27’43.38”S, 73° 3’21.85” W; MUSM 36601). Alto Sangobatea, Kinkateni (12°33’19.12” S, 72°47’36.56” W; MUSM 36602-04, 36606). Camisea, Armihuari [Cashiriari 2] (11°51’51.30” S, 72°46’45.59” W; MUSM 14246, 14248). Camisea, Segakiato (11°50’42.11” S, 72°35’58.52” W; MUSM 14873). A 2 km SO de C.N. Tangoshiari (11°46’47”S, 73°20’26.5”W; MUSM 13429, 13432-33).
Nephelomys albigularis (*n=20).- AMAZONAS: Bongará: Área de Conservación Privada (ACP) Abra Patricia-Alto Nieva (5°38’48.48” S, 77°49’21.50” W; MUSM 25174). Chachapoyas: Leimebamba, ca 20 km by road W. (6°45’0.00” S, 77°47’60.00” W; MUSM 4971). Luya: ACP Huiquilla El Choctamal (6°22’43.39” S, 77°58’41.38” W; MUSM 25746, 25748). CAJAMARCA: Chota: La Granja, Qda. Agua de la Montaña (6°21’21.78” S, 79° 8’39.01” W; MUSM 40341). La Granja, Qda. Checos (6°22’48.22” S, 79° 7’12.65” W; MUSM 40345-46, 40348, 40350, 41577-78, 41583). La Granja, Qda. San Lorenzo (6°22’50.69” S, 79° 9’0.48” W; MUSM 41586). La Granja, San Lorenzo (6°22’41.63” S, 79° 8’35.23” W; MUSM 40355). Pagaibamba Bajo (6°25’4.98” S, 79° 3’34.34” W; MUSM 39495-96). Pagaibamba Medio (6°25’35.36” S, 79° 4’14.34” W; MUSM 39498). Paja Blanca (6°23’13.99” S, 79° 7’38.24” W; MUSM 39505). Plataforma 5 (6°22’3.51” S, 79° 7’24.87” W; MUSM 39512). Quebrada Honda (6°22’22.33” S, 79° 4’47.21” W; MUSM 39516).














