Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.24 no.2 Mendoza Dec. 2017
ARTÍCULO
Morcegos da Estação Ecológica Aiuaba, Ceará, nordeste do Brasil: uma unidade de proteção integral na caatinga
Anderson Feijó1, 2 e Patrício A. da Rocha1, 2
1 Programa de Pós-Graduação em Ciências Biológicas (Zoologia), CCEN, Universidade Federal da Paraíba, João Pessoa, PB, Brasil. [Correspondência: <andefeijo@gmail.com>]
2 Laboratório de Mamíferos, Departamento de Sistemática e Ecologia, CCEN, Universidade Federal da Paraíba, João Pessoa, PB, Brasil.
Recibido 26 diciembre 2016.
Aceptado 1 marzo 2017.
Editor asociado: T Lacher
RESUMO.
Nesse trabalho, inventariamos a quiropterofauna da Estação Ecológica Aiuaba (ESEC Aiuaba), situada no estado do Ceará, nordeste do Brasil, e uma das poucas unidades de proteção integral no bioma Caatinga. Cinco campanhas de agosto de 2012 a dezembro de 2013 foram conduzidas. Um esforço de 31 500 h.m2 de redes de neblina somadas às 30 horas de busca ativa resultou na captura de 275 espécimes pertencentes a 26 espécies, 24 gêneros e sete famílias. Desse total, 205 indivíduos (26 espécies) foram capturados nas redes de neblina, enquanto 70 (11 espécies) foram capturadas nos abrigos. A família Phyllostomidae foi a mais representativa, contribuindo com 82.9% da abundância total. A espécie mais frequente nas redes de neblina foi Artibeus planirostris (37.5% do total), seguida por Carollia perspicillata (16.5%), Micronycteris sanborni (8.8%), Glossophaga soricina (5.4%), Myotis lavali (5.3%) e Trachops cirrhosus (4.4%). Pteronotus gymnonotus, A. planirostris e M. sanborni estavam prenhes em dezembro (final da época seca) e A. planirostris, M. sanborni, Gardnerycteris crenulatum, T. cirrhosus, Molossus molossus e Myotis lavali estavam lactantes em abril (final da época chuvosa). A quiropterofauna da ESEC Aiuaba destacou-se como uma das mais diversas da Caatinga, contendo 55% da diversidade de morcegos registrada no Ceará. A diversidade elevada de molossídeos e vespertilionídeos encontrada pode ser explicada pela presença de corpos de água perenes próximos aos pontos de coleta. Nós registramos a maior abundância de M. sanborni já reportada. Os nossos resultados oriundos do monitoramento dos abrigos reforçam a importância de métodos complementares visando retratar propriamente a estruturação da taxocenose dos morcegos. Nós discutimos a variação dos carácteres diagnósticos morfológicos utilizados atualmente para diferenciar Peropteryx trinitatis e P. macrotis.
ABSTRACT.
Bats of the Estacão Ecológica Aiuaba, Ceará, Northeastern Brazilian: an integral protection unit in the Caatinga.
We sampled the chiropterofauna of the Aiuaba Ecological Station (ESEC Aiuaba), located in Ceará State, northeastern Brazil, one of the few integral protection units in the Caatinga biome. We conducted five surveys, from August 2012 through December 2013. A sampling effort of 31 500 h.m2 of mist nets and 30 hours of roost monitoring yielded 275 specimens classified into 26 species, 24 genera and seven families. Of these, 205 individuals (26 species) were captured in mist nets and 70 bats (11 species) were captured in roosts. Phyllostomidae was the most common family, accounting for 82.9% of the total abundance. The most common species caught in the mist nets were Artibeus planirostris (37.5% of the total), followed by Carollia perspicillata (16.5%), Micronycteris sanborni (8.8%), Glossophaga soricina (5.4%), Myotis lavali (5.3%), and Trachops cirrhosus (4.4%). Pteronotus gymnonotus, A. planirostris and M. sanborni were pregnant in December (late dry season) and A. planirostris, M. sanborni, Gardnerycteris crenulatum, T. cirrhosus, Molossus molossus and Myotis lavali were lactating in April (late rainy season). The chiropterofauna of ESEC Aiuaba is one of the most diverse in the Caatinga, including 55% of the species of bats registered in Ceará state. The high diversity of molossids and vespertilionids sampled may be explained by the presence of perennial water near the collection sites. We recorded the highest abundance of M. sanborni ever reported. Our results from roost monitoring reinforce the importance of using complementary techniques to properly reveal the bat taxocenosis. We discuss variation in the morphologic traits currently used to differentiate Peropteryx trinitatis and P. macrotis.
Palavras chaves: Caatinga; Chiroptera; Micronycteris sanborni; Peropteryx trinitatis; Unidade de Conservação.
Key words: Caatinga; Chiroptera; Micronycteris sanborni; Peropteryx trinitatis; Protected area.
INTRODUÇÃO
Os morcegos apresentam uma alta diversidade, cerca de 1230 espécies (Simmons & Wettere 2010), e uma grande radiação ecológica e evolutiva (Fenton 1992; Kalko 1997), com representantes insetívoros, frugívoros, nectarívoros, granívoros, carnívoros, piscívoros e hematófagos (Humphrey & Bonaccorso 1979; Nowak 1994; Nogueira & Peracchi 2003). O Brasil destaca-se como o segundo país mais diverso em relação a sua quiropterofauna, atualmente com 180 espécies (Nogueira et al. 2014; Moratelli & Dias 2015; Feijó et al. 2015a), atrás apenas da Colômbia (187 espécies). Essa grande diversidade se concentra na Amazônia, Mata Atlântica, Cerrado e Caatinga (Paglia et al. 2012).
Nos últimos 30 anos um crescente interesse pela Caatinga tem aumentado a diversidade de mamíferos conhecida, que hoje conta com 155 espécies, um aumento de 48% nesse período (Mares et al. 1981; Carmignotto et al. 2012; Moratelli & Dias 2015; Feijó et al. 2015a). Em relação aos morcegos, 81 espécies são registradas para esse bioma (Paglia et al. 2012; Moratelli & Dias 2015; Rocha et al. 2015a; Feijó et al. 2015a; Feijó et al. 2015b), o que representa um aumento de 17 espécies (20%) em apenas doze anos (Oliveira et al. 2003). Esse crescimento deve-se ao aumento dos trabalhos de campo na Caatinga (ex. Rocha et al. 2015a; Feijó et al. 2015a) e análises de espécimes em museus (ex. Moratelli & Dias, 2015), refletindo o grande potencial faunístico dessa área.
A Caatinga é um ecossistema de alta sazonalidade com períodos prolongados de seca, composto por uma vegetação arbustiva e de florestas sazonais secas (ver mais em Prado 2003; Leal et al. 2005). Essa região apresenta poucas unidades de conservação, apenas 1% do bioma está inserido em unidades de proteção integral, como parques nacionais, estações ecológicas e reservas biológicas (Leal et al. 2005). Visando contribuir para o melhor conhecimento da quiropterofauna da Caatinga, bem como de uma das poucas unidades de conservação de proteção integral nesse bioma, o objetivo desse trabalho é inventariar a quiropterofauna da Estação Ecológica Aiuaba, Ceará, nordeste do Brasil. Este trabalho fez parte do projeto “Fauna da ESEC Aiuaba: Integração de Informações para Subsídio de Planos de Conservação e o Uso Sustentável”, desenvolvido entre 2011 e 2014, visando catalogar a diversidade de mamíferos, aves, répteis, anfíbios, peixes, crustáceos, insetos, bentos, zooplânctons e parasitas presentes na ESEC Aiuaba.
ÁREA DE ESTUDO
A Estação Ecológica Aiuaba (ESEC Aiuaba) é uma unidade de conservação de proteção integral de 11 805 hectares situada no município de Aiuaba, sudoeste do estado do Ceará, entre as coordenadas 06º36’01” S - 06°44’35”S e 40°07’15”O- 40°19’19”O (Fig. 1). A precipitação média anual é de 582 mm. A temperatura média mensal varia de 24 a 28 °C (Lemos & Meguro 2010). As chuvas ocorrem de dezembro a maio e a maior precipitação pluviométrica média ocorre em março (Oliveira et al., 1988). Os tipos de fitofisionomia presentes na área são: Floresta Caducifólia Espinhosa, Caatinga arbustiva aberta, Carrasco e Floresta Subcaducifólia Tropical Pluvial (Lemos e Meguro, 2010). Na área circundante à ESEC Aiuaba há plantações de milho, banana e mandioca, assim como criações de gado bovino e caprino.
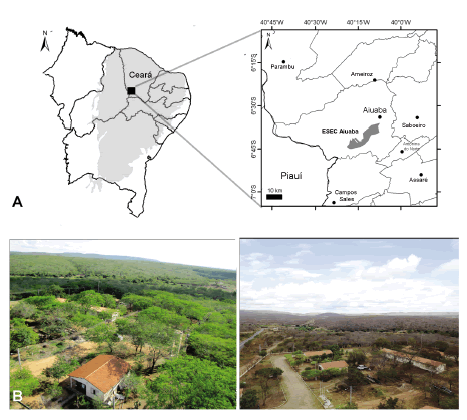
Fig. 1: A: Mapa do Nordeste do Brasil evidenciando a região da Caatinga (cinza claro) e a localização da ESEC Aiuaba, Ceará (quadrado preto). À direita, a localização da ESEC Aiuaba, no município de Aiuaba. B: Vista aérea da ESEC Aiuaba na estação chuvosa (esquerda) e estação seca (direita).
MATERIAL E MÉTODOS
O levantamento dos morcegos foi realizado em cinco campanhas: a primeira entre 26 de agosto a 1 de setembro de 2012; a segunda entre 2 a 5 de abril de 2013; terceira entre 26 de junho a 1 de julho de 2013; a quarta entre 30 de agosto a 2 setembro de 2013; e a quinta de 1 a 4 de dezembro de 2013.
Os morcegos foram capturados com redes de neblina (12 × 2.5 m cada), abertas das 18:00 às 00:00 h. O número de redes variou de cinco a dez dependendo do ponto de coleta e/ou da estação do ano amostrada. O esforço amostral foi de 31 500 h. m2, calculado de acordo com o método proposto por Straube & Bianconi (2002), que consiste em multiplicar a área total das redes pelo número de horas que as mesmas ficaram expostas. Ao longo das sessões de captura, as redes foram vistoriadas a cada 30 minutos para a retirada dos indivíduos. Além disso, nós realizamos buscas ativas em possíveis abrigos dentro e no entorno da ESEC Aiuaba, como cavernas, telhados de casas, ocos de árvores e em bueiros.
As capturas foram realizadas em cinco pontos, selecionados de forma a potencializar o registro dos morcegos mesmo durante a estação seca, onde as capturas tendem a diminuir (Rocha et al. 2015b). Todos os pontos encontram-se nas proximidades de corpos d’água perenes, incluindo pequenos açudes artificiais, barragens e riachos. Em complemento, dois abrigos foram monitorados durante todas as campanhas para detectar possíveis flutuações populacionais e na composição de espécies. Um dos abrigos é uma cavidade subterrânea chamada Caverna Sobradinho (6° 38’ 35,7’’ S, 40° 5’ 57’’ O), com cerca de 50 metros de extensão e uma altura média de 4 metros (Fig. 2). O segundo abrigo é o sótão do alojamento da sede da ESEC Aiuaba, uma construção de alvenaria coberta por telhas com cerca de 40 metros de extensão e um metro de altura.

Fig. 2: Caverna Sobradinho. Entrada da caverna (esquerda) e Colônia de Pteronotus no interior da caverna (direita).
A identificação dos espécimes foi baseada principalmente em Gardner (2008), e em trabalhos específicos, como Moratelli et al. (2011) e Feijó et al. (2015c). Os indivíduos capturados foram identificados e avaliados quanto ao sexo, idade, estágio reprodutivo, peso e comprimento do antebraço. O estágio reprodutivo foi verificado a partir da observação de caracteres externos e categorizado como: i) Fêmea prenhe: quando o feto pode ser percebido no útero por apalpação; ii) Fêmea lactante: mamas intumescidas, sem pelos e com presença de leite; iii) Fêmea prenhe e lactante: presença simultânea das duas categorias anteriores e; iv) Fêmea pós-lactante: mamas sem pelos e ausência de leite. Após as avaliações e medições, os indivíduos foram marcados com anilhas alfanuméricas e soltos na mesma noite e local da captura. Cinco indivíduos de cada espécie foram mortos (Licença SISBIO número: 551993/2011-1), fixados em formol a 10% e preservados em álcool 70% para confirmação da identificação e depósito como material testemunho. Os espécimes coletados estão depositados na coleção de Mamíferos da Universidade Federal da Paraíba (UFPB).
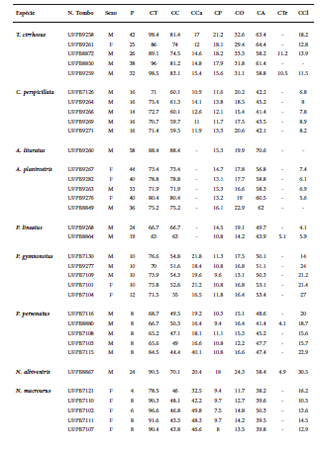
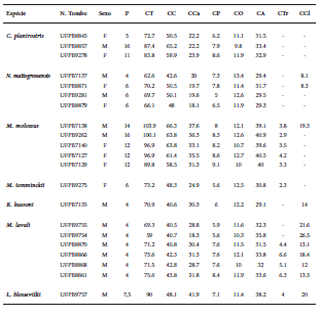
Para os espécimes coletados, foram obtidas as seguintes medidas: Peso (P), Comprimento total (CT); comprimento cabeça-corpo (CC); comprimento da cauda (CCa); comprimento do pé (CP); comprimento da orelha (CO); comprimento do antebraço (CA); comprimento do trago (CTr); comprimento do calcâneo (CCl); comprimento do crânio (CCr); comprimento côndilo-incisivo (CCI); largura do mastóide (LM); largura do zigomático (LZ); largura da caixa encefálica (LC); largura da constrição pós-orbital (LCp); largura ao nível dos caninos superiores (LCa); largura ao nível dos molares superiores (LMo); comprimento da série dentária superior (CSDs); comprimento da mandíbula (CMa) e comprimento da série dentária inferior (CSDi).
A estimativa de riqueza Jackknife 1 e curvas de acumulação de espécies (observada e estimada por Jackknife 1) foram calculadas usando o programa EstimateS 8.2 (Colwell, 2009) e aleatorizadas 1.000 vezes. A randomização dos dados elimina a influência da ordem em que os mesmos são incluídos na análise, o que resulta em uma curva acumulativa de espécies suavizada (Colwell e Coddington, 1994). As espécies foram categorizadas de acordo com seus hábitos alimentares preferenciais, seguindo Nowak (1994) e Kalko (1997), adotando-se as categorias: onívoros, insetívoros, frugívoros, nectarívoros, carnívoros e hematófagos.
RESULTADOS
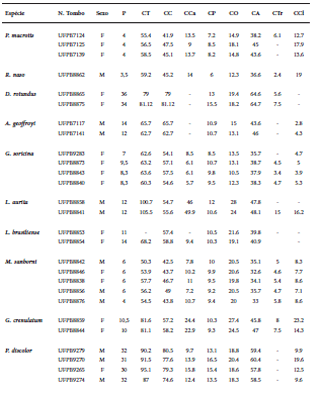
Nós capturamos 275 espécimes pertencentes a 26 espécies, 24 gêneros e sete famílias. Desse total, 205 indivíduos representando 26 espécies foram capturados nas redes de neblina, enquanto 70 indivíduos (11 espécies) foram capturados em abrigos (Tabela 1). A riqueza estimada por Jackknife 1 foi de 35 espécies, havendo diferença significativa (t = -8.25; P = 0.0001) entre o valor estimado e observado (Fig. 3). Pranchas com as espécies capturadas na ESEC Aiuaba são fornecidas no Suplemento 1. As medidas externas e o número de tombo dos espécimes coletados na ESEC Aiuaba são apresentados na Tabela 2.
Tabela 1
Lista de espécies registradas na ESEC Aiuaba, Ceará, com respectiva abundância por método de captura e hábito alimentar. *Indivíduos capturados na Caverna Sobradinho; **Indivíduos capturados no sótão da sede da ESEC Aiuaba. A abundância das espécies registrada nos abrigos representa o número de indivíduos capturados e não o tamanho real das colônias.
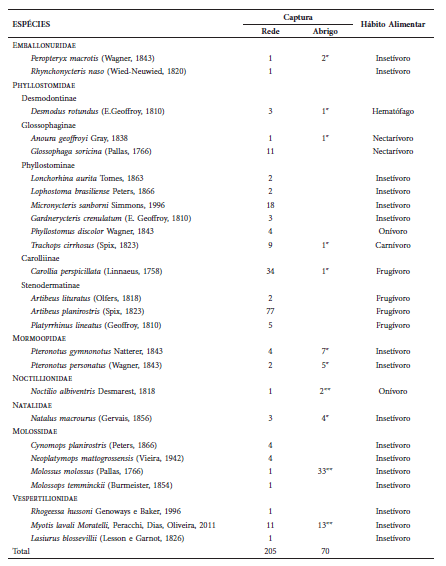
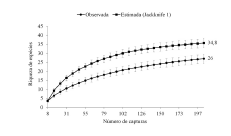
Fig. 3: Curvas aleatorizadas de acumulação (observada e estimada por Jackknife 1) de espécies de morcegos da ESEC Aiuaba, Ceará, Brasil.
Tabela 2
Medidas externas (em mm) dos espécimes coletados na ESEC Aiuaba, Ceará, Brasil, entre agosto de 2012 e abril de 2013. F: Fêmea; M: Macho.
A família Phyllostomidae foi a mais representativa com 170 indivíduos capturados (82.9% da abundância total), seguida por Vespertilionidae (6.34%; N = 13), Molossidae (4.88%; N = 10), Mormoopidae (2.93%; N = 6), Natalidae (1.46%; N = 3), Emballonuridae (0.98%; N = 2) e Noctilionidae (0.49%; N = 1).
A espécie com o maior número de capturas nas redes de neblina foi Artibeus planirostris com 37.5% dos indivíduos capturados (N = 77), seguida por Carollia perspicillata com 16.5% (N = 34), Micronycteris sanborni com 8.8% (N = 18), Glossophaga soricina (5.4%; N = 11), Myotis lavali (5.3%; N = 11) e Trachops cirrhosus (4.4%; N = 9). Juntas, essas seis espécies representam 77.9% de todos os indivíduos capturados (Fig. 4).

Fig. 4: Abundância absoluta de espécies de morcegos capturadas na ESEC Aiuaba, Ceará, Brasil. A.g. = Anoura geoffroyi; A.l. = Artibeus lituratus; A.p. = Artibeus planirostris; C.p. = Carollia perspicillata; C.pl. = Cynomops planirostris; D.r. = Desmodus rotundus; G.c. = Gardnerycteris crenulatum; G.s. = Glossophaga soricina; L.a. = Lonchorhina aurita; L.b = Lasiurus blossevillii; L.br. = Lophostoma brasiliense; M.s. = Micronycteris sanborni; M.l. = Myotis lavali; M.m = Molossus molossus; M.t. = Molossops temminckii; N.a. = Noctilio albiventris; N.m. = Neoplatymops mattogrossensis; N.mc = Natalus macrourus; P.d. = Phyllostomus discolor; P.l. = Platyrrhinus lineatus; P.g. = Pteronotus gymnonotus; P.m. = Peropteryx macrotis; P.p. = Pteronotus personatus; R.h. = Rhogeessa hussoni; R.n = Rhynchonycteris naso; T.c. = Trachops cirrhosus.
A maioria das espécies capturadas apresenta hábito alimentar insetívoro (61.5% das espécies registradas), seguida por frugívoros (15.3%), onívoros (7.6%), nectarívoros (7.7%) e hematófagos (3.8%). Todavia, considerando-se o número de indivíduos capturados, os frugívoros foram os mais representativos (57.5%), seguidos dos insetívoros (28.3%), onívoros (12.2%), hematófagos (1.5%) e nectarívoros (0.5%).
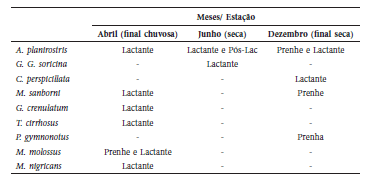
Das 26 espécies capturadas, nove apresentaram características que indicavam atividade reprodutiva (Tabela 3). Pteronotus gymnonotus, A. planirostris e M. sanborni estavam prenhes em dezembro (final da época seca) e A. planirostris, M. sanborni, G. crenulatum, T. cirrhosus, M. molossus e M. lavali estavam lactantes em abril (final da época chuvosa).
Tabela 3
Condição reprodutiva das fêmeas reprodutivamente ativas capturadas em 2013 na ESEC Aiuaba, Ceará, Brasil. Pós-Lac: pós-lactante
O monitoramento dos abrigos resultou na captura de 11 espécies (Tabela 1), sendo estas também registradas nas redes de neblina. As buscas no sótão da ESEC Aiuaba resultaram na identificação de uma colônia de Molossus molossus (cerca de 30 indivíduos), Myotis lavali e Noctilio albiventris (cinco indivíduos foram visualizados). A caverna Sobradinho abrigava uma riqueza de oito espécies: Peropteryx macrotis, Desmodus rotundus, Anoura geoffroyi, Trachops cirrhosus, Carollia perspicillata, Natalus macrourus, Pteronotus personatus e Pteronotus gymnonotus (Tabela 1). As espécies do gênero Pteronotus formavam uma colônia de pelo menos de 35 mil indivíduos (inferido a partir de estimativas fotográficas; ver Kunz & Parsons 2009). A abundância das outras espécies não pôde ser estimada.
DISCUSSÃO
Considerando os padrões encontrados em outras áreas de caatinga, a riqueza de quirópteros registrada na ESEC Aiuaba (26 espécies) é alta. Os inventários realizados nesta região apontam uma diversidade local de morcegos entre 14 (Parque Nacional Ubajara, no Ceará; Silva et al. 2001) e 33 espécies (região de Exu, em Pernambuco; Willig 1983). A ESEC Aiuaba possui 55% da diversidade de morcegos registrada no Ceará (Gurgel-Filho et al. 2015), e destaca-se como a área com maior número de registros (18) de M. sanborni (Feijó et al. 2015c), o que torna a unidade promissora para estudos de biologia dessa espécie, considerada “Data Deficient” pela IUCN (Tavares e Aguirre 2008). Conforme indicado pelo estimador Jackknife 1, essa área provavelmente apresenta uma diversidade maior do que a reportada aqui, indicando que novas coletas podem ampliar a lista aqui apresentada. Nesse sentido, a ESEC Aiuaba pode abrigar uma das maiores diversidades para a Caatinga, o que reforça a sua importância na conservação dos morcegos nesse ecossistema.
A maior abundância de Phyllostomidae já era esperada, uma vez que esta família apresenta o maior número de espécies de morcegos neotropicais (Simmons 2005). Além disso, o principal método utilizado (redes de neblina ao nível do solo) apresenta viés para a captura de espécies desta família (Simmons & Voss 1998). Dessa maneira, inventários devem utilizar abordagens complementares, tais como busca ativa em abrigos, redes ao nível do dossel e levantamentos bioacústicos. Por outro lado, os registros de quatro espécies de molossídeos e quatro de vespertilionídeos foram maiores do que o reportado em outros inventários na Caatinga (ex. Gregorin et al. 2008; Fabián 2008; Silva et al. 2015). Esse efetivo sucesso em contemplar espécies de hábito alimentar insetívoro, raramente registradas com redes-de-neblina ao nível do solo, pode ser atribuído às amostragens em diferentes hábitats associados a corpos d’água, onde há uma maior disponibilidade de insetos (Grindal et al. 1999; Lloyd et al. 2006). Similar explicação pode ser atribuída ao fato que todas as espécies registradas durante as buscas ativas foram também capturadas em redes, ainda que em frequências menores (Tabela 1).
A presença de corpos de água perenes em ambientes onde esse recurso é escasso é um elemento fundamental para muitas espécies da fauna local. No caso dos morcegos, o direcionamento da amostragem nas imediações desses corpos favorece a captura de espécies geralmente pouco registradas com redes de neblina, no momento em que vão beber ou forragear sobre a lamina d’água (Grindal et al. 1999; Greif & Siemers 2010; Ciechanowsk 2002; Lloyd et al. 2006). Esse fato pode explicar o elevado número de capturas de M. lavali (n = 21) e M. sanborni (n = 18), incomum nos inventários realizados nesse bioma (ex. Novaes & Laurindo 2014; Novaes et al. 2015, Beltrão et al. 2015). Similar resultado foi reportado por Grindal et al. (1999) e Lloyd et al. (2006) que encontraram um maior forrageamento de morcegos insetívoros sobre corpos d’água no Canadá e Australia, respectivamente, associado a uma maior disponibilidade de alimento e a necessidades dos morcegos beberem água. Dessa maneira, visando potencializar a captura de morcegos na Caatinga, futuros inventários devem focar em áreas com corpos d’água perenes, artificiais ou não, principalmente durante a estação seca, onde esse recurso é limitado.
As buscas ativas proporcionaram o registro de oito espécies na Caverna Sobradinho e três no sótão do alojamento da sede da ESEC Aiuaba. O tamanho das colônias encontradas nos abrigos ressalta a seletividade das redes de neblina em retratar a estruturação de taxocenose de morcegos. Espécies consideradas raras nas redes, como P. personatus e P. gymnonotus, formam uma colônia mista de aproximadamente 35 mil indivíduos na Caverna Sobradinho (Fig. 2), podendo ser, ao contrário do que as redes retratam, as espécies mais abundantes na região. Essa excepcional concentração de morcegos na Caverna Sobradinho (principalmente do gênero Pteronotus) associada à sua alta riqueza (Guimarães e Ferreira, 2014) a tornam uma cavidade de máxima relevância no contexto regional de paisagem e, portanto, prioridade em proteção.
A história natural das espécies de morcegos da Caatinga ainda é pouco conhecida e as poucas informações disponíveis resultam de observações pontuais e descontínuas. Willig (1985) apresentou um dos primeiros e, ainda hoje, mais consistentes dados sobre padrões reprodutivos de morcegos em florestas sazonais secas do Nordeste do Brasil, com enfoque no complexo da Chapada do Araripe (Exu, Pernambuco e Crato, Ceará). Os dados aqui apresentados são coerentes com os de Willig (1985), o qual observou que dentre a maioria dos frugívoros, os nascimentos e a lactação geralmente concentram-se na época chuvosa. A frutificação das plantas zoocóricas na Chapada do Araripe e ESEC Aiuaba durante a estação chuvosa (Willig 1985; Oliveira et al. 1988) resulta no maior aporte de recursos para frugívoros nessa época, coincidindo com a maior demanda energética durante a lactação.
Os três espécimes do gênero Peropteryx capturados na ESEC Aiuaba apresentam uma mescla de características diagnósticas de P. macrotis e P. trinitatis de acordo com Simmons & Voss (1998). Segundo Simmons & Voss (1998:37), P. trinitatis pode ser diferenciado de P. macrotis pelo seu tamanho menor e pelo “anterior upper premolar is peglike and lacks well-defined anterior and posterior cusps in [anterior upper premolar]”, enquanto P. macrotis possui “this tooth [anterior upper premolar] larger and with a distinct posterior cusp”. O nosso espécime UFPB7124 apresenta as medidas externas e cranianas dentro da variação (Tabela 4) atribuída por Simmons & Voss (1998) a P. trinitatis, entretanto o primeiro pré-molar superior apresenta uma cúspide posterior, padrão de P. macrotis (Fig. 5). Por outro lado, os espécimes UFPB7125 e UFPB7139 apresentam as medidas dentro do padrão de P. macrotis, mas com o primeiro pré-molar superior sem a cúspide posterior como em P. trinitatis sensu Simmons & Voss (1998). Comparando-se o primeiro pré-molar supe rior desses dois últimos espécimes é possível observar que o indivíduo UFPB7125 possui a extremidade arredondada e a base relativamente larga, enquanto o UFPB7139 tem a extremidade aguçada (Fig. 5). Dessa maneira, as poucas características diagnósticas utilizadas para separar ambas as espécies estão sujeitas a variação e, portanto, possuem pouca utilidade taxonômica. Considerando que estudos filogenéticos (Lim 2007; Clare et al. 2011) e dados bioacústicos (Barataud et al. 2013; Hintze et al. 2016) suportam a separação de P. macrotis e P. trinitatis, uma detalhada análise morfológica de ambos os táxons é necessária visando identificar caracteres diagnósticos consistentes.
Tabela 4
Medidas cranianas de Peropteryx macrotis coletados na ESEC Aiuaba, Ceará, Brasil. As siglas estão descritas na metodologia.
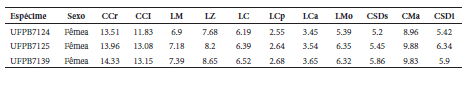
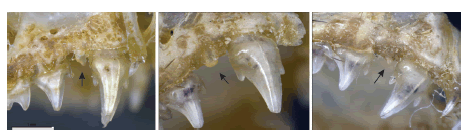
Fig. 5: Vista lateral da série dentária superior dos três espécimes de Peropteryx macrotis coletados na ESEC Aiuaba, Ceará, Brasil com destaque para o primeiro pré-molar superior (seta). Esquerda (UFPB7124), centro (UFPB7125), direita (UFPB7139). Note a variação da forma do primeiro pré-molar superior entre os três indivíduos. Escala = 1mm.
A alta riqueza inventariada e estimada ressalta a grande relevância da ESEC Aiuaba para a conservação da quiropterofauna da Caatinga e enfatiza a importância da criação de outras unidades de conservação de proteção integral nessa região. A amostragem com redes de neblina próximas a corpos d’água mostrou-se bastante eficiente, uma vez que todas as espécies encontradas nos abrigos foram registradas. Por outro lado, enfatizamos que a utilização de métodos complementares (ex., buscas ativas, bioacústica) em inventários é fundamental para obter um cenário mais realístico da taxocenose local.
AGRADECIMENTOS
Agradecemos a Robson Waldermar Ávila pelo convite em participar do projeto “Fauna da ESEC Aiuaba: integração de informações para subsídio de planos de conservação e o uso sustentável”. Agradecemos também a Honório Miguel Arrais e toda a equipe da ESEC Aiuaba pela autorização e suporte para o desenvolvimento deste projeto. Somos gratos a Felipe Silva Ferreira, Rebeka Morais Alves dos Santos e Franciedna da Silva Gonçalves pelo auxílio em campo. Agradecemos a Frederico Hintze e ao revisor anônimo pelos valiosos comentários e sugestões. Este trabalho foi financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (processo 551993/2011-1). PAR agradece à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior pela bolsa de Pós-doutorado (PNPD).
LITERATURA CITADA
1. Beltrão. M. G., C. G. Zeppelini, M. P. A Fracasso & L. C. S. Lopes. 2015. Bat inventory in a Caatinga area in Northeastern Brazil, with a new occurrence in the state of Paraíba. Neotropical Biology and Conservation 10:15-20. [ Links ]
2. Barataud, M., S. Giosa, F. Leblanc, V. Rufray, T. Disca, L. Tillon, M. Delaval, A. Haquart, & M. Dewynter. 2013. Identification etécologie acoustique des chiroptères de Guyane Française. Le Rhinolophe 19:103-145. [ Links ]
3. Carmignotto, A. P., M. Vivo, & A. Langguth. 2012. Mammals of the Cerrado and Caatinga: distribution patterns of the tropical open biomes of Central South America. Bones, clones, and biomes: the history and geography of Recent Neotropical mammals (B. D. Patterson & L. P. Costa, eds.). Chicago, University of Chicago Press. [ Links ]
4. Ciechanowsk, M. 2002. Community structure and activity of bats (Chiroptera) over different water bodies. Mammalian Biology 67:276-285. [ Links ]
5. Clare, E. L., B. K. Lim, M. B. Fenton, & P. D. N. Hebert. 2011. Neotropical bats: estimating species diversity with DNA barcodes. PLoS ONE 6(7): e22648. doi:10.1371/ journal.pone.0022648 [ Links ]
6. Colwell RK. 2009. EstimateS 8.2 User’s Guide: Statistical estimation of species richness and shared species from samples. Version 8.2. Copyringht 2009.
7. Colwell, R. K., & J. A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical transactions of the Royal Society of London 345:101-118. [ Links ]
8. Fabián, M. 2008. Quirópteros do bioma caatinga, no Ceará, Brasil, depositados no museu de ciências naturais da Fundação Zoobotânica do Rio Grande do Sul. Chiroptera Neotropical 14(1):354-359. [ Links ]
9. Feijó, A., P. A. Rocha, & S. L. Althoff. 2015a. New species of Histiotus (Chiroptera: Vespertilionidae) from northeastern Brazil. Zootaxa 4048:412-427. [ Links ]
10. Feijó, A., P. A. Rocha, J. S. Mikalauskas, & S. F. Ferrari. 2015b. Macrophyllum macrophyllum (SCHINZ, 1821) in the Brazilian Caatinga scrublands: river basins as potential routes of dispersal in xeric ecosystems. Mastozoología Neotropical 22:1-7. [ Links ]
11. Feijó, A., P. A. Rocha, & S. F. Ferrari. 2015c. How do we identify Micronycteris (schizonycetris) sanborni Simmons, 1996 (Chiroptera, Phyllostomidae) reliably and where we can find this species in Brazil? Papéis Avulsos de Zoologia 55:269-280. [ Links ]
12. Fenton, M. B. 1992. Bats. Facts on File. New York. 207 pp. [ Links ]
13. Gardner, A. L. 2008. Mammals of South America. University of Chicago Press, Chicago. [ Links ]
14. Gregorin, R., A. P. Carmignotto, & A. R. Percequillo. 2008. Quirópteros do Parque Nacional da Serra das Confusões, Piauí, nordeste do Brasil. Chiroptera Neotropical 14:366-383. [ Links ]
15. Greif, S., & B. M. Siemers. 2010. Innate recognition of water bodies in echolocating bats. Nature Communications 1:107. [ Links ]
16. Grindal, S. D., J. J .Morissette, & R. M. Brigham. 1999. Concentration of bat activity in riparian habitats over an elevational gradient. Canadian Journal of Zoology 77:972-977. [ Links ]
17. Guimarães, M. M., & R. L. Ferreira. 2014. Morcegos cavernícolas do Brasil: Novos registros e desafios para conservação. Revista Brasileira de Espeleologia 2(4):1-33. [ Links ]
18. Gurgel-Filho, N. M., A. Feijó, & A. Langguth. 2015. Pequenos mamíferos do Ceará (marsupiais, morcegos e roedores sigmodontíneos) com discussão taxonômica de algumas espécies.Revista Nordestina de Biologia 23(2):3-150. [ Links ]
19. Hintze, F., E. Barbier, & E. Bernard. 2016. Emballonuridae Gervais, 1855 (Chiroptera) of Reserva Biológica de Saltinho (Atlantic Forest), in Brazil, revealed by echolocation. Check List 12(4):1925-1933. [ Links ]
20. Humphrey, S. R., & F. J. Bonaccorso. 1979. Population and community ecology. Biology of the bats of the new world family Phyllostomidae. Part III. Special Publications of the Texas Tech University 16:409-441. [ Links ]
21. Kalko, E. K. V. 1997. Diversity in tropical bats. Tropical biodiversity and systematics (H. Ulrich, ed.). Proceedings of the International Symposium on Biodiversity and Systematics in Tropical Ecosystems, Bonn, 1994. Bonn, Zoologisches Forschungsinstitut und Museum Alexander Koenig. [ Links ]
22. Kunz, T. H., & S. Parsons. 2009. Ecological and behavioral methods for the study of bats. Segunda edição. Smithsonian Institution Press, Washington, DC. [ Links ]
23. Leal, I. R., J. M. Silva, M. Tabarelli, & T. E. Lacher Jr. 2005. Mudando o curso da conservação da biodiversidade na Caatinga do Nordeste do Brasil. Megadiversidade 1:139-146. [ Links ]
24. Lemos, J. R., & M. Meguro. 2010. Florística e fitogeografia da vegetação decidual da Estação Ecológica de Aiuaba, Ceará, Nordeste do Brasil. Revista Brasileira de Biociências 8:34-43. [ Links ]
25. Lim, B. K. 2007. Divergence times and origin of Neotropical sheath-tailed bats (tribe Diclidurini) in South America. Molecular Phylogenetics and Evolution 45:777-791 [ Links ]
26. Lloyd, A., B. Law, & R. Goldingay. 2006. Bat activity on riparian zones and upper slopes in Australian timber production forests and the effectiveness of riparian buffers. Biological Conservation 129:207-20. [ Links ]
27. Mares, M. A., M. R. Willig, K. E. Steilein, & T. E. Lacher Jr. 1981. The mammals of Northeastern Brazil: a preliminary assessment. Annals of the Carnegie Museum 50:81-137. [ Links ]
28. Moratelli, R., & D, Dias. 2015. A new species of nectar-feeding bat, genus Lonchophylla, from the Caatinga of Brazil (Chiroptera, Phyllostomidae). ZooKeys 514:73-91. [ Links ]
29. Moratelli, R., A. L. Peracchi, D. Dias, & J. A. Oliveira. 2011. Geographic variation in South American populations of Myotis nigricans (Schinz, 1821) (Chiroptera, Vespertilionidae), with the description of two new species. Mammalian Biology 76:592-607. [ Links ]
30. Nogueira, M. R., & A. L. Peracchi. 2003. Fig-seed predation by 2 species of Chiroderma: discovery of a new feeding strategy in bats. Journal of Mammalogy 84:225-233. [ Links ]
31. Nogueira, M. R., I. P. Lima, R. Moratelli, V. C. Tavares, R. Gregorin, & A. L. Peracchi. 2014. Checklist of Brazilian bats, with comments on original records. Check List 10(4):808–821.
32. Nowak, R. M. 1994. Walker’s bats of the world. Baltimore, Johns Hopkins University Press, 287p.
33. Novaes, R. L. M., & R. S. Laurindo. 2014. Morcegos da Chapada do Araripe, nordeste do Brasil. Papeis Avulsos Zoologia 54:315-328. [ Links ]
34. Novaes, R. L. M., R. D. S. Laurindo, & R. D. F. Souza. 2015. Structure and natural history of an assemblage of bats from a xerophytic area in the Caatinga of northeastern Brazil. Studies on Neotropical Fauna and Environment 50:40-51. [ Links ]
35. Oliveira, J. A., P. R. Gonçalves, & C. R. Bonvicino. 2003. Mamíferos da Caatinga. Ecologia e Conservação da Caatinga (I. R. Leal, M. Tabarelli, & J. M. C. D. Silva, eds). Editora da UFPE, Recife. [ Links ]
36. Oliveira, J. D., H. L. Quesado, E. P. Nunes, & F. D. A. Viana. 1988. Observações preliminares da fenologia de plantas da caatinga na Estação Ecológica de Aiuba. Coleção Mossorossense 538. [ Links ]
37. Paglia, A. P. et al. 2012. Lista anotada dos mamíferos do Brasil. 2. ed. Occasional Papers in Conservation Biolology. 6:1-76. [ Links ]
38. Prado, D. E. 2003. As caatingas da América do Sul. Pp. 3-73, em: Ecologia e conservação da caatinga (I. R. Leal, M. Tabarelli & J. M. C. Silva, eds.). Universitária da UFPE, Recife. [ Links ]
39. Rocha, P. A., A. Feijó, M. A. Pedroso, & S. F. Ferrari. 2015a. First record of the big free-tailed bat, Nyctinomops macrotis (Chiroptera, Molossidae), for the semi-arid caatinga scrublands of northeastern Brazil. Mastozoología Neotropical 22:195-200. [ Links ]
40. Rocha, P. A., J. Ruiz-Esparza, A. S. Ribeiro, & S Ferrari. 2015b. Species diversity and seasonal variation in the composition of a bat community in the semiarid Brazilian caatinga. Acta Scientiarum. Biological Sciences 37(2):197-203. [ Links ]
41. Sá-Neto, R. J., & J. Marinho-Filho. 2013. Bats in fragments of xeric woodland Caatinga in Brazilian semiarid. Journal of the Arid Environments 90:88-94. [ Links ]
42. Silva, S. S., D. Dias, M. A. Martins, P. G. Guedes, J. C. Almeida, A. P. Cruz, & A. L. Peracchi. 2015. Bats (Mammalia: Chiroptera) from the Caatinga scrublands of the Crateus region, northeastern Brazil, with new records for the state of Ceará. Mastozoología Neotropical 22:335-348. [ Links ]
43. Silva, S. S. P., P. G. Guedes, & A. L. Peracchi. 2001. Levantamento preliminar dos morcegos do Parque Nacional de Ubajara (Mammalia, Chiroptera), Ceará, Brasil. Revista Brasileira de Zoologia 18(1):139-144. [ Links ]
44. Simmons, N. B. 2005. Order Chiroptera. Mammal species of the world: a taxonomic and geographic reference (D. E. Wilson, & D. M. Reeder, eds.). Johns Hopkins University Press, Baltimore, OH. [ Links ]
45. Simmons, N. B., & R. S. Voss. 1998. The mammals of Paracou, French Guiana: A Neotropical lowland rainforest fauna, Part 1. Bats. Bulletin of the American Museum of Natural History 37:1-219. [ Links ]
46. Simmons, N. B., & A. L. Wetterer. 2010. Estimating diversity: how many bat species are there? 15th International Bat Research Conference. 380p. [ Links ]
47. Straube, F. C., & G. V. Bianconi. 2002. Sobre a grandeza e a unidade utilizada para estimar esforço de captura com utilização de redes-de-neblina. Chiroptera Neotropical 8:150-152. [ Links ]
48. Tavares, V., & L. Aguirre. 2008. Micronycteris sanborni. The IUCN Red List of Threatened Species: e.T40029A10308158. http://dx.doi.org/10.2305/IUCN.UK.2008.RLTS.T40029A10308158.en. [ Links ]
49. Willig, M. R. 1983. Composition, microgeographic variation and sexual dimorphism in Caatingas and Cerrado bat communities from northeastern Brazil. Bulletin of Carnegie Museum of Natural History, Pittsburgh 23:1-131. [ Links ]
50. Willig, M. R. 1985. Reproductive patterns of bats from caatingas and cerrado biomes in northeast Brazil. Journal of Mammalogy 66:668-681. [ Links ]
MATERIAL SUPLEMENTAR ON-LINE
Fotos das espécies capturadas na ESEC Aiuaba.
https://www.sarem.org.ar/wp-content/uploads/2017/00/SAREM_MastNeotrop_24-2_Feijo-sup1.pdf














