Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.25 no.1 Mendoza June 2018
ARTÍCULO
Variação na dieta de Artibeus lituratus e Sturnira lilium (Chiroptera: Phyllostomidae) em três regiões fitogeográficas no sul do Brasil
Daniela A. S. Bôlla1, Fernando Carvalho2, 3, 4, Janaina Gazarini5, Jairo J. Zocche2, 3, 4 e Wagner A. Pedro6
1 Programa de Pós-Graduação em Ecologia, Instituto Nacional de Pesquisas da Amazônia (INPA), Manaus, Brasil. [Correspondência: <danielabolla@hotmail.com>]
2 Programa de Pós-Graduação em Ciências Ambientais, Universidade do Extremo Sul Catarinense, Criciúma, SC, Brasil.
3 Laboratório de Zoologia e Ecologia de Vertebrados da Universidade, Extremo Sul Catarinense, Criciúma, SC, Brasil.
4 Laboratório de Ecologia de Paisagem e de Vertebrados, Universidade do Extremo Sul Catarinense, Criciúma, Brasil.
5 Faculdade de Ciências Biológicas e Ambientais, Universidade Federal de Dourados, Dourados, MS, Brasil.
6 Departamento de Apoio, Produção e Saúde Animal, Faculdade de Medicina Veterinária da UNESP, Campus Araçatuba, Araçatuba, SP, Brasil.
Recibido 12 diciembre 2016.
Aceptado 10 mayo 2017.
Editor asociado: R Gregorin
RESUMO.
Phyllostomidae possui a maior diversidade morfológica e ecológica dentre os morcegos neotropicais desempenhando importantes papéis em ambientes florestais, tal como a dispersão de sementes. O objetivo do presente estudo foi comparar a dieta de Artibeus lituratus e Sturnira lilium em três regiões fitogeográficas do bioma Mata Atlântica - Floresta Ombrófila Densa (FOD), Floresta Estacional Semidecidual (FES) e Formação Pioneira com Influência Marinha (FPIM) - na Região Sul do Brasil. Os morcegos foram amostrados mensalmente com redes de neblina, seguindo o protocolo padrão para análise de dieta. Analisamos os dados de composição da dieta conforme atributos de riqueza, abundância e similaridade entre as três regiões amostradas (escalonamento multidimensional não métrico - NMDS e Índice de Bray-Curtis). Para A. lituratus e S. lilium o maior número de amostras provém da FES. Em todas as três regiões fitogeográficas, Ficus e Cecropia foram os gêneros mais consumidos por A. lituratus e Solanum por S. lilium. A abundância dos itens alimentares de A. lituratus e S. lilium foi influenciada pelas regiões fitogeográficas com a presença de agrupamentos distintos entre as amostras de FES, FOD e FPIM. A diferenciação da composição das dietas de A. lituratus e S. lilium entre as três fitofisionomias analisadas corrobora a hipótese de que a estrutura da vegetação influencia a composição da dieta dos morcegos. Essa diferença pode ser detectada apenas quando os itens alimentares são identificados em nível de espécie ou morfo-espécie.
ABSTRACT.
Variation of the diet of Artibeus lituratus and Sturnira lilium (Chiroptera: Phyllostomidae) in three phytogeographic regions of southern Brazil.
The family Phyllostomidae has the greatest morphological and ecological diversity among Neotropical bats, playing important roles in forest environments. This study aimed to compare the diet of Artibeus lituratus and Sturnira lilium in three phytophysiognomies in the Atlantic Forest biome in Southern Brazil - Ombrophilous Dense Forest (FOD), Semideciduous Seasonal Forest (FES) and Restinga (FPIM). Bats were sampled monthly along a year using mist nets. Bat's diet was analyzed in feces following a standardized protocol. We analyzed data on diet composition by richness, abundance and similarity among the three sampled regions (Non-metric Multidimensional Scaling and Bray-Curtis Index). Samples from FES were the most abundant for both A. lituratus and S. lilium, with Ficus and Cecropia being the most consumed genera for the first species and Solanum for the second one in all sampled sites. The abundance of feeding items varied across phytogeographic regions.
Palavras-chave: Frugivoria; Mata Atlântica; Morcegos; Plasticidade alimentar.
Key words: Atlantic Forest; Bats; Feeding plasticity; Frugivory.
INTRODUÇÃO
Dentre as famílias de morcegos neotropicais, Phyllostomidae possui a maior diversidade morfológica e ecológica (Fenton et al. 1992). No Brasil, 92 espécies de morcegos filostomídeos possuem ocorrência confirmada, das quais 63 espécies são fitófagas (Bredt et al. 2012). Dessas espécies, 35 são predominantemente frugívoras (Nogueira et al. 2014) desempenhando importante papel na dispersão de sementes (Fleming & Sosa 1994). Algumas dessas espécies ocorrem em diversos ambientes e apresentam amplas áreas de distribuição no Brasil, como é o caso de Artibeus lituratus (Olfers, 1818) (Maques‑Aguiar 2008) e Sturnira lilium (É. Geoffroy, 1810) (Velazco & Patterson 2013).
Estas duas espécies são endêmicas da região Neotropical (Peracchi et al. 2011), presentes desde centros urbanos até áreas florestais preservadas (Luz et al. 2011; Marques-Aguiar 2007; Moras et al. 2013; Esberárd et al. 2014). Artibeus lituratus e S. lilium desenvolveram algumas especializações alimentares, com a primeira espécie consumindo principalmente frutos de Ficus L. e Cecropia Loefl e a segunda, frutos de Solanum L. e Piper L. (Nowak 1994; Passos et al. 2003; Mello et al. 2008; Lobova et al. 2009). Recentemente, essas especializações levaram à hipótese de que, ao longo de toda área de distribuição, A. lituratus e S. lilium apresentam forte consistência em seus padrões alimentares (Parolin et al. 2016).
Os gêneros Ficus, Cecropia, Solanum e Piper são muito diversificados e amplamente distribuídos em regiões tropicais e subtropicais (Berg 1989; Franco-Rosselli & Berg 1997; Quijano‑Abril et al. 2006; Angra et al. 2009). Esses gêneros possuem inúmeras espécies registradas como recurso nas dietas de A. lituratus e S. lilium (Lobova et al. 2009; Bredt et al. 2012). Em um ambiente altamente heterogêneo como a Mata Atlântica, ainda que esses gêneros estejam presentes em todas as regiões fitogeográficas do Bioma, existem variações na riqueza e na frequência de ocorrência das espécies (Vibrans et al. 2013).
A Mata Atlântica possui elevada riqueza e diversidade de espécies vegetais, as quais estão distribuídas em diferentes regiões fitogeográficas (IBGE 2012). Dentre essas regiões presentes na Região Sul do Brasil, há um gradiente de diversidade com a Floresta Ombrófila Densa (FOD) apresentando maior riqueza, seguida pelas florestas estacionais (Estacional Semidecidual e Decidual), e por último, as florestas costeiras, que abrangem áreas de Formação Pioneira com Influência Marinha (FPIM) ou "Restinga" (Oliveira-Filho et al. 2013). Essa variação é explicada principalmente por fatores climáticos, tais como temperatura e precipitação (Gonçalves & Souza 2014; Rezende et al. 2015). Fatores como vento, instabilidade e salinidade do solo também contribuem para o decréscimo no número de espécies em regiões de FPIM (Falkenberg 1999; Scherer et al. 2005; MMA 2010).
Ao longo dessas três regiões fitogeográficas da Mata Atlântica, inúmeros trabalhos sobre a composição da dieta de A. lituratus e S. lilium já foram realizados (Muller & Reis 1992; Sipinski & Reis 1995; Mikich 2002; Passos et al. 2003; Brito et al. 2010). Entretanto, esses descrevem somente o número de itens e a frequência em que eles aparecem nas dietas em apenas um ambiente. Poucos são os estudos que comparam a composição da dieta entre diferentes sítios (e.g. Passos & Graciolli 2004) ou ao longo da área de distribuição das espécies de morcegos (Parolin et al. 2016). Contudo, observações sobre a alteração da dieta de algumas espécies entre diferentes regiões já foram realizadas (Silva et al. 2008). Dentro deste contexto, nossa hipótese é de que variações na composição da vegetação das diferentes regiões fitogeográficas resultam em variação na dieta de A. lituratus e S. lilium. Para testar essa hipótese comparamos a dieta destas espécies em três regiões fitogeográficas do bioma Mata Atlântica, na Região Sul do Brasil.
MATERIAIS E MÉTODOS
Áreas de estudo
Nós amostramos três áreas, as quais representam três regiões fitogeográficas do bioma Mata Atlântica, na Região Sul do Brasil. A Área 1 corresponde à Floresta Estacional Semidecidual, abrangendo dois fragmentos florestais do município de Maringá (23° 25' S e 51° 55' O, Fig. 1), centro-norte do estado do Paraná: o Parque Municipal do Ingá (48 hectares) e o Parque Florestal dos Pioneiros (59 hectares). A vegetação em ambas as áreas está em estádio secundário de regeneração. O clima do Município, segundo classificação de Köppen, é do tipo Cfb, com estação chuvosa entre os meses de dezembro e março (Alvares et al. 2013). A Área 2 insere-se na Floresta Ombrófila Densa, dentro dos limites da Reserva Particular do Patrimônio Natural Salto Morato (2340 hectares) no município de Guaraqueçaba (25° 10' S e 48° 15' O, Fig. 1), litoral norte do estado do Paraná (FBPN 2001). Nesta área, a vegetação encontra-se em estádio secundário de regeneração e o clima, segundo classificação de Köppen, é do tipo Cfa, sem estação seca definida (Alvares et al. 2013). A Área 3 caracteriza-se como Formação Pioneira de Influência Marinha (FPIM), também denominada de Restinga. Ela abrange um fragmento florestal (7.2 hectares) no município de Jaguaruna (28° 35' S e 48° 58' O, Fig. 1), litoral sul do estado de Santa Catarina. Segundo a classificação de Köppen, o clima da região também é classificado Cfa, sem estação seca definida (Alvares et al. 2013). A vegetação nesta área encontra-se em estádio secundário de sucessão.

Fig. 1. Localização das áreas de estudo nos estados do Paraná e Santa Catarina, sul do Brasil, com delimitação das Regiões Fitogeográficas adaptadas de IBGE (2012) onde: Área 1 refere-se ao município de Maringá, na região fitogeográfica FES; Área 2 refere-se à localização da Reserva Particular do Patrimônio Natural Salto Morato na região fitogeográfica FOD, município de Guaraqueçaba e; Área 3 refere-se à localidade de Jabuticabeira, na região fitogeográfica FPIM, no município de Jaguaruna, Santa Catarina
Captura dos morcegos, coleta de amostras fecais e análise de dados
As três fitofisionomias foram amostradas ao longo de um ano, em períodos diferentes. Na Área 1, as amostragens ocorreram entre agosto de 2006 e julho de 2007, com duas noites consecutivas de amostragem mensais (N = 24), utilizando em cada noite, sete redes (7 x 2.5 m). A Área 2 foi amostrada entre setembro de 2013 e agosto de 2014, com seis noites consecutivas de amostragem mensais (N = 72), utilizando 18 redes em cada noite (três de 12 x 2.5 m; nove de 9 x 2.5 m e; seis de 9 x 2.5 m). Na Área 3 as amostragens ocorreram entre março de 2014 e fevereiro de 2015, com duas noites mensais não consecutivas (N = 24), com 10 redes em cada noite (quatro de 12 x 2.5 m; quatro de 9 x 2.5 m e duas de 6 x 2.5 m). Em todos os ambientes as redes permaneceram abertas em média por seis horas após início do crepúsculo, sendo revisadas em intervalos regulares de 20 minutos.
Depois de capturados e retirados das redes, os morcegos foram contidos individualmente em sacos de algodão, onde permaneceram por 40 minutos para obtenção de amostras de fezes (Mikich 2002). As amostras foram armazenadas em tubos plásticos, etiquetadas e encaminhadas para laboratório, onde fizemos a triagem seguindo o protocolo de Passos et al. (2003). A denominação dos itens alimentares consumidos é a mesma para ambas as espécies. Os morcegos foram identificados com as chaves taxonômicas de Marques-Aguiar (2008) e Miranda et al. (2011).
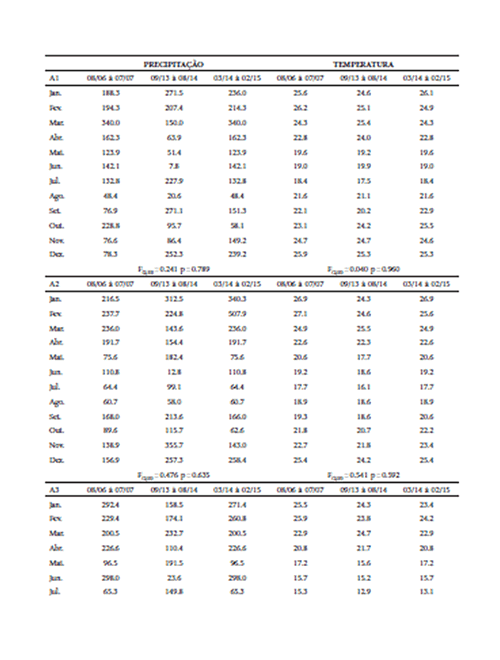
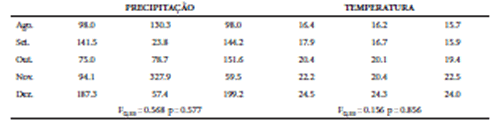
Em virtude da diferença temporal na realização das amostragens, utilizamos uma Análise de Variância (ANOVA) para testarmos se houve diferença nos padrões de precipitação e temperatura nas áreas amostradas, uma vez que esses poderiam influenciar os padrões de frutificação das plantas e consequentemente o seu consumo pelos morcegos (Heithaus et al. 1975; Dinerstein 1985; Mello et al. 2008). Para isso, obtivemos junto à base de dados online do Instituto Nacional de Meteorologia (INMET - http://www.inmet.gov.br), os valores médios mensais de precipitação e temperatura para as estações meteorológicas mais próximas às áreas amostradas (Maringá = Área 1; Guaraqueçaba = Área 2 e; Urussanga = Área 3). Os dados indicam que, para as três áreas amostradas, não houve nenhum evento atípico que tenha alterado os padrões de precipitação e temperatura nesses períodos (p > 0.05, Tabela 1), possibilitando assim a comparação dos dados referentes à dieta de A. lituratus e S. lilium nas três áreas.
Tabela 1 Valores médios mensais de precipitação, temperatura e comparação por ANOVA de uma via (F), para os períodos amostrados (mês/ano), nas três regiões fitogeográficas do bioma Mata Atlântica na Região Sul do Brasil, onde A1 = Área 1; A2 = Área 2 e; A3 = Área 3.
A identificação das sementes foi baseada em material de referência coletado em todos os pontos amostrados, germinação das sementes e consulta a herbários. A nomenclatura dos táxons identificados somente ao nível de gênero ou morfo-espécie é a mesma para A. lituratus e S. lilium. A análise da dieta dos morcegos baseou-se em atributos de riqueza e abundância. Nós utilizamos um Escalonamento Multidimensional Não Métrico (NMDS) para avaliar a similaridade na composição da dieta das duas espécies nas três regiões fitogeográficas amostradas. Para a ordenação, utilizamos os dados de abundância dos itens consumidos e o Índice de Bray-Curtis para obter a ordenação de abundância dos itens alimentares de acordo com as áreas amostradas. Essas análises foram realizadas no software PAST, versão 3.1 (Hammer et al. 2001).
RESULTADOS
Nós coletamos 160 amostras de fezes de A. lituratus, das quais 46% provêm da FES, 38% da FOD e 15% da FPIM. Os gêneros mais consumidos nas três regiões fitogeográficas foram Ficus e Cecropia. Na FOD, A. lituratus consumiu predominantemente Ficus adhatodifolia Schott. (46%) e Cecropia glaziovii Snethl. (36%). A última espécie também teve grande representatividade na FES (20%), juntamente com Ficus sp. 1 (30%) e F. guaranitica Mill. (19%). Cecropia pachystachya Trécul foi um dos três itens predominantes na dieta de A. lituratus na FPIM (32%), seguida de Ficus sp. 3 e Ficus cestrifolia Schott. (28% cada, Tabela 2). Dentre as três regiões fitogeográficas analisadas, a dieta de A. lituratus foi mais diversificada na FOD (S = 9). A ordenação dos valores de abundância dos itens alimentares em função das regiões fitogeográficas demonstra que a dieta de A. lituratus diferiu entre FES, FOD e FPIM (Fig. 2).
Tabela 2 Lista de espécies de plantas consumidas por A. lituratus nas três regiões fitogeográficas amostradas na Região Sul do Brasil, sendo N = número absoluto de amostras e % = abundância relativa por região fitogeográfica sendo; FOD = Floresta Ombrófila Densa; FES = Floresta Estacional Semidecidual; FPIM = Formação Pioneira de Influência Marinha. Números entre parênteses demonstram a quantidade de taxa consumida por região.

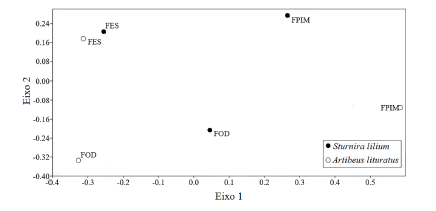
Fig. 2. Escalonamento multidimensional não métrico (NMDS), utilizando Índice de Similaridade de Bray-Curtis dos valores de abundância dos itens alimentares de Artibeus lituratus e Sturnira lilium em três regiões fitogeográficas, no sul do Brasil, onde: FES = Floresta Estacional Semidecidual; FOD = Floresta Ombrófila Densa e; FPIM = Formação Pioneira com Influência Marinha.
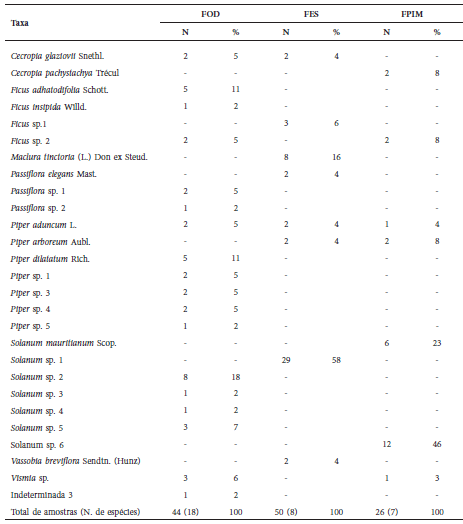
Para S. lilium nós coletamos 120 amostras de fezes, sendo que FES contribuiu com 42% do total, FOD com 36% e FPIM com 22%. O gênero de maior abundância na dieta foi Solanum L. (51% da amostra). Na FOD, S. lilium apresentou a dieta mais diversificada, incluindo Solanum sp. 2 (18% da amostra), Piper dilatatum Rich (11%) e Ficus adhatodifolia (11%). Na FES, Solanum sp. 1 teve grande representatividade, correspondendo a 60% dos itens. Maclura tinctoria (L.) Don ex Steud., ausente nas demais regiões fitogeográficas foi a segunda espécie mais consumida na FES (17%). Em FPIM, Solanum sp. 6 e Solanum mauritianum Scop. foram os itens mais consumidos, representando 70% da dieta desta espécie (Tabela 3). Assim como registrado para A. lituratus, a dieta mais diversificada de S. lilium foi em FOD, incluindo 18 itens alimentares (Tabela 3). A ordenação dos valores de abundância dos itens consumidos em função das três regiões fitogeográficas, também demonstra que a dieta de S. lilium diferiu entre FES, FOD e FPIM (Fig. 2).
Tabela 3 Lista de espécies de plantas consumidas por S. lilium em três regiões fitogeográficas amostradas na Região Sul do Brasil, sendo N = número absoluto de amostras e % = abundância relativa por região fitogeográfica, sendo; FOD = Floresta Ombrófila Densa; FES = Floresta Estacional Semidecidual; FPIM = Formação Pioneira de Influência Marinha. Números entre parênteses demonstram a quantidade de taxa consumida por região.
DISCUSSÃO
A composição das dietas de A. lituratus e S. lilium diferiram entre as três regiões fitogeográficas analisadas, corroborando assim a hipótese inicial do presente estudo. Essa diferenciação é facilmente observada quando a composição das dietas é analisada em nível de espécie ou morfo-espécie Entretanto, em nível de gênero, ambas as espécies consomem os mesmos itens vegetais nas três regiões, mantendo o padrão de consistência alimentar descrito por Parolin et al. (2016).
A dieta de A. lituratus e S. lilium foi mais diversificada na Floresta Ombrófila Densa, quando comparada com Floresta Estacional Semidecidual e Formação Pioneira com Influência Marinha. Este também é o padrão observado no que se refere a riqueza e diversidade de árvores e arbustos, para estas regiões fitogeográficas no Sul do Brasil (Oliveira-Filho et al. 2013; Gonçalves & Souza 2014; Rezende et al. 2015). Esses atributos reforçam a hipótese de que a composição e a amplitude da dieta de A. lituratus e S. lilium estejam fortemente relacionadas à composição florística das áreas de ocorrência desses quirópteros. Uma análise mais detalhada da composição da dieta destas espécies em outras regiões fitogeográficas do bioma Mata Atlântica poderá fornecer indícios mais precisos sobre a influência da composição florística nos padrões alimentares de A. lituratus e S. lilium. A identificação do consumo de itens alimentares típicos de cada região fitogeográfica pelos morcegos melhora nossa compreensão sobre a biologia e a ecologia de espécies neotropicais, auxiliando no planejamento de ações para conservação do grupo em diferentes ambientes.
Para A. lituratus, a diferença na composição da dieta entre as regiões fitogeográficas foi influenciada pela frequência de ocorrência dos itens, e não pela riqueza destes. Por exemplo, na FOD poucas espécies do gênero Ficus foram consumidas, havendo grande consumo de Piper. Na FES houve o consumo de maior riqueza de Ficus e Solanum, consumo de Maclura e ausência de sementes de Piper nas fezes. Para FPIM, três itens (C. pachystachya, F. cestrifolia e Ficus sp. 3) correspondem a 88% dos itens consumidos. Modificações na dieta, em decorrência da presença ou ausência de determinados itens alimentares, foram também reportadas para populações de A. lituratus no litoral sul do Paraná (Passos & Graciolli 2004).
Já para S. lilium, a diferença na composição da dieta entre as regiões fitogeográficas foi influenciada tanto pelo número de itens consumidos, quanto pela frequência dos mesmos. Em ambientes mais diversificados como a FOD, a dieta desta espécie tende a ser mais diversificada e com baixa dominância (Mello et al. 2009; Passos et al. 2003). Em ambientes menos diversos, a dieta se concentra em poucas espécies consumidas com grande frequência (Brito et al. 2010). Além disso, pode ocorrer o consumo de itens raramente registrados como recurso alimentar desta espécie (Rosa 2004; Lopez & Vaughan 2007), tais como frutos de Bromeliaceae em FPIM (Carvalho et al. 2009) e Maclura na FES (Mikich 2002; Brito et al. 2010).
Artibeus lituratus e S. lilium frequentemente consumiram frutos de Cecropia nas três regiões fitogeográficas (C. glaziovii em FES e FOD; C. pachystachya em FPIM). Esse táxon é composto por plantas pioneiras que atuam como espécies-chave para a alimentação da fauna frugívora (Berg et al. 2005; Kaminski 2013; Gonçalves & Vitorino 2014) sendo um importante recurso alimentar para diversas espécies de morcegos (Lobova et al. 2003; Sato et al. 2008; Bredt et al. 2012). Para A. lituratus, outro item alimentar importante foi Ficus, um dos gêneros dominantes no estrato arbóreo em ambientes de FOD e FES (Roderjan et al. 2002). Com importância reconhecida em estudos de frugivoria de Artibeus spp. (Fleminget al. 1978), os figos são itens muito consumidos por outros grupos de vertebrados (Aguiar et al. 2003; Ragusa-Netto 2002) e aparecem como importante recurso na escassez de frutos sazonais (Bronstein & Hoffmann 1987).
Maclura tinctoria teve elevada frequência de ocorrência na dieta das espécies analisadas, todavia seu consumo foi restrito à FES. Essa espécie possui registros desde o norte até o sul do Brasil, ocorrendo em diferentes regiões fitogeográficas (Carvalho 2003; Sobral et al. 2006). Seus frutos são consumidos por diversas espécies de morcegos, dentre elas A. lituratus e S. lilium (Galetti & Morellato 1994; Mikich 2002; Lobova et al. 2009). Em ambientes com menor oferta de recursos, como na FES, M. tinctoria pode ser um importante recurso na dieta das espécies frugívoras, uma vez que fornece grande quantidade de frutos a cada período reprodutivo (Batillani et al. 2006). Assim, para compreender quais fatores influenciam o consumo desta espécie pelos morcegos, estudos específicos sobre essa interação deverão ser realizados nas diferentes regiões fitogeográficas. Além disso, o caráter oportunista da utilização de recursos pelas espécies de morcegos deve ser levado em conta, visto que geralmente são abundantes e generalistas, como as analisadas neste estudo.
Ainda que espécies tão comuns quanto A. lituratus e S. lilium sejam amplamente distribuídas e abundantes em várias regiões do Brasil, consumindo frutos de diversas espécies de plantas, suas dietas diferem de acordo com a região fitogeográfica em que estão inseridas. Isso demonstra que ainda há uma lacuna de conhecimento na ecologia e biologia de morcegos considerados de hábitos generalistas, assim como de outros quirópteros neotropicais. Dessa forma, estudos que comparem dados de diferentes regiões fitogeográficas são fundamentais para identificar e compreender as características e exigências ecológicas, principalmente as alimentares, de cada espécie em cada um dos ambientes que ocorrem.
AGRADECIMENTOS
Somos gratos à Fundação O Boticário de Proteção à Natureza pelo apoio logístico e financeiro durante as amostragens na RNSM (termo de parceria 0105-20112-BR); à SIBELCO Ltda. por ceder a área de estudo e pelo apoio logístico e financeiro durante as amostragens realizadas no município de Jaguaruna; ao CNPq pela Bolsa de doutorado cedida a FC entre os anos de 2012 e 2015, pelas Bolsas de Iniciação Científica e Mestrado cedidas à DASB entre os anos de 2015 e 2018; à CAPES pela bolsa de mestrado cedida à JG entre os anos de 2006 e 2007; a Viviane Mottin; Rodrigo Á. Mendonça; Melody M. Mattias, Cassius Ricardo Santana, João Eduardo Brito e Diego Pavei, pelo auxílio durante os trabalhos de campo; aos dois revisores anônimos e ao Dr. Renato Gregorin, pelos comentários e sugestões feitos na primeira versão do manuscrito.
LITERATURA CITADA
1. Aguiar, L. M., N. R. Reis, G. Ludwig, & V. J. Rocha. 2003. Dieta, área de vida, vocalizações e estimativas populacionais de Alouatta guariba em um remanescente florestal no norte do Estado do Paraná. Neotropical Primates 11(2):78-86. [ Links ]
2. Angra, M. F., K. Nurit-Silva, & L. R. Berger. 2009.Flora da Paraíba: Solanum L. (Solanaceae). Acta Botanica Brasilica 23(3):826-842. [ Links ]
3. Berg, C. C., P. F. Rosselli, & D. W. Davidson. 2005. Cecropia. Flora Neotropica 94:1-230. [ Links ]
4. Berg, C. C. 1989. Classification and distribution of Ficus. Experientia 45:605-611. [ Links ]
5. Bredt, A., W. Uieda, & W. A. Pedro. 2012.Plantas e morcegos na recuperação de áreas degradadas e na paisagem urbana. Redes de Sementes do Cerrado, Brasília. [ Links ]
6. Brito, J. E. C., J. Gazarini, & C. H. Zawadzki. 2010. Abundância e frugivoria da quiropterofauna (Mammalia, Chiroptera) de um fragmento no noroeste do Estado do Paraná, Brasil. Acta Scientiarum 32(3):265-271. [ Links ]
7. Bronstein, J. L., & K. Hoffmann. 1987. Spatial and temporal variation in frugivory at a Neotropical fig, Ficus pertusa. Oikos 49(3):261-268. [ Links ]
8. Carvalho, F., M. E. Fabián, & R. Á. Mendonça. 2009. Nota sobre o consumo de frutos de Billbergia zebrina (Bromeliaceae) por Sturnira lilium (Chiroptera: Phyllostomidae) no sul do Brasil. Chiroptera Neotropical 15(2):482-486. [ Links ]
9. Carvalho, P. E. R. 2003. Espécies arbóreas brasileiras. EMBRAPA, Brasília. [ Links ]
10. Dinerstein, E. 1985. Reproductive ecology of fruit bats in the seasonality of fruit production in a Costa Rican cloud forest. Biotropica 18(4):307-318. [ Links ]
11. Falkenberg, D. B. 1999. Aspectos da flora e da vegetação secundária da restinga de Santa Catarina, Sul do Brasil. Insula Revista de Botânica 28(28):1-30. [ Links ]
12. FBPN (Fundação O Boticário de Proteção à Natureza). 2001. Reserva Natural Salto Morato - Plano de Manejo. Fundação O Boticário de Proteção à Natureza, São José dos Pinhais, Paraná, Brazil. [ Links ]
13. Fenton, M. B. et al. 1992. Phyllostomid bats (Chiroptera: Phyllostomidae) as indicators of habitat disruption in the Neotropics. Biotropica 24(3):440-446. [ Links ]
14. Fleming, T. H., R. Breitwisch, & G. H. Whitesides. 1978. Patterns of tropical vertebrate frugivore diversity. Annual Review of Ecology and Systematics 18:91-109. [ Links ]
15. Fleming, T. H., & V. J. Sosa. 1994. Effects of nectarivorous and frugivorous mammals on reproductive success of plants. Journal of Mammalogy 75:845-851. [ Links ]
16. Franco-Rosselli, P., & C. C.Berg. 1997. Distributional patterns of Cecropia (Cecropiaceae): a panbiogeographic analysis. Caldasia 19(1-2):285-296. [ Links ]
17. Gonçalves, E. T., & A. F. Souza. 2014. Floristic variation in ecotonal areas: patterns, determinants and biogeographic origins of subtropical forest in South America. Austral Ecology (39):122-134. [ Links ]
18. Gonçalves, G. L., & B. D. Vitorino. 2014. Comportamento alimentar de aves em Cecropia pachystachya Trécul (Urticacea) em um ambiente urbano no município de Luz, Minas Gerais, Brasil. Biota Amazônia 4(3):100-105. [ Links ]
19. Hammer, Ø., D. A. T. Harper, & P. D. Ryan. 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4(1):1-9. [ Links ]
20. Heithaus, E. R., T. H. Fleming, & P. A. Opler. 1975. Foraging patterns and resource utilization in seven species of bats in a seasonal tropical forest.Ecology 56(4):841-854. [ Links ]
21. IBGE (Instituto Brasileiro de Geografia e Estatística). 2012. Manual técnico da vegetação brasileira. Fundação Instituto Brasileiro de Geografia e Estatística, Rio de Janeiro. [ Links ]
22. Kaminski, N. 2013. Consumo de frutos por três espécies de Picidae em área de Floresta Ombrófila Mista de Santa Catarina. Biotemas 26(3):261-263. [ Links ]
23. Lobova, A. T., A. S. Mori, F. Blanchard, H. Reckham, & P. Charles-Dominique. 2003. Cecropia as a food resource for bats in French Guiana and the significance of fruit structure in seed dispersal and longevity. American journal of Botany 90(3):388-403. [ Links ]
24. Lobova, T. A., C. K. Geiselman, & S. A. Mori. 2009. Seed dispersal by bats in the Neotropics. The New York Botanical Garden Press, New York. [ Links ]
25. Lopez, J. E., & C. Vaughan. 2007. Food niche overlap among Neotropical frugivorous bats in Costa Rica. Revista de Biología Tropical 55(1):301-313. [ Links ]
26. Luz, J. L., L. D. M. Costa, E. C. Lourenço, & C. E. L. Esbérard. 2011. Bats (Mammalia, Chiroptera) from Reserva Rio das Pedras, Rio de Janeiro, Southeastern Brazil. Biota Neotropica 11(1):95-101. [ Links ]
27. Marques-Aguiar, S.A. 2008.Genus Artibeus Leach, 1821. Gardner, A. L. Mammals of South America. The University of Chicago Press,Chicago. [ Links ]
28. Mello, M. A. R., E. K. V. Kalko, & W. R. Silva. 2008. Diet and abundance of the bat Sturnira lilium (Chiroptera) in a Brazilian montane Atlantic forest. Journal of Mammalogy 89(2):485-492. [ Links ]
29. Mello, M. A. R. 2009. Temporal variation in the organization of a Neotropical assemblage of leaf-nosed bats (Chiroptera: Phyllostomidae). Acta Oecologica, 35(2):280-286. [ Links ]
30. Mikich, S. B. 2002. A dieta dos morcegos frugívoros (Mammalia, Chiroptera, Phyllostomidae) de um pequeno remanescente de Floresta Estacional Semidecidual do sul do Brasil. Revista brasileira de Zoologia 19(1):239-249. [ Links ]
31. MMA (Ministériodo Meio Ambiente). 2010. Manual de Adequação Ambiental: Mata Atlântica. Ministério do Meio Ambiente/Secretaria de Biodiversidade e Florestas,Brasília. [ Links ]
32. Miranda, J. M. D., I. P. Bernardi, & F. C. Passos. 2011. Chave ilustrada para a determinação de morcegos da região sul do Brasil. João M.D. Miranda, Curitiba. [ Links ]
33. Miranda, J., L. Zago, F. Carvalho, M. B. Rubio, & I. P. Bernardi. 2015. Bats (Mammalia: Chiroptera) from the Middle Teles Pires River region, Southern Amazonia, Brazil. Acta Amazonica 45(1):89-100. [ Links ]
34. Moras, L. M., E. Bernard, & R. Gregorin. 2013. Bat assemblages at a high-altitude area in the Atlantic Forest of Southeastern Brazil. Mastozoología Neotropical 20(2):269-278. [ Links ]
35. Muller, M. F., & N. R. Reis.1992. Partição de recursos alimentares entre quatro espécies de morcegos frugívoros (Chiroptera; Phyllostomidae). Revista Brasileira de Zoologia 9(3-4):223-233. [ Links ]
36. Nogueira, M. R., I. P. Lima, R. Moratelli, V. C. Tavares, R. Gregorin, & A. L. Peracchi. 2014. Checklist of Brazilian bats, with comments on original records. Check List 10(4):808-821. [ Links ]
37. Nowak, R. M. 1994. Walker's Bats of the World. The Johns Hopkins University Press, London. [ Links ]
38. Oliveira-Filho, A. T., J. C. Budke, J. A. Jarenkow, P. V. Eisenlohr, & D. R. M. Neves. 2013. Delving into the variations in tree species composition and richness across South American subtropical Atlantic and Pampean forest. Journal of Plant Ecology 8(3):242-260. [ Links ]
39. Parolin, L. C., S. B. Mikich ,& G. V. Bianconi. 2015. Olfaction in the fruit-eating bats Artibeus lituratus and Carollia perspicillata: an experimental analysis. Anais da Academia Brasileira de Ciências 87(4):2047-2053. [ Links ]
40. Passos, F. C., & G. Graciolli. 2004. Observações da dieta de Artibeus lituratus (Olfers) (Chiroptera, Phyllostomidae) em duas áreas do sul do Brasil. Revista Brasileira de Zoologia 21(3):487-489. [ Links ]
41. Passos, F.C., W.R. Silva, W.A. Pedro, & M.R. Bonin. 2003. Frugivoria em morcegos (Mammalia, Chiroptera) no Parque Estadual Intervales, sudeste do Brasil. Revista Brasileira de Zoologia 20(3):511-517. [ Links ]
42. Passos, F. C., & M. Passamani. 2003. Artibeus lituratus (Chiroptera, Phyllostomidae): biologia e dispersão de sementes no Parque do Museu de Biologia Prof. Mello Leitão, Santa Teresa (ES). Natureza online 1(1):1-6. [ Links ]
43. Peracchi, A. L., I. P. Lima, N. R. Reis, M. R. Nogueira, & H. Ortêncio-Filho. 2011. Ordem Chiroptera. Mamíferos do Brasil. Volume II (N. R. Reis, A. L. Peracchi, W. A. Pedro & I. P. Lima, eds.). Nélio R. dos Reis, Londrina. [ Links ]
44. Quijano-Abril, M. A., R. Callejas-Posada, & D. R. Miranda-Esquivel. 2006. Areas of endemismo and distribution patterns of Neotropical Piper species (Piperaceae). Jounal of Biogeography 33:1266-1278. [ Links ]
45. Rezende, V. L., P. V. Eisenlohr, A. C. Vibrans, & A. T. Oliveira-Filho. 2015. Humidity, low temperature extremes, and space influence floristic variation across an insightful gradient in the Subtropical Atlantic Forest. Plant Ecology 0216(6):759-774. [ Links ]
46. Roderjan, C. V., F. Galvão, Y. S. Kuniyoshi, & G. G. Hatschbach. 2002. As unidades fitogeográficas do estado do Paraná, Brasil. Ciência & Ambiente 24:75-92. [ Links ]
47. Rosa, S. D. 2004. Morcegos (Chiroptera, Mammalia) de um remanescente de restinga, estado do Paraná, Brasil: Ecologia da comunidade e dispersão de sementes. 115 f. Dissertação Mestrado. Universidade Federal do Paraná, Curitiba. [ Links ]
48. Sato, T. M., F. C. Passos, & A. C. Nogueira. 2008. Frugivoria de morcegos (Mammalia, Chiroptera) em Cecropia pachystachya (Urticaceae) e seus efeitos na germinação das sementes. Papéis Avulsos de Zoologia 48(3):19-26. [ Links ]
49. Scherer, A., F. Maraschin-Silva, & L. R. M. Baptista. 2005. Florística e estrutura do componente arbóreo de matas de Restinga arenosa no Parque Estadual de Itapuã, RS, Brasil. Acta Botanica Brasilica 19(4):717-726. [ Links ]
50. Silva, A. G., O. Gaona, & R. A. Medellín. 2008. Diet and trophic structure in a community of fruit-eating bats in Lacandon forest, México. Journal of Mammalogy 89(1):43-49. [ Links ]
51. Sipinski, E. A. B., & N. R. Reis. 1995. Dados ecológicos dos quirópteros da Reserva de Volta Velha, Itapoá, Santa Catarina, Brasil. Revista Brasileira de Zoologia 12(3):519-528. [ Links ]
52. Velazco, P. M., & B. D. Patterson. 2013. Diversification of the yellow-shouldered bats, genus Sturnira (Chiroptera, Phyllostomidae), in the New World tropics. Molecular Phylogenetics and Evolution 68(3):683-698. [ Links ]
53. Vibrans, A. C., L. Sevgnani, D. V. Lingner, A. L. Gasper, & S. Sabbagh. 2013. Inventário florístico florestal de Santa Catarina (IFFSC). Edifurb, Blumenau. [ Links ]














