Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Mastozoología neotropical
Print version ISSN 0327-9383On-line version ISSN 1666-0536
Mastozool. neotrop. vol.25 no.2 Mendoza Dec. 2018
ARTÍCULO
Atividade reprodutiva e estrutura populacional de Myotis nigricans (Schinz, 1821) (Chiroptera: Vespertilionidae) no sul do Brasil
Viviane Mottin1, Fernando Carvalho1, 2*, Daniela A. S. Bôlla3, João M. D. Miranda4, Thuany Sergio Machado5 e Fernando C. Passos6
1 Laboratório de Zoologia e Ecologia de Vertebrados da Universidade do Extremo Sul Catarinense, Criciúma, SC. [Correspondência: Fernando Carvalho <f.carvalho@unesc.net>]
2 Programa de Pós-Graduação em Ciências Ambientais da Universidade do Extremo Sul Catarinense (UNESC), Criciúma, SC.
3 Programa de Pós-Graduação em Ecologia do Instituto Nacional de Pesquisas da Amazônia (INPA), Manaus, AM.
4 Departamento de Biologia da Universidade Estadual do Centro-Oeste (UNICENTRO), Guarapuava, PR.
5 Curso de Ciências Biológicas da Universidade do Extremo Sul Catarinense (UNESC), Criciúma, SC.
6 Departamento de Zoologia da Universidade Federal do Paraná (UFPR), Curitiba, PR.
RESUMO
Dentre os mamíferos, os morcegos compõem o grupo com a maior diversidade de estratégias reprodutivas. Nesse estudo, analisamos as características reprodutivas e a estrutura populacional de Myotis nigricans nos 12 meses do ano, em uma região de clima temperado no sul do Brasil. Nós desenvolvemos o estudo em um abrigo antrópico, localizado no município de Pedras Grandes, no estado de Santa Catarina. Nós capturamos os morcegos mensalmente com redes de neblina instaladas na saída do abrigo e identificamos os indivíduos capturados quanto ao sexo, condição reprodutiva e classe etária. O tamanho populacional estimado da colônia variou de 596 à 1050 indivíduos. Os nascimentos ocorreram principalmente entre os meses de setembro e janeiro, com mais de um evento de gravidez, caracterizando padrão poliéstrico sazonal e bimodal de reprodução. O período reprodutivo de M. nigricans no sul do Brasil assemelha-se ao registrado para outras regiões, todavia, não é possível descrever um padrão único ao longo da área de distribuição da espécie.
ABSTRACT
Reproductive activity and population structure of Myotis nigricans (Schinz, 1821) (Chiroptera: Vespertilionidae) in the southern Brazil.
Among mammals, bats present the greatest diversity in reproductive strategies. In this study we analyzed reproductive and population characteristics of Myotis nigricans over one year in a temperate region in Brazil. We carried out the samplings in an anthropic roost, in Pedras Grandes municipality, Santa Catarina state. We captured bats monthly with mist nets installed at the roosts exits and identified the captured individuals according to sex, reproductive condition and age. There was greatest number of females than males. Population size was estimated from 569 to 1050 individuals. Births occurred mainly from September to January, with more than one pregnancy event along the year, evidencing a seasonal and bimodal polyester pattern. The reproductive period of M. nigricans in southern Brazil is similar to the records made in other regions. Despite of it, there is no pattern along its distribution range.
Palavras chaves: Colônia maternidade; Mata Atlântica; Poliestria; Reprodução.
Key words: Atlantic Forest; Maternity colony; Polyesty; Reproduction.
Recibido 14 febrero 2018.
Aceptado 3 julio 2018.
Editor asociado: A. Chemisquy
Introdução
A reprodução é um período crítico e energeticamente custoso para a maioria dos organismos (Dinerstein 1986; Racey & Speakman 1987). Os processos relacionados à reprodução são frequentemente cíclicos, ocorrendo mais de uma vez durante a vida dos indivíduos (Weir & Rowlands 1973). Na maioria dos animais, estes ciclos são adaptados para que o nascimento ocorra em períodos energeticamente favoráveis (Fleming et al. 1972), dado o custo energético despendido nesse processo. Alguns animais, como os morcegos, apresentam características reprodutivas únicas (Korine et al. 2004) que visam aumentar as chances de sobrevivência das fêmeas e seus filhotes (Altringham 1996), tais como estocagem de espermatozoides, diapausa embrionária e variações no padrão temporal de reprodução (e.g. Crichton & Krutzsch 2000).
Na ordem Chiroptera existem dois tipos de comportamentos reprodutivos. O primeiro envolve a estocagem de espermatozoides viáveis no útero ou na vagina e é encontrado principalmente em espécies que vivem em regiões com clima temperado, onde o período de hibernação interrompe o ciclo reprodutivo (Taddei 1980). Apenas recentemente esse padrão foi descrito para morcegos de áreas tropicais (Araújo et al. 2013). O segundo tipo de comportamento reprodutivo expressa o padrão básico de reprodução dos mamíferos, quando a ovulação e a cópula coincidem (Wimsatt & Trapido 1952). Esse padrão básico é mais comum em morcegos de regiões tropicais e subtropicais e subdivide-se em outros quatro subtipos: (1) sazonalmente monoéstricos, que se reproduzem uma única vez no ano; (2) sazonalmente poliéstricos, que apresentam dois picos preferenciais de reprodução ao longo do ano; (3) extenso período reprodutivo com curto período de inatividade reprodutiva e; (4)atividade reprodutiva ao longo do ano todo (Fleming et al. 1972).
Dentre as famílias de morcegos, Vespertilionidae é a melhor conhecida quanto à sua biologia reprodutiva, principalmente para as espécies da América do Norte e Europa. Estudos com Vespertilionidae são desenvolvidos desde a década de 30 (e.g. Miller 1939; Kunz 1971, 1974; Wilson 1971; Wilson & La Val 1974; Racey & Speakman 1987; Pikula et al. 2017), com destaque para as espécies Eptesicus fuscus (Beauvois, 1796), Myotis daubentonii (Kuhl, 1817), Myotis lucifugus (Le Conte, 1831) e Myotis grisescens A. H. Howell, 1909. Na América do Sul, poucos são os trabalhos que abordam características reprodutivas dos vespertilíonideos (e.g. Willig 1985a; b; Peracchi & Albuquerque 1992; Bernard 2002; Mikalauskas 2007; Miranda et al. 2010; Araújo et al. 2013; Bernardi et al. 2013), sendo a maioria relacionados às espécies do gênero Myotis Kaup 1829.
Espécies do gênero Myotis apresentam distribuição cosmopolita, exceto nas regiões árticas, antárticas e em ilhas oceânicas mais isoladas (Nowak 1994). Estes animais utilizam grande variedade de estruturas como abrigo, desde construções antrópicas, telhados, vãos entre tijolos, cavidades subterrâneas e oco de árvores (Trajano 1984; Esbérard et al. 1999; Arnone & Passos 2007). Apesar da ampla distribuição, dados sobre seus padrões reprodutivos são conhecidos apenas por estudos realizados na Europa e América do Norte (Miller 1939; Solick & Barclay 2006; Krutzsch 2009; Frick et al. 2010). No Hemisfério Sul, estudos realizados na ilha de Barro Colorado, na América Central, mostraram que morcegos deste gênero possuem ciclo poliéstrico, com períodos de gestação de aproximadamente 60 dias, máximo de três gestações por ano (Wilson & LaVal 1974) e nascimentos entre primavera e verão (Walker 1968; Kunz 1971). As fêmeas formam colônias maternidade, com número reduzido de machos (Nowak 1994), os quais são geralmente solitários e ocupam essas colônias somente no período reprodutivo (Kunz & Pierson 1994).
No Brasil, estudos que abordam a biologia reprodutiva de Myotis foram realizados por Willig (1985b) com Myotis nigricans (Schinz, 1821) na Caatinga; por Miranda et al. (2010) e Araújo et al. (2013) com Myotis levis (I.Geoffroy, 1824) nas regiões Sul e Sudeste, respectivamente, e por Bernardi et al. (2013) sobre reprodução de Myotis ruber (É. Geoffroy, 1806) também para a Região Sul.
Informações sobre a biologia reprodutiva dos morcegos no Brasil provêm geralmente de observações pontuais, o que dificulta a identificação de padrões, principalmente para espécies com amplas áreas de distribuição (Marinho-Filho 2003), tais como aquelas do gênero Myotis (Wilson 2008). Além disso, a baixa frequência de captura de Myotis em estudos desenvolvidos com redes de neblina em diferentes regiões (e.g. Esbérard 2003; Bianconi et al. 2004; Bordignon 2006; Dias & Peracchi 2008; Bôlla et al. 2017) contribui para a permanência destas lacunas de conhecimento. Amostragens realizadas em abrigos destas espécies correspondem a uma importante ferramenta para se obter dados de muitos indivíduos simultaneamente, o que possibilita o estudo de biologia reprodutiva e estrutura populacional, por exemplo (e.g. Tamsitt & Valdivieso 1963; Esbérard 2002; Miranda et al. 2010; Esbérard 2011; Humphrey & Oli 2015). Dentro do exposto, nosso objetivo foi descrever a atividade reprodutiva e a estrutura populacional de uma colônia de M. nigricans, ao longo dos 12 meses do ano em uma região de clima temperado na Região Sul do Brasil.
Material e métodos
Realizamos o estudo em uma área de Floresta Ombrófila Densa Submontana (IBGE 2012) no sul do estado de Santa Catarina (28°26¢58²S e 49°11¢31²O, 58 metros de altitude em relação ao nível do mar), na Região Sul do Brasil (Fig. 1). Segundo classificação de Köppen, o clima é do tipo Cfa, caracterizado como subtropical úmido, sem estação seca definida e com verões quentes (Alvares et al. 2013). Segundo dados do Instituto Nacional de Meteorologia para o sul de Santa Catarina, os meses mais quentes são janeiro, fevereiro e março, quando a temperatura média fica acima dos 23oC. Os meses mais frios são junho, julho e agosto, quando a temperatura não ultrapassa os 16oC. A precipitação é bem distribuída ao longo dos meses, com janeiro, fevereiro e março sendo o período mais chuvoso, com precipitação média superior a 200 mm. Ao contrário, abril, junho e julho são os mais secos, com precipitação abaixo de 115 mm.
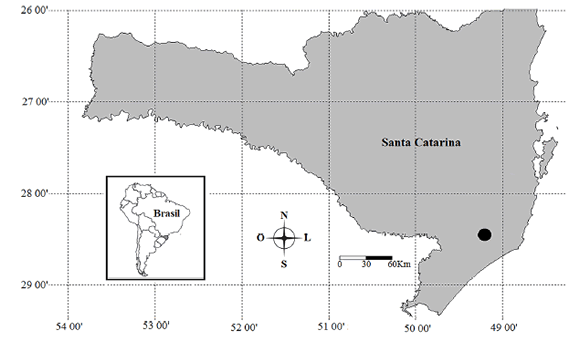
Fig. 1. Localização da área de estudo, onde destaca-se a América do Sul, Brasil, juntamente com a posição do estado de Santa Catarina, o qual está em ampliação e situa-se o município de Pedras Grandes (l), região sul do estado de Santa Catarina, sul do Brasil.
Para obtenção dos dados reprodutivos, realizamos uma noite de captura em cada mês, entre maio de 2012 e julho de 2013. Capturamos os morcegos com duas redes de neblina (uma de 9 x 3 m e uma de 6 x 3 m) instaladas na saída de um abrigo antrópico de M. nigricans. As redes ficaram expostas por quatro horas após início do crepúsculo, o que resultou em um esforço amostral total de 2700 m2/h, calculado segundo Straube & Bianconi (2002).
Os indivíduos capturados foram contidos em sacos individuais de pano e encaminhados à base de campo para tomada dos dados biométricos, marcação e classificação etária. Utilizamos a ossificação das falanges dos metacarpos, o desgaste dos dentes e a coloração da pelagem como critérios para definição da classe etária (ver Trajano 1984). Marcamos cada indivíduo com uma anilha metálica numerada no antebraço.
Os indivíduos foram identificados quanto a espécie segundo Wilson (2008) e Miranda et al. (2011). Dois espécimes foram coletados e depositados na Coleção Cientifica de Mastozoologia do Departamento de Zoologia da Universidade Federal do Paraná, sob os números tombo DZUP/CCMZ 1796 (macho adulto) e DZUP/CCMZ 1797 (fêmea adulta). As amostragens foram realizadas sob a licença do SISBIO no10298-1.
Para identificarmos o período reprodutivo, utilizamos caracteres morfológicos externos das fêmeas, as quais foram classificadas como: Grávidas — com presença de feto palpável; Lactantes — com ausência de pelos ao redor das glândulas mamárias e presença de leite; Pós-lactantes — com pelos em crescimento em volta das glândulas mamárias e ausência de leite; Não reprodutivas — sem nenhuma das características acima citadas. Fêmeas que apresentaram simultaneamente duas características reprodutivas, como as pós-lactantes e grávidas, foram contabilizadas em ambas as categorias.
Pelo fato da amostragem ter se estendido por 15 meses, três meses foram amostrados mais de uma vez, resultando em um esforço amostral desigual entre os meses. Para contornar esse viés, utilizamos a taxa de captura ([número de animais capturados no mês para cada classe / esforço amostral do mês] x 1000), para representar a abundância mensal das classes. Para determinar se houve segregação temporal na abundância das classes ao longo dos meses, realizamos o teste de Rayleigh (Z), calculado pelo softwareOriana versão 4.1, adotando 0.05 como nível de significância. Realizamos o cálculo da estimativa populacional pelo Índice de Parker, com auxílio do software BioEstat versão5.3 (Ayres et al. 2007), adotando intervalo de confiança de 99%. Para o cálculo do Índice, utilizamos os dados de captura/recaptura obtidos durante todas as 15 campanhas.
Resultados
Myotis nigricans apresentou padrão poliéstrico sazonal e bimodal de reprodução. Grávidas foram registradas em seis dos 12 meses do ano, com dois picos de captura sendo um maior nos meses de setembro e outubro e, um segundo e menor em dezembro (Fig. 2). Pós-lactantes foram frequentes, com capturas em nove dos 12 meses do ano, porém, sem registros nos meses de maio, junho e setembro (Fig. 2). Lactantes foram registradas somente em outubro e novembro (Fig. 2). Fêmeas não reprodutivas foram capturadas em todos os meses exceto janeiro (Fig. 2).
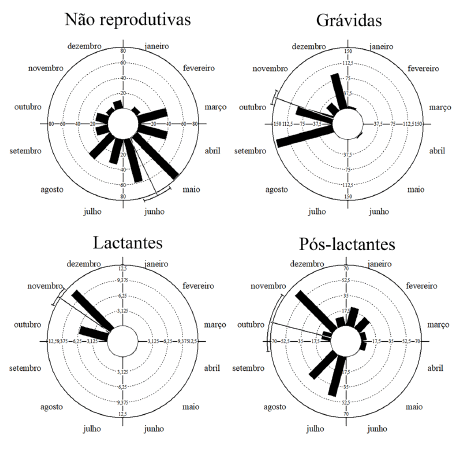
Fig. 2. Taxa de captura para fêmeas adultas de Myotis nigricans em cada uma das categorias analisadas, obtidas em abrigo antrópico, ao longo de um ano, no sul do estado de Santa Catarina, sul do Brasil.
Foram obtidas 267 capturas de 164 indivíduos de M. nigricans. Deste total, 209 foram fêmeas adultas, 44 jovens (machos + fêmeas) e 14 machos adultos. Fêmeas adultas estiveram presentes no abrigo em todos os meses do ano, com maior taxa de captura entre maio e agosto (Fig. 3). Machos adultos foram registrados no abrigo somente em sete meses, sendo a maior taxa de captura em agosto, setembro e novembro (Fig. 3). Fêmeas e machos jovens foram registrados entre dezembro e julho, com maior taxa de captura no mês de dezembro (Fig. 3). A estimativa do tamanho populacional para a colônia ficou entre 596 e 1050 indivíduos, o que sugere que nossa amostragem registrou entre 15.6% e 27.5% da colônia, respectivamente.

Fig. 3. Distribuição mensal da taxa de captura de fêmeas adultas, machos adultos e jovens de Myotis nigricans obtidas em abrigo antrópico, ao longo de um ano, no sul do estado de Santa Catarina, sul do Brasil.
Discussão
A alta taxa de captura de fêmeas grávidas em setembro, associada à gestação de aproximadamente 60 dias da espécie (Wilson & LaVal 1974) sugere que a atividade reprodutiva de M.nigricans, na região sul de Santa Catarina, inicia no final de junho e/ou início de julho com as cópulas. Um grande número de nascimentos deve ocorrer no final de setembro/início de outubro, corroborando a maior taxa de captura de jovens em dezembro—período em que os primeiros filhotes provavelmente começam a voar fora do abrigo. Após este período de nascimentos, um segundo evento de concepção deve ocorrer, resultando no aumento da taxa de captura de fêmeas grávidas no mês de dezembro. Esse segundo evento de nascimentos também é corroborado pelo aumento no número de jovens em março e abril e a ocorrência de alguns indivíduos jovens em maio e junho.
Ao longo de área de distribuição de M.nigricans são observadas variações no seu padrão reprodutivo. No Equador, essa espécie é monoéstrica (Tamsitt & Valdivieso 1963); no Panamá, é poliéstrica, com nascimentos ocorrendo de janeiro a setembro (Wilson 1971); na Amazônia Central, é poliéstrica bimodal (Reis & Peracchi 1987), assim como no presente estudo, e no Paraguai, apresenta atividade reprodutiva ao longo do ano todo, com maior frequência na primavera e verão (López-Gonzáles et al. 2001). Toda essa variação corrobora a hipótese de que espécies como M. nigricans, que apresentam amplas áreas de distribuição, tendem a apresentar modificações em seus padrões reprodutivos conforme o ambiente que estão (Racey & Entwistle 2000). Essas modificações podem estar relacionadas a diversos fatores ambientais bióticos e abióticos, como por exemplo, temperatura do ambiente, uma das variáveis que sabidamente influenciam nos ciclos reprodutivos de morcegos (Uchida et al. 1984; Crichton & Krutzsch 2000; Godoy et al. 2014; Orr & Zuk 2014), além da disponibilidade de recursos alimentares (Rodrigues 2004; Andrade et al. 2008), a qual deve alterar-se ao longo da distribuição da espécie em função da latitude e, consequentemente, da temperatura do ambiente.
O baixo número de capturas de machos em grande parte dos meses e o seu aumento no período reprodutivo, sugere que o abrigo estudado é uma colônia maternidade. A formação dessas colônias já foi observada no gênero Myotis (Nowak 1994), sendo sugerida inclusive para populações de M. nigricans no Panamá (Wilson & La Val 1974). No Brasil, há registros de formação de colônias maternidade para M.levis no estado do Paraná (Miranda et al. 2010). Entretanto, informações sobre a composição e dinâmica de colônias de Myotis no Brasil são escassas, não sendo possível predizer se esse é o padrão reprodutivo das populações de M. nigricans. Sendo assim, estudos em outras colônias devem ser realizados para confirmar esse padrão para o sul do Brasil.
O baixo número de fêmeas lactantes capturadas durante o período de estudo pode ser decorrente do pequeno tamanho corporal dos indivíduos e, consequentemente, das glândulas mamárias. Essas características podem dificultar a identificação dessa condição corpórea nos indivíduos. Em contraste, fêmeas grávidas foram capturadas entre os meses quentes e chuvosos de setembro e janeiro, como já observado para as espécies de M. levis, e M. ruber em regiões tropicais e subtropicais (Miranda et al. 2010; Araújo et al. 2013; Bernardi et al. 2013). Estes períodos provavelmente correspondem àqueles com maior disponibilidade de recurso alimentar (Wilson 1971; Altringham 1996; Balmori 1999).
O total de 164 indivíduos capturados sugere a ocorrência de uma colônia pequena de M.nigricans quando comparado à estimativa populacional. Entretanto, dados obtidos com contagem de indivíduos no sudeste brasileiro descrevem colônias com 200 a 300 indivíduos (Falcão et al. 2003). É provável que apenas uma parcela dos animais presentes no interior da colônia foi efetivamente capturada pois, para espécies deste gênero, incluindo M. nigricans, há registros de colônias com mais de 500 indivíduos (Kunz 1973; Wilson & La Val 1974). A hipótese de sub-amostragem devido ao método é reforçada também pelos dados apresentados por Miranda et al. (2010) para M. levis, onde os autores reportam a captura de 186 indivíduos com redes, porém a contagem no interior do abrigo registrou a mais de 10000 indivíduos. Outro fator que pode contribuir para a sub‑amostragem é o efeito do aprendizado dos morcegos em relação aos pontos de instalação de redes (Kunz & Kurta 1988; Esbérard 2006). A aprendizagem pode influenciar as taxas de captura e recaptura, tendo efeito negativo na estimativa do tamanho populacional.
A realização de amostragens em abrigos mostrou-se como uma importante ferramenta para obtenção de informação sobre os padrões reprodutivos de M. nigricans, uma vez que a espécie é pouco frequente em estudos sobre composição de assembleia (Esbérard 2003; Bordignon 2006; Arnone & Passos 2007). Apesar de ser uma espécie com ampla distribuição geográfica, os resultados aqui apresentados correspondem ao primeiro estudo específico sobre a biologia reprodutiva de M. nigricans no Brasil. A identificação de um ciclo poliéstrico sazonal e bimodal reforça a hipótese de ocorrência de variação no padrão reprodutivo ao longo da área de distribuição da espécie, uma vez que outras regiões apresentam padrões reprodutivos diferentes. Isso reforça a necessidade de estudos com a mesma espécie em ambientes distintos, a fim de compreender a plasticidade dessas populações, assim como quais fatores ambientais definem essa variação.
AGRADECIMENTOS
A João Masieiro, Gega Masieiro e Teresinha Masieiro pelo apoio logístico nas amostragens; A CAPES pela bolsa de mestrado de V. Mottin, ao CNPq pela bolsa de mestrado de D.A.S. Bôlla. A FAPESC pelo apoio financeiro cedido pelo edital de jovens pesquisadores (FAPESC/CNPQ Nº 06/2016 Apoio a Infraestrutura de CTI para Jovens Pesquisadores).
LITERATURA CITADA
1. Altringham, J. D. 1996. Bats, Biology and Behavior. Oxford University Press, New York. [ Links ]
2. Alvares, C. A., J. L. Stape, P. C. Sentelhas, G. De Moraes, J. Leonardo, & G. Sparovek. 2013. Köppen’s climate classification map for Brazil. Meteorologische Zeitschrift 22:711-728.
3. Andrade, L. L., A. C. Busoli, & J. C. Barbosa. 2008. Temperatura no desenvolvimento e na reprodução de cochonilhas criadas sobre abóboras. Ciência Rural, Santa Maria 38:2419-2426. [ Links ]
4. Araújo, R. A., B. D. Amaro, S. A. Talamoni, & H. P. Godinho. 2013. Seasonal reproduction of yellowish Myotis, Myotis levis (Chiroptera: Vespertilionidae), from a Neotropical highland. Journal of Morphology 274:1230-1238. [ Links ]
5. Arnone I. S., & F. C. Passos. 2007. Estrutura de comunidade da quiropterofauna (Mammalia, Chiroptera) do Parque Estadual de Campinhos, Paraná, Brasil. Revista Brasileira de Zoologia 24:573-581. [ Links ]
6. Ayres, M., D. L. Ayres, & A. A. S. Santos. 2007. BioEstat. Aplicações estatísticas nas áreas das ciências Bio-Médicas. Belém do Pará [ Links ].
7. Balmori, L. 1999. La reprodiccion em los quirópteros. Revisiones em Mastozooología 11:17-34. [ Links ]
8. Bernard, E. 2002. Diet, activity and reproduction of bats species (Mammalia: Chiroptera) in Central Amazonia, Brazil. Revista Brasileira de Zoologia 19:173-188. [ Links ]
9. Bernardi, I. P., J. Sponchiado, F. A. F. Jacomassa, E. M. Teixeira, J. M. D. Miranda, & F. C. Passos. 2013. Reproductive data of a threatened bat, Myotis ruber (É. Geoffroy, 1806) (Chiroptera, Vespertilionidae) in a southern Brazilian deciduous seasonal Forest. Mammalia 78(1):132-126. [ Links ]
10. Bianconi, V. G., S. B. Mikich, & W. A. Pedro. 2004. Diversidade de morcegos (Mammalia, Chiroptera) em remanescentes florestais do município de Fênix, noroeste do Paraná, Brasil. Revista Brasileira de Zoologia 21:943-954. [ Links ]
11. Bôlla, D. A. S. et al. 2017. Bat assemblage (Mammalia: Chiroptera) in a degraded Restinga in Southern Brazil. Neotropical Biology and Conservation 12:135-142. [ Links ]
12. Bordignon, M. O. 2006. Diversidade de morcegos (Mammalia, Chiroptera) do Complexo Aporé-Sucuriú, Mato Grosso do Sul, Brasil. Revista Brasileira de Zoologia 23:1002-1009. [ Links ]
13. Crichton, E. G., & P. H. Krutzsch. 2000. Reproductive Biology of Bats. Academic Press, London. [ Links ]
14. Dias, D., & A. L. Peracchi. 2008. Quirópteros da Reserva Biológica do Tinguá, estado do Rio de Janeiro, sudeste do Brasil (Mammalia: Chiroptera). Revista Brasilera de Zoologia 25:333-369. [ Links ]
15. Dinerstein, E. 1986. Reproductive ecology of fruit bats and the seasonality of fruit production in a Costa Rican Cloud Forest. Biotropica 18:307-318. [ Links ]
16. Esbérard, C. E. L. 2002. Composição de colônia e reprodução de Molossus rufus (E. Geoffroyi) (Chiroptera, Molossidae) em um refúgio no sudeste do Brasil. Revista Brasileira de Zoologia 19:1153-1160. [ Links ]
17. Esbérard, C. E. L. 2003. Diversidade de morcegos em área de Mata Atlântica regenerada no sudeste do Brasil. Revista Brasileira de Zoociências 5:189-204. [ Links ]
18. Esbérard, C. E. L. 2006. Efeito da coleta de morcegos por noites seguidas no esmo local. Revista Brasileira de Zoología 23:1093-1096. [ Links ]
19. Esbérard, C. E. L. 2011. Variação do tamanho de colônias de Molossus molossus and Molossus rufus in Rio de Janeiro, Southeastern Brazil. Neotropical Biology and Conservation 6:71-77. [ Links ]
20. Esbérard, C. E. L., E. M. Luz, & A. S. Chagas. 1999. Uso de residências para refúgios por morcegos no estado do Rio de Janeiro (Mammalia: Chiroptera). Revista Brasileira de Medicina Veterinária 21:17-20. [ Links ]
21. Falcão, F. C., V. F. Rebêlo, & S. A. Talamoni. 2003. Structure of a bat assemblage (Mammalia, Chiroptera) in Serra do Caraça Reserve, South-East Brazil. Revista Brasileira de Zoologia 20:347-350. [ Links ]
22. Fleming, T. H., E. T. Hooper, & D. E. Wilson. 1972. Three Central American bat communities: Structure, reproductive cycles and movement patterns. Ecology 53:555-569. [ Links ]
23. Frick, W. F. D., S. Reynolds, & T. H. Kunz. 2010. Influence of climate and reproductive timing on demography of little brown myotis Myotis lucifugus. Journal of Animal Ecology 79:128-136. [ Links ]
24. Godoy, M. S. M., W. D. Carvalho, & C. E. L. Esbérard. 2014. Reproductive biology of the bat Sturnira lilium (Chiroptera, Phyllostomidae) in the Atlantic Forest of Rio de Janeiro, southeastern Brazil. Brazilian Journal of Biology 74:913-922. [ Links ]
25. Humphrey, S. R., & M. K. Oli. 2015. Population dynamics and site fidelity of cave bat, Myotis velifer, in Oklahoma. Journal of Mammalogy 96:946-956. [ Links ]
26. IBGE. Instituto Brasileiro de Geografia e Estatística. 2012. Manual Técnico da Vegetação Brasileira. Manuais Técnicos em Geociências. 2ê Edição. Rio de Janeiro. [ Links ]
27. Korine, C., J. R. Speakman, & Z. Arad. 2004. Reproductive energetics of captive and free-ranging egyptian fruit bats (Rousettus aegyptiacus). Ecology 85:220-230. [ Links ]
28. Krutzsch, P. H. 2009. The reproductive biology of the cave myotis (Myotis velifer). Acta Chiropterologica 11:89-104. [ Links ]
29. Kunz, T. H., & A. Kurta. 1988. Capture methods and holding devices. Ecology and behavioral methods for the study of bats (T. H. Kunz, ed.). Smithsonian Institution Press, Washington. [ Links ]
30. Kunz, T. H., & E. D. Pierson. 1994. Bats of the World: An Introduction. Walker’s Bats of the World (R. M. Nowak, ed.). Johns Hopkins University Press, Baltimore.
31. Kunz, T. H. 1971. Reproduction of some vespertilionid bats in central Iowa. The American Midland Naturalist 86:477-486. [ Links ]
32. Kunz, T. H. 1973. Population studies of the cave bat (Myotis velifer): reproduction, growth, and development. Occasional Papers of the Museum of Natural History the University of Kansas Lawrence 15:1-43. [ Links ]
33. Kunz, T. H. 1974. Reproduction, growth and mortality of the vespertilionid bat, Eptesicus fuscus, in Kansas. Jounal of Mammalogy 55:1-13. [ Links ]
34. Lopéz-González, C., S. J. Presley, R. D. Owen, & M. R. Willig. 2001. Taxonomic status of Myotis (Chiroptera: Vespertilionidae) in Paraguay. Journal of Mammalogy 82:138-160. [ Links ]
35. Marinho-Filho, J. 2003. Notes on the reproduction of six phyllostomid bat species in Southeastern Brazil. Chiroptera Neotropical 9:173-175. [ Links ]
36. Mikalauskas, J. S. 2007. Diversidade, dieta e reprodução de morcegos (Mammalia: Chiroptera) da Serra de Itabaiana, Sergipe. Dissertação de Mestrado. Universidade Federal Rural do Rio de Janeiro, Rio de Janeiro, Brasil. [ Links ]
37. Miller, R. E. 1939. The reproductive cycle in male bats of the species Myotis lucifugus lucifugus and Myotis grisescens. Journal of morphology 64:267-295. [ Links ]
38. Miranda, J. M. D., N. Y. Kaku-Oliveira, L. C. Munster, I. P. Bernardi, R. Moro-Rios, & F. C. Passos. 2010. Primeiros dados de uma colônia reprodutiva de Myotis levis (I. Geoffroy, 1824) nos campos de Palmas, Paraná, Brasil (Vespertilionidae). Chiroptera Neotropical 16:762-768. [ Links ]
39. Miranda, J. M. D., I. P. Bernardi, & F. C. Passos (Eds). 2011. Chave ilustrada para a determinação de morcegos da região sul do Brasil. 1 ed. João M. D. Miranda, Curitiba. [ Links ]
40. Nowak, R. M. 1994. Walker’s Bats of the World. The Johns Hopkins University Press, London.
41. Orr, T. J., & M. Zuk. 2014. Reproductive delays in mammals: an unexplored avenue for post-copulatory sexual selection. Biological Reviews (United Kingdom) 89:889-912. [ Links ]
42. Peracchi, A. L., & S. T. Albuquerque. 1992. Quirópteros do município de Linhares, Estado do Espirito Santo, Brasil (Mammalia, Chiroptera). Revista Brasileira de Biologia 53:575-581. [ Links ]
43. Pikula, J., H. Bandouchova, V. Kovacova, P. Linhart, V. Piacek, & J. Zukal. 2017. Reproduction of rescued vespertilionid bats (Nyctalus noctula) in captivity: veterinary and physiologic aspects. Veterinary Clinics of North America: Exotic Animal Practice 20:665-677. [ Links ]
44. Racey, P. A., & A. C. Entwistle. 2000. Life-history and reproductive strategies of bats. Reproductive biology of bats (E. G. Crichton & P. H. Krutzsch, eds.). Academic Press, Cambridge. [ Links ]
45. Racey, P. A., & J. R. Speakman. 1987. The energy costs of pregnancy and lactation in heterothermic bats. Symposia of the Zoological Society of London 57:107-125. [ Links ]
46. Reis, N. R., & A. L. Peracchi. 1987. Quirópteros da região de Manaus, Amazonas, Brasil (Mammalia, Chiroptera). Boletim do Museu Paraense Emilio Goeldi, série Zoologia 3:161-182. [ Links ]
47. Rodrigues, W. C. 2004. Fatores que influenciam no Desenvolvimento dos insetos. Entomologistas do Brasil 1:1-4. [ Links ]
48. Solick, D. I., & R. M. R. Barclay. 2006. Thermoregulation and roosting behavior of reproductive and nonreproductive female western long-eared bats (Myotis evotis) in the Rocky Mountains of Alberta. Canadian Journal of Zoology 91:149-155. [ Links ]
49. Straube, F. C., & G. V. Bianconi. 2002. Sobre a grandeza e a unidade utilizada para estimar esforço de captura com utilização de redes-de-neblina. Chiroptera Neotropical 8:150-152. [ Links ]
50. Taddei, V. A. 1980. Biologia reprodutiva de Chiroptera: perspectivas e problemas. Inter-Facies 6:1-18. [ Links ]
51. Tamsitt, J. R., & D. Valdivieso. 1963. Condición reproductora de una colonia ecuatoriana del murciélago myotisnegro, Myotis nigricans nigricans (Familia Vespertilionidae). Caribbean Journal of Science 3: 49-51. [ Links ]
52. Trajano, E. 1984. Ecologia de populações de morcegos cavernícolas em uma região cárstica do sudeste do Brasil. Revista Brasileira de Zoologia 2:255-320. [ Links ]
53. Uchida, T. A., C. Inou, & K. Kimura. 1984. Effects of elevated temperatures on the embryonic development and corpus luteum activity in the Japanese long-fingered bat, Miniopterus schreibersii fuliginosus. Journal of Reproduction and Fertility 71:439-444. [ Links ]
54. Walker, E. P. 1968. Mammals of the World. The Johns Hopkins Press. Baltimore. [ Links ]
55. Weir, B. J., & I. W. Rowlands. 1973. Reproductive strategies of mammals. Annual Review of Ecology and Systematics 4:139-163. [ Links ]
56. Willig, R. M. 1985a. Reproductive activity of female bats from Northeast Brazil. Bat Research News 26:17-20. [ Links ]
57. Willig, R. M. 1985b. Reproductive patterns of bats from Caatingas and Cerrado Biomes in Northeast Brazil. Jounal of Mammalogy 66:668-681. [ Links ]
58. Wilson, D. E. 1971. Ecology of Myotis nigricans (Mammalia: Chiroptera) on Barro Colorado Island, Panama Canal Zone. Journal of Zoology 163:1-13. [ Links ]
59. Wilson, D. E. 2008. Genus Myotis. Mammals of South America (A. L. Gardner, ed.) The University of Chicago Press, Chicago and London. [ Links ]
60. Wilson, D. E., & R. K. Laval. 1974. Myotis nigricans. Mammalian Species 39:1-3. [ Links ]
61. Wimsatt, W. A., & H. Trapido. 1952. Reproduction and the female reproductive cycle in the tropical American vampire bat, Desmodus rotundus murinus. American Journal of Anatomy 91:415-445. [ Links ]














