Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Asociación Química Argentina
Print version ISSN 0365-0375
An. Asoc. Quím. Argent. vol.92 no.4-6 Buenos Aires Aug./Dec. 2004
EDUCATION
Un Nuevo Enfoque De La Enseñanza De La Química: Contextualizar y Modelizar
Mercè Izquierdo Aymerich1
1Departament de Didàctica de les Matemàtiques i de les Ciències Experimentals Universitat Autònoma de Barcelona. Fax: + 34 93 58 11 169, E-Mail: merce.izquierdo@uab.es
VI Jornadas Nacionales y III Internacionales de Enseñanza Universitaria de la Química
La Plata 28/09/2003 - 01/10/2003
Abstract
La química pierde público, sus alumnos fracasan; se ha convertido para muchos en el paradigma de lo incomprensible y de lo peligroso. Un porcentaje creciente de los estudiantes universitarios que tienen éxito y disfrutan con sus estudios consideran que las salidas profesionales que se les ofrecen no se corresponden con lo que aprendieron, la big science dominante (tan comprometida con el poder político y económico) no es la ciencia intelectual que les sedujo. Con todo y a pesar de estos problemas, ahora se reclama formación química para toda la población; parece difícil que una química en crisis frente a su audiencia de siempre pueda conquistar ahora una nueva.
Podemos considerar pues que la enseñanza de la química se enfrenta a serias dificultades; éstas constituyen un reto para los profesores que creen que la química puede aportar mucho a la actual sociedad del conocimiento, aún a sabiendas de que quizás tengan que cambiar algunas de las actuales prácticas docentes. Este cambio empieza ya a producirse: se editan bonitos libros de química que incorporan imágenes, ejemplos y narraciones y nuevos Proyectos de Química, pero sin embargo los currículos oficiales de química han cambiado poco, insensibles a que el desinterés por esta materia en la secundaria no haya dejado de aumentar.
Es urgente recuperar la capacidad explicativa de la química, PARA TODOS; para ello se ha de relacionar la práctica química (la intervención en determinados fenómenos mediante los procedimientos propios de la química) y la teoría (la teoría atómica y sus entidades y magnitudes químicas), utilizando el lenguaje adecuado para ello y de acuerdo a finalidades educativas.
Siempre ha sido costoso aprender química, siempre han sido necesarios profesores para inventar la disciplina según lo que se considere que ha de saber un discípulo. Si el de ahora( incluyendo los nuevos públicos, tan diferentes de los de antes) no se interesa por la disciplina, ésta ha de cambiar: quizás los currículos no son interesantes ni comprensibles, pero la química sí que lo es.
1. Crisis en la enseñanza de la química
Se detecta una cierta crisis en la enseñanza de la química, que se manifiesta en las opiniones desfavorables de quienes que, ya de mayores, recuerdan la química como algo incomprensible y aborrecible; en la falta de alumnos cuando la asignatura es optativa; en los recortes que va experimentando en los currículos (no universitarios y universitarios); en la disminución de estudiantes que escogen la química como carrera; en las connotaciones negativas que tiene la química, que no se compensa con la afirmación trivial todo es química que surge de los propios químicos, pero que no convence a los que no lo son, porque no la comprenden.
Además, los profesores de química saben bien que incluso los buenos estudiantes de química tienen dificultades en aplicar sus conocimientos y tienen la sensación de que la química no les sirve para explicar. Pero si la química ha de contribuir a la alfabetización científica de los ciudadanos, precisamente es su capacidad de explicar fenómenos relevantes lo que debería priorizarse.
En este apartado analizaremos las diferentes dimensiones de esta crisis. En el subapartado a. se verá como puede concebirse una química para todos, que sea comprensible. En el b. se identificarán los obstáculos que impiden la comprensión de los principales conceptos químicos. Finalmente, en el subapartado c. se harán algunas propuestas iniciales y se comentarán los nuevos recursos para la enseñanza que van apareciendo algo al margen de las aulas: quizás en los media y en los comercios ya se está produciendo un cambio que desde la Universidad nos pasa por alto
a. ¿Es posible diseñar una química para todos?
Nunca, hasta ahora, se había pretendido que la química (junto con las otras ciencias), formaran parte de currículos obligatorios para toda la población hasta los 16 o 18 años. No ha de sorprender, por lo tanto, que aparezcan problemas nuevos que obligan a seleccionar lo más básico y fundamental de la química así como a reflexionar sobre los condicionantes y mecanismos de la comprensión humana y las estrategias docentes más adecuadas para facilitarla.
La novedad es que ahora se ha de enseñar química a personas que no saben de qué va ni tienen interés por saberlo. Por esto se debería empezar por generar experiencia química en los alumnos y alumnas, para que, a partir de ella, puedan formular preguntas; sin ellas, las explicaciones no tendrían sentido puesto que no se pueden avanzar respuestas (químicas) a preguntas que aún no se han planteado. (Las buenas preguntas son las que generan respuestas argumentadas que utilizan la Teoría Química y, a la vez, conectan con la experiencia).
Las ciencias son el resultado de una actividad humana muy compleja sustentada, como cualquier otra actividad humana, en una pluralidad de sistemas de valores; nunca fueron, ni son ahora, neutras. La ciencia emergió en la Edad Moderna como una intervención en la naturaleza que iba a permitir arrancarle sus secretos aunque sea a la fuerza, para descubrir sus riquezas y aplicarlas al progreso de la humanidad. Esta metáfora empieza a no ser adecuada ya que se plantean ahora graves problemas de sostenibilidad del planeta y se denuncian alianzas de la ciencia con la economía y el poder. Se van imponiendo nuevos valores; pero donde se manifiesta con más urgencia la necesidad de cambio es en las aulas de ciencias, tanto por una nueva sensibilidad y nuevas expectativas de los estudiantes como por las nuevas demandas que hace la sociedad a los docentes.
Al ir cambiando los valores, lo hace también la epistemología: las justificaciones se fundamentan en una axiología. [1]; sus intervenciones y afirmaciones, a pesar de ser lo más objetivas posible, están mediatizadas por las decisiones que se han de tomar respecto a los instrumentos a utilizar o los argumentos que es legítimo utilizar para proporcionar explicaciones.
El estudiante tampoco puede plantear preguntas y aprender ciencias sin una actividad científica en el aula que corresponda a sus finalidades y a sus valores. A diferencia de la actividad de los científicos, la de los estudiantes ha de ser promovida por los profesores, que han de proporcionar finalidades adecuadas a una persona joven que está creciendo (en la escuela) o a un adulto que se inicia en una profesión (en la universidad). Los nuevos valores han de tener que ver con el cuidado de la propia salud, con la lucha por la paz, con la protección del medio ambiente y los conocimientos han de ser los necesarios para poder ejercer una responsabilidad compartida en un mundo que es ahora global, planetario y que requiere intervenciones concretas para ser sostenible, en un entorno solidario y pacífico.
Pero para aprender es necesario algo más. Las personas tienen diversas capacidades cognoscitivas que se presentan según diferentes dimensiones, irreducibles una a la otra: el pensamiento (que opera mediante representaciones de la realidad, que en ciencias corresponden a las teorías científicas), la acción (que se deriva de la capacidad de desarrollar actividades de transformación del mundo, que en ciencias corresponden a la experimentación) y la comunicación (que se manifiesta mediante diversos lenguajes, que en ciencias corresponden a los especializados de las diferentes disciplinas). En las personas, cuando algo en el mundo tira de ellas, cuando se persigue una finalidad que interesa alcanzar porque es valiosa, entonces se piensa sobre lo que se hace, se inventan los lenguajes adecuados a la nueva experiencia y se establece un consenso respecto a los que van a permitir comunicarla, para continuar actuando, pensando, comunicando con éxito hasta alcanzar la meta. [2] (Guidoni, 1985) (Ver fig. 1). En caso contrario, cuando las preguntas no son las adecuadas, los lenguajes resultan vacíos, las teorías no tienen significado experimental y los experimentos se llevan a cabo como si fueran una receta de cocina.
En las aulas, la ciencia se ha de implicar en fenómenos relevantes y significativos y la clase ha de garantizar una dinámica que permita pensar, hacer y comunicar de manera coherente, según las reglas de juego de la química. Para ello no bastan las buenas preguntas ni un sistema de valores adecuado; es necesario también disponer de buenas teorías que ayuden a pensar y de las palabras adecuadas para sustentar una dinámica cognitiva que es, a la vez, intervención y transformación del mundo.
b. Los conceptos químicos son complejos, difíciles
Es crucial, por lo tanto, ofrecer al discípulo teorías apropiadas a sus conocimientos y a las intervenciones experimentales que puede llegar a realizar significativamente. Esto no es nada fácil y obliga a una reflexión profunda para identificar los obstáculos que se han de superar para llevar acabo esta tarea.
Se considera (en general) que la Química es difícil porque es al mismo tiempo una ciencia muy concreta (se refiere a una gran diversidad de substancia) y muy abstracta (se fundamenta en unos átomos a los que no se tiene acceso), y porque la relación entre los cambios que se observan y las explicaciones no es evidente ya que se habla de los cambios químicos con un lenguaje simbólico que es muy distinto del que conoce y utiliza el alumnado al transformar los materiales en la vida cotidiana. Incluso el objeto de la química (comprender y gestionar la transformación de los materiales) queda lejos de los intereses de las gentes de ahora, que ya están acostumbrados a aceptar los fenómenos más llamativos sin tener necesidad de comprenderlos.
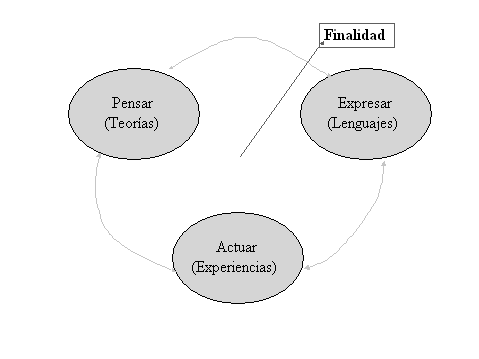
Fig.1. Las dimensiones de la cognición
Según Erduran Scerri [3], las principales dificultades se derivan del reduccionismo de la química a la física: los átomos se explican como si fueran entidades físicas; y lo mismo ocurre cuando las explicaciones utilizan electrones, enlaces. En efecto, desde un punto ontológico, si se explicara el cambio químico mediante átomos que cambian de sitio y enlaces que se redistribuyen, la química quedaría reducida a la física; en cambio, desde un punto de vista epistemológico, los átomos físicos no sirven para justificar el cambio químico, puesto que carecen de las propiedades de composición que necesitarían para funcionar, en las explicaciones, como componentes de las sustancias [4]
Así, podría parecer que las explicaciones del cambio químico se refieren a intercambios de electrones entre los átomos y que esto tiene que ver con la física cuántica. Pero un análisis cuidadoso muestra que esto no es así. Cuando la química explica mediante orbitales, no lo hace con los orbitales físicos que tienen un determinado status ontológico en la mecánica cuántica, sino que estos orbitales se adaptan a lo que la química quiere explicar: el cambio químico.
Las leyes de la química son muy diferentes de las leyes de la física y esto puede confundir a los estudiantes, puesto que no se les hace ver esta diferencia. Fijémonos, por ejemplo, en la Ley Periódica: es aproximada, pero proporciona un sistema de los elementos químicos. Para comprender esta Ley es necesario tener una cierta intuición de las relaciones que establecen entre si las substancias cuando reaccionan y sólo entonces la Tabla Periódica sistematiza el estudio de la química general, que es lo que pretendía Mendeleev.
Otra de las dificultades que plantea la química es la relación asimétrica que existe entre la estructura de las substancias y sus propiedades. En efecto, si bien los sistemas con idéntica estructura microscópica han de tener las mismas propiedades macroscópicas, no ocurre lo mismo a la inversa: dos sistemas que presentan una determinada propiedad macroscópica (por ejemplo, tener sabor dulce) pueden ser diferentes a nivel microscópico y esto resulta desconcertante y genera muchos errores entre los estudiantes. Las relaciones se han de investigar empíricamente, una por una y no se pueden generalizarse de manera sencilla.
Así pues, una gran parte de las dificultades de la química se derivan de un planteamiento inadecuado de la teoría atómica, que se presenta al margen de la experiencia química. En las aulas, esta experiencia parece ser deducible de la teoría, cuando, como se verá con mas detalle en el apartado siguiente, esto no es así. La experiencia química no sólo es condición para aprender, sino que es también la clave para dar sentido a la teoría atómica química.
c.¡Decidámonos de una vez por nuevos currículos!
Hemos visto hasta aquí dos posibles causas en la crisis actual en la enseñanza de la química, especialmente si ha de conquistar de nuevo al publico y reconquistar al antiguo. En primer lugar, que se presenta de manera demasiado dogmática, alejada de las finalidades y valores de los estudiantes, cuando debería desencadenar actividad científica en cada uno de ellos (tanto en la enseñanza básica como en la Universidad); y, en segundo lugar, que quizás no se tienen tanto en cuenta como se debiera las dificultades conceptuales que le son propias, y que se derivan del desajuste entre la teoría y sus ejemplos modelos o campo de aplicaciones.
Este desajuste llega a vaciar de sentido una parte de las lecciones y propuestas de trabajo que se hacen a los alumnos. Si enseñar química consiste sólo en enseñar ideas teóricas sin explicar suficientemente a qué tipo de intervención se refieren se convierte en un ejercicio de irracionalidad que es rechazado por el alumnado de ahora. Las ideas fuera de contexto no son aceptadas por los nuevos discípulos, que no están ya dispuestos a memorizar conocimientos y lenguajes que no llegan a comprender ni les parecen útiles.
El problema ha sido ya detectado y son muchos los que se preocupan por él, aunque quizás no tanto los profesores de química, demasiado apegados a lo que ha sido nuestra manera de hacer de siempre, a la que hemos dedicado muchos esfuerzos. [5]. Se están proponiendo nuevos currículos, se editan libros renovadores, bien ilustrados, con narraciones interesantes; proliferan las Web con propuestas docentes, los recursos en red aumentan. Se puede ser optimista en este sentido pero también se ha de reconocer que lo que se ha modificado es, sobre todo, la presentación de los temas pero que no hay un cambio profundo en su contenido conceptual (teórico) que es el fundamental porque sin él no se puede pensar a la manera de las ciencias y no hay formación científica posible.
Es el momento de aportar nuevas ideas para culminar los cambios que se anuncian y conseguir superar el reto que tenemos planteado ahora los profesores de química: hacer que la química sea comprensible para el gran público y ocupe su lugar como ciencia básica pero al servicio de otras nuevas que están emergiendo, sin que por ello se convierta en una banalidad.
Ya que una parte importante del problema tiene que ver con utilizar la teoría atómica con significado químico, se va a presentar a continuación un breve repaso de la evolución histórica de los conceptos básicos de química y de su relación con los átomos.
2. Explicar para hacer comprender: una visión histórica y epistemológica
La reflexión histórica permite ahondar en el significado práctico de los conceptos que elaboraron los químicos para comprender y controlar el cambio químico, que los libros de texto presentan como si fueran debidos a una supuesta capacidad de los químicos de ver la materia por dentro. La historia de la química ofrece multitud de ejemplos de este proceso de dar sentido, con el cual se consiguió algo tan difícil como justificar teóricamente es decir, hacer racional, generando entidades teóricas una intervención artesanal. Por ejemplo, la entidad elemento químico permitió comprender las relaciones entre las substancias, al poder seguirle la pista en sus diferentes compuestos sin que, debido a su indestructibilidad, la materia desaparezca al desaparecer la substancia y aparezca de nuevo de la nada. La historia ayuda también a comprender lo que pasa en momentos de cambio de paradigma en los que aparecen nuevas finalidades de la actividad científica, surgen nuevas formas de intervención y se consolidan nuevas reglas del juego con las que poner a prueba nuevos Modelos del mundo.
El subapartado a. se dedicará al desarrollo de la Química de las substancias y de la teoría atómica de Dalton. En el subapartado b. se analizará la emergencia de la estructura electrónica de los átomos planteando la posibilidad de que, con ello, haya emergido un nuevo paradigma. En el subapartado c. se verá como afecta todo ello a la enseñanza de una teoría atómica química vinculada a la experiencia química que es posible adquirir en las aulas.
a. La trama conceptual y las intervenciones de la química clásica
Según Hannaway [6], la química moderna nace con un libro destinado a enseñar química a nuevos discípulos (los médicos y los boticarios) que consideraban necesario aprenderla. Este libro es la 'Alchemia' de Andreas Libavius, editado en 1597, en el cual se presentan los procedimientos y resultados de la química experimental del Renacimiento que se interpretaban entonces en el marco de la magia natural. Lo que Libavius consideró necesario recoger en su libro fue el aspecto práctico de la química renacentista, porque permitía obtener medicamentos útiles y, por ello, valiosos, y procuró disimular su base teórica mágica porque ésta ya empezaba a parecer sospechosa por ser demasiado intuitiva y poco académica.
Empezó con ello una nueva tradición: la Química de las Substancias [7], que fue estructurando la teoría a partir de la práctica artesanal del cambio de los materiales. Se perseguía un resultado: llegar a tener algo (la substancia) que se podía vender para ser utilizado en un nuevo proceso: para mejorar la salud, para facilitar la limpieza, para pintar. La substancia se obtenía mediante determinados procedimientos establecidos (destilar, disolver, precipitar), que se tenían que controlar para poder realizarlos de nuevo, a ser posible con un rendimiento mejor. La nueva teoría química se refería a la constitución de la materia tal como la mostraban las operaciones de la química y las posibilidades de control en aquel momento; poco a poco elaboró criterios para obtener con buen rendimiento determinadas substancias de nombre específico, mediante procedimientos que requirieron de instrumentos cada vez más ajustados.
Veamos, con un ejemplo, qué tipo de situación podría haber generado la necesidad del elemento químico. Imaginemos, en París a finales del siglo XVII, el laboratorio de Nicolás Lemery, un farmacéutico- químico que obtiene y vende, entre otros, un medicamento apreciado llamado Espíritu Ardiente de Saturno (nuestra acetona) según un procedimiento bien conocido y utilizado por otros boticarios de su tiempo. Es fácil darse cuenta de que su nombre, que puede parecernos ahora pintoresco, viene sugerido por la manera de obtenerlo: se disuelveel plomo en vinagre y la disolución se destila en una retorta bien cerrada, pues si no se hace así se esparce un penetrante olor por todo el recinto. En efecto, parece que el espíritu (un cuerpo volátil) que se obtiene proceda del plomo, que había sido destruido previamente por el ácido. Pero los químicos se van dando cuenta de que en la retorta queda un residuo del cual puede obtenerse de nuevo el plomo; deducen, por lo tanto, que no se ha destilado nada que correspondiera al plomo y que el espíritu ardiente obtenido procede del vinagre, que sí que ha desaparecido de la retorta. En consecuencia, se ha de cambiar el nombre, que no ha de referirse al plomo y que pasa a ser un licor inflamable que sale de la sal de Saturno que procede del espíritu de vinagre. Este tipo de razonamiento se va aplicando a los diferentes procesos químicos y consigue llegar a diferenciar entre una substancia simple (el plomo metal o Saturno, en este ejemplo) y una compuesta (el acetato de plomo) y entre una substancia simple y un elemento (el plomo en el acetato de plomo y en el residuo que queda en la retorta).
Así, la química moderna se va configurando según corresponde a una determinada práctica y a un determinado sistema de valores, entre los cuáles se encuentra el provecho económico y la reproducibilidad de los materiales obtenidos de manera artificial en el laboratorio. Es esta tradición la que da sentido a los conceptos básicos de química: cambio químico, substancia simple y compuesta, elemento químico y átomo químico que emergieron de la revolución del XVIII, con una tabla de elementos / substancias simples indestructibles, a partir de los cuales se podían obtener todas las substancias compuestas.
En esta época los átomos proporcionaban una explicación razonable, pero superficial, de los cambios químicos al conectar el cambio químico al modelo mecanicista de la materia que estaba en boga y que substituía a la magia natural.
La química dio un paso más en su propio camino hacia la cuantificación cuando Dalton consiguió asignar una masa a unos átomos que correspondían a los elementos químicos; llamaremos a estos átomos, a partir de ahora, Md (modelo de Dalton). No se disponía de evidencias físicas de su existencia y muchos químicos los rechazaban; permitían un registro útil de las cantidades de reacción mediante símbolos, fórmulas y ecuaciones que si bien para algunos representaban la estructura real de los cuerpos y para otros eran sólo convencionales.
La idea de Dalton, por más que controvertida, fue desarrollada a lo largo del siglo por químicos eminentes como Berzelius, Liebig, Kekulé, vant Hoff y Wurtz. Los átomos Md llegaron a tener la propiedad de la valencia y se caracterizaron por ser indestructibles y intransformables unos en los otros. Tomaron sentido en la práctica química y fundamentaron el Sistema Periódico de Mendeleev [8].
La magnitud fundamental de la química, la cantidad de substancia, tiene que ver con estos átomos Md, ya que las masas atómicas que se fueron asignando a los elementos representaron avant la lettre la unidad mol que se definió llegando ya a final de siglo. Esta unidad corresponde a una masa proporcional a la masa de los átomos/ moléculas, dando por supuesto que la constante de proporcionalidad ha de ser la misma para todas las substancias: la cte. de Avogadro. No es necesario saber el valor de esta constante para dar sentido químico al mol; estamos en la química en la que unos cuantos millones de millones más o menos de átomos no tiene importancia.
Al llegar a finales del XIX, la Química se había consolidado como disciplina universitaria y disponía de una industria química potente que proporcionaba trabajo bien remunerado a sus licenciados. Los átomos químicos Md habían sido finalmente aceptados por la mayoría de químicos cuando empezaron a acumularse evidencias físicas de su existencia y de su estructura compleja.
b. Cambio de paradigma en el siglo XX
Las sorprendentes radiaciones que culminaron con el descubrimientos de elementos radioactivos (en palabras del matrimonio Curie) se interpretaron como evidencia de una estructura interna del átomo de naturaleza eléctrica. Es más, parecía ser que, al emitir radiaciones, algunos átomos se transformaban en algunos otros. Si bien Mendeleev se resistió a aceptar esta interpretación hasta su muerte, en 1907, otros químicos asimilaron las nuevas ideas y lo que parecían ser sus evidencias. Pero el átomo Md era ya tan importante, que no se podía prescindir de él y se tuvo que inventar una nueva mecánica para que el átomo químico Md llegara a identificarse con el átomo físico (cuántico) que iba surgiendo para dar lugar al nuevo átomo químico- físico, al que llamaremos Ma.
En algún momento de este siglo XX que acabamos de dejar atrás, el nuevo átomo cuántico se incorporó a la enseñanza de la química. En el libro de Química General de Pauling, aparecido en 1947, reeditado muchas veces desde entonces y que puede considerarse un hito para la historia, el Sistema de Mendeleev se recuperó para los discípulos de química del siglo XX, desde la nueva perspectiva del nuevo átomo cuántico Ma. Había nacido una nueva teoría atómica química, con nuevas aplicaciones gracias a nuevos instrumentos que permiten manipular cantidades muy pequeñas de materiales; se trata de una química de lo invisible y que puede inventar materiales de diseño a partir de las propiedades, ahora ya conocidas, de los nuevos átomos.
¿Qué aporta esta reflexión a la enseñanza actual de la Química?
La teoría atómica química, contemplada en el marco de la tradición de las substancias que la vio nacer (para poder intervenir en el cambio químico, para comprenderlo mejor) adquiere un significado completamente diferente del que tiene en algunas clases de química actuales, en las que los conocimientos químicos parecen deducirse de las propiedades de unos átomos formados por electrones y núcleos y ordenados en la tabla periódica. El problema principal en la enseñanza aparece cuando la mayor parte de las prácticas de química corresponden a Md y en cambio, en clase se explica Ma sin que se proporcionen suficientes ejemplos ni acceso a los nuevos instrumentos que harían posible una intervención propia de Ma.
Para continuar esta reflexión, vamos a suponer que la Teoría atómica química del siglo XX tiene dos Modelos: Md y Ma. Con ello la química ha cambiado, porque a partir de Ma se pueden plantear intervenciones que de ninguna manera eran posibles con Md. Ma y Ma configura una ciencia de las estructuras atómico-moleculares y del número de Avogadro (con la constante de Boltzmann controlando los cambios energéticos) y Md corresponde a la química macroscópica, la del Mol, con cambios energéticos regulados por la constante R. La práctica química corresponde aún en gran parte a Md y continúa dando significado químico a Ma, a la vez que Ma se desarrolla y da lugar a nuevas aplicaciones que no hubieran podido preverse con Md. Lo importante es que ambos modelos interaccionan y ambos enriquecen a la teoría química; Ma y Md son complemementarios, siempre y cuando ambos modelos se referieran a la chemical chemistry y no a símbolos en los libros; pero los ejemplos e intervenciones según uno de los modelos no lo son del otro.
El problema se complica si pensamos que empieza a ser posible la existencia de nuevos profesionales (físicos, biólogos, biotecnólogos, químicos, que se especializan en ciencias de los materiales, en proteómica o genómica) que trabajan sólo con moléculas y que utilizan las leyes de la química macro como una consecuencia lógica que se deriva de Ma y que casi no necesitan de las técnicas de la química macroscópica; la química de siempre, la del Mol que corresponde mayoritariamente a Md también va a continuar, en manos de otros profesionales e investigadores que exploran nuevos procesos, nuevos controles. La formación teórica de estos profesionales tan diversos no tiene por qué ser la misma y, efectivamente, ya empieza a no serlo. Con mucha mayor razón, tampoco ha de serlo la de quienes estudian la química como una parte obligatoria de su formación en la escuela. Sin embargo, los estudiantes han de poder percibir siempre que la propuesta disciplinar es racional (está fundamentada teóricamente y la teoría se presenta mediante Modelos que muestran el significado práctico de sus entidades) y que es razonable (pueden utilizarla para responder razonadamente las preguntas adecuadas al marco teórico)
Para que la enseñanza de la química resulte racional y llegue a ser razonable es necesario gestionar adecuadamente los dos modelos actuales de la teoría atómica, Ma y Md. Se desarrollará esta idea en el apartado siguiente.
3. La disciplina es para el discípulo
Todo lo que se ha ido viendo hasta aquí proporciona ideas para promover el cambio que necesita la Química como disciplina, es decir, como algo que se enseña a los discípulos para que éstos lo aprendan. Quizás ahora sería oportuno relacionar mejor cada uno de los Modelos de la moderna teoría atómica (Md y Ma) con sus respectivas aplicaciones y con ejemplos apropiados.
En el subapartado a. se va a reflexionar sobre la necesidad de estructurar la química para el discípulo de ahora. En el subapartado b. se utilizará un modelo cognitivo de ciencia para comprender mejor qué son las Teorías científicas y la función de sus Modelos. Todo ello permitirá después fundamentar la química para todos en una experiencia que permita razonar.
a. El origen de las disciplinas es la necesidad de formar al discípulo
La enseñanza es uno de los contextos de la actividad científica, como nos recuerda Echeverría,[1] y por esto la disciplina y el discípulo se condicionan mutuamente, tanto ahora como a lo largo de la historia.
La química, como las otras disciplinas, se han estructurado gracias a la labor de buenos profesores (Livabius, Liebig, Wurtz, Mendeleev, Pauling, etc.) que pensaron en los intereses de los discípulos a los que iba dirigida y supieron seleccionar los temas clave del quehacer químico para tramar una red conceptual convincente sustentada por una representación sencilla del mundo que funcionara en la práctica. Gracias a este trabajo, sumamente creativo, se reconstruyó lo esencial de una actividad compleja (la actividad química, que se desarrollaba en un entorno diferente a la clase y según intereses ajenos a los de los discípulos) de tal manera que suscitara aprendizaje significativo y el discípulo llegara a formar parte del grupo de iniciados en la disciplina. Para ello se escribieron libros, se organizaron prácticas y se inventaron tablas, esquemas, símbolos, que generaron entidades apropiadas para estructurar las ideas de manera que se puedan divulgar.
El problema es que los libros pueden reeditarse y perdurar cuando los lectores para los que fueron escritos ya no existen; una propuesta de enseñanza que fue buena en un determinado momento de la historia puede dejar de ser adecuada en otro. Por esto, si bien la disciplina obliga al discípulo, también va cambiando para atenderle mejor.
La fig. 1 recuerda los mecanismos de dar sentido al mundo y, por lo tanto, que la docencia ha de facilitar que los estudiantes puedan establecer relaciones significativas entre las teorías químicas, las intervenciones experimentales que pueden llevar a cabo y los lenguajes con los que hablar de ellas. Han de generar experiencia química que tire de ellos hacia la elaboración de las entidades abstractas que necesitan para poder interpretar los fenómenos de interés para la química. Sin esta vivencia, lo que se les enseña en clase no es racional para ellos (porque resulta fuera de contexto) ni puede llegar a ser razonable (porque no puede ser justificado por ellos de manera convincente); en consecuencia, aprender química puede convertirse en un ejercicio de irracionalidad
Si la química de los currículos oficiales no atiende al discípulo actual, que actúa según nuevos valores y tiene nuevas necesidades, la química debe cambiar, y puede hacerlo: haciendo que viva la química, mostrando cómo encajan los hechos y las entidades teóricas y enseñando a razonar a partir de unos y otras. Es tarea de los profesores (tanto ahora como antes) hacer que la química que se enseña sea racional y pueda llegar a ser razonable para las nuevas audiencias, que ya no son ni tan sólo como las de veinte años atrás.
b. Los Modelos y las Teorías
El concepto actual de ciencia tiene en cuenta el proceso o actividad que lo hizo surgir; es más rico y mucho más útil que el tradicional (la ciencia como conocimiento comprobado por la evidencia experimental) para reflexionar sobre los problemas que se han ido detectando en los apartados anteriores. Este nuevo enfoque permite destacar, por ejemplo, la función de instrumentos (artefactos para intervenir, lenguajes para pensar) en la emergencia de conocimiento, así la intervención de diversos sistemas de valores; y puede explicarse de manera similar a otros procesos cognitivos humanos que son estudiados actualmente por las Ciencias Cognitivas. Las teoría científicas pueden equipararse, así, a los modelos mentales, esquemas, frames con los que todas las personas dan sentido al mundo y a sus intervenciones en él.
Giere [9], físico y filósofo, por ejemplo, propone un modelo cognitivo de ciencia que puede utilizarse también para comprender el proceso de aprender ciencias [12]. Utiliza un concepto semántico de Teoría, según el cual ésta se caracteriza por el conjunto de sus Modelos, que lo son porque comparten las mismas reglas de juego (lo que se puede hacer y lo que no se puede hacer al intervenir en los fenómenos según la teoría) y una misma representación de lo que ocurre cuando se interviene en ellos. Estos Modelos son similares entre si y similares a conjuntos de fenómenos. El ajuste entre las características de los fenómenos y el Modelo se realiza mediante Hipótesis Teóricas que permiten contrastar las previsiones del Modelo con los resultados experimentales. Así, la teoría adquiere significado en sus Modelos vinculados a los fenómenos; las hipótesis teóricas, experimentales, van estableciendo las maneras de proceder y de argumentar en la intervención experimental según la Teoría General, que va adquiriendo así significado práctico.
Las hipótesis teóricas se pueden formular de la manera siguiente: Si este esto fuera tal como dice el modelo, al hacer esto pasaría aquello. Como que son experimentales, puede ser que sus previsiones acierten (cuando el hecho del mundo se comporta según el modelo) o que no lo hagan (en el caso contrario). Pero cuando se comunica y se enseña el conocimiento científico las hipótesis ya han validado al Modelo.
Entonces los fenómenos ya se explican en términos del modelo y de las entidades teóricas que han surgido en el proceso de ajuste; dejan de ser mundo para pasar a ser parte del Modelo Teórico que es, a la vez, Modelo de una Teoría General y Modelo de otros hechos similares (Fig.2).

Fig. 2 . La concordancia entre los Modelos y los Fenómenos
Giere [9] afirma que es así como los físicos presentan las teorías en sus libros de texto de física y en sus conferencias. Pone la Mecánica clásica como ejemplo de teoría, puesto que con ella empiezan casi todos los libros de texto de Física general. En efecto, si bien las leyes del movimiento pueden considerarse los axiomas de la teoría, los libros no deducen Teoremas a partir de ellos; no se detienen en discutir cuáles enunciados son postulados y cuáles son definiciones, ni el significado de que, según la segunda ley, la posición en el espacio sea doblemente diferenciable o de que tenga sentido hablar de velocidad y aceleración en un instante. Lo que hacen, en cambio, es pasar a una serie de capítulos basados en diferentes suposiciones sobre la forma de la función de fuerza, ilustrando con un ejemplo cada una de las diferentes funciones seleccionadas: un cuerpo que cae (el problema de Galileo), una masa sometida a una fuerza restablecedora lineal (ley de Hooke), una masa en un resorte dentro de un medio viscoso (el oscilador armónico amortiguado). Lo que resulta interesante es que los autores desarrollan la teoría teniendo ya en mente una determinada aplicación, la que proponen como ejemplo y, por ello, imponen desde el principio, al argumentar, unas determinadas condiciones iniciales [9].
Por ejemplo, el péndulo, que es un sistema bidireccional, se reduce a un caso unidireccional mediante una aproximación que restringe las oscilaciones del péndulo a ángulos pequeños, con lo cual queda claro que la ecuación del movimiento del péndulo y la ley del péndulo que se deriva de ella no se deducen de manera puramente matemática o lógica de las leyes de Newton; y que la ley del péndulo no es una afirmación universal verdadera a propósito de todos los péndulos. (Unas leyes del movimiento que proporcionaran una descripción literalmente verdadera y exacta de hasta los fenómenos físicos más simples deberían de ser muchísimo más complicadas). Pero, según Giere [9], para la manera como los físicos practican la física parece ser que la verdad exacta y literal de las leyes del movimiento es lo de menos. Lo que importa es un grado suficiente de aproximación para el propósito que se persigue, cualquiera que éste sea
Esta reflexión permite afirmar que cuando los físicos dicen que las leyes de la naturaleza son afirmaciones generales confirmadas saben perfectamente que en las ciencias se usan habitualmente aproximaciones; es más, que la idealización y la aproximación forman parte de la esencia de las ciencias empíricas. Siguiendo con este ejemplo, está claro que todo estudiante de física sabe de que está hablando y admite que ningún péndulo real se mueve según indica la ley porque se deja guiar por una lógica de la práctica. Así, un péndulo que realmente cumpla la ley del péndulo es un Modelo Teórico que muestra como pensar y actuar en el conjunto de sistemas reales que se muevan a la manera de un péndulo, porque es similar a estos péndulos que los lectores pueden identificar.
Se establecerían así conglomerados de modelos con diferentes grados de especificidad; éstos, conjuntamente con las hipótesis teóricas experimentales, constituyen las Teorías.
Veamos como se puede aplicar todo ello a la Química y a su teoría más importante la Teoría Atómica Química, que ha de poder funcionar de manera similar al Cambio Químico, puesto que para ello se inventaron sus entidades teóricas (elemento, átomo, reacción química) y su lenguaje de símbolos, fórmulas y ecuaciones. A la luz del modelo cognitivo de ciencia podemos comprender por qué, sin actividad que genere experiencia, las entidades no se comprenden y el lenguaje resulta críptico [10,11]: es la consecuencia de dar más importancia a afirmaciones abstractas de la Teoría (sobre los electrones y núcleos, los enlaces, las valencias, las propiedades termodinámicas y cinéticas) que a sus Modelos teóricos, es decir, a los conjuntos de fenómenos en los que se puede intervenir y que muestran el significado que estas afirmaciones tienen para el químico.
El problema de la química es que sus Modelos Teóricos no son tan visibles como el péndulo. Si, como hace Giere [9], se fijara la atención en los libros de química, se tomarían como Modelos Teóricos las explicaciones generales para familias de fenómenos como el Ácido - Base o la Oxidación- Reducción, que a su vez serían modelos de Md. Pero los libros pasan demasiado deprisa a las ecuaciones químicas o dibujos abstractos. Por ejemplo, un esquema del cloruro de sodio con sus iones dispuestos en una red tridimensional no puede ser un ejemplo de substancia iónica para los lectores, porque, a menos que se conozca muy bien la historia química del cloruro de sodio, la representación gráfica, que corresponde a Md, no aporta nada que permita comprender lo que son las bolitas y los trazos que la unen en el dibujo del libro. En cambio, se dedican muchas páginas a Ma, sin ejemplos apropiados para que los lectores sepan de qué se está hablando.
Según se ha visto en la fig 2, si los hechos y los modelos de una teoría se adaptan mutuamente, los hechos pueden ser explicados mediante las entidades que caracterizan al Modelo Teórico; pero esto no ocurre si los hechos no corresponden al Modelo o si los hechos relevantes se desconocen. Esta confusión puede documentarse a partir de un estudio detallado de los libros de texto y de los exámenes de química en los últimos cincuenta años en los que algunas veces se justifican con Ma fenómenos que se deberían justificar con Md y se explica Ma sin modelos adecuados que permitan hacer comprender su significado.

Fig. 3 El libro de Pimentel representa así la muerte de Bohr (¿Md?)
Se proclama ahora la muerte del átomo planetario (que se puede considerar aún un átomo Md) y su substitución por el átomo Ma (fig. 3) porque se pretende explicar con Ma lo mismo que se explicaba con Md como si Ma fuera la culminación de Md. Pero se puede considerar, en cambio, que cada uno de ellos es Modelo de diferentes conjuntos de fenómenos, por más que ambos sean modelos de la Teoría atómica Química y que ambos son necesarios para hacer comprender como funciona la química en el mundo real. Vamos a continuar desarrollando esta idea.
4. Una propuesta racional y razonable: Contextualización y modelización
Si la teoría (los Modelos teóricos) no correlaciona con la experiencia química, el conjunto de teorías químicas y los lenguajes especializados que se enseñan, relacionadas con una determinada manera de intervenir en determinados fenómenos, deja de ser racional y no es tampoco razonable, ya que se pueden generar argumentos significativos que fundamenten lo que ha de aprender. Para evitar estos problemas es necesario empezar y terminar bien: introducir al discípulo en el programa de trabajo de la disciplina (subapartado a), enseñarle a utilizar los modelos que pueden iluminar su práctica (subapartado b) y evaluarle según sea su actividad científica (subapartado c)
a. Enseñar las reglas del juego de la disciplina y de la enseñanza /aprendizaje
La principal finalidad de la química es el control del cambio químico y para poder ejercerlo se ha desarrollado una manera específica de hacer (método), de pensar (sobre datos cuantitativos, con la teoría apropiada) y de hablar (lenguaje). Los Modelos que se utilizan han de proporcionar un concepto adecuado de la materia y la energía que interviene en cada uno de los cambios que se estudian. Por otra parte, si se ha de enseñar para que los estudiantes puedan aprender va a ser necesario diseñar cuidadosamente lo que se ha de enseñar, cómo hacerlo y para qué hacerlo.
Estas ideas quedan bien representadas en la fig. 4, de un libro de texto moderno Tú y la Química, de Garritz y Chamizo, 2001. En este texto los contenidos del libro se organizan según tres ejes: la cultura científica, que da sentido a los métodos, lenguajes y finalidades; los temas de máximo interés de la disciplina, que se refieren siempre a un determinado tipo de cambio que requiere una manera determinada de imaginar la materia (átomos enlazados) y la energía (enlaces); los conocimientos que son necesarios para comprender el proceso de aprendizaje en contexto escolar. Una propuesta así combina los fundamentos prácticos y teóricos de la disciplina y, a ambos, con los requisitos del aprendizaje; de esta manera el discípulo queda, como ha de ser, en el centro de la propuesta y hacerlo competente pasa a ser la principal finalidad del libro.
Un libro, por bueno que sea, no puede substituir al profesor, aunque es un excelente recurso para la docencia. En este caso, es un nuevo ejemplo de que algo está cambiando en la enseñanza de la química. Las recomendaciones actuales de los gobiernos y de las instancias internacionales que se refieren a la educación insisten en la necesidad de dejar de lado el aprendizaje enciclopédico y, en cambio, desarrollar competencias y evaluar, según ellas, al alumnado. Pero todo ello requiere superar definitivamente la barrera entre los conocimientos teóricos y la práctica; en química, esta reflexión nos encara de nuevo a los átomos ya que éstos son, ante todo, entidades teóricas
En una propuesta de estas características, los átomos podrían conectar con una auténtica química de las substancias centrada en la intervención en Cambios Químicos concretos mediante un proceso de modelización en el cual se enseñe a hacer ciencia (experimentando, leyendo, redactando informes, comparando con aportaciones de otras materias). La actividad científica que sostendría, en este caso, al aprendizaje, permitiría desarrollar una de las principales competencias humanas: la capacidad de pensar de manera teórica, de interpretar lo que se ve y se toca, de intervenir en ello y de prever fenómenos futuros, en términos de entidades abstractas.

Fig. 4. Tres temas, tres elementos de la cultura química y tres dimensiones del aprendizaje
c. Modelar los fenómenos
Si la química se enseñara desconectada de la actividad científica les parecería a los alumnos que los científicos han visto las entidades a las que se refieren cuando comunican sus resultados. Con ello, los conceptos científicos acabarían siendo sólo descriptivos, por muy sofisticados y teóricos que parecieran; perderían su dimensión práctica y una parte importante de su significado. Por ello, lo importante no es describir qué son y como funcionan las entidades químicas, sino plantear un problema que las haga necesarias, que sea adecuado a las capacidades del estudiante y a las finalidades de la enseñanza.
Llamamos modelización al proceso mediante el cual determinados fenómenos se convierten en ejemplos de Cambio Químico según un modelo (Md o Ma) que permita representarse lo que está ocurriendo al intervenir e interpretar los datos que se obtienen. El proceso de modelización en la investigación científica y el proceso de modelización en la enseñanza son muy diferentes en algunos aspectos, pero coinciden en otros; quizás la diferencia es como la que hay entre llevar a cabo una investigación policíaca de un crimen y escribir una novela policíaca. Tanto las diferencias como las semejanzas son administradas por el profesor y dan lugar a propuestas docentes específicas, algunas de las cuales llegan a formar parte de los manuales y textos de divulgación, como hemos ido viendo. La comparación entre ambos permite una reflexión interesante porque ilumina el proceso y, al mostrar sus mecanismos subyacentes, permite adecuarlo a las nuevas demandas del siglo XXI.
La modelización, en ciencias, forma parte del proceso de descubrimiento y de justificación de nuevos conocimientos; cuando los científicos, contrastando nuevos fenómenos con modelos que tienen sentido en la teoría de referencia, colonizan nuevos territorios e introducen las nuevas entidades y reglas del juego que sugiere la nueva aplicación del modelo o el nuevo modelo que se va formando. Un buen ejemplo, citado por Giere [9], es la propuesta de Watson y Crick de una estructura de doble hélice para la molécula de ADN; el modelo-Md era, en aquel caso, una maqueta que reproducía la posible estructura tridimensional de la molécula.
El proceso de modelización en la enseñanza es más complejo, puesto que los estudiantes o bien no conocen ni las teorías ni sus aplicaciones ni sus lenguajes o bien conocen los lenguajes de la teoría pero no saben aplicarla. Se ha de desarrollar, como se ha ido viendo hasta aquí, a partir de la formulación de buenas preguntas en la resolución de problemas y el trabajo experimental, de la lectura de buenos textos y de la argumentación al interpretar los resultados de las intervenciones, todo ello con el objetivo de dar sentido a un conjunto de hechos aparentemente diferentes entre si, pero que se van a poder interpretar se manera similar mediante las entidades propias de la teoría que se van a ir introduciendo en clase [13]. (Izquierdo, Espinet, Sanmartí, 1999).
La figura 4 representa y compara ambos procesos. Un experto (izquierda) contrasta un nuevo fenómeno con un modelo teórico que ya conoce o que intuye que va a funcionar. A partir de este modelo puede hacer una previsión del resultado de una determinada intervención experimental que va a realizar; si la previsión según el modelo coincide con el resultado del experimento y si no hay ningún otro modelo que pueda hacer la misma previsión, el nuevo fenómeno se va a explicar mediante las entidades propias del modelo teórico. Un novato que se introduce en la disciplina ha de ambientarse en una nueva cultura, ha de aprender a preguntarse sobre cantidades y relaciones, a intervenir experimentalmente mediante nuevos instrumentos que requieren nuevas maneras de actuar y que toman sentido en unos modelos que aún no conoce; no tiene autonomía para actuar y necesita de un profesor que le guíe en su actividad científica. En este segundo caso, lo primero que se va a tener que hacer es presentar un determinado conjunto de hechos (los que se van a llegar a interpretar de manera parecida) y sugerir el modelo que va a permitir establecer relaciones entre estos hechos, más abstractas que las que explicarían detalles de cada uno de ellos pero bien asentadas en la cultura científica y capacidades cognoscitivas del alumnado [14].

Fig. 5. Comparación entre el proceso de modelización en la ciencia y el proceso de modelización en la enseñanza
La didáctica de la física ha elaborado numerosos ejemplos de este proceso, pero no se dispone aún de suficientes ejemplos en química. De acuerdo con la fig. 5, los pasos a seguir, en la enseñanza, deberían ser los siguientes:
- Escoger un fenómeno relevante y relacionarlo con otros
- Generar la necesidad de intervención en ellos
- Dar tiempo al alumnado para la apropiación del problema (darse cuenta de las diferencias y semejanzas, de lo que saben y de lo que no saben; introducir entidades para dar sentido a lo que está pasando) y para elaborar buenas preguntas (que son aquellas que invitan a actuar porque se formulan en el contexto adecuado; y pueden recibir una explicación adecuada a la intervención que será consecuencia de haber entendido [15].
-Plantear hipótesis que den lugar a buenas argumentaciones que sean válidas para el conjunto de hechos.
-Elaborar argumentos que justifiquen los resultados de la intervención mediante las nuevas entidades teóricas
Finalmente, todos los fenómenos que van a llegar a ser modelos de Cambio Químico según Md han de compartir las siguientes reglas del juego
-Una substancias desaparecen y aparecen otras
-Se conservan los elementos
La masa se conserva (en los átomos), las substancias reaccionan en proporciones fijas (en las ecuaciones)
- La energía se conserva (en los enlaces)
- El cambio se puede representar mediante átomos y enlaces
- El estado final puede ser de equilibrio químico
En cambio, los fenómenos que van a ser modelos según Ma ya dan todo ello por solucionado por otros. El interés se centra en partes de las moléculas, por ejemplo en interacciones como el efecto túnel entre agrupaciones en una molécula compleja cuya obtención y cristalización ya no interesa. Estos fenómenos comparten las siguientes características:
- Requieren nuevos instrumentos para la interacción entre radiación y materia
- Se refieren a interacciones cuantizadas
- Manipulan lo invisible mediante instrumentos específicos
- Se refieren a fenómenos moleculares
- Constituyen ciencias emergentes (Ciencias de los materiales, Ciencias de las moléculas, Nanotecnologías)
d. Nuevas actividades de evaluación
Finalmente, es necesaria una breve reflexión sobre la evaluación, que debería formar parte de todo el proceso de enseñar y de aprender [16].
La enseñanza de la química según un proceso de modelización y al alcance de todos es completamente diferente de la enseñanza para seleccionar a unos pocos y no va a funcionar si no va acompañado de un dispositivo didáctico que favorezca una nueva dinámica de clase basada en la comunicación de las ideas. El conocimiento ha de circular: de profesor a alumno y de alumnos a profesor, y entre los alumnos; ha de permitir la emergencia de los lenguajes apropiados a las nuevas ideas y que, a la vez, muestren las reglas del juego de la ciencia . Este conocimiento ha de serlo también de la clase, para que el alumnado pueda participar en ella con autonomía y conozca con toda certeza los criterios con los que será evaluado.
La evaluación forma parte de lo que tira del alumnado porque le hace aprender lo que cree que le va hacer aprobar. Por lo tanto, la evaluación que se necesita ha de consistir en preguntas contextualizadas (que se refieran a una situación del mundo que el alumno pueda interpretar y que la sitúen en una perspectiva científica) que interpelen al alumnado y que incidan en los conceptos básicos con un enfoque la vez teórico y práctico. Ha de valorar la capacidad de preguntar y de argumentar, la comprensión lectora y la actitud crítica; ha de tener en cuenta las relaciones entre la ciencia y la técnica y entre ambas y la sociedad. Y ha de ser transparente: no pretende cazar a los alumnos en lo que no saben, sino ayudarles a expresar lo que sí saben. Ha de contribuir al aprendizaje del saber hacer, es decir, ha de hacer al estudiante competente
De nuevo se plantea la necesidad de plantear preguntas auténticas, puesto que sin ellas no se puede generar una actividad química genuina que permita responderlas y llegar a saber hacer participando en la cultura científica según las posibilidades de las personas a las cuales se ofrece. Un conocimiento así, que se deriva de una pregunta que se puede responder de manera argumentada, mediante conocimiento estructurado, práctico y teórico, es dinámico [17], porque se sabe aplicar.
El esquema que conocemos como V de Gowin (fig. 6) muestra las principales características de este tipo de conocimientos que debería ser propio de las clases de ciencias y por ello puede funcionar como logotipo de lo que se ha ido planteando.

Fig. 6. La V divide el papel en cuatro zonas en las cuales colocar: una pregunta sobre una intervención, conocimiento practico y conocimiento teórico que permite responderla y una respuesta argumentada a la pregunta inicial
Al empezar por presentar temas sobre los cuales los estudiantes puedan preguntar se configurará un programa de química que muestra cómo es la intervención química en el mundo (con sus aspectos teóricos y prácticos, con sus lenguajes, con sus justificaciones y expresiones típicas), a diferencia de los programas tradicionales que se centran directamente en las entidades químicas. Los nuevos temas y los fenómenos han de ser rastreados pacientemente en las diferentes disciplinas científicas y se necesitaría investigación para ver si sirven los que ahora ya se están utilizando en los nuevos libros. Han de poder ser vistos desde la perspectiva de alguno de los aspectos del cambio químico, aquél que más fácilmente pueda ser sugerido a partir de una manipulación al alcance del alumnado, aquél que más fácilmente pueda ser representado mediante una analogía o una metáfora que permita orientar convenientemente la atención de los alumnos hacia preguntas productivas. Y han de cubrir los diferentes aspectos de la Teoría Química: sus principales entidades, sus lenguajes, sus instrumentos y sus procedimientos experimentales.
Los proyectos de química más actuales ofrecen ya un amplio repertorio de fenómenos que pueden ser apropiados para la intervención química en ellos. Por ejemplo, de Chemistry in Community: Tenemos necesidad de agua; Conservación de los recursos químicos; Petróleo: ¿para quemar? ¿Para construir?; Salud: riesgos y decisiones; La industria química: promesa y reto. O el proyecto Salters, con sus unidades complementarias como Química de los Medicamentos, Color por diseño, que están siendo traducidas y adaptadas en España de manera experimental [18]. Pero es necesario, como ya se ha dicho, profundizar un poco más, explorando las nuevas vías de la modelización para introducir los conceptos químicos de la manera más apropiada a los fenómenos que se están considerando.
Todo ello necesita nuevos criterios de calidad, y deberíamos tomarnos tiempo para averiguar cuáles son. Si realmente estamos viviendo un cambio de época que, como ocurre siempre, tiene aspectos positivos y aspectos negativos, es necesario trabajar para reforzar de nuevo, con nuevos fundamentos, los positivos: la sabiduría (el conocimiento que ayuda a vivir) frente a la pedantería (el conocimiento que simplemente se acumula), la solidaridad frente a la competitividad, el conocimiento frente a la información.
Conclusión
En esta conferencia se ha analizado la situación actual de la enseñanza de la química, admitiendo como punto de partida que necesita adecuar sus contenidos, lenguajes y métodos a las demandas de formación científica actuales, muy diferentes a las anteriores no sólo por la novedad de la nanotecnología relacionada con el nuevo modelo de átomo cuántico (Ma) sino también por las nuevas finalidades sociales de alfabetización científica que se han de tener muy en cuenta.
Los profesores de ciencias de todos los niveles se forman en la universidad. Les corresponde pues a los profesores universitarios tener una mirada amplia sobre la química que se enseña y que se va a enseñar en un futuro inmediato. Es razonable pensar, como se ha ido haciendo aquí, que la evolución de la Teoría atómica química ha dado lugar ya a dos grupos de profesionales que ya están recibiendo una formación diferenciada: los químicos continúan necesitando Md, los físicos que se dedican a la ciencia de materiales quizás necesiten sólo Ma. Desde luego que la formación básica de un ciudadano que nunca va a ser científico va a ser diferente de ambas. Podrían emerger nuevas disciplinas y que nuestra vieja química no se identifique con ninguna de ellas pero que proporcione ideas para todas ellas.
En todo caso es razonable pensar que las nuevas propuestas disciplinares, racionales y razonables, en las que la teoría y la práctica estén bien relacionadas, darán lugar a programas contextualizados y a propuestas docentes modelizadoras que aseguren que la trama conceptual va a ser la adecuada. Se priorizará, para ello, el aspecto semántico de la teoría (su significado tal como lo muestran sus modelos) frente al aspecto sintáctico (la trabazón lógica de sus lenguajes especializados). En consecuencia, se han proporcionar finalidades que inciten a los alumnos a intervenir en ellos y a pensar; las nuevas estrategias requieren un nuevo perfil de profesorado que alcanza también al de licenciado universitario en química (puesto que algunos de ellos llegarán a ser profesores a su vez), dedicado a hacer que los estudiantes lleguen a ser competentes: como personas, como ciudadanos, como científicos.
Lo que ahora hace falta es avanzar decididamente en esta dirección. La química para todos no puede empezar definiendo entidades que sólo tienen sentido para los químicos, sino planteando situaciones en las cuales la explicación química resulta relevante. Los profesores, formados en la universidad, han de ser capaces de seguir la pista de la química en las situaciones complejas a las que se refieren los temas seleccionados. Para que este cambio tan necesario en la enseñanza se produzca, para que podamos pasar del enciclopedismo (ya inútil en la sociedad de la información) a la sabiduría, también las clases universitarias han de proporcionar un conocimiento que se pueda aplicar y recursos para aprender a aprender, para continuar haciéndolo así toda la vida.
Todo ello es un magnífico estímulo para ejercer de docentes con profesionalidad, con una renovada conciencia y una valoración positiva de lo que esto significa, que no se contrapone (todo lo contrario) a una valoración igualmente positiva de la investigación en química. Es necesario pues defender la importancia de la tarea del profesor, creativa como pocas, que puede conducir a una nueva disciplina de química para la vida, una ciencia que ayude a tomar decisiones para un planeta sostenible, solidario y en paz.
Bibliografía
[1] Echevarria, J., Filosofía de la Ciencia. Madrid: Akal, 1995. [ Links ]
[2] Guidoni, P., On Natural Thinking. International Journal of Science Education, 1985, 7 (2) 133- 140. [ Links ]
[3] Erduran, S.; Scerri, E. The Nature of Chemical Knowledge and Chemical Education. En J. Gilbert et al. (ed.), Chemical Education: Towards Research-Based Practice, 2002, pp. 7- 28. [ Links ]
[4] Scerri, E.; Mc Intyre, L. The Case for the Philosophy of Chemistry. Synthese, 1997, 111, 213- 232. [ Links ]
[5] Bennet, J.; Holman, J., Context-based Approaches to the Teaching of Chemistry: What Are They And What Are Their Effects?, en J. Gilbert et al. (ed.), Chemical Education: Towards Research-based Practice, 2002, pp.165-184. Dordrecht: Kluwer Academic Publishers. [ Links ]
[6] Hannaway, O. The Chemist and the Word. John Hopkins University Press, 1975. [ Links ]
[7] Meinel, C., Early seventeenth- century atomism. Theory, Epistemology And The Insuffiency Of Experiment. Isis, 1988, 79, 68-103. [ Links ]
[8] Kim, M. G.,. The Layers of Chemical Language. I. Constitution of Bodies v. Structure of Matter. His. Sci. XXX, 1992, pp. 69-96. [ Links ]
[9] Giere, R., Explaining Science. University of Chicago Press, 1988. [ Links ]
[10] Izquierdo, M.; Sanmarti, N.; Esinet, M., 1999. Fundamentación y Diseño De Las Pràcticas Escolares De Ciencias Experimentales. Enseñanza De Las Ciencias, 1999, 17 (1), 45-59. [ Links ]
[11] Izquierdo, M., Enseñanza y conocimiento especializado. Conocimiento y conceptos. En Terminología y conocimiento especializado, T. Cabré ed., 2003, pp. 55-88. Barcelona: IULA, UPF. [ Links ]
[12] Izquierdo, M., Adúriz, A.. Epistemological Foundations of School Science. Science & Education, 2003, 12, 27- 43. [ Links ]
[13] Solsona, N., Izquierdo, M., de Jong, O., Exploring the development of the students conceptual profiles of chemical change. International Journal of Science Education, 2003, 25 (1), 3-12. [ Links ]
[14] Justi, R., Gilbert, J., Models and Modelling in Chemical Education, en J. Gilbert et al. (ed), Chemical Education: Towards Research-based Practice, Dordrecht: Kluwer Academic Publishers, 2002, pp. 47- 68. [ Links ]
[15] Pedrosa, H., Teixeira-Días, J., Watts, M. Questions of Chemistry. Int. J. Sci. Educ., 2003, 1015- 103. [ Links ]
[16] Jorba, J., Sanmartí, N.,. Enseñar, aprender y evaluar: un proceso de regulación continua. Publicaciones del MEC: Madrid, 1996. [ Links ]
[17] Perkins, D.N. Knowledge as Design. London: Erlbaum, 1986 [ Links ]
[18] Caamaño, A. Martín-Díaz, M.J., Llopis, R., Química Salters Bachillerato, adaptación. Departament dEnsenyament, 2003. [ Links ]














