Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista de la Sociedad Entomológica Argentina
Print version ISSN 0373-5680On-line version ISSN 1851-7471
Rev. Soc. Entomol. Argent. vol.62 no.3-4 Mendoza Aug./Dec. 2003
El picudo del algodonero en la Argentina: Principales resultados e implicancias de los estudios moleculares
The cotton boll weevil in Argentina: Main results and implications of the molecular studies
Lanteri, Analía A.*, Viviana A. Confalonieri** y M. Amalia Scataglini**
* División Entomología, Museo de La Plata, UNLP, Paseo del Bosque s/n, 1900 La Plata, Argentina. E-mail: alanteri@museo.fcnym.unlp.edu.ar
** Departamento de Ecología, Genética y Evolución, Fac. Cs. Exactas y Naturales, UBA, Ciudad Universitaria, 1428 Buenos Aires, Argentina.
RESUMEN. Después de diez años del primer registro del picudo del algodonero, Anthonomus grandis Boheman (Coleoptera, Curculionidae), en la Argentina, el insecto ha llegado a la zona algodonera del Chaco. Los estudios moleculares realizados sobre poblaciones de la Argentina, Brasil y Paraguay, y posibles poblaciones fuente de EE.UU y México, han aportado información relevante para el control de la plaga. Se aplicaron las técnicas de RAPD (Polimorfismos del ADN Amplificados al Azar) y de secuenciación de los genes mitocondriales de la Citocromo Oxidasa I y II, las cuales permitieron identificar dos linajes principales de picudos: a) linajes con escasa o nula variabilidad medida en términos de heterocigosis y diversidad haplotípica, considerados colonizadores recientes, y asociados con ambientes xerófilos y cultivos de algodón (provincia de Formosa); b) linajes con una elevada variabilidad y diversidad haplotípica, considerados ancestrales, y asociados con áreas de vegetación nativa de la selva misionera (Parque Nacional Iguazú). Se supone que ambos linajes tendrían diferentes orígenes, adaptaciones y preferencias de huéspedes, y que en este momento se estarían hidridando en zonas de ecotono. Se postula que el picudo se hallaría presente en América del Sur como consecuencia de una dispersión natural asociada principalmente con sus huéspedes silvestres de los géneros Gossypium y Cienfuegosia, probablemente desde el Pleistoceno. Por otra parte no se descarta la posibilidad de una o más introducciones desde EE.UU. hacia Brasil, mediante el comercio del algodón. Se destaca la importancia del cultivo extensivo del algodón, y de la deforestación y formación de corredores entre fragmentos de selva, para explicar la dispersión rápida de la plaga durante los últimos 20 años, en áreas algodoneras y/o no algodoneras pero afectadas por serios disturbios ambientales, como por ejemplo la provincia de Misiones.
PALABRAS CLAVE. Picudo del algodonero. ADN mitocondrial. RAPD. Argentina. Variabilidad poblacional. Linajes ancestrales y colonizadores recientes.
ABSTRACT. Ten years after the first record of the cotton boll weevil, Anthonomus grandis Boheman (Coleoptera, Curculionidae), in Argentina, the insect arrived in the cotton area of Chaco. Molecular studies on populations from Argentina, Brazil and Paraguay, and possible source populations from USA and Mexico, provided helpful information to control the pest. RAPD technique (Random Analysis of Polymorphic DNA) and sequencing of Cytochrome Oxidase I and II mitochondrial genes, allowed to differentiate two main lineages: a) lineages with scarce or null variability measured by heterocigosis and haplotypic diversity, considered recent colonizers, and associated with xerophytic environments and cotton areas (Formosa province); b) lineages with high genetic variability and haplotypic diversity, considered ancestral, and associated with areas of wild vegetation as the subtropical forests of Misiones (Iguazú National Park). Both lineages probably have different origins, adaptations and host preferences, and at present would be hibridizing in ecotonal areas. We propose that the boll weevil probably occurs in South America as a consequence of a natural dispersal associated to wild hosts, mainly of the genera Gossypium and Cienfuegosia, probably since Pleistocene times. On the other hand, there is a possibility of introductions from USA to Brazil, trough the commercial exchange. Extensive cotton cultivation and deforestation, with formation of corridors connecting fragments of forests would explain the rapid dispersal of the pest during the last 20 years, in cotton and/or non cotton areas under environmental impact, such as the Misiones province.
KEY WORDS. Anthonomus grandis. Mitochondrial DNA. RAPD. Argentina. Population variability. Ancestral lineages and recent colonizers.
INTRODUCCIÓN
Una década después que el picudo del algodonero, Anthonomus grandis, fuera registrado por primera vez en la Argentina, el insecto llegó al Chaco, provincia cuya economía se sustenta básicamente en la producción de algodón. Los departamentos de Primero de Mayo, Bermejo y Libertad han sido declarados en emergencia por resolución 262/03 del Boletín Oficial del Servicio Nacional de Sanidad Agroalimentaria (SENASA), y en consecuencia, deberá iniciarse una nueva etapa en la lucha contra la plaga.
Hasta el presente, los principales esfuerzos de dicho organismo estuvieron destinados a impedir el avance del picudo, desde zonas algodoneras de Brasil y Paraguay hacia las provincias limítrofes con la Argentina (Misiones y Formosa). Para ello, a partir de 1993, se diseñó una red de trampas de feromonas con el fin de monitorear los movimientos de la plaga en zonas específicas de vigilancia, como son las fronteras, los centros de acopio de algodón, las rutas provinciales y las áreas de cultivo (Manessi, 1997). No obstante los ingentes esfuerzos realizados para erradicar al picudo, la realidad actual indica que Anthonomus grandis se halla establecida en el país, desde Misiones hasta el norte de Corrientes y desde Formosa hasta Chaco, y que será necesario implementar un eficiente programa de control integrado de sus poblaciones para minimizar el impacto económico sobre la producción algodonera.
En 1997 las autoras de esta contribución iniciaron estudios moleculares en poblaciones de A. grandis de Argentina, Brasil y Paraguay, y desde entonces han realizado diversos análisis con el fin de lograr una caracterización genética de las mismas, de estimar sus niveles de flujo génico y de interpretar sus principales vías de dispersión. En las últimas décadas las técnicas moleculares se han convertido en poderosas herramientas para el control de plagas, ya que permiten establecer el grado de aislamiento de las poblaciones, así como su lugar de origen y los procesos históricos que tuvieron lugar durante su evolución en el tiempo y el espacio (Confalonieri et al., 1998, 2002; Lanteri, 1999; Scataglini et al., 2000; Lanteri & Confalonieri, 2003).
El objetivo principal de esta contribución es realizar una síntesis de los aportes más relevantes que surgen de los estudios moleculares, y discutir sus implicancias tanto a nivel de los conocimientos básicos, como aplicados al control de plagas.
¿Por qué Anthonomus grandis es una plaga tan difícil de controlar?
La información reunida sobre diversos aspectos de la biología de A. grandis (Falcón et al., 1986; Manessi, 1997) contribuyen a explicar por qué esta especie es la mayor plaga del algodonero en toda América.
La especie registra una elevada tasa y eficiencia reproductivas. Las hembras del picudo pueden llegar a depositar 300 huevos a lo largo de toda su vida (el promedio es de 100-120), en los botones florales y capullos del algodonero y de otras malváceas. Para ello preparan un sitio de oviposición con su rostro, perforando las estructuras reproductivas del huésped, que servirán de protección y alimento a las larvas.
La supervivencia de los estados de huevo y larva, que en Curculionidae suelen alcanzar los mayores porcentajes de mortalidad, es muy elevada, puesto que el desarrollo larval es endofítico y de este modo se halla protegido contra posibles depredadores.
Puede haber entre siete y diez generaciones anuales, y el período que media entre la oviposición y la emergencia de los adultos es muy breve en condiciones óptimas de temperatura y humedad. Por ejemplo, a temperaturas de 30° C dicho período es de 17-18 días.
El picudo ha demostrado poseer una enorme capacidad de adaptación a diferentes ambientes. Si bien se considera originario de tierras bajas, húmedas y calientes, como las selvas del sur de México, se ha adaptado a áreas de temperaturas templado-frías y extrema aridez, como el desierto de Sonora en el noroeste de México y el sudoeste de EE.UU. En estos ambientes los picudos suelen atravesar una diapausa invernal, período en que sobreviven en los capullos caídos, la hojarasca y otros lugares de refugio, sin desarrollar actividad reproductiva y con un consumo energético mínimo. También se ha propuesto la existencia de una diapausa estival relacionada con períodos de sequía.
La capacidad de dispersión de la especie es muy grande y esto se debe no sólo a que los adultos son buenos voladores, sino también a las posibilidades del transporte de huevos, larvas y pupas dentro de los capullos y botones florales de diversas malváceas, por medio del viento, adheridos a diversos animales, y en el caso del algodón, mediante instrumentos de labranza, acopio y transporte.
Los machos producen una feromona de agregación que atrae tanto a hembras como a machos. Cuanto más se alimentan mayor es la producción de feromona y por lo tanto la atracción de numerosos individuos hacia la fuente de alimento. Asimismo se ha demostrado que esta capacidad se incrementa cuando los picudos consumen algodón cultivado.
El picudo es una especie oligófaga al estado de larva, que se alimenta no sólo de Gossypium hirsutum L, sino también de otras especies de malváceas de las tribus Gossypieae (Cienfuegosia, Hampea y Thespesia), Hibisceae (Hibiscus) (Cross et al., 1975; Burke, 1976; Anderson, 1993) y probablemente de otros huéspedes aun no bien estudiados (Sida, Abutilon, Pseudabutilon, etc), la mayoría de los cuales se distribuyen en vastas áreas del continente americano. Los huéspedes silvestres y cultivados habrían favorecido la expansión del rango geográfico de A. grandis tanto en tiempos prehistóricos como históricos (Lanteri et al., 2002 a, b; Loiácono et al., 2003).
Hipótesis previas sobre las causas de la distribución del picudo del algodonero
Anthonomus grandis fue descripta por Boheman en 1843, sobre la base de material de México, pero los primeros registros de daños sobre algodón cultivado datan de 1880 (Monclova, México) y 1894 (Texas, EE.UU). Desde entonces ocurrió una rápida y devastadora invasión del cinturón algodonero del sur de EE.UU de modo que en 1916 el picudo se hallaba en la costa Atlántica (Burke et al., 1986). La campaña de erradicación del picudo llevada a cabo en dicho país obligó a reemplazar el algodón por otros cultivos, en la mayor parte del área que se extiende hacia el este de Texas. Sin embargo la especie nunca pudo erradicarse del área comprendida entre Texas y California, ya que en ella existen hospederos alternativos al algodón, como por ejemplo Gossypium thurberi Todaro y Cienfuegosia drummondii (A. Gray) Lewton.
Según la hipótesis de Burke et al. (1986) la presencia del picudo en EE.UU. se explicaría por una dispersión natural desde las selvas del sur de México, a lo largo de las costas Pacífica y del Golfo, ocurrida probablemente durante el Pleistoceno. Dicha dispersión habría acompañando la diferenciación de algunos de sus huéspedes nativos de los géneros Gossypium y Cienfuegosia. A partir de entonces la selección natural habría favorecido la adaptación de las poblaciones de picudo a nuevas condiciones ambientales, de modo que cuando comenzó el cultivo extensivo del algodón en el cinturón del sudeste de EE.UU, había poblaciones capaces de colonizar las nuevas áreas cultivadas. Según Burke et al. (1986) ambas condiciones fueron necesarias para que se produjera esa espectacular invasión de los zonas algodoneras, la disponibilidad de algodón y la presencia de picudos pre-adaptados para vivir en ambientes marginales (más áridos y secos que los de su área de distribución original).
La diferenciación morfológica, biológica y genética alcanzada por las poblaciones del nordeste de México y sudoeste de EE.UU. (forma thurberia) y del sudeste de EE.UU. (forma del sudeste), con respecto a las del sur de México (forma mexicana), demuestra que la presencia de la plaga en EE.UU. no fue consecuencia de una introducción reciente, sino de un proceso de divergencia y ampliación del rango geográfico que pudo haber durado miles de años o hasta más de un millón de años.
La presencia de A. grandis en distintos países de América del Sur ha sido considerada, hasta el presente, como resultado de introducciones sucesivas a causa del comercio del algodón (Manessi, 1997). La secuencia temporal en que fue registrada es la siguiente: Venezuela 1949, Colombia 1951, Brasil 1983, Paraguay 1991, Argentina 1993 y Bolivia 1997. En la Argentina el picudo fue hallado por primera vez en Misiones en una zona donde no se cultiva algodón, el Parque Nacional Iguazú; un año después se encontró en zonas algodoneras de Formosa (1994), y subsecuentemente en Corrientes (1996) y Chaco (2003). Asimismo en 1998, una de las autoras de esta contribución tuvo la oportunidad de identificar un ejemplar de picudo procedente de trampas de feromonas ubicadas en la provincia de Salta (Colonia Santa Rosa), casi en la frontera con Bolivia, asociado aparentemente con vegetación silvestre.
El conocimiento sobre la variación morfológica y genética de las poblaciones de picudo en América del Sur es aún insuficiente. Burke et al (1986) señalaron que algunas muestras de A. grandis de Brasil se asemejaban a la forma del sudeste, la cual también estaría presente en Venezuela, en consecuencia propuso que los picudos de Brasil habrían ingresado desde dicho país o directamente desde EE.UU. Sin embargo los mismos autores destacaron que resulta necesario realizar estudios más detallados al respecto.
Principales resultados obtenidos a partir de los estudios moleculares
Nuestro grupo de investigación llevó a cabo dos trabajos donde se aplicó la técnica de RAPD (Polimorfismos de ADN Amplificados al Azar) para analizar la variabilidad de las poblaciones de A. grandis en Argentina, Brasil y Paraguay, considerando como posibles poblaciones fuente, muestras de México y EE.UU. (Lanteri et al., 2000 Scataglini et al. 2000). Dado que dicha técnica no permite realizar inferencias de tipo filogenético, se decidió iniciar un análisis de secuencias de los genes mitocondriales de la Citocromo Oxidasa I y II (COI y COII) (Confalonieri et al., 2003), y un estudio filogeográfico (Scataglini et al, inéd.) a fin de interpretar la historia evolutiva de A. grandis.
En los estudios de RAPD todas las poblaciones estudiadas se comportaron como unidades panmícticas independientes y la mayor variabilidad genética medida por porcentaje de loci polimórficos y niveles de heterocigosis se registró en las muestras de Tecomán (sudoeste de México) y del Parque Nacional Iguazú (Misiones, Argentina). El cálculo del número de migrantes por generación (Nm) señala que el par Tecomán–Iguazú registra el valor de tasa de migración efectiva más alto, a pesar de que éstas son poblaciones geográficamente muy distantes, lo cual estaría indicando una posible conexión ancestral entre las mismas. Asimismo el árbol de Neigbour–Joining resultante del estudio de RAPD también muestra que la población de Iguazú es genéticamente más próxima a la de México, que a las restantes poblaciones procedentes de zonas algodoneras de la Argentina (Laguna Naick–Neck en Formosa), Paraguay (Caacupé e Yjhovy) y Brasil (Carajá y Londrina en el estado de Paraná), a pesar de que estas últimas se hallan geográficamente más próximas (Scataglini et al, 2000).
A fin de corroborar la hipótesis surgida a partir de los marcadores RAPD se analizaron secuencias de dos genes mitocondriales que por su elevada tasa mutacional resultan marcadores adecuados para realizar estudios a nivel infraespecífico y de especies próximas (Avise, 2000) Una población se considera ancestral o antigua cuando posee numerosos haplotipos o variantes del ADN mitocondrial, y reciente o colonizadora, si tiene uno o unos poco haplotipos separados por uno o unos pocos pasos mutacionales (sustituciones de nucleótidos). Además, cuando varias poblaciones diferentes poseen un mismo haplotipo, se puede inferir que tienen un mismo origen (Avise, 2000; Confalonieri et al., 2003; Lanteri & Confalonieri, 2003).
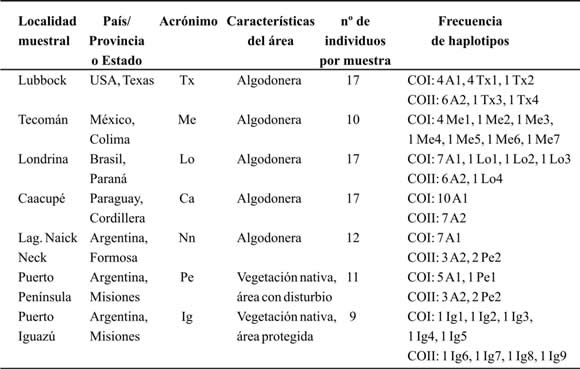
A partir de las secuencias del gen COI se identificaron 19 haplotipos diferentes en poblaciones de picudos de la Argentina, Brasil, Paraguay, México y USA; y a partir del gen COII, nueve haplotipos (en este último caso no fue posible estudiar poblaciones de México por falta de material suficiente). La procedencia de todas las muestras estudiadas, como así también su tamaño y los haplotipos presentes en cada una de ellas, se detallan en la Tabla I. Como puede observarse, las muestras con mayor diversidad haplotípica son las de México y la del Parque Nacional Iguazú, las cuales para COI presentan siete y cinco haplotipos distintos, respectivamente. Además se identificó un haplotipo al que se denominó A1 en COI, y A2 en COII, que es muy frecuente en la mayoría de las muestras recolectadas en zonas algodoneras de América del Sur y en Texas, pero está ausente en la de México y en la de Iguazú. Inclusive las poblaciones de Caacupé (Paraguay) y de Laguna Naick-Neck (Formosa, Argentina) son monomórficas para el haplotipo A (Confalonieri et al., 2003; Scataglini et al. inéd.).
Tabla 1. Información sobre procedencia de las muestras estudiadas, tamaño de las mismas y frecuencia de haplotipos hallados.
En los filogramas obtenidos mediante técnicas de parsimonia también se observa que los haplotipos de Iguazú forman un clado independiente de los restantes, procedentes de áreas algodoneras de América del Sur y de Texas, y que el número de cambios acumulados en el clado de Iguazú es aun mayor que en la muestra de México (Fig. 1) (Confalonieri et al., 2003; Scataglini et al. inéd).
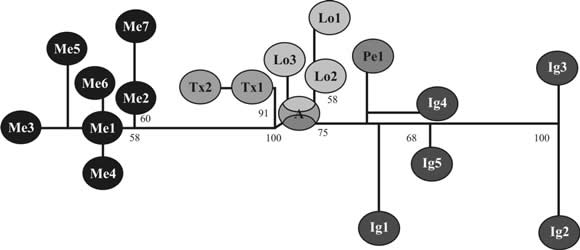
Figura 1: Filograma de haplotipos basado en secuencias del gen mitocondrial COI (Citocromo Oxidasa I). El largo de las ramas es proporcional al número de pasos entre los haplotipos. Los acrónimos utilizados son los mismos de la Tabla 1. Los números ubicados en la intersección de las ramas indican valores de bootstrap (ilustración tomada de Confalonieri et al. 2003).
La nueva hipótesis que surge de la evidencia molecular
Todos los análisis moleculares realizados aportan evidencias en favor de una nueva hipótesis para explicar la presencia de A. grandis en América del Sur, ya que de acuerdo con los valores de variabilidad genética y diversidad haplotípica alcanzados, algunas poblaciones deben considerarse típicamente ancestrales, lo cual significa que ciertos linajes de picudos se hallarían en áreas de vegetación nativa, con anterioridad al inicio del cultivo del algodón. Sin embargo, la hipótesis de introducción de la plaga mediante el cultivo del algodón tampoco puede descartarse, ya que también se identificaron poblaciones con características de colonizadoras recientes, es decir, con muy bajos niveles de heterocigosis y/o diversidad haplotípica nula.
El haplotipo A se ha encontrado en zonas algodoneras situadas en ambientes de vegetación xerófila de Texas y de Brasil–Paraguay–Argentina, pero no estaría presente en México, de modo que esta distribución disyunta podría interpretarse como consecuencia de una colonización a distancia desde EE.UU., debida al cultivo del algodón. Pero por otra parte llama la atención el hecho de que uno de los huéspedes nativos del picudo, Cienfuegosia drummondii (A. Gray) Lewton, exhiba el mismo patrón disyunto (Texas, provincia biogeográfica chaqueña en América del Sur) (Burke & Clark, 1976), lo cual sugiere que dicho patrón podría explicarse tanto por dispersión a distancia como por vicarianza, es decir, por interrupción de la distribución continua de la especie debida al surgimiento de una barrera geográfica. Por ejemplo, se podría postular que durante el período de máxima expansión de las zonas áridas ocurrido en el Pleistoceno (Simpson–Vuilleumier, 1971; Ab'Saber, 1977), el huésped y su fitófago alcanzaron su rango de expansión máxima, y hacia fines de ese período geológico, cuando se produjo una re-expansión de las selvas y una reducción del área de costas por elevación del nivel de los océanos (Donn et al., 1962), en México se habrían extinguido los linajes de picudos asociados con vegetación xerófila costera (con alta frecuencia del haplotipo A). Asimismo una vez que comenzó el cultivo extensivo del algodón, tanto en América del Sur como en América del Norte, las poblaciones habrían atravesado cuellos de botella que condujeron a la selección del haplotipo A, de modo que éste se transformó en el más frecuente o en el único presente en ciertas áreas de cultivo.
Existen numerosos ejemplos de patrones disyuntos en plantas vasculares distribuidas en zonas templadas y desiertos de EE.UU., y en áreas de vegetación xerófila de América del Sur, y no hay acuerdo entre los especialistas acerca de cuál de las dos hipótesis, vicarianza o dispersión, es la más plausible (Axelrod, 1958; Raven, 1963; Raven & Axelrod, 1975; Lia et al., 2001). Se espera que futuros estudios de filogeografía comparada, en plantas y fitófagos asociados, bajo el marco teórico–metodológico de la biogeografía histórica, contribuyan a dar respuesta a los interrogantes aun no resueltos.
Los indicios de que A. grandis podría hallarse en América del Sur como consecuencia de una dispersión natural son numerosos, pero hasta el presente no habían sido considerados. Por ejemplo, el picudo se encontró por primera vez en Venezuela en 1949, tanto en algodón cultivado como en Cienfuegosia affinis (H.B.K.) Hochreutiner, cuyo rango de distribución incluye también Brasil, Bolivia, Paraguay y Argentina (Szumkowski, 1952). Parece improbable que un insecto recientemente introducido se hubiera adaptado tan rápidamente a un huésped nativo. En Cuba el picudo se asocia exclusivamente con G. barbadense L. y en general no causa daños a dicha planta (Burke et al., 1986), por lo que podría inferirse que la presencia de huésped y fitófago se debería a una dispersión natural desde el continente hacia la isla. La capacidad de dispersión transoceánica de varias especies de Gossypium ha sido bien documentada (Fryxell, 1965, 1969). También resulta llamativo que los primeros registros de A. grandis en la Argentina no procedan de zonas algodoneras sino de un área de vegetación nativa (Iguazú); que uno de los primeros focos de picudo en Brasil se localizara en el nordeste, donde se distribuye el algodón endémico Gossypium mustelinum Miers ex Watt.; que el foco ubicado en Paraguay coincida con el área de mayor diversidad específica de Cienfuegosia en América y que en dicho país la asociación natural de A. grandis con el ectoparasitoide Catolaccus grandis (Burks) (Hymenoptera: Pteromalidae) sea sorprendentemente elevada (Gallo et al., 1998).
Los datos mencionados precedentemente sugieren que A. grandis podría haber estado asociado con malváceas nativas de América del Sur antes de que comenzara el cultivo extensivo del algodón, pero hasta el presente se supuso que dichas plantas servirían sólo como hospederos alternativos durante épocas de inter-zafra. Los resultados de los estudios moleculares proveen una evidencia fundamental en favor de la distribución natural del picudo en América del Sur, al mismo tiempo que demuestran que el cultivo del algodón ha jugado un rol determinante en la dispersión de la plaga.
Implicancias teóricas y prácticas de la nueva hipótesis propuesta
Implicancias prácticas: Linajes de picudos con diferentes características morfológicas, genéticas y biológicas podrían requerir diferentes estrategias de control.
Las formas de picudo descriptas por Burke (1968) para América del Norte, no sólo se diferencian por sus caracteres morfológicos sino además por sus preferencias de huéspedes, biología y adaptaciones (Burke et al., 1986). Por ejemplo la forma thurberia es la más robusta de las tres, se asocia preferentemente con el huésped silvestre Gossypium thurberi, algodón silvestre endémico del desierto de Sonora, sus hembras oviponen preferentemente en capullos y no en flores, y de acuerdo con análisis moleculares mediante fragmentos de restricción de ADN mitocondrial sus poblaciones son genéticamente muy variables (Roehrdanz, 2001).
Desde el punto de vista aplicado la caracterización genética es importante para establecer desde qué áreas y a partir de qué huéspedes (cultivados o silvestres) provienen los picudos que atacan el algodón en una zona determinada (Bartlett et al., 1983; Roehrdanz & North, 1992). Por ejemplo, estudios morfológicos y genéticos indican que los picudos de áreas algodoneras de Arizona provienen por un lado de áreas algodoneras de Sonora (los vientos predominantes favorecen este movimiento especialmente hacia fines de la época de cosecha), y por otro, de poblaciones asociadas con G. thurberi en Arizona. Inclusive Burke et al (1986) señalaron que en ciertas áreas los picudos asociados con G. thurberi continuarían su divergencia genética, en tanto que en otras, estarían aislados de los linajes asociados con el algodón. Asimismo Roehrdans & North (1992) señalaron la importancia de los estudios basados en ADN mitocondrial para poner a prueba hipótesis alternativas con respecto a los cambios de huéspedes:
a. Si el cambio de huéspedes desde malváceas silvestres hacia el algodón fuera muy reciente o si se hubiera dado en una pequeña población, por efecto de cuello de botella cabría esperar una escasa variabilidad a nivel de los haplotipos mitocondriales de dicha población.
b. Si los picudos que se desarrollan habitualmente en plantas silvestres pudieran pasar al algodón cada vez que les fuera posible, entonces cabría registrar una considerable variabilidad en las poblaciones de estos picudos.
Los estudios morfológicos y genéticos que está desarrollando nuestro grupo de investigación, aunque aun preliminares, demuestran que en la Argentina existen dos linajes principales de picudos: los que presentan al haplotipo A como el más frecuente o son monomórficas para dicho haplotipo, y los que registran una gran variabilidad haplotípica pero carecen del haplotipo A. Las primeras incluyen individuos muy robustos y de tamaño grande (además de otras características morfológicas), y estarían adaptadas al ambiente típico de la provincia biogeográfica chaqueña (xerofítico en relación con las selvas de la provincia paranaense) y al algodón cultivado como huésped principal.
El tamaño de los picudos está determinado por el tamaño de la estructura reproductiva en la cual se desarrolla la larva (depende de la cantidad de alimento consumido), de modo que esta característica morfológica podría tomarse como un indicio de que dichos picudos se han desarrollado en algodón. Estos datos concuerdan con los obtenidos a partir de capturas en la zona de erradicación de Formosa, donde se advierte el ingreso de picudos procedentes de áreas algodoneras de Paraguay, próximas a la frontera (Manessi, 1997; Lanteri et al., 2000). Asimismo, debido a la ausencia de variabilidad genética, se podría inferir que dichos picudos han atravesado un cuello de botella y podrían haber perdido la capacidad de cambiar de huéspedes o de desarrollarse en otros huéspedes además del algodón cultivado.
Por lo contrario, las poblaciones procedentes de áreas de vegetación nativa de Misiones, como es el Parque Nacional Iguazú, presentan picudos de tamaño mucho más pequeño y una elevada variabilidad genética también expresada en varios caracteres morfológicos que están siendo estudiados (del Río & Lanteri, 2003). Cabe suponer que estos picudos se desarrollan en malváceas silvestres aun no identificadas, cuyas estructuras reproductivas son probablemente más pequeñas que las de Gossypium hirsutum L, estarían adaptados a ambientes húmedos como los de la selva paranaense, y conservarían la capacidad de realizar cambios de huéspedes y de pasar al algodón cultivado cuando éste estuviera disponible. En efecto, resultados preliminares señalan que los picudos que actualmente causan daños en áreas algodoneras del norte de Corrientes, provendrían principalmente de áreas de vegetación silvestre de Misiones.
Implicancias teóricas: Nuevas hipótesis sobre la distribución y huésped ancestrales de A. grandis
Los resultados obtenidos a partir de los estudios moleculares permiten plantear alternativas a las hipótesis previas sobre el lugar de origen y el huésped ancestral del picudo. Según Burke et al (1986) A. grandis es originaria de las selvas del sur de México, área en que se registra la mayor diversidad específica de Hampea, género de malváceas considerado ancestral para las cinco especies del grupo de A. grandis (Jones & Burke, 1997; Jones, 2001). Sin embargo, si para identificar el área de origen del picudo se tomara en cuenta la ubicación de las poblaciones con mayor variabilidad genética del insecto, entonces ésta debería situarse en América del Sur.
El concepto de centro de origen ha sido criticado por numerosos biogeógrafos modernos dado que los criterios empleados para determinar su ubicación se fundan en argumentos cuyo sustento es débil y a veces contradictorio (Croizat et al., 1974; Rosen, 1976; Nelson & Platnick, 1981; Morrone, 2002). Asimismo en el caso del picudo no podría darse una respuesta definitiva al respecto, pues aun resta estudiar numerosas poblaciones del área comprendida entre Argentina y México, y se necesita mayor información sobre filogenia, distribución y variación genética de sus huéspedes. La novedad más importante con respecto a la distribución ancestral de A. grandis aportada por la evidencia molecular, es que la especie se hallaba ampliamente distribuida en las Américas, probablemente desde el Pleistoceno (Scataglini et al., inéd.).
A causa de la intervención humana resulta muy difícil establecer, tanto en el caso de A. grandis como en el de sus huéspedes cultivados, cuáles eran los límites de la distribución ancestral, antes de dicha intervención (Phillips, 1963; Fryxell, 1979). En este sentido no sólo se debe tener en cuenta el cultivo moderno del algodón sino además la dispersión asociada con el cultivo primitivo de Gossypium hirsutum L. desde hace aproximadamente 8.000 años (MacNeish, 1964; Fryxell, 1965), y de otros algodones nativos como por ejemplo Gossypium barbadense L, utilizados para consumo familiar por los aborígenes americanos y los primeros colonizadores (Hutchinson et al., 1 947; Gutiérrez et al., 1960; Carnevali, 1970).
Las autoras de este artículo suponen que los linajes de picudo actualmente asociados con ambientes xerófilos de América del Sur podrían haberse dispersado a largo de la costa norte de Brasil y desde el nordeste brasileño hasta Paraguay siguiendo el denominado corredor de las savanas (Prado & Gibbs, 1993; Morrone, 2000), que incluye las provincias biogeográficas de la Caatinga, del Cerrado y Chaqueña (Cabrera & Willink, 1980), en las cuales crecen numerosos potenciales huéspedes, principalmente especies de Cienfuegosia, Gossypium mustelinum Miers ex Watt, e Hibiscus pernambucensis Arruda. También cabe suponer una distribución natural del picudo desde Colombia hasta Bolivia, siguiendo las distribución de las poblaciones genéticamente más variables de G. barbadense L. (Gutiérrez et al., 1960; Carnevali, 1970), y la posibilidad de que en América del Sur haya otros huéspedes nativos no bien estudiados, como por ejemplo especies de malváceas pertenecientes a los géneros Abutilon, Pseudabutilon, Sida, Pavonia y Sphaeralcea.
Estas propuestas deben ser confirmadas por estudios de campo, que permitan certificar el desarrollo de la especie en los distintos huéspedes nativos, y con el análisis molecular de muestras de diferentes áreas de América del Sur. Por el momento no es posible establecer hasta qué latitud llegaba el picudo antes de que comenzara el cultivo extensivo del algodón y/o la deforestación masiva. Tampoco se puede saber si los picudos del Parque Nacional Iguazú, estudiados sobre la base de material de trampas colocadas en la frontera entre Argentina y Brasil, procedían de uno u otro país, o de áreas de selva situadas dentro o fuera del parque, ya que los vientos podrían haber favorecido su dispersión desde zonas más alejadas. Lo que sí se puede argüir sobre la base de la evidencia molecular, es que esos picudos no provienen de áreas algodoneras cercanas, sino de algún lugar de la selva paranaense (sensu Morrone, 2001).
Con respecto al supuesto huésped ancestral del grupo grandis, cabe señalar que Hampea es un género de origen reciente en términos filogenéticos, con una distribución restringida, que se extiende entre el sur de México y Colombia (Fryxell & Lukefahr, 1967; Fryxell, 1979; Jones et al., 1997). Por lo tanto las poblaciones ancestrales de A. grandis presentes en áreas de vegetación nativa situadas al sur de Colombia, no podrían haberse desarrollado en dicho huésped. Las autoras de este trabajo consideran que géneros de malváceas de mayor antigüedad y con una amplia distribución geográfica en las Américas, como Gossypium y Cienfuegosia, son huéspedes ancestrales más plausibles que Hampea, el cual podría ser un huésped secundario. En América del Sur existen especies diploides y anfidiploides de Gossypium, presentes al menos desde el Pleistoceno, y una gran diversidad de especies de Cienfuegosia, principalmente en áreas de vegetación xerófila (Krapovickas, 1999), muchas de los cuales podrían haberse comportado como huéspedes ancestrales de A. grandis (Fig. 2).
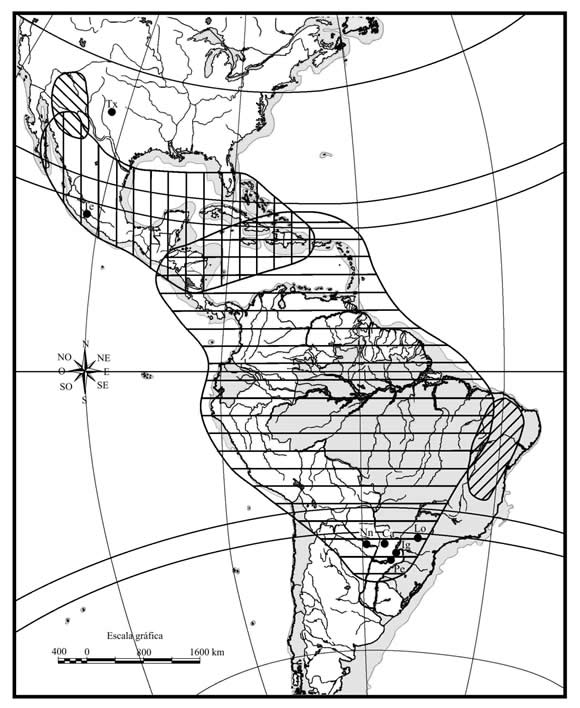
Figura 2. Mapa mostrando las poblaciones de Anthonomus grandis estudiadas en estudios moleculares. Los acrónimos son los mismos que se utilizaron en la Tabla 1 y la figura 1. Las áreas delimitadas y diferenciadas con distinto tipo de rayas corresponden a la distribución de cuatro especies de algodones americanos: Gossypium thurberi Todaro (rayas oblícuas hacia la derecha); G. hirsutum L. (rayas verticales); G. barbadense L. (rayas horizontales) y G. mustelinum Miers ex Watt. (rayas oblícuas hacia la izquierda).
Por otra parte el especialista norteamericano W. Clark (1995) ha propuesto que A. grandis podría estar más estrechamente relacionada con ciertas especies del género Loncophorus Chevrolat, distribuido desde Argentina hasta México y asociado con Bombacaceae (familia de Malvales próxima a Malvaceae) (Clark, 1988), que con las demás especies del grupo grandis, restringidas a México y Costa Rica, y con Hampea como único huésped (Jones, 2001). Es decir que la reformulación del análisis de las relaciones filogenéticas de A. grandis también podría influir sobre la proposición de una nueva hipótesis sobre sus posibles huéspedes ancestrales. Asimismo los estudios filogenéticos de malváceas basados en datos moleculares, en especial aquéllos relativos a la evolución de Gossypium, también prometen aportar información valiosa para interpretar la evolución del picudo en América (Wendel et al., 1995; Zhao et al,. 1998; Small & Wendel, 2000; Wendel & Cronn, 2002).
PERSPECTIVAS Y CONCLUSIONES
Anthonomus grandis es una de las especies de Curculionidae que ha recibido mayor atención por parte de entomólogos de todas las especialidades, en los últimos 120 años, sin embargo, es indudable que aun resta muchísimo por conocer acerca de la constitución genética de sus poblaciones, sus huéspedes y preferencias de alimentación, sus adaptaciones a diferentes ambientes, sus relaciones filogenéticas con otros Anthonomini, etc. Aunque existen patrones generales, el comportamiento de la especie tiene sus peculiaridades en cada región del continente americano. Las estrategias para su control no deberían ser las mismas en áreas de cultivo situadas en valles entre montañas, como ocurre en México, América Central y países del norte de América del Sur, que en ambientes abiertos o corredores naturales o artificiales, donde las plaga no tiene barreras geográficas naturales para su dispersión. Además se deberían tomar en cuenta los diferentes ambientes (desiertos, bosques xerófilos o selvas tropicales o subtropicales; áreas con o sin mayor grado de disturbio por la agricultura y/u otras actividades humanas) y las posibles adaptaciones de los picudos a dichos ambientes (mayor o menor resistencia a la sequía o las bajas temperaturas, preferencias para la oviposición en capullos o en botones florales, preferencias de alimentación por determinados huéspedes alternativos al algodón, etc.).
Nuestro grupo de investigación continua trabajando en la caracterización genética de poblaciones de picudo con el objetivo de ampliar el muestreo hacia áreas aun no exploradas, que se consideran críticas para el avance de los estudios, por ejemplo Colombia, Bolivia, el nordeste de Brasil, y las provincias de Chaco y Corrientes en la Argentina. Se ha iniciado la caracterización morfológica de los linajes de picudo distribuidos en la Argentina y países limítrofes, y su comparación con los resultados obtenidos a partir de los análisis moleculares (del Río & Lanteri, 2003); se ha llevado a cabo un estudio filogeográfico para explicar la evolución del picudo en América donde se aplicó un reloj molecular basado en el gen COI (Scataglini et al. inéd.), procedimiento que ha dado muy buenos resultados para estimar la antigüedad de filogrupos diferenciados durante el Pleistoceno (Avise & Walker, 1998); y se está realizando la caracterización de poblaciones de diferentes áreas de la provincia de Misiones mediante la técnica de RAPD de alta resolución (Guzmán et al., 2003).
El estudio de las poblaciones de Misiones justifica la realización de análisis genéticos detallados, ya que en dicha provincia existe la posibilidad de que picudos procedentes de áreas de selva nativa se estén hibridando con otros que provienen de áreas algodoneras de Paraguay, especialmente en las zonas de frontera y después de las zafras. Indudablemente la deforestación indiscriminada que tuvo lugar en esta provincia durante los últimos 20 años ha determinado la formación de fragmentos de selva nativa conectados por corredores artificiales, que habrían facilitando la dispersión rápida del picudo, a pesar de que en dicha provincia no se cultiva algodón.
Otros aspectos fundamentales que deberían ser investigados se refieren a la identificación de los huéspedes nativos de A. grandis en Misiones y otras provincias de la Argentina, y al estudio de las preferencias de oviposición de las hembras adultas, ya que este comportamiento determina en qué huéspedes se desarrollarán las larvas. En este último caso será preciso realizar una previa caracterización genética de los individuos empleados en los experimentos, ya que si se trabajara con linajes de picudos endocriados o con muy escasa variabilidad (como aquellos monomórficos para el haplotipo A) se podría obtener como resultado una marcada preferencia por Gossypium hirsutum L., en tanto que si se utilizaran muestras con elevada variabilidad genética, los picudos podrían tener un rango de huéspedes mucho más amplio. Por ejemplo, ciertas poblaciones de picudos de la costa oeste de Chiapas (México) se desarrollan en Hibiscus pernambucensis Arruda, pero no así las de la costa este, cuya constitución genética sería diferente (Bodegas et al., 1977). Dichos autores han sugerido que el cambio de huéspedes de Gossypium a Hibiscus sería relativamente reciente. Asimismo se ha comprobado que bajo condiciones experimentales, las larvas de picudo se desarrollan en Hibiscus rosasinensis L., planta ornamental ampliamente extendida en el nordeste de la Argentina y algunas áreas urbanas y suburbanas de Brasil y Paraguay, alcanzando inclusive una mayor longevidad que en Gossypium hirsutum L. (Gabriel, 1999). De comprobarse esta asociación en la naturaleza, cabría inferir un cambio de huésped reciente, dado que la denominada rosa china es una especie introducida.
Por otra parte, cuando se analizan las posibilidades de que hayan ocurrido o puedan ocurrir cambios de huéspedes, o ampliaciones del rango de huéspedes, se debe tener en cuenta no sólo la constitución genética de las poblaciones de los fitófagos y las características físico-químicas de las plantas, sino además la disponibilidad y la abundancia de estas últimas en determinadas áreas (Lanteri et al., 2002b). Estudios recientes señalan que entre dos o más huéspedes con características similares, el fitófago elegirá aquél con un área de distribución más amplia y con mayor frecuencia de individuos (Fowler & Lawton., 1982; Bernays & Chapman, 1994; Schoonhoven et al., 1998; Becerra & Venable, 1999).
Otras investigaciones básicas y aplicadas necesarias para poder mantener las poblaciones de picudo por debajo del nivel de daño económico, se relacionan con el estudio de sus enemigos naturales, principalmente microhimenópteros parasitoides de larvas (Ramalho & Wanderley, 1995). El pteromálido Catolaccus grandis (Burks) es una de las 15 especies de esta familia de insectos, asociadas con el picudo del algodonero (Summy et al. 1995), que ha demostrado una notable eficacia de control, especialmente en áreas tropicales de México, América Central, Colombia y nordeste de Brasil (Morales–Ramos et al., 1995, 1996; García-Roa & Sánchez, 1996; Ramalho et al., 2000). Asimismo, la técnica de cría masiva de Catolaccus grandis, para realizar liberaciones inundativas, se ha desarrollado con éxito utilizando como huéspedes alternativos a otros coleópteros como el curculiónido Euscepes postfasciatus (Fairmaire) y/o el brúchido Acanthoscelides obtectus (Say) (García Roa & Sánchez, 1996; Ramalho et al. 2000).
El control biológico mediante el ectoparasitoide de larvas (tercer estadio) y pupas, Catolaccus grandis, y/u otros enemigos naturales, sería una estrategia conveniente para impedir el aumento de las densidades poblacionales del picudo en la Argentina. Ésta podría aplicarse tanto sobre linajes de picudo con características de colonizadores recientes, donde se podría intentar un enfoque clásico introduciendo el controlador biológico desde su lugar de origen, como en poblaciones supuestamente ancestrales, las cuales estarían naturalmente parasitoidizadas (por ejemplo ciertas poblaciones paraguayas, según Gallo et al., 1998). En este último caso habría que estudiar las causas por las cuales Anthonomus grandis escapó a los efectos del control ejercido por Catolaccus grandis (e.g. incremento de la actividad algodonera sin que mediaran prácticas culturales adecuadas, deforestación y aumento de áreas ocupadas por malváceas ruderales, selección de picudos resistentes a otros agentes de control, etc.).
La historia evolutiva del picudo del algodonero es antigua y compleja, y parece estar estrechamente relacionada tanto con la historia filogenética y de diversificación de sus huéspedes, como con el cultivo del algodón, desde la época de su incipiente domesticación en Mesoamérica. Su irrupción como plaga y su rápida dispersión sobre vastas áreas de América del Sur, es sin embargo un evento histórico reciente, cuyas causas deberían buscarse no sólo en la intensificación del intercambio comercial, sino también en los serios disturbios ambientales ocurridos a partir de la década del ochenta en la Argentina (Misiones), Paraguay y Brasil, en especial la intensa deforestación de bosques y selvas, y su reemplazo por cultivos de algodón (Scataglini et al., 2000). Una situación tan compleja debería abordarse sobre la base de sólidos conocimientos básicos y de una estrategia de control integrado que tome en cuenta toda la información disponible.
AGRADECIMIENTOS
A Lucía Claps por invitarnos a participar en este foro de la Revista de la SEA. A los técnicos y especialistas que nos enviaron material para estudios moleculares: Sandra Ronco (SENASA, Argentina); Teodoro Stadler (CONICET, Argentina); Walter G. dos Santos (IAPAR, Brasil); Víctor Gómez (IAN, Paraguay); Nina Bárcenas (IREGEP, México) y Horace Burke (Texas A. & M. University, USA). A la Ing. Sonia Suárez por su ayuda en la separación de muestras y en la obtención de bibliografía. A los especialistas en Anthonomini Horace Burke, Wayne Clark y Robert Jones, por su colaboración en varios aspectos de nuestro proyecto, y a los botánicos Antonio Krapovickas, Silvia Ferrucci y M. Mercedes Arbo, por enviarnos publicaciones de gran utilidad para nuestros trabajos. Al CONICET (PIP 4328/96), y al Common Fund for Commodities- International Council e International Cotton Advisory Committee (CFC-ICAC-04) a través del Proyecto de Manejo Integrado del Picudo del Algodonero en Argentina Brasil y Paraguay, por financiar la primera parte de nuestras investigaciones. A la Fundación Antorchas, que por medio de un subsidio de emergencia nos brindó un apoyo fundamental para proseguir nuestros estudios moleculares a partir del año 2001.
BIBLIOGRAFÍA CITADA
1. AB'SÁBER, A. N. 1977. Espaços ocupados pela expansão dos climas secos na America do Sul, por ocasião dos períodos glaciais Quaternários. Paleoclimas, Univ. São Paulo, Inst. de Geografía 3: 1-19. [ Links ]
2. ANDERSON, R. S. 1993. Weevil and plants: Phylogenetic versus ecological mediation of evolution of host plant associations in Curculioninae (Coleoptera: Curculionidae). Mem. Entomol. Soc. Can. 165: 197-232. [ Links ]
3. AXELROD, D. I. 1958. Evolution of the Madro-Tertiary flora. Bot. Rev. 24: 433- 509. [ Links ]
4. AVISE, J. C. 2000. Phylogeography: The history and formation of species. Harvard Univ. Press, Cambridge, MA. [ Links ]
5. AVISE, J. C. & D. WALKER. 1998. Pleistocene phylogeographic effects on avian populations and the speciation process. Proc. Roy. Soc. Lond. B 265: 457- 463. [ Links ]
6. BARTLETT, A. C., W. C. RANDALL & J. E. MAY. 1983. Allozyme variation among populations of boll weevils in Arizona and Mexico. Southwest. Entomol. 8: 118-130. [ Links ]
7. BECERRA, J. K. & L. VENABLE. 1999. Macroevolution of insect-plant associations. The relevance of host biogeography to host association. Proc. Nat. Acad. Sci., USA 96: 12626- 12631. [ Links ]
8. BERNAYS, E. A. & R. F. CHAPMAN. 1994. Host-plant selection by Phytophagous Insects. Chapman and Hall, New York. [ Links ]
9. BODEGAS, V. P. R., G. R. FLORES & M. E. DE COSS FLORES. 1977. Aspectos de interés sobre las hospederas alternantes del picudo del algodonero A. grandis y avances en la investigación respectiva en el Soconusco, Chiapas, México. Cent. Invest. Ecol. Sureste, Bol. 3. [ Links ]
10. BURKE, H. R. 1968. Geographic variation and taxonomy of Anthonomus grandis Boheman. Dept. Entomol. Texas A. & M. Univ., USA. [ Links ]
11. BURKE, H. R. 1976. Bionomics of the anthonomine weevils. Annu. Rev. Entomol. 21: 283-303. [ Links ]
12. BURKE, H. R. & W. E. CLARK. 1976. Cienfuegosia drummondii as a host of the boll weevil, Anthonomus grandis Boheman, in south Texas. Proceedings, Boll Weevil Suppression, Management and Elimination Technology, pp.13-15. [ Links ]
13. BURKE, H. R., W. E. CLARK, J. R. CATE & P. A. FRYXELL. 1986. Origin and dispersal of the boll weevil. Bull. Entomol. Soc. Am. 32: 228-238. [ Links ]
14. CABRERA, A. L. & A. WILLINK. 1980. Biogeografía de América Latina. 2nd. ed. Serie de Biología. Sec. Gral. OEA, Washington, D. C. [ Links ]
15. CARNEVALI, R. 1970. Variación geográfica y origen de Gossypium barbadense en Argentina. Bol. Soc. Argent. Bot. 11 (supl.): 277-285. [ Links ]
1 6. CLARK, W. E. 1988. Revision of the weevil genus Loncophorus Chevrolat (Coleoptera: Curculionidae, Anthonominae). Quaest. Entomol. 24: 465- 520. [ Links ]
17. CLARK, W. E. 1995. A new species of Loncophorus from Mexico (Coleoptera: Curculionidae: Anthonomini) associated with Mortoniodendron (Malvales: Tiliaceae). An. Inst. Biol. UNAM, Serie Zool. 66: 107- 112. [ Links ]
18. CONFALONIERI, V. A., A. S. SEQUEIRA, L. TODARO & J. C. VILARDI. 1998. Mitochondrial DNA phylogeography of the grasshopper Trimerotropis pallidipennis in relation to clinal distribution of chromosome polymorphisms. Heredity 81: 444- 452. [ Links ]
19. CONFALONIERI, V. A., M. A. SCATAGLINI & M. J. REMIS. 2002. Sequence differentiantion among inversion rearrangements are revealed by RAPD markers in the grasshopper Trimerotropis pallidipennis (Orthoptera). Ann. Entomol. Soc. Am. 95 (2):201-207. [ Links ]
20. CONFALONIERI, V. A., M. A. SCATAGLINI & A. A. LANTERI. 2003(2001). Origen de las poblaciones del picudo del algodonero en Argentina, Brasil y Paraguay: una hipótesis basada en el estudio de genes mitocondriales. Proceedings Cotton in the Southern Cone. Project Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay. CFC/ICAC/04. Final Workshop Part I: 29-39. [ Links ]
21. CROIZAT, L., G. NELSON & D. E. ROSEN. 1974. Centers of origin and related concepts. Syst. Zool. 23: 265-287. [ Links ]
22. CROSS, W. H., M. J. LUKEFAHR, P. A. FRYXELL & H. R. BURKE. 1975. Host plants of the boll weevil. Environ. Entomol. 4: 19-26. [ Links ]
23. DEL RÍO, G. & A. A. LANTERI. 2003. Caracterización morfológica y análisis multivariado de las poblaciones argentinas del picudo del algodonero, Anthonomus grandis (Coleoptera: Curculionidae). XI Jornadas de Jóvenes Investigadores de AUGM. Septiembre de 2003. [ Links ]
24. DONN, W. L., W. R. FARRAND & M. EWING. 1962. Pleistocene ice volumes and sea-level lowering. Jour. Geol. 63: 538- 578. [ Links ]
25. FALCON, L. A., A. P. GUETIÉRREZ & D. MUELLER-BELLSCHMIDT. 1986. Exotic pest profile-boll weevil. Dept. Entomol. Science, Univ. of California, Berkeley, CA, 91 pp. [ Links ]
26. FOWLER, S. V. & J. H LAWTON. 1982. The effects of host-plant distribution and local abundance on the species richness of agromyzid flies attacking British umbellifers. Ecol. Entomol. 7: 257-265. [ Links ]
27. FRYXELL, P. A. 1965. Stages in the evolution of Gossypium L. Adv. Front. Plant. Sci. 10: 31-56. [ Links ]
28. FRYXELL, P. A. 1979. The natural history of the cotton tribe (Malvaceae, tribe Gossypieae). Texas A&M Univ., College Station and London. [ Links ]
29. FRYXELL, P. A. & M. J. LUKEFAHR. 1967. Hampea Schlecht: possible primary host of the cotton boll weevil. Science 155: 1568-1569. [ Links ]
30. GABRIEL, D. 1999. Biología del picudo del algodonero Anthonomus grandis Boh. 1843, en hospederas alternantes a través de la oviposición artificial. Actas del III Seminario Internacional del Proyecto: Manejo Integrado del Picudo del Algodonero en Argentina, Brasil y Paraguay. Pp. 57- 62. [ Links ]
31. GALLO, I., M. SANABRIA, B. GIMÉNEZ, Y. FRANCO, A. BENÍTEZ, S. NÚÑEZ & O. SOLÍS. 1998. Parasitismo, un factor clave de mortalidad en el picudo mexicano Anthonomus grandis Boh., en Paraguay. Actas del II Seminario Internacional del Proyecto: Manejo Integrado del Picudo del Algodonero en Argentina, Brasil y Paraguay. Pp. 42-44. [ Links ]
32. GARCÍA ROA, F. & M. SÁNCHEZ. 1996. Cría masiva de Catolaccus grandis, parasitoide del picudo del algodón. Actas del I Seminario Internacional del Proyecto: Manejo Integrado del Picudo del Algodonero en Argentina, Brasil y Paraguay. Pág. 149. [ Links ]
33. GUTIÉRREZ, M, A. A. RICCIARDI, J. VRDOLJAK, A. C. A. GALVÁN & R. CARNEVALI. 1960. Algodones barbadenses indígenas de la Argentina. Recolección de material y formación de una colección. Bol N° 8, INTA, Centro Regional Chaqueño, Argentina, pp. 1-50. [ Links ]
34. GUZMÁN, N., V. LIA, A. LANTERI & V. CONFLAONIERI. 2003. Divergencia genética y flujo génico entre poblaciones del picudo del algodonero coleccionadas sobre plantas nativas y sobre cultivos de algodón. XXXII Congreso de la Sociedad Argentina de Genética. Septiembre de 2003. [ Links ]
35. HUTCHINSON, J. B., R. A. SILOW & S. G. STEPHENS. 1947. The evolution of Gossypium. Oxford Univ. Press, London, U.K. [ Links ]
36. JONES, R. W. 2001. Evolution of the host plant associations of the Anthonomus grandis species group (Coleoptera: Curculionidae): Phylogenetic test of various hypothesis. Ann. Entomol. Soc. Am. 94(1): 51- 58. [ Links ]
37. JONES, R. W. & H. R. BURKE. 1997. New species and host plants of the Anthonomus grandis species group (Coleoptera: Curculionidae). Proc. Entomol. Soc. Wash. 99(4): 705-719. [ Links ]
38. JONES, R. W., P. A. FRYXELL & D. M. BARO. 1997. Phylogenetic analysis of the genus Hampea (Malvales: Malvaceae: Gossypiae). An. Inst. Biol. UNAM, ser. Bot. 68(1): 21-42. [ Links ]
39. KRAPOVICKAS, A. 1999. El género Cienfuegosia y el picudo del algodonero al sur del trópico, en Sudamérica. III International Workshop on Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay, Workshop Proceedings p. 43. [ Links ]
40. LANTERI, A. A. 1999. Aplicación de técnicas moleculares en estudios poblacionales y filogenéticos en Curculionidae. Rev. Soc. Entomol. Argent. 58(1-2): 161-168. [ Links ]
41. LANTERI, A. A., M. A. SCATAGLINI & V. A. CONFALONIERI. 2000. Caracterización de las poblaciones de Anthonomus grandis en Argentina, Brasil y Paraguay, mediante la técnica de RAPD's. III Seminario Internacional del Proyecto de Manejo Integrado del Picudo del algodonero en Argentina, Brasil y Paraguay. Actas: 33-40. [ Links ]
42. LANTERI, A. A. & V. A. CONFALONIERI. 2003. Filogeografía: objetivos, métodos y ejemplos. Pp 185-193. En: J. Llorente Bousquets & J. J. Morrone (eds.) Una perspectiva latinoamericana de la Biogeografía. Facultad de Ciencias, UNAM, México. [ Links ]
43. LANTERI, A. A., M. S. LOIÁCONO & A. E. MARVALDI. 2002A. Anthonomus (Coleoptera: Curculionidae) asociados con el algodonero en la Argentina. Rev. Soc. Entomol. Argent. 61(3-4): 24-26. [ Links ]
44. LANTERI, A. A., A. MARVALDI & S. SUÁREZ. 2002b. Gorgojos de la Argentina y sus plantas huéspedes. Tomo I: Apionidae y Curculionidae. Publ. Especial SEA 1: 1-96. [ Links ]
45. LIA, V. V., V. A. CONFALONIERI, C. I. COMAS & J. H. HUNZIKER. 2001. Molecular phylogeny of Larrea and its allies (Zygophyllaceae): Reticulate evolution and the probable time of Creosote Bush arrival to North America. Mol. Phyl. Evol. 21(2): 309-320. [ Links ]
46. LOIÁCONO, M. S., C. MARGARÍA, M. I. BARRIOS, F. MOSCHIONE & A. A. LANTERI. 2003(2001). Implicancias del hallazgo de una especie de Anthonomini en Malváceas de la provincia de Misiones, Argentina. Proceedings Cotton in the Southern Cone. Project Integrated Pest Management of the Cotton Boll Weevil in Argentina, Brazil and Paraguay. CFC/ICAC/04. Final Workshop Part I: 87-99. [ Links ]
47. MANESSI, O. G. 1997. Anthonomus grandis Boh. El picudo del algodonero La super plaga. FULCPA, Buenos Aires. [ Links ]
48. MACNEISH. R. S. 1964. The food gathering and incipient agriculture stage of prehistoric Middle America. Pp. 413-426. En: R. C. West (ed.). Handbook of Middle American Indian, vol. 1, Univ. of Texas, Austin. [ Links ]
49. MORALES-RAMOS, J. A., K. R. SUMMY & E. G. KING. 1995. Estimating parasitism by Catolaccus grandis (Hymenoptera: Pteromalidae) after inandative releases against the boll weevil (Coleoptera: Curculionidae). Environ. Entomol. 24(6): 1718- 1725. [ Links ]
50. MORALES-RAMOS, J. A., S. M. GREENBERG & E. C. KING. 1996. Selection of optimal physical conditions for mass propagation of Catolaccus grandis (Hymenoptera: Pteromalidae) aided by regression. Biol. Control 25(1): 165-173. [ Links ]
51. MORRONE, J. J. 2000. What is the Chacoan subregion?. Neotropica 45: 51-68. [ Links ]
52. MORRONE, J. J. 2001. The Parana subregion and its provinces. Physis (Buenos Aires) 58(134-135): 1-7. [ Links ]
53. MORRONE, J. J. 2002. El espectro del dispersalismo: de los centros de origen a las áreas ancestrales. Rev. Soc. Entomol. Argent. 61 (3-4): 1-14. [ Links ]
54. NELSON, G. & N. I. PLATNICK. 1981. Systematics and biogeography: cladistics and vicariance. Columbia University Press, New York. [ Links ]
55. PHILLIPS, G. F. 1963. The cytogenetics of Gossypium and the origin of New World cottons. Evolution 17: 460- 469. [ Links ]
56. PRADO, D. E. & P. E. GIBBS. 1993. Patterns of species distributions in the dry seasonal forests of South America. Ann. Miss. Bot. Garden 80(4): 903-927. [ Links ]
57. RAMALHO, F. S. & P. A. WANDERLEY. 1995. Ecology and management of the boll-weevil in South American cotton. Am. Entomol. 42(1): 41-47. [ Links ]
58. RAMALHO, F. S., J. M. DIAS, R. S. MEDEIROS, W. P. LEMOS, F. F. TEREIRA & J. C. ZANUNCIO. 2000. Criação de Catolaccus grandis (Burks) ectoparasitoide do bicudo-do-algodoeiro, tendo como hospedeiro larvas de Euscepes postfasciatus (Fairmaire). Actas del III Seminario Internacional del Proyecto: Manejo Integrado del Picudo del Algodonero en Argentina, Brasil y Paraguay. Pp. 123-125. [ Links ]
59. RAVEN, P. H. 1963. Amphitropical relationships in the floras of North and South America. Quatern. Rev. Biol. 38: 151-177. [ Links ]
60. RAVEN, P. H. & D. I. Axelrod. 1975. History of the flora and fauna of Latin America. Am. Scient. 63(4): 420-429. [ Links ]
61. ROEHRDANZ, R. L. 2001. Genetic differentiation of Southeastern boll weevil and Thurberia weevil populations of Anthonomus grandis (Coleoptera: Curculionidae) using mitochondrial DNA. Ann. Entomol. Soc. Am. 94(6): 928-935. [ Links ]
62. ROEHRDANZ, R. L. & D. T. NORTH. 1992. Mitochondrial DNA restriction fragments variation and biosystematics of the boll weevil, Anthonomus grandis. Southwest. Entomol. 17(2): 101-108. [ Links ]
63. ROSEN, D. E. 1976. A vicariance model of Caribbean biogeography. Syst. Zool. 24: 431-464. [ Links ]
64. SCATAGLINI, M. A., V. A. CONFALONIERI & A. A. LANTERI. 2000. Dispersal of the cotton boll weevil in South America: evidence of the RAPD's analysis. Genetica 108: 127-136. [ Links ]
65. SCATAGLINI, M. A., A. A. LANTERI & V. A. CONFALONIERI. Inéd. The boll weevil in South America: recent invader or ancient inhabitant?. [ Links ]
66. SCHOONHOVEN, L., T. JERMY & J. J. A. VAN LOON. 1998. Insect-plant biology. Chapman and Hall, London. [ Links ]
67. SIMPSON VUILLEUMIER, B. 1971. Pleistocene changes in the fauna and flora of South America. Science 173: 771-780. [ Links ]
68. SMALL, R. L. & J. F. WENDEL. 2000. Phylogeny, duplication and intraspecific variation of Adh sequences in New World diploid cottons (Gossypium L., Malvaceae). Mol. Phyl. Evol. 16(1): 73- 84. [ Links ]
69. SUMMY, K. R., J. A. MORALES-RAMOS & E. G. KING. 1995. Suppression of boll weevil (Coleoptera: Curculionidae) infestations on South Texas cotton by augmentative releases of the parasite Catolaccus grandis (Hymenoptera: Pteromalidae). Biol. Control 5: 523-529. [ Links ]
70. SZUMKOWSKI, W. 1952. El algodón de sabana, Cienfuegosia affinis (H. B. K) Hochr., huésped del picudo del algodón, Anthonomus grandis Boh. en Venezuela. Agron. Trop. 1: 279-286. [ Links ]
71. WENDEL, J. F. & R. C. CRONN. 2002. Polyploidy and the evolutionary history of cotton. Adv. Agron. 87:139-186. [ Links ]
72. WENDEL, J. F. A. SCHNABEL & T. SEELANAN. 1995. An unusual ribosomal DNA sequence from Gossypium gossypioides reveals ancient, cryptic, intergenomic introgression. Mol. Phyl. Evol. 4: 298- 313. [ Links ]
73. ZHAO, X. P., Y. SI, R. E. HANSON, C. F. CRANE, H. J. PRICE, D. M. STELLY, J. F. WENDEL & A. H. PATTERSON. 1998. Dispersal repetitions DNA has colonized new genomes since polyploid formation in cotton. Genome Res. 8: 479- 492. [ Links ]
Recibido: 1-IX-2003
Aceptado: 16-IX-2003














