Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. v.64 n.3 San Miguel de Tucumán ago./dic. 2005
Análisis morfológico del sistema reproductor femenino de Baeacris punctulatus (Orthoptera: Acrididae: Melanoplinae)
Morphological analysis of the female reproductive system in Baeacris punctulatus (Orthoptera, Acrididae, Melanoplinae)
Michel, Adriana A. y Héctor R. Terán
Instituto de Morfología Animal, Fundación Miguel Lillo, Miguel Lillo 251. 4000 San Miguel de Tucumán, Argentina; e-mail: fmlzoo@tucbbs.com.ar
ABSTRACT. Baeacris punctulatus (Thunberg) is an economical important species widely distributed in Southamerica. In the present contribution an anatomical-histological study of the internal reproductive organs from females collected in the wild and also laboratory raid was carried out. The present study allowed us to determine histomorphologic particularities in the ovaries, accessory glands, lateral oviducts and medial oviduct related with gamete genesis and transference and oviposition. The spermathecal organ is characterized by its external morphology and histology of its regions and compare to closely related species. The type of spermatheca observed in Baeacris punctulatus is not included in the current classification of Orthoptera. The morphology of the genital chamber and regions used in breeding, oviposition and fecundation of oocytes are described and characterized by its histology. New data to contribute to the understanding of reproductive biology and systematic position of the Acrididae is provided.
Key wordS. Orthoptera. Acrididae. Reproductive. Anatomy. Histology.
RESUMEN. Baeacris punctulatus (Thunberg) es una especie de importancia económica, de amplia distribución en Sudamérica. En el presente trabajo se realiza un estudio anatomo-histológico de los órganos reproductivos internos, en hembras silvestres y obtenidas en cámara de cría. El estudio permitió determinar particularidades histomorfológicas, en ovarios, glándulas accesorias, oviductos laterales y oviducto medio, relacionadas con la génesis y transferencia de las gametas y la ovoposición. Se caracteriza la espermateca por la morfología externa y la histología de sus regiones, se compara con especies emparentadas. El tipo de espermateca observada en B. punctulatus no se incluye en las clasificaciones de esta estructura realizadas para Orthoptera. Se describe la morfología de la cámara genital, se definen por sus características anatomo-histológicas las regiones destinadas a la cópula y ovoposición y a la fecundación del ovocito. Se aportan datos para la comprensión integral del sistema biológico reproductivo y el análisis sistemático de los Acrididae.
Palabras clave. Orthoptera. Acrididae. Reproductor. Anatomía. Histología.
Introducción
Los órganos reproductivos de Acrididae fueron estudiados principalmente en especies de langostas y tucuras de importancia económica para diferentes regiones de EEUU, Canadá, sudeste de Siberia y Rusia, India, China, África y Australia (Nelsen, 1931 y 1934; Albrecht & Verdier, 1956; Dirsh, 1957; Singh, 1958; Phipps 1959; Shulov & Pener, 1959; Mathur, 1960; Uvarov, 1966; Gallois, 1979a y b; Szollosi & Marcaillou, 1979; Wagan, 1980; Sahai, 1984; Sahai & Banerjee, 1987; Sathe & Joshi, 1988; Saxena et al., 1988; Longo et al., 1993).
La subfamilia Melanoplinae incluye los géneros de mayor diversidad y distribución geográfica de la acridiofauna Sudamericana, con numerosas especies de importancia económica. Constituyen la tercera parte del total de acridoideos conocidos para la Argentina, incluyendo a varias especies causantes de considerables pérdidas para la producción agrícola-ganadera (Liebermann & Schiuma, 1946; Carbonell & Ronderos, 1973; Barrera & Paganini, 1975; Turk & Barrera, 1979; Ronderos, 1985; Lange, 1986; Bentos Pereira, 1989; Lange, 1992; Cigliano et al., 1995; de Wysiecki et al., 1997; Cigliano & Lange, 1998; Lange & Wittenstein, 1998; Sánchez et al., 2001; Lange, 2002 y 2003; Michel, Inéd.; Michel & Terán, 2005).
Los estudios sobre reproducción y desarrollo en especies de acrididos de importancia económica para Sudamérica y en especial para la Argentina son escaso (Zapata & Diaz, 1979; Sisler, 1981; Michel & Teisaire, 1996; Michel, Inéd.; Michel & Terán, en prensa -a-).
Las características morfológicas de los órganos reproductivos de la hembra, al igual que en el macho, varían con la especie. Los ovarios, las glándulas accesorias, la espermateca y la cámara genital, cumplen una importante función en la génesis, transferencia y fecundación interna de las gametas femeninas, por lo que su estudio representa un aporte al conocimiento de la reproducción de estos insectos. Así mismo, el número de ovariolas en insectos es variable y muestra diferencias interespecíficas, un incremento en el número de ovariolas está relacionado con el incremento en el potencial reproductivo de un individuo. La estructura de la espermateca aporta datos para el análisis sistemático de las familias de acridoideos (Phipps, 1949 y 1959; Albrecht & Verdier, 1956; Dirsh, 1957; Uvarov, 1966; Liebermann, 1966; Matsuda, 1975; Zapata & Diaz, 1979; Daly et al., 1998; Wagan, 1980; Sathe & Joshi, 1988; Kristensen, 1991; Martins & Serrào, 2004).
Baeacris punctulatus (Thunberg) es la especie de mayor distribución geográfica dentro del género, considerada plaga agrícola para la Argentina. Estudios realizados en nuestro país indican que esta especie junto con Dichroplus pratensis Bruner y Dichroplus elongatus Giglio-Tos, son las especies de Melanoplinae de mayor suceptibilidad a agentes de control biológico, siendo substrato adecuado para el desarrollo de Nosema locustae. En B. punctulatus como en Ronderosia bergi (Stal), especies con posibilidad de desarrollo continuo, la hembra presenta mayor susceptibilidad a la esporulación de microsporidios del cuerpo graso; el volumen de este órgano está directamente relacionado con el estado reproductivo (Ronderos & Cigliano, 1991; Lange, 2002 y 2003).
El objetivo de este trabajo es determinar, mediante un estudio anatomo-histológico, las características morfológicas de los órganos reproductivos internos de la hembra de B. punctulatus. Los resultados obtenidos se correlacionarán con los estudios realizados para el macho, con el fin de aportar datos a la comprensión integral del sistema biológico reproductivo de la especie y a la taxonomía del género.
Material y métodos
Se realizaron disecciones anatómicas bajo microscopía esteroscópica simple con solución fisiológica para ortópteros (isotónica) de Meisenheimer (Baldeig, 1975) en ejemplares obtenidos de dos bioterios: 1.- Hembras adultas silvestres capturadas con redes entomológicas en áreas destinadas al pastoreo y banquinas del km 28 y 29 de la ruta provincial nro. 380 a San Javier (Tucumán) y mantenidos en el laboratorio a temperatura ambiente. 2.- Hembras vírgenes, sexualmente maduras y en cópula nacidos en cámara de cría, con un ambiente regulado a 30°C ± 1, entre el 50 y el 70% de HR y un fotoperíodo de 14 horas luz y 10 de oscuridad. La alimentación en ambos bioterios se realizó con hojas frescas de Taraxacum officinale (Michel, Inéd.; Michel & Terán, 2005). Se realizaron esquemas con cámara clara del sistema reproductor completo y esquemas y fotografías de las diferentes regiones del mismo.
El estudio anatómico se complementó con el análisis de la estructura bajo microscopía óptica. Para tal fin los ejemplares se fijaron en Boüin (solución acuosa saturada de ácido pícrico, formol puro y ácido acético 70ml: 25ml: 5ml) durante 24 horas. Se deshidrató en una batería ascendente de etanol y se conservó en alcohol n-Butílico con el fin de ablandar la cutícula y facilitar el seccionamiento del material. Se incluyó en paraplast y se realizaron cortes seriados de 6 mm de espesor con orientación sagital. Se coloreó con Hematoxilina de Erlich-Eosina (H-E) (Geurr, 1956 citado por Humason, 1979) y Tricrómico de Mallory (Azan) Heidenhain (M.A.) (modificado por Konef, 1938 citado por Humason, 1979). Se tomaron fotomicrografías de las diferentes regiones analizadas. Los ejemplares de referencia se encuentran depositado en la Colección Entomológica del Instituto-Fundación Miguel Lillo (IFML), Tucumán, Argentina.
Resultados
El sistema reproductor femenino de B. punctulatus está constituido por un par de ovarios en posición dorsal al tubo digestivo, que abarcan desde el 2° al 4° segmento abdominal. Cada ovario está formado por 10 ovariolas alargadas y dispuestas en forma paralela, cinco dorsales y cinco ventrales, ligeramente curvadas siguiendo la pared lateral del cuerpo. El número de ovariolas en esta especie es igual y constante para ambos ovarios, tanto en hembras silvestres como en las obtenidas en cautiverio en condiciones óptimas para su desarrollo (Figs. 1 y 2). Los ovarios están rodeados por abundante tejido conectivo, con un importante desarrollo del cuerpo graso en el extremo proximal de las ovariolas. En hembras adultas el volumen de este tejido aumenta progresivamente con el proceso de vitelogénesis en ovocitos del folículo basal.
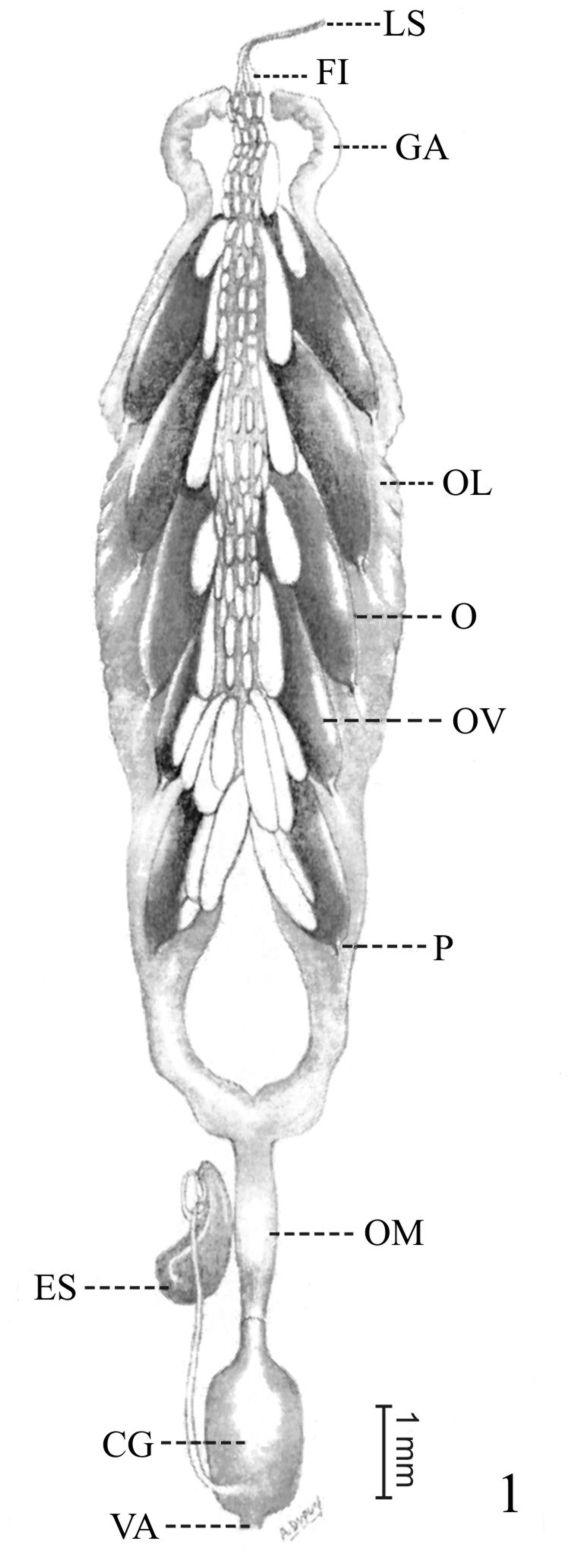
Fig. 1. Sistema reproductor interno de la hembra de B. punctulatus . (LS: ligamento suspensorio; FI: filamento terminal; GA: glándula accesoria; OL: oviducto lateral; O: ovario; OV: ovariola; P: pedicelo; OM: oviducto medio; ES: espermateca; CG: cámara genital; VA: vagina).

Fig. 2. Vista dorsal de la masa ovárica. (GA: glándula accesoria; O: ovario; OV: ovariola; OL: oviductos laterales. Escala: 1cm = 1,21 mm).
Las ovariolas son de tipo panoísticas, carecen de células nutricias especiales (trofocitos) y el epitelio folicular es el único tejido trófico presente. Cada ovariola, limitada por una vaina externa de células epiteliales planas, presenta tres regiones: 1.- el filamento terminal, es un delgado cordón celular en el extremo distal de la ovariola. Los filamentos de un mismo ovario se unen formando el ligamento suspensorio que se fija a la pared del cuerpo a través del diafragma dorsal; 2.- el tubo de huevo, en el cual las células germinales se disponen linealmente, con ovocitos pequeños de color blanquecinas en la región media y ovocitos grandes de color amarronados en el extremo proximal; 3.- el pedicelo en la región proximal, es un conducto corto y delgado que desemboca en el oviducto lateral respectivo (Fig. 3).

Fig. 3. Ovariola panoística de B. punctulatus . (FI: filamento terminal; G: germario; VT: vitelario; P: pedicelo).
En el tubo de huevo se observan dos regiones, el germario en el extremo distal, con ovogonias y ovocitos en las primeras etapas de la profase I de la meiosis, dispuestos en forma irregular y rodeados por tejido prefolicular y el vitelario en la región media y proximal, con ovocitos en las diferentes etapas de previtelogénesis y vitelogénesis, dispuestos linealmente y rodeados por una capa continua de células foliculares. En esta especie la túnica propia o lámina basal del epitelio folicular, se observa solo en la región del vitelario, con un mayor espesor en el folículo basal de la ovariola (Michel, Inéd.) (Figs. 11 y 12).
En B. punctulatus puede verse un par de glándulas accesorias, que son conductos delgados de paredes lisas con recorrido tortuoso ubicados en el extremo distal de los oviductos laterales, abarcando desde el 2° segmento abdominal al extremo posterior del 3° segmento torácico. Estas glándulas son tubulares simples y están constituidas por un epitelio secretor ligeramente plegado, con células cilíndricas bajas de secreción continua. La secreción se acumula en la luz glandular en forma de pequeñas vesículas fuertemente acidófilas y se utiliza en la ovoposición. Externamente a la lámina basal del epitelio glandular se observa una delgada capa muscular con fibras de disposición longitudinal. (Figs. 4; 13).

Fig. 4. Vista lateral del ovario y la región distal del oviducto lateral. (O: ovario; V: vitelo; CO: corion; OL: oviducto lateral; GA: glándula accesoria. Escala: 1cm = 1,95mm.).
Los oviductos laterales son conductos de gran calibre y paredes plegadas, con una región distal y media que abarcan desde el 2° al 4° segmento abdominal y una región proximal de menor diámetro, que desciende en forma oblicua hacia la pared ventral del abdomen para unirse, a nivel del 7° esternito abdominal con el extremo distal del oviducto medio (Figs. 4 y 5).

Fig. 5. Vista ventral de la región posterior del sistema reproductor femenino. (OL: oviducto lateral, OM: oviducto medio; CG: cámara genital; VV: valvas ventrales del ovopositor. Escala: 1cm = 3,5 mm).
Las paredes de los oviductos laterales están constituidas por un epitelio simple secretor que forma grandes pliegues en la región distal y media, con células de secreción continua acidófila, que se localizan en la base de los pliegues y células de secreción continua basófila, en la región apical de los mismos. El plegamiento y la actividad secretora del epitelio disminuye hacia la región proximal de estos conductos, donde las células son de menor espesor y sintetizan escasa secreción acidófila. Externamente a la lámina basal del epitelio se observa una delgada capa de tejido conectivo denso que penetra en el interior de los pliegues y por fuera de ésta una delgada capa muscular constituida por una capa interna con fibras de disposición circular que penetra en el interior de los pliegues epiteliales y una externa con fibras de disposición longitudinal que lo separa del tejido conectivo circundante. La capa muscular aumenta de espesor en la región proximal del conducto (Figs. 14 y 15).
En los oviductos laterales la secreción acidófila modifica la estructura del corion del ovocito, mientras que la secreción basófila y la capa muscular facilitan su desplazamiento a través de la luz de estos conductos (Michel, Inéd.).
El oviducto medio es un conducto de paredes gruesas y luz estrecha, que corre paralelo a la línea media ventral del 8° esternito abdominal y desemboca ventralmente en la cámara genital de la hembra, a través de un conducto delgado y corto cuyo orificio en el extremo distal corresponde al gonoporo. Las paredes del oviducto medio están constituidas por un epitelio cúbico simple, que forma pliegues paralelos a la luz del conducto, revestida por una delgada epicutícula. Externamente al epitelio se observa una delgada capa de tejido conectivo y una gruesa capa muscular con fibras de disposición longitudinal. Los pliegues del tejido epitelial y la gruesa capa muscular, cumplen una importante función en el desplazamiento del ovocito a través de la luz del conducto y en su ingreso a la cámara genital (Figs. 5 y 15).
Baeacris punctulatus presenta una espermateca que desemboca dorsalmente en la cámara genital y está constituida por dos regiones: el conducto y el divertículo. El conducto espermatecal es largo, delgado y dilatado en su extremo proximal, desemboca dorsal y posteriormente en la cámara genital, continua con un recorrido rectilíneo hasta el extremo anterior del 8° segmento abdominal, se pliega formando un rulo y se curva en sentido posterior uniéndose al divertículo. Está región está formada por un epitelio simple con células cilíndricas bajas entre las que se identifican dos tipos: 1.- células de secreción continua acidófila que forman la delgada epicutícula que reviste la luz del conducto y 2.- células de secreción continua levemente basófila que se acumula en la luz del conducto facilitando el desplazamiento de los espermatozoides a través del mismo. Externamente al epitelio se observa una delgada capa muscular con una hilera de fibras de disposición circular (Figs. 6; 7; 8; 16 y 18).
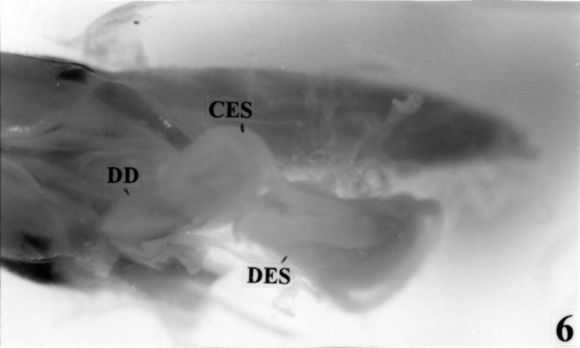
Fig. 6. Vista lateral de la espermateca y la dilatación dorsal de la cámara genital. (CES: conducto espermatecal; DES: divertículo espermatacal; DD: dilatación dorsal de la cámara genital. Escala: 1cm = 4,56 mm).
El divertículo espermatecal es una glándula tubular plegada en forma de una U acostada con dos grandes ramas paralelas y juntas, la rama dorsal es de mayor diámetro y termina en un fondo ciego. La pared del divertículo está constituida por un epitelio simple con células cilíndricas altas, con dos tipos de células secretoras: 1.- células de secreción continua acidófila que sintetizan la gruesa cutícula depositada sobre la membrana apical del epitelio y 2.- células de secreción discontinua que producen una secreción acidófila que se vierte a través de perforaciones de la cutícula hacia la luz del divertículo y cumple una importante función en el mantenimiento y capacitación de los espermatozoides almacenados en la luz del divertículo, desde la cópula hasta la fecundación de los ovocitos maduros. Externamente al epitelio se observa una delgada capa muscular con dos hileras de fibras de disposición longitudinal y por fuera de ésta se observa abundante tejido conectivo laxo con células adiposas (Figs. 7; 8 y 16).

Fig. 7. Espermateca de B. punctulatus . DES: divertículo espermatecal; CES: conducto espermatecal.
En B. punctulatus la cámara genital, ubicada ventralmente en la cavidad del 9° segmento abdominal, está formada por dos regiones: 1.- la región ventral que es un conducto de paredes delgadas y color blanquecino, con una zona anterior que termina en un fondo ciego con un importante apodema donde se insertan grandes haces musculares que intervienen en la ovoposición y una zona posterior o vagina que desemboca entre las valvas ventrales del ovopositor a través de la vulva o abertura genital de la hembra a través de la cual se realiza la cópula y ovoposición; 2.- la región dorsal que es una dilatación ligeramente amarronada, en cuya pared dorsal y posterior desemboca la espermateca. En esta región se produce la fecundación de los ovocitos que descienden del oviducto medio a través del gonoporo. El plegamiento de las paredes laterales y dorsal de esta región permite el aumento de su luz facilitando el ingreso del ovocito. La cámara genital está revestida interiormente por la hipodermis y una cutícula fuertemente acidófila de mayor espesor en la pared dorsal de la misma (Figs. 1;17 y 18).
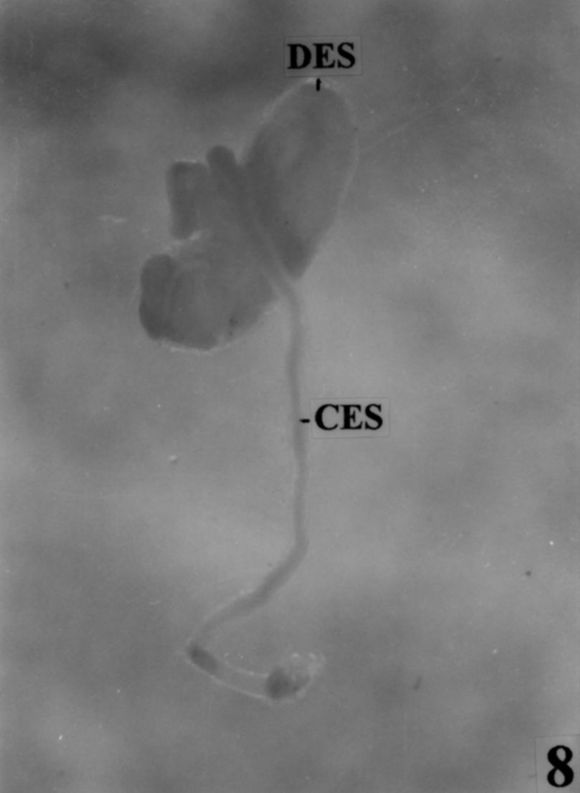
Fig. 8. Espermateca de B. punctulatus . (DES: divertículo espermatecal; CES: conducto espermatecal. Escala: 1cm = 4,85mm).
Entre las pleuras del 7° y 8° segmento abdominal se observan dos grandes masas musculares, que rodean los órganos reproductores internos e intervienen en la ovoposición. Estas masas musculares se insertan en grandes apodemas formados a partir de engrosamientos cuticulares de la invaginación ectodérmica media del extremo posterior del abdomen, limitada por las valvas dorsales, internas y ventrales del ovopositor, que corresponde a la falsa abertura genital de la hembra (Figs. 9; 10; 17 y 18).
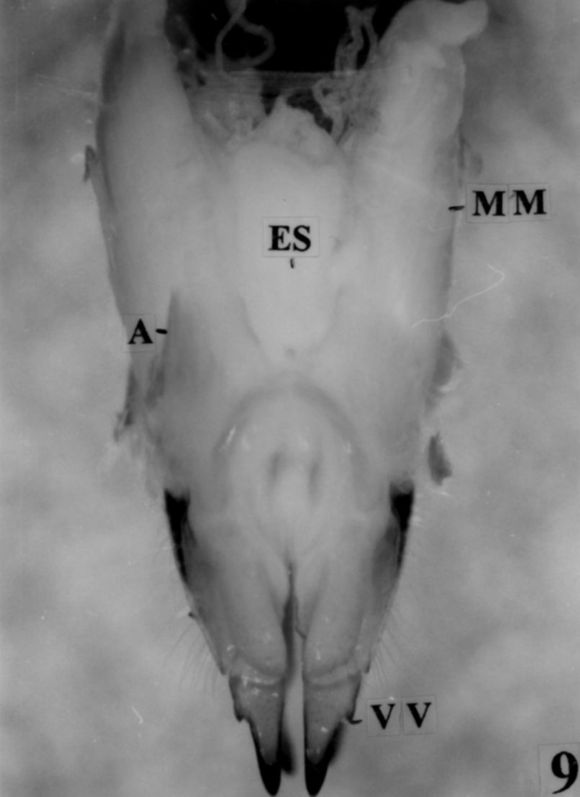
Fig. 9. Vista ventral de las masas musculares que protegen los órganos reproductivos internos de la hembra. (MM: masas musculares; ES: espermateca; A: apodemas; VV: valvas ventrales del ovopositor. Escala: 1cm = 2,46 mm).

Fig. 10. Vista lateral del ovopositor. (VD: valvas dorsales; VI: valvas internas; VV: valvas ventrales; PS: placa subgenital. Escala: 1cm = 2,77mm).
Discusión y Conclusiones
En Orthoptera hay grandes diferencias específicas en el número de ovariolas y folículos testiculares, lo cual no solo se da dentro de un mismo género sino también en individuos de una misma especie y entre ovarios o testículos de un mismo individuo. Esta variación está relacionada, con cambios estacionales que afectan al microclima y la alimentación, con factores geográficos o bien con un patrón poblacional (Phipps, 1949; Uvarov, 1966; Gillot, 1995). En B. punctulatus los ovarios están constituidos por 10 ovariolas, este número se mantiene constante en ambos ovarios, tanto en hembras recolectadas del campo en diferentes estaciones del año, como en hembras de diferentes edades obtenidas en cámara de cría en condiciones óptimas para su desarrollo. Esta característica de estabilidad también se puso de manifiesto en la gónada masculina, con un elevado número de folículos testiculares, siempre constantes en ambos testículos, en ejemplares criados bajo diferentes condiciones ambientales (Michel & Terán, en prensa).

Fig. 11. Corte sagital de la región distal del ovario en la cual se observa las diferentes regiones de la ovariola. (FT: filamento terminal; LS: ligamento suspensorio; G: germario; VT: vitelario; OP: ovocito primario; CF: célula folicular. Coloración: H-E. Escala: 1cm = 56,58 µm).
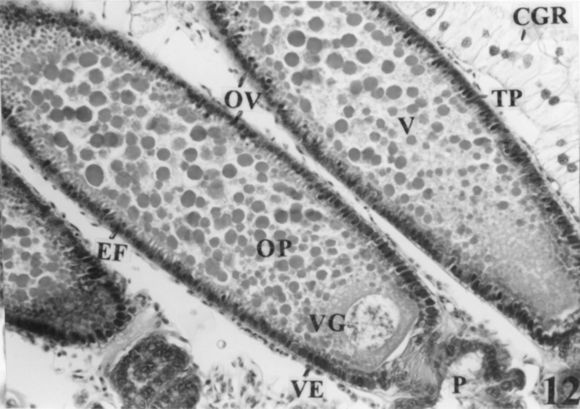
Figura 12. Corte sagital de la región ventral del ovario donde se observa el extremo proximal de ovariolas con ovocitos cargados de vitelo. (OV: ovariola; CGR: cuerpo graso; VE: vaina externa; EF: epitelio folicular; TP: túnica propia; P: pedicelo; OP: ovocito primario; V: vitelo; VG: vesícula germinal. Coloración: H-E. Escala: 1cm = 56,58 µm).

Fig. 13. Corte sagital de la glándula accesoria (GA). (E: epitelio; S: secreción. Coloración: H-E. Escala: 1cm = 56,58 µm).
El estudio histológico de la gónada revela que en B. punctulatus (Acrididae) la túnica propia está presente sólo en la región del vitelario y aumenta de espesor en el folículo basal de la ovariola; esta es sintetizada por las células foliculares y cumplen una importante función en el transporte de nutrientes desde el cuerpo graso, a través del epitelio folicular al ovocito para la síntesis de vitelo. Según Bonhag (1958), Chapman (1979) y Sahai & Banerjee (1987) en Poekilocerus pictus (Fabricius) (Pyrgomorphidae), la túnica propia se extiende a lo largo de toda la ovariola, tanto en la región del germario como del vitelario y tiene un doble origen a partir de las células que forman la vaina externa y el epitelio folicular. Estos resultados indicarían la necesidad de realizar estudios histoquímicos que confirmen la composición química, el origen y la función de la túnica propia en Acrididae.

Fig. 14. Corte sagital de la región distal del oviducto lateral. (OL: oviducto lateral; RD: región distal; E: epitelio; S: secreción. Coloración: H-E. Escala: 1cm = 22,8 µm).
En la espermateca de B. punctulatus no se observan glándulas accesorias asociadas, ni las formaciones digitiformes (predivertículos o divertículo preapical) características de las espermatecas de especies de Acrididae como Dichroplus elongatus, Brorellia bruneri (Bruner), Elasmoderus lutescens (Blanchard), Conometopus sulcaticollis (Blanchard), Moluchacris cinerascens (Philippi), Trimerotropis ochraceipennis (Blanchard) (Zapata & Díaz, 1979). Por su morfología externa, esta espermateca no se incluye dentro de las cinco categorías establecidas por Dirsh (1957) para Acridoidea; en esta clasificación los Melanoplinae no se mencionan entre las subfamilias de Acrididae estudiadas.
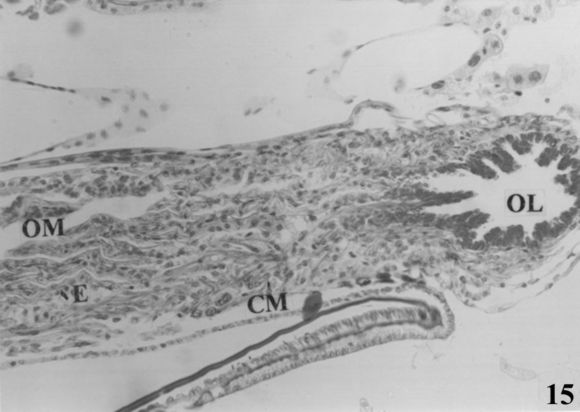
Fig. 15. Corte sagital de la región distal del oviducto medio en continuidad con la región proximal del oviducto lateral. (OM: oviducto medio; E: epitelio; CM: capa muscular; OL: oviducto lateral. Coloración: M.A. Escala: 1cm = 56,58 µm).
Sathe & Joshi (1988) realizaron un estudio comparado en Orthoptera y determinaron que las espermatecas simples en forma de saco con un epitelio simple, como en Acheta domestica y G ryllus bimaculatus (De Geer), son primitivas. En cambio las espermatecas de forma compleja, con tubos de almacenamiento y epitelio doble, con una capa de células secretoras y otra con células quitinosa, en una o ambas regiones de la espermateca, como en Melanoplus sanguinipes (Fabricius), son más evolucionadas. Sin embargo B. punctulatus, que es una especie de Acrididae y por lo tanto estaría dentro del grupo más evolucionado de Orthoptera, presenta una espermateca de forma compleja sin tubos de almacenamiento, con un epitelio simple con células secretoras y productoras de quitina, tanto en la región del conducto como del divertículo, lo cual sería una característica de la especie. En el futuro se profundizará en el estudio histológico empleando técnicas histoquímicas, con el fin de lograr una correcta caracterización de la espermateca de B. punctulatus y establecer nuevas pauta para la clasificación en Acrididae.
En B. punctulatus (Melanoplinae) la cámara genital en sus diferentes regiones, no presenta glándulas accesorias asociadas. En miembros de las subfamilias Cantatopinae, Calliptominae, Cyrtocanthacridinae, Ommexechinae y Egnatiinae, en el extremo anterior de la vagina hay un par de bolsa llamadas glándulas de Comstock-Kellog, que son evertidas durante la cópula y posiblemente intervienen en la atracción del macho por la hembra (Vardé, 1929, 1934; Slifer & King, 1936; Slifer, 1940b citado por Uvarov,1966).
Este trabajo junto con el realizado por Michel & Terán (en prensa), representan los primeros estudios anatomo-histológicos de órganos reproductivos internos en una especie de Baeacris. Los resultados obtenidos aportan datos para la comprensión integral del sistema y al análisis sistemático de los Acrididae.

Fig. 16. Corte sagital de la espermateca cargada de espermatozoides y líquido seminal. (DES: divertículo espermatecal; CES: conducto espermatecal. Coloración: H-E. Escala: 1cm = 56,58 µm).

Fig. 17. Corte sagital de la región posterior del abdomen de una hembra adulta. (VD: valva dorsal del ovopositor; VV: valva ventral; IEM: invaginación ectodermica media que origina la falsa abertura genital; GU: guía de huevos; PS: placa subgenital; VU: vulva; VA: vagina; CG: cámara genital; DD: dilatación dorsal; A: apodemas; OM: oviducto medio; CU: cutícula. Coloración: H-E. Escala: 1cm = 360 µm).

Fig. 18. Corte sagital de la región posterior del abdomen de una hembra adulta. (AG: abertura genital; VA: vagina; CG: cámara genital; DD: dilatación dorsal; CES: conducto espermatecal; GN: gonoporo; OM: oviducto medio; MM: masa muscular; A: apodema. Coloración: H-E. Escala: 1cm = 360 µm).
AGRADECIMIENTOS
A Analía Dupuy y Patricia Vince por la realización de los dibujos. A la Dra. Gabriela Cuezzo por su colaboración en la elaboración del abstract, como también a los árbitros anónimos de la SEA por sus oportunos comentarios. Al Consejo de Investigación de la Universidad Nacional de Tucumán, por el subsidio otorgado.
BIBLIOGRAFÍA CITADA
1. ALBRECHT, F. o. & M. VERDIER. 1956. Le poids et le nombre d'ovarioles ches les larves nouveaux-nées de Locusta migratoria migratorioides. Acad. Sc. Paris, 249: 203205. [ Links ]
2. BALDEIG, J.Z.. 1975. Fisiología Animal Comparada. Universidad de Concepción, Inst. de Biología "Otmar Wilhelm Grob", Dep. de Zoología (Chile). [ Links ]
3. BARRERA, M.. & I.H. PAGANINI, 1975. Acrididos de Tucumán: Notas Biológicas. Acta Zool. Lilloana, 31(11):107-124. [ Links ]
4. BENTOS PEREIRA, A.. 1989. Distribución geográfica de las especies del género Dichroplus Stal (Orthoptera, Acrididae, Melanoplinae). Rev. Bras. Entomol. 33(1): 31-47. [ Links ]
5. BONHAG, P.F. 1958. Ovarian structure and vitellogenesis in insects. A. Rev. Entomol., 3:137-160. [ Links ]
6. CARBONELL, C.S. & R.A. RONDEROS. 1973. Las especies del "grupo punctulatus" del genero Dichropus Stal (Orthoptera,Acrididae). Rev. Museo La Plata, 11:359-398. [ Links ]
7. CHAPMAN, R.F. 1979. The insects, structure and function. Elsevier, New York. [ Links ]
8. CIGLIANO, M.M., M.L. de WYSIECKI & C.E. LANGE. 1995. Disminución de la abundancia de Dichcroplus maculipennis (Orthoptera: Acridoidea) en comunidades del sudoeste de la provincia de Buenos Aires, Argentina. Rev. Soc. Entomol. Argent. 54(1-4): 15-16. [ Links ]
9. CIGLIANO, M.M. & C.E. LANGE. 1998. Orthoptera. En Morrone, J.J. & S. Cascarón (dirs.), Biodiversidad de Artrópodos Argentinos, una perspectiva biotaxonómica. Ediciones Sur, La Plata, pp. 67-83. [ Links ]
10. DALY, H.V., J.T. DOYEN & A.H. PURCELL, III. 1998. Insect Biology and Diversity. Ed. Oxford University Press. [ Links ]
11. DIRSH, V.M. 1957. The spermatheca as a taxonomic character in Acridoidea. Proc. Rent. Soc. Lond., (A), 32:107-114. [ Links ]
12. GALLOIS, D. 1979. Dones chronologiques sur la morphogenese de l'appareil genital femalle de Locusta migratoria migratorioides (R. et F.) (Orthoptera,Acrididae). Acrida 8(3):117-131. [ Links ]
13. GALLOIS, D. 1979. Etude chronologique de l'organogénese de l'appareil genital mâle chez Locusta migratoria migratorioides (R. et F.) (Orthoptera,Acrididae). Bull. Biol. Fr. Belg., 113:31-51. [ Links ]
14. GILLOT, C. 1995. Entomology. Plenum Press, New York and London. [ Links ]
15. HUMASON, G.L., 1979. Animal Tissue Techniques. W. H. Freeman and Company- San Francisco. [ Links ]
16. KRISTENSEN, N.P. 1991. Philogeny of extant hexapods. En: The Insects of Australia, Vol. 1. CSIRO, 125-140pp. Cornell University Press, New York. [ Links ]
17. LANGE, C.E. 1986. Crianza en cautiverio de Dichroplus elongatus (Orthoptera, Acrididae, Melanoplinae). Neotrópica, 32(88):147-148. [ Links ]
18. LANGE, C.E. 1992. Espectro hospedador natural y persistencia de Perizia dichroplusae Lange y Nosema locustae Canning (Protozoa, Microspora) en acrididos argentinos (Orthoptra,Acrididae). Neotrópica, 38(99):65-74. [ Links ]
19. LANGE, C.E. & E. WITTENSTEIN, 1998. Susceptibilidad de la langosta Schistocerca cancellata (Orthoptera,Acrididae) a diferentes entomopatógenos. Rev. Soc. Entomol. Argent., 57(1-4):19-22. [ Links ]
20. LANGE, C.E. 2002. Foro. El desarrollo de Nosema locustae (Protozoa: Microsporidia) para el control biológico de tucuras (Orthoptera: Acridoidea) y las consecuencias de su utilización en la Argentina. Rev. Soc. Entomol. Argent. 61(1-2): 1-9. [ Links ]
21. LANGE, C.E. 2003. Niveles de esporulación experimentales y naturales de Nosema locustae (Microsporidia) en especies de tucuras y langostas (Orthoptera: Acridoidea) de la Argentina. Rev. Soc. Entomol. Argent., 62(1-2):15-22. [ Links ]
22. LIEBERMANN, J. & R. SCHIUMA. 1946. Las "tucuras" mas perjudiciales de nuestra agricultura y ganadería. Publ. Inst. Sanidad Vegetal, año II, ser. B, 7:1-62. [ Links ]
23. LIEBERMANN, J. 1966. Los primeros estudios sobre genitales internos en acrididos. Rev. Soc. Ent. Argentina, 28(1-4):110. [ Links ]
24. LONGO, G., L. SOTTILE, Q. VISCUSO, A. GIUFFRIDA & R. PRIVITERA. 1993. Ultrastructural changes in sperm of Eyprepocnemis plorans (Charpentier) (Orthoptera, Acrididae) during storage of gametes in female genital tract. Invert. Reproduc. and Develop., 24:1-6. [ Links ]
25. MARTINS, G.F. & J.F. SERRÀO. 2004. A Comparative Stdy of the Ovaries in some Brazilian Bees (Hymenoptera; Apoidea). Papéis Avulsos de Zoología. Museu de Zoología da Universidade de Sào Paolo. 44(3): 45-53. [ Links ]
26. MATHUR, R. S. 1960. Studies on the normal and x-irradiated spermatogenesis of Stenobothrus viridulus and Schistocerca gregaria (Orthoptera). Cellule, 61:171-190. [ Links ]
27. MATSUDA, R. 1975. Morphology and evolution of the insect abdomen. Ed. Pergamon Press. [ Links ]
28. MICHEL, A.A. & E.S. TEISAIRE. 1996. Cronología del desarrollo embrionario normal de Baeacris punctulatus (Thunberg) (Orthoptera, Acrididae). Rev. Chilena Ent., 23:29-41. [ Links ]
29. MICHEL, A.A. & H.R. TERÁN. En prensa. C ría en cautiverio de Baeacris punctulatus (Thunberg) (Orthoptera, Acrididae, Melanoplinae). Acta zool. lilloana. [ Links ]
30. MICHEL, A.A. & H.R. TERÁN. 2005. Morfología del sistema reproductor masculino de Baeacris punctulatus (Thunberg) (Orthoptera, Acrididae). Rev. Museo La Plata, Zoología 16(169):1-12. [ Links ]
31. MICHEL, A.A. Inéd. Morfogénesis del sistema reproductor y gametogénesis en Baeacris punctulatus (Thunberg) (Orthoptera, Acrididae). Tesis Doctoral. Fac. de Ciencias Naturales e Inst. Miguel Lillo, Univ. Nacional de Tucumán, 2001, 310pp. [ Links ]
32. NELSEN, O.E. 1931. Life-cycle, sex differenciation and testis development in Melanoplus differentialis (Acrididae, Orthoptera). J. Morph., 51:467-515. [ Links ]
33. NELSEN, O.E. 1934. The development of the ovary in the grassopper, Melanoplus differentialis (Acrididae,Orthoptera). J. Morph., 55:515-543. [ Links ]
34. PHIPPS, J. 1949. The structure and maturation of the ovaries in british Acrididae (Orthoptera). Trans. R. ent. Soc. Lond., 100(9):233-247. [ Links ]
35. PHIPPS, J. 1959. Studies on East African Acridoidea (Orthopera) with special reference to egg-production, habitat and seasonal cycles. Trans. R. ent. Soc. Lond., 111:27-56. [ Links ]
36. RONDEROS, R.A. 1985. Consideraciones sobre la biogeografía de los Melanoplinae en Sudamerica (Orthptera, Acrididae). Proc. 3rd. Trienial Mtg., Pan Amer. Acrid. Soc., 53-54. [ Links ]
37. RONDEROS, R. & M.M. CIGLIANO. 19 91. The Andean Dichoplini: cladistic analysis with description of Keyacris n. gen. and Ponderacris n. gen. (Orthoptera, Acrididae, Melanoplinae). Trans. Amer. Ent. Soc., 117(3-4):167-191. [ Links ]
38. SAHAI, Y.N. 1984. Histochemical studies of oocyte development in Poecilocerus pictus Fabr. Folia Morph., Vol. 32 ( India ). [ Links ]
39. SAHAI, Y.N. & S. BANERJEE. 1987. Histological and citilogical studies of development of the oocyte of Poecilocerus pictus Fabr. (Acrididae,Orthoptera). Folia Morph. Vol. 35 (India). [ Links ]
40. SÁNCHEZ, N.E., P. PESSACQ, M. THEILLER & G. ALMANDOZ. 2001. Aspectos biológicos y demográficos de Dichroplus schulzi (Orthoptera: Acrididae), en laboratorio. Rev. Soc. Entomol. Argent. 60(1-4): 73-78. [ Links ]
41. SATHE, A.A. & P.V. JOSHI. 1988. Comparative study on the spermatheca of some orthopteran Insects. Cytologia (Tokyo), 53(2):347-352. [ Links ]
42. SAXENA, R.C. S. JAIN, A. SAXENA & Y.N. SAHAI. 1988. Towards the contribution of follicular epitelium in the growing oocyte of Poecilocerus pictus (Orthoptera). A cytochemical study. Beitr.Entomol., 38(1):229-231. [ Links ]
43. SHULOV, A. & M.P. PENER. 1959. A contribution to knowledge of the development of the egg of Locusta migratoria. R.et.F. Locusta, 6:73-88. [ Links ]
44. SINGH, T. 1958. Ovulation and corpus luteum formation in Locusta migratoria migratorioides Reiche and Fairmaire and Schistocerca gregaria (Forskal). Trans. R. ent. Soc. Lond., 110:1-20. [ Links ]
45. SISLER, G.M. 1981. Desarrollo embrionario de Dichroplus elongatus G. Tos (Orthoptera,Acrididae) bajo diferentes condiciones ambientales. Rev. Fac. Agronomía, 2(1):47-52. [ Links ]
46. SZOLLOSI, A. & C. MARCAILLOU. 1979. The apical cell of locust testis: an ultrastructural study. J. Ultrastruct. Res., 69(3):331-342. [ Links ]
47. TURK, S. & M. BARRERA. 1979. Acrididos del NOA III. Estudio bio-ecológico sobre siete especies del género Dichroplus Stal. (Orthoptera, Acrididae). Acta zool. lilloana, 35:785-805. [ Links ]
48. UVAROV, B. 1966. Grassohoppers and locusts, Volume I. A handbook of general acridology. Cambridge University Press. [ Links ]
49. WAGAN, M.S. 1980. A comparative study of female reproductive organs of Orthoptera from sind. Pakistan J. Zool., 12(1):17-25. [ Links ]
50. WYSIECKI, M.L., M.M. CIGLIANO & C.E. LANGE. 1997. Fecundidad y longevidad de adultos de Dichroplus elongatus (Orthoptera, Acrididae) bajo condiciones controladas. Rev. Soc. Ent. Argent., 56(1-4):101-104. [ Links ]
51. ZAPATA, C.S. & O. DIAZ SCH. 1979. La espermateca de algunos acrididos chilenos (Orthoptera, Acrididae). Noticiario Mens. Mus. Nac. Hist. Nat., 23(271):7-10. (España). [ Links ]
Recibido: 11-III-2005
Aceptado: 18-XI-2005














