Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista de la Sociedad Entomológica Argentina
versión impresa ISSN 0373-5680versión On-line ISSN 1851-7471
Rev. Soc. Entomol. Argent. v.65 n.1-2 Mendoza ene./jul. 2006
Descripción de las larvas II, III y el pupario de Compsomyiops fulvicrura (Diptera: Calliphoridae)
Description of the larvae II, III, and the puparium of Compsomyiops fulvicrura (Diptera: Calliphoridae)
Trigo, A. Verónica.
Museo Argentino de Ciencias Naturales (MACN). Laboratorio de Entomología Forense.
Av. A. Gallardo 470. C1405DJR Buenos Aires, .Argentina; e-mail: forensictrigo@yahoo.com.ar
ABSTRACT. The larvae II, III, and the puparium of Compsomyiops fulvicrura (Robineau-Desvoidy, 1830) are described. The material was collected in Tandil ( Buenos Aires , Argentina ), during an experiment on sarcosaprophagous faunal succession. New diagnostic characters of C. fulvicrura, Calliphora vicina (Robineau-Desvoidy, 1830), Phaenicia sericata (Meigen, 1826), Cochliomyia macellaria (Fabricius, 1775), and Paralucilia pseudolyrcea (Mello, 1969) are given that may be found on a corpse.
KEY WORDS: Compsomyiops fulvicrura. Description of larvae. Calliphoridae.
RESUMEN. Se describen las larvas II, III y el pupario de Compsomyiops fulvicrura (Robineau-Desvoidy, 1830). El material se capturó en Tandil (Buenos Aires, Argentina), durante un experimento de sucesión de fauna sarcosaprófaga. Se aportan nuevos caracteres diagnósticos de C. fulvicrura , Calliphora vicina (Robineau-Desvoidy, 1830), Phaenicia sericata (Meigen, 1826), Cochliomyia macellaria (Fabricius, 1775) y Paralucilia pseudolyrcea (Mello, 1969) que se pueden hallar sobre un cadáver.
PALABRAS CLAVE: Compsomyiops fulvicrura . Descripción larval. Calliphoridae.
INTRODUCCIÓN
Los cuerpos en descomposición proveen un micro hábitat temporal que ofrece cambios progresivos y suministra recursos de alimento para una amplia gama de organismos, entre los que abundan los estadios inmaduros; quizás sea una consecuencia de lo efímero de este particular micro ambiente (Goff, 1998).
El tiempo que transcurre desde que se produce el deceso hasta la llegada de los primeros artrópodos, depende de las especies y del micro-hábitat de cada cadáver (O´Flynn, 1993). Al respecto, Goff et al. (1993) se refieren a numerosos estudios de descomposición efectuados sobre distintos tipos de cadáveres, desde pequeños saurios hasta paquidermos, arrojando como resultado una gran diversidad de taxones colonizadores.
Cuando el tiempo transcurrido entre la muerte y el hallazgo de los restos es de semanas, meses o aún mayor, los insectos son una de las evidencias más fuertes; así, la entomología forense puede ser el único medio para estimar el intervalo post-mortal (PMI) (Anderson, 2001). Si tenemos en cuenta que la Entomología Forense es la rama de la Entomología que estudia los artrópodos hallados sobre cadáveres, a fin de estimar el PMI y, cuando es posible, determinar las circunstancias que lo rodearon o que lo siguieron (Oliva, 1997); se hace evidente la necesidad de conocer caracteres morfológicos distinguibles para reconocer las especies asociadas a cada estadio de la descomposición. La correcta determinación de la edad de las larvas y la especie a la que pertenecen, es fundamental para la estimación del PMI.
La colonización de un cadáver está regida no sólo por factores autogénicos como producción de olores atractivos, temperatura de la descomposición, etc, sino también por factores alogénicos, entre los que se destacan la temperatura ambiente, humedad, lluvia y abundancia de insectos (Galloway et al., 1989; Mann et al ., 1990; Shean et al ., 1993). Estas variables están condicionadas por la estacionalidad, principalmente en las regiones templadas (Tantawi et al. , 1996). La localidad de Tandil presenta una fluctuación térmica circadiana, esto sugiere que el desarrollo larval de la entomofauna, fue condicionado por las temperaturas mínimas imperantes durante el desarrollo del experimento de sucesión (Oliva & Ravioli, 2004).
Early & Goff (1986) dividen el proceso de descomposición en cinco etapas discretas, las cuales vincula con las especies mejor representadas en cada una de ellas. Estas etapas son: a) fresca con predominio de las familias Calliphoridae y Sarcophagidae; b) enfisematosa por la cual los adultos de Calliphoridae muestran una fuerte atracción; c) putrefacción donde larvas de Diptera, adultos y larvas de Coleoptera adquieren más importancia; d) post putrefacción en la cual los adultos y larvas de Coleoptera pasan a ser el grupo predominante en los hábitats xerófilos y mesófilos (Goff et al. , 1993) y en hábitats húmedos suelen ser desplazados por otros taxones de Diptera (Tullis & Goff, 1987); e) esquelética donde la presencia de ácaros en el suelo cobra importancia.
Conocimiento de las Calliphoridae Chrysomyinae
La familia Calliphoridae tiene una amplia distribución, desde el extremo Norte continental, hasta Islas subantárticas; la mayor diversidad corresponde a la región Afrotropical, siendo América del Sur la que posee menor diversidad específica (Mariluis & Mulieri, 2005). Los géneros neotropicales de esta familia, presentan un máximo de abundancia durante las épocas cálidas (primavera-verano), con alternancia en la dominancia de especies (Schnack et al. , 1995).
El ciclo de vida de las Calliphoridae comprende: huevo, larva I, larva II, larva III, pupa y adulto, tal como lo indica Mariluis (1982). Previo a la pupa, la larva III entra en el período post alimentario, en el cual abandona el cuerpo y se aleja buscando terreno apto para empupar. La distancia que recorren desde el cuerpo hasta el lugar de empupe depende de la especie (Greenberg, 1990).
Las larvas de Calliphoridae son vermiformes, sin cabeza visible, con el extremo anterior subcónico; el extremo posterior es truncado y forma un disco más o menos cóncavo rodeado por seis pares de tubérculos cónicos, y en el cual se abren los espiráculos posteriores. Las placas espiraculares suelen proporcionar caracteres diagnósticos, sobre todo en el estadío de larva III. En cada segmento hay una banda ventral de espinas cuticulares, la cual se prolonga hacia arriba, formando una banda que puede ser completa (cerrada en el dorso) o incompleta; el patrón de la distribución de espinas puede ser un carácter diagnóstico a nivel de género (Greenberg & Szyska, 1984). En ciertas especies, algunos segmentos llevan además áreas fusiformes cubiertas de espinas cuticulares en las caras laterales (Fig. 2A).
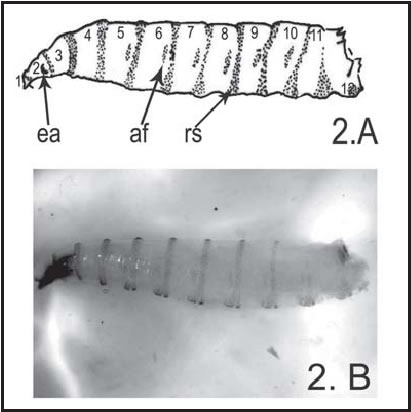
Fig. 2 . C. fulvicrura : A, Esquema de larva III, vista lateral. B, Larva III , vista lateral (10 X). ( af : área fusiforme; es : espiráculo anterior; rs : anillos de espinas; tnt phgn : fragma).
Las sinonimias de Compsomyiops fulvicrura (Robineau-Desvoidy, 1830) pueden ser consultadas en Mariluis & Schnack (2002). Cabe señalar que Palma (1973), publicó la descripción del ciclo ontogénico de Paralucilia fulvicrura , pero se ha podido establecer que se trataba de Paralucilia pseudolyrcea . El material de adultos del trabajo de Palma, fue revisado y redeterminado para este trabajo por el Dr J.C. Mariluis. Se desprende de esto que las larvas de C. fulvicrura habían permanecido en realidad desconocidas para la ciencia hasta ahora.
En este trabajo se describen las larvas II, III y el pupario de Compsomyiops fulvicrura , indicando además los caracteres diagnósticos para diferenciarla de otras Calliphoridae frecuentes sobre cadáveres como: Calliphora vicina (Robineau-Desvoidy, 1830), Phaenicia sericata (Meigen, 1826), Cochliomyia macellaria (Fabricius, 1775) y Paralucilia pseudolyrcea (Mello, 1969).
MATERIAL Y MÉTODOS
Las larvas de C. fulvicrura se capturaron en Tandil (Prov. de Buenos Aires, Argentina;37º14 ' S, 59º 15 ' O; altitud promedio: 175 m), al finalizar un experimento de sucesión de fauna cadavérica, en un área semirural. Este área se encuentra en el sudeste del distrito fitogeográfico Central, subdistrito Platense, del Espinal periestépico (Lewis & Collantes, 1973).
Se utilizó el protocolo para estudios de descomposición sugerido por Goff (1998), con algunas modificaciones. Se colocaron dos cadáveres de Sus scrofa L. (cerdo doméstico), de 15 kg. cada uno, sacrificados con métodos de carnicería local, separados por una distancia de más de 50 metros, y en diferentes ambientes (sol y sombra).
Se colocaron los cerdos dentro de jaulas de exclusión con piso, para evitar la interferencia de vertebrados carroñeros y realizar exclusivamente el estudio de la entomofauna.
La duración de este experimento se estableció como el tiempo que demorara en llegar a la reducción total el cerdo ubicado al sol (15 días, 1º de Marzo 2003). En ese mismo momento el cerdo que estaba a la sombra no presentaba señales de descomposición visibles, por lo que se realizó una necropsia (Técnicas de Necropsia, 2004); durante dicha intervención, se hallaron larvas de Compsomyiops fulvicrura y Cochliomyia macellaria dentro de la cavidad craneal, sobre la masa encefálica.
De la totalidad de larvas halladas (160 individuos), sesenta fueron fijadas por calor (agua a 95ºC por 5 minutos) y conservadas en etanol al 70 %; mientras que otras cien se trasladaron al laboratorio para su crianza y la obtención de adultos.
Para criar las larvas se emplearon frascos de vidrio de 20 X 7 cm, con 6 cm de turba de jardinería en el fondo; sobre esta base se colocaron cubos de papel de aluminio con alimento (carne picada) que contenían las larvas. La turba proporcionaba un sustrato de pupariación adecuado. Los frascos se taparon con trozos de voile para cortina.
De estos 100 individuos (40 Compsomyiops fulvicrura y 60 Cochliomyia macellaria), cada tres días se fijaba la mitad de los individuos de cada especie, continuando con la cría de las restantes. A los 12 días de crianza, emergieron 5 adultos de Compsomyiops fulvicrura y 10 de Cochliomyia macellaria. Se recuperaron del frasco de crianza 15 puparios, de los cuales 10 se determinaron como pertenecientes a Cochliomyia macelaria y 5 como una especie del género Compsomyiops (Greenberg & Szyska, 1984). Se confirmó la identidad de la especie por el examen de los adultos obtenidos, observándose todos los caracteres diagnósticos dados por Mariluis & Schnack (2002).
La determinación de las muestras se realizó con un microscopio estereoscópico Zeiss IV/b y las mediciones se realizaron con un ocular milimetrado. Las fotografías se tomaron con una cámara Nikon DXF 1200 montada, según la necesidad, sobre un microscópio estereoscópico Nikon C-PS 160 o sobre un microscopio de transmisión Olympus BH-2.
La descripción del esqueleto céfalofaríngeo de las larvas sigue la nomenclatura propuesta por Teskey (1981)(Fig. 1). Es de interés señalar que en todos los ejemplares de larvas II y III examinados, se observó la fusión del dentículo (de) al esclerito mandibular (md) tal como lo propone Townsend (1934).
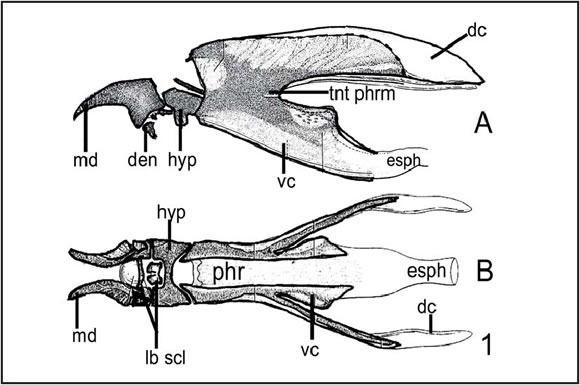
Fig. 1 Esquema con nomenclatura de escleritos cefálo-faríngeos A: vista lateral, B: vista dorsal. ( dc : cuerno dorsal; de : dentículo; ea : esclerito accesorio; esph : esófago; hyp : hipostoma; lb scl : escleritos labiales; md : esclerito mandibular; phr : faringe; tnt phgn : fragma tentorial).
Para una descripción completa de la larva, fue necesario aclarar los ejemplares in toto y las piezas disecadas, por sumersión en hidróxido de sodio (NaOH) 10 % durante 72 hs. Una vez concluido el proceso de aclarado, se tiñeron de la siguiente forma: las Chrysomyinae (Cochliomyia macellaria, Compsomyiops fulvicrura) se colorearon por sumersión con Negro de Clorazol 10 % para resaltar las estructuras cuticulares (Carayon, 1969); y las Calliphorinae (Phaenicia sericata, Calliphora vicina ) se inyectaron internamente con fucsina ácida (Ross et al ., 1997); el montaje final se hizo en glicerina. La diferenciación entre Calliphorinae y Chrysomyinae se realizó observando los caracteres diagnósticos mencionados por Mariluis & Guarnera (1983) y Greenberg & Szyska (1984).
También se revisó la descripción de Compsomyiops fulvicrura realizada por Palma (1973). Examinando el material depositado en el Museo de Zoología de la Universidad de Concepción, se pudo verificar, gracias a la colaboración del Dr. J.C. Mariluis, que esta descripción excelente en cuanto a los detalles, corresponde en realidad a otra especie de Calliphoridae, como se dijo anteriormente.
Abreviaturas empleadas en las descripciones: af : área fusiforme; AP : protuberancia anal dc : cuerno dorsal; de : dentículo DT : Tubérculo Dorsal; ea : esclerito accesorio; ep : espiráculo posterior; es : espiráculo anterior; esph : esófago; hyp : hipostoma; IDT : tubérculos dorsales internos; IVT: tubérculos ventrales internos; lb scl : escleritos labiales; md : esclerito mandibular; MDT : tubérculos dorsales medios; MVT : tubérculos ventrales medios; ODT : tubérculos dorsales externos; OVT : tubérculos ventrales externos; phr : faringe; rs : anillos de espinas; tnt phgn : fragma tentorial; VT : tubérculo ventral; vc : cuerno ventral.
RESULTADOS
Compsomyiops fulvicrura (Robineau- Desvoidy, 1830) (Figs. 2, 4 B, C, 5 A, B, 6 A, B, 7, 8, 9 A, B, 10, 11)
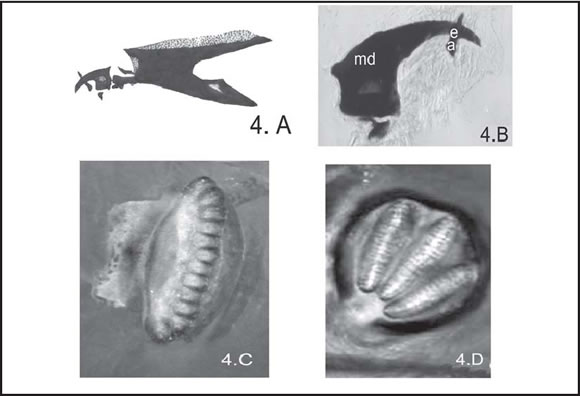
Fig. 4. C. fulvicrura : A, Esquema esqueleto céfalo-faríngeo de larva III; B, Detalle del esclerito mandibular ( md ) y accesorio ( ea ) (400 X), vista lateral; C, Espiráculo anterior ( es ) (400 X), vista lateral; D, Espiráculo posterior ( ep ) (100 X), vista posterior.

Fig. 5. C. fulvicrura : Esquema del pupario (15 X), A, vista lateral; B, vista dorsal.
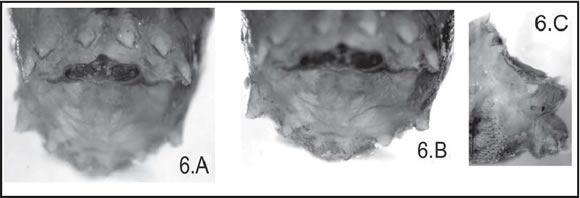
Fig. 6. C. fulvicrura : Tubérculos de larva III (15 X), vista A: Dorsales ( DT ), B: Ventrales ( VT ), C: vista lateral

Fig. 7. C. fulvicrura : Detalle de las espinas cuticulares de larva III. (600 X).
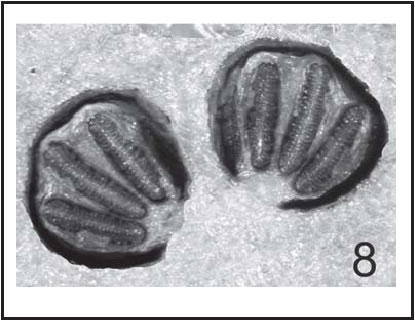
Fig. 8. C. fulvicrura : Placa espiracular de larva III (100 X)

Fig. 9. C. fulvicrura : Esclerito hipostomal ( hyp ) de larva II (400 X): A, vista doral, B, vista lateral.
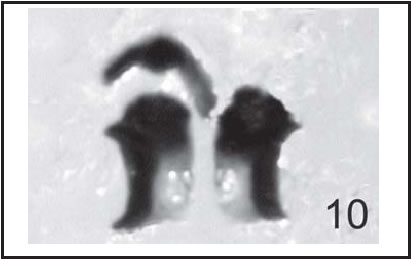
Fig. 10 . C. fulvicrura : Escleritos labiales ( lc scl ) de larva II (400 X), vista ventral.

Fig. 11. C. fulvicrura : Esqueleto céfalo-faríngeo de larva II (100 X), vista lateral. ( dc : cuerno dorsal; de : dentículo; hyp : hipostoma; tnt phgn : fragma tentorial; vc : cuerno ventral).
Caracteres morfológicos preimaginales.
Las larvas de C. fulvicrura presentan espinas cuticulares dispuestas sobre los segmentos aparentes de la larva, según el patrón siguiente: bandas completas de espinas desde el segmento 2 al 10; en el segmento 11 una o dos filas de espinas que cierran esta banda por la cara dorsal. Áreas fusiformes presentes en los segmentos 5 a 11 (Fig. 2).
El segmento 12 tiene seis tubérculos dorsales (DT) y seis ventrales (VT) (Fig. 3), con el siguiente patrón: los dorsales internos y externos (IDT y ODT) de tamaño similar, y los dorsales medios (MDT) de menor tamaño que los anteriores; todos separados por distancias semejantes. Los tubérculos ventrales externos (OVT) son de mayor tamaño que los ventrales medios e internos (MVT y IVT), muy pequeños en comparación con los tubérculos anteriores (Fig. 6 A, B). La protuberancia anal (AP) lleva espinas dispuestas en forma de V. Se observaron espinas cuticulares bífidas y también simples, muy melanizadas en su parte distal, con forma de mamelón en su parte proximal (Fig. 7).
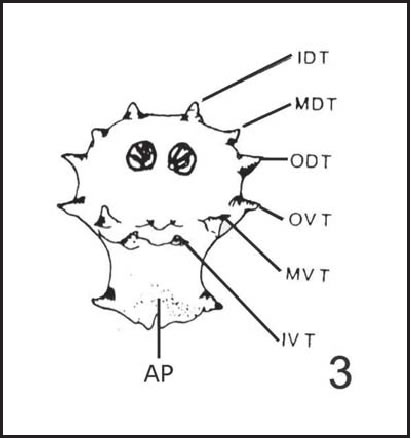
Fig. 3 C. fulvicrura : Esquema de larva III, distribución de los tubérculos, vista posterior. ( AP : protuberancia anal; IDT : tubérculos dorsales internos; IVT: tubérculos ventrales internos; MDT : tubérculos dorsales medios; MVT : tubérculos ventrales medios; ODT : tubérculos dorsales externos; OVT : tubérculos ventrales externos).
Las placas espiraculares posteriores tienen peritrema incompleto, con botón espiracular débilmente definido (Fig. 8).
En los preparados realizados para este estudio, se pudieron observar claramente las articulaciones del esclerito hipostomal, que no están descriptas en forma explícita en los trabajos de Townsend (1934) y Teskey (1981). El esclerito hipostomal (hyp) se distingue en vista dorsal y ventral del esqueleto céfalofaríngeo por su forma de «H» (Fig. 9 A); en la vista lateral presenta forma de silla de montar (Fig. 9B). En la vista dorsal se aprecia su articulación con el fragma tentorial en el extremo posterior; en el anterior se articula por la parte superior con el md, y por la inferior con los escleritos labiales (lb scl). (Fig. 10)
Caracteres de cada estadio
Larva II : longitud total 7.5-8.0 mm (n= 20). Espiráculo anterior con forma de guante, se distinguen entre 8 y 10 ramas. Esta diversidad parece que se debe a la edad: los ejemplares recién mudados a larva II, resultaron tener un número de ramas del es menor que los ejemplares maduros o los viejos, es decir, los que ya tienen formada la cutícula de larva III .
Esqueleto céfalo-faríngeo: md pares, falciformes, delgadas, en cuya región basal se observa una pequeña área menos esclerotizada. También se observan áreas menos esclerotizadas, en las regiones externas de los dc y en los vc . (Fig. 11).
Larva III : longitud total 12.0-8.0 mm (n=10). Espiráculo anterior con 12-16 ramas (Fig. 4 C).
Esqueleto céfalo-faríngeo: md falciformes, más robustos que en la larva II , con una pequeña área menos esclerotizada en la región basal, al igual que en el anterior estadio larval. Entre ambos md se observa un único esclerito accesorio ( ea ), dispuesto en forma diagonal, visible tanto en el aspecto ventral como en el lateral (Fig. 4 B).
Pupario : (n=4) forma subcilíndrica, color castaño rojizo; en la superficie se observa con claridad el patrón de espinas de la larva III (Fig. 5 A, B).
Material examinado. Para la descripción de C. fulvicrura y demás especies para su comparación: ARGENTINA. Provincia de Buenos Aires: Tandil, Trigo col. 1/ III / 2003, en cavidad craneal del cerdo ubicado en la sombra (masa encefálica); 35 larvas de C. fulvicrura , 5 adultos y 5 puparios; C. macellaria 90 larvas, 10 Adultos y 10 puparios; P. sericata 20 larvas. Se realizaron 10 preparados microscópicos transitorios para la descripción el esqueleto cefalofaringeo. ARGENTINA: Ciudad Autónoma de Buenos Aires, Oliva col. 13/ III / 2003, 20 larvas de C. vicina . Todo el material se encuentra depositado en la colección del Museo Argentino de Ciencias Naturales (MACN), Laboratorio de Entomología Forense (Ent-MACN) Buenos Aires, ARGENTINA.
Paralucilia pseudolyrcea (Mello, 1969) (Figs. 12, 13, 14, 15, 16, 17, 18, 19, 20, 21)
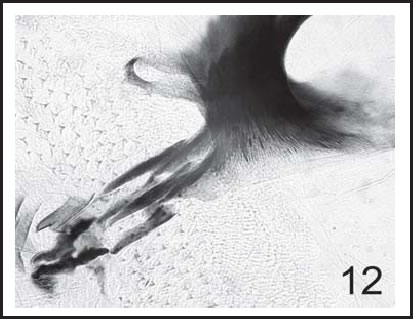
Fig. 12. P. pseudolyrcea : Esqueleto cefálo-faríngeo de larva I (400 X), vista lateral.

Fig. 13. P. pseudolyrcea : Esqueleto cefálo-faríngeo de larva II (100 X), vista lateral. ( dc : cuerno dorsal; de : dentículo; hyp : hipostoma; md : esclerito mandibular tnt phgn : fragma tentorial; vc : cuerno ventral).
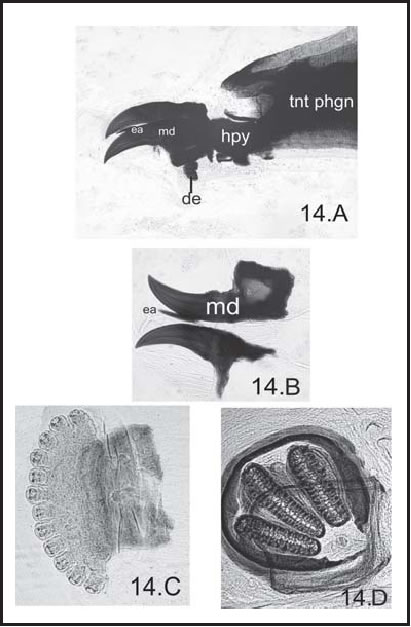
Fig. 14. P. pseudolyrcea : A, Esqueleto céfalofaríngeo de larva III (50 X), vista lateral; B, Esclerito mandibular ( md ), esclerito accesorio ( ea ), dentículo ( de ) y fragma tentorial ( tnt phgn ) vista dorsal (400 X); C, Espiráculo anterior ( es ) (400 X), vista lateral, D, Espiráculo posterior ( ep ) (100 X), vista posterior.
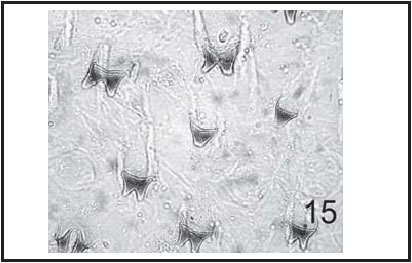
Fig. 15. P. pseudolyrcea : Espinas cuticulares de larva III (600 X).
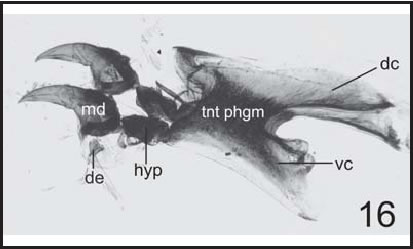
Fig. 16 . C. macellaria : Esqueleto céfalo-faríngeo de larva II (100 X), vista lateral. ( dc : cuerno dorsal; de : dentículo; hyp : hipostoma; md : esclerito mandibular; tnt phgn : fragma tentorial; vc : cuerno ventral).

Fig. 17. C. macellaria : Esclerios mandibular ( md ), esclerito accesorio ( ea ), dentículo ( de ) e hipostoma ( hyp ) de larva III (400 X), vista lateral.
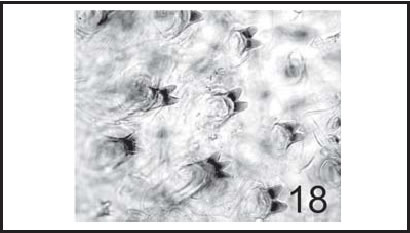
Fig. 18 . C. macellaria: Espinas cuticulares de larva III (600 X).
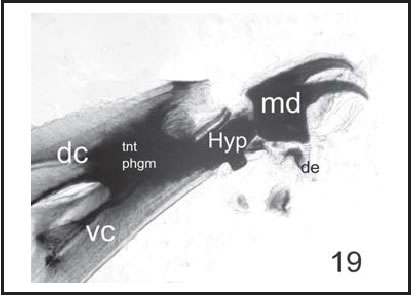
Fig. 19. P. sericata : Esqueleto céfalo-faríngeo de larva III (100 X), vista lateral. ( dc : cuerno dorsal; de : dentículo; hyp : hipostoma; md : esclerito mandibular; tnt phgn : fragma tentorial; vc : cuerno ventral).
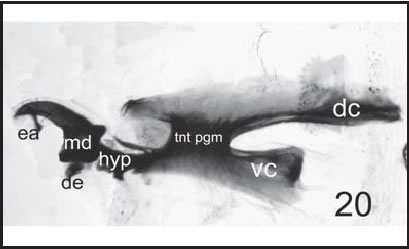
Fig. 20. C. vicina : Esqueleto céfalo-faríngeo de larva III (100 X), vista lateral. ( dc : cuerno dorsal; de : dentículo; ea : esclerito accesorio; hyp : hipostoma; md : esclerito mandibular; tnt phgn : fragma tentorial; vc : cuerno ventral).
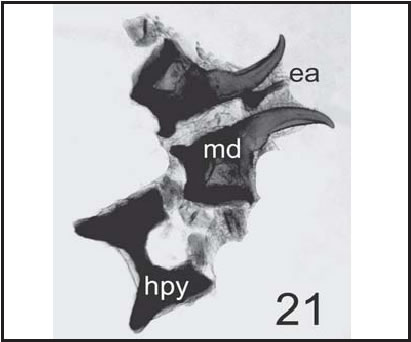
Fig. 21. C. vicina : Escleritos mandibular ( md ), esclerito accesorio ( ea ), dentículo ( de ) e hipostoma ( hyp ) de larva III (400 X), vista lateral
Las larvas de Paralucilia pseudolyrcea presentan un patrón de espinas cuticulares y un esqueleto céfalo-faríngeo acorde con el descripto por Palma, 1973 sub P. fulvicrura .
Ahora bien, si tenemos en cuenta que Paralucilia fulvicrura es un sinónimo de Compsomyiops fulvicrura (González Mora et al. , 1998), es de vital importancia para la correcta determinación de esta especie, notar que los caracteres diagnósticos expuestos por Palma (1973) para Paralucilia fulvicrura son realmente los caracteres de P. pseudolyrcea . Esta afirmación queda sustentada al observar los caracteres diagnósticos mencionados por Mariluis & Schnack (2002) para P. pseudolyrcea, sobre el adulto emergido de las crías de laboratorio realizadas por Palma (1973) (Figs. 12-15).
En el caso de Cochliomyia macellaria (Figs. 16-18), se siguió la descripción dada por Greenberg & Szyska (1984); para Phaenicia sericata (Fig. 19) la de Mariluis & Guarnera (1983) y para Calliphora vicina (Figs. 20, 21) , las dadas por Liu & Greenberg (1989) .
Material examinado. Para P. pseudolyrcea ( sub P. fulvicrura ): ARGENTINA. Provincia de Buenos Aires: Ezeiza (Barrio Esteban Echeverría), Palma col. 20/IV/1968. El lote original fue colectado en estado pupal, sobre restos secos del cadáver de un perro. Llevados al laboratorio y criadas dos generaciones completas, se utilizó material correspondiente a la segunda generación para las descripciones. Se analizaron 6 preparados microscópicos y un ejemplar adulto. Este material se encuentra depositado en la colección del Museo de Zoología, Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción, CHILE.
DISCUSIÓN
En 1984, Greenberg & Szyska señalan la divergencia entre los caracteres diagnósticos a nivel de género, en Compsomyiops arequipensis (Mello, 1968) ( sub C. boliviana ) y en P. fulvicrura (Palma, 1973). Atribuyen estas diferencias a la dificultad en la determinación de los estadíos inmaduros, como así también al ambiente en donde fueron obtenidas las muestras. Es sabido que las condiciones ambientales influyen significativamente en el desarrollo de los insectos, sin embargo en la mayoría de los casos, existen caracteres diagnósticos invariables que permiten determinar la especie.
Luego de observar el material de este estudio y el de Palma (1973), se concluye que las diferencias observadas por Greenberg y Szyska (1984) se debían a que estaban trabajando con una especie del género Compsomyiops, mientras que Palma (1973) trabajó con una especie perteneciente al género Paralucilia .
Caracteres diagnósticos (Figs. 2 A, B, 10 B, 14 B, 17, 21)
Compsomyiops fulvicrura (Calliphoridae, Chrysomyinae) se distingue de Calliphora vicina y Phaenicia sericata (Calliphoridae, Calliphorinae) (descripciones en Liu & Greenberg, 1989: 86-88), por las espinas cuticulares robustas, fuertemente melanizadas, con frecuencia bífidas; y por la presencia de seis áreas fusiformes (Fig. 2 A, B).
Además presenta bandas completas en los segmentos 2-10, y el segmento 11 con una banda cerrada dorsalmente por 1-2 filas de espinas, así como por el esclerito accesorio en la larva III.
Las Calliphorinae carecen de áreas fusiformes y sus espinas son pequeñas y débilmente pigmentadas, lo cual se puede observar claramente con la coloración interna anteriormente indicada.
Las especies antes mencionadas, excepto Phaenicia sericata , poseen esclerito accesorio ( ea ), éste tiene morfología y disposición diagnósticas para la especie. En Cochliomyia macellaria (Fig. 17) el ea observado es en realidad aparente, ya que al tratarlo con negro de colorazol, se lo puede observar como una esclerotización de la porción anterior de la faringe ( phr ). Esta característica, se pone fácilmente en evidencia cuando, al separar el esqueleto céfalo-faríngeo del resto de las estructuras larvales, la esclerotización queda adherida a los anillos orales y no al propio esqueleto céfalo-faríngeo como el resto de los escleritos accesorios. Además, en Cochliomyia macellaria, las bandas de los segmentos 10 y 11 están incompletas en el dorso, mientras que en Compsomyiops fulvicrura, están completas excepto la del segmento 11 (Greenberg & Szyska, 1984: 491).
Finalmente, compararemos el esclerito accesorio de Calliphora vicina (Fig. 21), con el de Compsomyiops fulvicrura (Fig. 10 B) y el de Paralucilia pseudolyrcea (Fig. 14 B). Se puede observar en estas figuras que Calliphora vicina tiene un ea (en forma de hoz), con disposición oblicua y ubicado en la mitad de la parte incisiva del esclerito md ; de manera que en la vista lateral se lo observa cruzando este esclerito. En Compsomyiops fluvicrura tiene una disposición diagonal con respecto a la misma sección del esclerito md, y es de un tamaño notablemente mayor. Por último, en Paralucilia pseudolyrcea este esclerito es de menor tamaño que el de Calliphora vicina , y se encuentra ubicado en la porción más distal de la parte incisiva del esclerito md , de manera que en la vista lateral se lo observa por debajo del esclerito md y levemente inclinado en dirección ventral, no cruzado sobre el esclerito md , como sucede en Compsomyiops fulvicrura .
La identificación de las larvas II, III y de los puparios tiene un gran interés práctico, porque estos estadíos son los que con mayor frecuencia se hallan sobre los cadáveres.
La presencia de Compsomyiops fulvicrura parece asociada con ambientes rurales o semirrurales (Mariluis & Schnack, 1986; Oliva, com. pers.; Trigo, 2005), y se ha observado su aparición sobre cadáveres de animales en etapa de descomposición activa (Trigo, 2005). La confusión de esta especie con otras, y en especial con Cochliomyia macellaria , a la que se parece a primera vista, podría falsear la estimación del intervalo post mortem .
AGRADECIMIENTOS
Este trabajo se basa en los resultados obtenidos en mi Tesis de Licenciatura, por lo que quiero agradecerle a mi directora de tesis, Dra. Adriana Oliva y a los jurados que la evaluaron. Agradezco también al Decano de la Facultad de Ciencias Veterinarias de la Universidad Nacional del Centro de la Provincia de Buenos Aires, Dr. Alejandro Soraci por ceder el uso de sus instalaciones para el desarrollo del experimento. Al Museo Zoología, Facultad de Ciencias Naturales y Oceanográficas, Universidad de Concepción en la persona del Dr. José N. Artigas, por el préstamo del material original estudiado por Palma en 1973. Al Dr. Axel O. Bachmann, por sus comentarios sobre el manuscrito. Al Dr. Juan C. Mariluis, por la confirmación en la determinación de los adultos. Al Dr. Martín Ramírez, por facilitarme el equipo de fotografía microscópica y a Cristian Grismado por el entrenamiento en el uso de dicho equipo y su colaboración en la obtención de las imágenes (división Aracnología del Museo Argentino de Ciencias Naturales).
BIBLIOGRAFÍA CITADA
1. ANDERSON, G. S. 2001. Insect succession on carrion and its relationship to determining time of death. En: Jason H. Byrd & James L. Castner (eds), Forensic entomology: The utility of arthropods in legal investigations , Chap. 5, Washington DC. pp:143- 176. [ Links ]
2. CARAYON, J. 1969. Emploi du noir du chlorazol en anatomie microscopique des insectes. Ann. Soc. Ent. Fr. Rev. Internat. d 'Entomologie gén. et app. N.S. 5 (1): 179-193. [ Links ]
3. DEAR, J. P. 1985. A revision of de new world Chrysomyini (Diptera, Calliphoridae). Rev. Bras. Zool. 3 (3): 109-169. [ Links ]
4. GALLOWAY , A., W. H. BIRKBY, A.M. JONES, T.E. HENRY & B.O. PARKS . 1989. Decay rates of human remains in a arid environment. J. Forensic. Sci. 34: 607-616. [ Links ]
5. GOFF, M. L. 1998. Determination of time since death in the early postmortem period. International Seminar in Forensic Entomology. Bari , Italy , November 12-14:1-16. [ Links ]
6. GOFF, M. L, W. A. BROWN, A. I. OMORI & D. A. LAPOINTE. 1993. Preliminary Observations of the effects of Amitriptyline in Decomposing tissues on the development of P arasarchophaga reficornis (Diptera: Sarcophagidae) and implications of this effect to estimation of postmortem interval. J. Forensic Sci. 38 (2):316-322. [ Links ]
7. GONZÁLEZ MORA, D, S. V. PARIS & J. C. MARILUIS. 1998. Notas sobre la taxonomía y distribución del género Compsomyiops Towensend, 1918. Bol. R. Soc. Esp. Hist. Nat. (Sec. Biol.) , 94 (1-2): 15- 21. [ Links ]
8. GREENBERG, B. 1990. Behavior of postfeeding larvae of some Calliphoridae and Muscid (Diptera). Ann. Entomol. Soc. Am. 83 (6):1210-1214. [ Links ]
9. GREENBERG, B. & M. L. SZYSKA. 1984. Immature stages and biology of fifteen species of Peruvian Calliphoridae (Diptera). Ann. Entomol. Soc. Am. 77: 488-517. [ Links ]
10. LEWIS, J. P. & B. M. COLLANTES. 1973. El Espinal periestépico. Ciencia e Investigación 29 (11-12): 360-377. [ Links ]
11. LIU, D. & B. GREENBERG. 1989. Immature stages of some flies of forensic importance. Ann. Entomol. Soc. Am. 82 (1): 80-93. [ Links ]
12. MANN, R. W., W. M. BASS & L. MEADOWS. 1990. Times since death and decomposition of the human body: variables and observations in case and experimental field studies. J. Forensic Sci. 35: 103-111. [ Links ]
13. MARILUIS J. C. 1982. Contribución al conocimiento de las Calliphoridae de la Argentina (Insecta; Diptera). Op. Lilloana 33: 1-58. [ Links ]
14. MARILUIS J. C & E. F. GUARNERA. 1983. Miasis producida por Phaenicia sericata (Meigen, 1826) (Calliphoridae, Luciliini). Rev. Soc. Entomol. Argent. 42 (1-4): 143-147. [ Links ]
15. MARILUIS J. C & P. M. MULIERI. 2005. Calliphoridae, Callifóridos. En: Salomón, O. R. (eds), Artrópodos de interés médico en Argentina. Ser. Enfermedades transmisibles . Publ. Monográf. 6. Cap. 14, Argentina , pp 97-100. [ Links ]
16. MARILUIS J. C. & J. A. SCHNACK. 2002. Calliphoridae de la Argentina. Sistemática, ecología e importancia sanitaria (Diptera, Insecta). En: Salomón, O R (Compilador ), Actualizaciones en artopodología sanitaria argentina, RAVE Ser. Enfermedades transmisibles . Publ. Monográf. 2, Argentina, pp 23-37. [ Links ]
17. O´FLYNN, M. A. 1993. The succession and rate of development of blowflies in carrion in southern Queensland and the application these data to forensic entomology. Jour. Austr. Ent. Soc. 22: 137-148. [ Links ]
18. OLIVA, A. 1997. Insectos de interés forense de Buenos Aires (Argentina). Primera lista ilustrada y datos binómicos . Rev. Mus. Arg. Cs. Nat. , Ent.VII, 2: 14-59. [ Links ]
19. OLIVA, A. & J. A. RAVIOLI. 2004. Conscript Carrasco: A peacetime casualty. En: Mark Beneke (Eds.), Jeff Wells (Main Reviewer), Forensic Entomology Special Issue , Aggrawal´s Internet Journal of Medicine and Toxicology 5 (1): 45- 49. Main Download Site: http:// www.geradts.com/~anill/ij/ indexpapers.html [ Links ]
20. PALMA, R. L. 1973. Desarrollo ontogénico de Paralucilia fulvicrura (Robineau-Desvoidy) 1830, en laboratorio (Diptera, Calliphoridae, Chrysomyinae). Bol. Soc. Biol. Concepción , 46: 185- 194. [ Links ]
21. ROBINEAU-DESVOIDY, J. B. 1830. Essai sur les Myodaires. Mem. Pres. Div. Sav. Acad. R. Sci. Inst. Fr. 2 (2): 1-813. [ Links ]
22. ROSS, M. H., ROMRELL, L. J. & KAYE, G. I. 1997. Histología. Texto y Atlas Color. Buenos Aires, Panamericana. 3ª Edición. [ Links ]
23. SHEAN, B. S., L. MESSINGER & M. PAPWORTH. 1993. Observation of differential decomposition on sun exposer v. shaded pig. Carrion in Coastal Washington State . J. Foernsic Sci. 38: 938-949. [ Links ]
24. SCHNACK, J. A., J. A. MARILUIS, N. CENTENO & J. MUZÓN. 1995. Composicón específica, ecología y sinantropía de Calliphoridae (Insecta: Diptera) en el gran Buenos Aires. Rev. Soc. Entomol. Argent . 54 (1-4): 161-171. [ Links ]
25. TANTAWI, T. I., E. M. EL-KADY, B. GREENBERG & H. A. ELGHAFFAR. 1989. Arthropod succession on exposed rabbit carrion in Alexandria , Egypt . J. Med. Entomol.. 33 (4): 566-580. [ Links ]
26. TÉCNICAS DE NECROPSIA. 2004. Servicio de Diagnóstico Veterinario Especializado del INTA, Estación Experimental Agropecuaria Balcarce. http:/ www.inta.gov.ar (Inicio > Actividades > Investigación > Sanidad Animal > Necropsia). [ Links ]
27. TESKEY, H. J. 1981. Morphology and terminology- Larvae. En: McAlpine, J. F, B. V. Pererson, G. E. Shewell, H. J. Teskey , J. R. Vodkeroth & D. M. Wood (Coordinadores). Manual of Nearctic Diptera . Vol.1. Monograph Nº 27. Ch. 3. Ottawa , Ontario , Canada : 78. [ Links ]
28. TOWNSEND, C. H. T. 1934-1935. Manual of Myiology in twelve parts. Vol. I-II. Development and structure. Section III. Internal maggot anatomy and physiology. Brazil São Paulo Itaquaquecetuba, São Paulo. Brazil [ Links ]
29. TRIGO, A. V. 2005. Inéd. Variaciones en la sucesión de entomofauna sobre cadáveres de cerdo doméstico Sus scrofa L. en un sistema serrano de la Provincia de Buenos Aires (Tandíl, Argentina). Tesis de Licenciatura. Facultad de Ciencias Exactas y Naturales (FCEN), UBA: I +71 pp. [ Links ]
30. TULLIS, K. & M. L. GOFF. 1987. Arthropod succession in exposed carrion in a tropical rainforest on O´ahu, Hawaii. J. Med. Entoml. 24: 332. [ Links ]
Recibido: 16-I-2006
Aceptado: 18-V-2006














